Volume 40 Number 4
Skin care for the protection and treatment of incontinence associated dermatitis (IAD) to minimise susceptibility for pressure injury (PI) development
Hiske Smart and R Gary Sibbald
Keywords pressure injuries, incontinence associated dermatitis, IAD, IAD skin protection
For referencing Smart H & Sibbald RG. Skin care for the protection and treatment of incontinence associated dermatitis (IAD) to minimise susceptibility for pressure injury (PI) development. WCET® Journal 2020;40(4):40-44
DOI https://doi.org/10.33235/wcet.40.4.40-44
Abstract
This manuscript summarises the important clinical concept of having a skin care protocol to protect and treat skin against incontinence associated dermatitis (IAD) to prevent and minimise the association IAD has on the subsequent development of pressure injuries (PI).
Skin protection for all skin tones is imperative to protect skin against exaggerated late presentations of IAD.
Introduction
Preserving the barrier function of the skin is an important clinical practice role that is often found in the nursing practice domain. Incontinence associated dermatitis (IAD) frequently includes severe discomfort to patients and tends to develop quickly in white skinned individuals and later, but in exaggerated form, in persons with darker tones of skin; this is due to the first clinical visual cues being obscured and not identified. Using evidence from the literature with clinical examples, the authors will highlight zinc oxide paste as a care option in the clinical setting due to ease of availability and relative low cost.
Incontinence Associated Dermatitis (IAD)
IAD is one of the four aetiologies included in the moisture associated dermatitis (MASD) category. IAD has been defined in the literature as a “form of irritant contact dermatitis that develops from chronic exposure to urine or liquid stool”1–3. The aetiology is believed to be from prolonged exposure of skin to urine or liquid stool (often in combination), with a resulting change of the normal acid pH of the skin into an alkaline pH level.1–6 Once the ‘acid mantle’ of the skin is compromised, the skin can undergo an inflammatory response (erythema) to the moisture from urine and/or faeces and the skin barrier may become compromised1–6.
Red skin (erythema) looks different depending on the natural pigmentation of the skin5. In brown or black skin, the erythema may not appear red but can have a darker tone to the surrounding skin and create diagnostic difficulty in examining the skin (Figure 1). Skin damage prevention is always better than treatment, but early skin damage is often harder to detect in darker skin tones5, leading to late initiation of interventions.
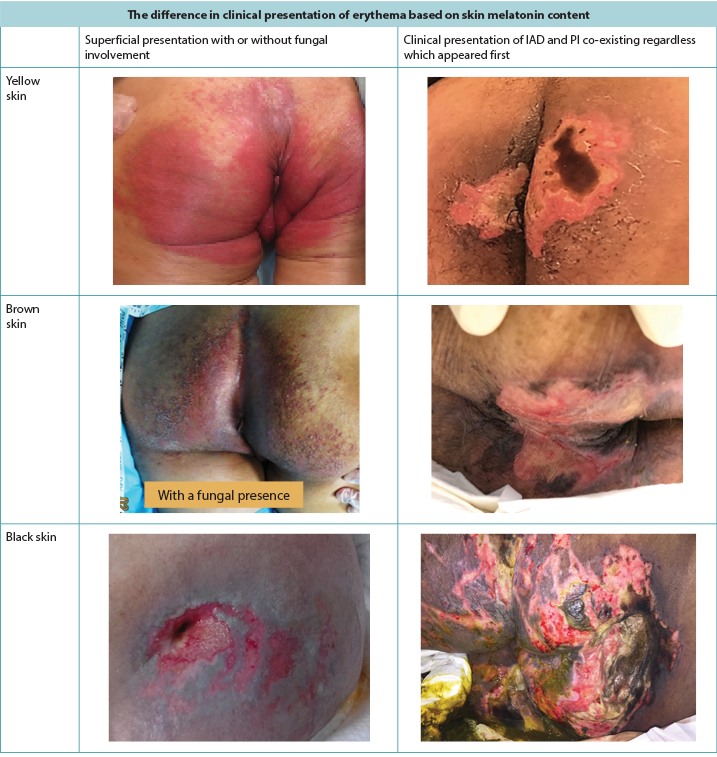
Figure 1. Clinical presentation of erythema and IAD co-existing with PI as seen in darker skin tones (Table and photos © Smart & Sibbald)
Pressure Injuries (PI) and IAD in combination
The literature supports an association between IAD and pressure injury (PI) formation, although the aetiology differs between the two7–11. Lachenbruch et al.8 analysed 176,689 patients and found that 92,889 persons with incontinence had a 16.3% incidence of PIs as opposed to continent persons (n=83,800) with an incidence of 4.1%. IAD was associated with a higher incidence of PIs than predicted by the Braden Risk Scale Score alone. Gray and Giuliano9 evaluated 5,342 patients, of whom 2,492 (46.6%) were incontinent of urine. They concluded that 21.3% of IAD may be associated with secondary yeast infection, immobility and an increased incidence of sacral PIs9.
Clinically, PIs present themselves over distinct bony prominences with distinct borders10. IAD, on the other hand, has a more diffuse appearance that may be present in the perineal area and spread out over the buttock area, causing a distinct dermatitis on the skin in prolonged contact with the incontinence content2,3,5,10. When they co-exist, the IAD diffuse pattern remains in exaggerated form8,9 (Figure 2). McNichol and colleagues4 summarised the literature on the importance of treating IAD aggressively in an attempt to decrease the subsequent development of PIs.
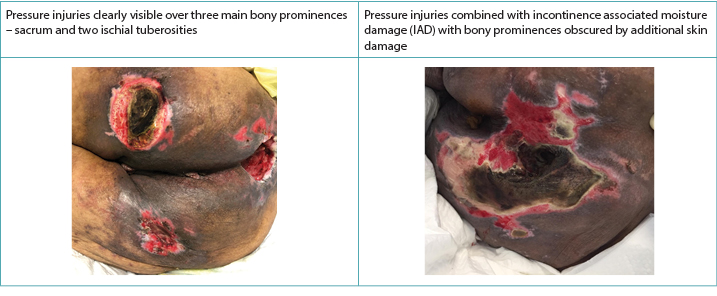
Figure 2. PIs alone and when co-existing with IAD in darker skinned persons (Table and photos © Smart & Sibbald)
Further support to this IAD/PI association is documented in the most recent European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel, and Pan Pacific Pressure Injury Alliance Pressure Injury Guideline10. Three guideline elements are crucial to practice with regards to IAD and PI co-existence. The one relates to the loss of the inert protective ability of the skin with the statement: “Moisture associated skin damage may compromise the epidermis barrier function and hence predispose tissue to pressure injury”10(p.21). The other relates to the ability of skin to tolerate additional forces if compromised by surface moisture: “Skin surface moisture combined with pressure and/or shear can increase the incidence of pressure injuries”10(p.86).
Yet another statement, that may sound contradictory in nature, also advises against ultra-dry dehydrated or flaky skin as a risk factor for skin breakdown when in contact with incontinence content:
Although research directly linking skin moisturizing to reduction in pressure injury incidence is lacking, one epidemiological study in hospitalized individuals with limited mobility (n=286) noted that dry skin was a significant and independent risk factor for pressure injuries in a multi-variate analysis 21 (Level 3 prognostic). Regular application of a moisturizer in a skin hygiene regimen is suggested for promoting skin hydration and preventing other adverse skin conditions, including dry skin and skin tears10(p.86).
Barrier Function and skin protective intervention strategies
The key is to keep skin well moisturised as that maintains the moisture protective gradient of skin4,8,12,13. In white skinned individuals this moisture unit protective gradient is three times lower than in darker skinned persons (2:6 ratio)12. This explains the risk of dry skin as a factor in moisture damage from stool enzymes and urine urea that occurs in white skinned persons far quicker than in persons with darker skin tones. The quality of the stratum corneum is also important as it is on its thinnest on the two opposite ends of the age continuum (babies13 and the frail aged14). Early intervention to treat the cause of the incontinence needs to be achieved in conjunction with a skin care protocol to protect, maintain and restore the skin’s barrier4–8,11.
In clinical practice, raising awareness of staff nurses and non-healthcare professionals and including the person’s family involved in their care about the use of appropriate skin cleansing products is vital. Educational enablers are easy ways to summarise key points and provide caregiver learnings about essential components regarding care. One such educational enabler for IAD skin care is the use of the ACT mnemonic to guide the clinician into a comprehensive skin care approach4 (Figure 3).

Figure 3. Clinical enabler to guide skin care in the presence of IAD
Skin care options
Skin cleansing after episodes of incontinence has evidence at B2 level as an effective intervention to remove residual surface debris from stool or urine on skin10. Neutral soaps or superfatted products15 are better options than ordinary soaps that are too alkaline (pH 9–10). This pH extreme either disrupts the skin’s acid mantle or damages structural proteins present in skin. Proper rinsing and gently patting the skin dry add additional value to skin protection as it prevents vigorous rubbing or massaging that may lead to micro-damage of the skin and substructures10,11.
Use of skin barriers
The natural moisturising factor of skin is achieved by in-built humectants to keep the skin surface moisture content at 10% for intact skin14. Products that do not alter the pH (as bacteria thrive in an alkaline environment10) and provide a barrier from incontinence are preferable and imperative to achieve better skin restoration outcomes4–8,16,17. Moisturisers frequently used in skin protection protocols could be either in a humectant or an emollient form. Humectants are available in many forms that may contain liquid-forming acrylates, ceramides, urea, lactic acid or glycerin, with the purpose to bind water to the skin surface16,17. It may cause local stinging and burning when water is drawn from the deeper layers. If applied after washing or bathing while the skin is still damp (within 2–3 minutes), this is prevented16. Emollients, on the other hand, can be applied at any time; they prevent insensible losses of moisture from the skin surface18. Since skin damaged from IAD can be painful, products that do not sting or burn on application may be better to address patient-centred concerns of pain management.
Zinc oxide as an example of an emollient in IAD preventative care
Zinc oxide is an enhanced barrier that prevents bacteria, contact irritants (e.g. stool, urine) and allergens from penetrating the skin. In zinc oxide ointment preparations, zinc oxide is combined with petrolatum as it creates a ‘stiff’ barrier, providing additional skin adherence and protection. It is less likely to soften or migrate from the skin into any co-existing deeper wound in that same area than with the petrolatum base alone18.
The 2016 Cochrane review on the prevention and treatment of IAD in adults17 cited several trials on zinc ointment that prevented or successfully treated IAD. The zinc oxide ointments do not always need to be removed if the surface is clean, but can be left to fill in the spaces. By using a clean tongue depressor to spread the zinc oxide preparation evenly, it helps to minimise the frictional resistance on the skin often encountered in application. It is well known that the topical application of zinc on skin adds to enhancement of the local defence systems in skin against superficial infection, while increasing epithelium migration to quickly cover any small lesion in the area18. Since the German dermatologist Unna created the zinc oxide paste bandage for venous ulcers in 1895, sufficient evidence has existed on its effect on aiding skin healing, with no currently documented adverse systemic effects encountered16. Although further robust studies are needed, zinc paste preparations are known to be effective skin protectants17 and are safe enough for use on babies13.
From a practice perspective, on skin without erythema or in the presence of mild redness, a zinc oxide barrier can be applied with ease using a gloved hand or tongue depressor. If there are erosions (loss of surface epidermis with an epidermal base as opposed to a dermal or deeper base) or satellite papules or pustules indicating candidiasis, a topical antifungal agent would then be required as a first layer. The antifungal agent can be applied first to the skin as a treatment and then the protective layer of zinc oxide is added as the second layer. This often poses as a practice challenge, as application in the presence of moisture is difficult. By layering the zinc ointment on a carrier medium (either on plain gauze or on impregnated gauze if available) and then applying this carrier as a last layer upside down on the area, this challenge can be averted. If the zinc oxide wears off between episodes of incontinence, a repeat layer can be applied once or twice a day. With consistent episodes of incontinence, skin cleansing, gentle pat drying and barrier ointment application should be repeated every time as soon as the incontinence occurs10,11.
Conclusion
Healthy skin requires it to be intact and have a stratum corneum moisture content of 10%. Incontinence of stool and urine can compromise this barrier in both white and darker skinned persons while adding to susceptibility of IAD and PI development. Skin protection for all skin tones is imperative to protect darker skin against exaggerated late presentations of IAD. Zinc oxide ointment provides an evidence-based ideal skin barrier that is readily available even in the most resource restricted environments. Proper application and use thereof has sufficient evidence10 to incorporate this in skin protective strategies to prevent and treat this common skin problem, especially in the young and aging populations with incontinence issues.
Conflict of Interest
Both authors have received an educational grant from Calmoseptine to teach the WoundPedia course in Manila, Philippines.
Cuidados com a pele para a proteção e tratamento da dermatite associada à incontinência (DAI) para minimizar a propensão ao desenvolvimento de lesões por pressão (LP)
Hiske Smart and R Gary Sibbald
DOI: https://doi.org/10.33235/wcet.40.4.40-44
Resumo
Este manuscrito resume o importante conceito clínico de se ter um protocolo de cuidados com a pele para proteger e tratar a pele contra a Dermatite Associada à Incontinência (DAI) para prevenir e minimizar a associação que a DAI tem no desenvolvimento subsequente de lesões por pressão (LP).
A proteção cutânea para todos os tons de pele é imperativa para proteger a pele contra as apresentações exageradas tardias da DAI.
Introdução
Preservar a função de barreira da pele é uma função importante da prática clínica que é muitas vezes encontrada no domínio da prática de enfermagem. A dermatite associada à incontinência (DAI) frequentemente inclui grave desconforto aos pacientes e tende a se desenvolver rapidamente em pessoas com tons de pele claros e mais tarde, mas de forma exagerada, em pessoas com tons de pele mais escuros; isso acontece porque as sugestões clínicas visuais ficam obscuras e não são identificadas. Usando evidências da literatura com exemplos clínicos, os autores focarão no uso da pasta de óxido de zinco como uma opção de cuidado no ambiente clínico devido a sua fácil disponibilidade e custo relativamente baixo.
Dermatite associada à incontinência (DAI)
A DAI é uma das quatro etiologias incluídas na categoria de lesões de pele associadas à umidade (MASD, do inglês moisture associated dermatitis). A DAI tem sido definida na literatura como "uma forma de dermatite de contato irritativa que se desenvolve pela exposição crônica à urina ou fezes líquidas".1–3. Acredita-se que a etiologia venha da exposição prolongada da pele à urina ou fezes líquidas (frequentemente em combinação), resultando em uma mudança do pH normalmente ácido da pele para um pH de nível alcalino.1–6 Uma vez que o manto ácido da pele é comprometido, a pele pode sofrer uma resposta inflamatória (eritema) à umidade da urina e/ou fezes e a barreira da pele pode ficar comprometida.1–6
A pele avermelhada (eritema) tem uma aparência diferente dependendo da pigmentação natural da pele.5 Nas peles morenas e negras, o eritema pode não aparecer como vermelhidão, mas sim ter um tom mais escuro que a pele ao seu redor e criar uma dificuldade de diagnóstico no exame da pele (Figura 1). A prevenção aos danos cutâneos é sempre melhor que o tratamento, mas o dano cutâneo inicial é muitas vezes mais difícil de se detectar em tons de pele mais escuros5, levando ao início tardio das intervenções.
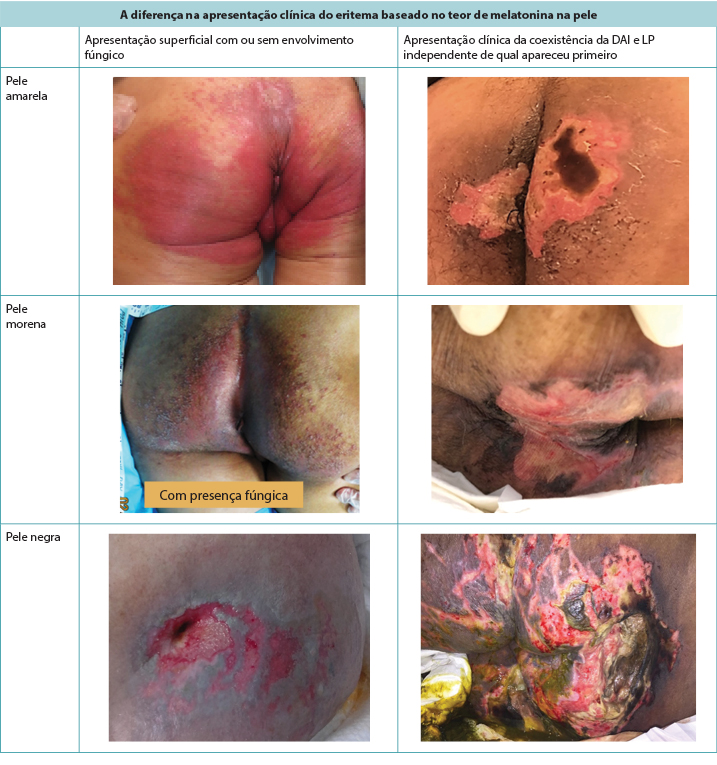
Figura 1. A apresentação clínica do eritema e DAI coexistindo com a LP conforme visto em tons de pele mais escuros (Tabela e fotos © Smart & Sibbald)
Lesões por pressão (LP) e DAI combinadas
A literatura suporta a associação da DAI com a formação de lesões por pressão (LP), embora a etiologia divirja entre as duas.7–11 Lachenbruch et al.8 analisaram 176.689 pacientes e descobriram que 92.889 das pessoas com incontinência tinham uma incidência de LP de 16,3% em comparação à incidência de 4,1% nas pessoas continentes (n = 83.800). A DAI foi associada a uma maior incidência de LP que o previsto pela pontuação de risco da escala de Braden sozinha. Gray e Giuliano9 avaliaram 5.342 pacientes, dos quais 2.492 (46,6%) tinham incontinência urinária. Eles concluíram que 21,3% das DAIs podem estar associadas à infecção secundária por fungos, imobilidade e um aumento na incidência de LP sacral.9
Clinicamente, as LPs se apresentam sobre as proeminências ósseas com bordas distintas.10 A DAI, por outro lado, tem uma aparência mais difusa que pode estar presente na área perineal e se espalhar pela área das nádegas, causando uma dermatite distinta na pele no contato prolongado com o produto da incontinência.2,3,5,10 Quando elas coexistem, o padrão difuso da DAI permanece na forma exagerada8,9 (Figura 2). McNichol e colegas4 resumiram a literatura sobre a importância de tratar a DAI agressivamente em uma tentativa de diminuir o desenvolvimento subsequente das LP.
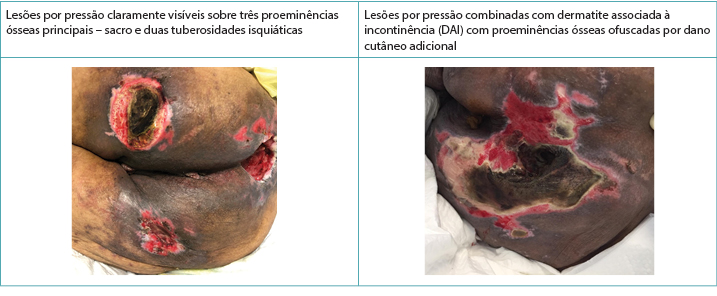
Figura 2. As LP sozinhas e coexistindo com a DAI em pessoas com tons de pele mais escuros (Tabela e fotos © Smart & Sibbald)
Mais suporte a essa associação da DAI/LP é documentado no mais recente Guia das Lesão por Pressão do European Pressure Ulcer Advisory Panel [Painel Consultivo Europeu de Úlcera por Pressão], National Pressure Injury Advisory Panel [Painel Consultivo Nacional de Lesão por Pressão], e Pan Pacific Pressure Injury Alliance [Aliança Pan Pacífica de Lesão por Pressão].10 Três elementos do guia são fundamentais para a prática no que diz respeito à coexistência da DAI e da LP. Um diz respeito à perda da capacidade de proteção inerte da pele, com a seguinte declaração: "lesões cutâneas associadas à umidade podem comprometer a função de barreira da epiderme e predispor o tecido à lesão por pressão".10(p.21) O outro se refere à habilidade da pele de tolerar forças adicionais se comprometida pela umidade da superfície: "A umidade de superfície da pele combinada com a pressão e/ou cisalhamento pode aumentar a incidência de lesões por pressão".10(p.86)
Ainda outra declaração, que pode soar contraditória por natureza, também não recomenda a pele desidratada ultra-seca ou escamosa como um fator de risco para a ruptura da pele quando em contato com o conteúdo da incontinência:
Embora não haja muitas pesquisa ligando diretamente a hidratação da pele com a redução da incidência da lesão por pressão, um estudo epidemiológico em indivíduos hospitalizados com mobilidade limitada (n = 286) notou que a pele seca foi um fator de risco significativo e independente para lesões por pressão em uma análise com múltiplas variáveis 21 (prognóstico nível 3). Sugere-se a aplicação regular de um hidratante em um regime de higiene da pele para promover a hidratação da pele e prevenir outras condições cutâneas adversas, incluindo pele seca e rupturas da pele.10(p.86)
Função de barreira e estratégias de intervenção para a proteção da pele
A chave é manter a pele bem hidratada, pois isso mantém o gradiente protetor de umidade da pele.4,8,12,13 Em indivíduos com pele branca, esse gradiente protetor de umidade é três vezes mais baixo que em pessoas com tons mais escuros de pele (razão 2:6).12 Isso explica o risco da pele seca como um fator de dano por umidade das enzimas das fezes e ureia da urina que ocorre em pessoas com pele branca muito mais rapidamente do que em pessoas com tons mais escuros de pele. A qualidade do estrato córneo também é importante, pois ele é mais fino nas duas extremidades opostas da faixa etária (bebês13 e os idosos frágeis14). A intervenção precoce para tratar a causa da incontinência precisa ser alcançada em conjunto com um protocolo de cuidados com a pele para proteger, manter e recuperar a barreira da pele.4–8,11
Na prática clínica, é vital aumentar a conscientização da equipe de enfermagem e profissionais que não são da saúde e incluir a família da pessoa envolvida em seus cuidados sobre o uso de produtos de limpeza da pele adequados. Os facilitadores educacionais são formas fáceis de resumir os pontos importantes e fornecer aos cuidadores aprendizado sobre os componentes essenciais relacionados aos cuidados. Um desses facilitadores para os cuidados com a pele para a DAI é o mnemônico ACT, usado para guiar o médico para uma abordagem completa de cuidados com a pele4 (Figura 3).

Figura 3. Facilitador clínico para guiar os cuidados com a pele na presença da DAI
Opções de cuidados com a pele
A limpeza da pele após episódios de incontinência tem evidência no nível B2 como uma intervenção eficaz para remover os detritos residuais das fezes ou urina da superfície da pele.10 Sabonetes neutros ou produtos ricos em gordura15 são opções melhores em comparação a sabonetes comuns que são muito alcalinos (pH 9–10). Esse pH extremo ou perturba o manto ácido da pele ou danifica as proteínas estruturais presentes na pele. O enxágue adequado e a secagem suave da pele agregam valor adicional à proteção da pele, pois evitam a fricção ou a massagem vigorosa que pode levar a micro-danos na pele e subestruturas.10,11
Uso de barreiras cutâneas
O fator de hidratação natural da pele é alcançado pelos umectantes embutidos para manter o teor de umidade da superfície da pele em 10% para a pele intacta.14 Produtos que não alteram o pH (uma vez que as bactérias prosperam em um ambiente alcalino10) e fornecem uma barreira para a incontinência são preferíveis e importantes para alcançar melhores resultados de restauração da pele.4–8,16,17 Os hidratantes mais usados nos protocolos de proteção da pele podem ser tanto em forma umectante como emoliente. Os umectantes estão disponíveis em muitas formas, que podem conter acrilatos, ceramidas, ureia, ácido láctico ou glicerina formadores de líquidos, com a finalidade de ligar água à superfície da pele.16,17 Pode causar ardência local e queimação quando a água é retirada das camadas mais profundas. Isso é evitado com sua aplicação após a lavagem ou banho enquanto a pele ainda está úmida (dentro de 2–3 minutos).16 Emolientes, por outro lado, podem ser aplicados a qualquer momento; eles evitam perdas insensíveis de umidade da superfície da pele.18 Como a pele danificada pela DAI pode ser dolorosa, produtos que não ardem ou queimam na aplicação podem ser melhores para atender às preocupações centradas no paciente de gerenciamento da dor.
O óxido de zinco como exemplo de um emoliente no tratamento preventivo da DAI
O óxido de zinco é uma barreira aprimorada que previne que bactérias, irritantes de contato (como fezes e urina) e alérgenos penetrem a pele. Em preparações de pomada de óxido de zinco, o óxido de zinco é combinado com petrolato, pois ele cria uma barreira "rígida", proporcionando aderência e proteção adicional à pele. Dessa forma, é menos provável que ela amoleça ou migre da pele para qualquer ferida mais profunda coexistente na mesma área do que com a base de petrolato sozinha.18
A revisão de Cochrane de 2016 sobre a prevenção e o tratamento da DAI em adultos17 citou diversos ensaios onde a pomada de zinco preveniu ou tratou a DAI com êxito. As pomadas de óxido de zinco nem sempre precisam ser removidas se a superfície estiver limpa, mas podem ser deixadas para preencher os espaços. Usar um abaixador de língua para espalhar a pomada de óxido de zinco uniformemente ajuda a minimizar a resistência ao atrito na pele frequentemente encontrada na aplicação. É bem sabido que a aplicação tópica de zinco na pele aumenta o reforço dos sistemas de defesa locais na pele contra infecções superficiais, enquanto aumenta a migração do epitélio para cobrir rapidamente qualquer pequena lesão na área.18 Desde que o dermatologista alemão Unna criou a pasta de óxido de zinco para úlceras venosas em 1895, existem evidências suficientes sobre seu efeito no auxílio à cicatrização da pele, sem efeitos sistêmicos adversos atualmente documentados.16 Embora sejam necessários mais estudos robustos, as preparações de pasta de zinco são conhecidas por serem eficazes na proteção da pele17 e são seguras o suficiente para uso em bebês.13
De uma perspectiva da prática, na pele sem eritema ou na presença de vermelhidão leve, uma barreira de óxido de zinco pode ser aplicada facilmente usando uma mão enluvada ou um abaixador de línguas. Se houver erosões (perda da epiderme superficial com uma base epidérmica em oposição a uma base dérmica ou mais profunda) ou pápulas ou pústulas satélites indicando candidíase, um agente antifúngico tópico seria então necessário como primeira camada. O agente antifúngico pode ser aplicado primeiro à pele como um tratamento e depois a camada protetiva de óxido de zinco é adicionada como a segunda camada. Isso geralmente representa um desafio prático, pois a aplicação na presença da umidade é difícil. Ao sobrepor a pomada de zinco em um meio transportador (em gaze simples ou em gaze impregnada, se disponível) e, em seguida, aplicar esse transportador como uma última camada de cabeça para baixo na área, esse desafio pode ser evitado. Se o óxido de zinco se desgastar entre os episódios de incontinência, uma camada de repetição pode ser aplicada uma ou duas vezes ao dia. Com episódios consistentes de incontinência, a limpeza da pele, a secagem suave e a aplicação da pomada de barreira devem ser repetidas todas as vezes assim que a incontinência ocorrer.10,11
Conclusão
A pele saudável precisa estar intacta e ter um teor de umidade de estrato córneo de 10%. A incontinência de fezes e urina pode comprometer essa barreira em pessoas tanto com pele clara ou com pele mais escura, ao mesmo tempo em que aumenta a propensão ao desenvolvimento da DAI e da LP. A proteção cutânea para todos os tons de pele é imperativa para proteger a pele mais escura contra as apresentações exageradas tardias da DAI. A pomada de óxido de zinco fornece uma barreira cutânea ideal baseada em evidências, prontamente disponível mesmo nos ambientes com recursos mais restritos. Sua aplicação e uso adequados têm evidência suficiente10 para incorporá-la nas estratégias de proteção da pele para prevenir e tratar esse problema comum de pele, especialmente nas populações jovens e idosas com problemas de incontinência.
Conflito de interesse
Os autores receberam um subsídio educacional da Calmoseptine para ensinar o curso WoundPedia em Manila, Filipinas.
Author(s)
Hiske Smart*
RN, MA (Nur), Hons BSocSc (Nur), PGDip (WHTR – UK), IIWCC (Can)
Nurse Manager and Clinical Nurse Specialist – Wound Care and Hyperbaric Oxygen Therapy Unit, King Hamad University Hospital, Kingdom of Bahrain
Secretary General – World Union of Wound Healing Societies
Email hiskesmart@gmail.com
R Gary Sibbald
BScMd, MEd, DSC (Hon), FRCPC (Med)(Derm), FAAD, MAPWCA, JM
Professor of Medicine and Public Health, University of Toronto
Director of International Interprofessional Wound Care Course (IIWCC) & Masters of Science Community Health (Prevention and Wound Care), Dalla Lana School of Public Health
Co-Editor in Chief Advances in Skin & Wound Care
Project Lead ECHO Ontario, Skin & Wound
Investigator, Institute Better Health, Trillium Health Partners
* Corresponding author
References
- Black JM, Gray M, Bliss DZ, et al. MASD part 2: incontinence-associated dermatitis and intertriginous dermatitis: a consensus. J Wound Ostomy Continence Nurs 2011;38(4):359–70.
- Gray M, Bliss DZ, Doughty DB, Ermer-Seltun J, Kennedy-Evans KL, Palmer MH. Incontinence associated dermatitis: a consensus. J Wound Ostomy Continence Nurs 2007;34(1):45–54.
- Gray M, Black JM, Baharestani MM, et al. Moisture-associated skin damage: overview and pathophysiology. J Wound Ostomy Continence Nurs 2011;38(3):233–41.
- McNichol LL, Ayello EA, Phearman LA, Pezzella PA, Culver EA. Incontinence-associated dermatitis: state of the science and knowledge translation. Adv Skin and Wound Care 2018;31(11):502–513.
- Ayello EA, Sibbald RG, Quiambao PCH, Razor B. Introducing a moisture-associated skin assessment photo guide for brown pigmented skin©. WCET J 2014;34(2):18–25.
- Beeckman D. A decade of research on incontinence-associated dermatitis (IAD): evidence, knowledge gaps and next steps. J Tissue Viabil 2017;26:47–56.
- Bateman SD, Roberts S. Moisture lesions and associated pressure ulcers: getting the dressing regimen right. Wounds UK 2013;9(2):97–102.
- Lachenbruch C, Ribbie D, Emmons K, Van Gilder C. Pressure ulcer risk in the incontinent patient: analysis of incontinence and hospital-acquired pressure ulcers from the International Pressure Ulcer Prevalence Survey. J Wound Ostomy Continence Nurs 2016;43(3):235–41.
- Gray M, Giuliano KK. Incontinence-associated dermatitis, characteristics and relationship to pressure injury: a multisite epidemiologic analysis. JWOCN 2018;45(1):63–67.
- European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel, and Pan Pacific Pressure Injury Alliance. Prevention and treatment of pressure ulcers/injuries: clinical practice guideline. The International Guideline. Emily Haesler (Ed). EPUAP/NPIAP.PPPIA:2019.
- Park KH, Kim KS. Effect of a structured skin care regimen on patients with fecal incontinence: a comparison cohort study. J Wound Ostomy Continence Nurs 2014;41(2):161–167.
- De Farias PT, Azambuja AP, Horimoto AR, et al. A population-based study of the stratum corneum moisture. Clin Cosmet Investig Dermatol 2016;9:79–87. doi:10.2147/CCID.S88485
- Shin HT. Diagnosis and management of diaper dermatitis. Pediatr Clin North Am 2014;61(2):367–382.
- Sopher R, Gefen A. Effects of skin wrinkles, age and wetness on mechanical loads in the stratum corneum as related to skin lesions. Med Biol Eng Comput 2011;49(1):97–105.
- Bou J, Segovia G, Verdu S, Nolasco B, Rueda L, Perejamo M. The effectiveness of a hyper oxygenated fatty acid compound in preventing pressure ulcers. J Wound Care 2005;14(3):117–21.
- Schuren J, Becker A, Sibbald RG. A liquid film-forming acrylate for peri-wound protection: a systematic review and meta-analysis (3MTM CavilonTM no-sting barrier film). Int Wound 2005;2:230–238.
- Beeckman D, Van Damme N, Schoonhoven L, Van Lancker A, Kottner J, Beele H, Gray M, Woodward S, Fader M, Van den Bussche K, Van Hecke A, De Meyer D, Verhaeghe S. Interventions for preventing and treating incontinence-associated dermatitis in adults. Cochrane Database System Rev 2016;11. Art. No: CD011627.
- Lansdown AB, Mirastschijski U, Stubbs N, Scanlon E, Agren MS. Zinc in wound healing: theoretical, experimental, and clinical aspects. Wound Repair Regen 2007;15(1):2–16.



