Volume 41 Number 2
WHAM evidence summary: effectiveness of topical coconut products
Robin Watts, Teresa Solomon and Emily Haesler
Keywords skin conditions, topical coconut, coconut oil, wound management, low- and middle-resource countries
For referencing Watts R et al. WHAM evidence summary: effectiveness of topical coconut products. WCET® Journal 2021;41(2):32-35
DOI https://doi.org/10.33235/wcet.41.2.32-35
Clinical Question
What is the best available evidence on the use of topical coconut products in wound management and the treatment of skin conditions?
Summary
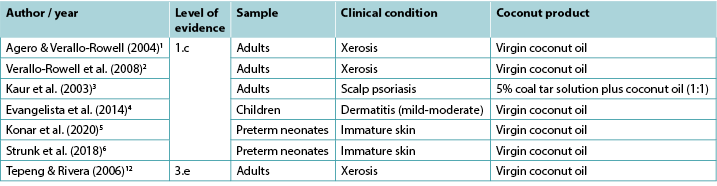
Despite the wide use of topical coconut products for medicinal purposes in tropical geographic regions, only a limited number of clinical studies reporting its effectiveness in treating skin conditions and no studies reporting its use in wound management were identified is this rapid review. Level 1 evidence1,2 demonstrated that topical virgin coconut oil (VCO) is associated with improvements in signs and symptoms of xerosis1,2 and psoriasis3 in adults, and mild-to-moderate dermatitis in children4. There is some evidence that VCO improves scores of skin immaturity in preterm neonates5,6. Currently no evidence is available on the use of topical coconut products for healing human wounds.
Clinical practice recommendations
All recommendations should be applied with consideration to the wound, the person, the health professional and the clinical context.
- Topical VCO could be considered for the treatment of mild-to-moderate xerosis (Grade B).
- Topical VCO could be considered for the treatment of psoriasis in the absence of access to topical corticosteroid therapy (Grade B).
- Topical VCO could be considered for the treatment of mild-to-moderate atopic dermatitis in children (Grade B).
Sources of evidence
This summary was conducted using methods published by the Joanna Briggs Institute (JBI)7–11. The summary is based on a systematic literature search combining search terms related to wounds and skin conditions with terms related to coconut palm. Searches were conducted in Embase, Medline, Global Health, and Allied and Complementary Medicine databases, and in 10 healthcare journals from low- and middle-income countries for evidence published up to May 2021 in English. Studies were assigned a level of evidence (Table 1) based on JBI’s hierarchy7–11. Recommendations are made based on the body of evidence and are graded according to the system reported by JBI7–11.
Table 1. Levels of evidence

Background
Various parts of the coconut tree have been used for a multitude of purposes in traditional medicine for thousands of years, to the extent that the plant is often called the “tree of life”16. Products derived from Cocos nucifera Linn: Arecaacae include coconut water, oil from coconut milk or copra (dried kernel), dried coconut shell and husk fibre17,18. The most used coconut product, virgin coconut oil (VCO), is extracted directly from coconut flesh and contains medium chain fatty acids that have surfactant qualities1,19,20. Another tested product, coconut shell liquid smoke (CS-LS) is produced by burning coconut shells at 400˚C resulting in a solution arising from condensation of vapour of wood smoke14. Coconut shells contain the highest antioxidant properties of any parts of the coconut14.
Laboratory testing and biochemical analysis of these products have identified a number of useful properties – anti-inflammatory, antimicrobial, antifungal, antioxidant, antineoplastic and analgesic17,18,20–24. When applied topically, VCO provides barrier protection for the stratum corneum and reduces transepidermal water loss (TEWL), promoting skin moisturisation19,20,24,25. When used on wounds, VCO and other coconut-derived products are reported to promote collagen synthesis and faster epithelisation15,20,24.
Evidence
Evidence from animal studies
Evidence on the wound healing effect of coconut comes from animal studies. Results from three studies13–15 are provided as examples of the significant amount of laboratory work on this topic. In the first study13, undertaken in India, VCO was applied daily for 10 days to open dermal wounds in rats. There were three groups of six rats each – a control group, a group treated with 0.5ml VCO, and a third treated with 1ml VCO. Time to complete epithelisation and composition of granulation tissue (e.g., collagen and fibroblasts) were among the outcome measures. In terms of both time to complete epithelisation and total collagen content, groups 2 and 3 were statistically significant compared to the control (p<0.05), 1ml being more effective than 0.5ml13 (Level 5).
The second study14 was conducted in Indonesia to evaluate the healing activity of CS-LS for burns. Thirty-six mice were randomised into three groups (n=12/group) – CS-LS, normal saline 0.9% (NaCl), and 10% povidone iodine. The burn wounds were left open, with treatment applied twice daily for 25 days. Wound contraction was measured on days 1, 5, 10 and 25 after burn induction. The CS-LS group showed the fastest wound contraction of the three groups by day 5 (p<0.001). On day 10 there was a statistically significant difference to the povidone iodine group (p<0.001) and on day 25 there was a statistically significant difference to the NaCl group (p<0.05)14 (Level 5).
In the third study15, VCO for treating diabetic ulcers was explored with a rat population. Rats with ulcers were divided into four groups – non-treated, non-diabetic rats (n=18), non-treated diabetic rats (n=18), diabetic rats receiving 1ml VCO applied daily for 14 days (n=18), and diabetic rats receiving silver sulfadiazine cream applied daily for 14 days (n=18). Wound closure rates were measured on days 5, 10 and 14. Diabetic ulcers treated with VCO had statistically significantly faster closure rates (p<0.05) compared with diabetic ulcers receiving no treatment on all days. On days 5 and 14 there was a statistically significant difference between the VCO and the silver sulfadiazine cream groups (p<0.05), favouring VCO15 (Level 5).
Evidence from human studies
Evidence on effectiveness for treating wounds
No evidence on topical coconut products for use in treating human wounds was identified.
Evidence on effectiveness for treating skin conditions
Xerosis in adults
Two blinded RCTs1,2 provided evidence for using VCO to relieve xerosis (dry skin) in adults. The first RCT1 was conducted on 34 individuals with mild-to-moderate xerosis to determine the effectiveness and safety of VCO compared with mineral oil when used as a therapeutic moisturiser. The solutions were applied to the legs twice daily for 14 days. Skin hydration and skin lipids were tested to measure effectiveness while TEWL and skin pH were the quantitative measures for safety. Xerosis was evaluated for dryness, scaling, roughness and pruritus by both an investigator using Wehr’s Grading and by participants using a visual analogue scale. Data were collected at baseline, day 7 and day 14. Participants also evaluated side effects (e.g., erythema, stinging or itching). Both treatments were comparable in terms of outcome measures for effectiveness and safety. By the end of the study 81% (13/16) of the participants in the VCO group showed improvement of at least one level in xerosis grading compared to 72% (13/18) of the mineral oil group1 (Level 1).
The second RCT2 compared VCO to virgin olive oil (VOO) for relieving xerosis and eliminating Staphylococcus aureus from skin in adults with atopic dermatitis (n=52). One group was treated with VCO and the other with VOO, with oils massaged gently into the skin twice daily at two skin sites displaying no clinical signs of infection. Outcome measures were skin cultures, photography and the objective component of the SCORAD severity index (O-SSI). Assessment occurred at baseline and at 4 weeks. At 4 weeks, the VCO group improved more significantly on the O-SSI compared to the VOO group (p=0.004)2. Of the VCO group, 77% (20/26) were positive for S. aureus on entry to the study compared 46% (12/26) in the VOO group. Following treatment, only 5% (1/12) of the VCO group remained positive versus 50% (6/12) of the VOO group. The relative risk for VCO was 0.1 compared to 10.1 for VOO (p=0.00; 95% confidence interval [CI], 0.01–0.73, number needed to treat [NNT]=2.2) (Level 1).
Psoriasis in adults
Two studies provided evidence on the use of coconut oil for treating psoriasis. In an RCT (n=40)3, adults with scalp psoriasis were randomised into three groups to assess the effectiveness of relatively bland emollients: 5% coal tar solution plus coconut oil (1:1); 10% urea, 10% lactic acid, 10% propylene glycol plus 10% liquid paraffin (in a cream base); and VCO alone. All three groups showed comparable significant improvement over time, showing 57%, 64.4% and 58.3% clearing of symptoms respectively (p<0.01) without adverse effects. The authors noted that topical corticosteroids have demonstrated substantially higher response and clearance rates than this study found3 (Level 1).
An observational study (n=31)12 explored the use of VCO applied twice daily for 8 weeks to psoriasis lesions in adults. Erythema, scaling and plaque elevation were evaluated every second week using photography and a clinical assessment of symptom clearance. At the completion of the study 16% of participants (5/31) had complete clearance. Scaling was observed to be most reduced in the 4–6-week period of treatment, while erythema and plaque elevation were most improved in the 6–8-week period. No adverse effects were experienced12 (Level 3).
Dermatitis in children
One RCT4 (n=117) compared the effectiveness of topical VCO to that of topical mineral oil for children (aged between 1–13 years) with mild-to-moderate atopic dermatitis. For both treatment groups, 5ml of oil was applied twice daily. Impact on epidermal function was measured using a clinical assessment tool (SSI) and by measuring TEWL and skin capacitance, all measured at baseline and 2, 4 and 8 weeks. On the SSI measure the VCO was significantly more effective than the mineral oil (mean reduction in symptoms 68.23% versus 38.13%, p<0.001). The VCO also produced significantly effective results in terms of the TEWL over the 8-week period compared to the mineral oil group (decrease in TEWL 70.7% versus 35.36%). In terms of the emollient effect of the two oils, a statistically significant difference between the two became apparent at 8 weeks of treatment (p=0.03). No adverse effects were reported in the VCO group, while five children in the mineral oil group required “rescue” treatment with topical corticosteroids4 (Level 1).
Treatment of immature skin in preterm neonates
Two non-blinded RCTs5,6 investigated application of VCO to preterm neonates to promote skin maturity. In both studies, skin maturity was assessed on days 7, 14 and 21 using the Neonatal Skin Condition Scale (NSCS) that includes evaluation of dryness, erythema and skin breakdown. In both studies, babies with existing skin conditions (e.g., infection or rash) were excluded5,6.
In the largest RCT (n=2,294)5, preterm neonates (<37 weeks) were randomised to a treatment group receiving 5ml VCO applied four times daily or to a control group receiving massage only (no topical treatment). Babies receiving VCO had statistically significantly better NSCS scores than the control group at days 7, 14, 21 and 28 (p<0.01) and were significantly less likely to experience a decrease in skin maturity (p<0.01) or hypothermia (p<0.01), without increase in adverse events including rash or accidental slippage of the baby. However, parents were significantly more likely to rate the intervention as cumbersome (2% versus 0.3%, p<0.001) (Level 1).
In the second RCT6, 72 preterm babies (n<30 weeks) received either no topical emollient (n=36) or 5ml/kg VCO applied twice daily over the body (excluding face, scalp and around medical devices). After 3 weeks of treatment, NSCS score declined for the babies in the control group but remained stable for those receiving VCO (p=0.01). There was no significant difference in adverse events including skin irritation or temperature instability6 (Level 1).
Due to methodological limitations of these studies, more evidence is required to recommend VCO for routine care of immature neonate skin. However, available research suggests that the practice is safe to explore5,6.
Table 2. Summary of clinical evidence for topical coconut products
Considerations for use
- When used as a skin moisturiser, VCO is applied to adults and children by rubbing directly on skin and/or lesions, usually twice daily1,2,4,12,22.
- Topical application of VCO for mild-to-moderate skin conditions is associated with a lower rate of adverse effects than topical corticosteroids4,12.
- To apply VCO to the immature skin of very preterm neonates, stroke the oil onto skin for 2–3 minutes without massage during routine care to avoid excessive handling6.
Conflict of Interest
The authors declare no conflicts of interest in accordance with International Committee of Medical Journal Editors (ICMJE) standards.
The method for development of WHAM (Wound Healing and Management unit at Curtin University, Perth) evidence summaries is consistent with methodology published in Munn Z, Lockwood C, Moola S. The development and use of evidence summaries for point of care information systems: a streamlined rapid review approach. Worldviews Evid Based Nurs 2015;12(3):131–8 and other resources on rapid evidence summaries published by the JBI as cited above. WHAM evidence summaries undergo peer-review by an international multidisciplinary Wound Expert Reference Group. WHAM evidence summaries provide a summary of the best available evidence on specific topics and make suggestions that can be used to inform clinical practice. Evidence contained within this summary should be evaluated by appropriately trained professionals with expertise in wound prevention and management, and the evidence should be considered in the context of the individual, the professional, the geographic and clinical setting and other relevant clinical information.
Funding
The authors received no funding for this evidence summary.
Copyright © 2021 Wound Healing and Management Unit, Curtin University.
![]()
Resumo das evidências do WHAM: eficácia dos produtos tópicos de coco
Robin Watts, Teresa Solomon and Emily Haesler
DOI: https://doi.org/10.33235/wcet.41.2.32-35
Questão Clínica
Quais são as melhores evidências disponíveis sobre a utilização de produtos tópicos de coco na gestão de feridas e no tratamento das condições cutâneas?
Síntese
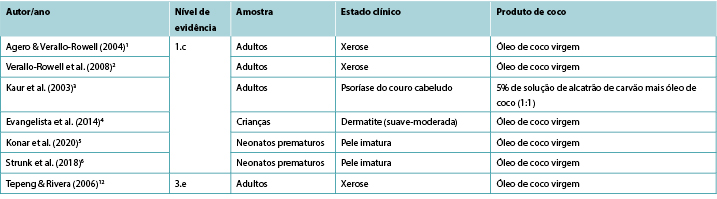
Apesar da ampla utilização de produtos tópicos de coco para fins medicinais em regiões geográficas tropicais, apenas um número limitado de estudos clínicos relatando a sua eficácia no tratamento das condições cutâneas e nenhum estudo relatando a sua utilização na gestão de feridas foram identificados nesta revisão rápida. As evidências de nível 1 1,2 demonstraram que o óleo de coco virgem tópico (VCO) está associado a melhorias nos sinais e sintomas de xerose1,2 e psoríase3 nos adultos e dermatite leve a moderada nas crianças4. Há algumas evidências de que o VCO melhora a pontuação de imaturidade da pele em recém-nascidos prematuros5,6. Atualmente não existem evidências disponíveis sobre a utilização de produtos tópicos de coco para a cura de feridas humanas.
Recomendações de prática clínica
Todas as recomendações devem ser aplicadas tendo em consideração a ferida, a pessoa, o profissional de saúde e o contexto clínico.
- O VCO tópico poderia ser considerado para o tratamento de xerose leve a moderada (Grau B).
- O VCO tópico poderia ser considerado para o tratamento da psoríase na ausência de acesso à terapia tópica com corticosteroides (Grau B).
- O VCO tópico poderia ser considerado para o tratamento de dermatite atópica leve a moderada em crianças (Grau B).
Origem das evidências
Este resumo foi conduzido utilizando métodos publicados pelo Instituto Joanna Briggs (JBI)7-11. O resumo baseia-se numa pesquisa bibliográfica sistemática, que combina termos de pesquisa relacionados com feridas e condições cutâneas, com termos relacionados com coqueiros. Foram realizadas pesquisas nas bases de dados Embase, Medline, Global Health, Allied and Complementary Medicine e em 10 revistas de saúde de países de baixo e médio rendimento para evidências publicadas até maio de 2021 em inglês. Foi atribuído aos estudos um nível de evidência (Quadro 1) baseado na hierarquia do JBI7-11. As recomendações são feitas com base no conjunto de evidências e são classificadas de acordo com o sistema reportado pelo JBI7-11.
Quadro 1. Níveis de evidência

Antecedentes
Há milhares de anos que várias partes do coqueiro têm sido utilizadas para uma multiplicidade de fins na medicina tradicional, na medida em que a planta é frequentemente denominada a "árvore da vida"16. Produtos derivados da Cocos nucifera Linn: Areca acaé incluem água de coco, óleo de leite de coco ou copra (amêndoa seca), casca de coco seca e fibra de casca17,18. O produto de coco mais utilizado, óleo de coco virgem (VCO), é extraído diretamente da carne de coco e contém ácidos gordos de cadeia média com qualidades surfactantes1,19,20. Outro produto testado, o líquido de fumo de casca de coco (CS-LS) é produzido pela queima de casca de coco a 400°C, resultando numa solução proveniente da condensação do vapor de fumo de madeira14. As cascas de coco contêm as propriedades antioxidantes mais elevadas de quaisquer outras partes do coco14.
Os testes laboratoriais e análises bioquímicas destes produtos identificaram uma série de propriedades úteis - anti-inflamatórias, antimicrobianas, antifúngicas, antioxidantes, antineoplásicas e analgésicas17,18,20-24. Quando aplicado topicamente, o VCO proporciona proteção de barreira para o estrato córneo e reduz a perda transepidérmica de água (TEWL), promovendo a hidratação da pele19,20,24,25. Quando utilizados em feridas, o VCO e outros produtos derivados do coco são relatados como promotores da síntese de colagénio e de uma epitelização mais rápida15,20,24.
Evidência
Evidências de estudos com animais
As evidências sobre o efeito curativo do coco provêm de estudos com animais. Os resultados de três estudos13-15 são fornecidos como exemplos da quantidade significativa de trabalhos de laboratório sobre este tópico. No primeiro estudo13, realizado na Índia, o VCO foi aplicado diariamente durante 10 dias para abrir feridas dérmicas em ratos. Havia três grupos de seis ratos cada - um grupo de controlo, um grupo tratado com 0,5ml de VCO e um terceiro tratado com 1ml de VCO. O tempo para completar a epitelização e a composição do tecido de granulação (por exemplo, colagénio e fibroblastos) estavam entre as medidas dos resultados. Tanto em termos de tempo para completar a epitelização como de conteúdo total de colagénio, os grupos 2 e 3 foram estatisticamente significativos em comparação com o controlo (p<0,05), sendo 1ml mais eficaz do que 0,5ml13 (Nível 5).
O segundo estudo14 foi realizado na Indonésia para avaliar a atividade curativa da CS-LS para queimaduras. Trinta e seis ratos foram aleatoriamente separados em três grupos (n=12/grupo) - CS-LS, solução salina normal 0,9% (NaCl) e 10% iodopovidona. As feridas de queimadura foram deixadas abertas, com tratamento aplicado duas vezes por dia durante 25 dias. A contração da ferida foi medida nos dias 1, 5, 10 e 25 após a indução da queimadura. O grupo CS-LS mostrou uma contração de feridas mais rápida entre os três grupos no quinto dia (p<0,001). No dia 10 houve uma diferença estatisticamente significativa no grupo da iodopovidona (p<0.001) e no dia 25 ocorreu uma diferença também estatisticamente significativa no grupo do NaCl (p<0.05)14 (Nível 5).
No terceiro estudo15, VCO para o tratamento de úlceras diabéticas foi explorado com uma população de ratos. Os ratos com úlceras foram divididos em quatro grupos - ratos não tratados, não diabéticos (n=18), ratos diabéticos não tratados (n=18), ratos diabéticos que recebem 1ml de VCO aplicado diariamente durante 14 dias (n=18) e ratos diabéticos que recebem creme de sulfadiazina de prata aplicado diariamente durante 14 dias (n = 18). As taxas de encerramento de feridas foram medidas nos dias 5, 10 e 14. As úlceras diabéticas tratadas com VCO tiveram taxas de encerramento significativamente mais rápidas (p<0,05) em comparação com as úlceras diabéticas que não receberam tratamento todos os dias. Nos dias 5 e 14 houve uma diferença estatisticamente significativa entre os grupos VCO e o grupo creme de sulfadiazina de prata (p<0,05), favorecendo o VCO15 (Nível 5).
Evidências de estudos em humanos
Evidências de eficácia no tratamento de feridas
Não foram identificadas evidências de produtos tópicos de coco para utilização no tratamento de feridas humanas.
Evidências de eficácia no tratamento de condições cutâneas
Xerose em adultos
Dois RCTs1,2 cegos forneceram provas da utilização de VCO para aliviar a xerose (pele seca) em adultos. O primeiro RCT1 foi realizado em 34 indivíduos com xerose leve a moderada para determinar a eficácia e segurança do VCO em comparação com o óleo mineral, quando usado como um hidratante terapêutico. As soluções foram aplicadas às pernas duas vezes por dia durante 14 dias. A hidratação e os lípidos cutâneos foram testados para medir a eficácia, enquanto a TEWL e o pH cutâneo foram as medidas quantitativas de segurança. A xerose foi avaliada para secura, descamação, rugosidade e prurido tanto por um investigador utilizando a classificação Wehr como pelos participantes utilizando uma escala analógica visual. Os dados foram recolhidos na linha de base, dia 7 e dia 14. Os participantes também avaliaram os efeitos secundários (por exemplo, eritema, picada ou prurido). Ambos os tratamentos eram comparáveis em termos de medidas de resultados ao nível da eficácia e segurança. No final do estudo, 81% (13/16) dos participantes do grupo VCO apresentaram uma melhoria de pelo menos um nível na classificação da xerose em comparação com 72% (13/18) do grupo do óleo mineral1 (Nível 1).
O segundo RCT2 comparou o VCO com o azeite virgem (VOO), para aliviar a xerose e eliminar o Staphylococcus aureus da pele em adultos com dermatite atópica (n=52). Um grupo foi tratado com VCO e o outro com VOO, com os óleos massajados suavemente na pele duas vezes por dia, em dois locais de pele que não apresentavam sinais clínicos de infeção. As medidas de resultados foram a cultura da pele, a fotografia e a componente objetiva do índice de gravidade SCORAD (O-SSI). A avaliação foi efetuada na linha de base e às 4 semanas. Com 4 semanas, o grupo VCO melhorou mais significativamente no O-SSI em comparação com o grupo VOO (p=0,004)2. Do grupo VCO, 77% (20/26) foram positivos para S. aureus ao entrar no estudo, em comparação com 46% (12/26) no grupo VOO. Após o tratamento, apenas 5% (1/12) do grupo VCO permaneceram positivos contra 50% (6/12) do grupo VOO. O risco relativo para VCO foi de 0,1 em comparação com 10,1 para VOO (p=0,00; intervalo de confiança de 95% [CI], 0,01-0,73, número necessário para tratar [NNT]=2,2) (Nível 1).
Psoríase em adultos
Dois estudos forneceram provas sobre a utilização de óleo de coco para o tratamento da psoríase. Num RCT (n=40)3, os adultos com psoríase do couro cabeludo foram distribuídos aleatoriamente em três grupos para avaliar a eficácia dos emolientes relativamente suaves: 5% de solução de alcatrão de carvão mais óleo de coco (1:1); 10% de ureia, 10% de ácido láctico, 10% de propileno glicol mais 10% de parafina líquida (numa base de creme); e apenas VCO. Os três grupos mostraram uma melhoria significativa comparável ao longo do tempo, mostrando 57%, 64,4% e 58,3% de compensação dos sintomas, respetivamente, (p<0,01) sem efeitos adversos. Os autores observaram que os corticosteroides tópicos demonstraram taxas de resposta e de depuração substancialmente mais elevadas do que as observadas neste estudo3 (Nível 1).
Um estudo observacional (n=31)12 explorou o uso de VCO aplicado duas vezes por dia durante 8 semanas em lesões psoriáticas em adultos. Eritema, descamação e elevação da placa foram avaliados de duas em duas semanas usando fotografia e uma avaliação clínica da depuração dos sintomas. Na conclusão do estudo, 16% dos participantes (5/31) tinham uma remissão completa. Observou-se que a escala foi mais reduzida no período de 4-6 semanas de tratamento, enquanto que o eritema e a elevação da placa foram melhorados de forma mais significativa no período de 6-8 semanas. Não foram sentidos efeitos adversos12 (Nível 3).
Dermatite nas crianças
Um RCT4 (n=117) comparou a eficácia do VCO tópico com a do óleo mineral tópico para crianças (com idades entre 1-13 anos), com dermatite atópica leve a moderada. Para ambos os grupos de tratamento, foram aplicados 5ml de óleo duas vezes por dia. O impacto na função epidérmica foi medido utilizando uma ferramenta de avaliação clínica (SSI) e medindo a TEWL e a capacitância da pele, todas as medições efetuadas na linha de base e 2, 4 e 8 semanas. Na medida SSI, o VCO foi significativamente mais eficaz que o óleo mineral (redução média dos sintomas 68,23% contra 38,13%, p<0,001). O VCO também produziu resultados significativamente eficazes em termos de TEWL durante o período de 8 semanas, em comparação com o grupo do óleo mineral (diminuição em TEWL 70,7% contra 35,36%). Em termos do efeito emoliente dos dois óleos, uma diferença estatisticamente significativa entre os dois tornou-se aparente às 8 semanas de tratamento (p=0,03). Não foram relatados efeitos adversos no grupo VCO, enquanto cinco crianças do grupo do óleo mineral necessitaram de tratamento de "emergência" com corticosteroides tópicos4 (Nível 1).
Tratamento de pele imatura em recém-nascidos prematuros
Dois RCTs5,6 não cegos investigaram a aplicação de VCO a neonatos prematuros para promover a maturidade da pele. Em ambos os estudos, a maturidade da pele foi avaliada nos dias 7, 14 e 21 usando a Escala de Condição da Pele Neonatal (NSCS), a qual inclui a avaliação da secura, eritema e rutura da pele. Em ambos os estudos, os bebés com condições cutâneas existentes (por exemplo, infeção ou erupção cutânea) foram excluídos5,6.
No maior RCT (n=2.294)5, os neonatos prematuros (<37 semanas) foram distribuídos aleatoriamente entre um grupo de tratamento que recebia 5ml de VCO aplicados quatro vezes por dia e entre um outro grupo de controlo que recebia apenas massagem (sem tratamento tópico). Os bebés que recebiam VCO tinham resultados de NSCS estatisticamente melhores do que o grupo de controlo nos dias 7, 14, 21 e 28 (p<0,01) e tinham uma probabilidade significativamente menor de experimentar uma diminuição da maturidade da pele (p<0,01) ou hipotermia (p<0,01), sem incremento de eventos adversos, incluindo erupções cutâneas ou escorregamentos acidentais do bebé. No entanto, os pais eram significativamente mais propensos a classificar a intervenção como incómoda (2% versus 0,3%, p<0,001) (Nível 1).
Na segunda RCT6, 72 bebés prematuros (n<30 semanas) não receberam nenhum emoliente tópico (n=36) ou, no outro grupo, 5ml/kg VCO aplicados duas vezes por dia sobre o corpo (excluindo rosto, couro cabeludo e em torno de dispositivos médicos). Após 3 semanas de tratamento, a pontuação do NSCS diminuiu para os bebés do grupo de controlo, mas manteve-se estável para aqueles que receberam VCO (p=0,01). Não houve diferença significativa em eventos adversos, incluindo irritação da pele ou instabilidade da temperatura6 (Nível 1).
Devido a limitações metodológicas destes estudos, são necessárias mais provas para recomendar VCO nos cuidados de rotina de pele imatura de recém-nascidos. No entanto, a investigação disponível sugere que a prática é segura para ser explorada5,6.
Quadro 2. Resumo das evidências clínicas de produtos tópicos de coco
Considerações De Utilização
- Quando usado como hidratante da pele, VCO é aplicado a adultos e crianças esfregando diretamente na pele e/ou lesões, habitualmente duas vezes por dia1,2,4,12,22.
- A aplicação tópica de VCO para condições cutâneas suaves a moderadas está associada a uma taxa de efeitos adversos inferior à dos corticosteroides tópicos4,12.
- Para aplicar VCO na pele imatura de recém-nascidos muito prematuros, passar o óleo na pele durante 2-3 minutos sem massagem durante os cuidados de rotina, de modo a evitar um manuseamento excessivo6.
Conflito De Interesses
Os autores declaram não haver conflitos de interesse em conformidade com as normas do Comité Internacional de Editores de Revistas Médicas (ICMJE).
O método de desenvolvimento dos resumos de evidências do WHAM (Wound Healing and Management unit at Curtin University, Perth) é consistente com a metodologia publicada em Munn Z, Lockwood C, Moola S. O desenvolvimento e utilização de resumos de evidências para sistemas de informação em pontos de atendimento: uma abordagem de revisão rápida simplificada. Worldviews Evidence Based Nurs 2015;12(3):131-8 e outros recursos sobre resumos rápidos de evidências publicados pelo JBI, conforme citado acima. Os resumos de evidências do WHAM são submetidos a uma revisão por pares por um Grupo Internacional Multidisciplinar de Referência de Peritos em Feridas. Os resumos de evidências do WHAM fornecem um resumo das melhores evidências disponíveis sobre tópicos específicos e fazem sugestões que podem ser utilizadas para informar a prática clínica. As evidências contidas neste resumo devem ser avaliadas por profissionais devidamente formados e com conhecimentos especializados na prevenção e gestão de feridas e as evidências devem ser consideradas no contexto do indivíduo e do profissional, do ambiente geográfico e clínico e de outras informações clínicas relevantes.
Financiamento
Os autores não receberam qualquer financiamento para este resumo de evidências.
Copyright © 2021 Wound Healing and Management Unit, Curtin University.
![]()
Author(s)
Robin Watts AM, PhD, MHSc, BA, Dip NEd, FRCNA
Emeritus Professor, School of Nursing, Midwifery and Paramedicine, Wound Healing and Management (WHAM) unit, Curtin University, Perth, WA, Australia
Teresa Solomon BA, Grad Dip Lib Sc ALIA
Curtin University, Perth, WA, Australia
Emily Haesler* PhD, BN, P Grad Dip Adv Nurs, FWA
Adjunct Associate Professor, School of Nursing, Midwifery and Paramedicine, Wound Healing and Management (WHAM) unit, Curtin University, Perth, WA, Australia
Email Emily.haesler@curtin.edu.au
* Corresponding author
References
- Agero AL, Verallo-Rowell VM. A randomized double-blind controlled trial comparing extra virgin coconut oil with mineral oil as a moisturizer for mild to moderate xerosis. Dermatitis 2004;15(3):109–16.
- Verallo-Rowell VM, Dillague KM, Syah-Tjundawan BS. Novel antibacterial and emollient effects of coconut and virgin olive oils in adult atopic dermatitis. Dermatitis 2008;19(6):308–15.
- Kaur I, Saraswat A, Kumar B. A comparison of three therapeutic modalities in scalp psoriasis and a review of literature. Indian J Dermatol 2003;48.
- Evangelista MT, Abad-Casintahan F, Lopez-Villafuerte L. The effect of topical virgin coconut oil on SCORAD index, transepidermal water loss, and skin capacitance in mild to moderate pediatric atopic dermatitis: a randomized, double-blind, clinical trial. Int J Dermatol 2014;53(1):100–8.
- Konar MC, Islam K, Roy A, Ghosh T. Effect of virgin coconut oil application on the skin of preterm newborns: a randomized controlled trial. J Trop Pediatr 2020;66(2):129–35.
- Strunk T, Pupala S, Hibbert J, Doherty D, Patole S. Topical coconut oil in very preterm infants: an open-label randomised controlled trial. Neonatol 2018;113(2):146–51.
- Munn Z, Lockwood C, Moola S. The development and use of evidence summaries for point of care information systems: a streamlined rapid review approach. Worldviews Evid Based Nurs 2015;12(3):131–8. doi:10.1111/wvn.12094. PMID: 25996621.
- Aromataris E, Munn Z, editors. JBI manual for evidence synthesis. Joanna Briggs Institute; 2021. Available from: https://synthesismanual.jbi.global
- Joanna Briggs Institute (JBI) Levels of Evidence and Grades of Recommendation Working Party. New JBI grades of recommendation; 2013. Available from: https://jbi.global/sites/default/files/2019-05/JBI-grades-of-recommendation_2014.pdf
- Joanna Briggs Institute (JBI) Levels of Evidence and Grades of Recommendation Working Party. Supporting document for the Joanna Briggs Institute Levels of Evidence and Grades of Recommendation; 2014. Available from: https://jbi.global/sites/default/files/2019-05/JBI%20Levels%20of%20Evidence%20Supporting%20Documents-v2.pdf
- Joanna Briggs Institute (JBI) Levels of Evidence and Grades of Recommendation Working Party. JBI levels of evidence; 2013. Available from: https://jbi.global/sites/default/files/2019-05/JBI-Levels-of-evidence_2014_0.pdf
- Tepeng K, Rivera F. Virgin coconut oil for psoriasis. J Am Acad Dermatol 2006;54(3):AB210.
- Nevin KG, Rajamohan T. Effect of topical application of virgin coconut oil on skin components and antioxidant status during dermal wound healing in young rats. Skin Pharmacol Physiol 2010;23(6):290–7.
- Tarawan VM, Mantilidewi KI, Dhini IM, Radhiyanti PT, Sutedja E. Coconut shell liquid smoke promotes burn wound healing. J Evid Based Complement Altern Med 2017;22(3):436–40.
- Soliman AM, Lin TS, Ghafar NA, Das S. Virgin coconut oil and diabetic wound healing: histopathological and biochemical analysis. Eur J Anat 2018;22(2):135–44.
- DebMandalm M, Mandalm S. Coconut (Cocos nucifera L.: Arecaceae): in health promotion and disease prevention. Asian Pacific J Trop Med 2011;4(3):241–7.
- Dua K, Sheshala R, Ling T, Ling S, Gorajana A. Anti-inflammatory, antibacterial and analgesic potential of Cocos nucifera Linn.: a review. Med Chem (Los Angeles) 2013;12(2):158–64.
- Vaughn AR, Clark AK, Sivamani RK, Shi VY. Natural oils for skin-barrier repair: ancient compounds now backed by modern science. Am J Clin Dermatol 2018;19(1):103–17.
- Ayanlowo O, -Adeife OC, Ilomuanya M, Ebie C, Adegbulu A, Ezeanyache O, Odiase O, Ikebudu V, Akanbi B. African oils in dermatology. Dermatol Ther 2021 Apr 30:e14968. doi:10.1111/dth.14968. PMID: 33928725.
- Chew YL. The beneficial properties of virgin coconut oil in management of atopic dermatitis. Pharmacog Rev 2019;13(25):24–7.
- Lima E, Sousa C, Meneses L, Ximenes N, Santos Junior G, Vasconcelos G, Lima N, Patroninio M, Macedo D, Vasconcelos S. Cocos nucifera (L.) (Arecaceae): a phytochemical and pharmacological review. Braz J Med Biol Res 2015;48(11):953–64.
- Alves AQ, da Silva VA, Goes AJS, Silva MS, de Oliveira GG, Bastos IVGA, de Castro Neto AG, Alves AJ. The fatty acid composition of vegetable oils and their potential use in wound care. Adv Skin Wound Care 2019;32(8):1–8.
- Kh H, Kuttinath S, Rammohan R. First description of antibacterial and in vitro wound healing properties of Cocos nucifera tomentum. Asian J Pharm Clin Res 2019;12(5):118–22.
- Lin TK, Zhong L, Santiago JL. Anti-inflammatory and skin barrier repair effects of topical application of some plant oils. Int J Mol Sci 2018;19(1).
- Karagounis TK, Gittler JK, Rotemberg V, Morel KD. Use of “natural” oils for moisturization: review of olive, coconut, and sunflower seed oil. Pediatr Dermatol 2019;36(1):9–15.



