Volume 42 Number 1
WHAM evidence summary: Papaya-based products for treating wounds
Terena Solomons and Emily Haesler
Keywords debridement, wounds, Papaya, pawpaw, papain
For referencing Solomons T and Haesler E. WHAM evidence summary: Papaya-based products for treating wounds. WCET® Journal 2022;42(1):34-39
DOI https://doi.org/10.33235/wcet.42.1.34-39
Cliunical question
What is the best available evidence on the effectiveness of papaya-based products for wound healing?
Summary
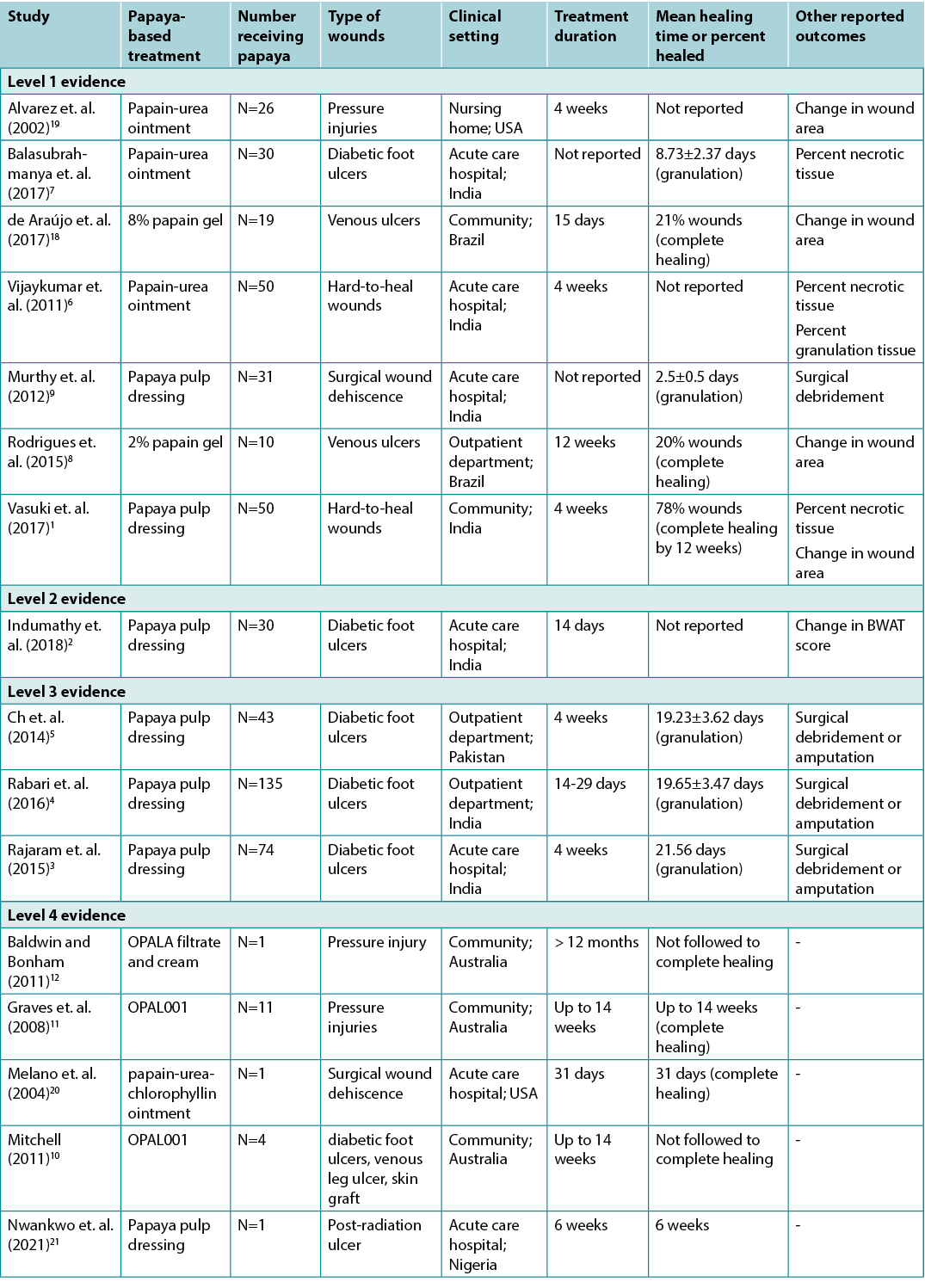
Despite a long history in low-to-middle resource countries of clinical use of papaya for managing wounds, limited high level research has been conducted on the effectiveness of papaya-based products. Evidence was available for natural papaya pulp wound dressings, commercial papain extract products (withdrawn from market in some countries due to the risk of anaphylaxis) and an experimental papaya filtrate product (not commercially available). Most studies were conducted in hard-to-heal wounds requiring debridement and the studies were generally at a high risk of bias.
Level 1 evidence1 and Level 2 evidence2 for papaya pulp dressings demonstrated an improvement in wound tissue type. Level 3 evidence3-5 suggested papaya pulp dressings were associated with improvement in wound tissue type, reasonable healing rates and reduction in requirement for further surgical interventions. Level 1 evidence6-9 for commercial papain products showed improvements in wound tissue type6, 7 and reduction in wound surface area8, 9. Other Level 1 evidence10 failed to demonstrate effectiveness, and Level 4 evidence was mixed.10-12
Clinical practice recommendations
All recommendations should be applied with consideration to the wound, the person, the health professional and the clinical context.
There is insufficient evidence to make a graded recommendation on the effectiveness of papaya-based products for promoting wound healing.
Evaluate the individual’s risk of allergic reaction (e.g., previous latex allergy) and licensing guidance in the geographic region before using topical papaya-based products. Cease use of natural papaya pulp dressings if the person experiences adverse outcomes (Grade B).
Search for evidence
This summary was developed using methods published by the Joanna Briggs Institute (JBI)13-17. The summary is based on a systematic literature search in English combining search terms that describe wounds and papaya. Searches were conducted in Embase, Medline, PubMed, Global Health, the Cochrane Library, Allied Health and Complementary Medicine and Google Scholar databases for dates up to December 2021. Searches were also conducted in ten healthcare journals from low-and-middle resource countries. Evidence was limited to clinical studies in humans. Studies were assigned a level of evidence (see Table One) based on JBI’s hierarchy13-17. Recommendations are made based on the body of evidence and are graded according to the system reported by JBI13-17.
Table One: Levels of evidence

Background
Papaya (Carica papaya, also called pawpaw) is a tropical plant originating from Southern Mexico and Central America that is now cultivated in tropical and subtropical regions worldwide. Many parts of the tree (e.g., fruit, leaves, seeds and bark) have been used in traditional medicine26. Biochemical analysis of papaya has identified several protease enzymes (e.g., papain and chymopapain) with debriding properties that are purported to remove slough and non-viable tissue and prepare the wound bed for healing. Papaya extract has also been reported to have antimicrobial properties9, 23, 24, 26. Papaya-based treatment is reported to be cost-effective7, 11, and papapaya pulp dressings have been successfully applied and managed by patients/unskilled carers in community settings1, 18.
The literature search identified several methods of applying papaya-based products to a wound:
- Natural papaya pulp dressing: Raw pulp from the fruit is prepared and applied directly to the wound bed.
- Commercial processed preparations: Products containing papain enzyme are available in gel, cream, impregnated dressings and other topically applied formulations. Papain is sometimes combined with other active agents including urea and chlorophyllin-copper complex to enhance its action25. Due to the risk of severe allergic response, papain-based topical agents are banned by the (USA) Food and Drug Administration22.
- Experimental processed formulation: A product prepared as papaya and peach (10-1 by volume), with the fruit flesh treated in a series of processes (titled OPAL001) to form two products – a filtrate and a cream11, 12. The mechanism of activity for the product were hypothesised to be related to either proinflammatory response, antioxidant effect and/or vasorelaxation12. The product is not currently listed with the Therapeutic Goods Administration in Australia where it was developed.
Although no serious adverse reactions were identified in the studies in this evidence summary, papaya has been associated with severe allergic reaction and anaphylaxis, including cross-reactivity in people with latex allergy. This has led to withdrawal of commercial papain-based products from the market in some countries, including the USA22, 26. Anaphylactic reaction is reported to occur at a rate of 1%;27 the response might be associated with the concentration of active ingredients, which is generally higher in processed perparations compared with the natural fruit pulp26.
Evidence
Papaya for improving clinical outcomes in chronic wounds
Studies reporting papaya pulp dressing for wound healing outcomes
One RCT1 compared the efficacy of two methods of debridement – enzymatic debridement using papaya pulp dressings and mechanical debridement using wet-to-dry saline dressings. Following randomisation, 128 participants were enrolled in the study. Of these, 93% had a chronic wound (7% hard wound dehiscence following surgery). There was a significant improvement in granulation tissue formation with papaya dressings compared to wet-to-dry dressings in the third and fourth weeks (p < 0.001) and superior reduction in slough/necrotic tissue for the papaya dressing group compared to the wet-to-dry dressing group at each weekly assessment point (week four, p = 0.0082). However, this did not translate to a significant difference in either reduction in mean wound size at four weeks (p = 0.08) or complete wound healing at three months (papaya 78% versus saline 72%, p = 0.488)1 (Level 1.c).
A quasi-experimental study2 assessed papaya pulp dressing prepared using fresh ripe fruit for healing diabetic foot ulcers. A convenience sample of 60 participants was assigned to either an experimental or control treatment (n = 30 in each group). The papaya dressings were changed daily for 14 days, while the control group received unspecified routine treatment. A significant improvement in healing occurred over time in the group receiving papaya dressing, as measured using the mean healing score on the Bates-Jensen Wound Assessment Tool (BWAT; pre-test 26.37 ± 7.73 versus post- test 51.10 ± 6.81, p < 0.001). A significant difference between the experimental and control group was also reported (p < 0.001)2 (Level 2.c).
A prospective study3 followed 94 patients who underwent a surgical procedure to treat a diabetic foot ulcer: amputation (n = 31) or surgical debridement (n = 63). Thereafter and in conjunction with oral antibiotic therapy, papaya pulp dressings were used for 89% (n = 74) of patients. The grated papaya was prepared, applied daily and covered with sterile gauze. Average healing time, defined as achieving healthy granulation tissue with epithelialised wound edges was 21.56 days (range from 17 to 28 days). Further surgery was required for ten patients3 (Level 3.e).
A second prospective study4 reported outcomes for 135 patients receiving papaya pulp dressings for diabetic foot ulcers (Grade 1-3 on Wagner’s classification system). Prior to commencing the second-daily dressing regimen, 96 patients (71.11%) required surgical debridement. Mean healing time, defined as achieving healthy granulation tissue and epithelialised wound edges, was 19.65 ± 3.47 days (range 14 to 29 days)4 (Level 3.e).
A study5 that included patients who were receiving combined therapy for diabetic foot ulcers (n = 43) tested the effect of papaya pulp dressings on healing. The papaya dressings were changed every two days. Healing time, defined as achieving healthy granulation tissue with epithelialised wound edges, ranged from 18 to 29 days (mean 19.23 days ± 3.624) and 88% of the ulcers required no further surgical intervention after papaya dressings commenced5 (Level 3.e).
A case study reported effective use of papaya pulp dressings to heal a post-radiation sacral ulcer. The wound had received surgical debridement, honey dressings, negative pressure wound therapy and failed flap surgery prior to commencing papaya treatment. Second-daily papaya pulp dressing led to healthy granulation after six weeks, allowing the patient to undergo a follow-up successful flap repair21 (Level 4.d).
Studies reporting processed papaya-based preparations for wound healing outcomes
In the largest RCT6 exploring processed papaya-based products, 100 participants with hard-to-heal, sloughy wounds received either papain-urea or collagenase debriding ointment. Treatment was commenced when the wound was stable (no healing observed over the preceding eight weeks) and continued for four weeks, with weekly assessment. The papain-urea group showed statistically significantly superior reduction in slough/necrotic tissue over time (89.22% ± 15.16% versus 82.51% ± 17.45%, p = 0.043). Between-group difference was not statistically significant in the first three weeks, and the small difference observed in week four may not be clinically significant. Percent of granulation tissue was statistically significantly greater for the papain-urea group at every weekly assessment, including baseline (week four: papain-urea 6.82% ± 8.15% versus collagenase 3.58% ± 3.09%, p = 0.01)6 (Level 1.c).
Sixty participants with diabetic foot ulcers were randomly assigned to received either papain-urea or an unidentified conventional wound dressing to explore the effectiveness of a commercially available papaya-based debriding agent.7 Both treatments were applied second-daily. The papain group achieved statistically significantly greater reduction of necrotic tissue (72.27% ± 4.68% versus 24.63% ± 3.74%, p = 0.03) and faster granulation (8.73 ± 2.37 days versus 16.03 ± 4.68 days, p = 0.001). The superior outcome led to faster hospital discharge7 (Level 1.c).
In a small, double-blind RCT18, 8% papain gel was compared to both fibrin gel a non-active gel control for the healing of chronic venous ulcers (n = 55 people with n = 63 ulcers). Individual ulcers were randomised to one of the three groups and assessed at baseline then every 15 days. Neither fibrin gel nor papain gel improved ulcer healing compared to the control. This conclusion was based on the following: complete wound healing rates were similar in all groups (fibrin gel 14.3%, papain gel 21.1% and control 30.4%, p = 0.43) and no statistically significant difference between groups in reduction in wound area (p = 0.62). All groups achieved improvements in exudate levels, signs of local wound infection and edge epithelisation by day 60 (all p > 0.05). Two participants (one in each of the active treatment groups) reported mild pain18 (Level 1.c).
In a small, non-blinded RCT, Rodrigues et. al. (2015)8 reported on the effectiveness of 2% papain gel compared to 2% carboxymethyl cellulose gel for healing venous leg ulcers. Twenty-one participants were randomised, of which 18 participants (n = 28 ulcers) completed the 12-week study. The results showed a statistically significant reduction in wound area for ulcers treated with papain, particularly between the fifth and 12th week of treatment (p = 0.032) and this was statistically significant compared to the control group (p = 0.006). However, the rate of complete healing was low (two ulcers treated with papaya and no control group ulcers completely healed in 12 weeks) and the amount of exudate and devitalised tissue were similar in both groups (p > 0.05 for both)8 (Level 1.c).
Another non-blinded small RCT19 (n = 29 randomised, n = 26 analysed) compared papain-urea to collagenase in non-infected pressure injuries. Participants were treated with moist-to-moist saline dressings in a screening period for up to two weeks prior to commencing the trial. After four weeks of treatment, papain-urea ointment was deemed to be statistically significantly (p < 0.05) superior for reducing wound size, with no pain or discomfort experienced by participants19 (Level 1.c).
Several case studies10-12 reporting use of OPAL001 papaya-based products have been published. In the first report, 11 quadriplegic patients with Category/Stage 2 and 4 pressure injuries received OPAL001 products in conjunction with contemporary wound dressings. Complete healing was achieved for nine of the pressure injuries after 6 days to 14 weeks of treatment11. In the second case report, removal of non-viable tissue and healing was achieved for two diabetic foot ulcers, one venous leg ulcer and an ulcerated skin graft in individuals with impaired vascular function10. The third case report12 detailed reduction in hyperkeratosis and the size of a sacral pressure injury after four weeks of treatment with OPALA filtrate and cream. Ongoing self-treatment with OPALA cream achieved resolution of hyperkeratosis, but the pressure injury deteriorated12 (all Level 4.d).
Table Two: Summary of the evidence for papaya-based treatments
Papaya for treating surgical wound dehiscence
An RCT9 compared the safety and efficacy of papaya pulp dressings with hydrogen peroxide solution in patients with wound dehiscence post-caesarean section (n = 63). Participants received concurrent antibiotics selected following culture and sensitivity. Time required to develop healthy granulation tissue in the hydrogen peroxide group was 6.2 ± 1.6 days compared to the papaya group at 2.5 ± 0.5 days (p < 0.05). Only 3.2% of the papaya dressing group required additional surgical debridement compared with 56% of the hydrogen peroxide group (p < 0.05). Minor adverse events (e.g., local irritation) were reported but not significantly different to those associated with hydrogen peroxide9 (n.b., hydrogen peroxide is not recommended for irrigating wounds) (Level 1.c).
A case study20 reported that the use of a papain-urea-chlorophyllin product applied to post-surgical sternal wound dehiscence was associated with complete healing after 31 days of second-daily treatment. The patient received concurrent negative pressure wound therapy20 (Level 4.d).
Considerations for use
- Papaya-based products facilitate breakdown of necrotic and nonviable tissues that contain protein and the debriding action is from the top downward in the wound. Debridement should be ceased when the wound bed is cleared of slough and necrotic tissue25.
- There is no standardised method of preparing papaya pulp dressing. Studies variably use ripe, semi-ripe or unripe fruit pulp9. Enzymatic content of the pulp is reported to potential decrease as the fruit ripens, suggesting raw or semi-ripe fruit is more effective1, 4, 9. Antimicrobial properties are reported to remain consistent as fruit ripens1, 4, 9.
- The following preparation method for papaya pulp dressings is reported:
- Remove the skin and seeds from papaya fruit2, 5.
- Either grate the fruit pulp9, 21, or mash it to a paste.
- Apply the papaya pulp to wound bed after cleansing the wound.9, 21
- Covered with sterile gauze9.
- Change the papaya pulp dressing daily2, 5 or second daily9, 21.
- Unused papaya paste should be placed in cold storage5.
Conflicts of interest
The author declares no conflicts of interest in accordance with International Committee of Medical Journal Editors (ICMJE) standards.
About WHAM evidence summaries
Wound Healing and management Collaborative (WHAM) evidence summaries are consistent with methodology published in:
Munn Z, Lockwood C, Moola S. The development and use of evidence summaries for point of care information systems: A streamlined rapid review approach, Worldviews Evid Based Nurs. 2015;12(3):131-8.
Methods are outlined in detail in resources published by the Joanna Briggs Institute as cited in this evidence summary, and on the WHAM website: http://WHAMwounds.com. WHAM evidence summaries undergo peer-review by an international multidisciplinary Expert Reference Group.
WHAM evidence summaries provide a summary of the best available evidence on specific topics and make suggestions that can be used to inform clinical practice. Evidence contained within this summary should be evaluated by appropriately trained professionals with expertise in wound prevention and management, and the evidence should be considered in the context of the individual, the professional, the clinical setting and other relevant clinical information.
Copyright © 2021 Wound Healing and Management (WHAM) Collaborative, Curtin University.

Resumo de provas da WHAM: Produtos à base de papaia para tratamento de feridas
Terena Solomons and Emily Haesler
DOI: https://doi.org/10.33235/wcet.42.1.34-39
Questão clínica
Qual é a melhor prova disponível sobre a eficácia dos produtos à base de papaia para a cicatrização de feridas?
Resumo
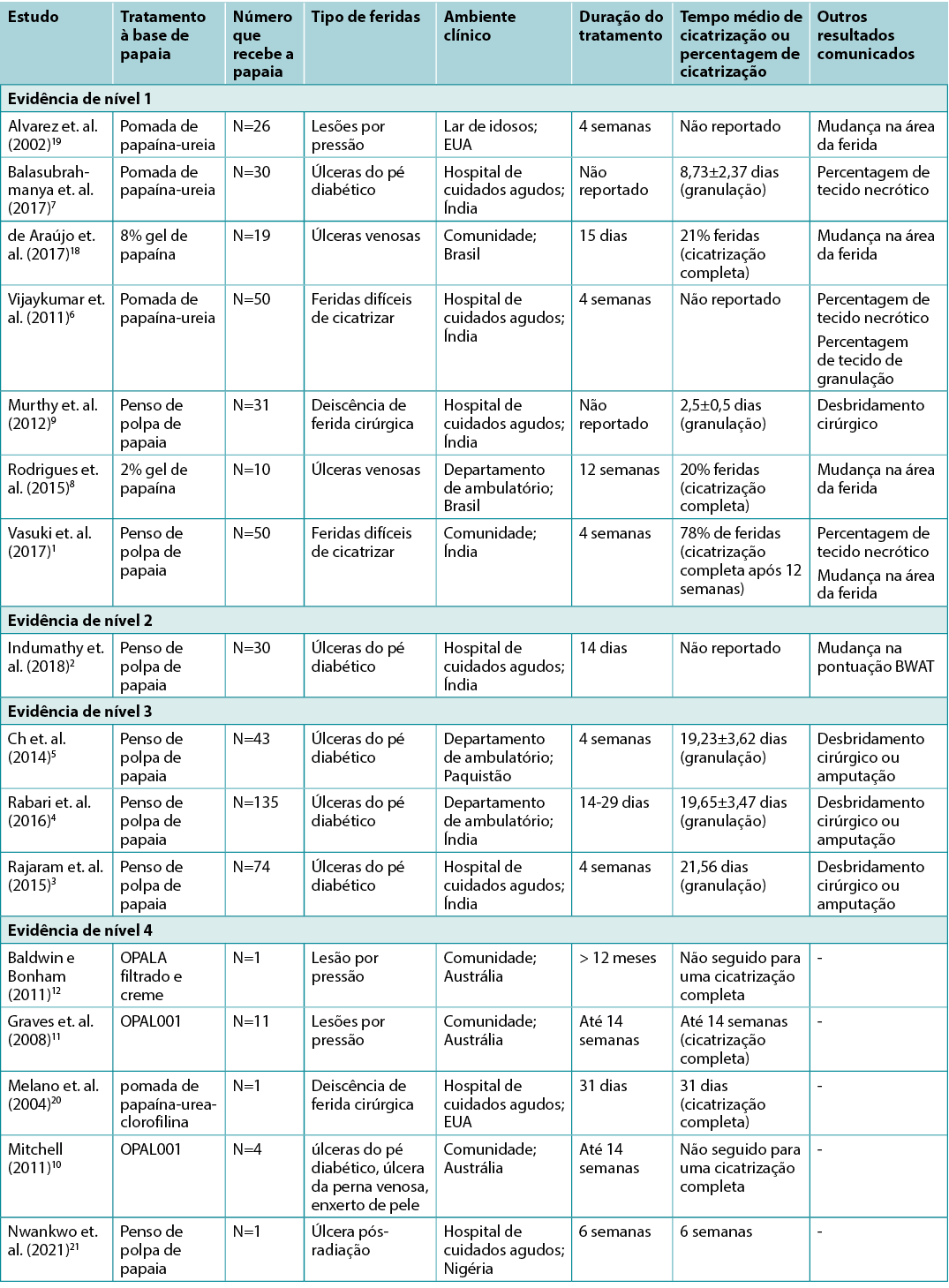
Apesar de uma longa história de utilização clínica da papaia para a gestão de feridas em países de recursos médios e baixos, têem sido limitada a realização de investigações de alto nível sobre a eficácia dos produtos à base de papaia. Estavam disponíveis provas de pensos naturais de polpa de papaia, produtos comerciais de extracto de papaína (retirados do mercado em alguns países devido ao risco de anafilaxia) e ainda um produto experimental de filtrado de papaia (não disponível comercialmente). A maioria dos estudos foram conduzidos em feridas difíceis de cicatrizar que necessitavam de desbridamento e os estudos geralmente continham um elevado risco de enviesamento.
Evidências1 de Nível 1 e evidências2 de Nível 2 para pensos de polpa de papaia demonstraram uma melhoria no tipo do tecido da ferida. Evidências3-5 de Nível 3 sugeriram que os pensos de polpa de papaia estavam associados a melhorias no tipo de tecido da ferida, taxas de cicatrização razoáveis e redução na necessidade de mais intervenções cirúrgicas. Evidências6-9 de Nível 1 para produtos comerciais de papaína mostraram melhorias no tipo de tecido da ferida6, 7 e redução na área da superfície da ferida8, 9. Outras evidências10 de Nível 1 não conseguiram demonstrar a eficácia, e as evidências de Nível 4 foram mistas.10-12
Recomendações de prática clínica
Todas as recomendações devem ser aplicadas tendo em consideração a ferida, a pessoa, o profissional de saúde e o contexto clínico.
Não há provas suficientes para fazer uma recomendação verificada sobre a eficácia dos produtos à base de papaia na promoção da cicatrização de feridas.
Avaliar o risco de reacção alérgica do indivíduo (por exemplo, alergia anterior ao látex) e orientações de licenciamento na região geográfica antes de utilizar produtos tópicos à base de papaia. Cessar o uso de pensos de polpa de papaia naturais se forem experimentados pela pessoa resultados adversos (Grau B).
Procura de provas
Este resumo foi conduzido utilizando métodos publicados pelo Instituto Joanna Briggs (JBI)13-17. O resumo é baseado numa pesquisa bibliográfica sistemática em inglês, a qual combina termos de pesquisa que descrevem feridas e papaia. Foram realizadas pesquisas em Embase, Medline, PubMed, Global Health, Biblioteca Cochrane, Saúde Aliada e Medicina Complementar e também em bases de dados do Google Scholar para datas até Dezembro de 2021. Foram também efectuadas pesquisas em dez revistas de saúde de países de recursos médios e baixos. As provas limitavam-se a estudos clínicos em humanos. Foi atribuído aos estudos um nível de prova (Quadro 1) baseado na hierarquia JBI13-17. As recomendações são feitas com base no conjunto de provas e são classificadas de acordo com o sistema reportado pelo JBI13-17.
Quadro 1: Níveis de evidência

Antecedentes
A papaia (papaia Carica, também chamada mamão) é uma planta tropical originária do sul do México e da América Central que é agora cultivada em regiões tropicais e subtropicais em todo o mundo. Muitas partes da árvore (por exemplo, frutos, folhas, sementes e casca) têm já sido utilizadas na medicina tradicional26. A análise bioquímica da papaia identificou várias enzimas proteases (por exemplo, papaína e quimopapaína) com propriedades de desbridamento que supostamente removem o tecido viscoso e o tecido não viável e preparam o leito da ferida para a sua cicatrização. Também foi relatado que o extracto de papaia tem propriedades antimicrobianas9, 23, 24, 26. O tratamento à base de papaia é relatado como sendo rentável7, 11 e os pensos de polpa de papaia têm sido aplicados e geridos com sucesso em ambientes comunitários por pacientes/cuidadores não qualificados1, 18.
A pesquisa bibliográfica identificou vários métodos de aplicação numa ferida de produtos à base de papaia:
- Penso de polpa de papaia natural: A polpa crua da fruta é preparada e aplicada directamente no leito da ferida.
- Preparações comerciais processadas: Os produtos contendo enzima papaína estão disponíveis em gel, creme, pensos impregnados e em outras formulações aplicadas topicamente. A papaína é por vezes combinada com outros agentes activos, incluindo a ureia e o complexo clorofilina-cobre para melhorar a sua acção25. Devido ao risco de resposta alérgica grave, os agentes tópicos baseados em papaína são proibidos pela (USA) Food and Drug Administration22.
- Formulação experimental processada: Um produto preparado como papaia e pêssego (10-1 por volume), com a polpa do fruto a ser tratada numa série de processos (denominado OPAL001) para formar dois produtos - um filtrado e um creme11, 12. O mecanismo de actividade para o produto foi hipoteticamente relacionado quer com a resposta pró-inflamatória, quer com o efeito antioxidante e/ou de vasorelaxação12. O produto não se encontra actualmente na lista da Therapeutic Goods Administration na Austrália, onde foi desenvolvido.
Embora não tenham sido identificadas reacções adversas graves nos estudos deste resumo de provas, a papaia tem sido associada a reacções alérgicas graves e a anafilaxia, incluindo reactividade cruzada em pessoas com alergia ao látex. Esta situação levou à retirada do mercado de produtos comerciais à base de papaína em alguns países, incluindo os EUA22, 26. A reacção anafiláctica é relatada a uma taxa de 1%;27 a resposta pode estar associada à concentração de ingredientes activos, que é geralmente mais elevada nas preparações processadas em comparação com a polpa natural da fruta26.
Evidência
Papaia para melhorar os resultados clínicos em feridas crónicas
Estudos relatam a utilização de pensos de polpa de papaia para a cicatrização de feridas
Um RCT1 comparou a eficácia de dois métodos de desbridamento - desbridamento enzimático usando pensos de polpa de papaia e desbridamento mecânico usando pensos salinos húmidos a secos. Após aleatorização, 128 participantes foram inscritos no estudo. Destes, 93% tinham uma ferida crónica (7% deiscência de ferida grave após cirurgia). Houve uma melhoria significativa na formação de tecido de granulação com pensos de papaia em comparação com pensos húmidos a secos na terceira e quarta semanas (p < 0,001) e uma redução superior do tecido viscoso/tecido necrótico para o grupo de pensos de papaia em comparação com o grupo de pensos húmidos a secos em cada momento de avaliação semanal (semana quatro, p = 0,0082). No entanto, isto não se traduziu numa diferença significativa quer na redução do tamanho médio da ferida às quatro semanas (p = 0,08) quer na cicatrização completa da ferida decorridos três meses (papaia 78% versus salina 72%, p = 0,488)1 (Nível 1.c).
Um estudo quase experimental2 avaliou o penso de polpa de papaia preparado utilizando fruta fresca madura para cicatrizar úlceras do pé diabético. Uma amostra de conveniência constituída por 60 participantes foi atribuída a um tratamento experimental ou de controlo (n = 30 em cada grupo). Os pensos de papaia foram mudados diariamente durante 14 dias, enquanto o grupo de controlo recebeu um tratamento de rotina não especificado. Uma melhoria significativa na cicatrização foi verificada ao longo do tempo no grupo que recebeu o penso de papaia, tal como medido utilizando a pontuação média de cicatrização na Ferramenta de Avaliação de Feridas Bates-Jensen (BWAT; pré-teste 26,37 ± 7,73 versus pós-teste 51,10 ± 6,81, p < 0,001). Foi também relatada uma diferença significativa entre o grupo experimental e o de controlo (p < 0,001)2 (Nível 2.c).
Um estudo prospectivo3 seguiu 94 pacientes submetidos a um procedimento cirúrgico para tratar uma úlcera do pé diabético: amputação (n = 31) ou desbridamento cirúrgico (n = 63). Posteriormente e em conjunto com a terapia antibiótica oral, foram utilizados pensos de polpa de papaia para 89% (n = 74) dos pacientes. A papaia ralada foi preparada, aplicada diariamente e coberta com gaze esterilizada. O tempo médio de cicatrização, definido como a obtenção de tecido de granulação saudável com bordos epitelizadas da ferida, foi de 21,56 dias (intervalo de 17 a 28 dias). Foi necessária cirurgia adicional para dez pacientes3(Nível 3.e).
Um segundo estudo prospectivo4 relatou resultados para 135 pacientes que receberam pensos de polpa de papaia para tratamento de úlceras do pé diabético (Graus 1-3 no sistema de classificação de Wagner). Antes de iniciar o segundo regime de penso diário, 96 pacientes (71,11%) necessitavam de desbridamento cirúrgico. O tempo médio de cicatrização, definido como o necessário para a obtenção de tecido de granulação saudável e bordos epitelizados da ferida, foi de 19,65 ± 3,47 dias (intervalo de 14 a 29 dias)4 (Nível 3.e).
Um estudo5 que incluiu pacientes que estavam a receber terapia combinada para úlceras do pé diabético (n = 43), testou o efeito dos pensos de polpa de papaia na cicatrização. Os pensos de papaia eram mudados de dois em dois dias. O tempo de cicatrização, definido como a obtenção de tecido de granulação saudável com bordos epitelizados da ferida, variou de 18 a 29 dias (média 19,23 dias ± 3,624) e 88% das úlceras não necessitaram de mais intervenções cirúrgicas após o início dos pensos de papaia5(Nível 3.e).
Um estudo de caso relatou o uso eficaz de pensos de polpa de papaia para cicatrizar uma úlcera sacral pós-radiação. A ferida tinha recebido desbridamento cirúrgico, pensos de mel, terapia de feridas com pressão negativa e cirurgia de retalho sem êxito antes de se iniciar o tratamento com papaia. Um penso de polpa de papaia aplicado 2 vezes ao dia levou a uma granulação saudável após seis semanas, permitindo ao paciente submeter-se a uma reparação de retalho de seguimento 21 (Nível 4.d) com sucesso.
Estudos que relatam preparações processadas à base de papaia para a obtenção de resultados de cicatrização de feridas
Na maior RCT6 explorando produtos transformados à base de papaia, 100 participantes com feridas viscosas de difícil cicatrização, receberam papaína-ureia ou pomada de colagenase. O tratamento foi iniciado quando a ferida estava estável (não foi observada cicatrização durante as oito semanas anteriores) e continuou durante quatro semanas, com avaliação semanal. O grupo papaína-ureia mostrou uma redução superior estatisticamente significativa em tecido viscoso/ tecido necrótico ao longo do tempo (89,22% ± 15,16% contra 82,51% ± 17,45%, p = 0,043). A diferença entre grupos não foi estatisticamente significativa nas primeiras três semanas e a pequena diferença observada na quarta semana pode não ser clinicamente significativa. A percentagem de tecido de granulação foi significativamente superior para o grupo da papaína-ureia em cada avaliação semanal, incluindo a linha de base (semana quatro: papaína-ureia 6,82% ± 8,15% versus colagenase 3,58% ± 3,09%, p = 0,01)6 (Nível 1.c).
Sessenta participantes com úlceras do pé diabético foram designados aleatoriamente para receberem papaína-ureia ou um penso convencional não identificado para explorar a eficácia de um agente desbridante à base de papaia disponível comercialmente.7 Ambos os tratamentos foram aplicados duas vezes ao dia. No grupo da papaína verificou-se uma redução estatisticamente maior do tecido necrótico (72,27% ± 4,68% versus 24,63% ± 3,74%, p = 0,03) e uma granulação mais rápida (8,73 ± 2,37 dias versus 16,03 ± 4,68 dias, p = 0,001). Este resultado superior levou a uma alta hospitalar mais rápida7(Nível 1.c).
Num RCT18 pequeno e duplo-cego, 8% gel de papaína foi comparado com gel de fibrina e com um controlo de gel não activo para a cicatrização de úlceras venosas crónicas (n = 55 pessoas com n = 63 úlceras). As úlceras individuais foram aleatorizadas para um dos três grupos e avaliadas na linha de base e depois de 15 em 15 dias. Nem o gel de fibrina nem o gel de papaína melhoraram a cicatrização da úlcera em comparação com o controlo. Esta conclusão baseou-se no seguinte: as taxas de cicatrização completa das feridas foram semelhantes em todos os grupos (gel de fibrina 14,3%, gel de papaína 21,1% e controlo 30,4%, p = 0,43) e nenhuma diferença estatisticamente significativa foi encontrada entre grupos em termos de redução da área da ferida (p = 0,62). Todos os grupos alcançaram melhorias nos níveis de exsudado, sinais de infecção local da ferida e epitelização dos bordos até ao dia 60 (todos p > 0,05). Dois participantes (um em cada um dos grupos de tratamento ativo) reportaram dor ligeira18(Nível 1.c).
Num pequeno RCT não cego, Rodrigues et. al. (2015)8 relatou a eficácia de 2% de gel de papaína em comparação com 2% de gel de carboximetilcelulose para a cicatrização de úlceras venosas das pernas. Vinte e um participantes foram aleatorizados, dos quais 18 participantes (n = 28 úlceras) completaram um estudo de 12 semanas. Os resultados mostraram uma redução estatisticamente significativa na área da ferida para úlceras tratadas com papaína, particularmente entre a quinta e 12ª semana de tratamento (p = 0,032) e isto foi estatisticamente significativo, em comparação com o grupo de controlo (p = 0,006). No entanto, a taxa de cicatrização completa foi baixa (duas úlceras tratadas com papaia e nenhuma úlcera do grupo de controlo curaram completamente em 12 semanas) e a quantidade de exsudado e tecido desvitalizado foram semelhantes em ambos os grupos (p > 0,05 para ambos)8 (Nível 1.c).
Outro pequeno RCT19 não cego (n = 29 aleatorizado, n = 26 analisado) comparou a papaína-ureia com a colagenase em lesões por pressão não infectadas. Os participantes foram tratados com pensos salinos hidratados, num período de rastreio até duas semanas antes do início do ensaio. Após quatro semanas de tratamento, o feito da pomada de papaína-ureia foi considerado estatisticamente significativo (p < 0,05) superior para reduzir o tamanho da ferida, sem dor ou desconforto experimentado pelos participantes19(Nível 1.c).
Foram publicados vários estudos de caso10-12 em que se relata a utilização de produtos à base de papaia OPAL001. No primeiro relatório, 11 pacientes tetraplégicos com lesões por pressão de categoria/fase 2 e 4 receberam produtos OPAL001, em conjunto com pensos contemporâneos para feridas. Após 6 dias a 14 semanas de tratamento, a cicatrização completa foi alcançada para nove das lesões por pressão11. No segundo relatório de caso, a remoção de tecido não viável e a cicatrização foi conseguida para duas úlceras do pé diabético, uma úlcera da perna venosa e um enxerto de pele ulcerada em indivíduos com função vascular comprometida10. O terceiro relatório de caso12 pormenorizou a redução da hiperqueratose e do tamanho de uma lesão por pressão sacral após quatro semanas de tratamento com OPALA filtrado e com creme. O autotratamento contínuo com o creme OPALA permitiu a resolução da hiperqueratose, mas a lesão por pressão deteriorou-se12 (todos de nível 4.d).
Papaia para tratamento de deiscência de ferida cirúrgica
Um RCT9 comparou a segurança e a eficácia dos pensos de polpa de papaia com uma solução de peróxido de hidrogénio em pacientes com deiscência da ferida pós-cesariana (n = 63). Os participantes receberam antibióticos concomitantes seleccionados de acordo com a cultura e com a sensibilidade. O tempo necessário para desenvolver tecido de granulação saudável no grupo do peróxido de hidrogénio foi de 6,2 ± 1,6 dias em comparação com o grupo da papaia a 2,5 ± 0,5 dias (p < 0,05). Apenas 3,2% do grupo de pensos de papaia necessitaram de desbridamento cirúrgico adicional em comparação com 56% do grupo do peróxido de hidrogénio (p < 0,05). Foram relatados pequenos eventos adversos (por exemplo, irritação local), mas não significativamente diferentes daqueles associados ao peróxido de hidrogénio9 (n.b., o peróxido de hidrogénio não é recomendado para feridas irrigantes) (Nível 1.c).
Um estudo de caso20 relatou que o uso de um produto de papaína-urea-clorofilina, aplicado à deiscência pós-cirúrgica da ferida do esterno, foi associado à cicatrização completa após 31 dias de tratamento de segundo dia. O paciente recebeu, simultaneamente, terapia de feridas com pressão negativa20(Nível 4.d).
Quadro 2: Resumo das provas de tratamentos à base de papaia
Considerações para utilização
- Os produtos à base de papaia facilitam a quebra de tecidos necróticos e de tecidos não viáveis que contêm proteínas e a acção de desbridamento ocorre de cima para baixo na ferida. O desbridamento deve ser cessado quando o leito da ferida se encontra limpo de tecido viscoso e de tecido necrótico25.
- Não existe um método normalizado de preparação do penso de polpa de papaia. Os estudos utilizam de forma variável polpa de fruta madura, semi-madura ou verde9. O conteúdo enzimático da polpa é reportado como tendo uma potencial diminuição à medida que o fruto amadurece, sugerindo que o fruto verde ou semi-maduro é mais eficaz1, 4, 9. As propriedades antimicrobianas são relatadas como sendo consistentes à medida que a fruta amadurece1, 4, 9.
- É relatado o seguinte método de preparação de pensos de polpa de papaia:
- Remover a pele e as sementes dos frutos da papaia2, 5.
- Ou ralar a polpa da fruta9, 21, ou triturá-la para obter uma pasta.
- Aplicar a polpa de papaia no leito da ferida após a limpeza da ferida.9, 21
- Cobrir com gaze esterilizada9.
- Mudar o penso de polpa de papaia diariamente2, 5 ou duas vezes ao dia9, 21.
- A pasta de papaia não utilizada deve ser colocada em câmara frigorífica5.
Conflito de interesses
Os autores declaram não haver conflitos de interesse, em conformidade com as normas do Comité Internacional de Editores de Revistas Médicas (ICMJE).
Sobre os resumos de provas da WHAM
Os resumos de provas de Wound Healing and management Collaborative (WHAM) são consistentes com a metodologia publicada em:
Munn Z, Lockwood C, Moola S. O desenvolvimento e uso de resumos de provas em sistemas de informação utilizados em pontos de atendimento: Uma abordagem de revisão rápida e simplificada, Worldviews Evid Based Nurs. 2015;12(3):131-8.
Os métodos são descritos em pormenor nos recursos publicados pelo Instituto Joanna Briggs, tal como citado neste resumo de provas e no website do WHAM: http://WHAMwounds.com. Os resumos de provas da WHAM são submetidos a uma revisão por pares por um Grupo de Especialistas de Referência Internacional e Multidisciplinar em Feridas.
Os resumos de provas da WHAM fornecem um resumo das melhores provas disponíveis sobre tópicos específicos e fazem sugestões que podem ser utilizadas para informação da prática clínica. As provas contidas neste resumo devem ser avaliadas por profissionais devidamente formados e com conhecimentos especializados na prevenção e gestão de feridas e as evidências devem ser consideradas no contexto do indivíduo e do profissional, do ambiente clínico e de outras informações clínicas consideradas relevantes.
Copyright © 2021 Wound Healing and Management (WHAM) Collaborative, Curtin University.

Author(s)
Terena Solomons
BA Grad Dip Lib Sc AALIA (CP) Health
Western Australian Group for Evidence Informed Healthcare Practice, Curtin University
Emily Haesler*
PhD Post Grad Sip Adv Nurs (Gerontics) BNurs Fellow Wounds Australia
Wound Healing and Management Collaborative, Curtin Health Innovation Research Institute, Curtin University
* Corresponding author
References
- Vasuki V, Thanmaran N, Vimalakaran B, Madan K. Comparative study of papaya dressing versus normal saline dressing in healing of ulcers. 2017, 2017;4(4):8.
- Indumathy S, Thenmozhi PA, Gowri PM. Effectiveness of papaya pulp dressing on diabetic foot ulcer International Journal of Research in Ayurveda and Pharmacy, 2018;9(5):75-8.
- Rajaram B, Venkanna M, Kumaraswamy BV, Kumar D, Maripeddi K, Puligilla S, Reddy S. The role of papaya dressings in the management of diabetic foot ulcers: A propsective study. Journal of Evidence Based Medicine and Healthcare, 2015;2(42):7365-71.
- Rabari Y, Singh R, Prasad D, Abraham A. The role of papaya (Carica papaya) dressings in the management of chronic ulcers. National Journal of Medical and Dental Research, 2016;4(4):329-32.
- Ch I, Shaikh S, ur Rashid H. The role of papaya dressings in the management of diabetic foot ulcers: A prospective study. Journal of Evidence Based Medicine and Healthcare, 2015;18(1):87-9.
- Vijaykumar H, Pai SA, Pandey V, Kamble P. Comparative study of collagenase and papain-urea based preparations in the management of chronic nonhealing limb ulcers. Indian J Sci Technol, 2011;4:1096-100.
- Balasubrahmanya KS, Praveen MP, Srinidhi M, Shruthi S, Jinumon KV, Rahul DK. A prospective study on effectiveness of use of papain urea based preparation in dressings compared with regular conventional dressings in diabetic foot ulcers Int Surg J, 2017;4(6):1984-87.
- Rodrigues AL, de Oliveira BG, Futuro DO, Secoli SR. Effectiveness of papain gel in venous ulcer treatment: Randomized clinical trial. Revista Latino-americana de Enfermagem, 2015;23(3):458‐65.
- Murthy MB, Murthy BK, Bhave S. Comparison of safety and efficacy of papaya dressing with hydrogen peroxide solution on wound bed preparation in patients with wound gape. Indian J Pharmacol, 2012;44(6):784-87.
- Mitchell GK. Clinical observations supporting a vasodilatory effect of the modified papaya extract OPAL001. Wound Practice & Research, 2011;19(4):190-5.
- Graves N, Ashby A. The use of OPAL001 filtrate and cream in the treatment of chronic pressure ulcers. Wound Practice & Research, 2008;16(2):22-9.
- Baldwin C, Bonham S. Treatment of a sacral pressure ulcer and extensive hyperkeratosis with OPAL A filtrate and cream: A case study. Wound Practice & Research, 2011;19:196.
- Munn Z, Lockwood C, S. M. The development and use of evidence summaries for point of care information systems: A streamlined rapid review approach. Worldviews Evid Based Nurs, 2015;12(3):131-8.
- Aromataris E, Munn Z, editors. JBI Manual for Evidence Synthesis. 2021. https://synthesismanual.jbi.global: Joanna Briggs Institute.
- Joanna Briggs Institute (JBI) Levels of Evidence and Grades of Recommendation Working Party. New JBI Grades of Recommendation. 2013. https://jbi.global/sites/default/files/2019-05/JBI-grades-of-recommendation_2014.pdf: JBI.
- Joanna Briggs Institute (JBI) Levels of Evidence and Grades of Recommendation Working Party. Supporting Document for the Joanna Briggs Institute Levels of Evidence and Grades of Recommendation. 2014. https://jbi.global/sites/default/files/2019-05/JBI%20Levels%20of%20Evidence%20Supporting%20Documents-v2.pdf: JBI.
- Joanna Briggs Institute (JBI) Levels of Evidence and Grades of Recommendation Working Party. JBI Levels of Evidence. 2013. https://jbi.global/sites/default/files/2019-05/JBI-Levels-of-evidence_2014_0.pdf: JBI.
- de Araújo IC, Defune E, Abbade LP, Miot HA, Bertanha M, de Carvalho LR, Ferreira RR, Yoshida WB. Fibrin gel versus papain gel in the healing of chronic venous ulcers: A double-blind randomized controlled trial. Phlebology, 2017;32(7):488-95.
- Alvarez OM, Fernandez-Obregon A, Rogers RS, Bergman L, Black M. A prospective, randomized comparative study of collagenase and papain-urea for pressure ulcer debridement. Wounds, 2002;14(8):293-301.
- Melano E, Rodriguez HL, Carrillo R, Dillon L. The effects of Panafil when using topical negative pressure to heal an infected sternal wound. J Wound Care, 2004;13(10):425-6.
- Nwankwo EU, Maduba CC, Modekwe VI, Nnadozie UU. The use of unripe pawpaw for wound bed preparation following radiation-induced sacral ulcer: A case report and review of literature. Niger J Med 2021;30(339-41).
- US Food Drug Administration (FDA). 2015. Questions and Answers about FDA’s Enforcement Action Regarding Unapproved Topical Drug Products Containing Papain. Available from: http://www.fda.gov/Drugs/GuidanceComplianceRegulatoryInformation/EnforcementActivitiesbyFDA/SelectedEnforcementActionsonUnapprovedDrugs/ucm119646.htm. [Accessed January 2021].
- Hakim R, Fakhrurrazi, Dinni. Effect of Carica papaya extract toward incised wound healing process in mice (Mus musculus) clinically and histologically. Evidence-Based Complementary and Alternative Medicine, 2019;2019:8306519.
- Tumpa SI, Hossain MI, Ishika T. Antimicrobial activities of Psidium guajava, Carica papaya and Mangifera indica against some gram positive and gram negative bacteria. J Pharmacogn Phytochem, 2015;3(6):125-9.
- Kravitz S, McGuire J, Zinszer K. Management of skin ulcers: Understanding the mechanismand selection of enzymatic debriding agents. Adv Skin Wound Care, 2008;21(2):72-4.
- Haesler E, Watts RR, J., Carville K. Local resource botanicals used in wound care. Wound Practice & Research, 2016;24(2):85-90.
- Pieper B, Caliri MH. Nontraditional wound care: A review of the evidence for the use of sugar, papaya/papain, and fatty acids. J Wound Ostomy Continence Nur, 2003;30(4):175–83.



