Volume 42 Number 2
Fluid handling dynamics and durability of silver-containing gelling fibre dressings tested in a robotic wound system
Aleksei Orlov, Adi Lustig, Angela Grigatti and Amit Gefen
Keywords Wound care, biomechanical model, exudate management, laboratory testing, sorptivity, tissue phantom
For referencing Orlov A et al. Fluid handling dynamics and durability of silver-containing gelling fibre dressings tested in a robotic wound system. WCET® Journal 2022;42(2):15-23
DOI https://doi.org/10.33235/wcet.42.2.15-23
Abstract
Objective To develop a robotic phantom system containing multiple simulated wound replicates to determine the synergy in fluid absorbency and retention (sorptivity) performances and the post-simulated-use mechanical durability of silver-containing gelling fibre primary dressings when used with a secondary dressing, as per clinical practice.
Methods Using a robotic system containing six identical wound simulators, the authors tested the sorptivity performances of the Exufiber Ag+ (Mölnlycke Health Care, Gothenburg, Sweden) primary dressing (ExAg-polyvinyl alcohol [PVA]) against a market-leading comparator product, when used with a secondary foam dressing. The durability of the primary dressings after simulated use was further investigated through tensile mechanical testing.
Results The ExAg-PVA primary dressing delivered greater fluid amounts for absorbency and retention by the secondary foam dressing, approximately 2- and 1.5-fold more than the comparator dressing pair after 10 and 15 hours, respectively. The ExAg-PVA dressing was also substantially less sensitive to the direction of pulling forces and, accordingly, exhibited post-use mechanical strength that was approximately four- and six-times greater than that of the other primary dressing (when the latter dressing was tested out-of-alignment with its visible seams) after 10 and 15 hours, respectively.
Conclusions The dynamics of the sorptivity and fluid sharing between primary and secondary dressings and the effect of directional preference of strength of the primary dressings for adequate durability, resulting in safe post-use removals, have been described. The comparative quantification of these capabilities should help clinical and nonclinical decision-makers select dressings that best meet their patient needs.
Copyright ©2022 the Author(s). This is an open-access article distributed under the terms of the Creative Commons Attribution-Non Commercial-No Derivatives License 4.0 (CCBY-NC-ND), where it is permissible to download and share the work provided it is properly cited. The work cannot be changed in any way or used commercially without permission from the journal.
Introduction
Wounds of all types, including chronic cavity wounds such as pressure injuries, are one of the most impactful, expensive, and common medical problems. Nearly 2.5% of the US population experiences wounds, which is similar, for example, to the prevalence of stroke in the US.1–4 As the population ages and the prevalences of diabetes and obesity increase, there is a sharp growth in demand for advanced and cost-effective wound care to deliver improved patient outcomes. Treatment dressings play a pivotal role in all aspects of wound healing. Designed, in essence, as a temporary artificial substitute for intact skin, treatment dressings protect the wound and manage the exudates that result from periwound inflammatory processes. The presence and composition of exudates typically support the function of tissue-repairing cells and newly generated tissues; thus, in a normal tissue-repair process, the rate of exudate and its constituents will match the healing phase.5–7 However, abnormal prolongation of the inflammatory stage, such as in chronic wounds, may disrupt the physiologic control of exudate production, leading to excessive exudate amounts or altered ratios of protein content which causes the fluid to be thick, highly viscous, or even sticky.5
Effective wound dressings are required to manage exudate fluids secreted at varying rates and viscosities, in the same wound at different times, or for wounds of the same etiology but different patients. A common clinical practice is to insert a primary wound dressing through the wound opening to form the first-line reservoir for fluid absorption and retention on the wound bed. A secondary dressing is then placed above the cavity (and the primary dressing) for mechanical and biological protection, as well as to make a second vessel for the accumulating fluids. Gelling fibre dressings composed of polyvinyl alcohol (PVA) fibres or sodium carboxymethyl cellulose (CMC) are widely used as primary dressings because of their ability to trap fluids by transformation into a gel phase8 (examples of these commercial primary wound dressing products are listed in the woundsource.com resource database9 under the “Gelling Fiber Dressings” wound dressing product category). A variant of these primary gelling fibre dressings are those that contain silver ions to further induce an antimicrobial effect. To deliver effective treatments, a primary dressing and a secondary dressing must work in synergy; that is, neither dressing should approach its maximum fluid absorption capacity within the timeframe indicated for use.3,10–12
The performance of a wound dressing depends primarily on the specific material composition, structure, and manufacturing technology of the dressing. These characteristics, in combination with the relevant clinical protocol, specific wound environment, and the type of paired secondary dressing, impact the safety and efficacy of the primary dressing product. Two fluid-structure interaction properties that are relevant to the function of primary dressings are “sorptivity,” the capacity of a dressing structure to transfer excessive exudate away from the wound bed and onward to the secondary dressing through capillary action,10,13 and “durability,” the ability of a dressing to withstand patient body weight and other mechanical forces applied during changes and remain intact within the wound over the period of use or upon removal.10,13
In the 1970s, it was reported that the presence of gauze dressing particles in wounds “act as foreign bodies and may delay healing. Their removal has been associated with accelerated healing.”14 More recently, Chakravarthy and colleagues15 documented grossly visible disintegration of modern (hydrocolloid) dressings in wounds. Dressing disintegration was associated with inflammatory giant cells—pathologic evidence for a foreign-body reaction—which highlights the importance of durability at both the macroscale and microscale. Specifically, Chakravarthy et al15 evaluated the density of giant cells in histologic tissue sections that were extracted from wounds in a pig model of wound healing and subsequently stained by hematoxylin and eosin. They documented the presence of foreign material (ie, dressing debris) in the vicinity of the giant cells in the histologic slides, which correlated with their observed fragmentation of some of the tested hydrocolloid dressings upon removal during dressing changes.15
Accordingly, poorly performing wound dressings or dressing pairs may cause suboptimal moisture balance, mechanical damage to tissues, foreign-body reactions, or a combination of these adverse events. Such dressing failure modes should be identified through methodological bioengineering laboratory testing so that medical claims can be controlled by regulatory bodies and dressing failure in clinical settings can be avoided. In this context, the authors continue to invest research efforts into the development and improvement of preclinical and laboratory testing methods for objective, quantitative, and standardised evaluation of wound dressing performance.3,10,11,13 Here, the authors present a novel robotic phantom system that contains multiple simulated wound replicates for the simultaneous testing of dressings. The system was developed and used to determine the synergy in fluid absorbency and retention performances of two silver-containing gelling fibre primary dressing products. The methods, equipment, and protocols reported herein form the basis for the next level of clinically relevant performance testing for wound dressings, focused on both safety and efficacy.
Methods
Robotic Exuding Wounds
The researchers developed and used a robotic phantom system comprising six wound replicates. Each wound unit in this system simulated an exuding, 2.5 cm-deep cavity wound (Figure 1). All six wound units included three layers of synthetic soft-tissues simulants (Figure 1). The top layer, representing the peri-wound skin, consisted of 5 mm-thick transparent silicone rubber (RTV615, Momentive Performance Materials Inc, Waterford, New York). An 8-mm-thick layer of paraffin gel (“candle-gel”; Ziv Chemicals Ltd., Holon, Israel) was placed below this “skin” layer, to represent adipose tissue. The inferior layer (with thickness of 12 mm) representing skeletal muscle was again made of silicone rubber (identical to that used as the skin simulant). The elastic modulus of the aforementioned silicone rubber material, measured through uniaxial tensile testing using an electromechanical material-testing machine (Instron model 5944; Instron Co, Norwood, Massachusetts) following ASTM D412-06,16 is 1.5 MPa, which is characteristic of both skin and muscle tissues under large deformations.17–19 The elastic modulus of the paraffin gel used to represent adipose tissue was measured through previously reported indentation tests20 and found to be 5 kPa, which is similar to the reported stiffness of native adipose tissues.21 To simulate continuous secretion of exudate from the above wound constructs, a spiral perforated irrigation tube was laid in each simulated wound bed and tunneled through the phantom structure to connect to a multichannel, programmable syringe pump (NE-1600; New Era Pump Systems Inc, Farmingdale, New York; Figure 1). The effective wet surface formed in the simulated wound beds through this irrigation element was approximately 24 cm2, corresponding to an effective irrigation depth of approximately 2.5 cm. The multichannel syringe pump provided precise control over the flow volume and release rate of an exudate-substitute fluid delivered into the simulated wound beds. The safe and reproducible exudate substitute fluid formula is based on Xanthan gum (C35H49O29); it was previously developed by the authors’ research group for use with the robotic wound phantom systems. This formula facilitates control of the fluid viscosity and pH level to adequately represent the physical characteristics of native exudates.10-13,22 Two exudate solutions were prepared, with high and low viscosities of 0.23 Pa×s and 0.06 Pa×s, respectively; the fluid density was 1.03 g/mL for both. An infrared heating lamp was positioned above the six wound replicas to maintain them at a temperature of 33 ± 2° C;23 the temperatures were monitored via a digital thermometer (Newtron TM-5005-SINGLE I/P; MRC Laboratory Equipment Ltd, Holon, Israel).
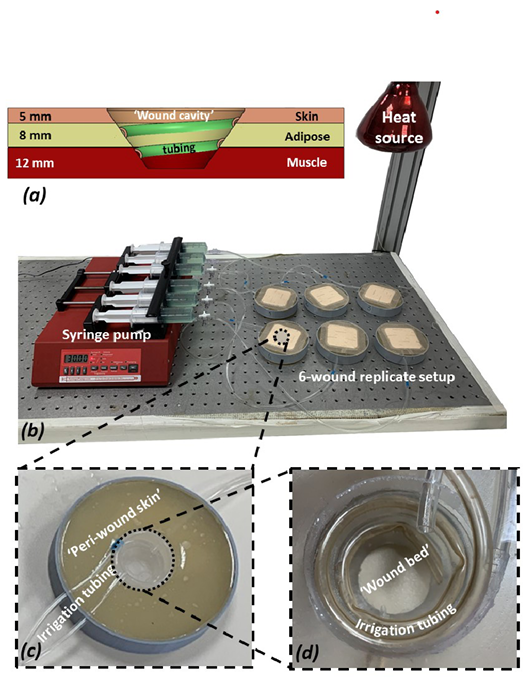
Figure 1. The experimental setup and its components
a) A scheme of a cross-section through a single “wound” simulator unit showing the different tissue simulant layers and their respective thicknesses, the shape and depth of the ‘wound cavity’ and the configuration of the spiral irrigation tubing. (b) A photograph of the robotic phantom system including the six wound replicates and the control unit. (c) A close-up view of a single simulated wound. (d) Zoom on the simulated exuding “wound bed.”
Simulated Treatments
Two types of 10×10 cm primary gelling fibre dressings were investigated: Exufiber Ag+ (Mölnlycke Health Care AB, Gothenburg, Sweden) with PVA fibres (ExAg-PVA) and an equivalent, commercially available, and market-leading silver ion dressing product containing sodium CMC as the gelling material (Ag-CMC). The Ag-CMC dressing is a soft, sterile, nonwoven pad composed of sodium CMC hydrocolloid fibre material that is impregnated with 1.2% ionic silver.24-26 It is indicated for clinical use in various wound types, both acute and chronic, and its physical and antibacterial properties have been described in detail elsewhere.24-26 Of note, although the two types of primary dressings selected for this study—PVA-based and CMC-based—are made of distinct materials and produced through different manufacturing technologies, both are clinically indicated for use as cavity wound fillers, which was the rationale for the current comparison. Mepilex Border Flex (MBF-Foam; Mölnlycke Health Care), a multilayer bordered silicone-foam dressing, was used as the secondary dressing to cover the simulated wounds in all the tests. The MBF-Foam is a five-layer dressing that includes (from the outer dressing surface to its wound-facing aspect): backing film, a retention layer, a spreading layer, an absorptive foam layer (which transports exudate to the spreading layer), and a wound contact layer.
Prior to applying the dressing products onto the simulated wounds, each dressing (primary or secondary) was weighed. The dressings were then applied according to manufacturer instructions. The simulated wounds were positioned facing upward, so that the tested dressings were required to absorb and retain the exudate substitute through capillary action (ie, against gravity). The robotic system was activated with a flow rate of 2 mL/h. To determine the time course of the absorbency performances of the tested dressings and, importantly, the dynamics of the fluid distribution between the primary and secondary dressings, the products were tested for multiple durations of simulated use: 5, 10, and 15 hours.
Dressing Studies
Fluid Retention and Distribution Between the Primary and Secondary Dressings. Following simulated use in the robotic phantom system, the dressings were reweighed to calculate the net mass gain in each dressing due to fluid absorption; any nonretained, residual fluids were carefully collected from the wound cavities and also weighed. After converting the measured fluid masses to volumes (by dividing the absorbed and residual fluid masses by the fluid density), the total exudate volume was calculated separately for each test as the sum of the fluid volumes in the primary and secondary dressings plus the volume of the residual fluid. Next, the distribution of fluid volumes between the primary and secondary dressings was calculated for each test as the percentage of fluid retained in the primary versus the secondary dressing, with respect to the corresponding total exudate volume (the theoretical value of which is also calculable, as the product of the predetermined flow rate and the time of operation of the robotic wound system).10
Fiber Directionality. For gelling fibre dressings, the directionality of the fibres, which typically is related to the manufacturing technology of these primary dressings (ie, PVA vs CMC), likely affects the performances of the dressing product, such as the sorptivity (the fibres become the structural conductors for the capillary action) and the durability (the fibres provide structural support and mechanical tolerance against forces that are aligned with their primary direction). Accordingly, the researchers assessed the directionality of the fibres in the two primary dressing types by digital image processing of microscopy images of the dressing surfaces, which were acquired using a light optical stereo microscope (Axiolab A450909; Carl Zeiss AG, Oberkochen, Germany). The micrographs of the dressing surfaces were acquired in transmitted light mode using a 1.25× magnification objective, a C-mounted digital camera (Swift Cam SC1803; Swift Optical Instruments Inc, Schertz Texas) and the Swift Imaging software (version 3.0, Swift Optical Instruments Inc.). Five fields of view (FOVs) were captured at consistent surface locations from two primary dressing specimens of each type: One FOV was located at the center of the dressing, and the other four FOVs formed a cross around the dressing center, with each such peripheral FOV located at a distance of 2.5 cm from the dressing edges. This resulted in a total of 15 digital micrographs of the FOVs per dressing type, each with dimensions of 4,912 × 3,684 pixels (1 square pixel = 0.919 µm2). For the purpose of the fibre directionality analyses, the acquired FOVs were further divided into three rectangular sub-FOVs, each with dimensions of 1445×3288 pixels. The fibre directionality analyses were conducted using the postacquisition plugin “OrientationJ” of the ImageJ software suite (version 1.X),27,28 which segments the fibres in the digital micrographs and calculates the probability function for their planar orientation in each analyzed sub-FOV. After calibrating this code and visually verifying its performances, the normalised histograms of the fibre orientations in the studied primary dressings were extracted.
Strength of the Primary Dressings After Simulated Use. Immediately after the simulated use sessions, the tensile strength of each primary dressing specimen was tested using an electromechanical testing machine (Instron model 5944; Instron Co) equipped with a 2kN load cell, following a protocol that is based on ASTM D882-02.29 Primary dressing specimens prepared according to the above testing standard were stretched at a deformation rate of 50 mm/min until ultimate failure occurred. Based on the resulting force-deformation data, stress-strain curves of the dressings after simulated use were plotted and the area under the stress-strain curve, which is the strain energy density (SED) to failure, was calculated for each test using a dedicated MATLAB computer code (ver. R2019a; MathWorks, Inc, Natick, Massachusetts). Based on these microscopy analyses of the fibre orientations, the ExAg-PVA dressing was treated as a structure without a specific directional preference (ie, test specimens from this dressing type were prepared and mechanically tested at random directions). However, the Ag-CMC silver-containing primary dressing, which has a specific directional preference of its fibres (as further detailed in the Results), was tested in two different configurations: where its principal fibre direction was fully aligned with the loading axis of the material testing machine, and where the fibres were out of such alignment.
Statistical analyses
All the experiments reported above were conducted in replicates of six and descriptive statistics of means and SDs were calculated for the retained fluid volumes, the distribution of fluid contents between the primary and secondary dressings per each simulated use duration (5, 10, and 15 hours), and the SED to failure of the primary dressings (depending on the directionality of the fibres with respect to the loading axis, as noted previously). Next, analyses of variance (ANOVA), followed by post-hoc Tukey-Kramer multiple pairwise comparisons, were run to identify potential differences between the dressing performances in the previously described fluid management (sorptivity) and material strength tests. Specifically, two-way ANOVAs for the factors of the usage time and the primary dressing type were conducted for the fluid retention and fluid distribution data. In addition, a three-way ANOVA for the factors of the usage time, the primary dressing type, and the directionality of the tensile test with respect to the fibre orientation (in the primary dressing that exhibited directional preference of fibre orientation) was performed for the material strength data. Only the longer exposure times of 10 and 15 hours, for which substantial fluid mass had accrued in the tested primary dressings, were considered for the latter three-way ANOVA. With respect to the directionality factor, based on the microscopy analyses, the last ANOVA considered the ExAg-PVA dressing, which did not show any specific and consistent directional preference of its fibres, as having a single strength (SED-to-failure) property. However, the Ag-CMC had two strength properties, namely, the strength measured (1) when the fibres were fully aligned with the loading axis of the material testing machine and, (2) when they were out of such alignment. P <.05 was considered statistically significant.
Results
When examined in isolation, the absorbency of the ExAg-PVA primary dressing was lower (approximately 11-22%) than that of the Ag-CMC primary silver dressing (Figure 2a). However, this difference was due to a more effective transfer of the exudate-like fluid from the ExAg-PVA dressing to the secondary dressing, as evident when examining the data for the fluid distribution between the primary and secondary dressings (Figure 2b). Specifically, when functioning in a pair with the ExAg-PVA dressing, the secondary dressing contained approximately twice the amount of fluid at the 10-hour time point and 1.5-times the amount of fluid after 15 hours with respect to the comparator pair (Figure 2b). The dynamics of the fluid distribution between the primary and secondary dressings over time (Figure 2b) further revealed that the reservoir of the secondary dressing began to receive fluid no earlier than 5 hours from the time of the dressing application (Figure 2b). After 15 hours, the secondary dressing shared approximately 54.2% of the retained fluid when the primary dressing was ExAg-PVA but only 36.7% when the Ag-CMC primary dressing was used (P < .05; Figure 2b). Importantly, these results represent the performances of the dressing pairs and therefore, better reflect real-world clinical practice, as opposed to assessments of the function of wound dressings in isolation (Figure 2b).
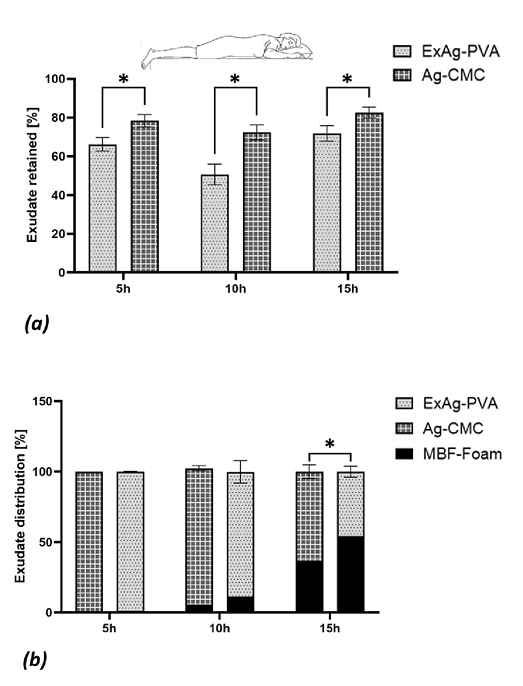
Figure 2. Fluid absorption and retention performances of the tested dressings
(a) The fluid retained in the primary dressings, reflecting the sorptivity of these dressings (reported as percentage of the total fluid volume retained in the primary and secondary dressings plus the residual fluid in the simulated wound bed). (b) The fluid distribution between the primary and secondary dressings after 5, 10, and 15 hours of simulated use in offloaded wounds (as in a prone position). The error bars are the SDs from the mean values of six test repetitions per test configuration and an asterisk indicates a statistically significant difference in the relevant outcome measure (P < .01).
The digital microscopy image analyses of the primary dressings indicated that the ExAg-PVA dressing had no distinguishable directional fibre preference. Specifically, to verify the relative lack of directional preference of the ExAg-PVA dressing with respect to that of the Ag-CMC primary silver-containing dressing, the researchers calculated the integral bounded between the fibre orientation histogram curve and the 0.5 (midpoint) level for the two primary dressings. This integral is defined here as the fibre orientation index (FOI). When a dressing does not exhibit a directional preference of its fibres, the positive and negative areas between the aforementioned histogram curve and the 0.5 level approximately cancel each other out, which results in a relatively low FOI value. The analyses of the FOI data indicated that the ExAg-PVA dressing had a statistically significant, approximately 3.9-fold lower FOI (15.6 ± 11.8) with respect to that of the Ag-CMC primary silver-containing dressing (60.8 ± 48.8; P < .05 for five different microscope FOVs on each dressing type). This FOI property ratio quantitatively demonstrates the strong preference of the fibre alignment in the Ag-CMC primary dressing toward the direction of the visible reinforcing seams in that dressing (the 90° direction marked in Figure 3a). Of note, the fibre orientation histogram of the latter (Ag-CMC) dressing was always above the midpoint level, which again indicates a strong directional preference (Figure 3a). Visual inspection of the microscopy data confirmed that the majority of the fibres in the Ag-CMC primary dressing were aligned and grouped together to connect to the vertical (90°-oriented) visible seams. The micrographs further demonstrated numerous elliptically shaped voids with characteristic maximum length dimensions of approximately 400 to 600 µm in the Ag-CMC primary dressing (Figure 3a). These findings, of a preferred fibre orientation and abundant presence of noncircular voids, justified the selection of the Ag-CMC primary silver-containing dressing as having a specific directional preference (ie, along its visible seams) for the purpose of further mechanical testing, as follows.
For the mechanical testing of the primary dressings post simulated use, the later time points of 10 and 15 hours of fluid exposure were selected because the previous results indicated that at 10 hours and afterward, both primary dressing types had transferred fluid to their paired secondary dressings (Figure 2b). Thus, at the 10- and 15-hour timepoints, both primary dressing types used their fluid reservoirs in a manner indicating that they were indeed tested at their “wet” state. Further, based on the results of the microscopy analyses, the ExAg-PVA dressing was tested as a structure without a specific directional preference (ie, irrespective of the direction by which test specimens were cut from this dressing type), whereas the Ag-CMC dressing was tested in two different configurations: fully aligned with the primary fibre orientation (90° direction), which is the direction of the visible seams, and out of such alignment (ie, randomly selected but different from the 90° direction).
The SED-to-failure data for the two primary dressing types are shown in Figure 3b and demonstrate considerable differences in mechanical behaviors of the post-use dressing types, particularly concerning the ductility of the ExAg-PVA dressing versus the Ag-CMC product. Ductility is the degree to which a material or structure can sustain plastic/irreversible deformations and continue to absorb strain energy under tensile loading before catastrophic failure occurs. Interestingly, the ExAg-PVA dressing appeared to gain ductility as it absorbed more fluid and gelled and accordingly, at 15 hours, it had 1.7-times greater SED-to-failure than it did at 10 hours. In contrast, gelling transformation did not translate into greater ductility for the Ag-CMC primary dressing; its SED-to-failure data were indistinguishable for the 10- and 15-hour time points (Figure 3b). Moreover, the aforementioned strength tests clearly indicated that the main loadbearing structure in the Ag-CMC primary dressing was, indeed, the reinforcing (visible) seams and the (near) 90°-oriented fibres. When tested out of alignment, the strength of the Ag-CMC primary dressing dropped significantly, by more than 8-fold (P < .05). With respect to the mechanical strength of the ExAg-PVA dressing, the Ag-CMC primary dressing had an out-of-alignment strength that was approximately four and six times lower for the 10- and 15-hour time points, respectively (P < .05).
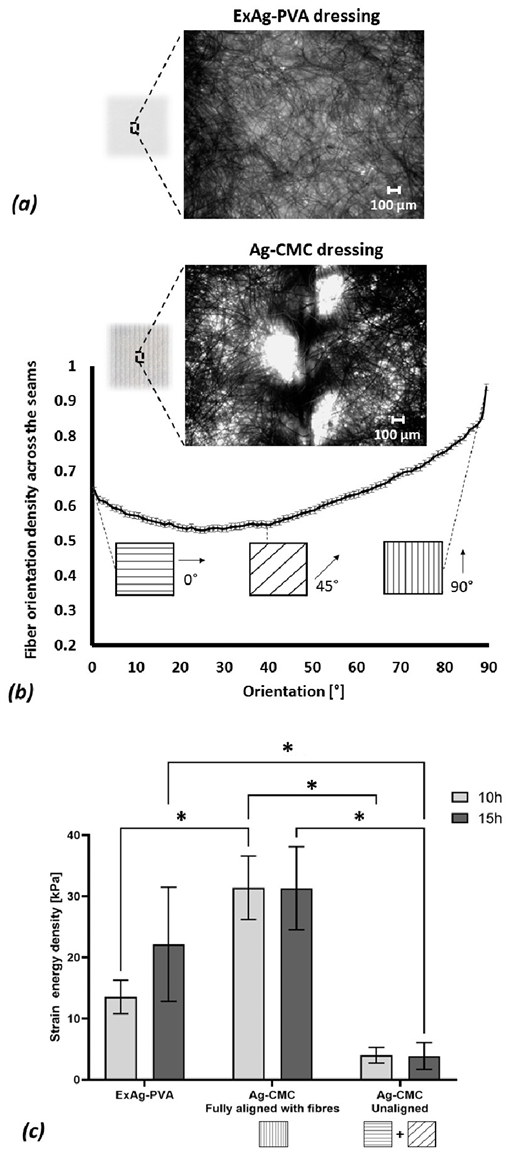
Figure 3. Structure-function analyses of the tested primary wound dressings
(a) An example of a microscopic image of the Exufiber Ag+ (ExAg-PVA) dressing. (b) Representative microscopy image analysis of the fiber orientation in the Ag-sodium carboxymethyl cellulose (CMC) dressing, showing the normalised planar distribution of fiber orientations in this primary dressing type. (c) The strain energy density to failure of the two tested primary dressing types post simulated use of 10 and 15 hours, where the Ag-CMC product has been tested in two configurations, either in full alignment of the principal direction of the fibers of the dressing with the loading axis of the testing machine, or out of such alignment. The error bars are the SDs from the mean values of six test repetitions per test configuration and an asterisk indicates a statistically significant difference in the relevant outcome measure (P < .01).
Discussion
Wound exudates are critical for tissue repair—they facilitate cell mobility and transport of signaling molecules and growth factors across the wound bed. However, excess exudate production may lead to maceration, become a medium for infections, or prolong the inflammation period.30,31 Thus, excess exudate amounts should be absorbed and retained in therapeutic dressings to support the natural wound-healing process. Clinical practice in treating cavity wounds as well as other highly exuding wounds (such as venous leg ulcers and burns) is to use a nonadherent wound filler as the primary dressing to induce a moist wound-healing environment while maximising dressing contact with the wound bed for effective absorbency. A secondary dressing is then applied to close the wound and protect it from potential mechanical traumas and pathogen invasion while also allowing evaporation of the exudate and release of byproduct gases. The secondary dressing also potentially provides an additional reservoir for absorbency and retention of the wound fluids, but it strongly depends on the sorptivity of the primary dressing for effective exudate management. Hence, for effective treatments, the primary and secondary dressings must work in synergy; both dressings should share the retained fluid mass as equally as possible and not approach their maximum fluid absorption capacity until a dressing change is indicated.3,10,11 Of note, for clinical realism, sorptivity should be assessed by testing a wound dressing pair using a relatively viscous, not watery, test fluid, which was the approach of the current study.10,11 New exudate cannot enter a primary dressing if there is no space for it at the wound-contacting aspect of the dressing; however, the existence of such available space depends on adequate transport of existing exudate from the primary to the secondary dressing.10,11 The capillary action that enables this fluid movement is inversely proportional to the square root of the viscosity of the transferred fluid (see Equation 2 in Lustig et al10); that is, the more viscous the fluid, the more difficult it is for it to be transported against gravity upward to the secondary dressing in any offloaded wound.10 Of note, nonoffloaded wounds may occur in real-world clinical practice and include, for example, wounds that are subjected to body weight forces such as plantar diabetic foot ulcers or sacral pressure injuries in patients who are ventilated supine, or wounds that are compressed by a medical device such as compression stockings applied on venous leg ulcers. The current study and configuration of the robotic exuding wounds apply to off-loaded wounds only; the additional biophysical complexity that arises from the action of bodyweight or external (eg, medical device-related) forces on a wound or its vicinity was not taken into account.
Gelling fibre dressings based on PVA or CMC fibres are used as primary dressings on a variety of highly exuding wound types. These dressings are meant to form a soft, cohesive gel when in contact with exudate, which induces the necessary moisture in the wound. However, such dressings must exhibit sufficient capillary action (sorptivity) to effectively transfer any excess exudate fluids away from the wound bed and prevent their pooling at the wound-dressing interfaces or within any undermining or tunneling spaces.3,10,11 In this work, a robotic phantom system of multiple simulated wound replicates was developed and used to evaluate the synergy in fluid absorbency and retention performances (facilitated through sorptivity) of two market-leading silver-containing gelling fibre primary dressing products when used with a secondary foam dressing, as per clinical practice. The ability of these primary dressings to stay intact while being subjected to pulling forces post simulated use sessions (ie, to exhibit clinically relevant durability) was further tested. These pulling forces mimic the mechanical effect of the forces that a clinician would apply with his/her gloved fingers or forceps when removing a used dressing and replacing it with a new one.
The ExAg-PVA was substantially more effective in transferring exudate simulants to the secondary foam dressing compared with the Ag-CMC. The ExAg-PVA dressing contained less fluid at each time point, and its paired secondary dressing accepted that fluid and retained it at increasing amounts over time. The latter results are particularly innovative because they reveal, for the first time in the literature, that the sharing process initiates between 5 and 10 hours after application of the dressings and amplifies thereafter. Specifically, the ExAg-PVA primary dressing delivers greater fluid amounts for absorbency and retention by the secondary dressing, approximately 2- and 1.5-fold the amounts of fluid at the 10- and 15-hour time points, respectively, with reference to the comparator dressing pair. The more fluid that is transferred to the secondary dressing, the greater the available capacity of the primary dressing to manage new inflowing exudates. Thus, laboratory evaluations must assess the function of wound dressings in the relevant clinical context (ie, measuring the function of the primary-secondary dressing pair as opposed to testing dressing products in isolation). Importantly, these experimental results demonstrate that the extent and rate of fluid sharing depend on the dressing materials and composition, indicating that there are more and less optimal choices of primary-secondary dressing combinations.
Nevertheless, sorptivity and the associated absorbency and retention performances are only one aspect to consider when assessing the safety and effectiveness of wound dressings through bioengineering laboratory testing. The mechanical strength of a primary dressing must be sufficient to endure the forces that occur throughout the life cycle of the dressing, including under the extraction forces that a clinician applies when the dressing is removed. Despite being exposed to the aggressive chemical and thermodynamic environment of the wound, a dressing must not disintegrate or leave debris or particles in the wound. Any debris (even microparticles) that originate from the primary dressing and spread onto the wound surface may initiate a foreign-body reaction whereby the immune system attempts to form granuloma (aggregation of macrophages and fibroblasts around each particle to isolate it from the body tissues). Such events consume valuable inflammatory and tissue repair efforts, which detract from the local biologic healing resources (eg, the potential numbers of the immune and fibroblast cells that are available for the tissue repair task).3,10,15,32
The microscopy image analyses did not show a consistent, strong directional preference of the fibres in the ExAg-PVA dressing, indicating low directional strength preference compared with the Ag-CMC, which did demonstrate a strong directional preference associated with its weave structure, specifically toward the visible reinforcing seams of the dressing. The durability testing results were consistent with the aforementioned microscopy findings for the Ag-CMC. Specifically, the Ag-CMC demonstrated poor mechanical strength when the direction of the pulling forces did not fully align with that of the reinforcing seams. Moreover, the current mechanical testing indicated that the strength of the Ag-CMC dressing is dominantly provided by the visible reinforcing seams and the closely aligned fibres; this imposes a real-world requirement (not presented by the manufacturer) that a clinician removing the dressing should be aware of the orientation of the seams and attempt to pull in that specific direction so as to avoid accidental (partial or complete) tearing. Yet, when removing a primary dressing from the wound cavity, the likelihood that a nurse would (blindly) pull the dressing at a specific orientation that exactly matches the primary fibre orientation of the dressing approaches zero. Moreover, removing a dressing in line with its primary fibre orientation is made even harder if the dressing takes on the same color as the exudate while in the wound. Because dressings are typically folded in the wound cavity and most of their structure is invisible, even if a nurse would hypothetically attempt to pull the dressing in a specific direction (to conform with the dressing’s optimal mechanical energy absorption to failure properties), then still, from a cost-effectiveness perspective, a dressing requiring removals at specific orientation and extra attention to that aspect adds to the clinical workload. The above implies that in real-world, clinically relevant scenarios, the Ag-CMC would have a four to six times lower strength (ie, mechanical energy absorption to failure) than that of the ExAg-PVA dressing, and the Ag-CMC dressing is therefore much more likely to leave debris or particles in a wound. The likelihood of such dressing failure events increases further when a wound has undermining, is tunneled, or has sticky or rough surfaces, all of which may be associated with greater pullout forces required to release the used dressing to be changed.
As with any experimental study, there are limitations in the ability to mimic in vivo processes and the large variety of clinical scenarios. Accordingly, in future work, additional experiments focusing on typically nonoffloaded wounds such as venous leg ulcers, are warranted. There is also a need to test additional wound dressing types and technologies from various manufacturers and include the aspect of cost-effectiveness versus the measured performance parameters. Other sensors and post analyses can potentially be added to the apparatus (and to each wound simulant unit) or be integrated in the testing methodology, such as intrawound continuous pH monitoring or mass spectrometry of the residual fluids following dressing usage periods. Further progress can be achieved by introducing exudate substitutes that contain specific microbiomes that may represent different wound etiologies, such as infected pressure injuries or diabetic foot ulcers. All of these future improvements would require additional validation and reliability studies before informing clinical practice.
Conclusions
Using an automated robotic phantom system of multiple open cavity wounds, the authors evaluated the absorbency and retention and therefore the sorptivity performances of silver-containing gelling fibre dressings paired with a secondary foam dressing. The mechanical durability of the primary silver-containing dressings was tested after simulated use. The current experimental system and protocol were designed with emphasis on the clinical relevance of the bioengineering laboratory testing, to reproduce how wound dressings are used in practice and consider the real-world scenarios that may be associated with their failure. Consistent with the previous published work of the authors, sorptivity and durability were again identified as critical factors that should be assessed when evaluating wound dressings in laboratory testing.3,10,11 The present findings further underpin that wound dressings belonging to a certain product category, such as silver-containing gelling fibre dressings, are not all the same, and the specific absorption, retention, and, importantly, the ability to synergistically work with a secondary dressing (which good sorptivity enables) differ across products, depending on the specific materials and composition of the dressing.3,10,32,33 The present experimental data revealed that the ExAg-PVA dressing has better sorptivity and durability than the comparator Ag-CMC product. Moreover, the authors described the dynamics of the fluid sharing between primary and secondary dressings and identified the importance of not having a specific fibre directionality in a primary dressing for durability and safe post-use removals. The comparative quantification of these capabilities should help both clinical and nonclinical decision-makers to assess and select the wound dressings that best meet the needs of their patients. As with any preclinical work, the current laboratory findings need to be validated against randomised controlled trials with appropriate sample sizes of different wound etiologies. The role of the laboratory work reported here is primarily to guide such potential clinical research to focus on the novel aspects of fluid sharing between the primary and secondary wound dressings, and the ability of the primary dressings to remain intact during removals, topics that have been poorly addressed in the literature thus far.
Acknowledgment
This project has received funding from the European Union’s Horizon 2020 research and innovation program under the Marie Skłodowska-Curie Grant was also partially supported by the Israeli Ministry of Science & Technology (Medical Devices Program grant no. 3-17421, awarded to Prof Amit Gefen in 2020) and by Mölnlycke Health Care (Gothenburg, Sweden). The authors thank Ms Orel Belo, the Laboratory Engineer at the Gefen Laboratory, for supporting the experimental work. The authors have disclosed no other financial relationships related to this article. Submitted July 23, 2021; accepted in revised form November 1, 2021; published online ahead of print March 14, 2022. Copyright Advances in Skin & Wound Care and the World Council of Enterostomal Therapists.
Conflict of interest
The authors declare no conflicts of interest.
Funding
The authors received no funding for this study.
Dinâmica de manuseamento de fluidos e durabilidade dos pensos de fibra gelatinosa contendo prata testados num sistema robotizado de feridas
Aleksei Orlov, Adi Lustig, Angela Grigatti and Amit Gefen
DOI: https://doi.org/10.33235/wcet.42.2.15-23
Resumo
Objectivo Desenvolver um sistema robótico fantasma contendo múltiplas simulações de feridas para determinar a sinergia na absorção e na retenção de fluidos (sorptividade) e a durabilidade mecânica pós-simulada de pensos primários em fibra gelatinosa contendo prata, quando usados com um penso secundário, de acordo com a prática clínica.
Métodos Utilizando um sistema robótico contendo seis simuladores de feridas idênticos, os autores testaram o desempenho de sorptividade do penso primário Exufiber Ag+ (Mölnlycke Health Care, Gothenburg, Suécia) (ExAg- álcool polivinílico [PVA]), contra um produto de comparação líder de mercado, quando usado com um penso secundário de espuma. A durabilidade dos pensos primários após utilização simulada foi investigada mais aprofundadamente através de testes mecânicos de tracção.
Resultados O penso primário ExAg-PVA forneceu maiores quantidades de fluido para absorção e retenção pelo penso secundário de espuma, aproximadamente 2 e 1,5 vezes mais do que, respectivamente, o par de pensos comparadores após 10 e 15 horas. O penso ExAg-PVA era também substancialmente menos sensível à direcção das forças de tracção e, consequentemente, apresentava uma resistência mecânica pós-uso aproximadamente quatro e seis vezes superior à do outro penso primário (quando este último foi testado fora do alinhamento com as suas costuras visíveis), respectivamente, após 10 e 15 horas.
Conclusões Foi descrita a dinâmica da sorptividade e da partilha de fluidos entre os pensos primários e secundários e o efeito da preferência direccional da resistência dos pensos primários para uma durabilidade adequada, resultando em remoções seguras pós utilização. A quantificação comparativa destas capacidades deverá ajudar os decisores clínicos e não clínicos a seleccionar os pensos que melhor respondem às necessidades dos seus pacientes.
Copyright ©2022 o(s) Autor(es). Este é um artigo de livre acesso, distribuído nos termos da Creative Commons Attribution-Non Commercial-No Derivatives License 4.0 (CCBY-NC-ND), sendo permitido descarregar e partilhar a obra desde que devidamente citada. O trabalho não pode ser alterado de forma alguma ou utilizado comercialmente sem a permissão da revista.
Introdução
Feridas de todos os tipos, incluindo feridas crónicas das cavidades, tais como as lesões por pressão, são um dos problemas médicos mais comuns, impactantes e caros. Quase 2,5% da população dos EUA sofre de feridas, o que é semelhante, por exemplo, à prevalência de AVC nos EUA.1–4 À medida que a população envelhece e a prevalência de diabetes e obesidade aumentam, há um crescimento acentuado da procura de tratamentos avançados e rentáveis de feridas que proporcionem os melhores resultados aos pacientes. Os pensos de tratamento desempenham, em todos os aspectos da cicatrização de feridas, um papel fulcral. Concebidos essencialmente como um substituto artificial temporário da pele intacta, os pensos de tratamento protegem a ferida e gerem os exsudados que resultam dos processos inflamatórios perilesionais. A presença e composição de exsudados tipicamente apoiam a função das células reparadoras de tecidos e dos tecidos recentemente gerados; assim, num processo normal de reparação de tecidos, a taxa de exsudado e os seus constituintes irão corresponder à fase de cicatrização.5–7 Contudo, o prolongamento anormal da fase inflamatória, tal como em feridas crónicas, pode perturbar o controlo fisiológico da produção de exsudado, levando a quantidades excessivas de exsudado ou a rácios alterados de conteúdo proteico, o que faz com que o fluido seja espesso, altamente viscoso, ou mesmo pegajoso.5
São necessários pensos eficazes para gerir fluidos exsudados secretados a taxas e viscosidades variáveis, na mesma ferida e em momentos diferentes, ou para feridas da mesma etiologia, mas de pacientes diferentes. Uma prática clínica comum consiste em inserir um penso primário através da abertura da ferida para formar o reservatório de primeira linha para absorção e conseguir a retenção de fluido no leito da ferida. Um penso secundário é então colocado por cima da cavidade (e do penso primário) para protecção mecânica e biológica, bem como para fazer um segundo recipiente para os fluidos acumulados. Os pensos de fibras gelificantes compostos por fibras de álcool polivinílico (PVA) ou carboximetilcelulose de sódio (CMC) são amplamente utilizados como pensos primários devido à sua capacidade de prender fluidos por transformação numa fase de gel8 (exemplos destes pensos primários comerciais estão listados na base de dados de recursos do woundsource.com9, na categoria de produtos de penso de feridas "Gelling Fiber Dressings"). Uma variante destes pensos primários de fibra gelificante são aqueles que contêm iões de prata de modo a induzir ainda mais um efeito antimicrobiano. Para que os tratamentos sejam eficazes, um penso primário e um penso secundário devem funcionar em sinergia; ou seja, nenhum dos dois deve de se aproximar da sua capacidade máxima de absorção de fluidos, dentro do prazo indicado para a sua utilização.3,10–12
O desempenho de um penso depende principalmente da composição específica do seu material, estrutura e da tecnologia de fabrico do penso. Estas características, em combinação com o protocolo clínico relevante, o ambiente específico da ferida e o tipo de penso secundário emparelhado, têm impacto na segurança e na eficácia do penso primário. Duas propriedades de interacção fluido-estrutura que são relevantes para a função dos pensos primários são a "sorptividade", que consiste na capacidade da estrutura de penso para transferir o exsudado excessivo para longe do leito da ferida e para o penso secundário através da acção capilar,10,13 e a "durabilidade", a capacidade de um penso em suportar o peso corporal do paciente e outras forças mecânicas aplicadas durante as mudanças e permanecer intacto dentro da ferida durante o período de utilização ou após a sua remoção.10,13
Nos anos 70, foi noticiado que a presença de partículas de gaze dos pensos nas feridas "actuam como corpos estranhos e que podem atrasar a cicatrização. A sua remoção tem sido associada a uma cicatrização acelerada.”14 Mais recentemente, Chakravarthy e colegas15 documentaram uma desintegração nas feridas, grosseiramente visível, dos pensos modernos (hidrocolóides). A desintegração do penso foi associada a células gigantes inflamatórias - provas patológicas de uma reacção de corpo estranho - o que realça a importância da durabilidade tanto em macroescala como em microescala. Especificamente, Chakravarthy et al15 avaliaram a densidade de células gigantes em secções de tecido histológico que foram extraídas de feridas num modelo suíno de cicatrização de feridas e que subsequentemente foram coradas por hematoxilina e eosina. Documentaram a presença de material estranho (ou seja, resíduos de pensos) nas proximidades das células gigantes nas lâminas histológicas, o que se correlacionou com a fragmentação observada de alguns dos pensos hidrocolóides testados ao serem removidos durante as trocas de pensos.15
Consequentemente, pensos ou pares de pensos mal executados podem causar um equilíbrio de humidade subóptimo, danos mecânicos nos tecidos, reacções de corpo estranho, ou ainda uma combinação destes eventos adversos. Estas possibilidades de falha do penso devem ser identificadas através de testes laboratoriais metodológicos de bioengenharia, para que as reclamações médicas possam ser controladas por organismos reguladores e a falha de penso em cenários clínicos possa ser evitada. Neste contexto, os autores continuam a investir esforços de investigação no desenvolvimento e no aperfeiçoamento de métodos de ensaio pré-clínicos e laboratoriais, para uma avaliação objectiva, quantitativa e normalizada do desempenho do penso de feridas.3,10,11,13 Aqui, os autores apresentam um novo sistema robótico fantasma para os testes simultâneos de pensos, o qual contém múltiplas réplicas simuladas de feridas. O sistema foi desenvolvido e utilizado para determinar a sinergia na absorção de fluidos e os desempenhos de retenção de dois pensos primários de fibra gelatinosa contendo prata. Os métodos, equipamento e protocolos aqui relatados, constituem a base para o próximo nível de testes de desempenho clinicamente relevantes para os pensos de feridas, centrados tanto na segurança como na eficácia.
Métodos
Feridas de Exsudação Robótica
Os investigadores desenvolveram e utilizaram um sistema fantasma robótico, composto por seis réplicas de feridas. Cada unidade de ferida deste sistema simulou uma ferida exsudativa, com 2,5 cm de profundidade (Figura 1). Todas as seis unidades de feridas incluíam três camadas de simuladores de tecidos moles sintéticos (Figura 1). A camada superior, representando a pele peri-ferida, consistia em borracha de silicone transparente de 5 mm de espessura (RTV615, Momentive Performance Materials Inc, Waterford, New York). Uma camada de 8 mm de espessura de gel de parafina ("candle-gel"; Ziv Chemicals Ltd., Holon, Israel) foi colocada abaixo desta camada de "pele", de forma a representar o tecido adiposo. A camada inferior (com espessura de 12 mm), representando o músculo esquelético, foi novamente feita de borracha de silicone (idêntica à utilizada como simulador de pele). O módulo elástico do referido material de borracha de silicone, medido através de ensaios de tracção uniaxial, utilizando uma máquina de ensaio electromecânico de material (Instron modelo 5944; Instron Co, Norwood, Massachusetts) seguindo a ASTM D412-06,16 é de 1,5 MPa, que é característica tanto da pele como dos tecidos musculares sob grandes deformações.17-19 O módulo elástico do gel de parafina utilizado para representar tecido adiposo, foi medido através de testes de indentação previamente reportados20 e verificou-se ser de 5 kPa, o que é semelhante à rigidez reportada dos tecidos adiposos nativos.21 Para simular a secreção contínua de exsudado das construções de feridas acima referidas foi colocado, em cada leito de ferida simulada, um tubo de irrigação perfurado em espiral e tunelado através da estrutura fantasma para ligar a uma bomba de seringa programável multicanal (NE-1600; New Era Pump Systems Inc, Farmingdale, New York; Figura 1). A superfície húmida efectiva, formada nos leitos simulados de feridas através deste elemento de irrigação, foi de aproximadamente 24 cm2, o que corresponde a uma profundidade de irrigação efectiva de cerca de 2,5 cm. A bomba de seringa multicanal forneceu um controlo preciso sobre o volume de fluxo e a taxa de libertação do substituto de fluido exsudado, entregue nos leitos de feridas simulados. A fórmula segura e reprodutível do fluido substituto do exsudado é baseada na goma Xantana (C35H49O29); foi previamente desenvolvida pelo grupo de pesquisa dos autores para utilização com os sistemas fantasma robotizados de feridas. Esta fórmula facilita o controlo da viscosidade do fluido e do nível de pH, de modo a representar adequadamente as características físicas dos exsudados nativos.10-13,22 Foram preparadas duas soluções de exsudado, com viscosidades altas e baixas de 0,23 Pa×s e 0,06 Pa×s, respectivamente; a densidade do fluido era de 1,03 g/mL para ambas. Uma lâmpada de aquecimento infravermelha foi posicionada acima das seis réplicas de feridas para as manter a uma temperatura de 33 ± 2° C;23 as temperaturas foram monitorizadas através de um termómetro digital (Newtron TM-5005-SINGLE I/P; MRC Laboratory Equipment Ltd, Holon, Israel).

Figura 1. A configuração experimental e os seus componentes
a) Um esquema de secção transversal, através de uma única unidade simuladora de "ferida", mostrando as diferentes camadas simuladoras de tecido e as suas respectivas espessuras, a forma e profundidade da "cavidade da ferida" e a configuração da tubagem espiral de irrigação. (b) Uma fotografia do sistema fantasma robótico, incluindo as seis réplicas de feridas e a unidade de controlo. (c) Uma vista de proximidade de uma única ferida simulada. (d) Zoom sobre o "leito de ferida" simulado
Tratamentos simulados
Foram investigados dois tipos de pensos primários de fibra gelatinosa 10×10 cm : Exufiber Ag+ (Mölnlycke Health Care AB, Gothenburg, Suécia) com fibras de PVA (ExAg-PVA) e um produto equivalente, disponível comercialmente e líder no mercado de pensos de iões de prata, contendo CMC de sódio como material gelificante (Ag-CMC). O penso Ag-CMC é um penso macio, estéril, não tecido, composto por fibra hidrocolóide de sódio CMC, impregnado com prata iónica 1,2%.24-26 É indicado para utilização clínica em vários tipos de feridas, tanto agudas como crónicas e as suas propriedades físicas e antibacterianas são descritas em pormenor noutros locais.24-26 De notar, embora os dois tipos de pensos primários seleccionados para este estudo - baseados em PVA e baseados em CMC - sejam feitos de materiais distintos e produzidos através de diferentes tecnologias de fabrico, ambos são clinicamente indicados para a utilização como enchimentos de cavidades, o que constituiu a razão para a comparação actual. Mepilex Border Flex (MBF-Foam; Mölnlycke Health Care), um penso de silicone com várias camadas, foi utilizado como penso secundário para cobrir as feridas simuladas em todos os testes realizados. O MBF-Foam é um penso de cinco camadas que inclui (desde a superfície exterior do penso até ao seu aspecto virado para a ferida): película de suporte, uma camada de retenção, uma camada de espalhamento, uma camada de espuma absorvente (que transporta o exsudado para a camada de espalhamento) e uma camada de contacto com a ferida.
Antes de aplicar os pensos nas feridas simuladas, cada penso (primário ou secundário) foi pesado. Os pensos foram então aplicados de acordo com as instruções do fabricante. As feridas simuladas foram posicionadas viradas para cima, de modo que os pensos testados fossem necessários para absorver e reter o substituto do exsudado através da acção capilar (ou seja, contra a gravidade). O sistema robótico foi activado com um caudal de 2 mL/h. Para determinar o curso temporal do desempenho de absorção dos pensos testados e, o que é importante, a dinâmica da distribuição do fluido entre os pensos primários e secundários, os produtos foram testados para múltiplas simulações de duração de utilização: 5, 10, e 15 horas.
Estudos de Penso
Retenção e distribuição de fluidos entre os pensos primário e secundário. Após a utilização simulada no sistema fantasma robótico, os pensos foram repesados para calcular o ganho de massa líquida em cada penso devido à absorção de fluidos; quaisquer fluidos residuais não retidos foram cuidadosamente recolhidos das cavidades da ferida e também pesados. Após converter as massas de fluido medidas em volume (dividindo as massas de fluido absorvidas e residuais pela densidade do fluido), o volume total de exsudado foi calculado separadamente para cada ensaio como a soma dos volumes de fluido nos pensos primário e secundário, mais o volume do fluido residual. Em seguida, a distribuição dos volumes de fluido entre os pensos primário e secundário foi calculada, para cada ensaio, como a percentagem de fluido retido no penso primário versus o penso secundário, em relação ao volume total de exsudado correspondente (cujo valor teórico também é calculável, como o produto do caudal pré-determinado e o tempo de funcionamento do sistema de ferida robotizado).10
Direccionalidade da fibra. Para os pensos de fibras gelificantes, a direccionalidade das fibras, que normalmente está relacionada com a tecnologia de fabrico destes pensos primários (ou seja, PVA vs CMC), afecta provavelmente os desempenhos do penso, tais como a sorptividade (as fibras tornam-se os condutores estruturais para a acção capilar) e a durabilidade (as fibras fornecem apoio estrutural e tolerância mecânica contra forças que estão alinhadas de acordo à sua direcção primária). Por este motivo, os investigadores avaliaram a direccionalidade das fibras nos dois tipos de pensos primários através do processamento digital de imagens microscópicas das superfícies dos pensos, as quais foram captadas utilizando um microscópio estéreo óptico leve (Axiolab A450909; Carl Zeiss AG, Oberkochen, Alemanha). Os micrógrafos das superfícies de penso foram captados em modo de luz transmitida usando uma objectiva de ampliação de 1,25× , uma câmara digital montada em C (Swift Cam SC1803; Swift Optical Instruments Inc, Schertz Texas) e o software Swift Imaging (versão 3.0, Swift Optical Instruments Inc.). Cinco campos de visão (FOVs) foram capturados em locais consistentes da superfície, a partir de dois espécimes de pensos primários de cada tipo: Um FOV estava localizado no centro do penso e os outros quatro FOVs formavam uma cruz em torno do centro de penso, com cada um desses FOVs periféricos localizados a uma distância de 2,5 cm dos bordos do penso. Isto resultou, por tipo de penso, num total de 15 micrográficos digitais dos FOVs, cada um com dimensões de 4.912 × 3.684 pixels (1 pixel quadrado = 0,919 µm2). Para efeitos de análise da direccionalidade das fibras, os FOVs captados foram ainda divididos em três sub-FOVs rectangulares, cada um com dimensões de 1445×3288 pixels. As análises de direccionalidade das fibras foram realizadas utilizando o plugin de pós-aquisição "OrientationJ" do conjunto de software ImageJ (versão 1.X),27,28 que segmenta as fibras nos micrógrafos digitais e calcula a função de probabilidade para a sua orientação planar em cada sub-FOV analisado. Após calibrar este código e verificar visualmente as suas performances, foram extraídos dos pensos primários estudados os histogramas normalizados das orientações das fibras.
UseResistência dos pensos primários após o uso simulado. Imediatamente após as sessões de uso simulado, a resistência à tracção de cada amostra de penso primário foi testada utilizando uma máquina de ensaio electromecânico (Instron modelo 5944; Instron Co) equipada com uma célula de carga de 2kN, seguindo um protocolo baseado na ASTM D882-02.29 As amostras de pensos primários, preparadas de acordo com a norma de ensaio acima referida, foram esticadas a uma taxa de deformação de 50 mm/min até ocorrer a falha final. Com base nos dados resultantes da deformação por força, foram traçadas curvas tensão-deformação dos pensos após o uso simulado e a área sob a curva tensão-deformação, que é a densidade de energia de deformação (SED) até à falha, foi calculada para cada teste usando o software informático dedicado MATLAB (ver. R2019a; MathWorks, Inc, Natick, Massachusetts). Com base nestas análises microscópicas das orientações das fibras, o penso ExAg-PVA foi tratado como sendo uma estrutura sem uma preferência direccional específica (ou seja, as amostras de ensaio deste tipo de penso foram preparadas e testadas mecanicamente em direcções aleatórias). No entanto, o penso primário contendo prata Ag-CMC, que tem uma preferência direccional específica das suas fibras (conforme é mais detalhado nos Resultados), foi testado em duas configurações diferentes: onde a sua direcção principal das fibras estava totalmente alinhada com o eixo de carga da máquina de ensaio do material e onde as fibras estavam fora de tal alinhamento.
Análises estatísticas
Todas as experiências relatadas acima foram realizadas em conjuntos de seis réplicas e estatísticas descritivas de meios e SDs foram calculadas para os volumes de fluido retidos, a distribuição do conteúdo de fluido entre os pensos primários e secundários por cada duração de utilização simulada (5, 10, e 15 horas) e a SED até à falha dos pensos primários (dependendo da direccionalidade das fibras em relação ao eixo de carregamento, como já foi referido anteriormente). Em seguida, foram realizadas análises de variância (ANOVA), seguidas de comparações post-hoc Tukey-Kramer de múltiplos pares, de modo a identificar potenciais diferenças entre os desempenhos do penso nos testes de gestão de fluidos (sorptividade) e a resistência do material anteriormente descritos. Especificamente, os ANOVAs de duas vias para os factores do tempo de utilização e para o tipo de penso primário foram conduzidos para os dados de retenção e de distribuição de fluidos. Além disso, foi realizada uma ANOVA de três vias para os factores do tempo de utilização, o tipo de penso primário e a direccionalidade do ensaio de tracção, no que diz respeito à orientação das fibras (no penso primário que exibia preferência direccional de orientação das fibras) para os dados de resistência do material. Apenas os tempos de exposição mais longos, de 10 e 15 horas, para os quais se tinha acumulado uma massa fluida substancial nos pensos primários testados, foram considerados para os últimos ANOVA de três vias. No que respeita ao factor de direccionalidade, com base nas análises microscópicas, a última ANOVA considerou para o penso ExAg-PVA, que não mostrava qualquer preferência direccional específica e consistente das suas fibras, como tendo uma única propriedade de resistência (SED-to-failure). Contudo, o Ag-CMC tinha duas propriedades de resistência, nomeadamente, a resistência medida (1) quando as fibras estavam completamente alinhadas com o eixo de carga da máquina de ensaio de material e (2) quando estavam fora de tal alinhamento. P <.05 foi considerado estatisticamente significativo.
Resultados
Quando examinado isoladamente, a absorção do penso primário ExAg-PVA era inferior (aproximadamente 11-22%) à do penso primário de prata Ag-CMC (Figura 2a). No entanto, esta diferença deveu-se a uma transferência mais eficaz do fluido tipo exsudado do penso ExAg-PVA para o penso secundário, o que resultou evidente ao examinar os dados para a distribuição do fluido entre os pensos primário e secundário (Figura 2b). Especificamente, ao funcionar num par com o penso ExAg-PVA, o penso secundário continha aproximadamente o dobro da quantidade de líquido no ponto de tempo de 10 horas e 1,5 vezes a quantidade de líquido após 15 horas, em relação ao par de comparação (Figura 2b). A dinâmica da distribuição do fluido entre os pensos primário e secundário ao longo do tempo (Figura 2b), revelou ainda que o reservatório do penso secundário começou a receber fluido não antes de passadas 5 horas a partir da aplicação do penso (Figura 2b). Após 15 horas, o penso secundário partilhou aproximadamente 54,2% do fluido retido quando o penso primário era ExAg-PVA, mas apenas 36,7% quando o penso primário Ag-CMC foi utilizado(P < .05; Figura 2b). É importante notar que estes resultados representam as performances dos pares de pensos e, portanto, reflectem melhor a prática clínica do mundo real, em oposição às avaliações da função dos pensos isolados (Figura 2b).

Figura 2. Desempenhos de absorção e retenção de fluido dos pensos testados (a) O fluido retido nos pensos primários, reflectindo a sorptividade destes pensos (reportado como percentagem do volume total de fluido retido nos pensos primários e secundários, mais o fluido residual no leito simulado da ferida). (b) A distribuição do fluido entre os pensos primários e secundários após 5, 10, e 15 horas de utilização simulada em feridas descarregadas (como em decúbito ventral). As barras de erro são os SDs dos valores médios de seis repetições de teste por configuração de teste, sendo que um asterisco indica uma diferença estatisticamente significativa na medida do resultado relevante (P < .01).
A análise da imagem microscópica digital dos pensos primários indicou que o penso ExAg-PVA não tinha uma preferência de fibra direccional distinguível. Especificamente, para verificar a relativa falta de preferência direccional do penso ExAg-PVA em relação ao penso primário contendo prata Ag-CMC, os investigadores calcularam o limite integral entre a curva do histograma de orientação das fibras e o nível 0,5 (ponto médio) para os dois pensos primários. Este integral é aqui definida como o índice de orientação das fibras (FOI). Quando um penso não apresenta uma preferência direccional das suas fibras, as áreas positivas e negativas entre a curva do histograma acima referida e o nível 0,5 anulam-se aproximadamente umas às outras, o que resulta num valor FOI relativamente baixo. As análises dos dados FOI indicaram que o penso ExAg-PVA tinha um FOI estatisticamente significativo, aproximadamente 3,9 vezes inferior (15,6 ± 11,8) em relação ao do penso primário contendo prata Ag-CMC (60,8 ± 48,8; P < .05, para cinco FOVs microscópicos diferentes em cada tipo de penso). Esta relação de propriedade FOI demonstra quantitativamente a forte preferência do alinhamento das fibras no penso primário Ag-CMC no sentido da direcção das costuras de reforço visíveis nesse penso (a direcção de 90° marcada na Figura 3a). De notar que o histograma de orientação de fibras deste último (Ag-CMC) esteve sempre acima do nível do ponto médio, o que mais uma vez indica uma forte preferência direccional (Figura 3a). A inspecção visual dos dados da microscopia confirmou que a maioria das fibras do penso primário Ag-CMC foram alinhadas e agrupadas para se ligarem às costuras verticais (orientadas a 90°) visíveis. Os micrógrafos demonstraram ainda numerosos vazios de forma elíptica, com dimensões máximas características de comprimento de aproximadamente 400 a 600 µm no penso primário Ag-CMC (Figura 3a). Estas descobertas, de uma orientação preferencial das fibras e presença abundante de vazios não circulares, justificaram a selecção do penso primário contendo prata Ag-CMC como tendo uma preferência direccional específica (isto é, ao longo das suas costuras visíveis) para a realização de testes mecânicos adicionais, como se segue.
Para os testes mecânicos dos pensos primários, após o seu uso simulado, foram seleccionados os pontos de tempo posteriores de 10 e 15 horas de exposição aos fluidos, porque os resultados anteriores indicavam que, às 10 horas e depois, ambos os tipos de pensos primários tinham transferido fluido para os seus pensos secundários emparelhados (Figura 2b). Assim, nos pontos de tempo de 10 e 15 horas, ambos os tipos de pensos primários utilizaram os seus reservatórios de fluidos de uma forma que indicava que foram de facto testados no seu estado de "molhado". Além disso, com base nos resultados das análises microscópicas, o penso ExAg-PVA foi testado como uma estrutura sem uma preferência direccional específica (isto é, independentemente da direcção pela qual os provetes foram cortados deste tipo de penso), enquanto que o penso Ag-CMC foi testado em duas configurações diferentes: totalmente alinhado com a orientação da fibra primária (direcção 90°), que é a direcção das costuras visíveis e fora desse alinhamento (isto é, seleccionado aleatoriamente, mas sendo diferente da direcção 90°).
Os dados de SED para os dois tipos de pensos primários são apresentados na Figura 3b e demonstram diferenças consideráveis nos comportamentos mecânicos entre os tipos de pensos pós-uso, particularmente no que diz respeito à ductilidade do penso ExAg-PVA versus o produto Ag-CMC. Ductilidade define-se como o grau em que um material ou estrutura pode sustentar deformações plásticas/irreversíveis e continuar a absorver energia de tensão sob carga tênsil antes de ocorrer uma falha catastrófica. Curiosamente, o penso ExAg-PVA parecia ganhar ductilidade à medida que absorvia mais fluido e gelado e, em conformidade, às 15 horas, tinha 1,7 vezes mais SED para falhar do que às 10 horas. De forma oposta, a transformação gelificante não se traduziu numa maior ductilidade para o penso primário Ag-CMC; os seus dados de SED para falhar eram indistinguíveis para os pontos de tempo de 10 e 15 horas (Figura 3b). Além disso, os testes de resistência acima mencionados indicaram claramente que a principal estrutura de suporte de carga no penso primário Ag-CMC eram, de facto, as costuras de reforço (visíveis) e as fibras 90° (aproximadamente) orientadas. Quando testado fora de alinhamento, a resistência do penso primário Ag-CMC caiu significativamente, mais de 8 vezes (P < .05). Com respeito à resistência mecânica do penso ExAg-PVA, o penso primário Ag-CMC tinha uma resistência fora de alinhamento que era, aproximadamente, quatro e seis vezes inferior para os pontos de tempo de 10 e 15 horas, respectivamente(P < .05).

Figura 3. Análises de estrutura-função dos pensos primários testados (a) Um exemplo de uma imagem microscópica do penso Exufiber Ag+ (ExAg-PVA). (b) Análise por microscopia representativa da orientação das fibras no penso de carboximetilcelulose de Ag-sódio (CMC), mostrando a distribuição planar normalizada das orientações das fibras neste tipo de penso primário. (c) A densidade de energia de deformação até à falha dos dois tipos de penso primário testados após utilização simulada de 10 e 15 horas, em que o produto Ag-CMC foi testado em duas configurações, quer com alinhamento total da direcção principal das fibras do penso com o eixo de carga da máquina de ensaio, quer fora desse alinhamento. As barras de erro são os SDs dos valores médios de seis repetições de teste por configuração de teste, sendo que um asterisco indica uma diferença estatisticamente significativa na medida do resultado relevante (P < .01).
Discussão
Os exsudados das feridas são críticos para a reparação de tecidos - facilitam a mobilidade celular e o transporte de moléculas de sinalização e os factores de crescimento através do leito da ferida. No entanto, a produção excessiva de exsudado pode levar à maceração, tornar-se um meio para infecções, ou ainda prolongar o período de inflamação.30,31 Assim, o excesso de exsudado deve ser absorvido e retido em pensos terapêuticos, para apoiar o processo natural de cicatrização de feridas. A prática clínica no tratamento de feridas cavitárias, bem como de outras feridas altamente exsudativas (tais como úlceras de perna venosa e queimaduras) é o de utilizar um penso não aderente como penso primário para induzir um ambiente húmido de cicatrização da ferida, maximizando ao mesmo tempo o contacto do penso com o leito da ferida para uma absorção mais efectiva. Um penso secundário é então aplicado para fechar a ferida e protegê-la de potenciais traumas mecânicos e de invasão patogénica, permitindo ao mesmo tempo a evaporação do exsudado e a libertação dos gases derivados. O penso secundário também fornece potencialmente um reservatório adicional para absorção e retenção dos fluidos da ferida, mas depende fortemente da sorptividade do penso primário para permitir uma gestão eficaz do exsudado. Assim, para tratamentos eficazes, os pensos primários e secundários devem funcionar em sinergia; ambos os pensos devem partilhar a massa fluída retida da forma o mais equitativa possível e não se devem aproximar da sua capacidade máxima de absorção de fluidos até que uma mudança de penso seja indicada.3,10,11 De notar, como realidade clínica, a sorptividade deve ser avaliada testando um par de pensos de ferida usando um fluido de teste relativamente viscoso e não aquoso, a qual foi a abordagem do estudo actual.10,11 O novo exsudado não pode entrar num penso primário se não houver espaço para ele na superfície de contacto da ferida do penso; contudo, a existência de tal espaço disponível depende do transporte adequado do exsudado existente do penso primário para o penso secundário.10,11 A acção capilar que permite este movimento do fluido é inversamente proporcional à raiz quadrada da viscosidade do fluido transferido (ver Equação 2 em Lustig et al10); ou seja, quanto mais viscoso for o fluido, mais difícil será para ele ser transportado para cima e contra a gravidade até ao penso secundário em qualquer ferida descarregada.10 De notar que as feridas não descarregadas podem ocorrer na prática clínica real e incluem, por exemplo, feridas que são sujeitas a forças de peso corporal, tais como úlceras plantares do pé diabético ou lesões de pressão sacral em pacientes que são supino ventilado, ou feridas que se encontram comprimidas por um dispositivo médico, tais como meias de compressão aplicadas em úlceras de perna venosa. O estudo e a configuração actual das feridas robóticas de exsudação aplicam-se apenas às feridas descarregadas; a complexidade biofísica adicional que resulta da acção do peso corporal ou das forças externas (por exemplo, relacionadas com os dispositivos médicos) numa ferida ou nas suas proximidades não foi tida em conta.
Pensos de fibras gelificantes, baseados em fibras PVA ou CMC, são utilizados como pensos primários numa variedade de tipos de feridas altamente exsudativas. Estes pensos destinam-se a formar um gel macio e coesivo quando estão em contacto com o exsudado, o que induz a humidade necessária na ferida. Contudo, tais pensos devem exibir acção capilar suficiente (sorptividade) para transferir eficazmente qualquer excesso de fluidos exsudados para longe do leito da ferida e impedir a sua acumulação nas interfaces de tratamento de feridas ou dentro de quaisquer espaços de cavidade ou túnel.3,10,11 Neste trabalho, foi desenvolvido um sistema robótico fantasma de múltiplas simulações de réplicas de feridas, o qual foi utilizado para avaliar a sinergia na absorção e retenção de fluidos (facilitada pela sorptividade) de dois pensos primários de fibra gelificante de prata líderes de mercado, quando utilizados com um penso secundário de espuma, de acordo com a prática clínica. A capacidade destes pensos primários de se manterem intactos, enquanto são submetidos a forças de tracção após sessões de uso simulado (ou seja, de exibirem durabilidade clinicamente relevante), foi também testada. Estas forças de tracção imitam o efeito mecânico das forças que um clínico aplicaria com os seus dedos ou com um fórceps com luvas ao remover um penso usado para substituí-lo por um novo.
O ExAg-PVA foi substancialmente mais eficaz na transferência de simuladores de exsudado para o penso secundário de espuma, em comparação com o Ag-CMC. O penso ExAg-PVA continha menos fluido em cada ponto de tempo e o seu penso secundário emparelhado aceitou esse fluido e reteve-o em quantidades crescentes ao longo do tempo. Estes últimos resultados são particularmente inovadores porque revelam, pela primeira vez na literatura, que o processo de partilha se inicia entre 5 e 10 horas após a aplicação dos pensos e que se amplia depois disso. Especificamente, o penso primário ExAg-PVA fornece maiores quantidades de fluido para absorção e retenção pelo penso secundário, aproximadamente 2 e 1,5 vezes as quantidades de fluido nos pontos de tempo de 10 e 15 horas, respectivamente, com referência ao par de pensos comparados. Quanto maior quantidade de fluido for transferida para o penso secundário, maior será a capacidade disponível do penso primário para gerir novos exsudados de entrada. Assim, os estudos laboratoriais devem avaliar a função dos pensos de feridas no contexto clínico relevante (ou seja, medir a função do par de pensos do primeiro ciclo em vez de testar os pensos isoladamente). É importante notar que estes resultados experimentais demonstram que a extensão e a taxa de partilha de fluidos dependem dos materiais do penso e da sua composição, indicando que existem escolhas mais optimizadas e escolhas menos optimizadas de combinações de penso primário e secundário.
No entanto, a sorptividade e os desempenhos de absorção e retenção associados são apenas um dos aspectos a considerar ao avaliar a segurança e eficácia dos pensos de feridas através de testes laboratoriais de bioengenharia. A resistência mecânica de um penso primário deve ser suficiente para suportar as forças que ocorrem ao longo do seu ciclo de vida, incluindo as forças de extracção que um médico aplica quando o penso é removido. Apesar de estar exposto a um ambiente químico agressivo e termodinâmico da ferida, um penso não deve desintegrar-se ou deixar resíduos ou partículas na ferida. Quaisquer detritos (mesmo micropartículas) originários do penso primário e espalhados na superfície da ferida podem iniciar uma reacção de corpo estranho, em que o sistema imunitário tenta formar granuloma (agregação de macrófagos e fibroblastos à volta de cada partícula para isolá-la dos tecidos do corpo). Tais eventos consomem valiosos esforços inflamatórios e de reparação de tecidos, que prejudicam os recursos biológicos locais de cicatrização (por exemplo, os números potenciais de células imunitárias e fibroblastos que estão disponíveis para a tarefa de reparação de tecidos).3,10,15,32
A análise da imagem microscópica não mostrou uma preferência consistente e forte das fibras do penso ExAg-PVA, indicando uma preferência de baixa resistência direccional em comparação com o Ag-CMC, o qual demonstrou uma forte preferência direccional associada à sua estrutura de tecelagem, especificamente em relação às costuras visíveis de reforço do penso. Os resultados dos testes de durabilidade para o Ag-CMC foram consistentes com os resultados dos microscópios acima mencionados. Especificamente, o Ag-CMC demonstrou uma fraca resistência mecânica quando a direcção das forças de tracção não se alinhou totalmente com a direcção das costuras de reforço. Além disso, os testes mecânicos actuais indicaram que a resistência do penso Ag-CMC é predominantemente fornecida pelas costuras de reforço visíveis e pelas fibras estreitamente alinhadas; isto impõe um requisito do mundo real (não apresentado pelo fabricante) de que um médico que retire o penso deve estar ciente da orientação das costuras e tentar puxar nessa direcção específica, de modo a evitar rasgões acidentais (parciais ou totais). No entanto, ao remover um penso primário da cavidade da ferida, a probabilidade de um enfermeiro puxar (cegamente) o penso numa orientação específica que corresponda exactamente à orientação da fibra primária do penso aproxima-se de zero. Além disso, a remoção de um penso de acordo com a sua orientação de fibra primária torna-se ainda mais difícil se o penso, enquanto está na ferida, assumir a mesma cor que o exsudado. Como os pensos são tipicamente dobrados na cavidade da ferida e a maior parte da sua estrutura é invisível, mesmo que um enfermeiro tentasse hipoteticamente puxar o penso numa direcção específica (para estar de acordo com as propriedades óptimas de absorção de energia mecânica do penso em caso de falha), então, numa perspectiva de custo-eficácia, um penso que exija remoções com orientação específica e atenção adicional a esse aspecto aumenta a carga de trabalho clínico. O acima exposto implica que no mundo real e em cenários clinicamente relevantes, o Ag-CMC teria uma resistência quatro a seis vezes inferior (ou seja, absorção de energia mecânica até à falha) à do penso ExAg-PVA pelo que o penso Ag-CMC é, portanto, muito mais susceptível de deixar resíduos ou partículas numa ferida. A probabilidade de tais eventos de falha de pensos aumenta ainda mais quando uma ferida apresenta um enfraquecimento, é tunelada, ou tem superfícies pegajosas ou rugosas, tudo isto pode estar associado a maiores forças de tracção necessárias para, na mudança, libertar o penso utilizado.
Como em qualquer estudo experimental, existem limitações na capacidade de imitar processos in vivo e a grande variedade de cenários clínicos. Consequentemente, num trabalho futuro, justificam-se experiências adicionais centradas em feridas tipicamente não descarregadas, tais como úlceras de perna venosa. Existe também a necessidade de testar tipos e tecnologias adicionais de pensos de feridas de vários fabricantes e incluir o aspecto da relação custo-eficácia face aos parâmetros de desempenho medidos. Outros sensores e análises posteriores podem potencialmente ser adicionados ao aparelho (e a cada unidade simuladora de ferida) ou ser integrados na metodologia de ensaio, tais como a monitorização contínua do pH intra-ferida ou a espectrometria de massa dos fluidos residuais após os períodos de utilização do penso. É possível obter mais progressos através da introdução de substitutos do exsudado que contenham microbiomas específicos que podem representar diferentes etiologias de feridas, tais como lesões por pressão infectadas ou úlceras do pé diabético. Todas estas melhorias futuras exigiriam estudos de validação e fiabilidade adicionais antes de poderem informar a prática clínica.
Conclusões
Utilizando um sistema robotizado fantasma automatizado de múltiplas cavidades abertas, os autores avaliaram a absorção e a retenção e, desse modo, os desempenhos de sorptividade dos pensos de fibra gelatinosa contendo prata, emparelhados com um penso secundário de espuma. A durabilidade mecânica dos pensos primários contendo prata foi testada após uma utilização simulada. O actual sistema experimental e protocolo foram concebidos com ênfase na relevância clínica dos testes laboratoriais de bioengenharia, para conseguir reproduzir a forma como os pensos de feridas são utilizados na prática e considerar os cenários do mundo real que podem estar associados ao seu fracasso. De acordo com o trabalho dos autores anteriormente publicado, a sorptividade e a durabilidade foram novamente identificadas como factores críticos que devem ser estudados ao avaliar em testes laboratoriais os pensos de.3,10,11 As presentes conclusões sustentam ainda mais que os pensos para feridas pertencentes a uma determinada categoria de produtos, tais como pensos de fibra gelificante com prata, não são todos iguais e a absorção específica, retenção e, o que é importante, a capacidade de trabalhar em sinergia com um penso secundário (o que permite uma boa sorptividade) diferem entre produtos, dependendo dos materiais específicos e da composição do penso.3,10,32,33 Os dados experimentais actuais revelaram que o penso ExAg-PVA tem melhor sorptividade e durabilidade do que o produto de comparação Ag-CMC. Além disso, os autores descreveram a dinâmica da partilha de fluidos entre os pensos primários e secundários e identificaram a importância de não ter uma direccionalidade específica de fibra num penso primário por questões de durabilidade e remoção segura pós utilização. A quantificação comparativa destas capacidades deve ajudar tanto os decisores clínicos como não clínicos a avaliar e a seleccionar os pensos para feridas que melhor satisfaçam as necessidades dos seus pacientes. Como em qualquer trabalho pré-clínico, os resultados laboratoriais actuais precisam de ser validados frente a ensaios controlados aleatórios com tamanhos de amostra de diferentes etiologias de feridas apropriados. O papel do trabalho laboratorial aqui relatado é principalmente o de orientar essa potencial investigação clínica para se concentrar nos aspectos inovadores da partilha de fluidos entre os pensos primários e secundários, assim como na capacidade dos pensos primários de permanecerem intactos durante as remoções, tópicos que até agora têm sido deficientemente abordados na literatura.
Agradecimentos
Este projecto recebeu financiamento do programa de investigação e inovação Horizon 2020 da União Europeia ao abrigo da subvenção Marie Skłodowska-Curie Grant e foi também parcialmente apoiado pelo Ministério da Ciência e Tecnologia de Israel (subvenção nº 3-17421 do Programa de Dispositivos Médicos, concedida ao Prof. Amit Gefen em 2020) e pela Mölnlycke Health Care (Gothenburg, Suécia). Os autores agradecem à Sra. Orel Belo, Engenheira de Laboratório do Laboratório Gefen, pelo apoio dado ao trabalho experimental. Os autores não revelaram outras relações financeiras relacionadas com este artigo. Submetido a 23 de Julho de 2021; aceite na forma revista a 1 de Novembro de 2021; publicado on-line antes da impressão a 14 de Março de 2022. Copyright Avanços em Tratamentos de Pele e de Feridas e o Conselho Mundial de Terapeutas Enterostomais.
Conflito de interesses
Os autores declaram não existirem conflitos de interesse.
Financiamento
Os autores não receberam qualquer financiamento para este estudo.
Author(s)
Aleksei Orlov MSc
Graduate Student, Department of Biomedical Engineering, Tel Aviv University, Israel
Adi Lustig MSc
Graduate Student, Department of Biomedical Engineering, Tel Aviv University, Israel
Angela Grigatti MSc
Graduate Student, Department of Biomedical Engineering, Tel Aviv University, Israel
Amit Gefen* PhD
Professor of Biomedical Engineering and the Herbert J Berman Chair in Vascular Bioengineering,
Department of Biomedical Engineering, Tel Aviv University, Israel
At Tel Aviv University, Department of Biomedical Engineering, Tel Aviv, Israel, Aleksei Orlov, MSc; Adi Lustig, MSc; and Angela Grigatti, MSc, are Graduate Students at the research group of Professor Gefen; and Amit Gefen, PhD, is Professor of Biomedical Engineering and the Herbert J. Berman Chair in Vascular Bioengineering.
* Corresponding author
References
- Sen CK. Human wounds and its burden: an updated compendium of estimates. Adv Wound Care 2019;8:39-48.
- Guest JF, Fuller GW, Vowden P. Cohort study evaluating the burden of wounds to the UK’s National Health Service in 2017/2018: update from 2012/2013. BMJ Open 2020;10:e045253.
- Gefen A, Ousey K. Safe and effective wound care during the COVID-19 pandemic. J Wound Care 2020;29:622-3.
- Sen CK. Human wound and its burden: updated 2020 compendium of estimates. Adv Wound Care (New Rochelle) 2021;10:281-92.
- How To Guide: Managing High Exudate Wounds - A Wounds UK Publication. https://www.wounds-uk.com/resources/details/how-to-guide-managing-high-exudate-wounds. Last accessed February 18, 2022.
- Cutting KF. Wound exudate: composition and functions. Br J Community Nurs 2003;8(Supp3):S4-9.
- Schultz GS, Sibbald RG, Falanga V, et al. Wound bed preparation: a systematic approach to wound management. Wound Repair Regen 2003;11(Supp1):S1-28.
- Junker JPE, Kamel RA, Caterson EJ, Eriksson E. Clinical impact upon wound healing and inflammation in moist, wet, and dry environments. Adv Wound Care 2013;2:348-56.
- Woundsource Resource Database. https://www.woundsource.com/product-category/dressings/gelling-fiber-dressings. Last accessed March 11, 2022.
- Lustig A, Alves P, Call E, Santamaria N, Gefen A. The sorptivity and durability of gelling fibre dressings tested in a simulated sacral pressure ulcer system. Int Wound J 2021;18:194-208.
- Gefen A, Santamaria N. Saturation of a dressing applied to an exuding wound: The gap between clinical judgment and laboratory testing. Wounds Int J 2021;12:20-6.
- Lustig A, Gefen A. Fluid management and strength post-simulated use of primary and secondary dressings for treating diabetic foot ulcers: robotic phantom studies. Int Wound J 2022;19:305-15.
- Lustig A, Gefen A. Three-dimensional shape-conformation performances of wound dressings tested in a robotic sacral pressure ulcer phantom. Int Wound J 2021;18:670-80.
- Wood RA. Disintegration of cellulose dressings in open granulating wounds. Br Med J 1976;1:1444-5.
- Chakravarthy D, Rodway N, Schmidt S, Smith D, Evancho M, Sims R. Evaluation of three new hydrocolloid dressings: retention of dressing integrity and biodegradability of absorbent components attenuate inflammation. J Biomed Mater Res 1994;28:1165-73.
- ASTM D412 - 06, Standard Test Methods for Vulcanized Rubber and Thermoplastic Elastomers - Tension, ASTM International, West Conshohocken, PA, 2006, www.astm.org.
- Xu F, Lu TJ. Chapter 3 Skin Biothermomechanics: modeling and experimental characterization. Adv Appl Mech 2009;43:147-248.
- Kuthe CD, Uddanwadiker RV. Investigation of effect of fiber orientation on mechanical behavior of skeletal muscle. J Appl Biomater Funct Mater 2016;14:e154-62.
- Graham HK, McConnell JC, Limbert G, Sherratt MJ. How stiff is skin? Exp Dermatol 2019;28:4-9.
- Friedman R, Haimy A, Epstein Y, Gefen A. Evaluation of helmet and goggle designs by modeling non-penetrating projectile impacts. Comput Methods Biomech Biomed Engin 2019;22:229-42.
- Gefen A, Haberman E. Viscoelastic properties of ovine adipose tissue covering the gluteus muscles. J Biomech Eng 2007;129:924-30.
- Gefen A. Not all superabsorbent wound dressings are born equal: theory and experiments. J Wound Care 2021;30:738-50.
- Dini V, Salvo P, Janowska A, Di Francesco F, Barbini A, Romanelli M. Correlation between wound temperature obtained with an infrared camera and clinical wound bed score in venous leg ulcers. Wounds 2015;27:274-8.
- Barnea Y, Weiss J, Gur E. A review of the applications of the hydrofiber dressing with silver (Aquacel Ag) in wound care. Ther Clin Risk Manag 2010;6:21-7.
- Walker M, Parsons D. Hydrofiber® Technology: its role in exudate management. Wounds UK 2010;6:31-38.
- Hurlow J. AQUACEL® Ag dressing with Hydrofiber® technology. Adv Wound Care (New Rochelle) 2012;1:104-7.
- Rezakhaniha R, Agianniotis A, Schrauwen JT, et al. Experimental investigation of collagen waviness and orientation in the arterial adventitia using confocal laser scanning microscopy. Biomech Model Mechanobiol 2012;11:461-73.
- Schneider CA, Rasband WS, Eliceiri KW. NIH image to ImageJ: 25 years of image analysis. Nat Methods 2012;9:671-5.
- ASTM D882-02, Standard Test Method for Tensile Properties of Thin Plastic Sheeting, ASTM International, West Conshohocken, PA, 2002, www.astm.org.
- Expert working group; Satellite expert working group. Wound exudate and the role of dressings. A consensus document. Int Wound J 2008;5(Suppl 1):iii-12.
- Harding K, Carville K, Chadwick P, et al. World Union of Wound Healing Societies. World Union of Wound Healing Societies (WUWHS) Consensus Document. Wound exudate: effective assessment and management. Wounds Int 2019. https://www.woundsinternational.com/download/resource/7732.
- Grande A, Sivakumaran D. Assessment of the wet strength and log reduction capacity of a silver alginate dressing. 2016 Symp Adv Wound Care (SAWC) April 13-17. 2016:5.
- Gefen A, Santamaria N, Creehan S, Black J. Patient safety may be compromised if study conclusions are generalized to products that make similar claims but have no equivalent research evidence. J Patient Saf Risk Manag 2019;24:37-45.



