Volume 43 Number 2
WHAM evidence summary: sugar dressing for wound healing and treating wound infection in resource limited settings
Emily Haesler
Keywords Traditional wound management, sugar dressing, sugar paste
For referencing Haesler E. WHAM evidence summary: sugar dressing for wound healing and treating wound infection in resource limited settings. WCET® Journal 2023;43(2):35-40
DOI https://doi.org/10.33235/wcet.43.2.35-40
Clinical question
What is the best available evidence for sugar dressing improving wound healing and for reducing signs and symptoms of wound infection?
Summary
Granular/crystalized white sugar is readily accessible at low cost in most geographic regions. It has been used as a wound treatment for hundreds of years because it is sterile, non-toxic, absorbs fluid and has some antimicrobial properties1. Sugar is most often used in its granular form, packed into a wound cavity and secured with a wound dressing. Alternatively, it is ground into a powder, combined with glycerine or petroleum jelly and applied as a paste1, 2. There was no evidence comparing the effectiveness of sugar to modern dressings that promote moist wound healing. Level 1 evidence3, 4 at high risk of bias showed sugar dressing was associated with acceptable wound healing rates3, 4 and reduction in wound infection4, but might not be as effective as Edinburgh University Solution of Lime (EUSOL)3 or honey4, which are both commonly used in settings with limited resources. Level 35-7 and 48-15 evidence at moderate or high risk of bias provided evidence that sugar dressing might promote healing5, 6, 8, 9, 11-15, improve the wound bed tissue5, 9, 13-15, and reduce bacterial infection6, 12-15, wound pain5, and wound malodour7, 10.
Clinical practice recommendations
All recommendations should be applied with consideration to the wound, the person, the health professional and the clinical context.
|
Sugar dressing could be considered for use as a natural wound dressing to reduce signs and symptoms of infection and to promote healing when there is limited access to modern wound dressings (Grade B). |
Sources of evidence: search and appraisal
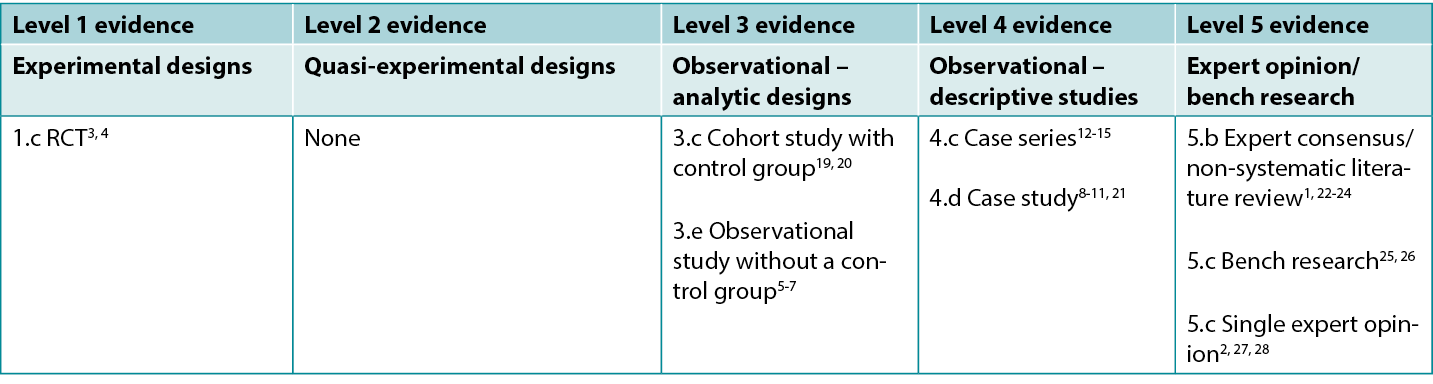
This summary was conducted using methods published by the Joanna Briggs Institute16-18. The summary is based on a systematic literature search combining search terms related to sugar dressing and wound healing. Searches were conducted for evidence reporting use of granulated sugar in human wounds published up to December 2022 in English in the following databases: Cumulative Index to Nursing and Allied Health Literature (CINAHL), Medline (Ovid), Google Scholar, Embase (Ovid), AMED and Health Internetwork Access to Research Initiative (Hinari, access via Research4Life) and Cochrane Library. Studies on other sugar sources (e.g., honey) or sugar combined with povidone-iodine (Knutson’s formula) were not eligible for inclusion (excepting when reported as a comparator). Levels of evidence for intervention studies are reported in Table 1.
Table 1: Levels of evidence for clinical studies
Background
Sugar has been used since the late 1600s as a wound cleanser and the early 1700s as a treatment to promote wound healing1, 22. It is readily accessible at a very low cost in most geographic regions. In its granular/crystalized form, sugar consists of glucose and fructose, bound together to form sucrose (a disaccharide)13, 26. Sugar is present as a monosaccharide in other natural treatments, including honey, saps and fruit22. In its crystalized form, sugar’s mechanism for wound healing is different than that of honey and fruits. Crystalized sugar is sometimes used in combination with povidone-iodine to treat wounds29-33, and is commercially marketed as a sugar-povidone-iodine paste in some countries. The evidence for sugar in other natural forms (e.g., honey) and in combination with povidone iodine is not reported in this evidence summary, excepting as a comparator to sugar dressing.
There are several mechanisms through which granular white sugar is presumed to promote wound healing. First, sugar is hygroscopic; that is, it absorbs moisture from the environment around it, contributing to reduction in wound exudate22, 28. This also leads to mechanical debridement through slough adherence to the sugar dressing for removal without damage to healthy tissue1, 3, 22. In addition, sugar’s hygroscopic property contributes to autolytic debridement13, and reduction of edema in the wound bed and surrounding tissues1, 13.
Sugar increases osmolality of the wound environment, which influences water level activity. This mechanism attracts lymphocytes and macrophages to the wound bed1, and can inhibit the growth of bacteria5, 7, 25, 26. Sugar also releases hydrogen peroxide at low, non-toxic levels, which further inhibits bacteria activity7, 13, 27. Invitro studies have demonstrated sugar’s activity against a range of bacteria, including S. aureus, P aeruginosa, S. faecalis, E. coli, K. pneumoniae, and C. albicans5, 8, 25; and this was supported in an in-vivo study reported below4. In comparison to many other antiseptics, sugar has low toxicity and lowers the wound bed pH to around 5.0, which is more conducive to healing than an alkaline pH1, 7.
Clinical evidence on sugar dressing
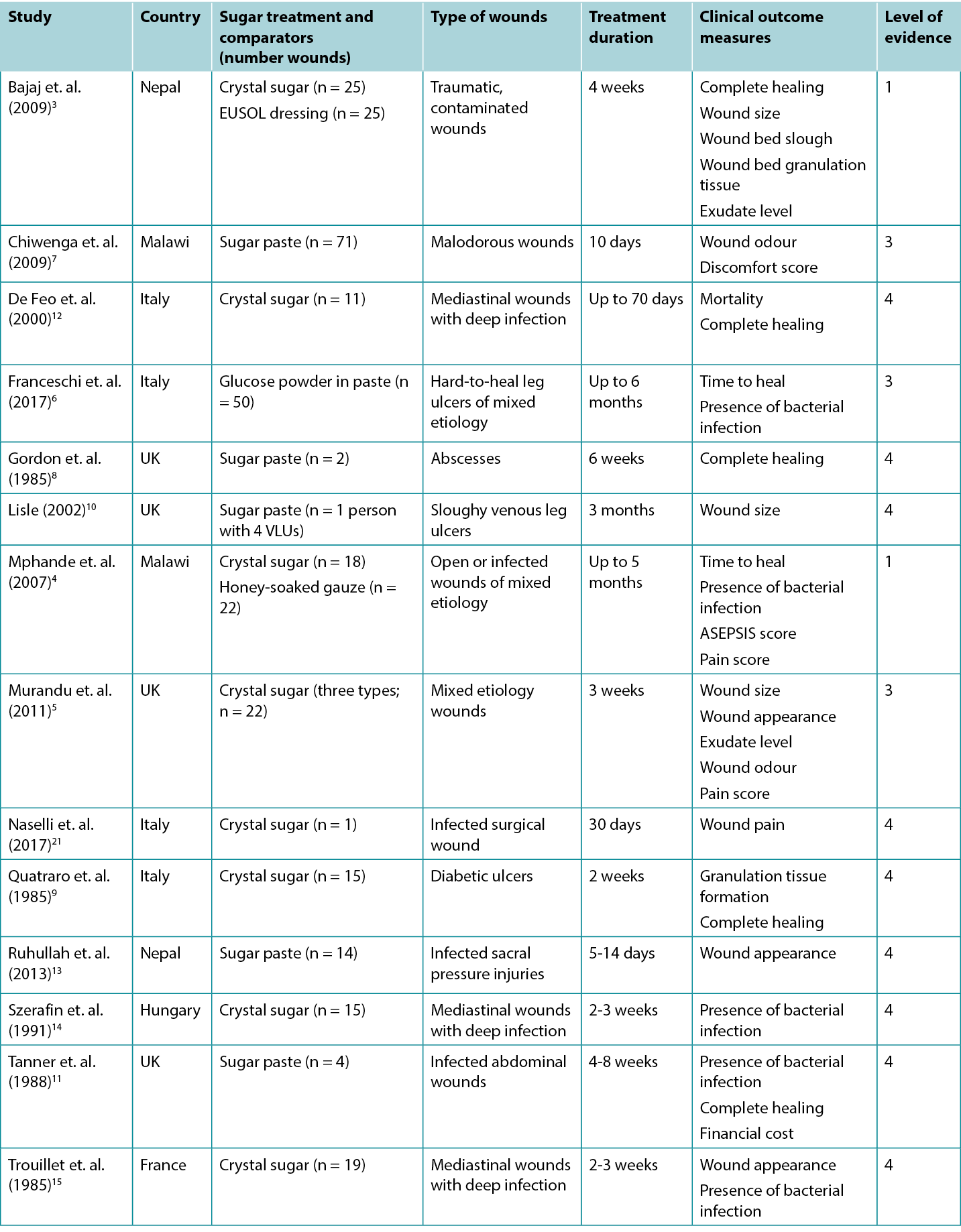
Studies reporting clinical outcomes for treatment with sugar dressings are summarised in Table 2.
Table 2: Summary of the evidence for traditional sugar dressing/paste
Sugar dressing for promoting wound healing
An RCT3 (n = 50 wounds) that was at high risk of bias compared sugar dressing to EUSOL dressing for treating traumatic, contaminated wounds associated with bone injuries. EUSOL is a traditional hypolochlorite made from chlorinated lime and boric acid34. In both groups the wounds were lavaged with normal saline. The sugar group received granulated white sugar plus a gauze dressing. The EUSOL group received a 30-minute EUSOL soak followed by packing with EUSOL gauze. Both groups received concurrent systemic antibiotics based on culture and sensitivity of organisms in the wounds. After four weeks both groups had good healing rates, but the EUSOL group showed superiority (77% healed versus 66% healed, p < 0.05). The EUSOL group had a 1.23 times higher likelihood of achieving healing within four weeks. The EUSOL group also had superior outcomes on other measures including wound size and wound bed tissue type3 (Level 1).
A second RCT4 (n = 40) that was at high risk of bias compared sugar dressing to a honey dressing in open or infected wounds in children and adults. Debris was removed using saline and gauze, then wounds were either packed with granulated sugar or with honey-soaked gauze. Dressings were initially performed daily, increasing to weekly based on wound condition. After two weeks of treatment, the median healing rate was higher in the honey group (3.8 cm2/week versus 2.2 cm2/week, p = not reported). Median time to complete healing was shorter in the honey group (31.5 days [range 14 – 98] versus 56 days [range 21 – 133]). Both treatments were considered effective. Honey was reported as superior; however, no statistical analysis was reported to support this conclusion4 (Level 1).
In a proof-of-concept study at high risk of bias5, 22 wounds of mixed etiology were treated with a sugar dressing for three weeks. At baseline, the wounds had sloughy/necrotic tissue and moderate to heavy exudate levels. Wounds were cleansed, packed with granulated sugar and an absorbent pad applied, either daily or twice daily. There was progressive improvement in wound bed appearance for all the wounds over the short study period, and a reduction in mean wound area (baseline mean: 34.7 cm2 [range 6–144]; 3-week mean: 28.9 cm2 (range 4.63 – 142.4])5 (Level 3).
Several case studies8-11 at high risk of bias reported successful healing of hard-to-heal wounds with various sugar preparations. In one8, two people with complex abscesses that had previously failed to heal with surgical debridement and EUSOL gauze packing achieved complete healing within six weeks of commencing treatment with sugar paste (powdered sugar combined with polyethylene glycol and hydrogen peroxide)8. Quatraro et. al. (1985)9 reported that packing diabetic ulcers (n = 15) with sugar replaced every 3 to 4 hours was associated with rapid wound bed granulation (5 to 6 days) and complete healing within 12 days9. Another case report10 described the use of sugar paste replaced daily to reduce wound malodour and heal multiple, sloughy, partial thickness leg ulcers in one person. Finally, Tanner et. al. (1988)11 reported four cases in which sugar paste was applied to infected abdominal wounds to achieve healing within 4 to 8 weeks. In this report, thicker sugar paste was applied directly to open wound beds, and a thinner sugar paste (with increased volume of polyethylene glycol and hydrogen peroxide) was installed into abscess cavities with a syringe and catheter11 (Level 4).
Sugar dressing for signs and symptoms of wound infection
In an observational study6 (n = 50) at high risk of bias, hard-to-heal leg ulcers were selected for trial of a 60% sugar powder and 40% petroleum jelly paste preparation. At baseline, wound swabs were taken, with results showing bacterial presence in 100% of ulcers. Treatment was wound cleansing with tap water (no debridement performed), weekly application of the sugar paste, bandaging and etiological-based management (e.g., compression therapy or conservative hemodynamic correction of venous insufficiency [CHIVA]). A second wound swab was performed at 30 to 40 days; 100% of ulcers were bacteria-free. Complete healing rate was 96%, with a mean healing time of 109 days6 (Level 3).
Another observational study7 (n = 71) at high risk of bias explored sugar paste to manage wound odour and pain. Malodorous wounds selected for treatment had a mean baseline odour score of 5.45 that reduced to 2.94 at ten days of treatment (score rated from 1 to 10, where 10 was worst odour). Patient-rated discomfort reduced from a mean of 6.73 to 3.87 (score from 1 to 10, where 10 was worst pain)7 (Level 3).
A case series12 (n = 11) at high risk of bias reported outcomes for mediastinal wound infection following cardiac surgery when treated with sugar dressing. On detection of wound infection, surgical exploration, debridement and povidone iodine irrigation were performed, and the wound was surgically closed. However, wound infection did not resolve for any participants. The sternal wound was re-opened, and sugar dressing was performed up to four times daily until complete healing or flap reconstruction. Mean time to resolution of infection (based on microbiological assessment) after sugar dressing commenced was 11.22 ± 1.6 days. Mean duration of sugar dressing was 44 ± 27.8 days12 (Level 4). In a later report19, 20 at moderate risk of bias, the researchers compared this cohort to two other cohorts with mediastinal wound infection following cardiac surgery that received different treatments based on a range of standardized protocols at the time of their admission. Mortality rates were significantly better for sugar dressing versus conservative treatment/closed irrigation (30.6% versus 2.4%, p < 0.05), but mortality was higher for people treated with sugar dressing versus negative pressure wound therapy (1.8% versus 2.4%, p < 0.05)19. However, all the people in this study were critically ill and it was not evident that the type of dressing influenced mortality outcomes (Level 3). Other small case series at high risk of bias13-15 achieved similar clinical outcomes in both surgical wounds14, 15 and chronic wounds13 using sugar dressing14, 15 or paste13 to resolve local wound infection, debride the wound bed and promote granulation in preparation for surgical repair (Level 4).
The RCT4 comparing sugar to honey dressings evaluated signs and symptoms of infection with microbiological assessment, ASEPSIS score and pain assessment (categorically described as no pain, moderate pain or severe pain). Both groups showed similar reduction in signs and symptoms of wound infection. After one week of treatment, the percent of wounds treated with sugar that returned positive cultures reduced from baseline (52% to 39%). The median ASEPSIS score for sugar-treated wounds showed a reduction in the first three weeks (8.3 points/week) and the percent of people describing severe pain during dressing changes or with movement also reduced4 (Level 1).
In the short proof-of-concept study described above, Murandu et. al. (2011)5 reported resolution of signs and symptoms of infection (i.e., exudate, malodour and wound pain). Malodour completely resolved by seven days of treatment in all 11 wounds that were assessed as malodorous at baseline. All 22 wounds had moderate-to-heavy exudate levels at baseline; exudate decreased in the first week and was absent or minimal for all wounds by trial end. Pain requiring opiates was reported by five people at baseline, and this resolved within three days of treatment5 (Level 3).
Considerations for use
Preparation and use of sugar dressing
The studies included in this evidence summary used various methods to apply sugar to the wound. Some researchers5, 9, 15 packed granular white sugar directly into the wound cavity and retained it with gauze, absorbent pad, dry gauze or adhesive dressing (see Table 3 for an example of a recommended application method24). Muranda et. al. (2011)5 described using yellow paraffin to build a ‘ridge’ around wounds in awkward anatomical locations (e.g., heels) to further assist in retaining sugar in the wound. In these studies, packing sugar directly into the wound required replacement of the sugar dressing at least twice daily to maintain a well-packed wound cavity5, 9, 15, because sugar combines with wound exudate and drains from the wound7. Other researchers describe the addition of glycerin or petroleum jelly to make a sugar paste that could more easily be retained in the wound6-8, 13 and had a consistency that eased application7.
Table 3: One method for applying sugar to a wound

Adverse effects
- Some people reported a burning pain on application of sugar dressing that resolved quickly5, 7. Sugar has also been reported to cause itching of the peri-wound skin.24 These effects are thought to occur due to the drying effect sugar has on the wound bed and might be reduced by using a sugar paste in preference to granular sugar28.
- Evidence on the effect of topically applied sugar on blood sugar levels in people with diabetes is mixed. Sugar is a disaccharide (i.e., glucose and fructose combine to form sucrose) that is absorbed through the intestines, so theoretically it should not influence blood sugar levels when applied to a wound bed1, 23, 35. Some studies explored and confirmed that applying sugar to a wound does not influence blood sugar levels5, 15; however, there was one case report in which raised blood sugar level was observed1, 22, and in another study people with diabetes were given higher insulin doses20.
- There is one report of acute kidney failure associated with sugar paste23. In some of the reports12, 14, 15, people who had a wound treated with sugar dressing died; however, these people had serious disease and death was likely not related to the sugar dressing.
Other considerations
- White granulated sugar is considered sterile. Care should be taken to guarantee the product used is not contaminated and that sterility is maintained (e.g., if powdering the sugar).
- The evidence in this summary came from settings with limited access to wound care resources. Consider the medico-legal implications of using a sugar dressing in resource-rich settings.
- Optimal frequency of sugar dressing replacements is twice daily7, 13, 21, 26 to maintain sufficient osmolality and hydrogen peroxide production to sustain inhibition of bacteria22, 27. However, this is rarely possible in resource-limited settings7. Numerous studies reported wound dressing frequencies of up to 5 to 7 days4, 6, 7, 13, particularly after wound exudate reduces.
- Patient and health practitioner satisfaction levels were reported to be high in one study, and in this study feasibility of people performing their own sugar dressing in the community was demonstrated5.
- Sugar is reported to have a lower attraction to flies than honey, which may be a consideration when selecting a wound dressing in resource-limited settings28.
- Sugar paste was prepared by a hospital pharmacy from by using powdered, additive-free sugar combined with polyethylene glycol and hydrogen peroxide11, with ratio of ingredients varying based on the viscosity required for ease of application. Hydrogen peroxide is not recommended for use in cavity wounds and sterility might not be maintained when powdering the sugar.
- A cost comparison that considered cost of dressing materials and community nursing time for a four-month treatment regime in the 1980s in the UK reported a sugar paste dressing to be a cheaper option than gauze or paraffin gauze11.
Conflicts of interest
The author declares no conflicts of interest in accordance with International Committee of Medical Journal Editors (ICMJE) standards.
About WHAM evidence summaries
WHAM evidence summaries are consistent with methodology published in Munn Z, Lockwood C, Moola S. The development and use of evidence summaries for point of care information systems: A streamlined rapid review approach, Worldviews Evid Based Nurs. 2015;12(3):131-8.
Methods are outlined in resources published by the Joanna Briggs Institute16-18 and on the WHAM Collaborative website: http://WHAMwounds.com. WHAM evidence summaries undergo peer-review by an international, multidisciplinary Expert Reference Group. WHAM evidence summaries provide a summary of the best available evidence on specific topics and make suggestions that can be used to inform clinical practice. Evidence contained within this summary should be evaluated by appropriately trained professionals with expertise in wound prevention and management, and the evidence should be considered in the context of the individual, the professional, the clinical setting and other relevant clinical information.
Copyright © 2023 Wound Healing and Management Collaboration, Curtin Health Innovations Research Institute, Curtin University
Resumo das evidências WHAM: pensos de açúcar para a cicatrização de feridas e para tratamento de infeções de feridas em contextos de recursos limitados
Emily Haesler
DOI: https://doi.org/10.33235/wcet.43.2.35-40
Questão clínica
Qual é a melhor prova disponível de que o penso de açúcar melhora a cicatrização da ferida e que reduz os sinais e os sintomas de infeção da ferida?
Resumo
O açúcar branco granulado/cristalizado é facilmente acessível e a baixo custo na maioria das regiões geográficas. Desde há centenas de anos que tem sido utilizado como tratamento de feridas porque é estéril, não tóxico, absorve fluidos e tem algumas propriedades antimicrobianas.1 O açúcar é mais frequentemente utilizado na sua forma granular, acondicionado na cavidade de uma ferida e fixado com um penso. Em alternativa, pode ser moído até se tornar um pó, combinado com glicerina ou com vaselina e aplicado como uma pasta1, 2. Não existem evidências que permitam comparar a eficácia do açúcar com a dos pensos modernos que promovem a cicatrização de feridas húmidas. Evidências de nível 13, 4 com elevado risco de enviesamento mostraram que o penso de açúcar estava associado a taxas aceitáveis de cicatrização de feridas3, 4 e à redução da infeção da ferida4, mas poderia não ser tão eficaz como a Solução de Cal da Universidade de Edimburgo (EUSOL)3 ou mel4, os quais são ambos normalmente utilizados em locais com recursos limitados. As evidências de nível 3 5-7 e 48-15 com risco moderado ou elevado de enviesamento forneceram provas de que os pensos de açúcar podem promover a cicatrização5, 6, 8, 9, 11-15, melhorar o tecido do leito da ferida5, 9, 13-15 e reduzir a infeção bacteriana6, 12-15, a dor da ferida5 e o mau odor da ferida7, 10.
Recomendações de prática clínica
Todas as recomendações devem ser aplicadas tendo em consideração a ferida, a pessoa, o profissional de saúde e o contexto clínico.
| Quando o acesso a pensos modernos para feridas é limitado, o penso de açúcar pode ser considerado para utilização como um penso natural para feridas para redução dos sinais e dos sintomas de infeção e para promover a cicatrização (Grau B). |
Origem das evidências pesquisa e avaliação
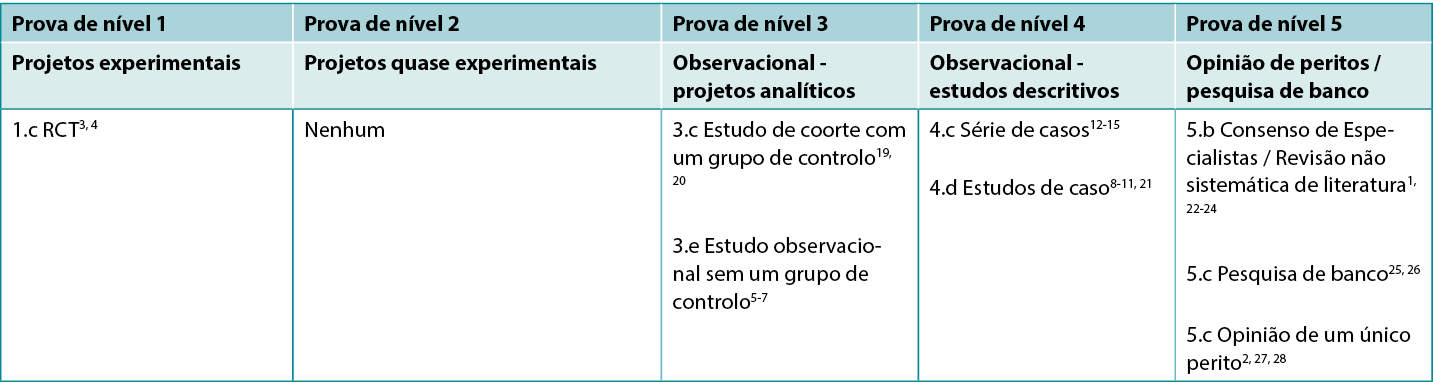
Este resumo foi conduzido utilizando os métodos publicados pelo Instituto Joanna Briggs16-18. O resumo baseia-se numa pesquisa bibliográfica sistemática que combina termos de pesquisa relacionados com pensos de açúcar e a cicatrização de feridas. Foram realizadas pesquisas por evidências em inglês que relatassem o uso de açúcar granulado em feridas humanas publicadas até dezembro de 2022 nas seguintes bases de dados: Cumulative Index to Nursing and Allied Health Literature (CINAHL), Medline (Ovid), Google Scholar, Embase (Ovid), AMED e Health Internetwork Access to Research Initiative (Hinari, acesso via Research4Life) e Biblioteca Cochrane. Estudos sobre outras fontes de açúcar (por exemplo, mel) ou açúcar combinado com iodopovidona (fórmula de Knutson) não foram elegíveis para inclusão (exceto quando relatados como um comparador). Os níveis de evidência para estudos de intervenção encontram-se relatados no Tabela 1.
Tabela 1: Níveis de evidência para estudos clínicos
Antecedentes
O açúcar tem sido utilizado desde o final do século XVII como produto de limpeza de feridas e no início do século XVIII como tratamento para promover a cicatrização de feridas1, 22. É facilmente acessível e a um custo muito baixo na maioria das regiões geográficas. Na sua forma granular/cristalizada, o açúcar é constituído por glucose e frutose, unidas para formar sacarose (um dissacárido)13, 26. O açúcar está presente como monossacárido noutros tratamentos naturais, incluindo o mel, a seiva e a fruta22. Na sua forma cristalizada, o mecanismo de cicatrização do açúcar é diferente do mecanismo do mel e dos frutos. O açúcar cristalizado é por vezes utilizado em combinação com iodopovidona para tratar feridas29-33, sendo comercializado como uma pasta de açúcar-povidona-iodo em alguns países. As evidências para o açúcar noutras formas naturais (por exemplo, mel) e em combinação com iodopovidona não são relatadas neste resumo de evidências, exceto como um comparador relativamente ao penso de açúcar.
Existem vários mecanismos através dos quais se presume que o açúcar branco granulado promove a cicatrização de feridas. Primeiro, o açúcar é higroscópico, ou seja, absorve a humidade do ambiente à sua volta, contribuindo para a redução do exsudado da ferida22, 28. Isto também leva a um desbridamento mecânico através da viscosidade aderida ao penso de açúcar permitindo a remoção sem danificar o tecido saudável1, 3, 22. Adicionalmente, a propriedade higroscópica do açúcar contribui para o desbridamento autolítico13 e para a redução do edema no leito da ferida e também nos tecidos circundantes1, 13.
O açúcar também incrementa a osmolalidade do ambiente da ferida, o que influencia a atividade do nível de água. Este mecanismo atrai linfócitos e macrófagos para o leito da ferida1 e pode inibir o crescimento de bactérias5, 7, 25, 26. O açúcar também liberta peróxido de hidrogénio em níveis baixos e não tóxicos, o que inibe ainda mais a atividade das bactérias7, 13, 27. Estudos in vitro demonstraram a atividade do açúcar contra uma série de bactérias, incluindo S. aureus, P aeruginosa, S. faecalis, E. coli, K. pneumoniae e C. albicans5, 8, 25; e isto foi apoiado por um estudo in vivo relatado em seguida4. Em comparação com muitos outros antissépticos, o açúcar tem baixa toxicidade e reduz o pH do leito da ferida para cerca de 5,0, o que é mais propício à cicatrização do que um pH alcalino1, 7.
Dados clínicos sobre o penso de açúcar
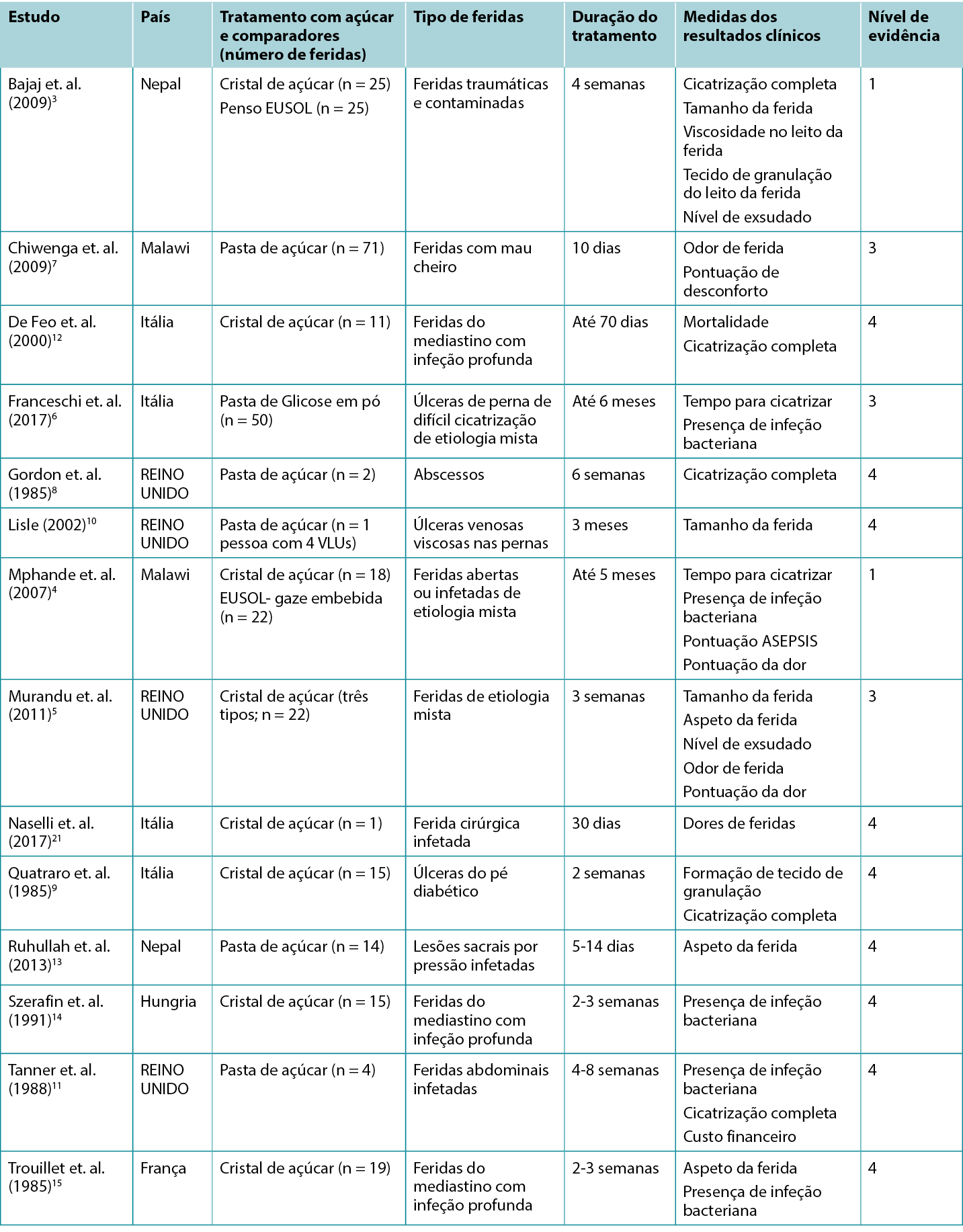
Na Tabela 2 estão resumidos os estudos que relatam os resultados clínicos do tratamento com pensos de açúcar.
Tabela 2: Resumo da evidência para o penso de açúcar/pasta de açúcar tradicional
Pensos de açúcar para promover a cicatrização de feridas
Um RCT3 (n = 50 feridas), que apresentava um elevado risco de enviesamento, comparou o penso de açúcar com o penso EUSOL para o tratamento de feridas traumáticas e contaminadas associadas a lesões ósseas. O EUSOL é um hipoclorito tradicional feito de cal clorada e de ácido bórico34. Em ambos os grupos, as feridas foram lavadas com uma solução salina normal. No grupo do açúcar foi aplicado açúcar branco granulado com um penso de gaze. O grupo EUSOL foi submetido a uma imersão de 30 minutos com EUSOL, seguida da aplicação de gaze EUSOL. Com base na cultura e na sensibilidade dos organismos presentes nas feridas, ambos os grupos receberam simultaneamente antibióticos sistémicos. Após quatro semanas, ambos os grupos apresentavam boas taxas de cicatrização, mas o grupo EUSOL atingiu uma taxa superior (77% de cicatrização versus 66% de cicatrização, p < 0,05). O grupo EUSOL teve uma probabilidade 1,23 vezes maior de atingir a cicatrização no prazo de quatro semanas. O grupo EUSOL também apresentou resultados superiores noutras medidas, incluindo o tamanho da ferida e o tipo de tecido do leito da ferida3 (Nível 1).
Um segundo RCT4 (n = 40), que apresentava um risco elevado de enviesamento, comparou o penso de açúcar com um penso de mel em feridas abertas ou infetadas em crianças e adultos. Os restos foram removidos com soro fisiológico e gaze e, em seguida, as feridas foram tapadas com açúcar granulado ou com gaze embebida em mel. Os pensos foram inicialmente efetuados diariamente, passando a semanais com base no estado da ferida. Após duas semanas de tratamento, a taxa media de cicatrização foi mais elevada no grupo do mel (3,8 cm2/semana versus 2,2 cm2/semana, p = não indicado). O tempo médio para completar a cicatrização foi mais curto no grupo do mel (31,5 dias [intervalo 14 - 98] versus 56 dias [intervalo 21 - 133]). Ambos os tratamentos foram considerados efetivos. O mel foi considerado superior; no entanto, não foi apresentada qualquer análise estatística de suporte a esta conclusão4 (Nível 1).
Num estudo de prova de conceito com elevado risco de enviesamento5, 22 feridas de etiologia mista foram tratadas durante três semanas com um penso de açúcar. No início do estudo, as feridas apresentavam um tecido viscoso/necrótico e níveis de exsudado de moderados a pesados. As feridas foram limpas, preenchidas com açúcar granulado e foi aplicado um penso absorvente, diariamente ou duas vezes por dia. Ao longo do curto período de estudo verificou-se uma melhoria progressiva do aspeto do leito da ferida em todas as feridas e uma redução da área média da ferida (média do início do estudo: 34.7 cm2 [variação 6-144]; média de 3 semanas: 28.9 cm2 (intervalo 4,63 – 142,4])5 (Nível 3).
Vários estudos de caso8-11, com elevado risco de enviesamento, com várias preparações de açúcar relataram uma cicatrização bem sucedida de feridas de difícil cicatrização. Num caso8, duas pessoas com abcessos complexos e que anteriormente não tinham cicatrizado com desbridamento cirúrgico e compressão com gaze EUSOL obtiveram uma cicatrização completa no prazo de seis semanas após o início do tratamento com pasta de açúcar (açúcar em pó combinado com polietileno glicol e peróxido de hidrogénio)8. Quatraro et. al. (1985)9 relataram que o preenchimento de úlceras diabéticas (n = 15) com açúcar, substituído a cada 3 a 4 horas, estava associado a uma rápida granulação do leito da ferida (5 a 6 dias) e a uma cicatrização completa no prazo de 12 dias9. Num outro relato de caso10 descreveu-se a utilização de pasta de açúcar substituída diariamente para reduzir o mau odor da ferida e cicatrizar em uma pessoa, úlceras de perna múltiplas e viscosas de espessura parcial. Por último, Tanner et. al. (1988)11 relataram quatro casos em que a pasta de açúcar foi aplicada a feridas abdominais infetadas, obtendo-se a cicatrização no espaço de 4 a 8 semanas. Neste relatório, uma pasta de açúcar mais espessa foi aplicada diretamente em leitos de feridas abertas e uma pasta de açúcar mais fina (com maior volume de polietileno glicol e de peróxido de hidrogénio) foi aplicada nas cavidades dos abcessos com uma seringa e um cateter11 (Nível 4).
Penso de açúcar para sinais e sintomas de infeção de feridas
Num estudo observacional6 (n = 50) com elevado risco de enviesamento, foram selecionadas úlceras de perna de difícil cicatrização para o ensaio de uma preparação de pasta com 60% de açúcar em pó e com 40% de vaselina. No início do estudo, foram efetuadas zaragatoas das feridas, tendo os resultados revelado a presença de bactérias em 100% das úlceras. O tratamento consistiu na limpeza da ferida com água da torneira (sem desbridamento), na aplicação semanal da pasta de açúcar, na aplicação de ligaduras e no tratamento de base etiológica (por exemplo, por terapia de compressão ou por correção hemodinâmica conservadora da insuficiência venosa [CHIVA]). Foi efetuada uma segunda zaragatoa da ferida entre os 30 a 40 dias; 100% das úlceras estavam livres de bactérias. A taxa de cicatrização completa foi de 96%, com um tempo médio de cicatrização de 109 dias6 (Nível 3).
Outro estudo observacional7 (n = 71), com elevado risco de enviesamento, explorou utilização da pasta de açúcar para gerir o odor e a dor da ferida. As feridas com odor desagradável selecionadas para o tratamento tinham uma pontuação média de odor inicial de 5,45, que diminuiu para 2,94 aos dez dias de tratamento (pontuação classificada de 1 a 10, sendo 10 o pior odor). O desconforto avaliado pelo paciente diminuiu de uma média de 6,73 para 3,87 (pontuação de 1 a 10, sendo 10 a pior dor)7 (Nível 3).
Uma série de casos12 (n = 11), com elevado risco de enviesamento relatou resultados para infeção de ferida mediastinal após cirurgia cardíaca quando tratada com penso de açúcar. Após ter sido detetada a infeção da ferida, procedeu-se à exploração cirúrgica, ao desbridamento e à irrigação com iodopovidona, tendo a ferida sido fechada cirurgicamente. No entanto, a infeção da ferida não foi resolvida em nenhum dos participantes. A ferida esternal foi reaberta e o penso de açúcar foi efetuado até quatro vezes por dia até à cicatrização completa ou reconstrução do bordo. Após o início da aplicação do penso de açúcar, o tempo médio para a resolução da infeção (com base na avaliação microbiológica) foi de 11,22 ± 1,6 dias. A duração média do tratamento com penso de açúcar foi de 44 ± 27,8 dias12 (Nível 4). Num relatório posterior19, 20, com risco moderado de enviesamento, os investigadores compararam esta coorte com duas outras coortes com infeção da ferida mediastínica após cirurgia cardíaca e que receberam diferentes tratamentos com base numa série de protocolos padronizados no momento da sua admissão. As taxas de mortalidade foram significativamente melhores para o penso de açúcar versus tratamento conservador/irrigação fechada (30,6% versus 2,4%, p < 0,05), mas a mortalidade foi superior para as pessoas tratadas com penso de açúcar versus terapia de feridas por pressão negativa (1,8% versus 2,4%, p < 0,05)19. No entanto, todas as pessoas neste estudo estavam gravemente doentes, não tendo ficado evidente que o tipo de penso influenciou os resultados de mortalidade (Nível 3). Outras pequenas séries de casos com elevado risco de enviesamento13-15 obtiveram resultados clínicos semelhantes, tanto em feridas cirúrgicas14, 15 como em feridas crónicas13, utilizando pensos de açúcar14, 15 ou pasta13 para resolver a infeção local da ferida, desbridar o leito da ferida e promover a granulação na preparação para a reparação cirúrgica (Nível 4).
O RCT4 que comparou pensos de açúcar com pensos de mel, avaliou sinais e sintomas de infeção com avaliação microbiológica, pontuação ASEPSIS e avaliação da dor (categoricamente descrita como sem dor, dor moderada ou dor intensa). Ambos os grupos apresentaram uma redução semelhante nos sinais e nos sintomas de infeção da ferida. Após uma semana de tratamento, a percentagem de feridas tratadas com açúcar com culturas positivas diminuiu em relação ao início do tratamento (52% para 39%). A mediana da pontuação ASEPSIS, para feridas tratadas com açúcar, mostrou uma redução nas primeiras três semanas (8,3 pontos/semana) e a percentagem de pessoas que descrevem dor intensa durante as mudanças de penso ou com o movimento também diminuiu4 (Nível 1).
No breve estudo de prova de conceito anteriormente descrito, Murandu et. al. (2011)5 relataram a resolução de sinais e de sintomas de infeção (ou seja, exsudado, mau odor e dor na ferida). O mau odor desapareceu completamente aos sete dias de tratamento em todas as 11 feridas que tinham sido avaliadas como malcheirosas no início do tratamento. Todas as 22 feridas apresentavam níveis de exsudado moderados a elevados no início do ensaio; o exsudado diminuiu na primeira semana e no final do ensaio estava ausente ou era mínimo em todas as feridas. No início do tratamento cinco pessoas referiram sentir dor que necessitava de opiáceos, a qual foi resolvida no prazo de três dias após o tratamento5 (Nível 3).
Considerações de utilização
Preparação e utilização de pensos de açúcar
Os estudos incluídos neste resumo de evidências utilizaram vários métodos de aplicação de açúcar na ferida. Alguns investigadores5, 9, 15 colocaram açúcar branco granulado diretamente na cavidade da ferida e protegeram-no com gaze, penso absorvente, gaze seca ou penso adesivo (ver Tabela 3 para um exemplo de um método de aplicação recomendado24). Muranda et. al. (2011)5 para ajudar a reter o açúcar na ferida, descreveram a utilização de parafina amarela para construir uma "crista" à volta de feridas em locais anatómicos estranhos (por exemplo, calcanhares). Nestes estudos, a colocação de açúcar diretamente na ferida exigiu a substituição do penso de açúcar pelo menos duas vezes por dia para manter uma cavidade da ferida bem acondicionada5, 9, 15, pois o açúcar combina-se com o exsudado da ferida e é drenado da mesma7. Outros investigadores descrevem a adição de glicerina ou de vaselina para formar uma pasta de açúcar que pudesse ser mais facilmente retida na ferida6-8, 13 e que tivesse uma consistência que facilitasse a aplicação7.
Tabela 3: Um método para aplicar açúcar em uma ferida

Efeitos adversos
- Algumas pessoas relataram uma dor que queimava aquando da aplicação do penso de açúcar, mas que se resolveu rapidamente5, 7. Também foi relatado que o açúcar provoca comichão na pele peri-ferida.24 Pensa-se que estes efeitos ocorrem devido ao efeito de secagem que o açúcar tem no leito da ferida e podem ser reduzidos utilizando uma pasta de açúcar em vez de açúcar granular28.
- As evidências sobre o efeito do açúcar, aplicado topicamente, nos níveis de açúcar no sangue em pessoas com diabetes são confusas. O açúcar é um dissacárido (ou seja, a glucose e a frutose combinam-se para formar sacarose) e que é absorvido através dos intestinos, pelo que, teoricamente, não deveria influenciar os níveis de açúcar no sangue quando aplicado no leito de uma ferida1, 23, 35. Alguns estudos exploraram e confirmaram que a aplicação de açúcar numa ferida não influencia os níveis de açúcar no sangue5, 15; no entanto, existiu um caso relatado em que se observou um aumento do nível de açúcar no sangue1, 22 e noutro estudo foram administradas doses mais elevadas de insulina a pessoas com diabetes20.
- Existe um relato de insuficiência renal aguda associada à pasta de açúcar23. Em alguns dos relatórios12, 14, 15, as pessoas que tinham uma ferida tratada com um penso de açúcar morreram; no entanto, estas pessoas tinham doenças graves e a morte provavelmente não estava relacionada com o penso de açúcar.
Outras considerações
- O açúcar granulado branco é considerado estéril. Deve ter-se o cuidado em garantir que o produto utilizado não está contaminado e que a esterilidade é mantida (por exemplo, se se tratar de açúcar em pó).
- As evidências contidas neste resumo foram obtidas em locais com acesso limitado a recursos de cuidados de feridas. Considere as implicações médico-legais da utilização de um penso de açúcar em ambientes ricos em recursos.
- A frequência ideal para as substituições do penso de açúcar é de duas vezes por dia7, 13, 21, 26 para assim manter uma osmolalidade e uma produção de peróxido de hidrogénio suficientes para manter a inibição das bactérias22, 27. No entanto, isto raramente é possível em contextos de recursos limitados7. Numerosos estudos relataram frequências de pensos de feridas de até 5 a 7 dias4, 6, 7, 13, particularmente após a redução do exsudado da ferida.
- Os níveis de satisfação do paciente e do profissional de saúde foram considerados elevados num estudo e, nesse estudo, foi demonstrada a viabilidade de as pessoas na comunidade efetuarem o seu próprio penso de açúcar5.
- É relatado que o açúcar atrai menos as moscas do que o mel, o que, em ambientes com recursos limitados, pode ser um fator a ter em conta na seleção de um penso para feridas28.
- A pasta de açúcar foi preparada por uma farmácia hospitalar a partir de açúcar em pó, sem aditivos, combinado com polietileno glicol e com peróxido de hidrogénio11, variando a proporção dos ingredientes com base na viscosidade necessária para facilitar a aplicação. O peróxido de hidrogénio não é recomendado para utilização em feridas com cavidades e a esterilidade pode não ser mantida quando se pulveriza o açúcar.
- Uma comparação de custos que considerou o custo dos materiais de penso e o tempo de enfermagem comunitária, para um regime de tratamento de quatro meses na década de 1980 no Reino Unido, relatou que um penso de pasta de açúcar era uma opção mais barata do que gaze ou gaze com parafina11.
Conflito de interesses
Os autores declaram não existirem conflitos de interesse, em conformidade com as normas do Comité Internacional de Editores de Revistas Médicas (ICMJE).
Sobre os resumos de evidências da WHAM
Os resumos de evidências da WHAM são consistentes com a metodologia publicada em Munn Z, Lockwood C, Moola S. O desenvolvimento e utilização de resumos de provas para sistemas de informação em pontos de atendimento: Uma abordagem simplificada de revisão rápida, Worldviews Evid Based Nurs. 2015;12(3):131-8.
Os métodos estão descritos nos documentos publicados pelo Instituto Joanna Briggs16-18 e na página web do WHAM Collaborative: http://WHAMwounds.com. Os resumos de evidências do WHAM passam por uma revisão por pares por um Grupo de Referência de Especialistas multidisciplinar e internacional. Os resumos de evidências da WHAM fornecem um resumo das melhores provas disponíveis sobre tópicos específicos e apresentam sugestões que podem ser utilizadas para informar a prática clínica. As evidências contidas neste resumo devem ser avaliadas por profissionais devidamente formados e com conhecimentos especializados na prevenção e gestão de feridas e as provas devem ser consideradas no contexto do indivíduo e do profissional, do ambiente clínico e de outras informações clínicas relevantes.
Copyright © 2023 Colaboração na Tratamento e Cicatrização de Feridas, Instituto de pesquisa de inovação em saúde Curtin, Universidade de Curtin
Author(s)
Emily Haesler
PhD P Grad Dip Adv Nurs (Gerontics), BN, FWA
Adjunct Professor, Curtin University, Curtin Health Innovation Research Institute, Wound Healing and Management (WHAM) Collaborative
References
- Biswas A, Bharara M, Hurst C, Gruessner R, Armstrong D, Rilo H. Use of sugar on the healing of diabetic ulcers: A review. J Diabetes Sci Technol, 2010; 4: 1139 - 45.
- Bitter CC, Erickson TB. Management of burn injuries in the wilderness: Lessons from low-resource settings. Wilderness Environ Med, 2016; 27(4): 519-25.
- Bajaj G, Karn NK, Shrestha BP, Kumar P, Singh MP. A randomised controlled trial comparing EUSOL and sugar as dressing agents in the treatment of traumatic wounds. Tropical Doctor, 2009; 39(1): 1-3.
- Mphande AN, Killowe C, Phalira S, Jones HW, Harrison WJ. Effects of honey and sugar dressings on wound healing. J Wound Care, 2007; 16(7): 317-9.
- Murandu M, Webber M, Simms M, Dealey C. Use of granulated sugar therapy in the management of sloughy or necrotic wounds: A pilot study. J Wound Care, 2011; 20(5): 206-16.
- Franceschi C, Bricchi M, Delfrate R. Anti-infective effects of sugar-vaseline mixture on leg ulcers. Veins and Lymphatics, 2017; 6(2).
- Chiwenga S, Dowlen H, Mannion S. Audit of the use of sugar dressings for the control of wound odour at Lilongwe Central Hospital, Malawi. Tropical Doctor, 2009; 39(1): 20-2.
- Gordon H, Middleton K, Seal D, Sullens K. Sugar and wound healing. Lancet, 1985; 2(8456): 663-5.
- Quatraro A, Minei A, Donzella C, Caretta F, Consoli G, Giugliano D. Sugar and wound healing. Lancet, 1985; 2(8456): 665.
- Lisle J. Use of sugar in the treatment of infected leg ulcers. Br J Community Nurs, 2002; 7(6 Suppl): 40, 2, 4, 6.
- Tanner A, Owen E, Seal D. Successful treatment of chronically infected wounds with sugar paste. Eur J Clin Microbiol Infect Dis, 1988; 7(4): 524-5.
- De Feo M, Gregorio R, Renzulli A, Ismeno G, Romano GP, Cotrufo M. Treatment of recurrent postoperative mediastinitis with granulated sugar. J Cardiovasc Surg, 2000; 41(5): 715-9.
- Ruhullah M, Sanjay S, Singh H, Sinha K, Irshad M, Abhishek B, Kaushal S, Shambhu S. Experience with the use of sugar paste dressing followed by reconstruction of sacral pressure sore with V-Y flap: A reliable solution for a major problem. Medical Practice and Reviews 2013; 4(4): 23-6.
- Szerafin T, Vaszily M, Péterffy A. Granulated sugar treatment of severe mediastinitis after open-heart surgery. Scand J Thorac Cardiovasc Surg, 1991; 25(1): 77-80.
- Trouillet JL, Chastre J, Fagon JY, Pierre J, Domart Y, Gibert C. Use of granulated sugar in treatment of open mediastinitis after cardiac surgery. Lancet, 1985; 2(8448): 180-4.
- Aromataris E, Munn Z (editors). Joanna Briggs Institute Reviewer’s Manual. https://reviewersmanual.joannabriggs.org/ The Joanna Briggs Institute, 2017.
- Joanna Briggs Institute Levels of Evidence and Grades of Recommendation Working Party. New JBI Grades of Recommendation. Adelaide: Joanna Briggs Institute, 2013.
- The Joanna Briggs Institute Levels of Evidence and Grades of Recommendation Working Party. Supporting Document for the Joanna Briggs Institute Levels of Evidence and Grades of Recommendation. www.joannabriggs.org: The Joanna Briggs Institute, 2014.
- De Feo M, Vicchio M, Santè P, Cerasuolo F, Nappi G. Evolution in the treatment of mediastinitis: single-center experience. Asian Cardiovasc Thorac Ann, 2011; 19(1): 39-43.
- De Feo M, Gregorio R, Della Corte A, Marra C, Amarelli C, Renzulli A, Utili R, Cotrufo M. Deep sternal wound infection: the role of early debridement surgery. Eur J Cardiothorac Surg, 2001; 19(6): 811-6.
- Naselli A, Accame L, P. B, Loy A, Bandettini R, Garaventa A, Alberighi O, Castagnola E. Granulated sugar for adjuvant treatment of surgical wound infection due to multi-drug-resistant pathogens in a child with sarcoma: a case report and literature review. Le Infezioni in Medicina, 2017; 4(35): 358-61.
- Pieper B, Caliri M. Nontraditional wound care: A review of the evidence for the use of sugar, papaya/papain, and fatty Aacids. J Wound Ostomy Cont Nurs, 2003; 30: 175–83.
- Valls L, Altisen M, Poblador R, Alvarez A, Biosca R. Sugar paste for treatment of decubital ulcers. J Pharm Technol, 1996; 12: 289 - 90.
- International Committee of the Red Cross (ICRC). ICRC Nursing Guideline 3: Sugar Dressing. IN: ICRC Nursing Guidelines. Geneva, Switzerland: ICRC; 2021.
- Chirife J, Herszage L, Joseph A, Kohn ES. In vitro study of bacterial growth inhibition in concentrated sugar solutions: microbiological basis for the use of sugar in treating infected wounds. Antimicrob Agents Chemother, 1983; 23(5): 766-73.
- Middleton KR, Seal DV. Development of a semi-synthetic sugar paste for promoting healing of Iinfected wounds. In: Wadström T, Eliasson I, Holder I, Ljungh Å, editors. Pathogenesis of Wound and Biomaterial-Associated Infections. London: Springer London; 1990. p. 159-62.
- Molan P, Cooper R. Honey and sugar as a dressing for wounds and ulcers Tropical Doctor, 2000; 30(4): 249-50.
- Tovey F. Honey and sugar as a dressing for wounds and ulcers. Tropical Doctor, 2000; 30: 1.
- Di Stadio A, Gambacorta V, Cristi MC, Ralli M, Pindozzi S, Tassi L, Greco A, Lomurno G, Giampietro R. The use of povidone-iodine and sugar solution in surgical wound dehiscence in the head and neck following radio-chemotherapy. Int Wound J, 2019; 16(4): 909-15.
- Knutson RA, Merbitz LA, Creekmore MA, Snipes HG. Use of sugar and povidone-iodine to enhance wound healing: five year’s experience. South Med J, 1981; 74(11): 1329-35.
- Nakao H, Yamazaki M, Tsuboi R, Ogawa H. Mixture of sugar and povidone - Iodine stimulates wound healing by activating keratinocytes and fibroblast functions. Arch Dermatol Res, 2006; 298(4): 175-82.
- Shimamoto Y, Shimamoto H, Fujihata H. Topical application of sugar and povidone-iodine in the management of decubitus ulcers in aged patients. Hiroshima Journal of Medical Sciences, 1986; 35(2): 167-9.
- Topham J. Sugar paste and povidone-iodine in the treatment of wounds. J Wound Care, 1996; 5(8): 364-5.
- Haesler E, Carville K. WHAM evidence summary: traditional hypochlorite solutions. WCET® Journal, 2023; 43(1): 35-40.
- Bogdanov S, Jurendic T, Sieber R, Gallmann P. Honey for nutrition and health: a review. J Am Coll Nutr, 2008; 27(6): 677-89.




