Volume 43 Number 3
Current perspectives on pressure injuries in persons with dark skin tones from the National Pressure Injury Advisory Panel
Joyce Black, Jill Cox, Virginia Capasso, Donna Z Bliss, Barbara Delmore, Vignesh Iyer, Jacqueline Massaro, Cassendra Munro, Joyce Pittman, Elizabeth A Ayello
Keywords health equity, pressure injuries, dark skin tones, skin assessment, social determinants of heath
For referencing Black J et al. Current perspectives on pressure injuries in persons with dark skin tones from the National Pressure Injury Advisory Panel. WCET® Journal 2023;43(3):18-29.
DOI
https://doi.org/10.33235/wcet.43.3.18-29
Submitted 30 April 2023
Accepted 26 June 2023
Abstract
Background Pressure injury (PI) development is multifactorial. In patients with dark skin tones, identifying impending PIs by visual skin assessment can be especially challenging. The need for improved skin assessment techniques, especially for persons with dark skin tones, continues to increase. Similarly, greater awareness of the need for inclusivity with regard to representation of diverse skin colours/tones in education materials has been apparent in recent years.
Objective To provide current perspectives from the literature surrounding skin assessment and PI development in patients with dark skin tones.
Methods The following elements will be discussed through the lens of skin tone: 1) historical perspectives of PI staging from the National Pressure Injury Advisory Panel, 2) epidemiology of PI, 3) anatomy and physiology of the skin, 3) skin tone assessment and measurement, 4) augmented visual assessment modalities, 5) PI prevention, 6) PI healing, 7) social determinants of health, and 8) gaps in clinician education.
Conclusions This review highlights the gap in our clinical knowledge regarding PIs in patients with dark skin tones. Racial disparities with regard to PI development and healing are especially highlighted among patients with dark skin tones. Skin tone colour assessment must be standardised and quantifiable in clinical education, practice, and research. This work is urgently needed, and support from private and governmental agencies is essential.
Introduction
Racial diversity across the United States has increased over the past 2 decades. The US Census Bureau reports that the overall diversity index has increased from 54.9% in 2010 to 61.1% in 2020 and is projected to continue to escalate over the next decade.1 Worldwide, people with dark skin tones comprise the majority of the population.2
Over the past 20 years, there has been a growing awareness of and interest in the need for skin assessment that is inclusive of all persons regardless of their skin colour.3-24 The clinical reality is that in the US and worldwide, skin tone demographics have shifted, and awareness of various skin colours has increased, such that the need for accurate skin assessment and diagnosis for all patients has taken on great urgency. Moreover, awareness of the need to include diverse skin colours/tones in education materials (basic professional and ongoing education) for students and clinicians has also increased in recent years.13
In this article, the authors outline current perspectives on pressure injuries (PIs) in patients with dark skin tones. The first section addresses the historical efforts of the National Pressure Injury Advisory Panel (NPIAP; formally the NPUAP) to address this disparity and revise staging definitions to be relevant for all skin tones. Additional topics addressed through the lens of skin tone include the epidemiology of PIs, anatomy and physiology of the skin, visual and augmented skin assessment techniques and modalities, PI prevention and healing, social determinants of health (SDOH) considerations, and professional education gaps.
Historical perspectives on PI staging in persons with dark skin tones
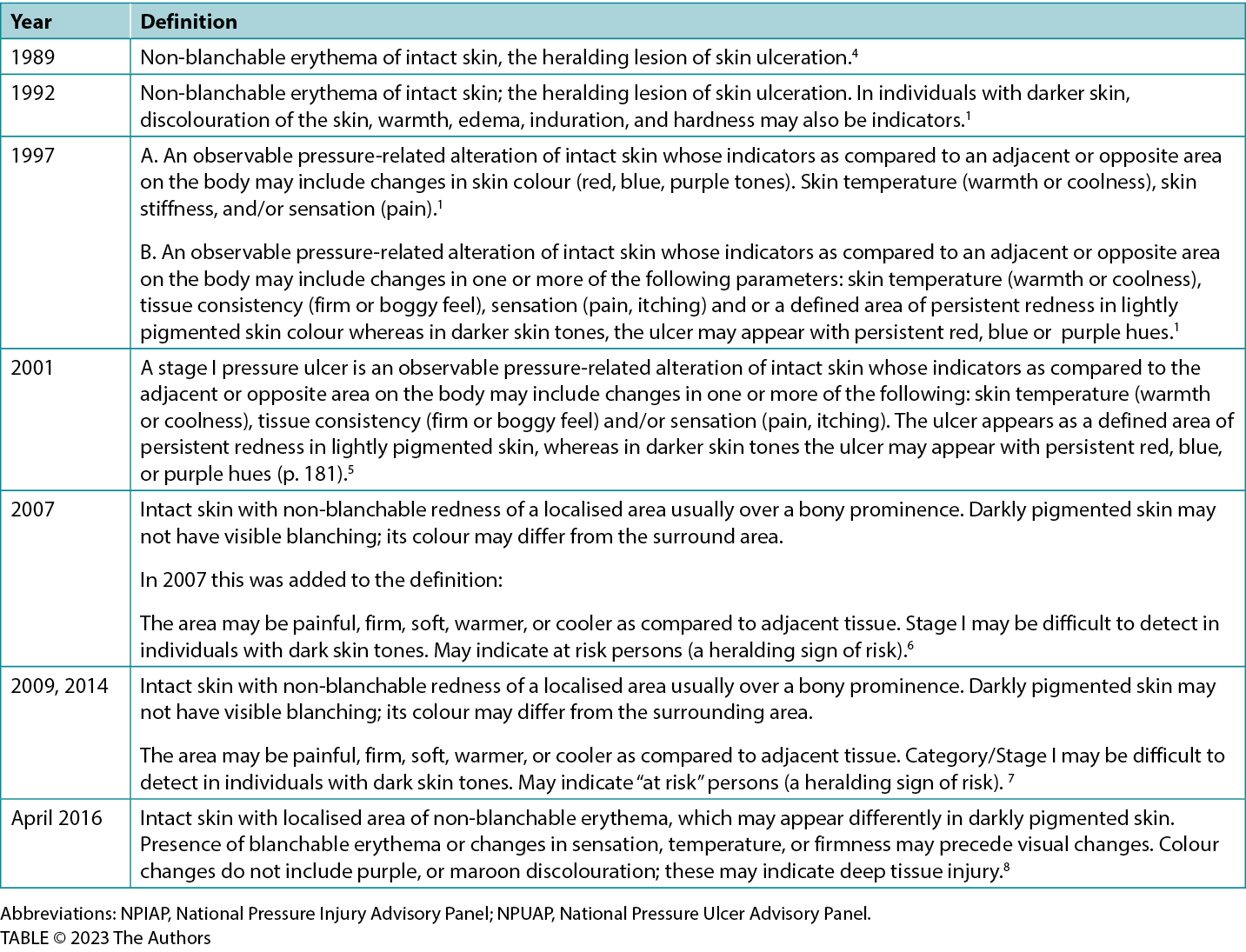
In the mid-1990s, clinicians and NPIAP board members recognised the need for the stage 1 definition to include how these PIs would appear in persons with dark skin tones.1 They noted that assessments that identify a stage 1 PI, such as “erythema” and “non-blanchable erythema,” were not always visible in patients with dark skin tones and, therefore, other indicators of stage 1 PI were needed. A task force was formed to address these issues.2,4
The NPIAP Task Force agreed on the following assumptions:20
- Intact skin has a variety of colour changes
- Very darkly pigmented skin does not have visible blanching
- The person’s race and ethnicity are not predictive of skin pigmentation
- Non-blanchable erythema only reflected one description of change in skin colour seen in early PI; it was not a universal descriptor
- Other objective findings of stage 1 PI could include temperature changes (warmth, coolness, edema, induration).
Table 1 lists the various iterations of the definition over the years.1,5,9,17,18,20
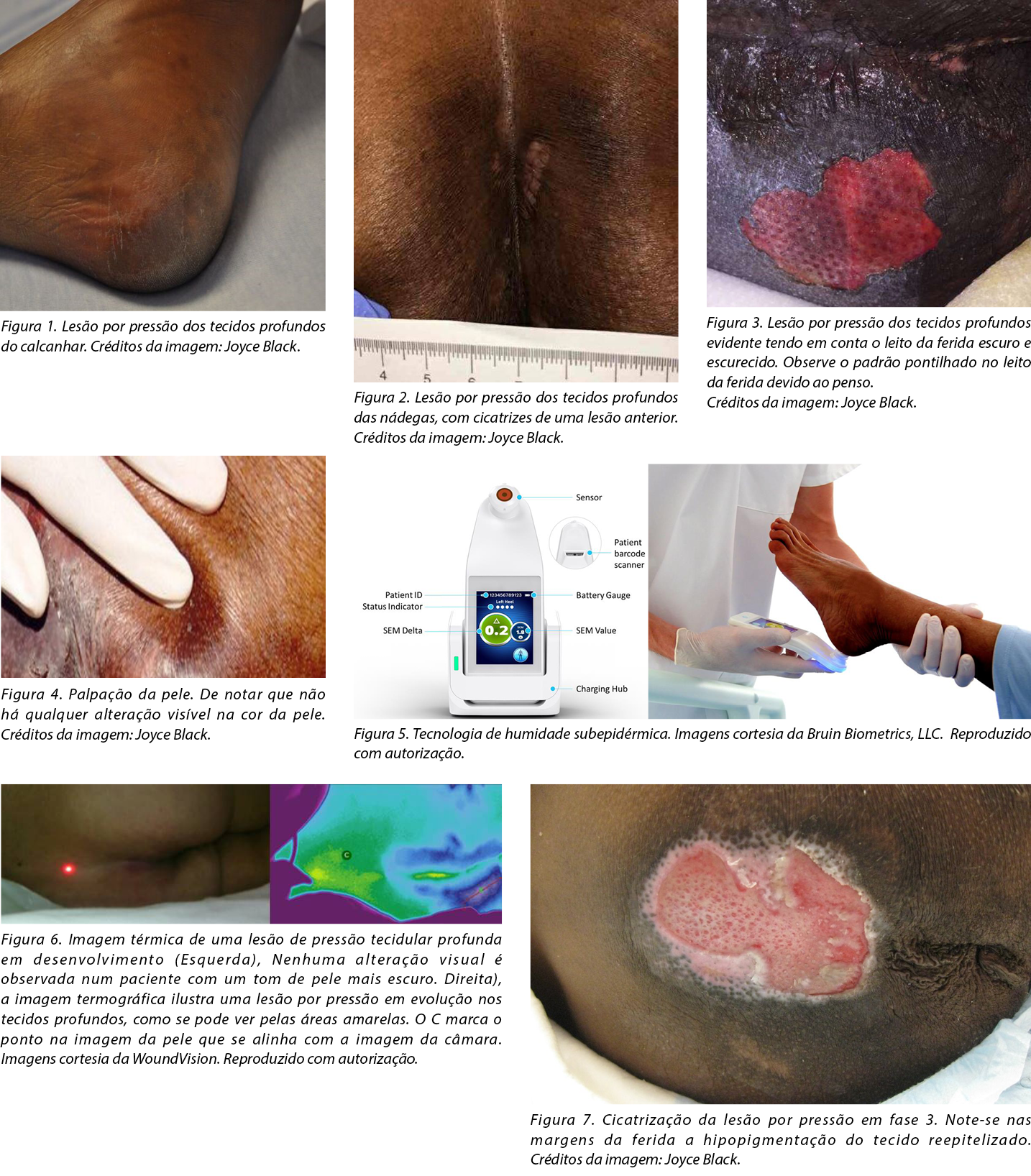
In 2005, the NPIAP identified deep tissue PIs (DTPIs). As with stage 1 PIs, DTPIs are difficult to detect in patients with dark skin tones (Figures 1-3).25 Other NPIAP initiatives that call attention to skin tone diversity include staging diagrams illustrating different skin colours/tones (available on the NPIAP website).
Table 1. Npuap/npiap stage 1 pressure injury definitions: historical evolution
Epidemiology of PIs in persons with dark skin tones
A limited number of studies have examined PI rates by race/ethnicity or skin tone in individuals admitted to acute care settings or long-term care facilities or residing in a nursing home. However, in a literature review of PIs in patients with dark skin tones, Gunowa and colleagues26 report that patients with dark skin tones are more likely to develop higher stage PIs regardless of the type of healthcare setting. The following discussion outlines what is known regarding the prevalence/incidence of PIs among patients with dark skin tones delineated by healthcare setting.
PIs among admissions to nursing homes
Using the Minimum Data Set (MDS) version 2.0, PIs (stage 2, 3 or 4) were present in 15% of older adults admitted to US nursing homes.27,28 Higher rates of PIs have been reported among Black individuals admitted to nursing homes. Approximately twice as many Black patients (16.6%) admitted to 59 nursing homes in Maryland had a PI compared with White patients (8.4%).29 In a national chain of nursing homes, Harms et al28 reported rates of PIs among older adults admitted to nursing homes by race and ethnicity (American Indian and Alaskan Native, Asian or Pacific Islander, Black not Hispanic, Hispanic, White not Hispanic). Black patients admitted to nursing homes had the greatest mean number of PIs per resident at 2.4 (SD, 2.2). The prevalences of stage 2, 3, or 4 PIs were lowest among White patients compared with all other racial and ethnic groups. The prevalence of a stage 1 PI among Black patients at admission was 7%, whereas stage 2 injury prevalence was 20%. Among all racial/ethnic groups, Black patients also had the highest prevalences of the most severe PIs at 7% (stage 3) and 8% (stage 4); White patients had the lowest prevalences at 3% for both stages.
PI prevalence among nursing home residents
Ahn et al30 found that among individuals residing in all US nursing homes, 8.4% had a PI, and 1.7% had a suspected DTPI.30 A greater percentage of Black residents (18.2%) compared with White residents (13.8%) had a PI in a set of nursing homes in New York.31 In a study examining differences in the prevalence of PIs among high-risk residents in US nursing homes over 5 years, PI prevalence decreased for both Black and White residents. However, there was a 5.4% overall unadjusted difference in PI prevalence (higher in Black patients).32 In a study examining the reporting of PIs by nursing homes using the MDS version 3.0, Chen et al33 found that the percentage of stage 4 PIs was higher among short-stay Black residents (50.4%) compared with White residents (40.8%).33 Black race was significantly associated with having a stage 2 to 4 PI (odds ratio [OR], 11.44; 95% CI, 1.44–1.47). Hispanic ethnicity was significantly associated with having a suspected DTPI (OR, 2.63; 95% CI, 1.47–1.58).
PI incidence in nursing homes
Cai et al31 found that Black residents in New York nursing homes were more likely to develop a PI during their stay than were White residents, controlling for other risk factors (OR, 1.203; P = .01).31 In another study, 7.7% of approximately 90,500 nursing residents developed stage 2 to 4 PIs after they were admitted to a nursing home. Black residents who developed a PI during their nursing home stay did so sooner than did White residents.34 The disparity in time to development of a PI among Black residents increased over time: The disparity was 3% at 3 months post-admission and grew to 5.8% at 6 months. During a 12-week surveillance in a nursing home in Pennsylvania, a greater percentage of Black residents (47%) developed a stage 2 to 4 PI than White residents (18%).35 Moreover, no stage 1 PIs were identified in Black residents.
PIs among hospitalised patients
Studies specifically examining PI prevalence and incidence in the acute care setting with a focus on racial distribution or patients with dark skin tones are scarce, with most studies conducted over a decade ago. In a large, multiyear prevalence study conducted between 1989 to 2005, Van Gilder and colleagues36 found the proportion of stage 1 PIs in patients with dark skin tones to be much lower (13%) than in those with medium (32%) to light (38%) skin tones. This finding may be attributed to difficulty in detection of stage 1 PIs in patients with dark skin. More severe PIs (stage 3, stage 4, eschar) were also found among patients with dark skin tones as compared with those with light or medium skin tones (11% vs 6-7%, 13% vs 6-7%, and 9% vs 5-6%, respectively). In a large, multiyear national study using the National Inpatient Sample (NIS) database from 2008 to 2012, Bauer and colleagues37 reported that among patients who identified as African American, PI rates were significantly higher than among all other racial groups at 2.4%; patients who identified as White had the second highest incidence reported at 1.8%. Moreover, the PI stage was more severe in African American patients (stage 3), whereas stage 2 was the most common stage among White patients.37
Using the NIS database from 2003, Fogerty and colleagues38 identified that African Americans were more likely to be discharged from US hospitals with PIs in comparison with non-African Americans (OR, 2.3; no CI provided). No analysis of PI stage was conducted in this investigation. A recent investigation conducted by Cox and Thomas-Hawkins39 echoes the results of these previous works. In this investigation of 17,781 patients with PIs using the 2018 Healthcare Cost and Utilization Project (HCUP) State-Specific Database (New Jersey), a higher proportion of patients identifying as Black had an admitting diagnosis of PIs (5.0% vs 3.5%; P < .05) as well as a higher proportion of stage 4 PIs (3.3% vs 2.3%) when compared to all other races combined. When secondary diagnoses of PIs were examined, Black patients had a significantly lower proportion of stage 1 PIs (4.7% vs 18%; P < .05) but a higher proportion of stage 4 PIs (28.7% vs 16.9%; P < .05) when compared to all other races combined. Limitations cited for this study include the single state nature of the data and a lack of multivariate analysis.
Collectively, this limited body of work highlights some important considerations with regard to PI reporting across healthcare settings. First, there is the paucity of recent studies that have considered or examined race or dark skin tones as a potential risk factor for PI development. This is important because the change in racial diversity across the US warrants investigation. Second, the similarities in PI rates across these limited studies are striking and may highlight the need for specific clinical and diagnostic tools in practice to identify impending PIs in patients with dark skin tones.
Anatomy and physiology of skin
The skin consists of two distinct layers: epidermis and dermis.40-43 The epidermis is cellular and avascular, consisting of 90% keratinocytes which synthesize the strong, water-insoluble structural protein, keratin. The epidermis protects from water loss, shear, friction, and toxic irritants. It also prevents invasion of bacteria and other pathogens by three mechanisms: 1) a mechanical barrier, 2) an acid mantle (pH, 4-6.6) suppressing bacterial growth, and 3) shedding of skin cells to minimize bioburden.
The epithelium is composed of five layers of cells: stratum corneum (SC), stratum lucidum, stratum granulosum, stratum spinosum, and stratum basale.40 Available evidence about epidermal layers with known differences in persons with dark versus light skin tones include the stratum corneum, stratum spinosum, and stratum basale.
The stratum basale is the deepest of the five layers of the epidermis.44 A basal cell is a stem cell that is a precursor of the keratinocytes of the epidermis. All keratinocytes are produced from this single layer of cells, which are constantly undergoing mitosis to produce new cells. As basal cells divide, one cell moves toward the surface and the other remains to continue reproduction.
In addition to basal cells, Merkel cells and melanocytes are also present in this layer. The Merkel cell functions as a receptor responsible for stimulating sensory nerves that the brain perceives as touch. Melanocytes produce the melanin pigment, which gives hair and skin its colour and protects living cells of the epidermis from ultraviolet radiation damage.
Differences in skin anatomy and physiology between dark and light skin tones
Pigmentation is the most obvious difference in the skin among racial groups.45 Racial variation is dependent on the quantity of melanin, amount of UV exposure, genetics, melanosome content, and type of pigments found in the skin. Four chromophores are responsible for the differences in colour found in human skin: hemoglobin, oxyhemoglobin, melanin, and carotenoids. Hemoglobin and oxyhemoglobin are responsible for the pinkish colour of white skin. Melanin accounts for the various brown shades in black and sun-tanned skin. Carotenes underlie yellow-orange pigmentation. Individuals with the most lightly pigmented skin have approximately half as much epidermal melanin as the most darkly pigmented skin types.
Differences in the SC have been reported between darkly pigmented skin (Fitzpatrick Classification Scale V and VI) and lightly pigmented skin (Fitzpatrick I/II/III).46 Darkly pigmented skin has more layers of corneocytes than lightly pigmented skin at a mean of 21.8 cells versus 16.7 cells, respectively. No differences have been reported in the size or thickness of the cells, although the cell layers in dark skin tones are thought to be more compact, reflecting greater intercellular cohesion. Although study results vary, the rate of spontaneous desquamation may be 2.5 times higher in persons with dark skin tones than those with lighter skin tones, accounting for the higher frequency of xerosis in individuals with dark skin tones.47 Differences in desquamation also vary by body site between individuals with dark versus light skin tones (eg, higher rates of desquamation of lightly pigmented skin on the cheeks and forehead).
Corneocyte size, quality, and phenotype are important because smaller cells usually correlate with epidermal (keratinocyte) hyperproliferation and development of dry skin from reduced lipid levels. Although study results vary, individuals with dark skin tones have the lowest levels of ceramides (lipid) at approximately 50% of the SC ceramide levels of individuals with lighter skin tones.2 Consequently, dark skin tones are linked to higher transepidermal water loss (TEWL) yielding lower water content (WC) of the SC. In addition, darkly pigmented skin has lower skin vascular reactivity to external factors (eg, vasodilators). Cumulatively, higher TEWL, lower WC, and reduced thermoregulatory skin response heighten the vulnerability of individuals with dark skin tones to PI development.48 Although studies are inconclusive, reduced vascular reactivity also may hinder visualization of blanching erythema of stage 1 PIs.
Gefen proposes a mechanical strain model for dark SC.48 Reduced WC in the SC may increase SC stiffness, resulting in less effective dispersion of friction and greater mechanical stress. Thus, a vicious cycle of shear damage occurs in persons with dark SC leading to progressive increases in TEWL. The WC in dark damaged SC decreases with increasing TEWL, further elevating mechanical stress concentrations. As TEWL increases, the skin becomes drier and more inflamed, heightening risk of skin injury from pressure, shear, and friction.
Skin tone assessment and measurement
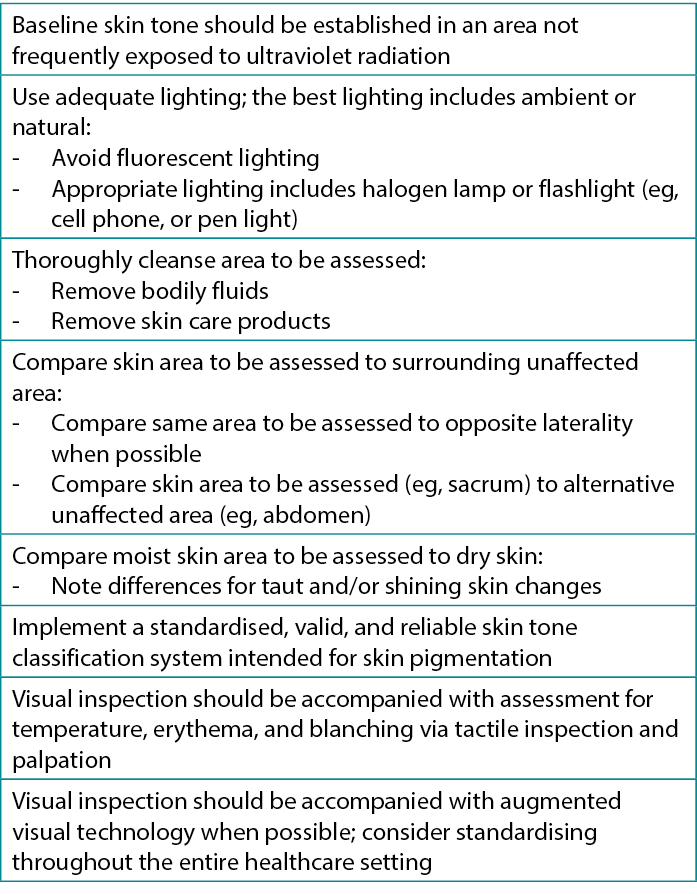
Variations in skin pigmentation, condition (dry or moist), and temperature; the presence of fluid or products; the visual acuity of the observer; and lighting are some of the factors that can influence the subjective nature of skin assessments performed by clinicians.49 Visual inspection of skin changes related to pressure, such as blanching, redness, or erythema is complemented by touch and technology (Figure 4).50,51 However, for visual inspection practices, standardization in terms and technique is key to ensure consistency among various clinician assessments. It is important to note that visual inspection alone is unreliable.22,51 Table 2 provides key information on visual assessment for diverse skin tones to assist clinicians in identifying early skin changes.22,52,53
Table 2. Visual skin assessment for diverse skin tones22,54
Skin tone classification scales
Classification of skin colour was often previously based on self-reported ethnicity and race. Colour categories based on observers’ descriptions have not been widely systematised. The use of classification scales offers some regularity; however, the function is varied. In addition to the validity and scientific rigor in the development and design of the scales, the effectiveness of classification models is dependent on individual competence and inter-rater reliability, which varies from setting to setting. These scales offer a constitutive (baseline) skin colour, facultative skin colour (sun or UV exposure), and PI-induced change in skin colour.22,54
The Fitzpatrick Classification Scale was developed to identify complexion and tolerance to sunlight and designed as a measure of sun sensitivity.22,53-57 The Fitzpatrick Scale is not reliable when evaluating skin exposed to UV radiation (environmental factors) and would be best used to assess skin not exposed.
The Munsell Colour System (MCS), designed by an artist for painting, describes qualities of hue, lightness (value), and intensity (chroma), and was initially used in soil research.58 In healthcare settings, this scale has undergone minimal validity and reliability testing despite its use in skin tone assessments.53,57,59
The Massey-Martin Scale (MMS), also known as the New Immigrant Survey (NIS) Skin Colour Scale, is a skin tone survey instrument designed for skin tone observation.53,60 The initial instructions for use avoided the comparison of the pictorial guide to the person’s skin side-by-side, as this was intended for social surveys conducted in person (by memory for the observer) or by phone (results indicated as unknown).
The Skin Tone Colour Scale (STCS) system by Konishi et al59 was designed based on the MCS and is intended for skin and lesion tone assessment. The system is vast in the selection of diverse skin tones making it the most comprehensive classification available to clinicians.
Overall, current terms to describe skin colour tone are subjective, imprecise, non-standardised, and can have offensive connotations. Visual assessment scales, such as the Munsell61,62 and Fitzpatrick scales,63 which use images of skin colour tones are limited in that they cannot represent the full range of tones among individuals or even between body locations of the same individual in a feasible and useful way.
Recognising these problematic issues of assessing skin colour tone, the British Association of Dermatologists (BAD) recommended that terminology about skin colour tone be neutral, based on objective measurements, and reflective of multiethnic populations.6,64 The most objective measure is via genetically established skin tone by melanogenesis. Pigmentation presents where melanocyte cells produce melanin in the skin. Dadzie et al6 and BAD proposed the use of eumelanin pigment nomenclature for skin tone description and developed the Eumelanin Human Skin Colour Scale (ESCS) specifically for visual skin assessment. The scale is based on and named after eumelanin, which comprises 90% of the pigment found in human skin. The ESCS has five categories of melanin index that is measured by light reflectance: eumelanin low (<25), eumelanin intermediate low (25-<50), eumelanin intermediate (50-<75), eumelanin intermediate high (75-<100), and eumelanin high (≥100).6 There are small, lightweight, portable, easy-to-use instruments for measuring melanin index. The ESCS has potential for use in classifying outcomes of PIs such as incidence and healing and monitoring for disparities/inequities.
Early visual detection technologies and dark skin tones
In individuals with dark skin tones, it is especially challenging to visually identify early skin changes that may herald an impending PI. The use of augmented visual technologies such as subepidermal moisture (SEM) assessment technology and long wave infrared technology (LWIT) hold promise for early identification of skin and tissue changes before they are visible to the naked eye. Thus, use of these technologies may create a window of opportunity for targeted interventions before the visible and tactile manifestations of tissue damage occur.65 Absent these technologies, this window is invisible to direct care clinicians. The subclinical nature of developing PIs has resulted in diagnostic latency, which then contributes to interventional latency. In individuals with dark skin tones, this lag results in a higher probability of PIs remaining undetected.66 Early detection technologies may help resolve this problem.
SEM technology
Subepidermal moisture assessment technology is based on the contemporary understanding of PI etiology (Figure 5).67,68 The onset of microscopic damage in the early development of PIs and DTPIs is consistent regardless of skin pigmentation. Cell and tissue damage triggered by sustained pressure, shear, and friction signal acute inflammatory responses. As the level of tissue damage increases, so does the inflammatory response.67 This immune response results in interstitial edema. Localised edema or SEM is one of the earliest indicators of nonvisible pressure damage. The ICD-10 coding for stage 1 PIs characterizes this early damage as ‘pre-ulcer skin changes limited to persistent focal edema.’69 This subclinical progression of tissue damage is further described in the etiology chapter of the 2019 clinical practice guidelines for the prevention and treatment of PIs.51
The SEM scanner device is FDA approved as a PI management tool and is indicated for adults of all skin tones at risk of PI development. The noninvasive point-of-care device detects persistent focal edema and reports the results as a SEM delta (∆) value (Figure 1). The SEM assessment technology measures changes in SEM between healthy and inflamed tissue.70 Increased SEM values may indicate an anatomy-specific increased risk for PI development in all skin tones.68
Meta-analyses from systematic reviews report early detection of PI development via SEM assessments by a median of 5 days before visual assessments (P ≤ .001).71,72 In a dual-arm study of 175 participants (n = 48/175, non-White), SEM assessments reported a diagnostic sensitivity and specificity of 86.8% and 88% in detecting PIs, resulting in an area-under-the-curve significantly exceeding clinical judgement (P < .0001).70 In a cohort study, SEM assessments detected developing stage 1 PIs 1 week earlier than a visible diagnosis of a stage 1 erythema (OR, 5.3; CI 1.87-15.11; P < .001) in individuals with dark skin tones (n = 11/66).73 In a multi-ethnic clinical study, SEM measurements were statistically significant in detecting concurrent and future stage 1 PIs and DTPIs in both heels in residents with dark skin tones as per Munsell value (n = 68/417; P < .001).74 An observational study of 15 patients (n = 4/15, Fitzpatrick type III and above) reported early indication of tissue damage based on SEM measurements that agreed with a later confirmation of suspected DTPIs via ultrasound-based identification of hypoechoic lesions and visual assessments.75 In a retrospective study of 69 patients in surgical intensive care, nurses indicated SEM assessments enabled more accurate skin assessments in patients with dark skin tones (n = 29/69).76
Long-Wave Infrared Thermography device
Long-wave infrared thermography (LWIT) is a noninvasive, multimodal device for use in clinical environments. It incorporates LWIT with a camera to detect PIs before visual or tactile changes occur. The device assesses changes in skin temperature because localised heat, edema, and changes in tissue consistency are all typical warning signs for PI development.77 The device can be useful in patients with light or dark skin tones. It is particularly helpful in detecting DTPIs, which can remain undetected on the skin for up to 72 hours (Figure 6).9,78 This feature is particularly important for patients with dark skin tones because dark skin pigmentation can mask the typical deep colours of purple and maroon that serve as the heralding visual signs for a DTPI.
As a combination photographic and LWIT device, it uses two imaging modalities by measuring long-wave infrared radiation (energy emitted from the human body) to create the final digital images. The energy, or lack thereof, is created from blood flow, perfusion, and, ultimately, metabolic activity. The device uses a relative temperature differential to compare the environmental temperature with the adjacent skin temperature and adapts for intrinsic and extrinsic factors (eg, elevated core body temperature, room temperature). A cooler temperature in comparison with the adjacent skin indicates less perfusion and deeper ischemic damage; warmer temperatures indicate increased metabolic activity and inflammation.
The reliability and validity of using LWIT to detect PIs have been confirmed in several studies.79-84 The 2019 International Pressure Injury Prevention and Treatment Clinical Practice Guideline identified thermography as an area of high research priority.85
Pi prevention in persons with dark skin tones
Pressure injury prevention is rooted in both risk assessment and routine, comprehensive skin and soft tissue assessment.51 Current evidence-based prevention practices apply to persons with dark skin tones and should be implemented.51,86 Because early PI detection is challenging in patients with dark skin tones, the identification of a later stage PI stage (at the time of discovery), has been reported when compared to lighter pigmented persons.87 Incorporating enhanced skin assessment techniques and visual augmentation devices into clinical practice should be a considered to enhance PI prevention in an effort to close the gap in early-stage identification.
PI treatment and healing in persons with dark skin tones
The process of healing a PI includes hemostasis, inflammation, proliferation, and maturation involving numerous molecular mechanisms.88,89 Healing is influenced by a patient’s clinical factors and treatments received. In patients with dark skin tones, healing PIs and especially the surrounding skin may appear differently to clinicians than in patients with lighter skin tones. For example, hypopigmentation of newly re-epithelialised tissue may be visible at the wound margins of a healing full thickness PI in patients with dark skin tones. (Figure 7). Although a few studies have reported differences and disparities in the prevalence or incidence of PIs by race or ethnicity,32,90 studies focused on the healing of PIs are far less common. Bliss et al91 analysed a nation-wide dataset of MDS records of older adults admitted to nursing homes. Of 10,862 older (65+ years) individuals admitted to a nursing home with a PI, 44% had healed by 90 days. However, there was a significant overall disparity of 6% in the healing of PIs (stages 2 to 4) present on admission at the required 90-day assessment among Black residents. In a study reporting on time to PI development during nursing home stays,90 99% of all residents with a PI received treatment for it, thus no disparity was found in the number of treatments by race or ethnic group. However, in other healthcare settings, such as acute care or the home care setting, there is a lack of evidence regarding disparities with regard to PI healing rates and treatment among patients with dark skin tones.

Social determinants of health
The impacts of SDOH on PI development and treatment are largely understudied and, thus, unknown. The US Department of Health and Human Services defines SDOH within five domains: economic stability, education access and quality, healthcare access and quality, neighborhood and built environments, and social and community context.92 Examination of these domains reveals potential health disparities and inequities across racial groups. Overall, people of colour have been disproportionately affected by and fare worse within all domains of SDOH compared with White individuals.93 Communities in Action: Pathways to Health Equity states that health equity is crucial for the well-being of communities.94 Although large gains have been made in healthcare coverage across racial/ethnic groups under the Affordable Care Act, people of colour remain more likely to be uninsured.94 Disparities exist with regard to income as well. In 2021, higher median incomes were reported for households headed by Asian or White individual, whereas households headed by persons identifying as Black or Hispanic reported median incomes lower than the national median.95
In two studies focused on PI development and the impact of race, elements of SDOH (economic stability and healthcare access and quality) were operationalised through patients’ income based on zip code of residence and health insurance payor status. Using the NIS database in 2009, Fogerty and colleagues38 identified an increased risk for PIs among African Americans insured by Medicare and Medicaid compared with Caucasians. With regard to income, a higher proportion of African Americans were found in the lower income quartiles (50.6%) than Caucasians (21.4%). However, in multivariate analysis, the researchers reported no significant differences between races for PI risk based on either payor status or income. Cox and Thomas-Hawkins39 reported a significantly higher proportion of Black individuals with PIs insured with Medicaid compared with patients with PIs from all other racial groups combined using 2018 HCUP state level data from New Jersey. With regard to income, reported by quartiles based on zip code of residence, a statistically significant higher proportion of Black persons with PIs resided in the lower income zip code quartiles and a lower proportion at the upper zip code income quartiles. In their sample, over 50% of Black patients with PIs lived in areas with reported incomes of $58,999 or less as compared with 19% of all other races combined. No multivariate analysis was conducted in this study. In a recent scoping review of the impact of SDOH on PI progression, Sasson and colleagues96 found that detriments in SDOH related to food scarcity (as identified through ICD-10 codes) and Black race were both significant, independent predictors of longer PI duration.96
Two recent national reports have validated the health inequities experienced by patients with dark skin tones who have PIs. In 2021, the Urban Institute reported that Black patients in the US were 31.9% less likely to be admitted to hospitals considered high quality with regard to PI prevention.97 Moreover, an Agency for Healthcare Research and Quality Disparities Report in 2019 identified that for both short- and long-stay nursing home patients, poorer quality of care associated with PIs was found among Black patients as compared with Whites patients.98 It is plausible that the development or worsening of a PI is influenced by access to quality healthcare, and this may play a pivotal role in the higher rates of PIs among Black patients. Without access to evidence-based prevention or treatment modalities, the ability to prevent a PI or facilitate wound healing is compromised. At this time, the extent of this disparity has not been studied and is unknown. This is an area in need of further exploration.
Clinician education and skin assessment in dark skin tones
Inaccurate skin assessment and lack of knowledge of PI appearance in dark skin tones can delay early identification and treatment, resulting in more severe PIs and financial penalties to the healthcare organization.99 Health inequities and racial disparities occur when healthcare professionals, whether through explicit or implicit biases, fail to adequately assess, identify, and prevent PIs in people of colour who are at risk of a PI.100,101 Inaccurate skin assessment can also occur because of the difficulty of visualising skin colour changes and discolourations in people with dark skin tones. Education provided to nurses and other clinicians related to assessment of people with diverse skin colours is sadly lacking.
As nurses, our reputation among the public is one of honesty, trust, and caring. Nurses have been ranked as the most honest and ethical of professions for more than 20 consecutive years.102 Yet, often nursing students emerge from our education programs not adequately prepared to understand the consequences of SDOH and the emphasis on providing safe and equitable care across the diverse populations we serve. Despite widespread goals to include diversity, equity, and inclusion and SDOH into nursing education curricula, whether this has been accomplished is uncertain.99 Recent evidence demonstrates there is a health disparity in undergraduate nurse education with education directed toward people with pale skin tones.99 Oozageer and colleagues99 conducted a documentary and observational study of nursing education and lectures on PIs at five undergraduate nursing programs in England. The investigators found an overwhelming focus on PIs in people with Caucasian skin tones with only brief, superficial information on people with dark skin tones.99 In a qualitative study in these five nursing education programs using focus groups, the investigators found a predominant theme of White normativity. Specifically, the investigators identified a dominance of Whiteness in the teaching about PIs and the implications for student nurses of Whiteness as the norm.99
In 2023, Pittman and Black103 examined health equity in nursing education textbooks, specifically examining physical assessment textbooks’ skin and integument content relevant to skin colour tones. Using a convenience sampling of physical assessment textbooks for undergraduate and graduate level nursing programs, the investigators modified Oozageer’s Diversity Observation Teaching Tool (DOTT) with permission to better fit their project aims. The textbooks’ content (ie, Integument/Skin Chapter) were reviewed independently, then data were reviewed for consistency or differences. Each investigator also explored their university’s simulation lab for evidence of diversity in manikin skin colour tones. Of the nine textbooks and 11 chapters, no chapter objectives included skin tone diversity. Six of the nine textbooks had visual descriptors of PI, including stages. However, of the six textbooks with photos, only three had photos with dark skin tones. The textbooks had 534 photos of various skin graphics or images but of those, only 35 (7%) were of dark skin tones. Conversely, 499 (93%) of the 534 images were of light skin tones. Both universities had simulation labs with 60 to 65% of the manikins having light skin tones and 35 to 40% having dark skin tones. However, it is not known if skin tone is discussed in the simulation scenarios. These findings support those of Oozageer and colleagues and demonstrate the lack of education regarding skin tone diversity that nursing students receive.
Conclusions
Racial disparities exist with regard to PI development and healing, especially highlighted among patients with dark skin tones. This article explored the current state of the science and identified gaps in the terms used to describe skin colour, making any data-based comparisons and trending impossible. With increasing racial diversity in the United States, including persons of mixed ethnic and racial backgrounds, the “race” of a patient should no longer be used as a demographic term or a risk factor for PIs. Skin tone colour must be more standardised and quantifiable in clinical education, practice, and research. In the face of a more racially diverse country in the upcoming decades, the ability to identify and treat developing PIs earlier will improve the quality of life for all patients. This work is urgently needed and support from private and governmental agencies is essential.
Conflict of Interest
The authors declare no conflicts of interest.
Funding
The authors received no funding for this study.
Perspetivas atuais sobre lesões por pressão em pessoas com tons de pele escuros por parte do Painel Consultivo Nacional de Lesões por Pressão
Joyce Black, Jill Cox, Virginia Capasso, Donna Z Bliss, Barbara Delmore, Vignesh Iyer, Jacqueline Massaro, Cassendra Munro, Joyce Pittman, Elizabeth A Ayello
DOI: https://doi.org/10.33235/wcet.43.3.18-29
Sumário
Antecedentes O desenvolvimento de lesão por pressão (PI) é multifatorial. Em pacientes com tons de pele escuros pode ser especialmente difícil a identificação de PIs iminentes através da avaliação visual da pele. Continua a aumentar a necessidade de melhorar as técnicas de avaliação da pele, especialmente para pessoas com tons de pele escuros. Do mesmo modo e nos últimos anos, tem-se verificado uma maior sensibilização para a necessidade de inclusão nos materiais educativos no que respeita à representação de diversas cores/tons de pele.
Objetivo Fornecer perspetivas atuais da literatura sobre a avaliação da pele e o desenvolvimento de PI em pacientes com tons de pele escuros.
Métodos Os seguintes elementos serão discutidos através do prisma do tom de pele: 1) Perspetivas históricas das etapas das lesões por pressão do Painel Consultivo Nacional de Lesões por Pressão, 2) Epidemiologia da PI, 3) Anatomia e fisiologia da pele, 3) Avaliação e medição do tom da pele, 4) Modalidades de avaliação visual aumentada, 5) Prevenção das lesões por pressão, 6) Cicatrização das lesões por pressão, 7) Determinantes sociais da saúde e 8) Lacunas na formação dos médicos.
Conclusões Esta revisão realça a lacuna no nosso conhecimento clínico relativamente às Pis em pacientes com tons de pele escuros. As disparidades raciais no que diz respeito ao desenvolvimento e à cicatrização das PI são especialmente evidentes nos pacientes com tons de pele escuros. A avaliação da cor do tom de pele deve ser normalizada e quantificável, tando no ensino clínico, como na prática e na investigação. Este trabalho é necessário de um modo urgente e o apoio de agências privadas e governamentais é essencial.
Introdução
A diversidade racial nos Estados Unidos aumentou nas últimas duas décadas. O US Census Bureau refere que o índice global de diversidade aumentou de 54,9% em 2010 para 61,1% em 2020, prevendo-se que continue a aumentar na próxima década.1 Em todo o mundo, as pessoas com tons de pele escuros constituem a maioria da população.2
Nos últimos 20 anos, tem havido uma crescente consciencialização e interesse na necessidade de uma avaliação da pele que inclua todas as pessoas, independentemente da sua cor de pele.3-24 A realidade clínica é que, nos EUA e em todo o mundo, a demografia do tom de pele mudou e a consciência das várias cores de pele aumentou, pelo que a necessidade de uma avaliação e de um diagnóstico exatos da pele para todos os pacientes assumiu uma grande urgência. Além disso, também aumentou nos últimos anos a sensibilização para a necessidade de incluir diversas cores/tons de pele em materiais didáticos (formação profissional básica e contínua) para estudantes e clínicos.13
Neste artigo, os autores descrevem as perspetivas atuais sobre as lesões por pressão (PIs) em pacientes com tons de pele escuros. A primeira secção aborda os esforços históricos do Painel Consultivo Nacional de Lesões por Pressão (NPIAP; formalmente NPUAP) para resolver esta disparidade e rever as definições das etapas de forma que sejam relevantes para todos os tons de pele. Outros tópicos abordados através do prisma do tom de pele incluem a epidemiologia das PIs, anatomia e fisiologia da pele, técnicas e modalidades de avaliação visual e aumentada da pele, prevenção e cura de PI, considerações sobre os determinantes sociais da saúde (SDS) e lacunas na formação profissional.
Perspectivas históricas sobre as etapas das pi em pessoas com tons de pele escuros
Em meados da década de 1990, os médicos e os membros da direção da NPIAP reconheceram a necessidade de a definição da fase 1 incluir a forma como estas PIs apareceriam em pessoas com tons de pele escuros.1 Observaram que as avaliações que identificam uma PI em fase 1, como o "eritema" e o "eritema não branqueável", nem sempre eram visíveis em pacientes com tons de pele escuros e, por isso, eram necessários outros indicadores de PI em fase 1. Foi criado um grupo de trabalho para abordar estas questões.2,4
O Grupo de Trabalho NPIAP concordou com os seguintes pressupostos:20
- A pele intacta apresenta várias alterações de cor
- A pele com pigmentação muito escura não apresenta um branqueamento visível
- A raça e a etnia da pessoa não são indicativas da pigmentação da pele
- O eritema não branqueável refletia apenas uma descrição da alteração da cor da pele observada no início da PI; não era um descritor universal
- Outras evidências objetivas da fase 1 da PI podem incluir alterações de temperatura (calor, frio, edema, endurecimento).
No Tabela 1 são enumeradas as várias iterações da definição ao longo dos anos.1,5,9,17,18,20
Em 2005, o NPIAP identificou as PIs de tecidos profundos (DTPIs). Tal como acontece com as Pis de estádio 1, as DTPIs são difíceis de detetar em pacientes com tons de pele escuros (Figuras 1-3).25 Outras iniciativas da NPIAP que chamam a atenção para a diversidade de tons de pele incluem diagramas de etapas que ilustram diferentes cores/tonalidades de pele (disponíveis no website da NPIAP).
Tabela 1. Definições de lesões por pressão em fase 1 da Npuap/npiap: evolução histórica

Epidemiologia das pis em pessoas com tons de pele escuros
Um número limitado de estudos examinou as taxas de PI por raça/etnia ou por tom de pele em indivíduos admitidos em ambientes de cuidados intensivos ou em instalações de cuidados prolongados ou a residir num lar de idosos. No entanto, numa revisão da literatura sobre as PIs em pacientes com tons de pele escuros, Gunowa e colegas26 referem que os pacientes com tons de pele escuros são mais propensos a desenvolver PIs em fases mais avançadas, independentemente do tipo de contexto de cuidados de saúde. A discussão que se segue descreve o que se sabe sobre a prevalência/incidência de PIs entre os pacientes com tons de pele escuros, delineados por contexto de cuidados de saúde.
PIs entre os internamentos em lares de idosos
Utilizando o Conjunto Mínimo de Dados (MDS) versão 2.0, as Pis (fases 2, 3 ou 4) estavam presentes em 15% dos idosos internados em lares de idosos nos EUA.27,28 Foram registadas taxas mais elevadas de PIs entre os indivíduos de raça negra internados em lares de idosos. Aproximadamente o dobro dos pacientes de raça negra (16,6%) internados em 59 lares de idosos em Maryland tinham uma PI, em comparação com os pacientes de raça branca (8,4%).29 Numa cadeia nacional de lares de idosos, Harms et al28 comunicaram as taxas de PIs entre os idosos internados em lares de idosos por raça e etnia (índios americanos e nativos do Alasca, asiáticos ou das ilhas do Pacífico, negros não hispânicos, hispânicos, brancos não hispânicos). Os pacientes de raça negra internados em lares de idosos registaram o maior número médio de PIs por residente, 2,4 (DP, 2,2). As prevalências de PIs em fase 2, 3 ou 4 foram mais baixas entre os pacientes brancos em comparação com todos os outros grupos raciais e étnicos. A prevalência de uma PI em fase 1 entre os pacientes negros em internamento foi de 7%, enquanto a prevalência de lesões em fase 2 foi de 20%. Entre todos os grupos raciais/étnicos, os pacientes de raça negra também registaram as prevalências mais elevadas das PIs mais graves, com 7% (fase 3) e 8% (fase 4); os pacientes de raça branca registaram as prevalências mais baixas, com 3% em ambas as fases.
Prevalência de PI em residentes de lares de idosos
Ahn et al30 verificaram que, entre os indivíduos residentes em todos os lares de idosos dos EUA, 8,4% apresentavam uma PI e 1,7% apresentavam uma suspeita de DTPI.30 Uma maior percentagem de residentes negros (18,2%) em comparação com os residentes brancos (13,8%) apresentavam uma PI num conjunto de lares de idosos em Nova Iorque.31 Num estudo que examinou as diferenças na prevalência de PI entre residentes de alto risco em lares de idosos dos EUA ao longo de 5 anos, a prevalência de PI diminuiu tanto para os residentes negros como para os brancos. No entanto, verificou-se uma diferença global não ajustada de 5,4% na prevalência de PI (mais elevada nos pacientes de raça negra).32 Num estudo que examinou a comunicação de PIs pelos lares de idosos utilizando a versão 3.0 do MDS, Chen et al33 verificaram que a percentagem de PIs de fase 4 era mais elevada entre os residentes de raça negra de curta duração (50,4%) em comparação com os residentes de raça branca (40,8%).33 A raça negra foi significativamente associada à existência de PI em fase 2 a 4 (rácio de probabilidade [OR], 11,44; IC 95%, 1,44-1,47). A etnia hispânica foi significativamente associada a uma suspeita de DTPI (OR, 2,63; IC 95%, 1,47-1,58).
Incidência de PI em lares de idosos
Cai et al31 descobriram que os residentes negros em lares de idosos de Nova Iorque tinham maior probabilidade de desenvolver uma PI durante a sua estadia do que os residentes brancos, controlando para outros fatores de risco (OR, 1,203; P = 0,01).31 Noutro estudo, depois de terem sido admitidos num lar de idosos, 7,7% de aproximadamente 90.500 residentes em lares de idosos desenvolveram PIs em fase 2 a 4. Os residentes negros que desenvolveram uma PI durante a sua permanência no lar de idosos fizeram-no mais cedo do que os residentes brancos.34 A disparidade no tempo de desenvolvimento de uma PI entre os residentes negros aumentou com o tempo: A disparidade era de 3% aos 3 meses após a admissão e aos 6 meses aumentou para 5,8%. Durante uma vigilância de 12 semanas num lar de idosos na Pensilvânia, uma maior percentagem de residentes negros (47%) desenvolveu uma PI em fase 2 a 4 do que os residentes brancos (18%).35 Além disso, não foram identificadas PIs em fase 1 em residentes negros.
PIs em pacientes hospitalizados
São escassos os estudos que examinam especificamente a prevalência e a incidência de PI no contexto dos cuidados intensivos, com enfoque na distribuição racial ou nos pacientes com tons de pele escuros, sendo que a maioria dos estudos foi realizada há mais de uma década. Num grande estudo de prevalência plurianual efetuado entre 1989 e 2005, Van Gilder e colegas36 verificaram que a proporção de PIs em fase 1 em pacientes com tons de pele escuros era muito mais baixa (13%) do que nos pacientes com tons de pele médios (32%) a claros (38%). Este resultado pode ser atribuído à dificuldade de deteção de PIs em fase 1 em pacientes com pele escura. Foram também encontradas PIs mais graves (estádio 3, estádio 4, escara) nos pacientes com tons de pele escuros em comparação com os de tons de pele claros ou médios (11% vs. 6-7%, 13% vs. 6-7% e 9% vs. 5-6%, respetivamente). Num grande estudo nacional plurianual que utilizou a base de dados National Inpatient Sample (NIS) efetuado entre 2008 e 2012, Bauer e colegas37 referiram que, entre os pacientes que se identificaram como afro-americanos, as taxas de PI eram significativamente mais elevadas do que entre todos os outros grupos raciais, com 2,4%; os pacientes que se identificaram como brancos tiveram a segunda incidência mais elevada, com 1,8%. Além disso, a fase de PI foi mais grave nos pacientes afro-americanos (fase 3), enquanto a fase 2 foi a fase mais comum entre os pacientes brancos.37
Utilizando a base de dados NIS de 2003, Fogerty e colaboradores38 identificaram que os afro-americanos tinham mais probabilidades de receber alta dos hospitais dos EUA com PIs do que os não afro-americanos (OR, 2,3; sem IC). Neste inquérito não foi efetuada qualquer análise da fase PI. Uma investigação recente conduzida por Cox e Thomas-Hawkins39 faz eco dos resultados destes trabalhos anteriores. Nesta investigação de 17.781 pacientes com PIs usando o banco de dados específico do Estado (New Jersey) do Healthcare Cost and Utilization Project (HCUP) de 2018, uma proporção maior de pacientes que se identificam como negros teve um diagnóstico de admissão de PIs (5,0% vs 3,5%; P < 0,05), bem como uma proporção maior de PIs em fase 4 (3,3% vs 2,3%) quando comparados a todas as outras raças combinadas. Quando foram examinados os diagnósticos secundários de PIs , os pacientes negros tinham uma proporção significativamente menor de PIs em fase 1 (4,7% vs. 18%; P < 0,05), mas uma proporção maior de PIs em fase 4 (28,7% vs. 16,9%; P < 0,05) quando comparados com todas as outras raças combinadas. As limitações citadas para este estudo incluem a natureza de os dados serem provenientes de um estado único e a falta de análise multivariada.
Coletivamente, este conjunto limitado de trabalhos destaca algumas considerações importantes no que diz respeito à comunicação de PI em contextos de cuidados de saúde. Em primeiro lugar, existe uma escassez de estudos recentes que tenham considerado ou examinado a raça ou os tons de pele escuros como um potencial fator de risco para o desenvolvimento de PI. Isto é importante porque a mudança na diversidade racial nos EUA merece ser investigada. Em segundo lugar, as semelhanças nas taxas de PI nestes estudos limitados são impressionantes e podem realçar a necessidade de ferramentas clínicas e de diagnóstico específicas para, na prática, identificar as PIs iminentes em pacientes com tons de pele escuros.
Anatomia e fisiologia da pele
A pele é constituída por duas camadas distintas: epiderme e derme.40-43 A epiderme é celular e avascular, sendo constituída por 90% de queratinócitos que são responsáveis pela síntese da queratina, uma proteína estrutural forte e insolúvel em água. A epiderme protege contra a perda de água, o cisalhamento, a fricção e os irritantes tóxicos. Também previne contra a invasão de bactérias e de outros agentes patogénicos através de três mecanismos: 1) uma barreira mecânica, 2) um manto ácido (pH, 4-6,6) que impede o crescimento bacteriano, e 3) a libertação de células da pele para minimizar a carga biológica.
O epitélio é composto por cinco camadas de células: estrato córneo (SC), estrato lúcido, estrato granuloso, estrato espinhoso e estrato basal.40 As evidências disponíveis relativas às camadas epidérmicas com diferenças conhecidas em pessoas com tons de pele escuros e claros incluem o estrato córneo, o estrato espinhoso e o estrato basal.
O estrato basal é a mais profunda das cinco camadas da epiderme.44 Uma célula basal é uma célula estaminal e que é um precursor dos queratinócitos da epiderme. Todos os queratinócitos são produzidos a partir desta camada única de células, as quais estão constantemente a sofrer mitoses para produzir novas células. Quando as células basais se dividem, uma das células desloca-se para a superfície e a outra permanece para continuar a reprodução.
Para além das células basais, também estão presentes nesta camada as células de Merkel e os melanócitos. A célula de Merkel tem o papel de funcionar como um recetor responsável pela estimulação dos nervos sensoriais que o cérebro perceciona como toque. Os melanócitos produzem o pigmento melanina, que dá cor ao cabelo e à pele e protege as células vivas da epiderme dos danos causados pela radiação ultravioleta.
Diferenças na anatomia e fisiologia da pele entre tons de pele claros e escuros
Entre grupos raciais, a pigmentação é a diferença mais óbvia na pele.45 A variação racial depende da quantidade de melanina, da quantidade de exposição aos raios UV, da genética, do conteúdo de melanossomas e ainda do tipo de pigmentos encontrados na pele. Quatro cromóforos são os responsáveis pelas diferenças de cor encontradas na pele humana: a hemoglobina, a oxihemoglobina, a melanina e os carotenóides. A hemoglobina e a oxihemoglobina são os responsáveis pela cor rosada da pele branca. A melanina é a responsável pelos vários tons castanhos da pele negra e bronzeada. Os carotenos estão na base da pigmentação amarelo-alaranjada. Os indivíduos com a pele ligeiramente pigmentada têm aproximadamente metade da melanina epidérmica que os tipos de pele com pigmentação mais escura.
Foram encontradas diferenças na SC entre a pele com pigmentação escura (Escala de Classificação de Fitzpatrick V e VI) e a pele com pigmentação clara (Fitzpatrick I/II/III).46 A pele com pigmentação escura tem mais camadas de corneócitos do que a pele com pigmentação clara, com uma média de 21,8 células versus 16,7 células, respetivamente. Não foram registadas diferenças no tamanho ou na espessura das células, embora se pense que as camadas celulares em tons de pele escuros são mais compactas, refletindo assim uma maior coesão intercelular. Embora os resultados dos estudos possam variar, a taxa de descamação espontânea pode ser 2,5 vezes mais elevada em pessoas com tons de pele escuros do que em pessoas com tons de pele mais claros, o que explica a maior frequência de xerose em indivíduos com tons de pele escuros.47 As diferenças na descamação também variam em função do local do corpo entre indivíduos com tons de pele escuros e claros (por exemplo, taxas mais elevadas de descamação da pele ligeiramente pigmentada nas bochechas e na testa).
O tamanho, a qualidade e o fenótipo dos corneócitos são importantes porque células mais pequenas estão normalmente relacionadas com a hiperproliferação epidérmica (queratinócitos) e com o desenvolvimento de pele seca, devido à redução dos níveis de lípidos. Embora os resultados dos estudos variem, os indivíduos com tons de pele escuros têm os níveis mais baixos de ceramidas (lípidos), aproximadamente 50% dos níveis de ceramidas do SC de indivíduos com tons de pele mais claros.2 Por este motivo, os tons de pele escuros estão associados a uma maior perda de água transepidérmica (TEWL), o que resulta num menor teor de água (WC) do SC. Além disso, a pele com pigmentação escura tem uma menor reatividade vascular cutânea a fatores externos (por exemplo, a vasodilatadores). Cumulativamente, com uma TEWL mais elevada, uma WC mais baixa e uma resposta termorreguladora reduzida da pele aumentam a vulnerabilidade dos indivíduos com tons de pele escuros ao desenvolvimento de PI.48 Embora os estudos não sejam conclusivos, a reatividade vascular reduzida também pode dificultar a visualização do eritema de branqueamento das PIs em fase 1.
Gefen propõe um modelo de tensão mecânica para o SC escuro.48 A redução da WC no SC pode aumentar a rigidez do SC, tendo como resultado uma dispersão menos eficaz da fricção e numa maior tensão mecânica. Deste modo, ocorre em pessoas com SC escura um círculo vicioso de danos por cisalhamento, levando a aumentos progressivos na TEWL. A WC no SC escuro danificado diminui com o aumento da TEWL, elevando ainda mais as concentrações de tensão mecânica. À medida que a TEWL aumenta, a pele torna-se mais seca e mais inflamada, aumentando o risco de lesões cutâneas por pressão, cisalhamento e fricção.
Avaliação e medição do tom da pele
As variações na pigmentação, na condição (seca ou húmida) e na temperatura da pele; a presença de fluidos ou produtos; a acuidade visual do observador; e a iluminação são alguns dos fatores que podem influenciar a natureza subjetiva das avaliações da pele realizadas pelos médicos.49 A inspeção visual das alterações cutâneas relacionadas com a pressão, como o branqueamento, a vermelhidão ou o eritema, é complementada pelo toque e pela tecnologia (Figura 4).50,51 No entanto, para garantir a consistência entre as várias avaliações dos médicos, a normalização dos termos e da técnica é fundamental nas práticas de inspeção visual. É importante notar que a inspeção visual por si só não é fiável.22,51 A Tabela 2 fornece informações importantes sobre a avaliação visual de diversos tons de pele para poder ajudar os médicos a identificar alterações cutâneas precoces.22,52,53
Tabela 2. Avaliação visual da pele para diversos tons de pele22,54

Escalas de classificação do tom da pele
Frequentemente, a classificação da cor da pele baseava-se na etnia e na raça declaradas pelo próprio. Não foram amplamente sistematizadas as categorias de cores baseadas nas descrições dos observadores. A utilização de escalas de classificação pode oferecer alguma regularidade; no entanto, a função é variada. Para além da validade e do rigor científico no desenvolvimento e na conceção das escalas, a eficácia dos modelos de classificação depende da competência individual e da fiabilidade entre avaliadores, a qual varia de um contexto para outro. Estas escalas oferecem uma cor de pele constitutiva (de base), uma cor de pele facultativa (exposição ao sol ou aos raios UV) e uma alteração da cor da pele induzida por uma PI.22,54
A Escala de Classificação de Fitzpatrick foi desenvolvida para identificar o aspeto e a tolerância à luz solar, tendo sido concebida como uma medida da sensibilidade ao sol.22,53-57 A Escala de Fitzpatrick não é fiável quando se avalia a pele exposta à radiação UV (fatores ambientais) e seria mais bem utilizada para avaliar a pele não exposta.
O Sistema de Cores de Munsell (MCS), concebido por um artista para pintura, descreve as qualidades to tom, luminosidade (valor) e intensidade (croma) e foi inicialmente utilizado na investigação de solos.58 Em contextos de cuidados de saúde, esta escala foi submetida a testes reduzido alcance de termos de validade e fiabilidade, apesar da sua utilização em avaliações do tom de pele.53,57,59
A Escala Massey-Martin (MMS), também conhecida como Escala de Cor da Pele do New Immigrant Survey (NIS), é um instrumento de inquérito sobre o tom de pele concebido para a observação do tom de pele.53,60 As instruções iniciais de utilização evitavam a comparação lado a lado do guia pictórico com a pele da pessoa, uma vez que se destinava a inquéritos sociais realizados pessoalmente (de memória para o observador) ou por telefone (resultados indicados como desconhecidos).
O sistema Skin Tone Colour Scale (STCS) de Konishi et al59 foi concebido com base no MCS e destina-se à avaliação do tom da pele e das lesões. O sistema é amplo na seleção de diversos tons de pele, o que o torna como sendo a classificação mais abrangente disponível para os médicos.
Em geral, os termos atuais para descrever o tom da cor da pele são subjetivos, imprecisos, não normalizados e podem ainda ter conotações ofensivas. As escalas de avaliação visual, como as escalas de Munsell61,62 e a de Fitzpatrick63, que utilizam imagens de tons de pele, são limitadas na medida em que não podem representar toda a gama de tons entre indivíduos, ou mesmo entre locais do corpo do mesmo indivíduo, de uma forma exequível e útil.
Reconhecendo estas questões problemáticas da avaliação da tonalidade da pele, a Associação Britânica de Dermatologistas (BAD) recomendou que a terminologia sobre a tonalidade da pele fosse neutra, baseada em medições objetivas e refletisse as populações multiétnicas.6,64 A medida mais objetiva é através do tom de pele geneticamente estabelecida através da melanogénese. A pigmentação ocorre quando as células dos melanócitos produzem melanina na pele. Dadzie et al6 e a BAD propuseram a utilização da nomenclatura dos pigmentos de eumelanina para a descrição do tom de pele e especificamente para a avaliação visual da pele desenvolveram a Escala de Cor da Pele Humana com Eumelanina (ESCS). A escala baseia-se na eumelanina, a qual constitui 90% do pigmento encontrado na pele humana e tem o mesmo nome. A ESCS tem cinco categorias de índice de melanina, o qual é medido por reflectância da luz: eumelanina baixa (<25), eumelanina intermédia baixa (25-<50), eumelanina intermédia (50-<75), eumelanina intermédia alta (75-<100) e eumelanina alta (≥100).6 Para medir o índice de melanina existem instrumentos pequenos, leves, portáteis e fáceis de utilizar. A ESCS tem potencial para poder ser utilizada na classificação dos resultados das PIs, como a incidência e a cura e na monitorização das disparidades/iniquidades.
Tecnologias de deteção visual precoce e tons de pele escuros
Em indivíduos com tons de pele escuros, é especialmente difícil identificar visualmente as alterações cutâneas precoces que podem anunciar uma iminente PI. A utilização de tecnologias visuais aumentadas, como a tecnologia de avaliação da humidade subepidérmica (SEM) e a tecnologia de infravermelhos de onda longa (LWIT), é promissora para a identificação precoce de alterações da pele e dos tecidos antes de as mesmas serem visíveis a olho nu. Desta forma, a utilização destas tecnologias pode criar uma janela de oportunidade para intervenções direcionadas antes de ocorrerem as manifestações visíveis e tácteis de danos nos tecidos.65 Na caso da ausência destas tecnologias, esta janela é invisível para os clínicos de cuidados diretos. A natureza subclínica do desenvolvimento de PIs resultou na latência do diagnóstico, o que contribui para uma latência da intervenção. Em indivíduos com tons de pele escuros, este atraso resulta numa maior probabilidade de não deteção das PIs.66 As tecnologias de deteção precoce podem ajudar a resolver este problema.
Tecnologia SEM
A tecnologia de avaliação da humidade subepidérmica baseia-se no conhecimento contemporâneo da etiologia das lesões invasivas (Figura 5).67,68 Independentemente da pigmentação da pele, o início dos danos microscópicos no desenvolvimento PIs invasivas e das DTPIs é consistente. Os danos celulares e tecidulares desencadeados por pressão, por cisalhamento e por fricção contínuos dão origem a respostas inflamatórias agudas. À medida que o nível de danos nos tecidos aumenta, cresce também a resposta inflamatória.67 Esta resposta imunitária resulta em um edema intersticial. O edema localizado ou SEM constitui-se como um dos primeiros indicadores de lesão por pressão não visível. A codificação da CID-10 para as PIs em fase 1 caracteriza este dano inicial como "alterações cutâneas pré-úlceras limitadas a edema focal persistente. "69 Esta progressão subclínica do dano tecidular é descrita mais detalhadamente no capítulo de etiologia das diretrizes de 2019 de prática clínica para a prevenção e tratamento das PIs.51
O dispositivo SEM scanner está aprovado pela FDA como ferramenta de gestão de PI e é recomendado para adultos de todos os tons de pele em risco de desenvolvimento de PI. No local de prestação de cuidados, o dispositivo não invasivo deteta edema focal persistente e comunica os resultados como um valor SEM delta (∆) (Figura 1). A tecnologia de avaliação SEM mede as alterações na SEM entre um tecido saudável e um inflamado.70 Valores SEM aumentados podem indicar um risco acrescido específico da anatomia para o desenvolvimento de PI em todos os tons de pele.68
As meta-análises de revisões sistemáticas relatam a deteção precoce do desenvolvimento de PI através de avaliações SEM numa mediana de 5 dias anteriores às avaliações visuais(P ≤ 0,001).71,72 Num estudo de braço duplo com 175 participantes (n = 48/175, não brancos), as avaliações SEM relataram uma sensibilidade e especificidade de diagnóstico de 86.8% e 88% na deteção de PIs, resultando numa área sob a curva que excede significativamente o julgamento clínico (P < 0,0001).70 Num estudo de grupo, as avaliações SEM detetaram o desenvolvimento de PIs em fase 1 1 semana antes de um diagnóstico visível de um eritema em fase 1 (OR, 5,3; IC 1,87-15,11; P < 0,001) em indivíduos com tons de pele escuros (n = 11/66).73 Num estudo clínico multiétnico, as medições da MEV foram estatisticamente significativas na deteção de IPs em fase 1 e DTPIs em ambos os calcanhares em residentes com tons de pele escuros de acordo com o valor de Munsell (n = 68/417; P < 0,001).74 Um estudo observacional de 15 pacientes (n = 4/15, tipo III de Fitzpatrick e acima) relatou uma indicação precoce de dano tecidual com base em medições de MEV que foram concordantes com uma confirmação posterior de DTPIs suspeitas por meio da identificação de lesões hipoecóicas com base em ultrassom e em avaliações visuais.75 Num estudo retrospetivo de 69 pacientes em cuidados intensivos cirúrgicos, os enfermeiros indicaram que as avaliações com MEV permitiam, em pacientes com tons de pele escuros, avaliações mais precisas da pele (n = 29/69).76
Dispositivo de termografia por infravermelhos de onda longa
A termografia por infravermelhos de onda longa (LWIT) é um dispositivo não invasivo e multimodal para ser utilizado em ambientes clínicos. Incorpora LWIT com uma câmara para detetar PIs antes de virem a ocorrer alterações visuais ou tácteis. O dispositivo permite avaliar alterações na temperatura da pele, uma vez que o calor localizado, o edema e as alterações na consistência dos tecidos são sinais de alerta típicos para o desenvolvimento de PI.77 O dispositivo pode ser útil em pacientes com tons de pele claros ou escuros. É particularmente útil na deteção de DTPIs, que possam permanecer indetetáveis na pele até 72 horas (Figura 6).9,78 Esta caraterística é particularmente importante para os pacientes com tons de pele escuros, porque a pigmentação da pele escura pode mascarar as típicas cores profundas de púrpura e castanho que servem como sinais visuais de um DTPI.
Sendo um dispositivo que combina a fotografia com LWIT, utiliza duas modalidades de imagem, medindo a radiação infravermelha de onda longa (energia emitida pelo corpo humano) para permitir criar as imagens digitais finais. A energia, ou a falta dela, é criada a partir do fluxo sanguíneo, da perfusão e em última análise, a partir da atividade metabólica. Para comparar a temperatura ambiente com a temperatura da pele adjacente, o dispositivo utiliza um diferencial de temperatura relativa e adapta-se a fatores intrínsecos e extrínsecos (por exemplo, temperatura corporal central elevada, temperatura ambiente). Uma temperatura mais baixa em comparação com a pele adjacente indica uma menor perfusão e danos isquémicos mais profundos; temperaturas mais quentes indicam um aumento da atividade metabólica e de inflamação.
A fiabilidade e a validade da utilização do LWIT para detetar PIs foram confirmadas em vários estudos.79-84 O Guia Internacional de Prática Clínica para a Prevenção e Tratamento de Lesões por Pressão de 2019 identificou a termografia como sendo uma área de elevada prioridade de investigação.85
Prevenção da pi em pessoas com tons de pele escuros
A prevenção das lesões por pressão tem como base a avaliação do risco e na avaliação rotineira e exaustiva da pele e dos tecidos moles.51 As atuais práticas de prevenção baseadas em evidências aplicam-se a pessoas com tons de pele escuros e devem ser implementadas.51,86 Uma vez que a deteção precoce de PI é um desafio em pacientes com tons de pele escuros, a identificação de uma fase mais tardia da PI (no momento da descoberta) tem sido relatada quando comparada com pessoas de pigmentação mais clara.87 A incorporação na prática clínica de técnicas melhoradas de avaliação da pele e de dispositivos de aumento visual deve ser considerada para melhorar a prevenção de PI, num esforço para colmatar a lacuna na identificação precoce.
Tratamento e cura de pi em pessoas com tons de pele escuros
O processo de cicatrização de uma PI inclui hemostase, inflamação, proliferação e maturação, envolvendo numerosos mecanismos moleculares.88,89 A cicatrização é influenciada por fatores clínicos do paciente e também pelos tratamentos recebidos. Em pacientes com tons de pele escuros, a cicatrização das PIs e especialmente da pele circundante podem ter para os médicos um aspeto diferente do que em pacientes com tons de pele mais claros. Por exemplo, em pacientes com tons de pele escuros a hipopigmentação do tecido recentemente reepitelizado pode ser visível nas margens da ferida de uma PI de espessura total. (Figura 7) Embora alguns estudos tenham referido diferenças e disparidades na prevalência ou incidência de PIs por raça ou etnia,32,90 são muito menos comuns os estudos centrados na cura das PIs. Bliss et al91 analisaram um conjunto de dados a nível nacional de registos MDS de idosos residentes em lares de idosos. Dos 10.862 idosos (65+ anos) residentes num lar de idosos com uma PI, 44% estavam curados em 90 dias. No entanto, verificou-se uma disparidade global significativa de 6% na cura de PIs (fases 2 a 4) presentes na admissão aquando da avaliação exigida aos 90 dias entre os residentes de raça negra. Num estudo sobre o tempo decorrido até ao desenvolvimento de uma PI durante o internamento num lar de idosos,90 99% de todos os residentes com uma PI receberam tratamento para a mesma, pelo que não foram encontradas disparidades no número de tratamentos por raça ou por grupo étnico. No entanto, noutros contextos de cuidados de saúde, como os cuidados intensivos ou em cuidados domiciliários, não existem evidências de disparidades no que diz respeito às taxas de cicatrização e de tratamento de lesões invasivas em pacientes com tons de pele escuros.
Determinantes sociais da saúde
Os impactos dos SDS no desenvolvimento e tratamento das PI são em grande parte pouco estudados e por conseguinte desconhecidos. O Departamento de Saúde e Serviços Humanos dos EUA define os SDS em cinco domínios: estabilidade económica, acesso e qualidade da educação, acesso e qualidade dos cuidados de saúde, vizinhança e ambientes construídos e contexto social e comunitário.92 A análise destes domínios revela potenciais disparidades e desigualdades de saúde entre os grupos raciais. De um modo geral, em comparação com os indivíduos de raça branca, as pessoas de cor têm sido desproporcionadamente afetadas e têm pior desempenho em todos os domínios dos SDS.93 Comunidades em Ação: A Pathways to Health Equity afirma que a equidade na saúde é crucial para o bem-estar das comunidades.94 Embora tenham sido obtidos grandes ganhos na cobertura de cuidados de saúde entre grupos raciais/étnicos ao abrigo do Affordable Care Act, as pessoas de cor continuam a ter maior probabilidade de não terem seguro.94 Também no que diz respeito ao rendimento existem disparidades. Em 2021, foram registados rendimentos medianos mais elevados para os agregados familiares chefiados por asiáticos ou por brancos, enquanto os agregados familiares chefiados por pessoas que se identificam como negras ou hispânicas registaram rendimentos medianos inferiores à mediana nacional.95
Em dois estudos centrados no desenvolvimento de PI e no impacto da raça, os elementos de SDS (estabilidade económica e acesso e qualidade dos cuidados de saúde) foram operacionalizados através do rendimento dos pacientes com base no código postal de residência e no estatuto de pagador do seguro de saúde. Utilizando a base de dados NIS de 2009, Fogerty e colegas38, em comparação com os caucasianos, identificaram um risco acrescido de PIs entre os afro-americanos segurados pelo Medicare e pelo Medicaid. No que se refere ao rendimento, os afro-americanos encontram-se em maior proporção nos quartis de rendimento mais baixos (50,6%) do que os caucasianos (21,4%). No entanto, na análise multivariada e com base no estatuto de pagador ou no rendimento, os investigadores não registaram diferenças significativas entre raças no que diz respeito ao risco de PI. Cox e Thomas-Hawkins39 relataram uma proporção significativamente maior de indivíduos de raça negra com PIs segurados pelo Medicaid, em comparação com pacientes com PIs de todos os outros grupos raciais combinados, usando dados de nível estadual do HCUP de 2018 de New Jersey. Relativamente ao rendimento, reportado por quartis com base no código postal de residência, uma proporção estatisticamente significativa mais elevada de pessoas negras com PIs residia nos quartis de código postal com rendimentos mais baixos e uma proporção mais baixa nos quartis de código postal de rendimentos superiores. Na sua amostra, mais de 50% dos pacientes de raça negra com PIs viviam em zonas com rendimentos declarados de 58.999 dólares ou inferiores, em comparação com 19% de todas as outras raças combinadas. Não foi efetuada qualquer análise multivariada neste estudo. Numa análise recente do impacto dos SDS na progressão da PI, Sasson e colegas96 concluíram que prejuízos nos SDS relacionados com a escassez de alimentos (conforme identificado através dos códigos da CID-10) e a raça negra eram ambos preditores significativos e independentes de uma maior duração da PI.96
Dois recentes relatórios nacionais validaram as desigualdades em termos de saúde vividas pelos pacientes com tons de pele escuros e que sofrem de PIs. No que diz respeito à prevenção de PI, em 2021 o Urban Institute referiu que os pacientes negros nos EUA tinham menos 31,9% de probabilidades de serem admitidos em hospitais considerados de alta qualidade.97 Além disso, um relatório da Agency for Healthcare Research and Quality Disparities Report de 2019 identificou que, tanto para os pacientes de curta como de longa duração em lares de idosos, a qualidade dos cuidados associados às PIs era inferior entre os pacientes negros em comparação com os pacientes brancos.98 É plausível que o desenvolvimento ou agravamento de uma PI seja influenciado pelo acesso a cuidados de saúde de qualidade, o que pode desempenhar um papel fundamental nas taxas mais elevadas de PIs entre os pacientes negros. Sem acesso a modalidades de prevenção ou tratamento baseadas em evidências, fica comprometida a capacidade de prevenir uma PI ou de facilitar a cicatrização de feridas. Atualmente, o alcance desta disparidade não foi estudada e é desconhecida. Este é uma área que necessita de ser mais explorada.
Educação do clínico e avaliação da pele em tons de pele escuros
A avaliação incorreta da pele e a falta de conhecimento do aspeto das PI em tons de pele escuros podem atrasar a identificação e o tratamento precoce, resultando em PIs mais graves e em penalizações financeiras para a organização de cuidados de saúde.99 As desigualdades na saúde e as disparidades raciais ocorrem quando os profissionais de saúde, através de preconceitos explícitos ou implícitos, não avaliam, identificam e previnem adequadamente as PIs em pessoas de cor que estão em risco de sofrer uma PI.100,101 A avaliação incorreta da pele também pode ocorrer devido à dificuldade em visualizar as alterações e as descolorações da cor da pele em pessoas com tons de pele escuros. Infelizmente, falta formação aos enfermeiros e a outros clínicos sobre a avaliação de pessoas com cores de pele diferentes.
Como enfermeiros, a nossa reputação junto do público é de honestidade, confiança e carinho. Os enfermeiros foram classificados como sendo a profissão mais honesta e ética durante mais de 20 anos consecutivos.102 No entanto, é frequente os estudantes de enfermagem saírem dos nossos programas de formação sem estarem devidamente preparados para compreender as consequências dos SDS e a importância da ênfase na prestação de cuidados seguros e equitativos às diversas populações que servimos. Apesar dos objetivos generalizados para incluir a diversidade, a equidade, a inclusão e os SDS nos currículos de formação em enfermagem, não é certo se tal foi conseguido.99 Evidências recentes demonstram que existe uma disparidade em termos de saúde na formação de enfermeiros, com uma formação dirigida a pessoas com tons de pele claros.99 Oozageer e colegas99 realizaram em Inglaterra um estudo documental e observacional da formação em enfermagem e respetivas aulas sobre PIs em cinco cursos de licenciatura em enfermagem. Os investigadores encontraram um foco esmagador nas PIs em pessoas com tons de pele caucasianos, com apenas informações breves e superficiais relativas a pessoas com tons de pele escuros.99 Num estudo qualitativo nestes cinco programas de educação em enfermagem, utilizando grupos de discussão, os investigadores encontraram um tema predominante de normatividade Branca. Especificamente, os investigadores identificaram como norma um predomínio da Brancura no ensino sobre os PIs e as implicações para os estudantes de enfermagem da Brancura.99
Em 2023, Pittman e Black103 examinaram a equidade em matéria de saúde dos manuais de ensino de enfermagem, analisando especificamente o conteúdo dos manuais de avaliação física da pele e do tegumento relevante para os tons de cor da pele. Utilizando uma amostragem de conveniência de manuais de avaliação física para programas de enfermagem de nível de graduação e pós-graduação, os investigadores modificaram com permissão o Diversity Observation Teaching Tool (DOTT) de Oozageer para melhor se adequar aos objectivos do seu projeto. O conteúdo dos manuais escolares (ou seja, o capítulo "Tegumento/Pele") foi revisto de forma independente e em seguida os dados foram revistos no que respeita à consistência ou diferenças. Cada investigador explorou também o laboratório de simulação da sua universidade para nos tons de pele dos manequins encontrar evidências de diversidade. Dos nove manuais escolares e 11 capítulos, nenhum dos objetivos dos capítulos incluía a diversidade de tons de pele. Seis dos nove manuais tinham descritores visuais de PI, incluindo fases. No entanto, em seis manuais com fotografias, apenas três continham fotografias com tons de pele escuros. Os manuais escolares continham 534 fotografias de vários gráficos ou imagens de pele, mas destas, apenas 35 (7%) eram relativas a tons de pele escuros. Por outro lado, 499 (93%) das 534 imagens eram relativas a tons de pele claros. Ambas as universidades possuíam laboratórios de simulação com 60 a 65% dos manequins com tons de pele claros e 35 a 40% com tons de pele escuros. No entanto, não é conhecido se o tom de pele é abordado nos cenários de simulação. Estas evidências corroboram as de Oozageer e colegas e demonstram a falta de formação que os estudantes de enfermagem recebem relativamente à diversidade de tons de pele.
Conclusões
Existem disparidades raciais no que se refere ao desenvolvimento e à cicatrização das PI, especialmente evidenciadas nos pacientes com tons de pele escuros. Este artigo explorou o estado atual da ciência e identificou lacunas nos termos utilizados para descrever a cor da pele, o que tornou impossível a realização de quaisquer comparações e tendências baseadas em dados. Com a crescente diversidade racial nos Estados Unidos, incluindo pessoas de origens étnicas e raciais mistas, a "raça" de um paciente já não deve ser utilizada como um termo demográfico ou como um fator de risco para os PIs. Na educação clínica, na prática e na investigação a cor do tom de pele deve ser mais normalizada e quantificável. Face a um país com uma cada vez maior diversidade racial nas próximas décadas, a capacidade de identificar e tratar mais cedo as PIs em desenvolvimento irá conseguir melhorar a qualidade de vida de todos os pacientes. Este trabalho é urgentemente necessário e o apoio de agências privadas e governamentais é essencial.
Conflito de Interesses
Os autores declaram não existirem conflitos de interesse.
Financiamento
Os autores não receberam financiamento para este estudo.
Author(s)
Joyce Black
PhD RN FAAN
Jill Cox
PhD RN APN-C CWOCN FAAN
Virginia Capasso
PhD CNP CNS CWS FACCWS FAAN
Donna Z Bliss
PhD RN FGSA FAAN
Barbara Delmore
PhD RN CWCN MAPWCA FAAN
Vignesh Iyer
MS
Jacqueline Massaro
MSN RN CWOCN
Cassendra Munro
PhD RN CNOR
Joyce Pittman
PhD RN ANP-BC FNP-BC CWOCN FAAN
Elizabeth A Ayello
PhD MS ETN RN CWON MAPWCA FAAN
* Corresponding author
Joyce Black is President, National Pressure Injury Advisory Panel, and Florence Niedfelt Professor of Nursing, College of Nursing, University of Nebraska.
Jill Cox is Member, Board of Directors, National Pressure Injury Advisory Panel; Clinical Professor, Rutgers University School of Nursing, Rutgers, New Jersey; and Wound/Ostomy/Continence Advanced Practice Nurse, Englewood Health, Englewood, New Jersey.
Virginia Capasso is Member, Board of Directors, National Pressure Injury Advisory Panel; Instructor in Surgery, Harvard Medical School, Cambridge Massachusetts; and Advanced Practice Nurse and Nurse Scientist, Massachusetts General Hospital, Boston.
Donna Z. Bliss, is School of Nursing Foundation Professor of Nursing Research, and Chair, Adult and Gerontological Health Cooperative, University of Minnesota School of Nursing, Minneapolis.
Barbara Delmore is Alumna, Board of Directors, National Pressure Injury Advisory Panel, and Senior Nurse Scientist and Clinical Assistant Professor, NYU Langone Health, New York.
Vignesh Iyer is Director, Medical Affairs, Bruin Biometrics, Los Angeles, California.
Jacqueline Massaro, MSN, RN, CWOCN, is Wound/Ostomy/Continence Nurse, Brigham and Women’s Hospital, Boston, Massachusetts.
Cassendra Munro, is Nurse Scientist, Office of Research Patient Care Services, Stanford Health Care, Palo Alto, California.
Joyce Pittman is Alumna, Board of Directors, National Pressure Injury Advisory Panel, and Associate Professor, College of Nursing, University of South Alabama, Mobile.
Elizabeth A Ayello is Alumna, Board of Directors, and Past President, National Pressure Injury Advisory Panel, and President, Ayello, Harris & Associates, Inc, New York.
Joyce Black é Presidente do Painel Consultivo Nacional de Lesões por Pressão e Florence Niedfelt Professora de Enfermagem , College of Nursing, University of Nebraska.
Jill Cox é Membro do Conselho de Administração do Painel Consultivo Nacional de Lesões por Pressão; Professora Clínica na Rutgers University School of Nursing, Rutgers, New Jersey; e Enfermeira de Prática Avançada em Feridas/Ostomia/Continência, Englewood Health, Englewood, New Jersey.
Virginia Capasso é membro do Conselho de Administração do Painel Consultivo Nacional de Lesões por Pressão; Professora de Cirurgia, Harvard Medical School, Cambridge Massachusetts; e Enfermeira de Prática Avançada e Enfermeira Cientista, Massachusetts General Hospital, Boston.
Donna Z. Bliss é Professora de Investigação em Enfermagem da Fundação da Escola de Enfermagem e Presidente da Cooperativa de Saúde de Adultos e Gerontologia, University of Minnesota School of Nursing, Minneapolis.
Barbara Delmore é Alumna, membro do Conselho de Administração, Painel Consultivo Nacional de Lesões por Pressão e Enfermeira Cientista Sénior e Professora Assistente Clínica, NYU Langone Health, Nova Iorque.
Vignesh Iyer é Diretor, Assuntos Médicos, Bruin Biometrics, Los Angeles, Califórnia.
Jacqueline Massaro, MSN, RN, CWOCN, é Enfermeira de Feridas/Ostomia/Continência, Brigham and Women's Hospital, Boston, Massachusetts.
Cassendra Munro, é Enfermeira Cientista, Gabinete de Serviços de Cuidados a Pacientes de Investigação, Stanford Health Care, Palo Alto, Califórnia.
Joyce Pittman é Alumna, membro do Conselho de Administração, Painel Consultivo Nacional de Lesões por Pressão, e Professora Associada, College of Nursing, University of South Alabama, Mobile.
Elizabeth A Ayello é Alumna, membro do Conselho de Administração e ex-presidente do Painel Consultivo Nacional de Lesões por Pressão e presidente da Ayello, Harris & Associates, Inc, Nova Iorque.
References
- United States Census Bureau. 2020 Census Statistics Highlight Local Population Changes and Nation’s Racial and Ethnic Diversity. https://www.census.gov/newsroom/press-releases/2021/population-changes-nations-diversity.html. Last accessed June 26, 2023.
- Rawlings AV. Ethnic skin types: are there differences in skin structure and function? Int J Cosmet Sci 2006;28(2):79-93.
- Ayello EA, Lyder CH. Pressure ulcers in person of colors: race and ethnicity. In Pressure Ulcers in America: Prevalence, Incidence, and Implications for the Future. Eds, Cuddigan J et al. Reston, VA: National Pressure Ulcer Advisory Panel; 2001.
- Bennett MA. Report of the task force on the implications for darkly pigmented intact skin in the predication and prevention of pressure ulcers. Adv Wound Care 1995;8(6)34-5.
- Black J, Baharestani MM, Cuddigan J et al. National Pressure Ulcer Advisory Panel’s updated pressure ulcer staging system. Adv Skin Wound Care 2007;20(5):269-74.
- Dadzie OE, Sturm RA, Fajuyigbe D, Petit A, Jablonski NG. The Eumelanin Human Skin Colour Scale: a proof of concept study. Br J Dermatol 2022;187:99-104.
- Dhoonmoon L, Fletcher J. Assessing skin tones in practice: results of an international survey. Wounds Int 2022;13(2):6-9.
- Dhoonmoon L, Nair HKR, Abbas Z, et al. International Consensus Document: Wound Care and Skin Tone Signs, Symptoms and Terminology for all Skin Tones. Wounds International. 2023. Available at www.woundsinternational.com.
- Edsberg LE, Black J, Goldberg M, et al. Revised National Pressure Ulcer Advisory Panel Pressure Injury Staging System. J Wound Ostomy Continence Nurs 2016;43(6):585-97.
- Eilers S, Bach DQ, Gaber R, et al. Accuracy of self-report in assessing Fitzpatrick skin phototypes I through VI. JAMA Dermatol 2013;149(11):1289-94.
- Fletcher J. The challenges of dark skin tone assessment: the importance of language. Wounds UK 2022;18(2):6,8.
- Gass M, Dadzie OE, Dlova N, Petit A, Goad N. Skin diversity erythema description guidance. British Association of Dermatology. February 2021. https://cdn.bad.org.uk/uploads/2022/02/29200007/Skin-diversity-descriptors-erythema-redness-guidance.pdf. Last accessed July 3, 2023.
- Gunowa NO. Skin tone bias and wound care: highlighting the current evidence and addressing the gaps in knowledge of dark skin tones. Wounds UK 2022;18(1):22-7.
- Lester JC, Jia JL, Zhang L, Okoye GA, Linos E. Absence of images of skin of colour in publication of COVID-19 skin manifestations. Br J Dermatol 2020;183:564-95.
- Matas A, Sowa MG, Taylor V, Taylor G, Schattka BJ, Mantsch HG. Eliminating the issue of skin color in assessment of the blanch response. Adv Skin Wound Care 2001;14(4):180-8.
- Mukwende M, Tamony P, Turner M. Mind the Gap: A Clinical Handbook of Signs in Black and Brown Skin. St. George’s University of London; 2020. https://www.blackandbrownskin.co.uk/mindthegap. Last accessed June 26, 2023.
- National Pressure Ulcer Advisory Panel. Pressure ulcers prevalence, cost and risk assessment: consensus development consensus statement. Decubitus 1989;2(2):24-8.
- National Pressure Ulcer Advisory Panel. Cuddigan J, Ayello EA, Sussman C. (Eds). Pressure Ulcers in America: Prevalence, Incidence, and Implications for the Future. Reston, VA: NPUAP; 2001.
- National Pressure Ulcer Advisory Panel (NPUAP), European Pressure Ulcer Advisory Panel (EPUAP), Pan Pacific Pressure Injury Alliance (PPPIA). Prevention and Treatment of Pressure Ulcers: Clinical Practice Guideline. Emily Haesler (Ed). Osborne Park, WA: Cambridge Media; 2014.
- Henderson CT, Ayello EA, Sussman C et al. Draft definition of stage I pressure ulcers: inclusion of persons with darkly pigmented skin. NPUAP Task Force on Stage I Definition and Darkly Pigmented Skin. Adv Wound Care 1997;10(5):16-9.
- National Pressure Ulcer Advisory Panel. NPUAP Pressure Injury Stages. 2016. Available from www.npiap.org
- Pusey Reid E, Quinn L, Samost ME, Reidy PA. Skin assessment in patients with dark skin tone. Am J Nurs 2023;123(3):36-43.
- Salcido S. Finding a window into the skin: it depends on the color of your skin. Adv Skin Wound Care 2008;22(1):8.
- Skin of Color Society. https://skinofcolorsociety.org/about-socs/. Last accessed June 26, 2023.
- Ankrom M, Bennett R, Sprigle S, et al. Pressure-related deep tissue injury under intact skin and the current pressure ulcer staging systems. Adv Skin Wound Care 2005;18 (1):35-42.
- Gunowa NO, Hutchinson M, Brooke J, Jackson D. Pressure injuries in people with darker skin tones: a literature review. J Clin Nurs 2017:27(17-18); 3266-75.
- Bliss DZ, Harms S, Garrard JM, et al. Prevalence of incontinence by race and ethnicity of older people admitted to nursing homes. J Am Med Directors Assoc 2013;14(6):451.e1-451.e7.
- Harms S, Bliss DZ, Garrad JM, et al. Prevalence of pressure ulcers by race and ethnicity for older people admitted to nursing homes. J Gerontol Nurs 2014;40(3);20-6.
- Baumgarten M, Margolis D, van Doorn C, et al. Black/White differences in pressure ulcer incidence in nursing home residents. J Am Geriatr Soc 2004;52(8):1293-8.
- Ahn H, Cowan L, Garvan C, Lyon D, Stechmiller J. Risk factors for pressure ulcers including suspected deep tissue injury in nursing home facility residents: analysis of National Minimum Data Set 3.0. Adv Skin Wound Care 2016;29(4):178-90.
- Cai S, Mukamel DB, Temkin-Greener H. Pressure ulcer prevalence among black and white nursing home residents in New York state: evidence of racial disparity? Medical Care 2010;48(3):233-9.
- Li Y, Yin J, Cai X, Temkin-Greener J, Mukamel DB. Association of race and sites of care with pressure ulcers in high-risk nursing home residents. JAMA 2011;306(2):179-86.
- Chen Z, Gleason LJ, Sanghavi P. Accuracy of pressure ulcer events in US nursing home ratings. Medical Care 2022;60(10):775-83.
- Bliss DZ, Gurvich O, Savik K, et al. Are there racial-ethnic disparities in time to pressure ulcer development and pressure ulcer treatment in older adults after nursing home admission? J Aging Health 2015;27(4):571-93.
- Rosen J, Mittal V, Degenholtz H, et al. Pressure ulcer prevention in Black and White nursing home residents: a QI initiative of enhanced ability, incentives, and management feedback. Adv Skin Wound Care 2006;19(5):262-9.
- Vangilder C, Macfarlane GD, Meyer S. Results of nine international pressure ulcer prevalence surveys: 1989 to 2005. Ostomy Wound Manage 2008;54(2):40-54.
- Bauer K, Rock K, Nazzal M, Jones O, Qu W. Pressure ulcers in the United States’ inpatient population from 2008 to 2012: results of a retrospective nationwide study. Ostomy Wound Manage 2016;62(11):30-8.
- Fogerty M, Guy J, Barbul A, Nanney LB, Abumrad NN. African Americans show increased risk for pressure ulcers: a retrospective analysis of acute care hospitals in America. Wound Repair Regen 2009;17(5):678–84.
- Cox J, Thomas Hawkins C. Racial disparities and pressure injuries among hospitalized patients. Adv Skin Wound Care 2023;36(2):78–84.
- Anatomy and Physiology of Skin, Soft Tissue, and Beyond. In Course Content, Wound Certification Prep Course. Malvern PA: HMP Communications, June 2022.
- Mufti A, Ayello EA, Sibbald RG: Anatomy and physiology of the skin. In: Doughty D, McNichol L (eds): Wound, Ostomy and Continence Nurses Society Core Curriculum, Wound Management. Philadelphia, PA: Wolters Kluwer; 2016.
- Lawton S. Skin 1: the structure and functions of the skin. Nurs Times 2019;115(12):30-3.
- Baranowski S, Ayello EA, Levine JM, Sibbald RG. Skin: an essential organ. In: Baranowski S, Ayello EA, eds. Wound Care Essentials 5th Edition. Philadelphia, PA: Wolters Kluwer; 2020:57-59, 66-67.
- Anatomy and Physiology 5.1 Layers of Skin. OpenStax Anatomy & Physiology. https://openstax.org/Anatomy-and-Physiology-2e/pages/5-1/layers-of- skin. Last accessed June 30, 2023.
- Rawlings AV. Ethnic skin types: are there differences in skin structure and function? Int J Cosmet Sci 2006;28(2):79-93.
- Fitzpatrick TB. The validity and practicality of sun-reactive skin types I through VI. Arch Dermatol 1988;124(6):869-71.
- Wesley NO, Maibach HI. Racial (ethnic) differences in skin properties: the objective data. Am J Clin Dermatol 2003;4(12)843-60.
- Gefen A. Application of the mechanical strain model to darkly pigmented skin. NPIAP 2023 Annual Conference; San Diego CA, March 18, 2023.
- Sullivan R. A 5-year retrospective study of descriptors associated with identification of stage I and suspected deep tissue pressure ulcers in persons with darkly pigmented skin. Wounds 2014;26(12):351–9.
- Clark M. Skin assessment in dark pigmented skin: a challenge in pressure ulcer prevention. Nurs Times 2010;106(30):16–7.
- National Pressure Injury Advisory Panel, European Pressure Ulcer Advisory Panel, & Pan Pacific Pressure Ulcer Injury Alliance. Prevention and treatment of pressure ulcers/injury: clinical practice guideline. The International Guideline; 2019.
- Black, J. & Simende, A. Top ten tips: assessing darkly pigmented skin. Wounds Int 2020;11(3):8-11.
- Francis, K. Assessment and identification of skin disorders in skin of color. J Wound Ostomy Continence Nurs 2023;50(2):107-14.
- Forman R, Zappas M, Lavell J. Dermatology in skin of color. Nurse Pract 2022;47(2):10-14.
- Khosla NN, Grullon K, Rosenblatt AE. Prevention of racialized medicine in pediatric dermatology: A call to re-examine skin tone typing. Pediatr Dermatol 2021;38(Suppl. 2):167–9.
- Del Bino S, Duval C, Bernard F. Clinical and biological character-ization of skin pigmentation diversity and its consequences on UV impact. Int J Mol Sci 2018;19(2668):1-44.
- Martin MK, Zaman T, Okello AM, Dennis LK. Validity of a self-assessment skin tone palette compared to a colorimeter for characterizing skin color for skin cancer research. Curr Oncol 2023;30:3189–200.
- Keuhni R. The early development of Munsell system. Color Res Appl 2002;27(1):20-7.
- Konishi N, Kawada A, Morimoto Y, et al. New approach to the evaluation of skin color of pigmentary lesions using Skin Tone Color Scale. J Dermatol 2007;34:441-6.
- Hannon L, DeFina R. Reliability concerns in measuring respondent skin tone by interviewer observation. Public Opin Quarterly 2016;80(2):534-41.
- McCreath HE, Bates-Jensen BM, Nakagami G, et al. Use of Munsell color charts to measure skin tone objectively in nursing home residents at risk for pressure ulcer development. J Adv Nurs 2016;72(9):2077-85.
- Munsell Color. (https://munsell.com/).
- Fitzpatrick TB. The validity and practicality of sun-reactive skin types I through VI. Arch Dermatol 1988;124(6):869-71.
- Gass KM, Dadzie OE, Dlova N, Petit A, Goad N. Skin diversity erythema description guidance. https://cdn.bad.org.uk/uploads/2022/02/29200007/Skin-diversity-descriptors-erythema-redness-guidance.pdf. Last accessed July 10, 2023.
- Moore Z, Patton D, Rhodes SL, O’Connor T. Subepidermal moisture (SEM) and bioimpedance: a literature review of a novel method for early detection of pressure-induced tissue damage (pressure ulcers). Int Wound J. Apr 2017;14(2):331-337.
- Baumgarten M, Margolis D, van Doorn C, et al. Black/White differences in pressure ulcer incidence in nursing home residents. J Am Geriatr Soc 2004;52(8):1293-8.
- Gefen A, Brienza DM, Cuddigan J, Haesler E, Kottner J. Our contemporary understanding of the aetiology of pressure ulcers/pressure injuries. Int Wound J 2022;19(3):692-704.
- Bryant RA, Moore ZE, Iyer V. Clinical profile of the SEM Scanner - modernizing pressure injury care pathways using sub-epidermal moisture (SEM) scanning. Expert Rev Med Devices 2021;18(9):833-47.
- World Health Organization. L89 Pressure Ulcers. In International Statistical Classification of Diseases and Related Health Problems; Tenth Revision. 2nd ed. Geneva: World Health Organization; 2020.
- Gershon S, Okonkwo H. Evaluating the sensitivity, specificity and clinical utility of algorithms of spatial variation in sub-epidermal moisture (SEM) for the diagnosis of deep and early-stage pressure-induced tissue damage. J Wound Care 2021;30(1):41-53.
- Chaboyer W, Coyer F, Harbeck E, et al. Oedema as a predictor of the incidence of new pressure injuries in adults in any care setting: a systematic review and meta-analysis. Int J Nurs Stud 2022;128:104189.
- Moore Z, McEvoy NL, Avsar P, et al. Measuring subepidermal moisture to detect early pressure ulcer development: a systematic review. J Wound Care 2022;31(8):634-47.
- Bates-Jensen BM, McCreath HE, Pongquan V. Subepidermal moisture is associated with early pressure ulcer damage in nursing home residents with dark skin tones: pilot findings. J Wound Ostomy Continence Nurs 2009;36(3):277-284.
- Bates-Jensen BM, McCreath HE, Nakagami G, Patlan A. Subepidermal moisture detection of heel pressure injury: The pressure ulcer detection study outcomes. Int Wound J 2018;15(2):297-309.
- Gefen A, Gershon S. An observational, prospective cohort pilot study to compare the use of subepidermal moisture measurements versus ultrasound and visual skin assessments for early detection of pressure injury. Ostomy Wound Manage 2018;64(9):12-27.
- Pittman J, Mulekar M. Enhanced skin assessment methodology to equitably detect early tissue damage and pressure injuries in adult patients in the acute care setting. Paper presented at NPIAP Annual Conference. 2023; San Diego, CA.
- European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel, Pan Pacific Pressure Injury Alliance. Skin and Tissue Assessment. In: Haesler E, ed. Prevention and Treatment of Pressure Ulcers/Pressure Injuries: Clinical Practice Guideline: The International Guideline 2019. European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel and Pan Pacific Pressure Injury Alliance; 2019:73-83.
- Simman R, Angel C. Early identification of deep-tissue pressure injury using long-wave infrared thermography: a blinded prospective cohort study. Adv Skin Wound Care 2022;35(2):95-101.
- Langemo D, Spahn J, Snodgrass L. Accuracy and reproducibility of the Wound Shape Measuring and Monitoring System. Adv Skin Wound Care 2015;28(7):317-23.
- Langemo D, Spahn JG. A multimodality imaging and software system for combining an anatomical and physiological assessment of skin and underlying tissue conditions. Adv Skin Wound Care 2016;29(4):155-63.
- Langemo DK, Spahn JG. A reliability study using a long-wave infrared thermography device to identify relative tissue temperature variations of the body surface and underlying tissue. Adv Skin Wound Care 2017;30(3):109-19.
- Langemo D, Spahn J, Spahn T, Chowdry Pinnamaneni V. Comparison of standardized clinical evaluation of wounds using ruler length by width and scout length by width measure and scout perimeter trace. Adv Skin Wound Care 2015;28(3):116-21.
- Cox J, Kaes L, Martinez M, Moles D. A prospective, observational study to assess the use of thermography to predict progression of discolored intact skin to necrosis among patients in skilled nursing facilities. Ostomy Wound Manage 2016;62(10):14-33.
- Koerner S, Adams D, Harper SL, Black JM, Langemo DK. Use of thermal imaging to identify deep-tissue pressure injury on admission reduces clinical and financial burdens of hospital-acquired pressure injuries. Adv Skin Wound Care 2019;32(7):312-20.
- European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel, Pan Pacific Pressure Injury Alliance. Future Research. In: Haesler E, ed. Prevention and Treatment of Pressure Ulcers/Pressure Injuries: Clinical Practice Guideline. The International Guideline. European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel, Pan Pacific Pressure Injury Alliance; 2019:373-7.
- Padula WV, Black JM. The Standardized Pressure Injury Prevention Protocol for improving nursing compliance with best practice guidelines. J Clin Nurs 2019;28(3-4):367-71.
- Clark M. Skin assessment in dark pigmented skin: a challenge in pressure ulcer prevention. Nurs Times 2010;106(30):16-7.
- Eming SA, Martin P, Tomic-Canic M. Wound repair and regeneration: mechanisms, signaling, and translation. Sci Transl Med 2014;6(265):265sr6.
- Ozgok Kangal MK, Regan JP. Wound Healing. StatPearls [Internet]. Treasure Island, FL: StatPearls Publishing; 2022.
- Bliss DZ, Gurvich O, Savik K, et al. Are there racial-ethnic disparities in time to pressure ulcer development and pressure ulcer treatment in older adults after nursing home admission? J Aging Health 2015;27(4):571-93.
- Bliss DZ, Gurvich O, Savik K, et al. Racial and ethnic disparities in the healing of pressure ulcers present at nursing home admission. Arch Gerontol Geriatr 2017;72:187-94.
- U.S Department of Health and Human Services, Healthy People 2030. Social Determinants of Health. https://health.gov/healthypeople/priority-areas/social-determinants-health. Last accessed June 30, 2023.
- Kaiser Family Foundation. Key Facts on Health and Health Care by Race and Ethnicity. 2023. https://www.kff.org/report-section/key-facts-on-health-and-health-care-by-race-and-ethnicity-social-determinants-of-health/. Last accessed June 30, 2023.
- National Academies of Sciences, Engineering, and Medicine, Health and Medicine Division, Board on Population Health and Public Health Practice, Committee on Community-Based Solutions to Promote Health Equity in the United States, Baciu A, Negussie Y, Geller A, & Weinstein JN (Eds.). Communities in Action: Pathways to Health Equity. National Academies Press (US); 2017.
- Peter G Peterson Foundation. Wealth is an important component of Americans economic status. 2022. https://www.pgpf.org/blog/2022/11/income-and-wealth-in-the-united-states-an-overview-of-recent-data. Last accessed June 30, 2023.
- Sasson DC, Duan K, Patel SM, Junn A, Hsia HC. The impact of social determinants of health on pressure injury progression: a retrospective chart and scoping review. Adv Skin Wound Care 2023;36(2):106–11.
- Gangopadhyaya, A. Black Patients Are More Likely than White Patients to Be in Hospitals with Worse Patient Safety Outcomes. Robert Wood Johnson Foundation; 2021. https://www.urban.org/sites/default/files/publication/103925/black-patients-are-more-likely-than-white-patients-to-be-in-hospitals-with-worse-patient-safety-conditions_0.pdf. Last accessed June 30, 2023.
- Agency for Healthcare Quality and Research. National Healthcare Quality and Disparity Report, 2019. https://www.ahrq.gov/sites/default/files/wysiwyg/research/findings/nhqrdr/2019qdr-core-measures-disparities.pdf. Last accessed June 30, 2023.
- Oozageer Gunowa N, Brooke J, Hutchinson M, Jackson D. Embedding skin tone diversity into undergraduate nurse education: through the lens of pressure injury. J Clin Nurs 2020;29(21-22):4358-67.
- Matthew D. Just Medicine: A Cure for Racial Inequality in American Healthcare. NYU Press; 2015.
- Institute of Medicine. Unequal Treatment: Confronting Racial and Ethnic Disparities in Health Care. Committee On Understanding and Eliminating Racial and Ethnic Disparities in Health Care. Smedley B, Stith A, and Nelson A. (Eds). National Academies Press (US); 2003.
- Brenan, M. 2023. Nurses Retain Top Ethics Rating in U.S, But Below 2020 High. Gallop News; Jan 10, 2023. https://news.gallup.com/poll/467804/nurses-retain-top-ethics-rating-below-2020-high.aspx. Last accessed June 30, 2023.
- Pitman J, Black J. 2023 Gaps in professional education on skin assessment. National Pressure Injury Advisory Panel annual conference presentation: promoting equity in prevention and treatment of pressure injury. San Diego, March 2023.



