Volume 44 Number 1
WHAM evidence summary: fish skin for treating burns
Emily Haesler
Keywords burns, Traditional wound management, fish skin, tilapia fish, evidence summary
For referencing Haesler E. WHAM evidence summary: fish skin for treating burns. WCET® Journal 2024;44(1):44-48.
DOI 10.33235/wcet.44.1.44-48
Clinical question
What is the best available evidence for fish skin for treating burns?
Summary
In low and middle resource settings, fish skin has been used as a low cost, traditional biological dressing for treatment of burns and other wounds. The high collagen concentration and tensile strength1-4 of fish skin has led to its use as a xenograft. There is insufficient clinical evidence on healing outcomes to make a recommendation on using fish skin for treating burns. Level 1 evidence5-7 at high risk of bias suggests that complete healing might be faster with a fish skin dressing compared to the local standard care (most frequently, silver sulfadiazine cream replaced every two days), but the time to healing difference was negligible in most studies and may not be clinically significant. Level 1 evidence5-7 on effectiveness in achieving better control of pain intensity showed mixed results. However, no studies reported that fish skin dressings were inferior to local standard care, adverse events were not reported to be an issue and some low level evidence indicated people receiving fish skin dressings were satisfied with the outcomes.
Clinical practice reccommendations
All recommendations should be applied with consideration to the wound, the person, the health professional and the clinical context.
|
There is insufficient evidence to make a recommendation on the use of fish skin dressings to promote healing in burns. |
Sources of evidence: search and appraisal
This summary was conducted using methods published by the Joanna Briggs Institute.8-11 The summary is based on a systematic literature search combining search terms related to fish skin, burns and healing. Searches were conducted for evidence reporting use of fish skin in human burns published up to 31 January 2024 in English in the following databases: Cumulative Index to Nursing and Allied Health Literature (CINAHL), Medline (Ovid), Google Scholar, Embase (Ovid), AMED, Global Health, Health Internetwork Access to Research Initiative (Hinari, access via Research4Life) and Cochrane Library. Levels of evidence for intervention studies are reported in Table 1.
Table 1. Levels of evidence for clinical studies
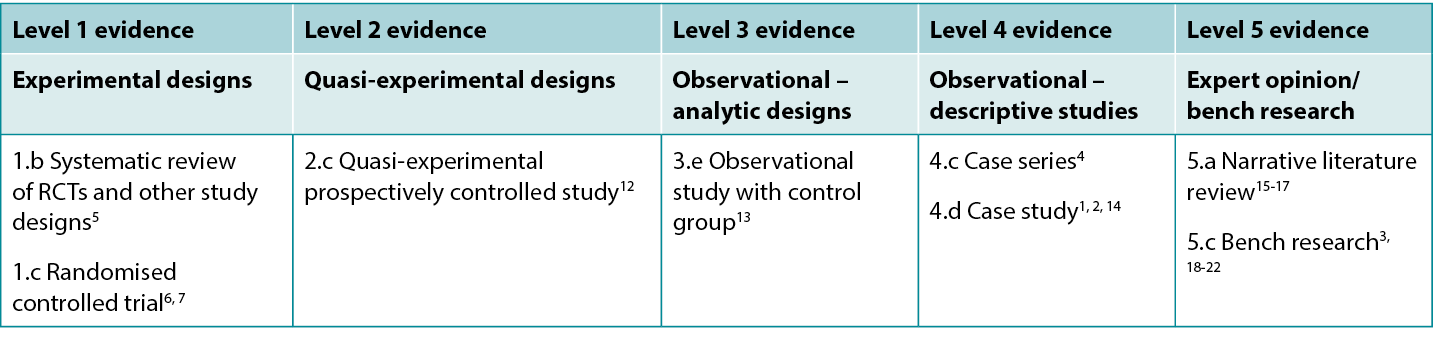
Background
Some types of fish skin have been used as a wound dressings in low resource communities due to their similarities to human skin. Fish skin has high collagen concentration, high resistance, and high tensile strength.1-4 Fish skin also has anti-viral, anti-bacterial and anti-oxidative properties, and is rich is unsaturated fatty acids, which might contribute to efficacy as a burn treatment.4, 16
The clinical research in this evidence summary is focused on the use of natural fish skin that is applied directly to burns (usually after a sterilisation process). The fish skin adheres to the wound bed as a xenograft, protecting the wound bed during healing and reducing the number of dressing changes that are required. This has potential to reduce healthcare resources and to reduce wound-related pain.1, 2, 4, 5, 12, 15
Bench research has also described the extraction and use of collagen from fish skin in commercial wound dressing products, including sponges, hydrogels and topical powders3,17-22 but no clinical research on the use of these products for human burns was identified in the literature search.
Clinical evidence on fish skin for wound healing
Studies reporting clinical outcomes for human burns treated with tilapia fish skin dressing and shaour fish skin dressing are summarized in Table 2. Half of the published evidence1, 2, 6, 7 was produced by one team in Brazil.
Table 2. Summary of the primary evidence for tilapia fish skin dressing for wound management
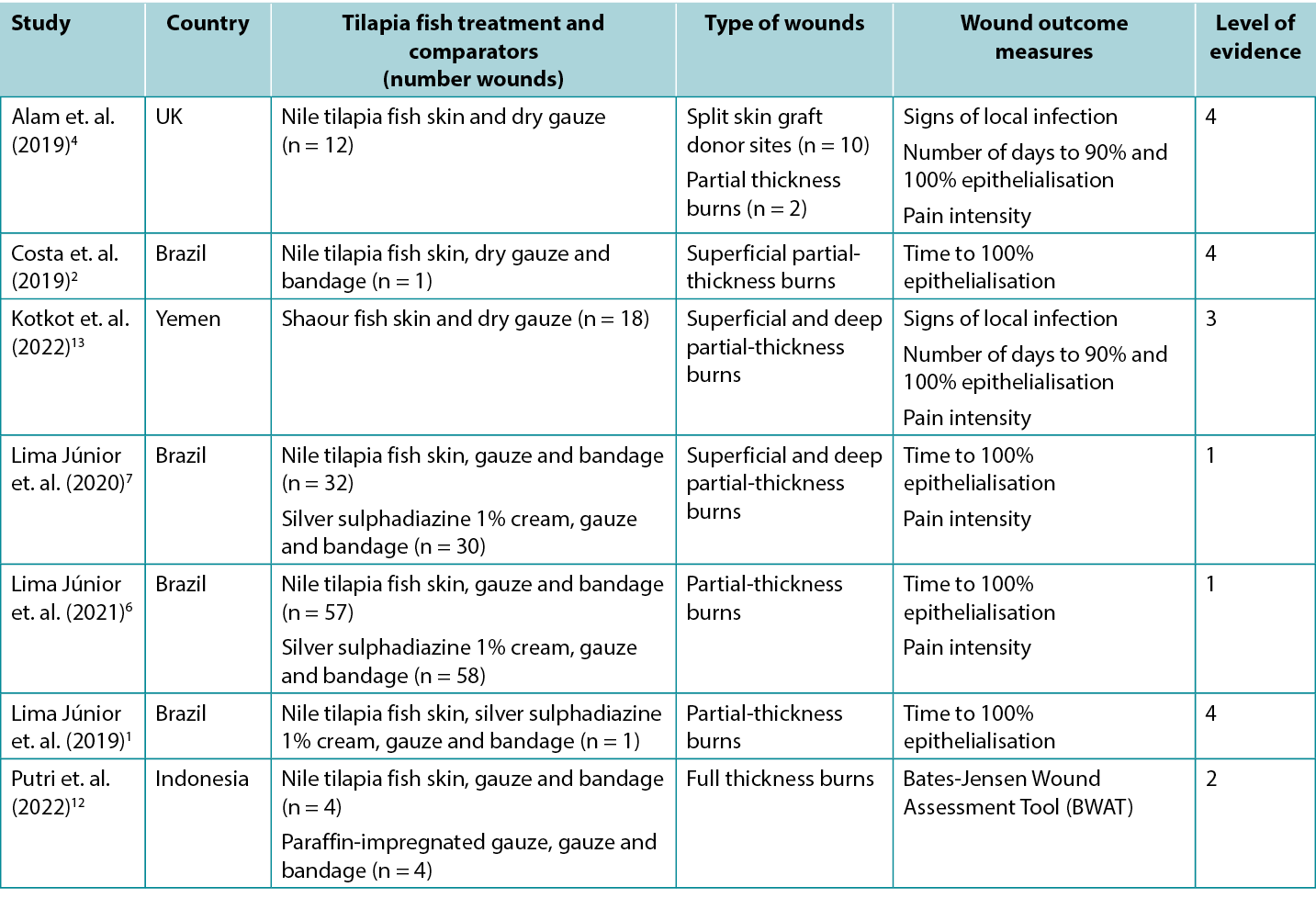
Fish skin for promoting healing in burns
The highest level of evidence comes from a meta-analysis5 at high risk of bias that included three studies1, 6, 7 (reported below). Pooled results showed tilapia fish skin dressing was associated with shorter time for partial-thickness burns to reach complete epithelialisation (standard mean difference [SMD] –0.903, 95% confidence interval [CI] −1.45 to −0.355, p<0.001) (Level 1). The primary studies all showed positive outcomes for healing with fish skin dressings:
- One RCT7 at moderate risk of bias, compared tilapia fish skin dressing with silver sulphadiazine 1% cream for treating partial thickness burns. The study had three arms based on the depth and extent of the participants burns (arm A: superficial second-degree burns to less than 10% of the body [n = 23]; arm B: superficial second-degree burns to 10–20% of the body [n = 19] and arm C: deep second-degree burns to 5–15% of the body [n = 20]). After light debridement and cleansing with a topical antimicrobial, the treatment group in each arm received a tilapia fish skin dressing, gauze and a bandage. Every 48 hours the secondary dressing was removed to check the fish skin dressing was correctly adhered. The control group in each arm received the local standard care regimen (silver sulphadiazine 1% cream, gauze and a bandage, changed every 48 hours). In all three study arms, complete epithelialisation was achieved significantly faster in burns treated with the tilapia fish dressing (mean difference between treatment arm and control arm ranged from 1.43 to 3.20 days, p < 0.05 in all arms)7 (Level 1).
- In an RCT6 at high risk of bias the same research team extended their research in individuals with partial thickness burns. Individuals with burns to up to 10% of the body that occurred no more than 72 hours prior and had not yet received treatment were eligible for the trial if they had no product sensitivity or significant co-morbidities. The treatment and control dressing regimens were the same as in the RCT reported above. The treatment group experienced faster healing (mean days: 10.2 ± 0.9 versus 9.7 ± 0.6; p = 0.001) Although the outcomes were statistically significant, the difference between the two regimens could not be considered clinically significant6 (Level 1).
- In a comparative study12 at high risk of bias, tilapia fish skin was applied to acute, non-infected full thickness limb burns (n = 4) following surgical sharp debridement. The fish skin dressings were changed every five days. The outcomes were compared to those for burns on the contralateral limbs that received the local standard care (paraffin-impregnated gauze changed every three days). The mean Bates-Jensen Wound Assessment Tool (BWAT) scores on day 10 were not different (fish skin: 18.75 ± 1.25 versus control: 30.5 18.75 ± 0.9) (Level 2).
- An observational study (n = 18)13 at high risk of bias, reported the effectiveness of shaour fish skin for treating partial-thickness burns. After preparation, the fish skin was applied to the burn area and secured with dry gauze. The fish skin dressing was replaced at day seven and day 15. The mean time to 90% epithelialisation was 11.05 ± 2.57 days (range 7–15) and the mean time to 100% epithelialisation was 17.27 ± 2.05 days (range 13–21). No cases experienced signs of local infection or allergic reaction13 (Level 3).
- A case series4 at high risk of bias reported the use of tilapia fish skin in split-skin graft donor sites for people (n =10) who had experienced burns. The fish skin was soaked in saline and applied directly to the donor sites, held in place with gauze. Dressings were changed on day 7 and then every three days. The average time to complete epithelialisation was 11.5 days (range 10–16) and the mean pain score on a VRS (0–10) at day 7 was 2.3 (range 1–4). In this study, an additional two participants received tilapia skin dressing applied to partial thickness burns, with complete epithelialisation observed at two weeks. No cases experienced signs of local infection (Level 4).
- Several case reports at high risk of bias describe the successful use of fish skin to treat partial thickness burns,1,2 including burns in babies and young children.2 In these case reports, healing occurred without complication in 10 to 17 days1, 2 (Level 4).
Wound-related pain outcomes with fish skin dressing
Findings on the impact of tilapia fish skin dressing on wound-related pain are inconclusive. First, pain was only reported on unidimensional scales measuring pain intensity, and in many studies it was not clear when the pain assessment was conducted. When the results from three studies1, 6, 7 were pooled in a meta-analysis,5 tilapia fish dressing was associated with lower pain intensity but the result was not significant (standard mean difference on a 10cm visual analogue scale (VAS) –0.608, 95% CI −0.885 to −0.331, p = 0.54) (Level 1). The following results were reported in the primary research:
- Participants in the three-armed RCT7 reported pain intensity using a 10cm VAS. There was no significant difference between pain intensity for tilapia fish skin dressing and silver sulphadiazine 1% cream in the arm in which participants had superficial second-degree burns to less than 10% of the body (p > 0.05). In the arms in which participants had superficial second-degree burns to 10–20% of the body or deep second-degree burns to 5–15% of the body, those receiving tilapia fish skin dressing reported lower pain intensity immediately after dressing change than those receiving silver sulphadiazine 1% cream (p < 0.005 for all wound dressing changes in both arms)7 (Level 1).
- Participants in the second RCT6 reported more rapid reduction in burn-related pain intensity (p < 0.001) with a tilapia fish skin dressing compared to a control group receiving silver sulphadiazine 1% cream (Level 1).
- In the observational study (n = 18),13 the mean pain rating on a Verbal Rating Scale (VRS, 0–10) was 6.94 ± 0.72 (range 6–8) at day 7, and this decreased statistically significantly (p < 0.001) to 5.22 ± 0.64 (range 4–6) at day 15 (Level 3).
- Individuals treated with fish skin dressing in other studies reported the dressing was comfortable.4, 12
Considerations for use
Consider local policies, procedures, and licensing before implementing traditional wound treatments.
Preparation
In the clinical studies,1, 2, 6 the fish skin was sterilised using a chemical process followed by gamma irradiation and stored in sterile packaging under refrigeration prior to use. After preparation, the product can be stored in refrigerated sterile packaging for up to two years.2
Clinical use
- In clinical use,1,6,13 burns were lightly debrided (if indicated) and then cleansed in sterile saline or a topical antimicrobial solution before fish skin was applied. The fish skin covered the entire wound or burn, including approximately 1cm of healthy peri-wound skin. The fish skin was covered with dry gauze with or without additional bandaging. In one study2 the fish skin was washed in sterile 0.9% saline for 5 minutes three times immediately before its application to the burn.
- In most clinical reports, the fish skin dressing was checked every few days to ensure the fish skin adhered to the burn, but the fish skin was not replaced.1,6,7 As the fish skin dries, it sloughs from the wound bed. At this stage, moistening the area (e.g., in the shower or using a cleansing solution) can assist in lifting the fish skin, revealing new epithelisation.1 In other reports, the fish skin dressing was replaced after 5 to 7 days.4,12,13
- Fish skin dressing may be inappropriate for some anatomical regions, including the face, neck and groin, due to difficulty achieving adequate adherence on skin folds.2,7,15
Cost effectiveness
- Several sources1,7,12 suggested that fish skin dressing is cost effective because the dressing does not need frequent replacement. In most reports in this evidence summary the fish skin was not replaced; in one study the fish skin dressing change was changed weekly13 In the pooled results5 from three studies1,6,7, tilapia skin dressing was associated with fewer dressings (SMD −4.195, 95% CI −5.615 to −2.774, p = 0.074) but the result was not significant (Level 1).
- In an RCT6, there were significantly lower costs associated with using tilapia fish skin dressings compared with silver sulphadiazine cream ($11 ± $1 versus Brazilian $19± $1; dollars in 2020), related to lower costs for dressing materials and analgesia (Level 1).
Adverse effects
Most of the research1,2,5-7 included in this evidence summary reported no adverse events associated with fish skin dressings. In one small study12, two of the participants died due to septic shock deemed not related to either the fish skin dressing or the comparison paraffin-impregnated gauze dressing they were receiving.
Conflicts of interest
The author declares no conflicts of interest in accordance with International Committee of Medical Journal Editors (ICMJE) standards.
About WHAM evidence summaries
WHAM evidence summaries provide a summary of the best available evidence on specific topics and make suggestions that can be used to inform clinical practice. Evidence contained within this summary should be evaluated by appropriately trained professionals with expertise in wound prevention and management, and the evidence should be considered in the context of the individual, the professional, the clinical setting and other relevant clinical information.
WHAM evidence summaries are developed using methodology consistent with that published by Joanna Briggs Institute8-11. Evidence underpinning a WHAM recommendation is identified via a PICO search strategy, assigned a level of evidence and evaluated for risk of bias. All WHAM evidence summaries are peer-reviewed by an international Expert Reference Group. For more information on the methods and the WHAM Expert Reference Group, visit the website: www.WHAMwounds.com.
Copyright © Wound Healing and Management Collaborative, Curtin University, and the authors.
Resumo das evidências da WHAM: pele de peixe no tratamento de queimaduras
Emily Haesler
DOI: 10.33235/wcet.44.1.44-48
Questão clínica
Qual é a melhor evidência disponível para pele de peixe no tratamento de queimaduras?
Resumo
Em ambientes de recursos baixos e médios, a pele de peixe tem sido utilizada como um penso biológico tradicional, de baixo custo, para o tratamento de queimaduras e outras feridas. A elevada concentração de colagénio e a resistência à tracção1-4 da pele de peixe levaram à sua utilização como xenoenxerto. Não existem provas clínicas suficientes sobre os resultados de cicatrização para poder fazer uma recomendação sobre a utilização de pele de peixe no tratamento de queimaduras. Evidências5-7 de nível 1 com alto risco de enviesamento sugerem que a cicatrização completa pode ser mais rápida com um penso de pele de peixe, em comparação com o tratamento padrão local (mais frequentemente, creme de sulfadiazina de prata substituído a cada dois dias), mas o tempo para a diferença de cicatrização foi insignificante na maioria dos estudos, pelo que pode não ser clinicamente significativo. As evidências5-7 de nível 1 relativamente à eficácia na obtenção de um melhor controlo da intensidade da dor apresentaram resultados mistos. No entanto, nenhum estudo relatou que os pensos de pele de peixe eram inferiores aos cuidados padrão locais, os eventos adversos não foram relatados como um problema e algumas evidências de baixo nível indicaram que as pessoas que receberam pensos de pele de peixe ficaram satisfeitas com os resultados.
Recomendações de prática clínica
Todas as recomendações devem ser aplicadas tendo em consideração a ferida, a pessoa, o profissional de saúde e o contexto clínico.
| Não existem provas suficientes para se poder fazer uma recomendação sobre a utilização de pensos de pele de peixe para promover a cicatrização de queimaduras. |
Origem das evidências pesquisa e avaliação
Este resumo foi realizado utilizando os métodos publicados pelo Joanna Briggs Institute.8-11 O resumo baseia-se numa pesquisa bibliográfica sistemática que combina termos de pesquisa relacionados com pele de peixe, queimaduras e cicatrização. Foram realizadas pesquisas por evidências que relatassem o uso de pele de peixe em queimaduras humanas publicadas em inglês até 31 de janeiro de 2024 nas seguintes bases de dados: Cumulative Index to Nursing and Allied Health Literature (CINAHL), Medline (Ovid), Google Scholar, Embase (Ovid), AMED, Global Health, Health Internetwork Access to Research Initiative (Hinari, acesso via Research4Life) e Cochrane Library. Os níveis de evidência para estudos de intervenção encontram-se relatados no Tabela 1.
Tabela 1. Níveis de evidência para estudos clínicos

Antecedentes
Devido às suas semelhanças com a pele humana, alguns tipos de pele de peixe têm sido utilizados como pensos para feridas em comunidades com poucos recursos. A pele de peixe possui uma elevada concentração de colagénio, elevada resistência e elevada força de tração.1-4 A pele de peixe tem também propriedades antivirais, antibacterianas e antioxidantes e é rica em ácidos gordos insaturados, o que pode contribuir para a sua eficácia no tratamento de queimaduras.4, 16
A investigação clínica neste resumo de evidências centra-se na utilização de pele de peixe natural que é aplicada diretamente nas queimaduras (normalmente após um processo de esterilização). A pele de peixe adere ao leito da ferida como um xenoenxerto, protegendo dessa forma o leito da ferida durante a cicatrização e reduzindo o número de mudanças de penso que são necessárias. Tem o potencial de reduzir os recursos dos cuidados de saúde e o de reduzir a dor relacionada com as feridas.1, 2, 4, 5, 12, 15
A investigação em bancos de ensaio também descreveu a extração e a utilização de colagénio da pele de peixe em produtos comerciais de pensos para feridas, incluindo esponjas, hidrogéis e pós tópicos3,17-22, mas não foi identificada na pesquisa bibliográfica qualquer investigação clínica sobre a utilização destes produtos em queimaduras humanas.
Provas clínicas sobre a pele de peixe na cicatrização de feridas
Os estudos que relatam os resultados clínicos de queimaduras humanas tratadas com o penso de pele de peixe tilápia e com o penso de pele de peixe Imperador estão resumidos na Tabela 2. Metade da evidência publicada1, 2, 6, 7 foi produzida por uma equipa no Brasil.
Tabela 2. Resumo da evidência primária para o penso de pele de peixe tilápia no tratamento de feridas
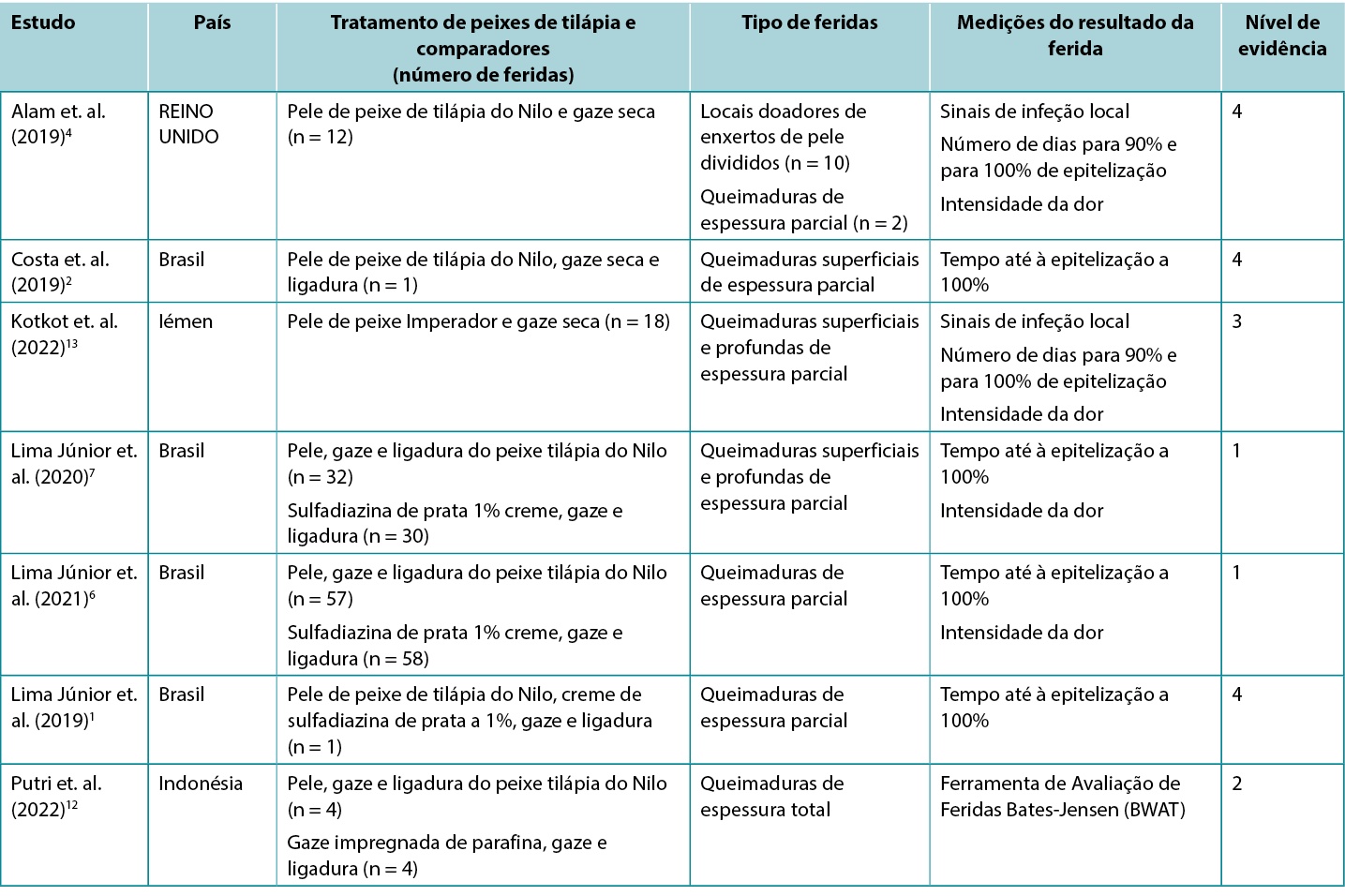
Pele de peixe para promover a cicatrização de queimaduras
O nível mais elevado de evidência provém de uma meta-análise5 com um elevado risco de enviesamento, que incluiu três estudos1, 6, 7 (abaixo relatados). Os resultados combinados mostraram que o penso de pele de peixe tilápia foi associado a um menor tempo para que as queimaduras de espessura parcial atingissem a epitelização completa (diferença média padrão [DMP] -0,903, intervalo de confiança de 95% [IC] -1,45 a -0,355, p<0,001) (Nível 1). Todos os estudos primários mostraram resultados positivos para a cicatrização com pensos de pele de peixe:
- Um RCT7 com risco moderado de enviesamento, comparou o penso de pele de peixe tilápia com o creme de sulfadiazina de prata a 1% para o tratamento de queimaduras de espessura parcial. O estudo tinha três ramificações com base na profundidade e extensão das queimaduras dos participantes (ramificação A: queimaduras superficiais de segundo grau em menos de 10% do corpo [n = 23]; ramificação B: queimaduras superficiais de segundo grau em 10-20% do corpo [n = 19] e ramificação C: queimaduras profundas de segundo grau em 5-15% do corpo [n = 20]). Após um ligeiro desbridamento e limpeza com um antimicrobiano tópico, o grupo tratado em cada ramificação recebeu um penso de pele de peixe tilápia, gaze e uma ligadura. A cada 48 horas, o penso secundário era removido para se verificar se o penso de pele de peixe estava corretamente aderido. O grupo de controlo em cada ramificação recebeu um regime de cuidados padrão local (creme de sulfadiazina de prata a 1%, gaze e uma ligadura, mudada a cada 48 horas). Em todos as três ramificações do estudo, a epitelização completa foi alcançada significativamente mais rápida nas queimaduras tratadas com o penso de peixe tilápia (a diferença média entre a ramificação de tratamento e a ramificação de controlo variou de 1,43 a 3,20 dias, p < 0,05 em todos as ramificações)7 (Nível 1).
- Num RCT6 com elevado risco de enviesamento, a mesma equipa de investigação alargou a sua investigação a indivíduos com queimaduras de espessura parcial. Os indivíduos com queimaduras até 10% do corpo, ocorridas no máximo 72 horas antes e que ainda não tivessem recebido tratamento, eram elegíveis para o ensaio, se não tivessem sensibilidade ao produto ou co-morbilidades significativas. Os regimes de pensos de tratamento e de controlo foram os mesmos que no RCT anteriormente referido. O grupo tratado teve uma cicatrização mais rápida (dias médios: 10,2 ± 0,9 versus 9,7 ± 0,6; p = 0,001) Embora os resultados fossem estatisticamente significativos, a diferença entre os dois regimes não pôde ser considerada clinicamente significativa6 (Nível 1).
- Num estudo comparativo12 com elevado risco de enviesamento, a pele de peixe tilápia foi aplicada a queimaduras de membros, agudas e não infectadas de espessura total (n = 4) após desbridamento cirúrgico acentuado. Os pensos de pele de peixe eram mudados de cinco em cinco dias. Os resultados foram então comparados com os das queimaduras nos membros contralaterais que receberam os cuidados padrão locais (gaze impregnada de parafina mudada de três em três dias). As pontuações médias da Bates-Jensen Wound Assessment Tool (BWAT) no dia 10 não foram diferentes (pele de peixe: 18,75 ± 1,25 em relação ao controlo: 30,5 18,75 ± 0,9) (Nível 2).
- Um estudo observacional (n = 18)13 com elevado risco de enviesamento, relatou a eficácia da pele de peixe Imperador no tratamento de queimaduras de espessura parcial. Após a preparação, a pele de peixe foi aplicada na área da queimadura e fixada com gaze seca. O penso de pele de peixe foi substituído ao 7º e ao 15º dia. O tempo médio para 90% de epitelização foi de 11,05 ± 2,57 dias (intervalo 7-15) e o tempo médio para 100% de epitelização foi de 17,27 ± 2,05 dias (intervalo 13-21). Nenhum caso apresentou sinais de infeção local ou de reação alérgica13 (Nível 3).
- Uma série de casos4, com elevado risco de enviesamento, relatou a utilização de pele de peixe tilápia em locais de doadores de enxertos de pele dividida para utilização em pessoas (n = 10) que tinham sofrido queimaduras. A pele de peixe foi embebida em soro fisiológico e aplicada diretamente nas zonas dadoras e mantida no lugar com gaze. Os pensos foram mudados no 7º dia e depois de três em três dias. O tempo médio para completar a epitelização foi de 11,5 dias (intervalo 10-16) e a pontuação média de dor num VRS (0-10) no dia 7 foi de 2,3 (intervalo 1-4). Neste estudo, mais outros dois participantes receberam um penso de pele de tilápia aplicado a queimaduras de espessura parcial, tendo sido observada uma epitelização completa ao final de duas semanas. Nenhum caso apresentou sinais de infeção local (Nível 4).
- Vários relatos de casos com elevado risco de enviesamento descrevem a utilização bem-sucedida de pele de peixe para tratar queimaduras de espessura parcial,1,2 incluindo queimaduras em bebés e em crianças pequenas.2 Nestes relatos de casos, a cicatrização ocorreu sem complicações em 10 a 17 dias1, 2 (Nível 4).
Resultados da dor relacionada com a ferida com o penso de pele de peixe
São inconclusivos os resultados sobre o impacto do penso de pele de peixe tilápia na dor relacionada com a ferida. Em primeiro lugar, a dor só foi relatada em escalas unidimensionais que medem a intensidade da dor e, em muitos estudos, não ficou claro quando é que a avaliação da dor foi realizada. Quando os resultados de três estudos1, 6, 7 foram reunidos numa meta-análise,5 o molho de peixe tilápia foi associado a uma menor intensidade de dor, mas o resultado não foi significativo (diferença média padrão numa escala visual analógica (EVA) de 10 cm -0,608, IC 95% -0,885 a -0,331, p = 0,54) (Nível 1). Os resultados da investigação primária foram os seguintes
- Os participantes no ensaio clínico RCT7 com três ramificações relataram a intensidade da dor utilizando uma EVA de 10 cm. Não houve diferença significativa entre a intensidade da dor para o penso de pele de peixe tilápia e para o creme de sulfadiazina de prata 1% na ramificação em que os participantes tinham queimaduras superficiais de segundo grau em menos de 10% do corpo (p > 0,05). Nas ramificações em que os participantes tinham queimaduras superficiais de segundo grau em 10-20% do corpo ou queimaduras profundas de segundo grau em 5-15% do corpo, aqueles que receberam o penso de pele de peixe tilápia relataram menor intensidade de dor imediatamente após a troca do penso do que aqueles que receberam sulfadiazina de prata 1% em creme (p < 0,005 para todas as trocas de pensos em ambas as ramificações)7 (Nível 1).
- Os participantes no segundo RCT6 relataram uma redução mais rápida da intensidade da dor relacionada com a queimadura (p < 0,001) com um penso de pele de peixe tilápia, em comparação com um grupo de controlo que recebeu creme de sulfadiazina de prata a 1% (Nível 1).
- No estudo observacional (n = 18),13 a classificação média da dor numa Escala de Classificação Verbal (VRS, 0-10) foi de 6,94 ± 0,72 (intervalo 6-8) no dia 7, tendo diminuído de forma estatisticamente significativa (p < 0,001) para 5,22 ± 0,64 (intervalo 4-6) no dia 15 (Nível 3).
- Os indivíduos tratados com pensos de pele de peixe em outros estudos referiram que o penso era confortável.4, 12
Considerações de utilização
Considerar as políticas, procedimentos e licenças locais antes de implementar tratamentos tradicionais para feridas.
Preparação
Nos estudos clínicos,1, 2, 6 a pele do peixe foi esterilizada por um processo químico, seguido de irradiação gama e armazenada em embalagens estéreis sob refrigeração antes da sua utilização. Após a sua preparação, o produto pode ser armazenado em embalagens estéreis refrigeradas durante um período máximo de dois anos.2
Utilização clínica
- Na utilização clínica,1,6,13 as queimaduras eram ligeiramente desbridadas (quando indicado) e depois limpas com solução salina estéril ou com uma solução antimicrobiana tópica, antes da aplicação da pele de peixe. A pele de peixe cobria toda a ferida ou queimadura, incluindo aproximadamente 1 cm de pele saudável na peri-ferida. A pele do peixe foi coberta com gaze seca, com ou sem ligadura adicional. Num estudo2, a pele do peixe foi lavada em solução salina estéril a 0,9% durante 5 minutos, três vezes, imediatamente antes da sua aplicação na queimadura.
- Na maioria dos relatos clínicos, o penso de pele de peixe foi verificado com intervalos de poucos dias de forma a garantir a aderência da pele de peixe à queimadura, mas a pele de peixe não foi substituída.1,6,7 À medida que a pele de peixe fica seca, desprende-se do leito da ferida. Nesta fase, humedecer a área (por exemplo, no duche ou utilizando uma solução de limpeza) pode ajudar a levantar a pele de peixe, revelando nova epitelização.1 Em outros relatos, o penso de pele de peixe foi substituído após 5 a 7 dias.4,12,13
- O penso de pele de peixe pode ser inadequado para algumas regiões anatómicas, incluindo a face, o pescoço e as virilhas, devido à dificuldade em se conseguir uma aderência adequada nas dobras cutâneas.2,7,15
Custo-benefício
Várias fontes1,7,12 sugeriram que o penso de pele de peixe é rentável porque o penso não necessita de uma substituição frequente. Na maioria dos relatos deste resumo de evidências, a pele do peixe não foi substituída; em um estudo, a troca do penso de pele do peixe foi realizada semanalmente13 Nos resultados combinados5 de três estudos1,6,7, o penso de pele de tilápia foi associado a menos pensos (DMP -4,195, IC 95% -5,615 a -2,774, p = 0,074), mas o resultado não foi significativo (Nível 1).
Em um RCT6, houve custos significativamente mais baixos associados ao uso de pensos de pele de peixe tilápia, em comparação com o creme de sulfadiazina de prata ($11 ± $1 versus $19± $1 brasileiros; dólares em 2020), relacionados a custos mais baixos para materiais de penso e de analgésicos (Nível 1).
Efeitos adversos
A maioria das pesquisas1,2,5-7 incluídas neste resumo de evidências não relatou eventos adversos associados aos pensos de pele de peixe. Num pequeno estudo12, dois dos participantes morreram devido a um choque sético, mas que foi considerado como não relacionado com o penso de pele de peixe ou com o penso de comparação de gaze impregnada de parafina que estavam a receber.
Conflito de interesses
Os autores declaram não existirem conflitos de interesse, em conformidade com as normas do Comité Internacional de Editores de Revistas Médicas (ICMJE).
Sobre os resumos de evidências da WHAM
Os resumos de evidências da WHAM fornecem um resumo das melhores provas disponíveis sobre tópicos específicos e apresentam sugestões que podem ser utilizadas para informar a prática clínica. As evidências contidas neste resumo devem ser avaliadas por profissionais devidamente formados e com conhecimentos especializados na prevenção e gestão de feridas e as provas devem ser consideradas no contexto do indivíduo e do profissional, do ambiente clínico e de outras informações clínicas relevantes.
Os resumos das provas do WHAM são desenvolvidos utilizando uma metodologia consistente com a publicada pelo Joanna Briggs Institute8-11. A evidência subjacente a uma recomendação WHAM é identificada através de uma estratégia de pesquisa PICO, sendo-lhe atribuído um nível de evidência e avaliado o risco de enviesamento. Todos os resumos de provas do WHAM são revistos por um grupo de referência de peritos internacionais. Para mais informações sobre os métodos e sobre o Grupo de Referência de Peritos WHAM, visite o sítio Web: www.WHAMwounds.com.
Copyright © Wound Healing and Management Collaborative, Curtin University, e os autores.
Author(s)
Emily Haesler
PhD P Grad Dip Adv Nurs (Gerontics) BN FWA
Adjunct Professor, Curtin University, Curtin Health Innovation Research Institute, Wound Healing and Management (WHAM) Collaborative
References
- Lima-Júnior EM, de Moraes Filho MO, Costa BA, Fechine FV, de Moraes MEA, Silva-Junior FR, Soares MFAdN, Rocha MBS, Leontsinis CMP. Innovative treatment using tilapia skin as a xenograft for partial thickness burns after a gunpowder explosion. J Surg Case Rep, 2019; 6: rjz181.
- Costa BA, Lima Júnior EM, de Moraes Filho MO, Fechine FV, de Moraes MEA, Silva Júnior FR, do Nascimento Soares MFA, Rocha MBS. Use of tilapia skin as a xenograft for pediatric burn treatment: A case report. J Burn Care Res, 2019; 40(5): 714-7.
- Ge B, Wang H, Li J, Liu H, Yin Y, Zhang N, Qin S. Comprehensive assessment of Nile tilapia skin (Oreochromis niloticus) collagen hydrogels for wound dressings. Marine Drugs. 2020; 18(4).
- Alam K, Jeffery SLA. Acellular Fish skin grafts for management of split thickness donor sites and partial thickness burns: A case series. Mil Med, 2019; 184(Suppl 1): 16-20.
- Cadri S, Elrosasy A, Al Mawla AM, Albakri K, Abdelwahab OA, Soliman A, Jaradat B, Cadri N, Alabdallat YJ, Negida A. The efficacy of Nile tilapia skin xenograft for treating superficial partial-thickness burn versus the standard of care: a meta-analysis of published trials. Arch Dermatol Res, 2023; 316(1): 33.
- Lima Júnior EM, de Moraes Filho MO, Costa BA, Fechine FV, Vale ML, Diógenes AKL, Neves KRT, Uchôa A, Soares M, de Moraes MEA. Nile tilapia fish skin-based wound dressing improves pain and treatment-related costs of superficial partial-thickness burns: A phase III randomized controlled trial. Plast Reconstr Surg, 2021; 147(5): 1189-98.
- Lima Júnior EM, De Moraes Filho MO, Costa BA, Rohleder AVP, Sales Rocha MB, Fechine FV, Forte AJ, Alves A, Silva Júnior FR, Martins CB, Mathor MB, Moraes MEA. Innovative burn treatment using tilapia skin as a xenograft: A phase II randomized controlled trial. J Burn Care Res, 2020; 41(3): 585-92.
- Aromataris E, Munn Z, editors. JBI Manual for Evidence Synthesis. https://synthesismanual.jbi.global: Joanna Briggs Institute, 2020.
- Joanna Briggs Institute Levels of Evidence and Grades of Recommendation Working Party. New JBI Grades of Recommendation. Adelaide, Australia: Joanna Briggs Institute, 2013.
- Joanna Briggs Institute Levels of Evidence and Grades of Recommendation Working Party. Supporting Document for the Joanna Briggs Institute Levels of Evidence and Grades of Recommendation. Adelaide, Australia: Joanna Briggs Institute, 2014.
- Munn Z, Lockwood C, Moola S. The development and use of evidence summaries for point of care information systems: A streamlined rapid review approach. Worldviews Evid Based Nurs, 2015;12(3):131-8.
- Putri N, Kreshanti P, Syarif A, Duhita G, Johanna N, Wardhana A. Efficacy of tilapia skin xenograft compared to paraffin-impregnated gauze as a full-thickness burn dressing after excisional debridement: A case series. Int J Surg Case Rep, 2022; 95(107240): 107240.
- Kotkot A, Ghabisha S, Ahmed F, Al-wageeh S, Al-shami E, Al-hajri A, Aljbri W, Mohammed F. Fish skin as a biological dressing for burn injuries. Journal of Emergency Medicine, Trauma and Acute Care, 2022; 2022(4).
- Riaz Z. Treatment of human skin burns through using tilapia skin. Bull. Biol. All. Sci. Res., 2021;6:24.
- Luze H, Nischwitz SP, Smolle C, Zrim R, Kamolz LP. The use of acellular fish skin grafts in burn wound management. A systematic review. Medicina (Kaunas), 2022; 58(7).
- Esmaeili A, Biazar E, Ebrahimi M, Heidari Keshel S, Kheilnezhad B, Saeedi Landi F. Acellular fish skin for wound healing. Int Wound J, 2023; 20(7): 2924-41.
- Afifah A, Suparno O, Haditjaroko L, Tarman K. Utilisation of fish skin waste as a collagen wound dressing on burn injuries: a mini review. IOP Conference Series: Earth and Environmental Science, 2019; 335(1): 012031.
- Lima-Verde MEQ, Parthiban SP, Júnior AECF, De Barros Silva PG, Junior EML, De Moraes MO, De Paulo Aragão Sabóia V, Bertassoni LE, Alves APNN. Nile tilapia fish skin, scales, and spine as naturally derived biomaterials for tissue regeneration. Current Oral Health Reports, 2020;7(4):335-43.
- Li D, Sun WQ, Wang T, Gao Y, Wu J, Xie Z, Zhao J, He C, Zhu M, Zhang S, Wang P, Mo X. Evaluation of a novel tilapia-skin acellular dermis matrix rationally processed for enhanced wound healing. Materials Science and Engineering: C, 2021; 127: 112202.
- Wang T, Yang L, Wang G, Han L, Chen K, Liu P, Xu S, Li D, Xie Z, Mo X, Wang L, Liang H, Liu X, Zhang S, Gao Y. Biocompatibility, hemostatic properties, and wound healing evaluation of tilapia skin collagen sponges. Journal of Bioactive and Compatible Polymers, 2020; 36(1): 44-58.
- Yang L, Chen K, Liu P, Kang Y, Shen S, Qu C, Gong S, Liu Y, Gao Y. Preparation of Nile tilapia skin collagen powder by low-temperature and comprehensive evaluation of hemostasis and wound healing. Int J Artif Organs, 2023; 46(2): 99-112.
- Zhou T, Wang N, Xue Y, Ding T, Liu X, Mo X, Sun J. Electrospun tilapia collagen nanofibers accelerating wound healing via inducing keratinocytes proliferation and differentiation. Colloids and Surfaces B: Biointerfaces, 2016; 143: 415-22.




