Volume 39 Number 4
Comparing fluid handling and microclimate conditions under superabsorbent polymer and superabsorbent foam dressings over an artificial wound
Evan Call, Craig Oberg, Iris Streit and Laurie M Rappl
Keywords Exudate, microclimate, wound, superabsorbent, dressing
For referencing Call E et al. Comparing fluid handling and microclimate conditions under superabsorbent polymer and superabsorbent foam dressings over an artificial wound. WCET® Journal 2019; 39(4):11-23
DOI https://doi.org/10.33235/wcet.39.4.11-23
Abstract
Introduction Superabsorbent foam (SAF) and superabsorbent polymer (SAP) dressings are compared on their abilities to handle moisture exuding from an artificial wound and to affect the microclimate beneath the dressings by measuring: the amount of moisture absorbed; the amount of moisture evaporated through the outer layer; the humidity, both beneath and outside the dressing and the difference between the two; and the temperature, both beneath and outside the dressing and the difference between the two.
Method A thermodynamic indenter was used in a laboratory setting to deliver a steady flow of moisture vapour across a standard wound size to each dressing under the weight of the indenter. Sensors recorded the humidity and temperature inside and outside each dressing over 3 hours and 16 minutes with a 45-second complete unweighting of the dressing at the 3- hour mark to simulate a patient weight shift. Dressings were weighed at test end to determine moisture absorbed and moisture evaporated.
Results There were no significant differences between the SAF and the SAP dressing groups in moisture absorption nor evaporation, nor in humidity nor temperature inside versus outside the dressings.
Conclusion It can therefore be determined that SAF and SAP dressings appear to be equally competent in maintaining a warm and moist microclimate in the wound bed. It should also be noted that these dressings do not dry the wound bed as the term superabsorbent may imply.
Introduction
Wound dressings are selected to manage moisture during wound healing for three reasons: to absorb exudate; to maintain an appropriate microclimate in the wound bed; and to protect the periwound from damage due to maceration from excessive moisture. Broad categories of absorptive technologies are foams, hydrocolloids, calcium alginates, hydrofibres, and moisture-binding polymers1,2. More complex superabsorbent foam (SAF) and superabsorbent polymer (SAP) dressings have been developed recently that claim to go beyond earlier dressings in managing wound moisture; however, these have been untested in comparison to each other. In addition, the term superabsorbent raises questions as to the possibility of over-absorption and therefore drying of the wound bed and inhibition of wound healing.
Exudate management
Since Winters published his pivotal work in 1963, moist wound healing has become accepted as best practice2,3. Cytokines and growth factors require moisture to diffuse throughout the wound bed to stimulate healing via wound closure and re-epithelialisation4. Maintaining the proper moisture level in a wound bed prevents desiccation which allows epithelial cells to migrate freely across the wound surface. Moist wounds granulate, epithelialise and heal two to three times faster than dry wounds5.
Exudate occurs naturally as a part of the wound healing process and keeps the wound bed moist to stimulate closure in most wounds. Some types of wounds are naturally more exudative than others, especially venous wounds, large pressure ulcers, and burns. Chronic wounds are highly exudative due to a sustained state of inflammation and disruption of normal cellular activity. Chronic wound exudate differs markedly from acute wound exudate, consisting of high levels of protein-degrading enzymes, matrix metalloproteases (MMPs), neutrophils and pro-inflammatory cytokines. Exuding wounds therefore require absorptive dressings whose capabilities match the flow of exudate to maintain an optimum moisture level at the wound bed. As these wounds begin to granulate, exudate decreases and dressing needs move from absorption to protection as a primary characteristic2.
The amount of exudate or moisture coming from a wound is commonly documented in a patient’s records with subjective descriptors such mild, moderate, severe and excessive rather than objective measurements. Several validated scales have been proposed for documenting exudate amount, including the Wound Exudate Score, the Bates-Jensen Wound Assessment Tool and the Pressure Ulcer Scale for Healing (PUSH) tool. Each scale provides a descriptor for each level on that scale. A summary and comparison of the available tools and their descriptors can be found in Wound exudate: effective assessment and management, a consensus document on exudate published by the World Union of Wound Healing Societies in 20195.
Wound microclimate
The microclimate has been identified as a key factor in both wound prevention and healing. The microclimate is the combination of temperature and humidity, and sometimes airflow, in a local region as compared to the ambient or surrounding area6. A warm moist environment is conducive to wound healing. Dini et al.7 show wound healing is impaired at <33°C by a decrease in neutrophil, fibroblast and epithelial cell activity. This same study shows a correlation between improvements in the wound bed and wound bed temperatures between 33–35°C. In addition, Salvo et al.8 report two studies showing that temperatures in the range of 36–38°C appear to promote wound healing.
Dressings, however, resist moisture escape, increasing heat and humidity levels beneath them. Advanced absorptive dressings can therefore affect the microclimate of the wound bed by drawing excessive moisture off the wound surface and maintaining warmth and humidity while dissipating excess heat and moisture through a vapour-permeable outer layer. Occlusive dressings do not have these functions.
Periwound skin
Excessive moisture on intact periwound skin weakens the dermis and epidermis by interrupting the arrangement of lipids in the stratum corneum (SC) and the linkages between epidermal cells1. The resulting increase in permeability makes the periwound more susceptible to invasion by contaminants and to the compounding effect of friction and shear. The term moisture-associated skin damage (MASD) refers globally to epidermal injuries resulting from exposure of the skin to moisture (for example perspiration) and irritants (for example urine, stool, ostomy effluent, wound exudate)1. One of the four clinical categories of MASD is periwound skin damage. Compounding the bond-weakening effects of moisture, enzymes in wound exudate that normally degrade contaminants in the wound also degrade proteins in intact skin. The resulting damage can cause pain, an increase in wound size, and decreased keratinocyte migration from the wound edges, therefore impairing wound closure9. As such, clinicians should choose dressings that prevent exudate from coming in contact with the periwound by locking in absorbed exudate. Ideally, the absorptive pad of a dressing should also be sized to that of the open wound bed rather than extending to the periwound.
Dressing constructions
Dressings are a dynamic primary method of either resisting moisture loss from a dry wound bed or absorbing excessive moisture from a wet wound bed while keeping the periwound free from excessive moisture.
Basic dressings such as pads made from cotton gauze or absorbents made from cellulose fibres or foams cover the wound bed and protect it from trauma and from the environment as well as simply absorbing moisture. Island dressings include an adherent border around the absorbent area. Dressings with increased capacities and enhanced features are used to treat highly exudative wounds that can overwhelm basic dressings.
SAP dressings are comprised of multiple layers in order to accommodate more highly exudative wounds by both absorption and evaporation of wound moisture. The superabsorbent core is often a mixture of cellulose and hydrophilic polymers wrapped in a cellulose tissue and/or a non-woven material. Most SAP dressings have an outer low-friction vapour-permeable polyurethane layer that allows moisture to transpire, thereby drawing more exudate from the wound and allowing a longer wear time. Polyurethane with a moisture vapour transmission rate of more than 35g/m2/hr is correlated with faster wound healing under occlusive dressings10. The sum of the fluid absorbed into the dressing and the fluid transpired through the dressing is called the fluid-handling capacity of the dressing, as defined by the European Committee for Standardization11.
Some SAP dressings have acrylic adhesive on a border around the absorbent island so no additional taping nor fixation of such dressing is required. Some of these dressings also feature a silicone layer across the wound surface of the dressing to minimise trauma to the wound bed – see Table 1 for an examination of the similarities and differences among a representative group of these dressings.
Table 1. Size and construction of representative test dressings.
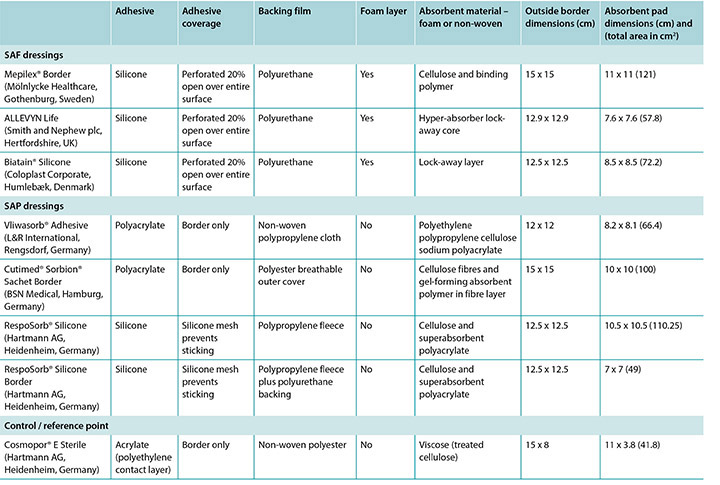
It should also be noted that the term superabsorbent can imply that a dressing can draw too much moisture from a wound and dry it out, thereby counteracting moist wound healing. One subgroup of SAP dressings – SAF dressings – are constructed in a manner similar to the SAP dressings and include an extra foam layer between the silicone and the polymer that is purported to prevent drying of the wound bed and to optimise the microenvironment of the wound bed (Table 1). Furthermore, removing pressure from a wound and dressing through a pressure release manoeuvre or a repositioning of the patient may affect moisture evaporation and heat dissipation and enhance the function of the dressing, increasing wear time.
There are few published studies comparing the effects of different dressings on similar wound types in patient use, nor ones examining the claims made by manufacturers in reference to benefits of their products in affecting the wound bed or the microclimate. Clinical research comparing dressings is very difficult to accomplish due to the many variables affecting wound healing and the impossible task of standardising patients. However, well-designed laboratory research can standardise the wound size and the exudate amount so that test dressings can be compared to each other. This standardisation limits applicability of results to the highly variable clinic population, but can provide some evidence to give guidance as to the effectiveness of a dressing in controlling the physical properties of a wound to optimise wound healing.
Study purpose
This in vitro study compares dressings in the SAF and the SAP dressing categories described in Table 1. A basic non-polymer surgical dressing was included as a control or a reference point. The dressings were studied for their abilities to handle moisture exuding from an artificial wound by measuring the:
- Amount of moisture absorbed, reported as total grams per dressing and g/cm2.
- Amount of moisture evaporated through the outer layer, reported as total grams per dressing and g/cm2.
- Humidity, both inside the covered wound bed and at the outer layer and the difference between the two.
- Temperature, both inside the covered wound bed and at the outer layer and the difference between the two.
Additionally, the effect of a pressure release or patient repositioning on each of these parameters was measured.
It is important to note that previous work was reported as simply moisture per dressing12. For this study, due to the large variation in dressings mass and surface area, these values are reported in grams of moisture per cm2.
Method
This study was conducted by an independent laboratory that is a contributor to the development of standards for support surfaces, wheelchair cushions, dressings and other wound-related medical equipment. The laboratory had an ambient temperature of 23°C ±2°C and a relative humidity of 50% ±5% as specified in ISO 554-1976(E)13.
The human model was a bronze thermodynamic rigid cushion loading indenter first described by Ferguson-Pell et al.14 for use in testing wheelchair cushions. The model was developed by a group of researchers from the United Kingdom, Japan and the United States. Since 2009 it has become a standard piece of testing equipment for studying support surfaces, dressings and wheelchair cushions in the international wound care market15 (Figure 1).
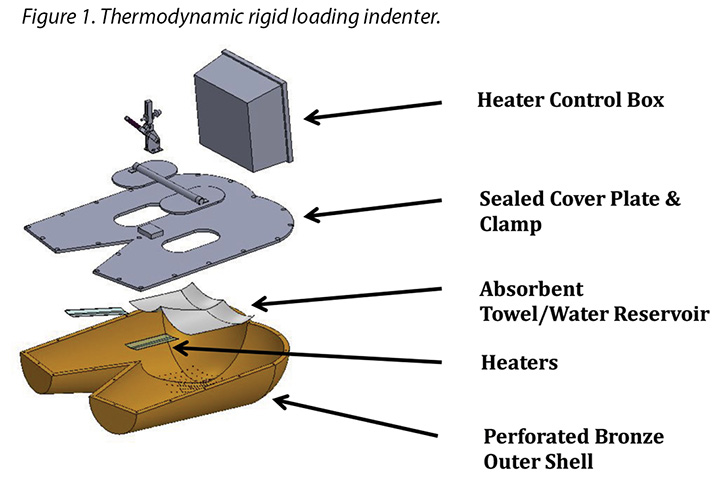
The test indenter was compliant with the American National Standards for Support Surfaces16. The indenter is shaped according to the buttocks and upper thighs of a 50th percentile human male and has pre-drilled holes in the area of the sacrum and ischium. The indenter can be loaded with pre-measured amounts of water, heated and cooled, and weighted. Diffusion of the water through the pre-drilled holes simulates moisture loss through the skin. This indenter mimics the heating, cooling, sweating and drying, weighting and unweighting of the human sacral area. Resulting conditions at the indenter–surface interface are measured, and can be compared between products, as well as in steady-state and transient conditions.
For this study the indenter was weighted with 64lbs ± 2.25lbs (just over 29kgs ± just over 1kg) which is the weight of this segment of the body for a 50th percentile male lying in bed supine. An artificial wound was created by covering all sweating pore holes not covered by the dressing pad; aluminised tape ensured no moisture evaporated outside the artificial wound area (Figure 2). This left an area of 7x7cm holes for moisture vapour; this was used for all dressings tested.

Challenging dressings under these conditions provides a scenario that is clinically relevant because foams and polymers are compressed and moisture vapour escape is reduced by the actual use conditions of the test14,15. For example, temperature and humidity sensors are high accuracy digital sensors manufactured by Sensirion AG (Staefa ZH, Switzerland) which are accurate to ±1.8% at 0–80% relative humidity and ±0.3°C at 20–50°C. The test support surface was an open-cell foam cushion 3x18x18” (7.6x45.7x45.7cm) covered with a breathable liquid moisture-resistant mattress cover by Dartex Coating US (Slaterville, RI) and positioned on a rigid mattress board.
Moisture and humidity were supplied by a weighed amount of distilled water soaked into EnduracoolTM Microfiber Cooling towels. This towel was chosen because the microfibre is a thermo-regulating technology with a moisture release rate compatible with previous published studies on LAL support surfaces17,18. In a laboratory setting, wound exudate is represented by distilled water. While the properties of each fluid differ markedly, the study is designed to demonstrate performance differences and this can be accomplished with a standard fluid. Previous publications characterising the moisture-handling capacity of dressings using this method provide a comparative baseline12.
The wound model used here is not a highly exudating model; it is a water vapour model. This model delivers a low level of moisture to the dressing surface over a period of time in a controlled manner so that a researcher can determine if the moisture is bound to the dressing or transpires through it. Test dressings were chosen from conveniently acquired and commonly utilised multilayer dressings in the European Union and in the United States. The representative dressings are listed in Table 1.
The indenter was suspended over the cushion by an H-frame which was positioned around the bed frame at about the midpoint of the bed frame. The cushion was centred under the indenter so that the ischial tuberosity area of the indenter was located 10–15cm from the rear edge of the cushion (Figure 3). The indenter was set to 37°C. The weights of two dry sets of EnduracoolTM towels were recorded, then 100±1g of distilled water was added to each towel set providing a potential for 200g to be delivered to the dressing. Each towel was folded in thirds and placed inside the indenter so that the towels covered all of the sweating pore holes. Heated weights were placed on top of the towels to facilitate moisture delivery.

Three sensors were placed to sense moisture escaping from the artificial wound area (Figure 4). Sensor locations were modified to accommodate the size of each dressing. The dressing was centred over the open sweating pore holes and covered all three sensors. Sensors placed outside the dressing lined up with those under the dressing (Figure 4). The indenter was lowered so that it settled on the support surface and transferred the full load of 64lbs ± 2.25lbs (just over 29kgs ± just over 1kg) to the support surface. A seventh sensor was used to measure ambient temperature and humidity. An EK-H4 Viewer program was set to log data at 30-second intervals through the test period.

To simulate a pressure release or patient repositioning, the indenter was raised from the support surface for 45 seconds at 3 hours ± 6 minutes. Readings were taken five minutes before the lift, identified as 175 minutes in the results section, to provide an air gap between the indenter and the support surface. It was held fully suspended from the support surface for a total of 45 seconds ± 10 seconds, then lowered back onto the support surface fully loaded for an additional 15 minutes ± 1 minute. Final readings are reported as 196 minutes in results.
At the end of the test the indenter was raised and the towels were removed and weighed. The dressing was removed from the indenter and artificial wound, and its weight recorded. The weight of a dry paper towel was recorded, the towel was used to wipe all moisture remaining in the indenter, and the towel was weighed again.
Between trials the indenter was allowed to return to steady state before the next trial was initiated. Distilled water was added to return the towels and the water mass back to the total weight of the dry towels plus 200±1g of distilled water. Two cushions and two covers were used; these were switched between trials to allow full recovery. A total of three trials were done for each dressing. Three trials were also performed with the indenter hanging in the air for 3 hours and 16 minutes without a dressing applied to measure the moisture vapour output of the artificial wound.
The final weight of the towels plus the paper towel was subtracted from the starting weight of the towels to ascertain the total amount of distilled water delivered to the system. Moisture absorbed in the dressing pad was calculated by subtracting the dressing initial weight from the dressing’s final weight. The amount of water vapour produced from the system was calculated by subtracting the starting weight of the towels from the end weight of the towels and adding the moisture recovered from inside the indenter using the paper towel. The amount of moisture that evaporated the dressing was calculated by subtracting the amount of moisture trapped in the dressings from the amount of water vapour produced by the system. The 95% CI was calculated.
While the artificial wound size was constant throughout the study, the absorbent pads for the dressings varied from 41.8cm2 to 121cm2 (Table 1). As such, the total moisture absorbed and evaporated per dressing was calculated. Calculations for moisture absorbed and moisture evaporated were done on a per cm2 basis as well to account for the variability in dressing sizes and to more accurately compare dressing performance. The average difference in temperature and humidity between the outside or cushion surface of the dressing and the inside or patient side of the dressing at 175 minutes and over the full length of the test was calculated by averaging the difference between the value over the dressing and the value under the dressing for each data point.
Results
The aim of the study was four-fold, namely to measure: the amount of moisture absorbed; the amount of moisture evaporated through the outer layer; the humidity, both beneath and outside the dressing and the difference between the two; and the temperature, both beneath and outside the dressing and the difference between the two.
The amount of moisture each dressing absorbed is shown in Table 2. This shows the total moisture and the moisture absorbed in g/cm2 per dressing as well as showing the average. The range of the SAF dressing group was 0.22–0.34g. The range of the SAP dressing group was 0.24–0.39g if the one outlier at 0.56g is not considered. The reference dressing was the smallest in area and absorbed the least by far. The range for six of the seven study dressings was 0.22–0.39g.
Table 2. Moisture absorbed in absorptive pad and moisture evaporated per dressing in total g and g/cm2 and averages of SAF and SAP.
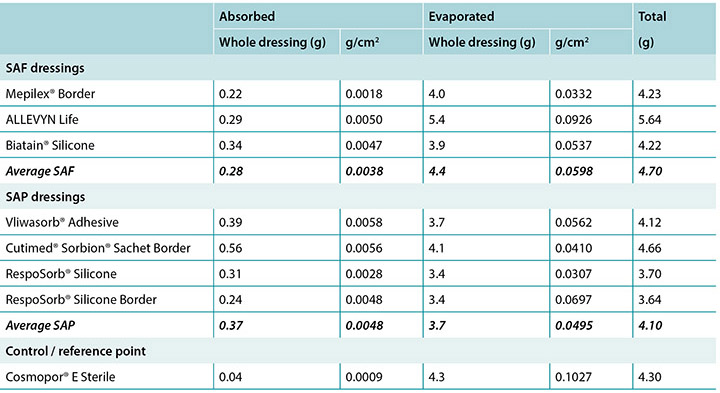
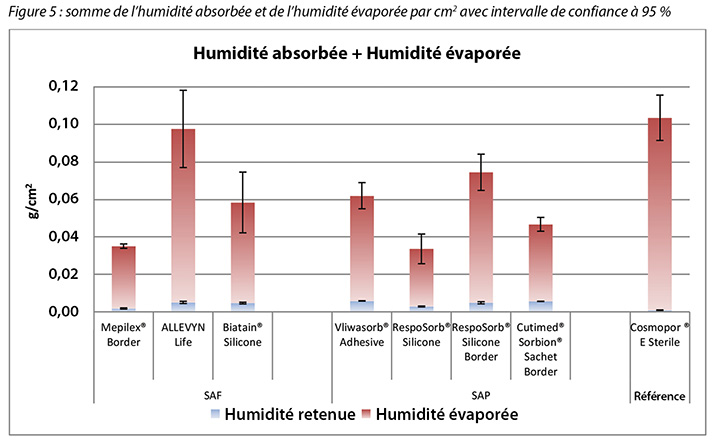
The amount of moisture evaporated (transpired or evaporated) through the outer polyurethane layer is also shown in Table 2 and in Figure 5. The range of the SAF dressing group was 3.9–5.4g, a difference of 1.5g, whereas the range of the SAP dressing group was 3.4–4.1g, a difference of just 0.7g. Indeed, six of the seven test dressings were within 0.7g of each other (range 3.4–4.1g). There was no significant difference among the dressings at a 95% CI.
In Table 2 it should be noted that the total amount of moisture delivered by the indenter was 5.9g. Adding together moisture absorbed and moisture evaporated shows that none of the dressings removed all of the moisture.
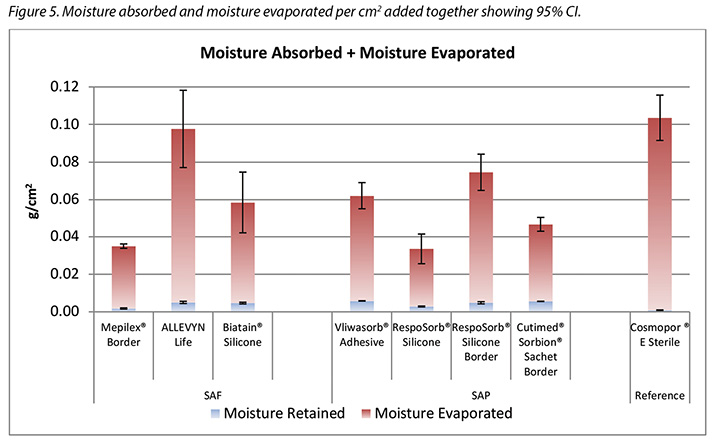
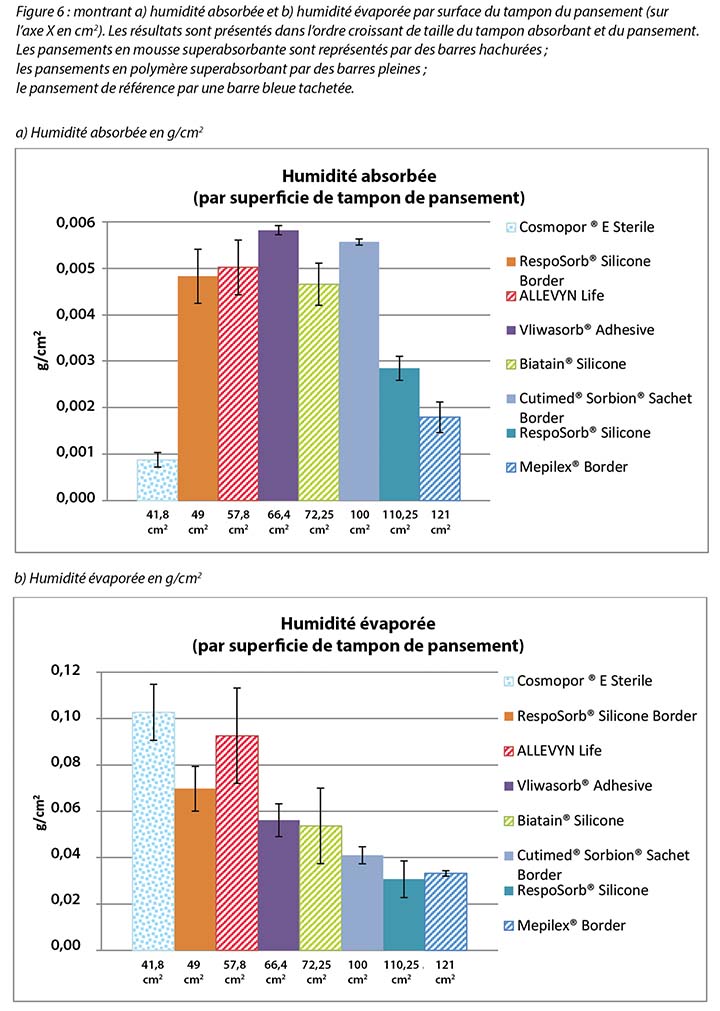
Figure 5 graphs the total amount of moisture absorbed and moisture evaporated in gcm2 for each dressing. Figures 6a and 6b graph the moisture absorbed and the moisture evaporated per cm2 arranged in order of size of the absorbent pad, from smallest to largest. As the dressing size increased, the amount of moisture absorbed and escaping per cm2 appears to decrease, making the larger pads appear to perform more poorly. However, larger dressings have more area over which to absorb and evaporate moisture, and this graph is not standardised for wound and dressing size.
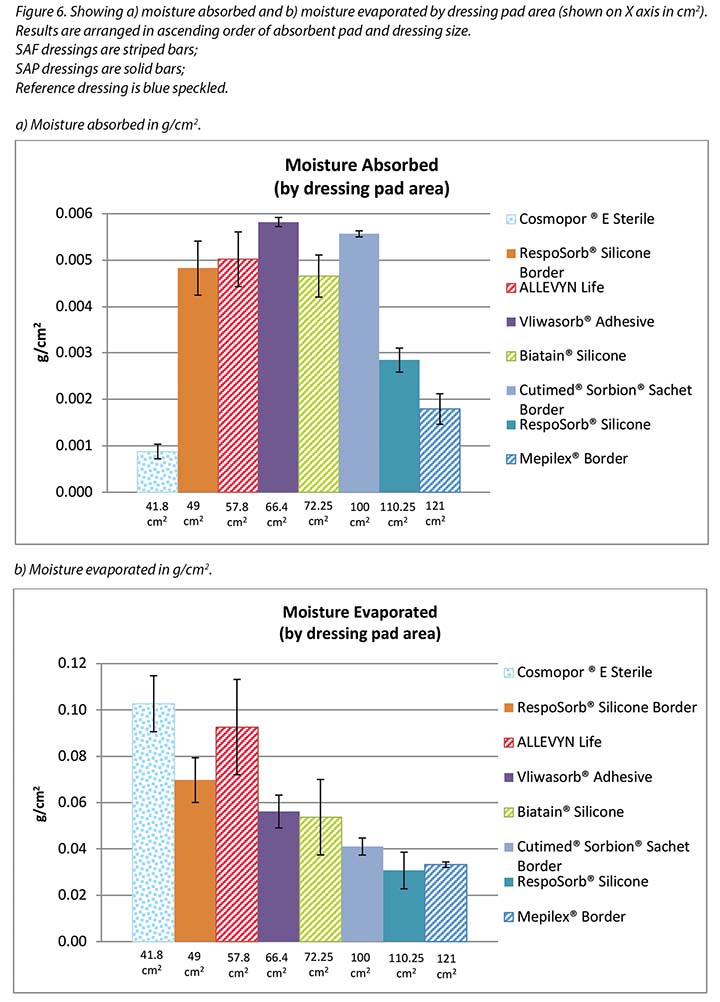
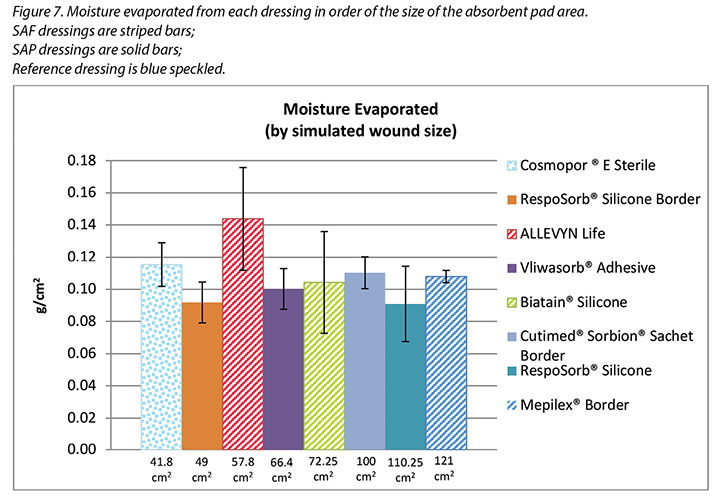
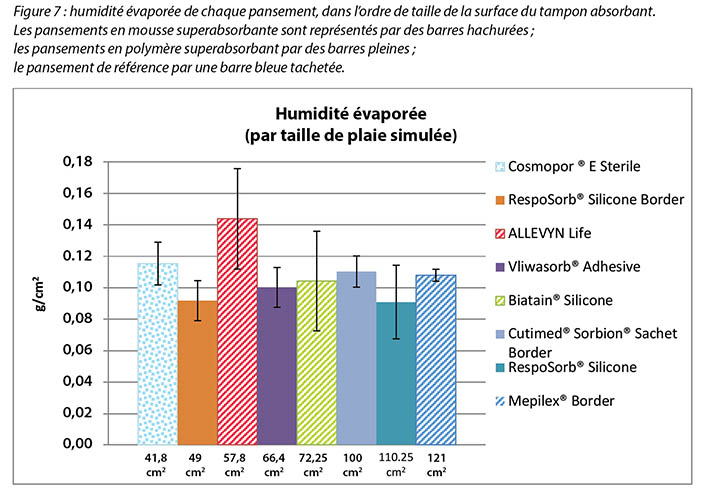
Figure 7 graphs the moisture evaporated per cm2 per wound area. That is, the dressings are compared by using both a standard wound size – the area of the exposed holes in the indenter – and a standard amount of vapour across a standard area. When compared in this way, all dressings manage approximately the same amount of moisture according to their absorbent area.
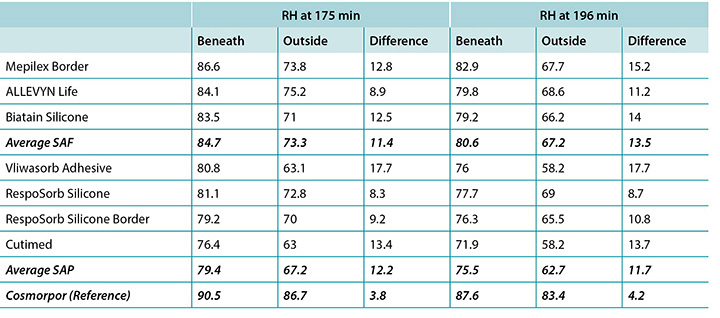
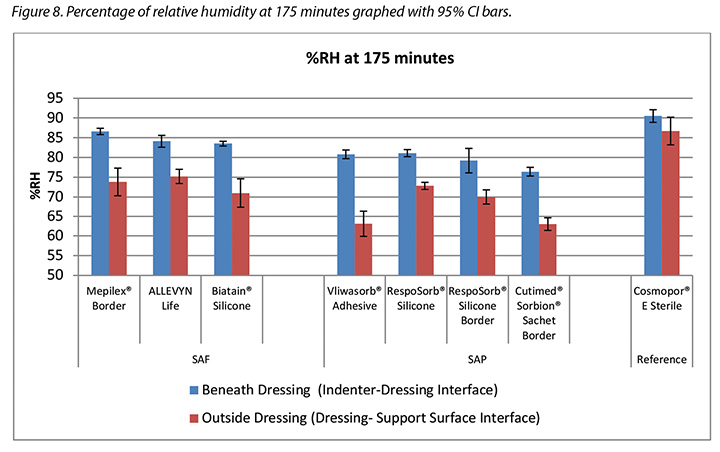
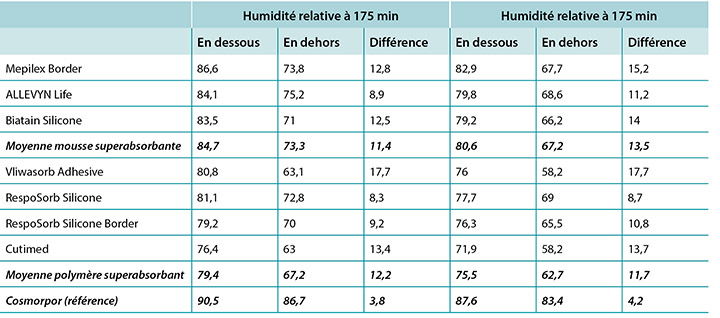
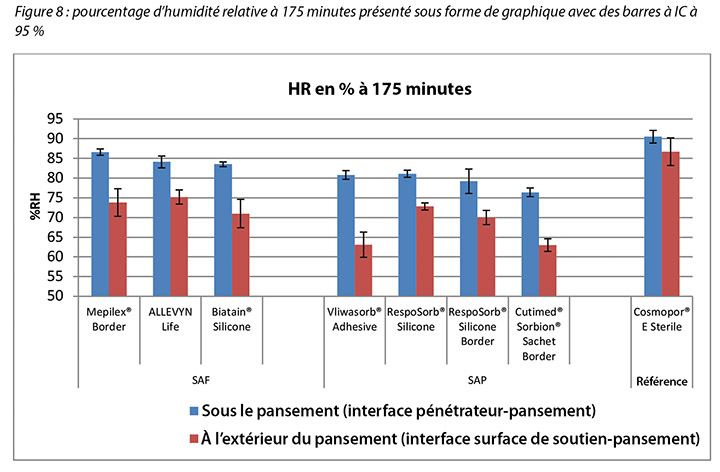
The humidity, both beneath and outside the dressing as well as the difference between the two, was also recorded. Table 3 shows the average percentage of relative humidity at 175 minutes (before pressure release) and at 196 minutes (after pressure had been reapplied for 15 minutes, at test end) inside and outside the dressings, and the difference between the inside and outside dressings, by dressing and by group. At 175 minutes all humidity readings outside the dressings were above ambient (50%), indicating active transpiration across the polyurethane backings. The SAF dressing group had a higher average humidity both inside and outside the dressing than the SAP dressing group, but the difference between the inside and the outside of the two groups was similar, 11.4 and 12.2% respectively. The reference dressing had much higher humidity both inside and outside the dressing, with a difference of only 3.8% (Table 3 and Figure 8). At 196 minutes the SAF dressing group had higher average humidities inside and outside the dressing than the SAP dressing group, but the differences between the inside and the outside were greater in the SAF dressing group. The reference dressing had a very small difference between the inside and the outside (Table 3). Looking at the error bars in Figure 8, there were no significant differences among the dressings at the 95% CI.
Table 3. Average percentage of relative humidity at 175 and 196 minutes.
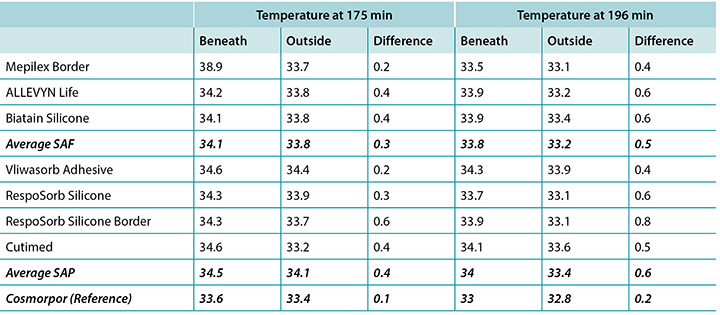
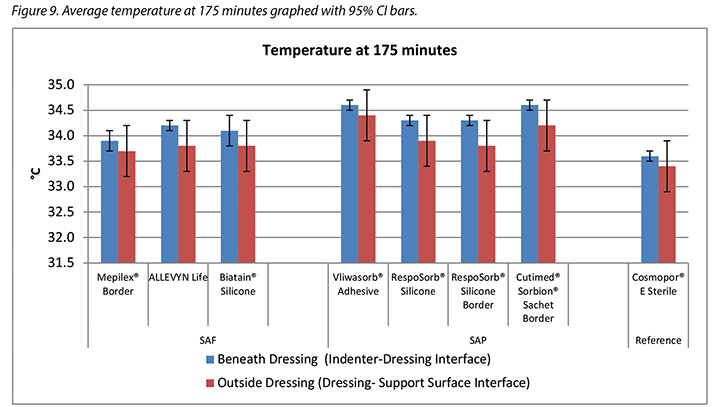
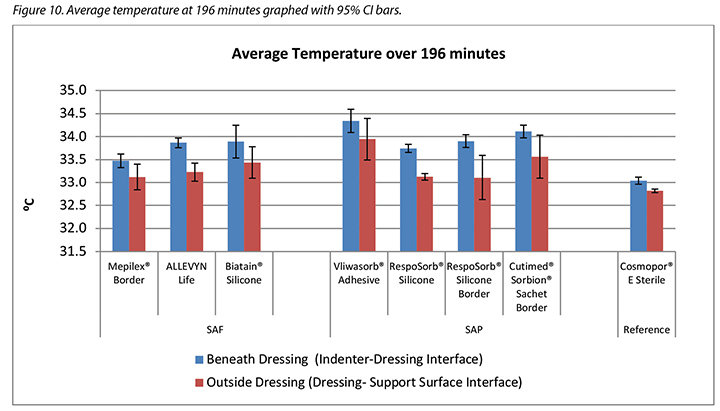
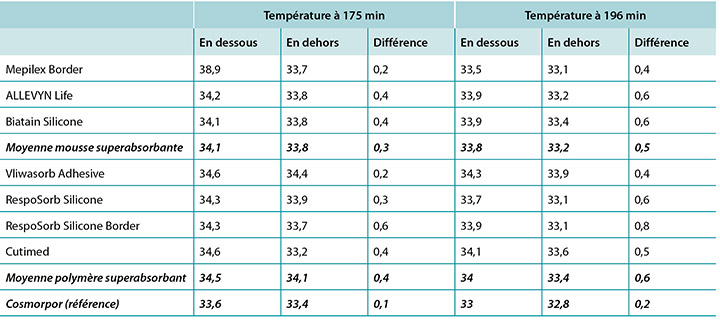
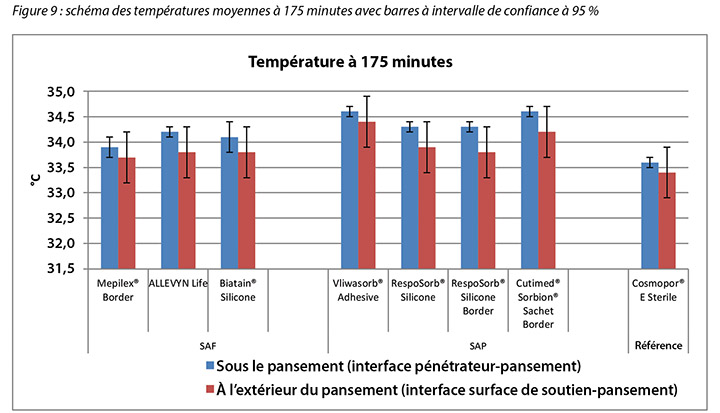
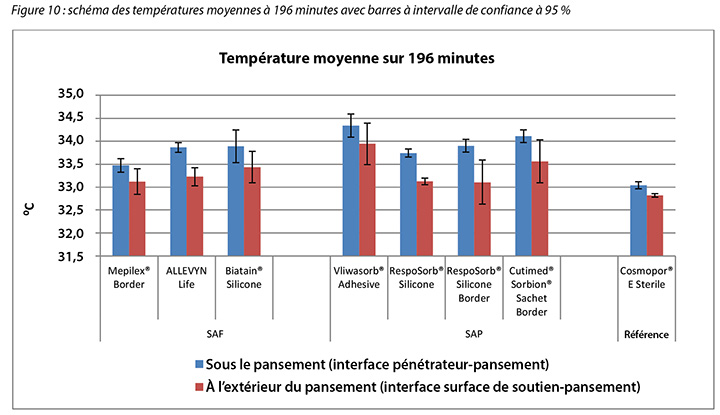
The temperature, both beneath and outside the dressing as well as the difference between the two, was also recorded. At 175 minutes, the average temperatures of the SAF dressing group, the SAP dressing group, and the reference dressing were within 0.9°C. The SAF and the SAP dressing groups had larger differences in temperature between the inside and the outside of the dressings than the reference dressing (Table 4 and Figure 9). At 196 minutes the average temperatures of the SAF and SAP dressings both inside and outside the dressings were within 0.2°C of each other. The reference dressing was only slightly below the two groups (Table 4 and Figure 10). The range of temperatures inside and outside the dressings at 196 minutes was 33.1–34.3°C. The range of temperature difference between the inside and the outside of the dressings was 0.4–0.8°C. The negative control had a temperature difference of only 0.2°C. There were no significant differences among the dressings at the 95% CI.
Table 4. Average temperature at 175 and 196 minutes.
Discussion
This study measures the relative performance of dressings in a laboratory setting by comparing results at specific time points and averaged across time. While the 3+ hour test period is a small segment of time compared to the length of time that a patient normally wears these types of dressings, the test gives an indication of how they may perform relative to each other over longer times.
This method tested how dressings handle moisture from a low steady exuding of vapour. When the integument is compromised in a stage 2, 3 or 4 wound, the regulation of moisture vapour escape is compromised as well, adding to the moisture that a dressing must handle. Total vapour can compromise the integument and must therefore also be considered when evaluating dressings6,19.
As expected, the more advanced SAF and SAP dressings outperformed the control/reference point basic island dressing in most categories.
Moisture absorbed and moisture evaporated
Both SAF and SAP dressing groups absorbed significantly more moisture in the pad than the reference dressing, indicating that their polymer materials absorb and lock in moisture and prevent it from migrating to the periwound or the wound bed. Six of the seven advanced dressings absorbed between 0.24–0.39g, with one outlier absorbing 0.56g. Dressings are expected to absorb enough to prevent maceration of the wound bed but not so much as to dry it. In order to dry a wound, a dressing would have to absorb and transpire all of the moisture provided to it. None of these dressings did, therefore the total of the moisture for each dressing in Table 2 does not equal the total moisture delivered by the indenter, 5.9g. It appears from these results that the SAF and SAP dressings are adept at absorption and will not dry a wound that exudes at the moderate level of the test fixture. The ALLEVYN Life comes closest to absorbing and transpiring all of the fluid supplied.
The same amount of moisture was delivered to all dressings. The smallest dressing had the least moisture absorbed and the most moisture which evaporated; this may be expected because the wound size was constant throughout, leaving the ratio of area of the artificial wound delivering the moisture to the area of the dressing that is available to transpire it dramatically greater for the larger dressings. Larger dressings are able to absorb and retain more, and the polymer locked in that moisture so that it could not – and did not – escape. Larger dressings can also spread and diffuse the moisture over a larger area.
The SAF dressing group, the SAP dressing group and the reference dressing were not significantly different in the amount of fluid that evaporated or transpired from the wound area at the 95% CI (Figure 6b). When moisture evaporated is graphed based on both moisture delivered and pad area in g/cm2, the advanced dressings are very similar (Figure 7). Various sizes of dressing can affect results. However, when results are shown in g/cm2 in order to compare various sized dressings, the differences are very small. This makes interpretation more difficult.
This test was performed consistent with other testing – some published and some unpublished – where striking differences in moisture handling between advanced dressings were shown6,12. This has inspired manufacturers to improve their products and the polymers and vapour-permeable backings used in the dressings, possibly resulting in more uniformity in dressing structures and the similarity in apparent handling capacities among the tested dressings.
Humidity and temperature
Specific temperature and humidity values defining the optimal microclimate conditions have not yet been determined by clinical nor laboratory research. Dressings are expected to keep the wound bed moderately warm and moist rather than too wet or too dry, too warm or too cool relative to the individual patient’s normal subdermal or dermal body conditions and to the external atmosphere. Higher humidity and moisture levels may negatively impact the wound environment just as they weaken intact skin1. The SC is in equilibrium hydration at ambient humidity of 40–60% but absorbs water at disproportionately increasing rates above 60%20–22. Wildnauer’s results show that relative humidity above 60% has the greatest influence in decreasing internal cohesive forces within the SC23.
At 175 minutes, all dressings were above 75% relative humidity beneath the dressing with a range of 83.5–86.6% for SAF dressings and 76.4–81.1% for the SAP dressings. It is reasonable to consider these values as moist. Dressings with higher inside humidities – the SAF dressing group and the reference dressing at 90.5% – may be cause for concern in potentially over-hydrating the wound bed or periwound. At 175 minutes, all dressings also had lower humidity readings outside the dressing than inside, as would be expected. All of the humidity levels outside the dressings were higher than ambient, indicating that the polyurethane backing does evaporate or transpire fluid. There was also a correlation between relative humidity beneath the dressing and moisture absorbed by the dressing pad. Lower moisture absorbed by the pad correlated with higher humidity beneath the dressing (Pearson’s correlation coefficient = –0.83).
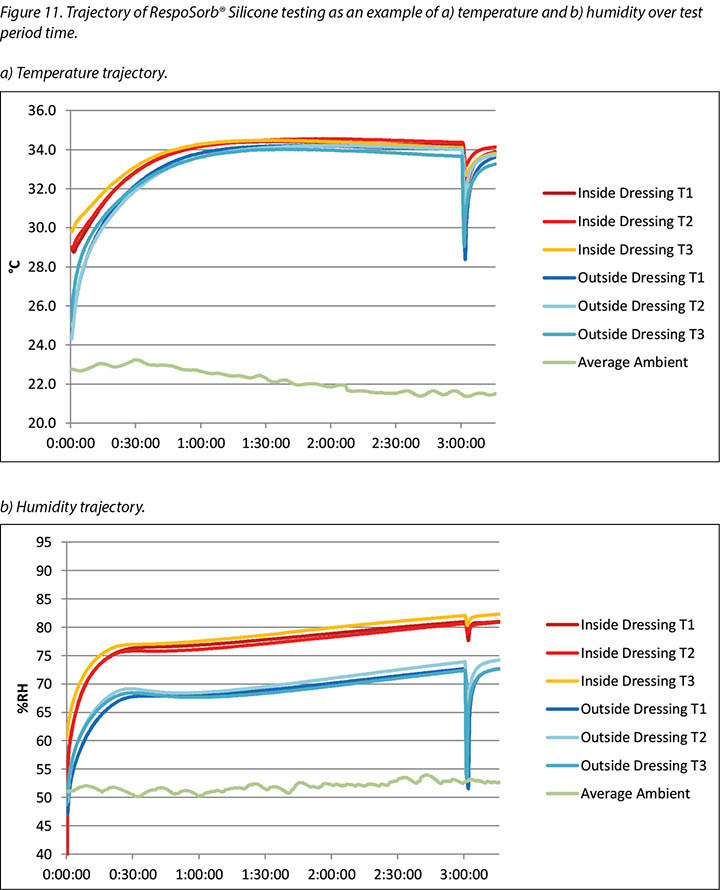
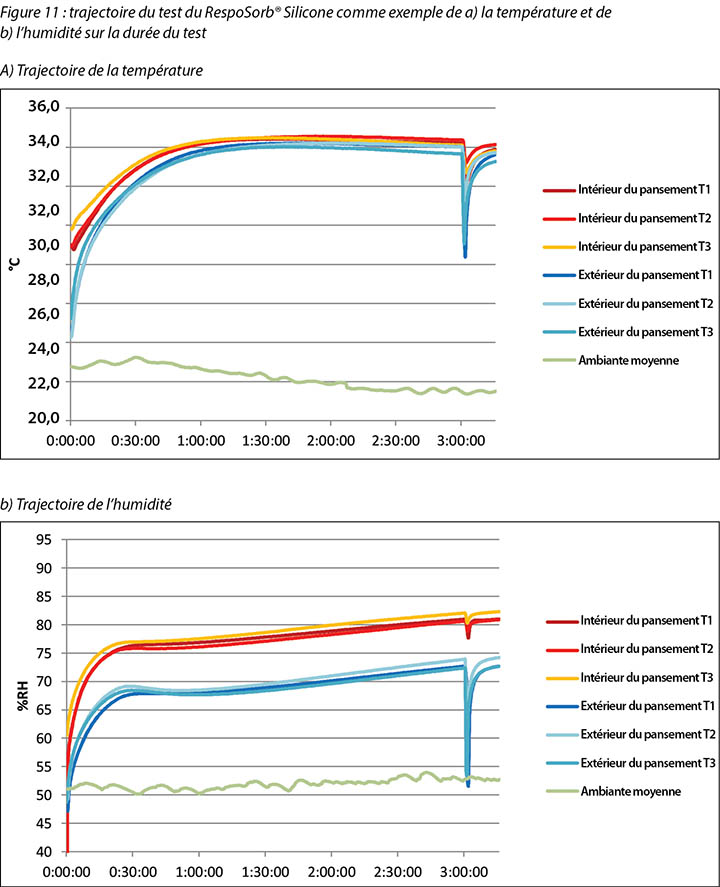
The complete release of pressure at 176 minutes suspended the indenter and the test dressing in air and allowed exchange of heat and moisture with the environment. Figure 11 shows the graphed results for one of the dressings, RespoSorb® Silicone, across the 196 minutes of the test. This is illustrative of a similar path seen for all dressings. Temperatures and humidities rose early in data collection, then temperatures eventually plateaued while humidities continued to rise. Both values dropped sharply when the indenter was lifted for the 45 second pressure release, then increased to or near pre-lift levels. It was impressive that a pressure release can have a rapid, measurable and significant affect on both heat and moisture which demonstrates the benefits of frequent position changes beyond addressing simply pressure and shear. Fifteen minutes after the pressure relief lift, at 196 minutes, all humidity levels were above 70%, with the reference dressing the highest at 87.6%. It appears that moisture vapour escapes more readily than it is trapped as, within 15 minutes of the lift, all values returned to the 175-minute levels.
Both dressing groups kept the wound bed relatively warm as indicated by lower temperatures outside the dressing than inside. This is conducive to wound healing as all were within the recommended 33–35°C range7. Yusuf et al.24 reported that a skin temperature difference of only 0.3°C predicted pressure ulceration. While this measurement is not in a wound bed, it does indicate that small differences in skin temperature can relate to damage. The range of inside dressing temperatures among the dressings was 1°C at 175 minutes and 0.8°C at 196 minutes, so these ranges could be problematic. While Yusuf’s study does not prove causation, we need to be aware of a possible effect of temperature on tissue integrity.
Temperature differences are cumulative. The rate at which temperature drops after a pressure release could affect this accumulation. A small difference accumulated over time can make a large difference. The drops in temperatures at 175 and 196 minutes per dressing were greatest for both the RespoSorb® dressings.
Limitations
It would be of interest to perform this study on a heavily exuding wound model rather than a vapour-exuding intact skin model in order to examine the performance of the dressings under conditions in which they are normally used more accurately.
Conclusion
This in vitro study concludes that SAF dressings and SAP dressings appear to be equally competent in maintaining a warm and moist microclimate at the wound bed level to enhance wound healing. They absorb more moisture per cm2 and evaporate or transpire more moisture than more basic dressings. The foam layer in SAF dressings does not appear to improve microclimate conditions at the wound bed over SAP dressings without the foam layer. Neither the SAF nor the SAP dressings dry the wound bed as the term superabsorber may imply. It was also shown that periodic relief of pressure markedly decreases temperature and humidity at the wound bed which enhances the function of the dressing and may increase wound healing.
Conflict of Interest
The authors declare no conflicts of interest.
Funding
This study was funded by Paul Hartmann AG, Heidenheim, Germany, manufacturer of RespoSorb® Silicone and RespoSorb® Silicone Border.
Comparaison de la gestion de l’exsudat et des conditions microclimatiques sous des pansements en mousse superabsorbante et en polymère superabsorbant sur une plaie artificielle
Evan Call, Craig Oberg, Iris Streit and Laurie M Rappl
DOI: https://doi.org/10.33235/wcet.39.4.11-23
Résumé
Introduction Les capacités des pansements en mousse superabsorbante et en polymère superabsorbant à gérer l’exsudat d’une plaie artificielle et à affecter le microclimat sous les pansements sont comparées en mesurant : la quantité d’humidité absorbée, la quantité d’humidité évaporée à travers la couche extérieure, l’humidité présente sous et à l’extérieur du pansement et la différence entre les deux, la température sous et à l’extérieur du pansement et la différence entre les deux.
Méthode Un pénétrateur thermodynamique a été utilisé dans un laboratoire pour diriger un flux constant de vapeur d’eau sur une plaie de taille standard, chaque pansement ayant été soumis au poids du pénétrateur. Des capteurs ont enregistré l’humidité et la température sous et à l’extérieur des pansements pendant 3 heures et 16 minutes et, au bout de 3 heures, en minimisant la pression du poids sur le pansement pendant 45 secondes pour simuler un transfert de poids du patient. Les pansements ont été pesés à la fin du test pour mesurer l’humidité absorbée et l’humidité évaporée.
Résultats Aucune différence significative n’a été constatée entre les groupes de pansements (en mousse superabsorbante et en polymère superabsorbant), ni en termes d’absorption et d’évaporation de vapeur, ni en termes d’humidité ou de température sous et à l’extérieur des pansements.
Conclusion On peut donc en conclure que les pansements en polymère et les pansements en mousse présentent les mêmes capacités de maintien d’un microclimat humide et chaud dans le lit d’une plaie. On peut également noter que ces pansements n’assèchent pas le lit de la plaie comme le terme « superabsorbant(e) » peut le supposer.
Introduction
Les pansements appliqués sur les plaies servent aussi à gérer l’humidité pendant la cicatrisation, et cela pour trois raisons : pour absorber l’exsudat, maintenir un microclimat adapté dans le lit de la plaie et protéger la peau périlésionnelle face aux risques de macération due à l’excès d’humidité. Plusieurs technologies d’absorption existent : mousses, hydrocolloïdes, alginates de calcium, hydrofibres et polymères hygroscopiques.1, 2 Des pansements en mousse superabsorbante et en polymère superabsorbant de nature plus complexe ont récemment été conçus. Ils prétendent offrir encore plus de capacités de gestion de l’humidité des plaies que leurs prédécesseurs, mais n’ont pas fait l’objet de test de comparaison entre eux. En outre, le terme « superabsorbant » soulève des questions quant au risque de surabsorption et donc d’assèchement du lit de la plaie et d’inhibition de la cicatrisation de la plaie.
Gestion de l’exsudat
Depuis la publication par Winters de ses études décisives en 1963, la cicatrisation de plaie en milieu humide s’est imposée comme pratique exemplaire.2, 3 Les cytokines et les facteurs de croissance ont besoin d’humidité pour se diffuser à travers le lit de la plaie et stimuler la cicatrisation en favorisant la fermeture de la plaie et la réépithélialisation.4 Le maintien d’un niveau d’humidité adéquat dans le lit de la plaie empêche son dessèchement, ce qui permet aux cellules épithéliales de migrer librement sur la surface de la plaie. Les plaies en milieu humide deviennent granuleuses, se revêtent d’épithélium et se cicatrisent trois fois plus vite que les plaies en milieu sec.5
La sécrétion d’exsudat est un phénomène naturel dans le processus de cicatrisation des plaies et maintient le lit de la plaie en milieu humide pour stimuler la fermeture de la plupart des plaies. Certains types de plaies sont naturellement plus exsudatifs que d’autres, notamment les plaies veineuses, les escarres de grande taille et les brûlures. Les plaies chroniques sont extrêmement exsudatives en raison d’une inflammation constante et d’une perturbation de l’activité cellulaire habituelle. L’exsudat des plaies chroniques est sensiblement différent de celui des plaies aiguës et présente de hauts niveaux d’enzymes dégradant les protéines, de métalloprotéases matricielles (MPM), de neutrophiles et de cytokines pro-inflammatoires. Sur des plaies exsudatives, il faut donc utiliser des pansements absorbants pouvant résorber le flux d’exsudat afin de maintenir un niveau d’humidité optimal dans le lit de la plaie. Au début de la granulation de ces plaies, la quantité d’exsudat diminue et le pansement quitte son rôle d’absorption pour un rôle de protection de la plaie.2
La quantité d’exsudat ou d’humidité suintant d’une plaie est généralement inscrite dans le dossier médical du patient avec des descripteurs subjectifs comme léger, moyen, sévère ou excessif, au lieu de mesures objectives. Plusieurs échelles de valeurs validées ont été proposées pour enregistrer avec plus de précision la quantité d’exsudat : le Score d’exsudat des plaies, l’Outil d’évaluation des plaies de Bates-Jensen et l’Échelle de guérison de l’escarre PUSH. Chaque échelle propose un descripteur pour chaque niveau sur cette échelle. Un résumé et une comparaison des outils disponibles et de leurs descripteurs sont consultables dans le document consensuel « Wound exudate: effective assessment and management », publié en 2019 par la World Union of Wound Healing Societies.5
Microclimat des plaies
Le microclimat des plaies a été désigné comme un facteur clé à la fois de prévention et de cicatrisation des plaies. Le microclimat est la combinaison de la température et de l’humidité, et parfois de la circulation d’air dans une région locale comparé à la zone ambiante ou environnante6. Un environnement humide et chaud est propice à la cicatrisation d’une plaie. Dini et al.7 ont démontré qu’une température < 33 °C contrarie la cicatrisation d’une plaie en raison d’une baisse d’activité des neutrophiles, fibroblastes et cellules épithéliales. Cette même étude montre une corrélation entre des améliorations du lit de la plaie et des températures du lit de la plaie comprises entre 33 et 35 °C. En outre, Salvo et al.8 ont réalisé deux études indiquant que des températures comprises entre 36 et 38 °C semblent favoriser la cicatrisation des plaies.
Pourtant, les pansements retiennent l’humidité, ce qui accroît les niveaux de chaleur et d’humidité sous le pansement. Des pansements absorbants perfectionnés peuvent donc avoir un effet sur le microclimat du lit de la plaie : ils absorbent l’excès d’humidité de la surface de la plaie et maintiennent la chaleur et l’humidité en dissipant les excès de chaleur et d’humidité à travers une couche externe perméable à la vapeur. Les pansements occlusifs n’ont pas ces capacités.
Peau périlésionnelle
L’excès d’humidité sur une peau périlésionnelle intacte affaiblit le derme et l’épiderme en interrompant l’arrangement des lipides dans la couche cornée (CC) et les liaisons entre les cellules épidermiques.1 Il en résulte une plus grande perméabilité qui rend la peau périlésionnelle plus susceptible à une invasion par des contaminants et à l’effet cumulatif de la friction et du cisaillement. Les expressions « dommages cutanés associés à l’humidité » (DCAH) ou « altérations de la peau associées à l’humidité » désignent globalement des lésions de l’épiderme dues à une exposition de la peau à l’humidité (comme la transpiration) et à des substances irritantes (comme l’urine, les selles, les effluents de stomie, l’exsudat de plaie).1 L’une des quatre catégories cliniques de DCAH est la dermatite périlésionnelle associée à l’humidité. En plus d’un affaiblissement des liaisons entre les cellules épidermiques dû à l’humidité, les enzymes de l’exsudat de la plaie qui dégradent normalement les contaminants de la plaie dégradent également les protéines dans la peau saine. Les dommages qui en résultent causent des douleurs, une augmentation de la taille de la plaie et une diminution de la migration des kératinocytes des bords de la plaie, ce qui nuit à sa fermeture.9 Ainsi, les cliniciens doivent choisir des pansements qui absorbent et retiennent l’exsudat pour empêcher tout contact avec la zone périlésionnelle. Idéalement, le tampon absorbant d’un pansement ne doit pas atteindre la région périlésionnelle et sa taille doit correspondre à celle du lit de la plaie ouverte.
Constructions des pansements
Les pansements sont une méthode primaire dynamique permettant soit d’éviter une perte d’humidité du lit d’une plaie sèche, soit d’absorber l’excès d’humidité du lit d’une plaie humide, tout en protégeant la peau périlésionnelle d’un excès d’humidité.
Les pansements de base comme les tampons en gaze de coton ou les absorbants à base de fibres de cellulose ou de mousses recouvrent le lit de la plaie, le protègent des traumatismes et de l’environnement et absorbent tout simplement l’humidité. Les pansements « island dressing » comportent une bordure adhésive autour de la zone absorbante. Des pansements plus avancés et aux capacités renforcées sont utilisés pour traiter les plaies extrêmement exsudatives pour lesquelles les pansements habituels ne suffisent pas.
Les pansements en polymère superabsorbant présentent plusieurs couches et sont adaptés aux plaies extrêmement exsudatives, car ils assurent une absorption et une évaporation de l’humidité de la plaie. La partie centrale superabsorbante est souvent composée de polymères cellullosiques et hydrophiles enveloppés dans un tissu de cellulose et/ou un matériau non tissé. La plupart des pansements en polymère superabsorbant présentent une couche extérieure de polyuréthane perméable à la vapeur et à faible frottement permettant à l’humidité de transpirer, extrayant donc davantage d’exsudat de la plaie, et prolongeant le port du pansement. Le polyuréthane dont le taux de transmission de vapeur d’eau est supérieur à 35 g/m2/h est corrélé à une cicatrisation de plaie plus rapide sous des pansements occlusifs.10 La somme du fluide absorbé par le pansement et du fluide transpiré à travers le pansement est ce que l’on appelle la capacité de rétention des fluides du pansement, comme défini par le Comité européen de normalisation.11
La partie centrale absorbante de certains pansements en polymère superabsorbant est bordée d’un adhésif acrylique de sorte qu’aucun sparadrap ni aucun bandage supplémentaire n’est nécessaire. Certains de ces pansements présentent également une couche de silicone qui recouvre la surface de la plaie afin de minimiser le risque de traumatisme au lit de la plaie (cf. tableau 1 pour connaître les points communs et les différences entre des pansements d’un groupe représentatif).
Tableau 1 : taille et construction des pansements de test représentatifs
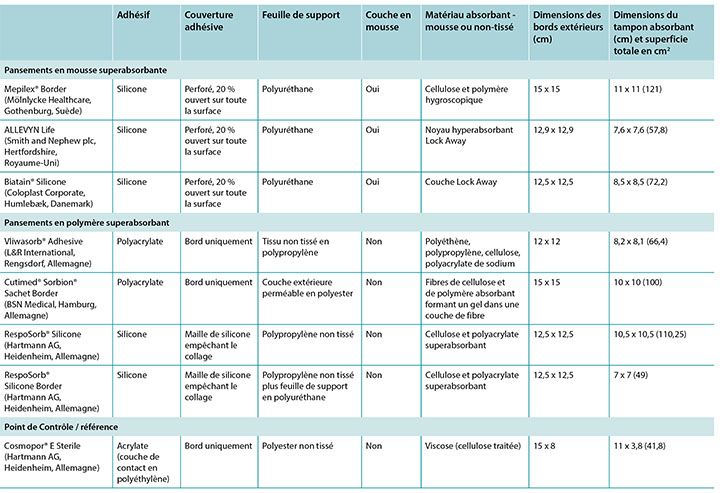
Il faut également noter que le terme superabsorbant peut impliquer qu’un pansement risque d’extraire trop d’humidité d’une plaie et l’assécher, ce qui nuit à la cicatrisation d’une plaie humide. Une
sous-catégorie de pansements en polymère superabsorbant (pansements en mousse superabsorbante) conçue un peu comme les pansements en polymère superabsorbant comporte une couche supplémentaire de mousse entre le silicone et le polymère. Cette couche empêche l’assèchement du lit de plaie et en optimise le micro-environnement (voir le tableau 1). En outre, retirer la pression d’une plaie et d’un pansement par une manipulation de relâchement de pression ou un changement de position du patient peut avoir des effets sur l’évaporation de l’humidité et sur la dissipation de la chaleur, et accroître l’efficacité du pansement qui pourra être porté plus longtemps.
Les études comparant les effets des différents pansements sur des plaies similaires sont peu nombreuses et les arguments des fabricants vantant les avantages de leurs produits et leurs effets bénéfiques sur le lit de la plaie et son microclimat ne sont pas non plus étudiés. Les études cliniques de comparaison de pansements sont très difficiles à réaliser en raison des nombreuses variables affectant la cicatrisation des plaies et du fait qu’il est impossible de standardiser les patients. Néanmoins, des recherches bien conçues menées en laboratoire peuvent standardiser la taille des plaies et la quantité d’exsudat afin de comparer les pansements testés. Si cette standardisation limite l’applicabilité des résultats à la population clinique qui est très variable, elle peut néanmoins fournir certaines preuves permettant de déterminer l’efficacité d’un pansement à contrôler les propriétés physiques d’une plaie, le but étant toujours d’en optimiser la cicatrisation.
Objectif de l’étude
Cette étude in vitro compare les pansements des catégories « polymère superabsorbant » et « mousse superabsorbante » décrits dans le tableau 1. Un pansement chirurgical de base sans polymère a été utilisé comme point de contrôle ou de référence. Les pansements ont été étudiés pour déterminer leurs capacités à gérer l’humidité s’échappant d’une plaie artificielle, en mesurant :
- La quantité d’humidité absorbée, en grammes par pansement et en g/cm2.
- La quantité d’humidité évaporée à travers la couche externe, en gramme par pansement et en g/cm2.
- L’humidité à la fois à l’intérieur du lit couvert de la plaie et sur la couche externe, ainsi que la différence entre les deux.
- La température à la fois à l’intérieur du lit de la plaie sous le pansement et sur la couche externe, ainsi que la différence entre les deux.
De plus, l’effet d’un relâchement de pression ou d’un changement de position du patient sur chacun de ces paramètres a été mesuré.
Il est important de noter que les travaux réalisés par le passé mesuraient uniquement l’humidité par pansement.12 Pour cette étude, du fait que chaque pansement présente une grande variation en termes de masse et de superficie, l’unité de mesure utilisée a été le gramme d’humidité par cm2.
Méthode
Cette étude a été menée par un laboratoire indépendant qui contribue à l’élaboration de normes pour les surfaces de soutien, les coussins pour fauteuils roulants, les pansements et autres dispositifs médicaux associés aux plaies. La température ambiante du laboratoire était de 23 °C ± 2 °C et son humidité relative de 50 % ± 5 %, conformément à la norme ISO 554-1976(E).13
Le modèle humain consistait en un pénétrateur de chargement rigide pour coussin thermodynamique en bronze, décrit pour la première fois par Ferguson-Pell et al.14 servant à tester des coussins de fauteuils roulants. Ce modèle a été conçu par un groupe de chercheurs du Royaume-Uni, du Japon et des États-Unis. Depuis 2009, il est devenu un dispositif de test standard utilisé pour l’étude des surfaces de soutien, des pansements et des coussins de fauteuils roulants sur le marché international des soins des plaies15 (voir figure 1).
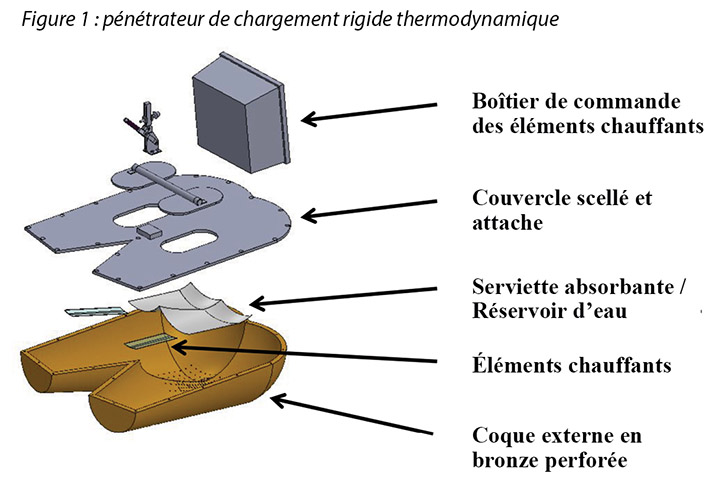
Ce pénétrateur de test était en conformité avec les normes américaines des surfaces de soutien16 (American National Standards for Support Surfaces). Il a la forme du fessier et de la partie supérieure des cuisses d’une personne de sexe masculin du 50e centile et présente des trous prépercés au niveau du sacrum et de l’ischion. Le pénétrateur peut être chargé de quantités d’eau pré-mesurées, chauffé et refroidi, et pesé. La diffusion de l’eau à travers les trous prépercés simule la perte d’humidité à travers la peau. Ce pénétrateur simule le chauffage, le refroidissement, la transpiration et l’assèchement, ainsi que les transferts de poids de la zone du sacrum d’un être humain. Les conditions qui en résultent à l’interface pénétrateur-surface sont mesurées et peuvent être comparées entre les produits, ainsi que sous des conditions stables et transitoires.
Dans le cadre de cette étude, le pénétrateur pesait un peu plus de 29 kg ± un peu plus de 1 kg, ce qui correspond au poids de cette partie du corps pour un homme du 50e centile allongé dans un lit. Une plaie artificielle a été créée en recouvrant tous les trous de pores de transpiration non recouverts par le tampon du pansement ; une bande d’aluminium empêchait l’évaporation de l’humidité à l’extérieur de la zone de la plaie artificielle (Figure 2). Il restait une zone de trous de de 7 x 7 cm pour la vapeur d’eau ; elle était utilisée pour tous les pansements testés.

Le test des pansements dans ces conditions fournit un scénario pertinent d’un point de vue clinique car les mousses et les polymères sont compressés et l’échappement de vapeur d’eau est réduit par les conditions d’utilisation réelles du test.14, 15 Par exemple, les capteurs d’humidité et de température sont des capteurs numériques de haute précision fabriqués par Sensirion AG (Staefa ZH, Suisse) d’une précision de ± 1,8 % dans des conditions d’humidité relative de 0-80 % et de ± 0,3 °C à une température de 20 à 50 °C. Installé sur une planche rigide, la surface de soutien du test, produit de l’entreprise Coating US (Slaterville, Rhode Island), consistait en un coussin de mousse à alvéoles ouvertes de 7,6 x 45,7 x 45,7 cm, recouvert d’une housse pour matelas perméable à l’air résistante à l’humidité.
La vapeur d’eau et l’humidité provenaient d’une quantité pesée d’eau distillée imprégnant des serviettes de refroidissement en microfibre EnduracoolTM. Ces serviettes ont été choisies pour leur microfibre aux capacités thermorégulatrices et parce qu’elles présentent un taux de désorption de l’humidité compatible avec les études préalablement publiées sur les surfaces de soutien à faible perte d’air.17, 18 Dans un laboratoire, l’exsudat des plaies est remplacé par de l’eau distillée. S’il est vrai que les propriétés de chaque fluide diffèrent considérablement, l’étude a été conçue pour démontrer les différences de performances et cela peut être effectué avec un fluide standard. Les publications précédentes décrivant la capacité de gestion de l’humidité de pansements à l’aide de cette méthode ont servi de base comparative.12
Le modèle de plaie utilisé ici n’est pas très exsudatif ; il s’agit d’un modèle de vapeur d’eau. Ce modèle délivre un faible taux d’humidité sur la surface du pansement sur une certaine période de temps de façon contrôlée, de sorte qu’un chercheur peut déterminer si l’humidité est retenue par le pansement ou si elle transpire à travers lui. Les pansements testés ont été sélectionnés parmi des pansements multicouches faciles à obtenir et couramment utilisés dans l’Union européenne et aux États-Unis. Les pansements représentatifs sont présentés dans le tableau 1.
Le pénétrateur était suspendu au-dessus du coussin à l’aide d’un cadre en H positionné autour du cadre de lit, à peu près au milieu de ce cadre. Le coussin était centré sous le pénétrateur de sorte que la zone de tubérosité ischiatique du pénétrateur se situait à 10-15 cm du bord arrière du coussin (voir la figure 3). La température du pénétrateur était réglée sur 37 °C. Les poids des deux lots de serviettes sèches EnduracoolTM ont été enregistrés, puis 100 ± 1 g d’eau distillée ont été ajoutés à chaque lot de serviette pour pouvoir éventuellement fournir 200 g d’eau distillée sur le pansement. Chaque serviette était pliée en trois et placée à l’intérieur du pénétrateur de façon à recouvrir tous les trous de pores de transpiration. Des poids chauffés ont été placés au-dessus des serviettes pour faciliter la distribution de l’humidité.

Trois capteurs ont été posés pour détecter l’humidité s’échappant de la zone de la plaie artificielle (voir la figure 4). Les emplacements des capteurs ont été modifiés pour s’adapter à la taille de chaque pansement. Le pansement était centré au-dessus des trous de pores de transpiration ouverts et recouvrait les trois capteurs. Les capteurs placés au-dessus du pansement étaient alignés sur les capteurs placés sous le pansement (voir la figure 4). Le pénétrateur a été abaissé jusqu’à ce qu’il repose sur la surface de soutien et transfère la charge complète d’un peu plus de 29 kg ± un peu plus de 1 kg à la surface de soutien. Un septième capteur servait à mesurer la température et l’humidité ambiantes. Le logiciel EK-H4 Viewer a été programmé pour enregistrer les données toutes les 30 secondes pendant toute la durée du test.

Pour simuler un relâchement de pression ou un changement de position du patient, le pénétrateur a été soulevé de la surface de soutien pendant 45 secondes à 3 heures ± 6 minutes. Des mesures ont été prises cinq minutes avant le soulèvement (ce qui est identifié comme correspondant à 175 minutes dans la rubrique des résultats) pour créer un vide d’air entre le pénétrateur et la surface de soutien. Il a été maintenu en suspens au-dessus de la surface de soutien pendant 45 secondes ± 10 secondes au total, puis rabaissé sur la surface de soutien pleinement chargé pendant 15 minutes ± 1 minute de plus. Les mesures finales relevées figurent à 196 minutes dans les résultats.
À la fin du test, le pénétrateur a été soulevé et les serviettes ont été retirées et pesées. Le pansement a été retiré du pénétrateur et de la plaie artificielle et son poids a été enregistré. Le poids d’une serviette de papier sèche a été enregistré et celle-ci a été utilisée pour essuyer toute l’humidité restante dans le pénétrateur. Cette serviette a ensuite de nouveau été pesée.
Entre chaque essai, le pénétrateur a été ramené à un état stationnaire avant le début de l’essai suivant. De l’eau distillée a été ajoutée pour que les serviettes et la masse d’eau retrouvent le poids total des serviettes sèches plus 200 ± 1 g d’eau distillée. Deux coussins et deux housses ont été utilisés pour laisser à chacun des coussins le temps de retrouver sa forme initiale entre les tests. Chaque pansement a été soumis à trois tests au total. Trois tests ont également été réalisés avec le pénétrateur placé en suspens pendant 3 heures et 16 minutes en l’absence de pansement afin de mesurer la production de vapeur de la plaie artificielle.
Le poids final des serviettes plus celui de la serviette en papier a été soustrait du poids de départ des serviettes pour déterminer la quantité totale d’eau distillée ajoutée au système. L’humidité absorbée par le tampon du pansement a été calculée en soustrayant le poids de départ du pansement de son poids final. La quantité de vapeur d’eau produite par le système a été calculée en soustrayant le poids de départ des serviettes de leur poids final et en y ajoutant l’humidité récupérée de l’intérieur du pénétrateur avec la serviette en papier. La quantité d’humidité évaporée du pansement a été calculée en soustrayant la quantité d’humidité emprisonnée dans le pansement de la quantité de vapeur d’eau produite par le système.
L’intervalle de confiance à 95 % a été calculé.
Alors que la taille de la plaie artificielle est restée la même tout au long de l’étude, celle des tampons absorbants des pansements a varié de 41,8 cm2 à 121 cm2 (voir tableau 1). Ainsi, l’humidité totale absorbée et évaporée pour chaque pansement a été calculée. Les calculs de l’humidité absorbée et de l’humidité évaporée ont été effectués par cm2 afin de tenir compte de la variabilité des tailles des pansements et comparer de manière plus précise leurs performances. La différence moyenne de température et d’humidité entre l’extérieur ou la surface du tampon du pansement et l’intérieur ou le côté patient du pansement à 175 minutes et sur toute la durée du test a été calculée en moyennant la différence entre la valeur sur le pansement et la valeur sous le pansement pour chaque point de donnée.
Résultats
L’étude avait quatre objectifs, à savoir mesurer : la quantité d’humidité absorbée ; la quantité d’humidité évaporée à travers la couche externe ; l’humidité sous et à l’extérieur du pansement, ainsi que la différence entre les deux ; et la température sous et à l’extérieur du pansement ainsi que la différence entre les deux.
La quantité d’humidité absorbée par chaque pansement est présentée dans le tableau 2. Ceci indique l’humidité totale et l’humidité absorbée en g/cm2 par pansement, ainsi que la moyenne. La plage des pansements de la catégorie « mousse superabsorbante » variait de 0,22 à 0,34 g. La plage des pansements de la catégorie « polymère superabsorbant » variait de 0,24 à 0,39 g si la valeur hors norme à 0,56 g est exclue. Le pansement de référence était le plus petit en superficie et était de loin le pansement le moins absorbant. La plage des six pansements sur sept utilisés pour l’étude variait de 0,22 à 0,39 g.
Tableau 2 : humidité absorbée par le tampon absorbant et humidité évaporée par pansement en g total et en g/cm2 et moyennes mousse superabsorbante et polymère superabsorbant
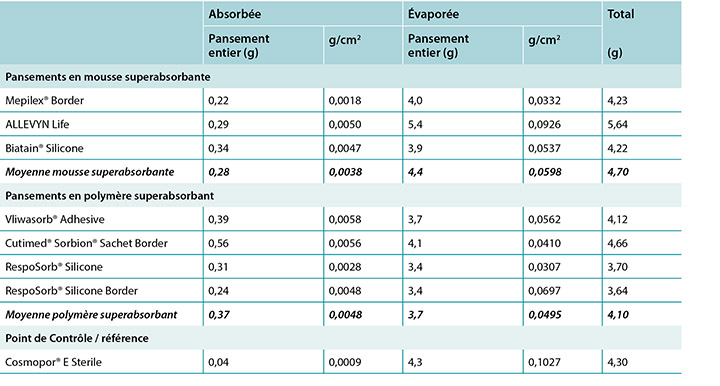
La quantité d’humidité évaporée (transpirée ou évaporée) à travers la couche de polyuréthane externe est également présentée dans le tableau 2 et la figure 5. La plage des pansements de la catégorie « mousse superabsorbante » variait de 3,9 à 5,4 g, un écart de 1,5 g, tandis que celle des pansements de la catégorie « mousse superabsorbante » variait de 3,4 à 4,1 g, un écart de juste 0,7 g. En effet, six des sept pansements testés étaient à 0,7 g l’un de l’autre (plage de 3,4 à 4,1 g). Il n’y avait aucune différence significative entre les pansements avec intervalle de confiance à 95 %.
Notez que le tableau 2 indique que la quantité totale d’humidité fournie par le pénétrateur était de 5,9 g. Si l’on additionne l’humidité absorbée et l’humidité évaporée, on constate qu’aucun des pansements n’a enlevé toute l’humidité.
La figure 5 présente sous forme graphique la quantité totale d’humidité absorbée et d’humidité évaporée en g/cm2 pour chaque pansement. Les figures 6a et 6b présentent sous forme de graphique l’humidité absorbée et l’humidité évaporée par cm2, selon la taille du tampon absorbant, dans l’ordre croissant. Plus le pansement est grand, plus la quantité d’humidité absorbée et évaporée (par cm2) semble diminuée, ce qui semble indiquer que les tampons de plus grande taille sont moins efficaces. Cependant, les pansements de plus grande taille offrent une plus grande superficie d’absorption et d’évaporation de l’humidité et ce graphique n’est pas normalisé pour la taille de la plaie et des pansements.
La figure 7 représente sous forme de graphique l’humidité évaporée par cm2 de la superficie de la plaie. Autrement dit, les pansements sont comparés en utilisant une taille de plaie standard (la superficie des trous exposés dans le pénétrateur) et une quantité de vapeur standard, sur une superficie standard. Comparés de cette façon, tous les pansements gèrent environ la même quantité d’humidité, selon leur superficie absorbante.
L’humidité à la fois sous et à l’extérieur du pansement, ainsi que la différence entre les deux, a également été enregistrée. Le tableau 3 indique le pourcentage moyen d’humidité relative à 175 minutes (avant le relâchement de pression) et à 196 minutes (après la réapplication de la pression pendant 15 minutes, à la fin du test), à l’intérieur et à l’extérieur des pansements, et la différence entre les pansements intérieurs et extérieurs, par pansement et par catégorie. À 175 minutes, toutes les lectures d’humidité à l’extérieur des pansements étaient supérieures à l’humidité ambiante (50 %), indiquant une transpiration active à travers les feuilles de support de polyuréthane. La catégorie de pansement « mousse superabsorbante » présentait une humidité moyenne plus élevée, aussi bien à l’intérieur qu’à l’extérieur du pansement, par rapport à la catégorie de pansement « polymère superabsorbant ». Cependant, la différence entre l’intérieur et l’extérieur des deux catégories était similaire (11,4 % et 11.4 % respectivement). Le pansement de référence avait un taux d’humidité bien plus élevé, aussi bien à l’intérieur qu’à l’extérieur du pansement, avec une différence de seulement 3,8 % (voir tableau 3 et figure 8). À 196 minutes, la catégorie des pansements à mousse superabsorbante présentait des humidités moyennes plus élevées à l’intérieur et à l’extérieur du pansement que la catégorie des pansements en polymère superabsorbant. Cependant, les différences entre l’intérieur et l’extérieur étaient plus importantes pour la catégorie des pansements en mousse superabsorbante. Le pansement de référence présentait une très petite différence entre l’intérieur et l’extérieur (voir le tableau 3). Les barres d’erreur de la figure 8 ne présentent pas de différences significatives entre les pansements avec IC à 95 %.
Tableau 3 : pourcentage moyen d’humidité relative à 175 et à 196 minutes
La température sous et à l’extérieur du pansement, ainsi que la différence entre les deux, a également été enregistrée. À 175 minutes, les températures moyennes des pansements en mousse superabsorbante, des pansements en polymère superabsorbant et du pansement de référence étaient à moins de 0,9 °C. Les pansements en mousse superabsorbante et les pansements en polymère superabsorbant présentaient de plus grands écarts de températures entre l’intérieur et l’extérieur des pansements que le pansement de référence (voir le tableau 4 et la figure 9). À 196 minutes, les températures moyennes des pansements en polymère superabsorbant et des pansements en mousse superabsorbante à la fois à l’intérieur et à l’extérieur des pansements étaient à moins de 0,2 °C l’une de l’autre. Le pansement de référence était seulement légèrement au-dessous des deux catégories (voir le tableau 4 et la figure 10). Les températures à l’intérieur et à l’extérieur des pansements à 196 minutes variaient de 33,1 à 34,3 °C. La plage de différences de températures entre l’intérieur et l’extérieur des pansements était de 0,4 à 0,8 °C. La différence de températures du contrôle négatif était de seulement 0,2 °C. Il n’y avait pas de différence significative entre les pansements avec intervalle de confiance à 95 %.
Tableau 4 : température moyenne à 175 et à 196 minutes
Discussion
Cette étude mesure, en laboratoire, les performances relatives des pansements en comparant les résultats à des points-temps spécifiques et moyennés dans le temps. S’il est vrai que la durée du test (plus de 3 heures) est un petit segment de temps comparé à la longueur de temps qu’un patient porte normalement ces types de pansements, ce test nous donne néanmoins une idée de ce que pourraient être les performances de ces pansements l’un par rapport à l’autre sur de plus longues périodes.
Cette méthode a permis de tester comment les pansements gèrent l’humidité provenant d’une exsudation lente et régulière de vapeur. Une altération du tégument dans une plaie de stade II, III ou IV affecte également la régulation de l’échappement de la vapeur d’eau et un pansement doit alors gérer davantage d’humidité. La quantité totale de vapeur peut compromettre le tégument et elle doit donc être également prise en considération au moment d’évaluer les pansements.6, 19
Comme escompté, les pansements en polymère superabsorbant et en mousse superabsorbante les plus perfectionnés ont surpassé le pansement « island dressing » de base de point de contrôle/référence dans la plupart des catégories.
Humidité absorbée et humidité évaporée
Les catégories de pansements en polymère superabsorbant et de pansement en mousse superabsorbante ont absorbé beaucoup plus d’humidité dans leur tampon que le pansement de référence, ce qui indique que le matériau en polymère qui les compose absorbe et retient l’humidité et l’empêche de migrer vers la zone périlésionnelle ou vers le lit de la plaie. Six des sept pansements avancés ont absorbé de 0,24 à 0,39 g d’humidité, et un pansement hors norme a absorbé 0,56 g. On attend des pansements qu’ils absorbent suffisamment pour empêcher une macération du lit de la plaie, mais pas trop pour éviter de l’assécher. Pour assécher une plaie, un pansement devrait absorber et transpirer toute l’humidité qui lui est fournie. Aucun de ces pansements ne l’a fait et de ce fait, le total de l’humidité pour chaque pansement du tableau 2 n’est pas égal à l’humidité totale fournie par le pénétrateur, à savoir 5,9 g. Il semble, à en croire ces résultats, que l’absorption des pansements en polymère superabsorbant et en mousse superabsorbante est efficace et qu’ils n’assécheront pas une plaie qui exsude au niveau modéré du montage de test. Le pansement ALLEVYN Life est celui qui a absorbé et transpiré le mieux tout le fluide fourni.
La même quantité d’humidité a été fournie sur tous les pansements. Le plus petit pansement est celui qui a absorbé le moins d’humidité et laissé évaporer le plus d’humidité. Cela est prévisible puisque la taille de la plaie est restée constante, laissant le ratio de la superficie du pansement artificiel fournissant l’humidité à la superficie du pansement disponible pour la transpirer considérablement plus grand pour les plus grands pansements. Les plus grands pansements peuvent absorber et retenir davantage d’humidité et le polymère a emprisonné cette humidité de sorte qu’elle ne pouvait pas s’échapper et ne l’a donc pas fait. Les plus grands pansements peuvent également répartir et diffuser l’humidité sur une plus grande surface.
La catégorie des pansements en mousse superabsorbante, celle des pansements en polymère superabsorbant et le pansement de référence n’étaient pas très différents en termes de quantité de fluide évaporé ou transpiré depuis la plaie avec intervalle de confiance à 95 % (voir la figure 6b). Lorsque l’humidité évaporée est illustrée en fonction de l’humidité fournie et de la surface du tampon en g/cm2, les pansements avancés sont très similaires (voir la figure 7). La taille des pansements peut influencer les résultats. Cependant, lorsque les résultats sont exprimés en g/cm2 afin de comparer des pansements de différentes tailles, les différences sont minimes. Cela rend l’interprétation plus difficile.
Ce test a été effectué en accord avec d’autres tests (publiés et non publiés) qui ont démontré des différences saisissantes dans la gestion de l’humidité entre des pansements avancés.6, 12 Cela a incité les fabricants à améliorer leurs produits ainsi que les polymères et les feuilles de support perméables à la vapeur utilisés dans les pansements, ce qui a peut-être donné lieu à une plus grande uniformité des structures de pansements et à la similarité des capacités de gestion apparentes parmi les pansements testés.
Humidité et température
Des valeurs d’humidité et de température spécifiques définissant les conditions optimales du microclimat n’ont toujours pas été déterminées par des recherches cliniques ou en laboratoire. Les pansements doivent maintenir le lit de la plaie modérément chaud et humide, ni trop humide, ni trop sec, ni trop chaud, ni trop froid, relativement aux conditions dermiques ou sous-dermiques corporelles normales de chaque patient et à l’atmosphère externe. Des niveaux plus élevés d’humidité peuvent avoir un impact négatif sur l’environnement de la plaie, tout comme ils fragilisent la peau saine.1 La couche cornée (CC) est en équilibre hydrique à une humidité ambiante de 40 - 60 %, mais au-dessus de 60 %, elle absorbe l’eau à des taux qui augmentent de manière disproportionnée.20-22 Les résultats de Wildnauer indiquent qu’une humidité relative supérieure à 60 % influence le plus la réduction des forces de cohésion internes dans la CC.23
À 175 minutes, l’humidité relative sous tous les pansements se situait à plus de 75 %, avec une plage de 83,5 à 86,6 % pour les pansements en mousse superabsorbante et de 76,4 à 81,1 % pour les pansements en polymère superabsorbant. Il est raisonnable de considérer ces valeurs comme étant humides. Les pansements à l’intérieur desquels les humidités sont plus élevées (comme c’est le cas pour les pansements en mousse superabsorbante et le pansement de référence avec 90,5 %) présentent un risque de surhydratation éventuelle du lit de la plaie ou de la zone périlésionnelle. À 175 minutes, les lectures d’humidité de tous les pansements étaient plus basses à l’extérieur du pansement qu’à l’intérieur, comme prévu. Tous les niveaux d’humidité à l’extérieur des pansements étaient supérieurs à l’humidité ambiante, ce qui indique que la feuille de support de polyuréthane évapore ou transpire vraiment le fluide. Il existait également une corrélation entre l’humidité relative sous le pansement et l’humidité absorbée par le tampon du pansement. Une plus faible absorption de l’humidité par le tampon était corrélée à une plus grande humidité sous le pansement (coefficient de corrélation de Pearson = -0,83).
Le relâchement complet de pression à 176 minutes a suspendu le pénétrateur et le pansement testé dans l’air et a permis un échange de chaleur et d’humidité avec l’environnement. La figure 11 présente sous forme graphique les résultats obtenus avec l’un des pansements, le RespoSorb® Silicone, sur les 196 minutes du test. Ceci illustre le parcours similaire observé pour tous les autres pansements. Les températures et les humidités ont augmenté au début de la collecte des données, puis les températures ont éventuellement plafonné tandis que les humidités continuaient d’augmenter. Les deux valeurs ont brusquement chuté lorsque le pénétrateur a été soulevé pendant le relâchement de pression de 45 secondes, puis augmenté pour atteindre ou se rapprocher de leurs niveaux avant le soulèvement. Le fait qu’un relâchement de pression puisse avoir un effet aussi rapide, mesurable et significatif, à la fois sur l’humidité et la chaleur est impressionnant et démontre les bénéfices de changements fréquents de position, au-delà de la simple prise en compte de la pression et du cisaillement. Quinze minutes après le relâchement de pression effectué à 196 minutes, tous les niveaux d’humidité étaient supérieurs à 70 %, ceux du pansement de référence étant les plus élevés à 87,6 %. Il semble que la vapeur d’eau s’échappe plus facilement qu’elle n’est emprisonnée car, 15 minutes après le soulèvement, toutes les valeurs avaient retrouvé leurs niveaux mesurés à 175 minutes.
Les deux catégories de pansements ont maintenu le lit de la plaie relativement chaud, comme l’indiquent des températures plus basses à l’extérieur du pansement qu’à l’intérieur. Cela est propice à la cicatrisation des plaies car elles étaient toutes dans la plage recommandée de 33-35 °C7. Selon Yusuf et al.24, une différence de température de la peau de seulement 0,3 °C était un prédicteur d’ulcère de pression. S’il est vrai que cette mesure n’est pas celle du lit de la plaie, elle indique qu’une légère différence de température de la peau peut causer une lésion. La plage de températures à l’intérieur des pansements était de 1 °C à 175 minutes et de 0,8 °C à 196 minutes. Ces plages pourraient donc être problématiques. Bien que l’étude de Yusuf n’apporte pas la preuve d’une causalité, nous devons être attentifs à l’effet potentiel de la température sur l’intégrité des tissus.
Les différences de température sont cumulatives. La rapidité avec laquelle la température baisse après un relâchement de pression peut influer sur cette accumulation. Une petite différence accumulée au fil du temps peut faire une grande différence. Les baisses de température à 175 et à 196 minutes par pansement étaient plus importantes pour les deux pansements RespoSorb®.
Limitations
Il serait intéressant de réaliser cette étude sur un modèle de plaie extrêmement exsudative au lieu d’un modèle de peau intacte exsudant de la vapeur afin d’examiner de manière plus précise la performance des pansements dans des conditions normales d’utilisation.
Conclusion
Cette étude in vitro a permis de conclure que les pansements en mousse superabsorbante et les pansements en polymère superabsorbant semblent être tout aussi efficaces pour maintenir un microclimat chaud et humide au niveau du lit de la plaie afin d’en améliorer la cicatrisation. Ils absorbent davantage d’humidité par cm2 et évaporent ou transpirent davantage d’humidité que les pansements de base. La couche en mousse des pansements en mousse superabsorbante ne semble pas améliorer les conditions microclimatiques du lit de la plaie comparé aux pansements en polymère superabsorbant sans couche en mousse. Ni les pansements en mousse superabsorbante, ni les pansements en polymère superabsorbant ne dessèchent le lit de la plaie comme le terme « superabsorbant(e) » peut le suggérer. Cette étude a également démontré qu’un relâchement périodique de la pression réduit sensiblement la température et l’humidité du lit de la plaie, ce qui améliore la fonction du pansement et peut augmenter la cicatrisation de la plaie.
Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts.
Financement
Cette étude a été financée par Paul Hartmann AG, Heidenheim, Allemagne, fabricant du RespoSorb® Silicone et du RespoSorb® Silicone Border.
Author(s)
Evan Call
MS, CSM (NRM)
Department of Microbiology, College of Science, Weber State University, Ogden, UT, USA
Craig Oberg
PhD
Department of Microbiology, College of Science, Weber State University, Ogden, UT, USA
Iris Streit
Senior Manager, Global Product Marketing Advanced Wound Management,
HARTMANN GROUP, Heidenheim, Germany
Laurie M Rappl*
PT, DPT, CWS
Rappl & Associates, Simpsonville, SC, USA
Email Lrappl630@gmail.com
* Corresponding author
References
- Woo KY, Beeckman D, Chakravarthy D. Management of moisture-associated skin damage: a scoping review. Adv Skin Wound Care 2017;30(11):494–501.
- Seaman S. Dressing selection in chronic wound management. J Am Podiatr Med Assoc 2002;92(1):24–33.
- Winter GD, Scales JT. Effect of air drying and dressings on the surface of a wound. Nature 1963;197:91–2.
- Rippon MG, Ousey K, Cutting KF. Wound healing and hyper-hydration: a counterintuitive model. J Wound Care 2016;25(2):68, 70–5.
- World Union of Wound Healing Societies. Wound exudate: effective assessment and management: WUWHS consensus document. London (UK): Wounds International; 2019.
- Kottner J, Black J, Call E, Gefen A, Santamaria N. Microclimate: a critical review in the context of pressure ulcer prevention. Clin Biomech;2018;59:62–70.
- Dini V, Salvo P, Janowska A, Di Francesco F, Barbini A, Romanelli M. Correlation between wound temperature obtained with an infrared camera and clinical wound bed score in venous leg ulcers. Wounds 2015;27(10):274–8.
- Salvo P, Dini V, Kirchhain A, Janowska A, Oranges T, Chiricozzi A, et al. Sensors and biosensors for C-reactive protein, temperature and pH, and their applications for monitoring wound healing: a review. Sensors;2017;17(12).
- Woo KY, Sibbald RG. The ABCs of skin care for wound care clinicians: dermatitis and eczema. Adv Skin Wound Care 2009;22(5):230–6; quiz 7–8.
- Bolton LL, Johnson CL, van Rijswijk L. Occlusive dressings: therapeutic agents and effects on drug delivery. Clin Dermatol 1992;9.
- European Standards. Test methods for primary wound dressings. Part 1: aspects of absorbency. Brussels (Belgium): European Committee for Standardization; 2002.
- Call E, Pedersen J, Bill B, Oberg C, Ferguson-Pell M. Microclimate impact of prophylactic dressings using in vitro body analog method. Wounds 2013;25(4):94–103.
- ISO. ISO 554:1976E Standard atmospheres for conditioning and/or testing: specifications. Geneva (Switzerland): International Organization for Standardization; 1976.
- Ferguson-Pell M, Hirose H, Nicholson G, Call E. Thermodynamic rigid cushion loading indenter: a buttock-shaped temperature and humidity measurement system for cushioning surfaces under anatomical compression conditions. J Rehabil Res Dev 2009;46(7):945–56.
- Call E, Pedersen J, Bill B, Black J, Alves P, Brindle CT, et al. Enhancing pressure ulcer prevention using wound dressings: what are the modes of action? Int Wound J 2015;12(4):408–13.
- ANSI/RESNA. ANSI/RESNA SS-1-2019 for support surfaces volume 1: requirements and test methods for full body support surfaces. Arlington (USA): Rehabilitation Engineering and Assistive Technology Society of North America; 2019.
- Figliola RS. A proposed method for quantifying low-air-loss mattress performance by moisture transport. Ostomy Wound Manage 2003;49(1):32–42.
- Reger SI, Adams TC, Maklebust JA, Sahgal V. Validation test for climate control on air-loss supports. Arch Phys Med Rehabil 2001;82(5):597–603.
- Phipps L, Gray M, Call E. Time of onset to changes in skin condition during exposure to synthetic urine: a prospective study. J Wound Ostomy Continence Nurs 2019;46(4):315–20.
- Imhof RE, De Jesus ME, Xiao P, Ciortea LI, Berg EP. Closed-chamber transepidermal water loss measurement: microclimate, calibration and performance. Int J Cosmet Sci 2009;31(2):97–118.
- Li X, Johnson R, Kasting GB. On the variation of water diffusion coefficient in stratum corneum with water content. J Pharm Sci 2016;105(3):1141–7.
- Petrofsky JS, Berk L, Alshammari F, Lee H, Hamdan A, Yim JE, et al. The interrelationship between air temperature and humidity as applied locally to the skin: the resultant response on skin temperature and blood flow with age differences. Med Sci Monit 2012;18(4):CR201–8.
- Wildnauer RH, Bothwell JW, Douglass AB. Stratum corneum biomechanical properties: I. Influence of relative humidity on normal and extracted human stratum corneum. J Investig Dermatol 1971;56(1):72–8.
- Yusuf S, Okuwa M, Shigeta Y, Dai M, Iuchi T, Rahman S, et al. Microclimate and development of pressure ulcers and superficial skin changes. Int Wound J 2015;12(1):40–6.
