Volume 40 Number 4
A quality improvement project comparing two treatments for deep-tissue pressure injuries to feet and lower legs of long-term care residents
Autumn Henson and Laurie Kennedy-Malone
Keywords pressure injury, deep-tissue pressure injury, lower-extremity injury, long-term care, offloading, polymeric membrane dressings, skin barrier film
For referencing Henson A and Kennedy-Malone L. A quality improvement project comparing two treatments for deep-tissue pressure injuries to feet and lower legs of long-term care residents. WCET® Journal 2020;40(4):30-35
DOI https://doi.org/10.33235/wcet.40.4.30-35
Abstract
Objective To retrospectively examine clinical outcomes from a feasibility study that compared two treatment options for deep-tissue pressure injuries (DTPIs), including the clinical indicators increasing the risk of deteriorating DTPIs among long-term care residents.
Methods A retrospective chart audit of 40 DTPIs from 33 long-term care residents in two long-term care facilities were conducted to compare 1: polymeric membrane dressings (PMDs) with offloading; and 2: a skin barrier film with offloading.
Results Of the 13 DTPIs treated with PMDs, only 23% deteriorated to a stage 3 or 4 pressure injury (PI), whereas of the 27 DTPIs treated with skin barrier film, 41% deteriorated to a stage 3 or 4 PI. The clinical factors found to increase the risk of developing and deteriorating DTPIs included weight loss, hypoalbuminemia, debility, dementia, coronary artery disease, and cerebrovascular disease.
Conclusions The PMD group’s DTPIs evolved into fewer open PIs despite having higher percentages of clinical indicators for DTPIs. The project findings support the use of PMD dressings for DTPIs; however, more robust research is warranted.
Introduction
A pressure injury (PI) is pressure-related damage to a local area of skin and the underlying tissue, generally over a bony prominence.1 These injuries present a significant challenge for the staff of long-term care facilities (LTCFs) and affect their residents’ quality of life, escalating healthcare costs, readmissions, risk of infection, pain, depression, and death.2,3 Deep-tissue pressure injuries (DTPIs) are PIs that occur under intact skin, which are thought to first develop in the deep tissues of the body and then appear on the skin surface4 as nonblanchable red, purple, or maroon discoloration or a blood-filled blister.1
Despite current treatment, these injuries often rapidly become open wounds.4 Typically, DTPI treatment aims to prevent further damage and avoid devolution to stage 3 or 4 PI.4 However, there is limited research on DTPI treatment, so this quality improvement project was implemented to retrospectively analyse the findings of a feasibility study that compared a drug-free polymeric membrane dressing (PMD) with the use of a skin barrier film among residents in two LTCFs with DTPIs on their feet and lower legs. The PMD is a foam dressing designed to reduce inflammatory factors and edema related to skin damage while requiring infrequent dressing changes.5 The PMD was chosen because of its easy accessibility and supply in the study LTCFs. Skin barrier films come in multiple forms and comprise a transparent coating to protect skin from trauma and moisture.6 The previous DTPI treatments used in the two facilities were a skin barrier film and offloading; despite using the skin barrier film twice a day, the facilities continued to see deteriorating DTPIs, prompting the feasibility study.
Along with the current treatment concerns regarding DTPIs, research is ongoing to ascertain whether there are clinical indicators that influence the evolution of DTPIs into open wounds. In LTCFs, most residents have multiple comorbidities that influence PI risk, including DTPIs.7 Further studies are needed to conclusively establish the clinical indicators that potentially contribute to DTPIs so they can be mitigated.
Background and Clinical Problem
The prevalence of DTPIs has increased threefold since 2006, presumably because of the classification of DTPIs, which were defined in 2007. This increased the awareness of DTPIs.4 Changes in regulations and improvements in prevention and treatment have not reduced their incidence, and the number and cost of all PIs continue to increase.8 In addition to causing pain and suffering for LTCF residents, DTPIs cost LTCFs as much as $3.3 billion annually.9
The most common location for a DTPI is on the heel. Heels are mostly bony prominences covered by a thin layer of skin with little padding or protection from pressure.10,11 Further, other medical conditions, such as respiratory and/or cardiovascular issues, increase the time residents spend supine, and they often require the head of the bed to be elevated, which places additional pressure on the feet and legs.10-13 The same pressure mechanisms damage the soft tissues of the lateral areas of the foot and toes; because of chronic lateral positioning, these areas often experience sustained, unrelieved pressure.11
Shearing is a common risk factor to consider in the evolution of DTPIs.13,14 The layers of skin stretched against a surface with friction and pressure result in damage on the surface and deeper internal tissues.14 Shearing risk includes passive repositioning of residents, elevating the head of the bed, and involuntary active movements involving spasms or tremors from medical conditions, which increase the constant positioning/pressure of the feet against the mattress.14 The risk of pressure and shearing consequently increases the risk of deterioration of DTPIs of the feet and lower legs.4,14,15
In addition to the lack of standard treatment for DTPIs, there is concern about whether DTPI deterioration could be affected by certain clinical indicators. In many LTCFs, a large percentage of residents with limited mobility and debility have a higher risk of developing a PI. As residents age, the number of medical conditions they encounter increases.7 Published studies show that medical conditions such as anemia, diabetes mellitus, fecal or urinary incontinence, vascular disease, or malnutrition increase the risk of developing PIs and (more recently) DTPIs.3,4,7,16 Of these risk factors, anemia has been most commonly associated with an increased risk of DTPIs.3,4 A review by Gefen et al13 notes that variables such as fever, uncontrolled cardiovascular disease, or respiratory acidosis could also increase the risk of DTPIs. Accordingly, this project not only compared two different treatment options for DTPIs, but also considered the resident’s clinical indicators and their potential influence on DTPI deterioration.
The treatment of DTPIs generally falls into one of two categories: offloading and application. In a Cochrane systematic review, McGinnis and Stubbs17 studied heel pressure-reducing devices for offloading in the treatment of heel ulcers. According to their results, there is no single device available that meets all of the criteria for comfort in the prevention and treatment of heel ulcers by removing pressure with offloading. There also is a need for further research into relieving heel pressure and treating PIs with offloading.17 Van Leen et al18 reviewed pressure-reducing techniques for PI treatment in a longitudinal study in a Dutch LTCF. Offloading the feet and lower legs led to a statistically significant decrease in PIs from 16.6% to 5.5%, with the most benefit for patients with medium to high risk of PIs. Over the years of the study, 57.8% of the patients at medium to high risk of PI with documented offloading of feet and legs (as well as educational intervention) were less likely to develop a PI.18
The other category of treatment is the application of dressings. A randomised controlled study by Sullivan19 evaluated the treatment of DTPIs with dressings and demonstrated that 74% of DTPIs decreased in size or resolved with the use of a self-adherent, multilayered, silicone-based border foam dressing. Of the 128 DTPIs in this study, only one opened to deeper tissue, and the other injuries either did not open or opened to the dermis with a mean healing time of 17.8 days. Essentially, the multilayered foam dressings decreased deterioration and improved resolution time.19
Campbell et al16 evaluated the use of padded-heel dressings to treat heel wounds. The treatment group showed 100% improvement among the 20 participants, whereas only 13 of 20 wounds in the control group closed. The study also demonstrated that the treatment group required less time and financial expense to heal.16
The National Pressure Injury Advisory Panel recommends the use of offloading and preventive dressings on residents who are at high risk of developing heel ulcers.20 Levy et al15 observed that prophylactic dressings applied to the heels decreased the risk of DTPIs by reducing stress and shear. Ultimately, the use of dressings to protect skin and offload pressure and shearing is widely recommended, although comparison studies are limited and warranted.
Methods
The purpose of this project was to retrospectively compare, analyse, and evaluate the documented deterioration of DTPIs to open PI among residents using two different treatments. The secondary purpose was to determine the prevalence of clinical indicators known to contribute to the development of DTPIs in the PMD group versus the skin barrier film group.
This project sought to answer the following research questions:
(1) Do PMDs and foot offloading reduce deterioration of DTPIs for residents 55 years or older better than skin barrier film with offloading?
(2) What was the prevalence of various clinical indicators among residents who developed a DTPI on their foot and/or lower extremity, and would a change in treatment have an impact on the evolution of the DTPI?
Study Initiation and Ethics
An analysis of administrative data collected by the quality assurance and performance improvement team from two LTCFs during 2014 and 2015 showed that 36% of DTPIs evolved into open stage 3 or 4 PIs when treated with offloading and the twice-daily application of a skin barrier film. This finding was the catalyst to perform a feasibility study comparing the skin barrier film with PMDs for DTPIs that developed between October 2015 and May 2017 in the two facilities. The PMD was chosen because it was new to the facilities’ formulary lists, was easily accessible, and had evidence of benefit for other types of wounds.
This retrospective comparative analysis project conducted in fall 2017 examined the outcomes for the 33 residents with a total of 40 DTPIs included in the feasibility study. Researchers conducted a systematic chart audit comparing the treatments of PMD or skin barrier film for the sample of residents with DTPIs and based on the type of treatment used from October 2015 to May 2017. Charts were included in the project if the resident had a DTPI to the feet and lower legs, were at least 55 years old, and were treated with either PMDs or skin barrier film with offloading.
During the feasibility study, each resident in each group had an ongoing order for offloading to the DTPI. The residents chosen for the PMD group either provided consent for the new treatment or permission was granted by the resident’s responsible party. Treatment with PMD included cutting the PMD to a size slightly larger than the DTPI as well as the application of a transparent medical dressing to cover the PMD once applied. The dressing was changed twice a week. The skin barrier film wipes were applied twice daily, and skin was allowed to dry following the application. The university’s institutional review board deemed the current project exempt. The LTCFs’ corporate holding company, administrative leadership teams, and medical providers’ board members approved the project.
Setting and Participants
The two participating LTCFs are Medicare and Medicaid approved, with private pay residents and a bed capacity of approximately 90 and 110 residents, respectively. They are in the southeastern US. These facilities provide short- and long-term care services that include rehabilitation and complex medical care for residents with reduced physical and mental functioning and multiple comorbidities such as PIs and DTPIs.
Data were extracted, deidentified, audited for the inclusion criteria, and given to the principal investigator by chart auditors. The sample was developed based on resident treatment, with the skin barrier group comprising 23 residents with 27 DTPIs, and the PMD group, 10 residents with 13 DTPIs.
Data Collection and Outcome Measures
Trained medical records experts from each facility extracted previously recorded data from the electronic medical record program called the Electronic Charting System. The data collectors were trained by the principal investigator as to what specific data to extrapolate and code for data entry. The data collectors received standardised training from the investigator to ensure the accuracy of the data collection and the systematic retrieval of the information. Data were retrieved from the electronic medical record on each resident for every DTPI documented. The generated data reports were deidentified and transferred into a private, secure PDF file by the data collectors. The PDF file was then coded and converted into a Microsoft Excel form and organised into a secure database and stored in a password-protected file for retrieval by the principal investigator for analysis.
Data extracted from the medical charts consisted of both demographics and clinical indicators. Demographics included resident age, sex, and ethnicity. The clinical indicators included laboratory test results (anemia and hypoalbuminemia screening), chronic diseases/comorbidities, health history, functional status, and Braden Scale scores.
The Braden Scale is an assessment tool used to determine the risk of developing a PI. The Braden Scale scoring ranges from less than 9 to 32. The lower the Braden Scale score, the higher the risk of developing a PI.21 Residents with albumin levels less than 3.2 g/dL (reference range, 3.5-5.2 g/dL) demonstrated hypoalbuminemia, which may reflect a decrease in nutrition status in certain patient populations.7 Anemia was identified as a hemoglobin level below the reference range of 12 to 15 g/dL. Chronic diseases and comorbidities were identified with a diagnosis or International Classification of Diseases, 10th Revision code and included peripheral vascular disease, dementia, coronary artery disease, and/or cerebrovascular disease.
Further data included history of previous PI and recent orthopedic history such as any fracture or surgery to the lower half of the body. In addition, information on the resident’s level of activities of daily living support and any history of chronic involuntary movements was retrieved. Weight changes were also noted, that is, whether each resident had weight gain or weight loss prior to the identification of the DTPI(s).
Any diagnosis of peripheral vascular disease noted in the residents’ chart was captured in the data collection. Because no residents had a documented ankle-brachial pressure index to confirm diagnosis, residents with peripheral artery disease were excluded. In addition, residents with previously diagnosed diabetic or arterial ulcers were excluded.
The outcome variables included DTPI deterioration and PI stage at the time of opening, if applicable.
Statistical Analysis
The Microsoft Excel Descriptive Statistics Tool (Redmond, Washington) was used to analyse the data from the two groups. Descriptive statistics were used to describe the sample. Independent χ2 tests were used to compare each group with the clinical outcomes of opening or not opening. P < .05 was considered statistically significant.
Results
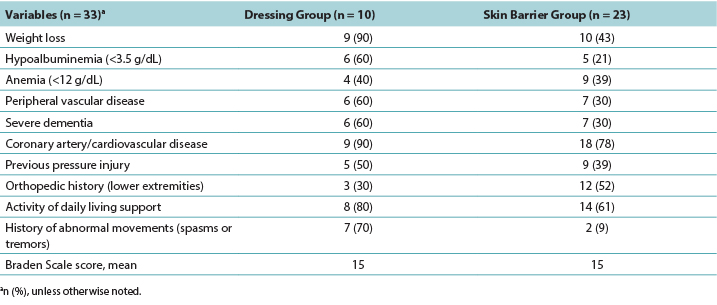
The majority of participants were White women with a mean age of 84 years. The PMD group was slightly older than the skin barrier film group (Table 1).
Table 1. Demographics of Residents with deep-tissue pressure injury by treatment group
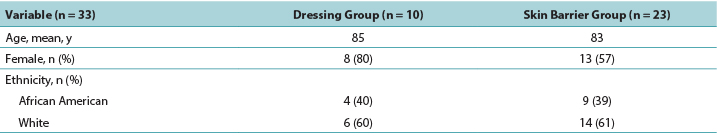
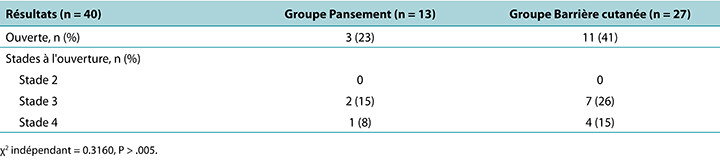
A simple statistical analysis compared the primary outcome measure between groups; according to the independent χ2 test, the difference was not statistically significant (P = .3160). In the PMD group, 23% of the DTPIs deteriorated to an open PI, whereas 41% of the DTPIs in skin barrier film group opened to a stage 3 or 4 PI. Of the DTPIs that opened, only two of the PMD group wounds opened to a stage 3 PI, and only one opened to a stage 4 PI. Of the DTPIs in the skin barrier film group, seven DTPIs opened to a stage 3 PI, and four opened to a stage 4 PI (Table 2).
Table 2. Wound outcomes
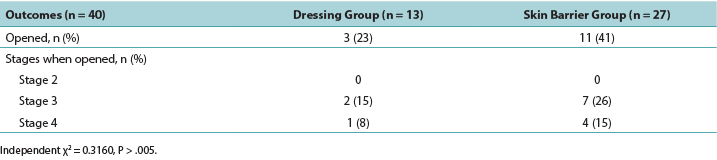
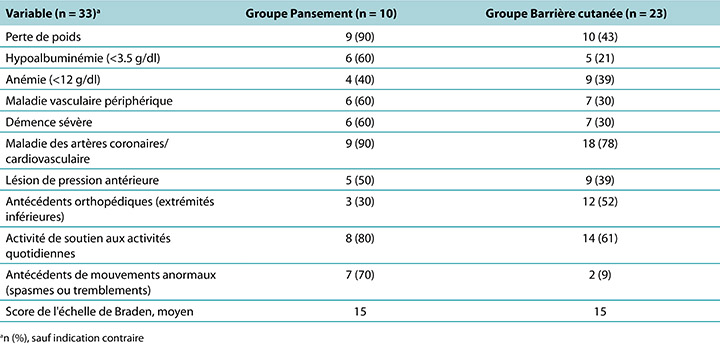
Descriptive data were generated for the clinical indicators that increased the risk of developing a DTPI (Table 3). The PMD group had more residents with known clinical indicators for DTPIs. The number of residents needing two people to assist in their activities of daily living was a significant factor, representing 80% of the PMD group and 61% of the skin barrier film group. Residents in both groups had an average Braden Scale score of 15, indicating at least a moderate risk of developing a DTPI. Weight loss and lower albumin scores were implicated, especially for the PMD group, with 90% seeing weight loss and 60% hypoalbuminemia. The residents with severe dementia (PMD, 60%; skin barrier film, 30%) also demonstrated a higher risk of DTPI, as well as residents with a diagnosis of coronary artery disease or cerebrovascular disease (PMD, 90%; skin barrier film, 78%). To investigate shearing, data were collected on residents who had abnormal lower extremity movement such as tremors or spasms. In the PMD group, this clinical indicator may have contributed to the development of DTPIs in 70% of the residents. Interestingly, anemia was an indicator for DTPIs (PMD, 40%; skin barrier film, 39%), although not to the significance level noted in other studies.
Table 3. Clinical Indicators of Residents with deep-tissue pressure injury by treatment group
Discussion
This retrospective project concluded that skin barrier film and offloading did not prevent the deterioration of DTPIs. Only three DTPIs evolved into an open wound in the PMD group, compared with 11 of the DTPIs in the skin barrier film group. Although this project did not have the statistical power to demonstrate significance, results indicate a possible benefit to changing the current treatment from the skin barrier film with offloading to PMDs with offloading.
This project found a higher risk of deteriorating DTPIs in the residents with more clinical indicators, in accordance with previous studies.7,16 Many of the LTCF residents’ medical conditions continue to be significant indicators, including weight loss, lower albumin levels, abnormal movements such as spasms or tremors, coronary artery disease, and cerebrovascular disease.4,16 Indicators such as anemia, previous orthopedic surgeries or fractures, peripheral vascular disease, and severe dementia were associated with a moderate risk of deteriorating DTPIs; previous studies found these were high-risk indicators.4,7,16 Interestingly, the PMD group had more clinical indicators for DTPI deterioration on average and yet had better outcomes. This demonstrates that treatment and management can outweigh the effects of clinical indicators for DPTI progression.
Limitations
The convenience sample size was small because of the total number of residents with diagnosed DTPI during the feasibility study period. Although all of the data collectors were trained by one person at the same time, there was no interrater reliability testing. Further, the diagnosis of DTPI was extracted by the data collectors based on provider diagnosis, because an International Classification of Diseases, 10th Revision code for DTPI was not established until 2019. Finally, it is important to note that PMDs may not be available in all healthcare settings, limiting the generalisability of the findings.
Implications for Clinical Practice
Offloading and repositioning of LTCF residents continue to be the recommended treatment for DTPIs. However, complications related to deteriorating DTPIs affect LTCF residents and strain the healthcare system. This project compares two different treatments for DTPIs, while considering the clinical indicators that may increase the risk of DTPI deterioration. Although further evidence is needed to address the cost-effectiveness of these treatments, PMD likely reduced the deterioration of DTPIs. Therefore, PMDs may be attractive to facilities striving to deliver efficient healthcare for their residents, especially those with high-risk residents.
Conclusions
Although prevention is crucial, once a DTPI has developed, having a fast and reliable treatment option to prevent further deterioration is of the utmost importance. By addressing DTPIs with offloading and screening for clinical indicators of deterioration, along with a preventive treatment such as PMD, the trajectory for these injuries could be vastly improved.
Conflict of Interest
The authors declare no conflicts of interest.
Funding
The authors received no funding for this study.
Un projet d'amélioration de la qualité comparant deux traitements des lésions de pression des tissus profonds aux pieds et dans la partie inférieure des jambes de résidents de soins de longue durée
Autumn Henson and Laurie Kennedy-Malone
DOI: https://doi.org/10.33235/wcet.40.4.30-35
Résumé
Objectif Examiner rétrospectivement les résultat cliniques d'une étude de faisabilité comparant deux options de traitement pour des lésions de pression des tissus profonds (LPTP), y compris les indicateurs cliniques qui augmentent le risque de détérioration des LPTP chez des résidents de soins de longue durée .
Méthodes Un audit de dossiers rétrospectif de 40 LPTP de 33 résidents de soins de longue durée dans deux établissements de soins de longue durée a été effectué pour comparer 1 : les pansements à membrane polymérique (PMP) à la décharge de pression ; et 2 : un film barrière cutanée avec décharge de pression.
Résultats Sur les 13 LPTP traitées à l'aide d’une PMP, seulement 23 % se sont détériorées jusqu'à une lésion de pression (LP) de stade 3 ou 4, tandis que sur les 27 LPTP traitées à l'aide d'un film barrière cutané, 41 % se sont détériorées jusqu'à une LP de stade 3 ou 4. Les facteurs cliniques qui augmentent le risque de développement et de détérioration des LPTP étaient une perte de poids, l'hypoalbuminémie, la débilité, la démence, la maladie coronarienne et les maladies cérébrovasculaires.
Conclusions Les LPTP du groupe PMP se sont transformées en moins de LP ouvertes bien que leurs pourcentages d'indicateurs cliniques de LPTP ai été plus élevé. Les résultats du projet viennent corroborer l'utilisation de pansements PMP pour les LPTP ; des recherches plus robustes sont toutefois nécessaires.
Introduction
Une lésion de pression (LP) est un dommage lié à la pression d'une zone locale de la peau et du tissu sous-jacent, généralement sur une proéminence osseuse1. Ces lésions présentent un défi significatif pour le personnel d'établissements de soins de longue durée (ESLD) et compromettent la qualité de vie des résidents, augmentant les coûts de soins de santé, les réadmissions, le risque d'infection, de douleur, de dépression, et de mort2,3. Les lésions de pression des tissus profonds (LPTP) sont des LP qui apparaissent sous une peau intacte, et on pense qu'elles se développent d'abord dans les tissus profonds du corps et puis apparaissent sur la surface de la peau4 sous forme de décoloration rouge, violette ou brune non blanchie ou d'ampoule remplie de sang.1
Malgré le traitement actuel, ces lésions deviennent souvent rapidement des blessures ouvertes4. Typiquement, le traitement des LPTP vise à éviter d'autres dommages et une dévolution au stade 3 ou 4 LP4. Et pourtant, les recherches sur le traitement des LPTP sont limitées, raison pour laquelle ce projet d'amélioration de la qualité a été mis en œuvre pour analyser rétrospectivement les conclusions d'une étude de faisabilité qui a comparé un pansement à membrane polymérique (PMP) sans médicament à l'utilisation d'un film barrière cutanée chez des résidents de deux ESLD présentant des LPTP sur le pied et sur la jambe. Le PMP est un pansement en mousse conçu pour réduire les facteurs inflammatoires et l'œdème liés au dommage cutané tout en nécessitant des changements peu fréquents de pansement5. Le PMP a été choisi car il était facile à obtenir et à fournir dans les ESLD de l'étude. Les films barrière cutanée se présentent sous plusieurs formes et comprennent un revêtement transparent qui protège la peau des traumatismes et de l'humidité6. Les traitements LPTP précédents utilisés dans les deux établissements étaient le film barrière cutanée et la décharge de pression ; malgré l'utilisation du film barrière cutanée deux fois par jour, les établissements ont continué de constater une détérioration des LPTP, ce qui a donné lieu à l'étude de faisabilité.
Parallèlement aux problèmes des traitement actuels des LPTP, des recherches sont en cours pour déterminer s'il existe des indicateurs cliniques qui influencent l'évolution des LPTP en plaies ouvertes. Dans les ESLD, la plupart des résidents présentent de multiples comorbidités qui influencent le risque de LP, y compris les LPTP7. Des études supplémentaires sont nécessaires pour établir de façon concluante les indicateurs cliniques qui contribuent potentiellement aux LPTP afin qu'ils puissent être atténués.
Contexte et problème clinique
La prévalence des LPTP a triplé depuis 2006, probablement en raison de la classification des LPTP, qui ont été définis en 2007. Ceci a amélioré la prise de conscience des LPTP4. Les changements dans la réglementation et les améliorations de la prévention et du traitement n'ont pas réduit leur incidence, et le nombre et le coût de toutes les LP continuent d'augmenter8. En plus de causer de la douleur et de la souffrance aux résidents des ESLD, les LPTP coûtent près de 3,3 milliards de dollars aux ESLD chaque année.9
L'emplacement le plus fréquent d'une LPTP est sur le talon. Les talons sont pour la plupart des proéminences osseuses recouvertes d'une fine couche de peau avec peu de rembourrage ou de protection contre la pression10,11. En outre, d'autres états pathologiques tels que des problèmes respiratoires et/ou cardiovasculaires, prolongent le temps que les résidents passent en position dorsale et nécessitent souvent que la tête du lit soit surélevée, ce qui exerce une pression supplémentaire sur les pieds et sur les jambes10-13. Les mêmes mécanismes de pression endommagent les tissus mous des zones latérales du pied et des orteils ; en raison du positionnement latéral chronique, ces zones subissent souvent une pression soutenue et non soulagée .11
Le cisaillement est un facteur de risque courant à considérer dans l'évolution des LPTP13,14. Les couches de peau tendues contre une surface avec une friction et une pression endommagent la surface et les tissus internes plus profonds14. Le risque de cisaillement inclut le repositionnement passif des résidents, l'élévation de la tête du lit, et les mouvements actifs involontaires sous forme de spasmes ou de tremblements causés par des états pathologiques, qui augmentent le positionnement/la pression du pied contre le matelat14. Le risque de pression et de cisaillement augment donc le risque de détérioration des LPTP des pieds et des jambes inférieures.4,14,15
Outre le manque de traitement standard des LPTP, la possibilité que la détérioration des LPTP soit affectée par certains indicateurs cliniques suscite des inquiétudes. Dans de nombreux ESLD, un pourcentage élevé de résidents souffrant de débilité et de mobilité limitée sont à plus haut risque de développer une LP. À mesure que les résidents vieillissent, le nombre de troubles médicaux dont ils souffrent augmente7. Des études publiées montrent que les troubles médicaux tels que l'anémie, le diabète sucré, l'incontinence fécale et urinaire, la maladie vasculaire ou la malnutrition augmente le risque de développer des LP et (plus récemment) des LPTP3,4,7,16. Parmi ces facteurs de risque, l'anémie a été le plus fréquemment associée à un risque accru de LPTP.3,4 Une revue par Gefen et al13 note que les variables telles que la fièvre, la maladie cardiovasculaire non contrôlée ou l'acidose respiratoire peuvent également augmenter les risque de LPTP. Par conséquent, ce projet n'a pas seulement comparé deux options de traitement différentes pour les LPTP, mais a également considéré les indicateurs cliniques des résidents et leur influence potentielle sur la détérioration des LPTP.
Le traitement des LPTP tombe généralement dans une de deux catégories : décharge de pression et application. Dans une revue systématique, Cochrane, McGinnis et Stubbs17 ont étudié des dispositifs de réduction de la pression au talon pour la décharge de pression dans le traitement des ulcères du talon. D'après leurs résultats, il n'existe aucun dispositif répondant à tous les critères de confort dans la prévention et le traitement des ulcères du talon en éliminant la pression par une décharge de pression. Des recherches plus approfondies sur le soulagement de la pression au talon et sur le traitement des IP à l’aide d’une décharge de pression sont également nécessaires.17 Van Leen et al18 examiné des techniques de réduction de la pression pour traiter des LP dans une étude longitudinale menée dans un ESLD hollandais. La décharge de pression du pied et de la partie inférieure de la jambe a entraîné une diminution statistiquement significatives des LP de 16.6 % à 5.5 %, ce dont les patients dont les risques de LP étaient moyens à élevés bénéficiaient le plus. Pendant les années de l'étude, 57.8 % des patients à risque moyen à élevé de LP avec une décharge documentée de la pression du pied et des jambes (ainsi qu'une intervention éducative) risquaient moins de développer une LP.18
L'autre catégorie de traitement consiste à appliquer des pansements. Une étude de contrôle randomisée par Sullivan19 a évalué le traitement de LPTP à l'aide de pansements et a démontré que 74 % des LPTP diminuaient de taille ou qu'elles guérissaient avec l'utilisation d'un pansement en mousse à bordure multicouches auto-adhérant à base de silicone. Sur les 128 LPTP dans cette étude, une seule s'est ouverte jusqu'au tissu plus profond, et les autres lésions ne se sont pas ouvertes ou se sont ouvertes jusqu'au derme avec un temps de guérison moyen de 17.8 jours. De manière générale, les pansements en mousse multicouches réduisaient la détérioration et amélioraient le temps de résolution.19
Campbellet al16 a évalué l'utilisation de pansements rembourrés du talon pour traiter les lésions du talon. Le groupe de traitement a enregistré une amélioration de 100 % parmi les 20 participants, tandis que seulement 13 de 20 lésions se sont fermées dans le groupe témoin. L'étude a également démontré que le groupe de traitement nécessitait moins de temps et de dépenses pour guérir.16
Le comité consultatif national des lésions de pression recommande l'utilisation de la décharge de pression ou de pansements préventifs sur des résidents à haut risque de développer des ulcères du talon.20 Levy et al15 a observé que les pansements prophylactiques appliqués aux talons réduisaient le risque de LPTP en réduisant les contraintes et les forces de cisaillement. Au final l'utilisation de pansements pour protéger la peau et soulager la pression et le cisaillement est largement recommandée, bien que les études de comparaison soient limitées et justifiées.
Méthodes
L'objectif de ce projet était de comparer, analyser et évaluer rétrospectivement la détérioration documentée des LPTP en IP ouvertes chez des résidents suivant deux traitements différents. L'objectif secondaire était de déterminer la prévalence d'indicateurs cliniques connus pour contribuer au développement de LPTP dans le groupe PMP versus le groupe de film protecteur cutané.
Ce projet a tenté de répondre aux questions suivantes de la recherche :
(1) Les PMP et la décharge de pression du pied réduisent-elles mieux la détérioration des LPTP chez les résidents âgés de 55 ans ou plus que le film protecteur cutané avec décharge de pression ?
(2) Quelle était la prévalence de divers indicateurs cliniques chez les résidents qui avaient développé une LPTP au pied et/ou au membre inférieur, et un changement de traitement aurait-il un impact sur l'évolution de la LPTP ?
Initiation et éthique de l'étude
Une analyse des données administratives collectées par l'équipe d'assurance qualité et d'amélioration de la performance de deux ESLD en 2014 et 2015 a montré que 36 % des LPTP évoluaient en LP ouvertes de stade 43 lorsqu'elles étaient traitées par une décharge de pression et par twice-l'application quotidienne d'un film protecteur cutané. La conclusion a été le catalyseur pour la conduite d'une étude de faisabilité comparant le film protecteur cutané aux PMP pour les LPTP qui s'étaient développées entre octobre 2015 et mai 2017 dans les deux établissements. Le PMP a été choisi parce qu’il était nouveau dans les formulaires des établissements, qu’il était facilement accessible et qu’il présentait des preuves d’effets favorables pour d’autres types de lésions.
Ce projet d'analyse comparative rétrospective mené à l'automne 2017 a examiné les résultats pour les 33 résidents avec un total de 40 LPTP incluses dans l'étude de faisabilité. Les chercheurs ont effectué un audit de dossiers systématique comparant les traitements à base de PMP ou de film protecteur cutané pour l'échantillon de résidents présentant des LPTP et basé sur le type de traitement utilisé d'octobre 2015 à mai 2017. Les dossiers ont été inclus dans le projet si le résident avait une LPTP au pied ou à la partie inférieure de la jambe, avaient au moins 55 ans, et were était traité à l'aide d’un PMP ou d’un film protecteur cutané avec décharge de pression.
Durant l'étude de faisabilité, chaque résident de chaque groupe faisait l'objet d'un ordre continu de décharge de pression de la LPTP. Les résidents choisis pour le groupe PMP avaient fourni leur consentement pour le nouveau traitement ou une permission avait été accordée par la partie responsable du résident. Le traitement utilisant un PMP consistait à couper le PMP pour le rendre légèrement plus grand que la LPTP et à appliquer un pansement médical transparent pour couvrir le PMP après son application. Le pansement était changé deux fois par semaine. Les lingettes de film barrière cutané étaient appliquées deux fois par jour, et on laissait la peau sécher après l'application. Le comité pour la protection des personnes de l'université a déterminé que le projet actuel était dispensé. La société holding de l'ESLD, les équipes de direction administrative et les membres du conseil des prestataires de soins médicaux ont approuvé le projet.
Cadre et participants
Les deux ESLD participants sont approuvés par Medicare et Medicaid, avec des résidents bénéficiant d’un régime privé d'assurance et une capacité de lits d'environ 90 et 110 résidents, respectivement. Ils sont situés au sud-est des États-Unis. Ces établissements offrent des services de soins de courte et de longue durée qui comprennent une rééducation et des soins médicaux complexes pour les résidents dont le fonctionnement physique et mental est réduit et qui ont de multiples comorbidités telles que des LP et des LPTP.
Les données ont été extraites, dépersonnalisées, auditées pour les critères d'inclusion, et transmises à l'investigateur principal par les auditeurs des dossiers. L'échantillon a été développé en fonction du traitement ,des résidents, le groupe barrière cutanée comprenant 23 résidents présentant 27 LPTP, et le groupe PMP comprenant 10 résidents présentant 13 LPTP.
Collecte des données et mesures des résultats
Des experts en dossiers médicaux formés de chaque établissement ont extrait les données précédemment enregistrées du programme de dossiers médicaux électroniques appelé Electronic Charting System. Les collecteurs de données étaient formés par l'investigateur principal au sujet des données spécifiques à extrapoler et à coder pour la saisie des données. Les collecteurs de données ont reçu une formation standardisée de l'investigateur pour garantir l'exactitude de la collecte des données et l'extraction systématique des informations. Les données ont été extraites du dossier médical électronique de chaque résident pour chaque LPTP documentée. Les rapports de données générés ont été dépersonnalisés et transférés dans un fichier PDF privé et sécurisé par les collecteurs de données. Le fichier PDF a ensuite été codé et converti en un formulaire Microsoft Excel, organisé dans une base de données sécurisée et stocké dans un fichier protégé par mot de passe pour être récupéré par l'investigateur principal qui l'a analysé.
Les données extraites des dossiers médicaux comprenaient à la fois des données démographiques et des indicateurs cliniques. Les données démographiques comprenaient l'âge, le sexe et l'origine ethnique des résidents. Les indicateurs cliniques comprenaient les résultats des tests de laboratoire (dépistage de l'anémie et de l'hypoalbuminémie), les maladies chroniques/comorbidités, les antécédents médicaux, l'état fonctionnel et les scores de l'échelle de Braden.
L'échelle de Braden est un outil d'évaluation utilisé pour déterminer le risque de développer une LP. L'évaluation de l'échelle de Braden est située entre moins de 9 et 32. Plus le score de l'échelle de Braden n’est bas, plus le risque de développer une LP est élevé.21. Les résidents dont les taux d'albumine étaient inférieurs à 3.2 g/dl (reference intervalle de 3.5 à 5.2 g/dl) présentaient une hypoalbuminémie, ce qui peut indiquer une diminution de l'état nutritionnel chez certaines populations de patients.7 L'anémie a été identifiée comme étant un taux d'hémoglobine inférieur à la reference gamme de 12 à 15 g/dl. Les maladies chroniques et les comorbidités ont été identifiées avec un diagnostic ou un code de la International Classification of Diseases, 10th Revision et comprenaient la maladie vasculaire périphérique, la démence, la maladie coronarienne et/ou la maladie cérébrovasculaire.
Les autres données comprenaient les antécédents de LP antérieures et les antécédents orthopédiques récents tels qu'une fracture ou une chirurgie de la moitié inférieure du corps. De plus, information on le niveau d’activités de soutien à la vie quotidienne et les antécédents de mouvements involontaires chroniques du résident ont été extraits. Les changements de poids, à savoir la prise ou perte de poids de chaque résident avant l'identification de la/des LPTP, ont également été notés.
Tout diagnostic de maladie vasculaire périphérique noté dans le dossier des résidents a été saisi dans la collecte des données. Comme aucun résident n'avait un indice de pression tibio-brachiale documenté pour confirmer le diagnostic, les résidents atteints de maladie artérielle périphérique ont été exclus. Les résidents chez lesquels des ulcères diabétiques ou artériels avaient été diagnostiqués précédemment ont également été exclus.
Les variables des résultats comprenaient la détérioration des LPTP et le stade de la LP au moment de l'ouverture, le cas échéant.
Analyse statistique
L'outil de statistiques descriptives Microsoft Excel (Redmond, Washington) a été utilisé pour analyser les données des deux groupes. Des statistiques descriptives ont été utilisées pour décrire l'échantillon. Des tests χ2 indépendants ont été utilisés pour comparer chaque groupe aux résultats cliniques de l'ouverture ou de la non ouverture. P < .05 était considéré comme statistiquement significatif.
Résultats
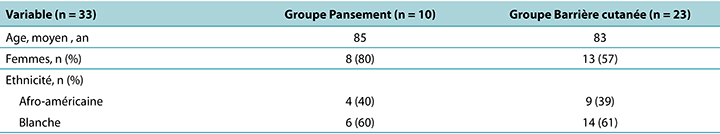
La majorité des participants étaient des femmes âgées en moyenne de 84 ans. Le groupe PMP était légèrement plus âgé que le groupe de film protecteur cutané (Tableau 1).
Tableau 1. Démographie des résidents présentant une lésion de pression des tissus profonds par groupe de traitement
Une simple analyse statistique a comparé la mesure des résultats primaires entre les groupes ; selon le test χ2 indépendant, la différence n'était pas statistiquement significative (P = .3160). Dans le groupe PMP, 23 % des LPTP se sont détériorées en une LP ouverte, tandis que 41 % des LPTP du groupe de film protecteur cutané se sont ouvertes pour devenir une 3 or LP de stade 4. Parmi les LPTP qui se sont ouvertes, seulement deux des lésions du groupe PMP se sont ouvertes pour devenir une LP de stade 3, et seulement une s'est ouverte pour devenir une LP de stade 4. Parmi les LPTP du groupe de film protecteur cutané, sept LPTP se sont ouvertes pour devenir une LP de stade 3, et quatre se sont ouvertes pour devenir une LP de stade 4. (Tableau 2).
Tableau 2. Résultats relatifs aux plaies
Des données descriptives ont été générées pour les indicateurs cliniques qui indiquaient le risque de développer une LPTP (Tableau 3). Le groupe PMP comportait un plus grand nombre de résidents présentant des indicateurs cliniques connus pour les LPTP. Le nombre de résidents qui avaient besoin de deux personnes pour les aider était un facteur significatif, représentant 80 % du groupe PMP et 61 % du groupe de film protecteur cutané. Le score moyen de l'échelle de Braden pour les résidents des deux groupes était de 15, indiquant au moins un risque modéré de développer une LPTP. Les scores de perte de poids et de diminution des taux d'albumine étaient impliqués, en particulier pour le groupe PMP, dans lequel 90 % présentaient une perte de poids et 60 % une hypoalbuminémie. Les résidents atteints de démence sévère (PMP, 60 % ; film protecteur cutané, 30 %) présentaient également un risque plus élevé de LPTP, ainsi que les résidents atteints de maladie coronarienne ou de maladie cérébrovasculaire (PMP, 90 % ; film protecteur cutané, 78 %). Pour examiner le cisaillement, des données ont été recueillies sur les résidents qui présentaient des mouvements anormaux des membres inférieurs tels que des tremblements ou des spasmes. Dans le groupe PMP, cet indicateur clinique aurait pu contribuer au développement de LPTP chez 70 des résidents. Fait intéressant, l'anémie était un indicateur de LPTP (PMP, 40 % ; film protecteur cutané, 39 %), sans être au niveau de signification noté dans d'autres études.
Tableau 3. Indicateurs cliniques des résidents présentant une lésion de pression des tissus profonds par groupe de traitement
Discussion
Ce projet rétrospectif a conclu que le film protecteur cutané et la décharge de pression n'évitaient pas la détérioration des LPTP. Les trois LPTP se sont seulement transformées en une plaie ouverte dans le groupe PMP, comparé à 11 des LPTP dans le groupe de film protecteur cutané. Bien que ce projet n'ait pas eu la puissance statistique permettant de démontrer la signification, les résultats indiquent que le fait de changer de traitement et d’utiliser des PMP avec décharge de pression au lieu du film protecteur cutané avec décharge de pression pouvait présenter un avantage.
Ce projet a relevé un risque plus élevé de détérioration des LPTP chez les résidents qui avaient un plus grand nombre d'indicateurs cliniques, conformément aux études précédentes.7,16 Bon nombre des problèmes médicaux des résidents d’ESLD continuent d'être des indicateurs significatifs, y compris une perte de poids, une diminution des taux d'albumine, des mouvements anormaux tels que des spasmes ou des tremblements, une maladie coronarienne et une maladie cérébrovasculaire.4,16 Les indicateurs tels que l'anémie, des chirurgies orthopédiques antérieures ou des fractures, une maladie vasculaire périphérique, et une démence sévère étaient associés à un risque modéré de détérioration des LPTP ; des études précédentes ont déterminé qu'il s'agissait d'indicateurs à haut risque.4,7,16 Il est intéressant de noter que le groupe PMP avait un plus grand nombre d'indicateurs cliniques de détérioration des LPTP en moyenne et pourtant leurs résultats étaient meilleurs. Ceci confirme que le traitement et la prise en charge peuvent l'emporter sur les effets des indicateurs cliniques dans la progression des LPTP.
Limitations
La taille de l'échantillon de convenance était petite en raison du nombre total de résidents présentant une LPTP diagnostiquée pendant la période d'étude de faisabilité. Bien que tous les collecteurs de données aient été formés par une seule personne en même temps, il n'y a pas eu de test de fiabilité interévaluateurs. En outre, le diagnostic de LPTP a été extrait par les collecteurs de données au vu du diagnostic du prestataire car un code de la International Classification of Diseases, 10th Revision pour la LPTP n'a pas été établi avant 2019. Enfin, il est important de noter qu'il est possible que les PMP ne soient pas disponibles dans tous les cadres de soins de santé, ce qui limite la généralisabilité des résultats.
Implications pour la pratique clinique
La décharge de pression et le repositionnement des résidents d’ESLD continuent d'être le traitement recommandé pour les LPTP. Toutefois, des complications liées à la détérioration des LPTP affectent les résidents d’ESLD et pèsent sur le système de soins de santé. Ce projet compare deux traitements différents pour les LPTP, tout en considérant les indicateurs cliniques susceptibles d'augmenter le risque de détérioration des LPTP. Bien que des preuves supplémentaires soient nécessaires pour évaluer le rapport coût-efficacité de ces traitements, le PMP a probablement réduit la détérioration des LPTP. Les PMP peuvent donc intéresser les établissements qui s'efforcent de prodiguer des soins de santé efficaces à leurs résidents, en particulier les résidents à haut risque.
Conclusions
Bien que la prévention soit cruciale, une fois qu'une LPTP s'est développée, il est extrêmement important de disposer d'une option de traitement rapide et fiable pour éviter une nouvelle détérioration. En gérant les LPTP avec une décharge de pression et un dépistage des indicateurs cliniques de détérioration, ainsi qu'un traitement préventif tel qu’un PMP, la trajectoire de ces blessures pourrait être considérablement améliorée.
Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts.
Financement
Les auteurs n’ont reçu aucun financement pour cette étude.
Author(s)
Autumn Henson*
DNP, GNP-BC, WCC Nurse Practitioner, Physicians Eldercare, Winston-Salem, North Carolina.
Laurie Kennedy-Malone
PhD, GNP-BC, FAANP, FGSA Professor of Nursing, University of North Carolina at Greensboro.
* Corresponding author
References
- National Pressure Injury Advisory Panel. NPIAP Pressure Injury Stages. 2016. https://cdn.ymaws.com/npiap.com/resource/resmgr/online_store/npiap_pressure_injury_stages.pdf. Last accessed June 15, 2020.
- Peart J. The aetiology of deep tissue injury: a literature review. Br J Nurs 2016;25(15):840-3.
- Honaker J, Brockopp D, Moe K. Suspected deep tissue injury profile. Adv Skin Wound Care 2014;27(3):133-40.
- Preston A, Rao A, Strauss R, Stamm R, Zalman D. Deep tissue pressure injury. Am J Nurs 2017;117(5):50-7.
- Gefen A. The future of pressure ulcer prevention is here: detecting and targeting inflammation early. EWMA 2018;19(2):7-13.
- Kestrel Health Information. Liquid skin protectors/sealants. WoundSource. 2019. www.woundsource.com/print/product-category/skin-care/liquid-skin-protectantssealants. Last accessed June 6, 2020.
- Ahn H, Cowan L, Garvan C, Lyon D, Stechmiller J. Risk factors for pressure ulcers including suspected deep tissue injury in nursing home facility residents. Adv Skin Wound Care 2016;29(4):178-90.
- Centers for Medicare & Medicaid Services. Nursing Home Data Compendium 2015 Edition. 2015. www.cms.gov/Medicare/Provider-Enrollment-and-Certification/CertificationandComplianc/Downloads/nursinghomedatacompendium_508-2015.pdf. Last accessed June 6, 2020.
- Agency for Healthcare Research & Quality. AHRQ’s Safety Program for Nursing Homes: On-Time Pressure Ulcer Prevention. 2016. www.ahrq.gov/professionals/systems/long-term-care/resources/ontime/pruprev/index.html. Last accessed June 6, 2020.
- Grothier L. Management of residents with heel located pressure damage. J Community Nurs 2013;27(5):42-6.
- Levy A, Gefen A. Computer modeling studies to assess whether a prophylactic dressing reduces the risk for DTI in the heels of supine residents with diabetes. Ostomy Wound Manage 2016;62(4):42-52.
- Santamaria N, Gerdtz M, Sage S, et al. A randomized controlled trial of the effectiveness of soft silicone multi-layered foam dressings in the prevention of sacral and heel pressure ulcers in trauma and critically ill patients: the border trial. Int Wound J 2013;12(3):302-8.
- Gefen A, Farid K, Shaywitz I. A review of deep tissue injury development detection and prevention: shear savvy. Ostomy Wound Manage 2013;59(2):26-35.
- Cutting K. Improving patient outcomes: bridging the gap between science and efficacy. Br J Nurs 2016;25(6):S28-S32.
- Levy A, Frank M, Gefen A. The biomechanical efficacy of dressings in preventing heel ulcers. J Tissue Viability 2015;24(1):1-11.
- Campbell N, Campbell D, Turner A. A retrospective quality improvement study comparing use versus nonuse of a padded heel dressing to offload heel ulcers of different etiologies. Ostomy Wound Manage 2015;61(11):44-52.
- McGinnis E, Stubbs N. Pressure-relieving devices for treating heel pressure ulcers. Cochrane Database Syst Rev 2014;12(2):1-31.
- Van Leen M, Schols J, Hovius S, Halfens R. A secondary analysis of longitudinal prevalence data to determine the use of pressure ulcer preventive measures in Dutch nursing homes, 2005-2014. Ostomy Wound Manage 2017;63(09):10-20.
- Sullivan R. Use of a soft silicone foam dressing to change the trajectory of destruction associated with suspected deep tissue pressure ulcers. Medsurg Nurs 2015;24(4):237-42.
- National Pressure Injury Advisory Panel. Pressure injury prevention points. 2016. https://npiap.com/page/PreventionPoints#:~:text=Inspect%20all%20of%20the%20skin,elbows%20and%20beneath%20medical%20devices. Last accessed June 15, 2020.
- Kalowes P, Messina V, Li M. Five-layered soft silicone foam dressing to prevent pressure ulcers in the intensive care unit. Am J Crit Care 2016;25(6):e108-19.