Volume 40 Number 4
Skin care for the protection and treatment of incontinence associated dermatitis (IAD) to minimise susceptibility for pressure injury (PI) development
Hiske Smart and R Gary Sibbald
Keywords pressure injuries, incontinence associated dermatitis, IAD, IAD skin protection
For referencing Smart H & Sibbald RG. Skin care for the protection and treatment of incontinence associated dermatitis (IAD) to minimise susceptibility for pressure injury (PI) development. WCET® Journal 2020;40(4):40-44
DOI https://doi.org/10.33235/wcet.40.4.40-44
Abstract
This manuscript summarises the important clinical concept of having a skin care protocol to protect and treat skin against incontinence associated dermatitis (IAD) to prevent and minimise the association IAD has on the subsequent development of pressure injuries (PI).
Skin protection for all skin tones is imperative to protect skin against exaggerated late presentations of IAD.
Introduction
Preserving the barrier function of the skin is an important clinical practice role that is often found in the nursing practice domain. Incontinence associated dermatitis (IAD) frequently includes severe discomfort to patients and tends to develop quickly in white skinned individuals and later, but in exaggerated form, in persons with darker tones of skin; this is due to the first clinical visual cues being obscured and not identified. Using evidence from the literature with clinical examples, the authors will highlight zinc oxide paste as a care option in the clinical setting due to ease of availability and relative low cost.
Incontinence Associated Dermatitis (IAD)
IAD is one of the four aetiologies included in the moisture associated dermatitis (MASD) category. IAD has been defined in the literature as a “form of irritant contact dermatitis that develops from chronic exposure to urine or liquid stool”1–3. The aetiology is believed to be from prolonged exposure of skin to urine or liquid stool (often in combination), with a resulting change of the normal acid pH of the skin into an alkaline pH level.1–6 Once the ‘acid mantle’ of the skin is compromised, the skin can undergo an inflammatory response (erythema) to the moisture from urine and/or faeces and the skin barrier may become compromised1–6.
Red skin (erythema) looks different depending on the natural pigmentation of the skin5. In brown or black skin, the erythema may not appear red but can have a darker tone to the surrounding skin and create diagnostic difficulty in examining the skin (Figure 1). Skin damage prevention is always better than treatment, but early skin damage is often harder to detect in darker skin tones5, leading to late initiation of interventions.
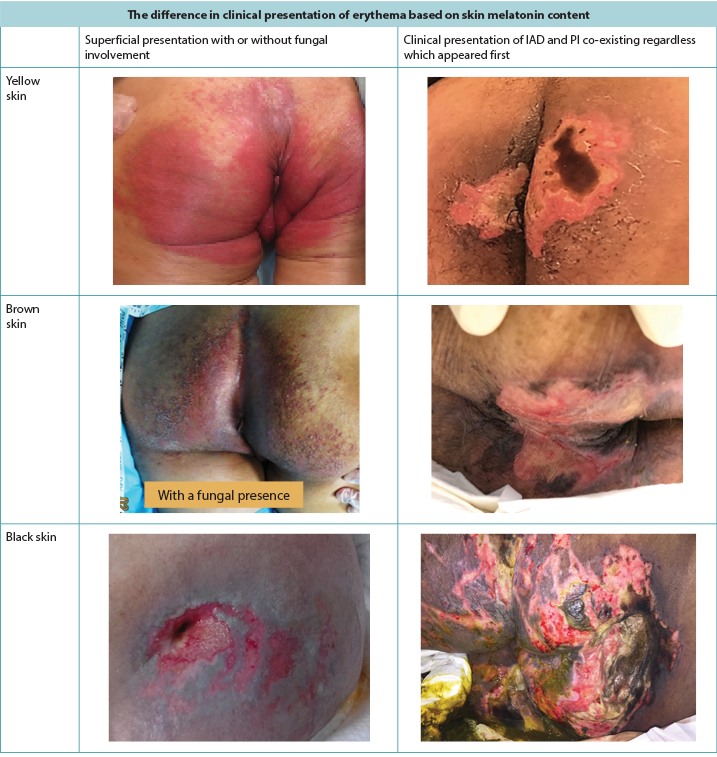
Figure 1. Clinical presentation of erythema and IAD co-existing with PI as seen in darker skin tones (Table and photos © Smart & Sibbald)
Pressure Injuries (PI) and IAD in combination
The literature supports an association between IAD and pressure injury (PI) formation, although the aetiology differs between the two7–11. Lachenbruch et al.8 analysed 176,689 patients and found that 92,889 persons with incontinence had a 16.3% incidence of PIs as opposed to continent persons (n=83,800) with an incidence of 4.1%. IAD was associated with a higher incidence of PIs than predicted by the Braden Risk Scale Score alone. Gray and Giuliano9 evaluated 5,342 patients, of whom 2,492 (46.6%) were incontinent of urine. They concluded that 21.3% of IAD may be associated with secondary yeast infection, immobility and an increased incidence of sacral PIs9.
Clinically, PIs present themselves over distinct bony prominences with distinct borders10. IAD, on the other hand, has a more diffuse appearance that may be present in the perineal area and spread out over the buttock area, causing a distinct dermatitis on the skin in prolonged contact with the incontinence content2,3,5,10. When they co-exist, the IAD diffuse pattern remains in exaggerated form8,9 (Figure 2). McNichol and colleagues4 summarised the literature on the importance of treating IAD aggressively in an attempt to decrease the subsequent development of PIs.
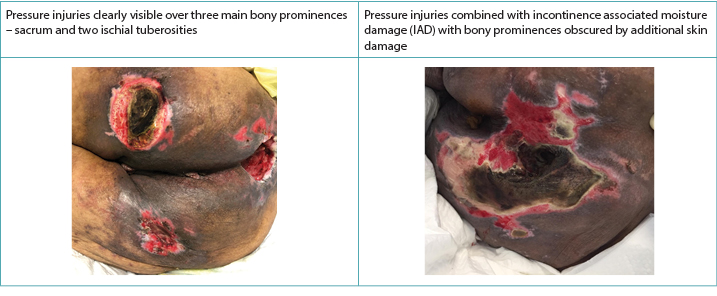
Figure 2. PIs alone and when co-existing with IAD in darker skinned persons (Table and photos © Smart & Sibbald)
Further support to this IAD/PI association is documented in the most recent European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel, and Pan Pacific Pressure Injury Alliance Pressure Injury Guideline10. Three guideline elements are crucial to practice with regards to IAD and PI co-existence. The one relates to the loss of the inert protective ability of the skin with the statement: “Moisture associated skin damage may compromise the epidermis barrier function and hence predispose tissue to pressure injury”10(p.21). The other relates to the ability of skin to tolerate additional forces if compromised by surface moisture: “Skin surface moisture combined with pressure and/or shear can increase the incidence of pressure injuries”10(p.86).
Yet another statement, that may sound contradictory in nature, also advises against ultra-dry dehydrated or flaky skin as a risk factor for skin breakdown when in contact with incontinence content:
Although research directly linking skin moisturizing to reduction in pressure injury incidence is lacking, one epidemiological study in hospitalized individuals with limited mobility (n=286) noted that dry skin was a significant and independent risk factor for pressure injuries in a multi-variate analysis 21 (Level 3 prognostic). Regular application of a moisturizer in a skin hygiene regimen is suggested for promoting skin hydration and preventing other adverse skin conditions, including dry skin and skin tears10(p.86).
Barrier Function and skin protective intervention strategies
The key is to keep skin well moisturised as that maintains the moisture protective gradient of skin4,8,12,13. In white skinned individuals this moisture unit protective gradient is three times lower than in darker skinned persons (2:6 ratio)12. This explains the risk of dry skin as a factor in moisture damage from stool enzymes and urine urea that occurs in white skinned persons far quicker than in persons with darker skin tones. The quality of the stratum corneum is also important as it is on its thinnest on the two opposite ends of the age continuum (babies13 and the frail aged14). Early intervention to treat the cause of the incontinence needs to be achieved in conjunction with a skin care protocol to protect, maintain and restore the skin’s barrier4–8,11.
In clinical practice, raising awareness of staff nurses and non-healthcare professionals and including the person’s family involved in their care about the use of appropriate skin cleansing products is vital. Educational enablers are easy ways to summarise key points and provide caregiver learnings about essential components regarding care. One such educational enabler for IAD skin care is the use of the ACT mnemonic to guide the clinician into a comprehensive skin care approach4 (Figure 3).

Figure 3. Clinical enabler to guide skin care in the presence of IAD
Skin care options
Skin cleansing after episodes of incontinence has evidence at B2 level as an effective intervention to remove residual surface debris from stool or urine on skin10. Neutral soaps or superfatted products15 are better options than ordinary soaps that are too alkaline (pH 9–10). This pH extreme either disrupts the skin’s acid mantle or damages structural proteins present in skin. Proper rinsing and gently patting the skin dry add additional value to skin protection as it prevents vigorous rubbing or massaging that may lead to micro-damage of the skin and substructures10,11.
Use of skin barriers
The natural moisturising factor of skin is achieved by in-built humectants to keep the skin surface moisture content at 10% for intact skin14. Products that do not alter the pH (as bacteria thrive in an alkaline environment10) and provide a barrier from incontinence are preferable and imperative to achieve better skin restoration outcomes4–8,16,17. Moisturisers frequently used in skin protection protocols could be either in a humectant or an emollient form. Humectants are available in many forms that may contain liquid-forming acrylates, ceramides, urea, lactic acid or glycerin, with the purpose to bind water to the skin surface16,17. It may cause local stinging and burning when water is drawn from the deeper layers. If applied after washing or bathing while the skin is still damp (within 2–3 minutes), this is prevented16. Emollients, on the other hand, can be applied at any time; they prevent insensible losses of moisture from the skin surface18. Since skin damaged from IAD can be painful, products that do not sting or burn on application may be better to address patient-centred concerns of pain management.
Zinc oxide as an example of an emollient in IAD preventative care
Zinc oxide is an enhanced barrier that prevents bacteria, contact irritants (e.g. stool, urine) and allergens from penetrating the skin. In zinc oxide ointment preparations, zinc oxide is combined with petrolatum as it creates a ‘stiff’ barrier, providing additional skin adherence and protection. It is less likely to soften or migrate from the skin into any co-existing deeper wound in that same area than with the petrolatum base alone18.
The 2016 Cochrane review on the prevention and treatment of IAD in adults17 cited several trials on zinc ointment that prevented or successfully treated IAD. The zinc oxide ointments do not always need to be removed if the surface is clean, but can be left to fill in the spaces. By using a clean tongue depressor to spread the zinc oxide preparation evenly, it helps to minimise the frictional resistance on the skin often encountered in application. It is well known that the topical application of zinc on skin adds to enhancement of the local defence systems in skin against superficial infection, while increasing epithelium migration to quickly cover any small lesion in the area18. Since the German dermatologist Unna created the zinc oxide paste bandage for venous ulcers in 1895, sufficient evidence has existed on its effect on aiding skin healing, with no currently documented adverse systemic effects encountered16. Although further robust studies are needed, zinc paste preparations are known to be effective skin protectants17 and are safe enough for use on babies13.
From a practice perspective, on skin without erythema or in the presence of mild redness, a zinc oxide barrier can be applied with ease using a gloved hand or tongue depressor. If there are erosions (loss of surface epidermis with an epidermal base as opposed to a dermal or deeper base) or satellite papules or pustules indicating candidiasis, a topical antifungal agent would then be required as a first layer. The antifungal agent can be applied first to the skin as a treatment and then the protective layer of zinc oxide is added as the second layer. This often poses as a practice challenge, as application in the presence of moisture is difficult. By layering the zinc ointment on a carrier medium (either on plain gauze or on impregnated gauze if available) and then applying this carrier as a last layer upside down on the area, this challenge can be averted. If the zinc oxide wears off between episodes of incontinence, a repeat layer can be applied once or twice a day. With consistent episodes of incontinence, skin cleansing, gentle pat drying and barrier ointment application should be repeated every time as soon as the incontinence occurs10,11.
Conclusion
Healthy skin requires it to be intact and have a stratum corneum moisture content of 10%. Incontinence of stool and urine can compromise this barrier in both white and darker skinned persons while adding to susceptibility of IAD and PI development. Skin protection for all skin tones is imperative to protect darker skin against exaggerated late presentations of IAD. Zinc oxide ointment provides an evidence-based ideal skin barrier that is readily available even in the most resource restricted environments. Proper application and use thereof has sufficient evidence10 to incorporate this in skin protective strategies to prevent and treat this common skin problem, especially in the young and aging populations with incontinence issues.
Conflict of Interest
Both authors have received an educational grant from Calmoseptine to teach the WoundPedia course in Manila, Philippines.
Soins de la peau pour la protection et le traitement de la dermatite associée à l'incontinence (DAI) visant à minimiser la susceptibilité au développement de lésions de pression (LP)
Hiske Smart and R Gary Sibbald
DOI: https://doi.org/10.33235/wcet.40.4.40-44
Résumé
Ce manuscrit résume un concept clinique important, avoir un protocole de soins de la peau pour protéger et traiter la peau contre la dermatite associée à l'incontinence (DAI) afin de prévenir et de minimiser l'association DAI sur le développement ultérieur des lésions de pression (LP).
La protection de la peau pour tous les tons de peau est impérative afin de protéger la peau contre les présentations tardives exagérées de DAI.
Introduction
Préserver la fonction barrière de la peau est un rôle de pratique clinique important que l'on retrouve souvent dans le domaine de la pratique infirmière. La dermatite associée à l'incontinence (DAI) cause souvent un inconfort intense aux patients et a tendance à se développer rapidement chez les personnes à peau blanche et plus tard, mais sous une forme exagérée, chez les personnes dont les tons de peau sont plus foncés ; cela est dû au fait que les premiers indices visuels cliniques sont masqués et non identifiés. En utilisant des données probantes de la littérature et des exemples cliniques, les auteurs mettront en évidence la pâte d'oxyde de zinc comme option de soins dans le cadre clinique en raison de sa disponibilité et de son coût relativement pas.
Dermatite associée à l'incontinence (DAI)
La DAI est l'une des quatre étiologies incluses dans la catégorie de dermatite associée à l'humidité (DAH). La DAI a été définie dans la littérature comme une « forme de dermatite de contact irritante qui se développe à la suite d'une exposition chronique à l'urine ou aux selles liquides »1–3. Il y a lieu de croire que l'étiologie résulte d'une exposition prolongée de la peau à l'urine ou aux selles liquides (souvent ensemble) entraînant la transformation du pH acide normal de la peau en un pH alcalin.1–6 Dès que le « manteau acide » de la peau est fragilisé, la peau peut subir une réponse inflammatoire (érythème) à l'humidité de l'urine et/ou des selles et la barrière cutanée peut être compromise1–6.
L’apparence de la peau rouge (érythème) est différente en fonction de la pigmentation naturelle de la peau5. Sur une peau brune ou noire, l'érythème peut ne pas paraître rouge mais être d’un ton plus foncé que la peau environnante, ce qui complique le diagnostic lorsque la peau est examinée (Figure 1). La prévention des lésions cutanées est toujours préférable au traitement, mais les lésions cutanées précoces sont souvent plus difficiles à détecter sur les peaux plus foncées5, retardant les interventions.
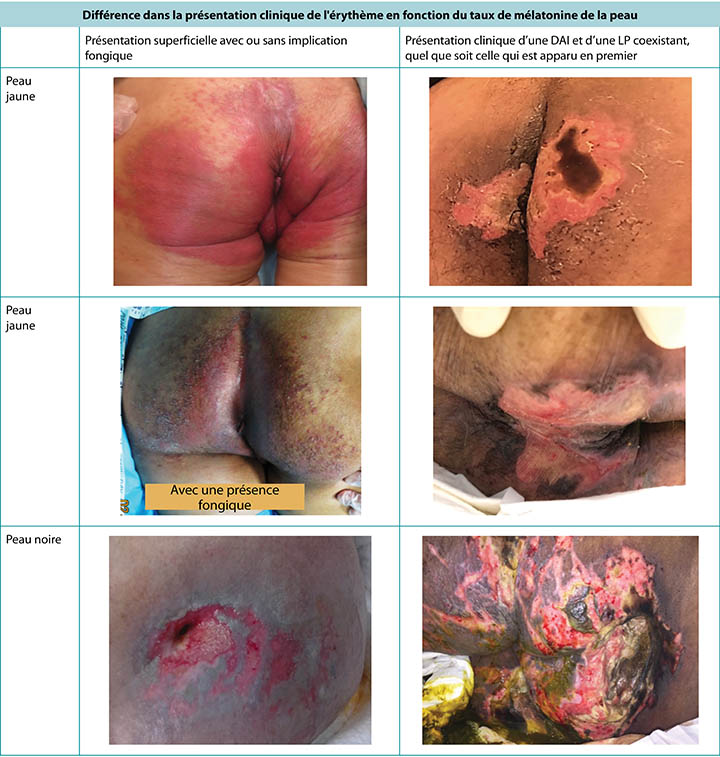
Figure 1. Présentation clinique d'un érythème et d'une DAI coexistant avec une LP observée avec des tons de peau plus foncée (Tableau et photos © Smart & Sibbald)
Lésions de pression (LP) associées une DAI.
La littérature soutient une association entre la DAI et la formation de lésions de pression (LP), bien que l'étiologie diffère entre les deux7–11. Lachenbruch et al.8 ont analysé 176 689 patients et constaté que 92 889 personnes souffrant d'incontinence avaient une incidence de LP de 16.3 % par rapport aux personnes continentes (n=83,800) avec une incidence de 4.1 %. La DAI a été associée à une incidence de LP plus élevée que prévu par le score de l'échelle de risque de Braden à lui-seul. Gray et Giuliano9 ont évalué 5342 patients, dont 2492 (46.6 %) étaient incontinents d'urine. Ils ont conclu que 21.3 % de la DAI pouvaient être associée à une mycose secondaire, à l'immobilité et à une incidence accrue de LP sacrées9.
Sur le plan clinique, les LP apparaissent sur des proéminences osseuses distinctes avec des bords distincts10. La DAI, par contre, a un aspect plus diffus qui peut être présent dans la région périnéale et se diffuser sur la zone du fessier, provoquant une dermatite distincte sur la peau en contact prolongé avec le contenu d'incontinence2,3,5,10. Lorsqu'elles coexistent, le patron diffus de la DAI demeure sous une forme exaggéree8,9 (Figure 2). McNichol et ses collègues4 ont résumé la littérature sur l'importance de traiter la DAI agressivement dans le but de réduire le développement ultérieur de LP.
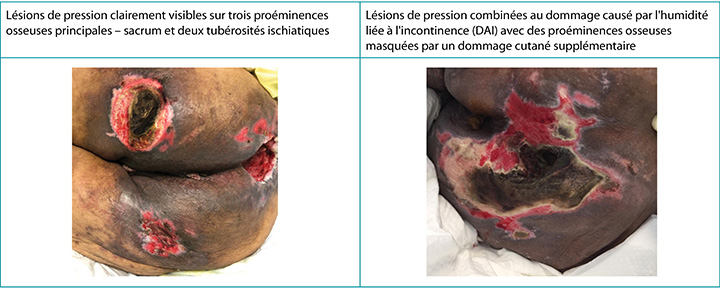
Figure 2. IP seules et coexistant avec une DAI chez des personnes de peau plus foncée (Tableau et photos © Smart & Sibbald)
Un autre soutien de cette association DAI/LP est documenté dans le Comité consultatif des ulcères de pression européen, le Comité consultatif des lésions de pression national, et la directive concernant les lésions de pression de l'Alliance sur les lésions de pression pan-pacifique les plus récents10. Trois directives sont essentielles à la pratique en ce qui concerne la coexistence de la DAI et des LP. L'un d'entre eux concerne la perte de la capacité de protection inerte de la peau avec l'énoncé : « Les dommages cutanés associés à l'humidité peuvent compromettre la fonction barrière de l'épiderme et donc prédisposer les tissus aux lésions de pression »10(p.21). L'autre concerne la capacité de la peau à tolérer des forces supplémentaires si elle est compromise par l'humidité superficielle : « L'humidité superficielle de la peau combinée à une pression et/ou un cisaillement peut accroître l'incidence des lésions de pression »10(p.86).
Un autre énoncé, qui peut sembler contradictoire par nature, déconseille également une peau ultra-sèche déshydratée ou squameuse comme facteur de risque de dégradation de la peau en cas de contact avec un contenu d'incontinence :
Bien que la recherche liant directement l'hydratation de la peau à une réduction de l'incidence des lésions de pression fasse défaut, une étude épidémiologique chez des personnes hospitalisées à mobilité réduite (n=286) a noté que la peau sèche était un facteur de risque significatif et indépendant de lésions de pression dans une analyse multivariée 21 (pronostic de niveau 3). L'application régulière d'une crème hydratante dans le cadre d’un régime d'hygiène cutanée est suggérée pour favoriser l'hydratation de la peau et prévenir d'autres affections cutanées indésirables, y compris une peau sèche et des déchirures cutanées10(p.86).
Fonction barrière et stratégies d'intervention de protection cutanée
La solution consiste à garder la peau bien hydratée pour maintenir le gradient de protection de l'humidité de la peau4,8,12,13. Chez les personnes à peau blanche, ce gradient de protection de l'unité d'humidité est trois fois plus faible que chez les personnes à peau plus foncée (ratio 2:6)12. Ceci explique le risque de sécheresse de la peau comme facteur de dommages dus à l'humidité causés par les enzymes des selles et de l'urée urinaire qui se produisent beaucoup plus rapidement chez les personnes à la peau blanche que chez les personnes à la peau plus foncée. La qualité de la couche cornée est également importante car elle est la plus fine aux deux extrémités opposées de la fourchette d'âges (bébés13 et personnes âgée s14). Une intervention précoce pour traiter la cause de l’incontinence est nécessaire conjointement à un protocole de soins de la peau pour protéger, maintenir et rétablir la barrière cutanée4–8,11.
Dans la pratique clinique, il est essentiel de sensibiliser le personnel infirmier et les professionnels non médicaux et inclure la famille impliquée dans les soins de la personne dans l’utilisation de produits appropriés pour le nettoyage de la peau. Les outils éducatifs sont des moyens faciles de résumer les points clés et de fournir au soignant des renseignements sur les éléments essentiels des soins. L'un de ces outils éducatifs dans les soins de la peau DAI consiste à utiliser le code mnémonique ACT pour guider le clinicien dans une approche globale des soins de la peau4 (Figure 3).

Figure 3. Outil clinique guidant les soins de la peau en présence d'une DLI
Options en matière de soins de la peau
Le nettoyage de la peau après des épisodes d'incontinence a un niveau de preuves B2 en tant qu'intervention efficace pour éliminer les débris de surface résiduels des selles ou de l'urine sur la peau10. Les savons neutres ou les produits surgras15 sont préférables aux savons ordinaires qui sont trop alcalins (pH 9–10). Ce pH extrême perturbe le manteau acide de la peau ou endommage les protéines structurelles présentes dans la peau. Un bon rinçage et un tapotement doux de la peau pour la sécher ajoutent une valeur supplémentaire à la protection de la peau, car il évite les frottements ou les massages vigoureux qui peuvent micro-endommager la peau et les sous-structures10,11.
Utilisation de barrières cutanées
Le facteur hydratant naturel de la peau est dû à des humectants intégrés qui maintiennent la teneur en humidité de la surface de la peau à 10 % pour une peau intacte14. Les produits qui n'altèrent pas le pH (car les bactéries se prolifèrent dans un environnement alcalin10) et constituent une barrière contre l'incontinence sont préférables et impératifs pour obtenir de meilleurs résultats en termes de réparation cutanée 4–8,16,17. Les hydratants fréquemment utilisés dans les protocoles de protection cutanée peuvent être sous forme humectante ou émolliente. Les humectants existent sous plusieurs formes pouvant contenir des acrylates formant un film liquide, des céramides, de l'urée, de l'acide lactique ou de la glycérine, dans le but de lier l'eau à la surface de la peau16,17. Ceci peut provoquer des brûlures et des picotements locaux lorsque l'eau est extraite des couches plus profondes. S'ils sont appliqués après le lavage ou le bain alors que la peau est encore humide (en 2 à 3 minutes), ce problème peut être évité16. Les émollients, par contre, peuvent être appliqués à tout moment ; ils évitent les pertes insensibles d'humidité de la surface de la peau18. Comme la peau endommagée par la DAI peut être douloureuse, les produits qui ne piquent pas ou ne brûlent pas lors de l'application peuvent être préférables pour répondre aux inquiétudes centrées sur le patient en matière de gestion de la douleur.
L'oxyde de zinc comme exemple d'émollient dans les soins préventifs de la DAI
L'oxyde de zinc est une barrière améliorée qui empêche les bactéries, les irritants de contact (p. ex. les selles, l'urine) et les allergènes de pénétrer dans la peau. Dans les préparations de pommade à l’oxyde de zinc, l’oxyde de zinc est associé à la vaseline car ceci crée une barrière rigide assurant une adhérence et une protection supplémentaires de la peau. Il risque moins de se ramollir ou de migrer de la peau vers une plaie plus profonde coexistante dans cette même zone qu'avec la base de vaseline seule18.
La revue de Cochrane en 2016 sur la prévention et le traitement de la DAI chez des adultes17 a cité plusieurs essais sur une pommade de zinc qui a évité ou réussi à traiter la DAI. Il n'est pas toujours nécessaire d'enlever les pommades à l'oxyde de zinc si la surface est propre et elles peuvent être laissées pour remplir les espaces. L'utilisation d'un abaisse-langue propre pour répartir uniformément la préparation d'oxyde de zinc minimise la résistance au frottement sur la peau qui se produit souvent lors de l'application. Il est bien établi que l'application topique de zinc sur la peau contribue à renforcer les systèmes de défense locaux de la peau contre une infection superficielle, tout en augmentant la migration de l'épithélium pour couvrir rapidement les petites lésions dans la zone18. Depuis la création du pansement en pâte d'oxyde de zinc pour les ulcères veineux par le dermatologue allemand Unna en 1895, il existe des preuves suffisantes de son effet bénéfique sur la cicatrisation de la peau, et aucun effet systémique indésirable n'a été documenté16. Bien que d'autres études robustes soient nécessaires, les préparations à base de pâte de zinc s’avèrent être des protecteurs cutanés efficaces17 et sont suffisamment sûres pour être utilisées sur les bébés13.
D'un point de vue pratique, une barrière à l'oxyde de zinc peut être appliquée facilement sur une peau sans érythème ou en cas de légères rougeurs à l'aide d'une main gantée ou d'un abaisse-langue. En présence d'érosions (perte d'épiderme superficiel avec une base épidermique par opposition à une base dermique ou plus profonde) ou de papules satellites ou de pustules indiquant une candidose, un antifongique topique serait alors nécessaire comme première couche. L'agent antifongique peut être appliqué en premier sur la peau comme traitement, suivi d’une application de la couche protectrice d'oxyde de zinc comme deuxième couche. Ceci pose souvent un défi de pratique car l'application en présence d'humidité est difficile. En étendant la pommade au zinc sur un support (de la gaze ordinaire ou de la gaze imprégnée si possible), puis en appliquant ce support à l'envers sur la zone comme dernière couche, ce problème peut être évité. Si l'oxyde de zinc s'estompe entre les épisodes d'incontinence, une autre couche peut être appliquée une ou deux fois par jour. En cas d'épisodes d'incontinence répétés, le nettoyage de la peau, son séchage en douceur en tapotant, et l'application de la pommade barrière doivent être répétés à chaque fois épisode d’incontinence10,11.
Conclusion
Une peau saine doit être intacte et avoir une teneur en humidité de la couche cornée de 10 %. L'incontinence des selles et de l'urine peut compromettre cette barrière chez les personnes à la peau blanche et plus foncée tout en augmentant leur susceptibilité à développer une DAI et une de LP. La protection cutanée pour tous les tons de peau est impérative pour protéger la peau plus foncée contre les présentations tardives exagérées de DAI. La pommade à l'oxyde de zinc constitue une barrière cutanée idéale fondée sur des données probantes et facilement disponible même dans les environnements disposant de ressources limitées. L'application et l'utilisation appropriées de cette pommade présentent des preuves suffisantes10 pour l'incorporer à des stratégies de protection cutanée afin de prévenir et de traiter ce problème cutané courant, en particulier dans les populations jeunes et vieillissantes qui ont des problèmes d'incontinence.
Conflit d’intérêts
Les deux auteurs ont reçu une subvention à caractère éducatif de Calmoseptine pour enseigner le cours WoundPedia à Manille, aux Philippines.
Author(s)
Hiske Smart*
RN, MA (Nur), Hons BSocSc (Nur), PGDip (WHTR – UK), IIWCC (Can)
Nurse Manager and Clinical Nurse Specialist – Wound Care and Hyperbaric Oxygen Therapy Unit, King Hamad University Hospital, Kingdom of Bahrain
Secretary General – World Union of Wound Healing Societies
Email hiskesmart@gmail.com
R Gary Sibbald
BScMd, MEd, DSC (Hon), FRCPC (Med)(Derm), FAAD, MAPWCA, JM
Professor of Medicine and Public Health, University of Toronto
Director of International Interprofessional Wound Care Course (IIWCC) & Masters of Science Community Health (Prevention and Wound Care), Dalla Lana School of Public Health
Co-Editor in Chief Advances in Skin & Wound Care
Project Lead ECHO Ontario, Skin & Wound
Investigator, Institute Better Health, Trillium Health Partners
* Corresponding author
References
- Black JM, Gray M, Bliss DZ, et al. MASD part 2: incontinence-associated dermatitis and intertriginous dermatitis: a consensus. J Wound Ostomy Continence Nurs 2011;38(4):359–70.
- Gray M, Bliss DZ, Doughty DB, Ermer-Seltun J, Kennedy-Evans KL, Palmer MH. Incontinence associated dermatitis: a consensus. J Wound Ostomy Continence Nurs 2007;34(1):45–54.
- Gray M, Black JM, Baharestani MM, et al. Moisture-associated skin damage: overview and pathophysiology. J Wound Ostomy Continence Nurs 2011;38(3):233–41.
- McNichol LL, Ayello EA, Phearman LA, Pezzella PA, Culver EA. Incontinence-associated dermatitis: state of the science and knowledge translation. Adv Skin and Wound Care 2018;31(11):502–513.
- Ayello EA, Sibbald RG, Quiambao PCH, Razor B. Introducing a moisture-associated skin assessment photo guide for brown pigmented skin©. WCET J 2014;34(2):18–25.
- Beeckman D. A decade of research on incontinence-associated dermatitis (IAD): evidence, knowledge gaps and next steps. J Tissue Viabil 2017;26:47–56.
- Bateman SD, Roberts S. Moisture lesions and associated pressure ulcers: getting the dressing regimen right. Wounds UK 2013;9(2):97–102.
- Lachenbruch C, Ribbie D, Emmons K, Van Gilder C. Pressure ulcer risk in the incontinent patient: analysis of incontinence and hospital-acquired pressure ulcers from the International Pressure Ulcer Prevalence Survey. J Wound Ostomy Continence Nurs 2016;43(3):235–41.
- Gray M, Giuliano KK. Incontinence-associated dermatitis, characteristics and relationship to pressure injury: a multisite epidemiologic analysis. JWOCN 2018;45(1):63–67.
- European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel, and Pan Pacific Pressure Injury Alliance. Prevention and treatment of pressure ulcers/injuries: clinical practice guideline. The International Guideline. Emily Haesler (Ed). EPUAP/NPIAP.PPPIA:2019.
- Park KH, Kim KS. Effect of a structured skin care regimen on patients with fecal incontinence: a comparison cohort study. J Wound Ostomy Continence Nurs 2014;41(2):161–167.
- De Farias PT, Azambuja AP, Horimoto AR, et al. A population-based study of the stratum corneum moisture. Clin Cosmet Investig Dermatol 2016;9:79–87. doi:10.2147/CCID.S88485
- Shin HT. Diagnosis and management of diaper dermatitis. Pediatr Clin North Am 2014;61(2):367–382.
- Sopher R, Gefen A. Effects of skin wrinkles, age and wetness on mechanical loads in the stratum corneum as related to skin lesions. Med Biol Eng Comput 2011;49(1):97–105.
- Bou J, Segovia G, Verdu S, Nolasco B, Rueda L, Perejamo M. The effectiveness of a hyper oxygenated fatty acid compound in preventing pressure ulcers. J Wound Care 2005;14(3):117–21.
- Schuren J, Becker A, Sibbald RG. A liquid film-forming acrylate for peri-wound protection: a systematic review and meta-analysis (3MTM CavilonTM no-sting barrier film). Int Wound 2005;2:230–238.
- Beeckman D, Van Damme N, Schoonhoven L, Van Lancker A, Kottner J, Beele H, Gray M, Woodward S, Fader M, Van den Bussche K, Van Hecke A, De Meyer D, Verhaeghe S. Interventions for preventing and treating incontinence-associated dermatitis in adults. Cochrane Database System Rev 2016;11. Art. No: CD011627.
- Lansdown AB, Mirastschijski U, Stubbs N, Scanlon E, Agren MS. Zinc in wound healing: theoretical, experimental, and clinical aspects. Wound Repair Regen 2007;15(1):2–16.
