Volume 42 Number 2
Fluid handling dynamics and durability of silver-containing gelling fibre dressings tested in a robotic wound system
Aleksei Orlov, Adi Lustig, Angela Grigatti and Amit Gefen
Keywords Wound care, biomechanical model, exudate management, laboratory testing, sorptivity, tissue phantom
For referencing Orlov A et al. Fluid handling dynamics and durability of silver-containing gelling fibre dressings tested in a robotic wound system. WCET® Journal 2022;42(2):15-23
DOI https://doi.org/10.33235/wcet.42.2.15-23
Abstract
Objective To develop a robotic phantom system containing multiple simulated wound replicates to determine the synergy in fluid absorbency and retention (sorptivity) performances and the post-simulated-use mechanical durability of silver-containing gelling fibre primary dressings when used with a secondary dressing, as per clinical practice.
Methods Using a robotic system containing six identical wound simulators, the authors tested the sorptivity performances of the Exufiber Ag+ (Mölnlycke Health Care, Gothenburg, Sweden) primary dressing (ExAg-polyvinyl alcohol [PVA]) against a market-leading comparator product, when used with a secondary foam dressing. The durability of the primary dressings after simulated use was further investigated through tensile mechanical testing.
Results The ExAg-PVA primary dressing delivered greater fluid amounts for absorbency and retention by the secondary foam dressing, approximately 2- and 1.5-fold more than the comparator dressing pair after 10 and 15 hours, respectively. The ExAg-PVA dressing was also substantially less sensitive to the direction of pulling forces and, accordingly, exhibited post-use mechanical strength that was approximately four- and six-times greater than that of the other primary dressing (when the latter dressing was tested out-of-alignment with its visible seams) after 10 and 15 hours, respectively.
Conclusions The dynamics of the sorptivity and fluid sharing between primary and secondary dressings and the effect of directional preference of strength of the primary dressings for adequate durability, resulting in safe post-use removals, have been described. The comparative quantification of these capabilities should help clinical and nonclinical decision-makers select dressings that best meet their patient needs.
Copyright ©2022 the Author(s). This is an open-access article distributed under the terms of the Creative Commons Attribution-Non Commercial-No Derivatives License 4.0 (CCBY-NC-ND), where it is permissible to download and share the work provided it is properly cited. The work cannot be changed in any way or used commercially without permission from the journal.
Introduction
Wounds of all types, including chronic cavity wounds such as pressure injuries, are one of the most impactful, expensive, and common medical problems. Nearly 2.5% of the US population experiences wounds, which is similar, for example, to the prevalence of stroke in the US.1–4 As the population ages and the prevalences of diabetes and obesity increase, there is a sharp growth in demand for advanced and cost-effective wound care to deliver improved patient outcomes. Treatment dressings play a pivotal role in all aspects of wound healing. Designed, in essence, as a temporary artificial substitute for intact skin, treatment dressings protect the wound and manage the exudates that result from periwound inflammatory processes. The presence and composition of exudates typically support the function of tissue-repairing cells and newly generated tissues; thus, in a normal tissue-repair process, the rate of exudate and its constituents will match the healing phase.5–7 However, abnormal prolongation of the inflammatory stage, such as in chronic wounds, may disrupt the physiologic control of exudate production, leading to excessive exudate amounts or altered ratios of protein content which causes the fluid to be thick, highly viscous, or even sticky.5
Effective wound dressings are required to manage exudate fluids secreted at varying rates and viscosities, in the same wound at different times, or for wounds of the same etiology but different patients. A common clinical practice is to insert a primary wound dressing through the wound opening to form the first-line reservoir for fluid absorption and retention on the wound bed. A secondary dressing is then placed above the cavity (and the primary dressing) for mechanical and biological protection, as well as to make a second vessel for the accumulating fluids. Gelling fibre dressings composed of polyvinyl alcohol (PVA) fibres or sodium carboxymethyl cellulose (CMC) are widely used as primary dressings because of their ability to trap fluids by transformation into a gel phase8 (examples of these commercial primary wound dressing products are listed in the woundsource.com resource database9 under the “Gelling Fiber Dressings” wound dressing product category). A variant of these primary gelling fibre dressings are those that contain silver ions to further induce an antimicrobial effect. To deliver effective treatments, a primary dressing and a secondary dressing must work in synergy; that is, neither dressing should approach its maximum fluid absorption capacity within the timeframe indicated for use.3,10–12
The performance of a wound dressing depends primarily on the specific material composition, structure, and manufacturing technology of the dressing. These characteristics, in combination with the relevant clinical protocol, specific wound environment, and the type of paired secondary dressing, impact the safety and efficacy of the primary dressing product. Two fluid-structure interaction properties that are relevant to the function of primary dressings are “sorptivity,” the capacity of a dressing structure to transfer excessive exudate away from the wound bed and onward to the secondary dressing through capillary action,10,13 and “durability,” the ability of a dressing to withstand patient body weight and other mechanical forces applied during changes and remain intact within the wound over the period of use or upon removal.10,13
In the 1970s, it was reported that the presence of gauze dressing particles in wounds “act as foreign bodies and may delay healing. Their removal has been associated with accelerated healing.”14 More recently, Chakravarthy and colleagues15 documented grossly visible disintegration of modern (hydrocolloid) dressings in wounds. Dressing disintegration was associated with inflammatory giant cells—pathologic evidence for a foreign-body reaction—which highlights the importance of durability at both the macroscale and microscale. Specifically, Chakravarthy et al15 evaluated the density of giant cells in histologic tissue sections that were extracted from wounds in a pig model of wound healing and subsequently stained by hematoxylin and eosin. They documented the presence of foreign material (ie, dressing debris) in the vicinity of the giant cells in the histologic slides, which correlated with their observed fragmentation of some of the tested hydrocolloid dressings upon removal during dressing changes.15
Accordingly, poorly performing wound dressings or dressing pairs may cause suboptimal moisture balance, mechanical damage to tissues, foreign-body reactions, or a combination of these adverse events. Such dressing failure modes should be identified through methodological bioengineering laboratory testing so that medical claims can be controlled by regulatory bodies and dressing failure in clinical settings can be avoided. In this context, the authors continue to invest research efforts into the development and improvement of preclinical and laboratory testing methods for objective, quantitative, and standardised evaluation of wound dressing performance.3,10,11,13 Here, the authors present a novel robotic phantom system that contains multiple simulated wound replicates for the simultaneous testing of dressings. The system was developed and used to determine the synergy in fluid absorbency and retention performances of two silver-containing gelling fibre primary dressing products. The methods, equipment, and protocols reported herein form the basis for the next level of clinically relevant performance testing for wound dressings, focused on both safety and efficacy.
Methods
Robotic Exuding Wounds
The researchers developed and used a robotic phantom system comprising six wound replicates. Each wound unit in this system simulated an exuding, 2.5 cm-deep cavity wound (Figure 1). All six wound units included three layers of synthetic soft-tissues simulants (Figure 1). The top layer, representing the peri-wound skin, consisted of 5 mm-thick transparent silicone rubber (RTV615, Momentive Performance Materials Inc, Waterford, New York). An 8-mm-thick layer of paraffin gel (“candle-gel”; Ziv Chemicals Ltd., Holon, Israel) was placed below this “skin” layer, to represent adipose tissue. The inferior layer (with thickness of 12 mm) representing skeletal muscle was again made of silicone rubber (identical to that used as the skin simulant). The elastic modulus of the aforementioned silicone rubber material, measured through uniaxial tensile testing using an electromechanical material-testing machine (Instron model 5944; Instron Co, Norwood, Massachusetts) following ASTM D412-06,16 is 1.5 MPa, which is characteristic of both skin and muscle tissues under large deformations.17–19 The elastic modulus of the paraffin gel used to represent adipose tissue was measured through previously reported indentation tests20 and found to be 5 kPa, which is similar to the reported stiffness of native adipose tissues.21 To simulate continuous secretion of exudate from the above wound constructs, a spiral perforated irrigation tube was laid in each simulated wound bed and tunneled through the phantom structure to connect to a multichannel, programmable syringe pump (NE-1600; New Era Pump Systems Inc, Farmingdale, New York; Figure 1). The effective wet surface formed in the simulated wound beds through this irrigation element was approximately 24 cm2, corresponding to an effective irrigation depth of approximately 2.5 cm. The multichannel syringe pump provided precise control over the flow volume and release rate of an exudate-substitute fluid delivered into the simulated wound beds. The safe and reproducible exudate substitute fluid formula is based on Xanthan gum (C35H49O29); it was previously developed by the authors’ research group for use with the robotic wound phantom systems. This formula facilitates control of the fluid viscosity and pH level to adequately represent the physical characteristics of native exudates.10-13,22 Two exudate solutions were prepared, with high and low viscosities of 0.23 Pa×s and 0.06 Pa×s, respectively; the fluid density was 1.03 g/mL for both. An infrared heating lamp was positioned above the six wound replicas to maintain them at a temperature of 33 ± 2° C;23 the temperatures were monitored via a digital thermometer (Newtron TM-5005-SINGLE I/P; MRC Laboratory Equipment Ltd, Holon, Israel).
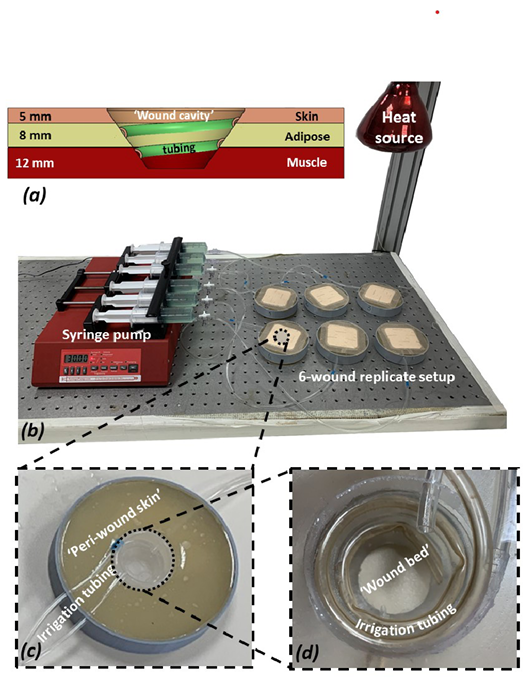
Figure 1. The experimental setup and its components
a) A scheme of a cross-section through a single “wound” simulator unit showing the different tissue simulant layers and their respective thicknesses, the shape and depth of the ‘wound cavity’ and the configuration of the spiral irrigation tubing. (b) A photograph of the robotic phantom system including the six wound replicates and the control unit. (c) A close-up view of a single simulated wound. (d) Zoom on the simulated exuding “wound bed.”
Simulated Treatments
Two types of 10×10 cm primary gelling fibre dressings were investigated: Exufiber Ag+ (Mölnlycke Health Care AB, Gothenburg, Sweden) with PVA fibres (ExAg-PVA) and an equivalent, commercially available, and market-leading silver ion dressing product containing sodium CMC as the gelling material (Ag-CMC). The Ag-CMC dressing is a soft, sterile, nonwoven pad composed of sodium CMC hydrocolloid fibre material that is impregnated with 1.2% ionic silver.24-26 It is indicated for clinical use in various wound types, both acute and chronic, and its physical and antibacterial properties have been described in detail elsewhere.24-26 Of note, although the two types of primary dressings selected for this study—PVA-based and CMC-based—are made of distinct materials and produced through different manufacturing technologies, both are clinically indicated for use as cavity wound fillers, which was the rationale for the current comparison. Mepilex Border Flex (MBF-Foam; Mölnlycke Health Care), a multilayer bordered silicone-foam dressing, was used as the secondary dressing to cover the simulated wounds in all the tests. The MBF-Foam is a five-layer dressing that includes (from the outer dressing surface to its wound-facing aspect): backing film, a retention layer, a spreading layer, an absorptive foam layer (which transports exudate to the spreading layer), and a wound contact layer.
Prior to applying the dressing products onto the simulated wounds, each dressing (primary or secondary) was weighed. The dressings were then applied according to manufacturer instructions. The simulated wounds were positioned facing upward, so that the tested dressings were required to absorb and retain the exudate substitute through capillary action (ie, against gravity). The robotic system was activated with a flow rate of 2 mL/h. To determine the time course of the absorbency performances of the tested dressings and, importantly, the dynamics of the fluid distribution between the primary and secondary dressings, the products were tested for multiple durations of simulated use: 5, 10, and 15 hours.
Dressing Studies
Fluid Retention and Distribution Between the Primary and Secondary Dressings. Following simulated use in the robotic phantom system, the dressings were reweighed to calculate the net mass gain in each dressing due to fluid absorption; any nonretained, residual fluids were carefully collected from the wound cavities and also weighed. After converting the measured fluid masses to volumes (by dividing the absorbed and residual fluid masses by the fluid density), the total exudate volume was calculated separately for each test as the sum of the fluid volumes in the primary and secondary dressings plus the volume of the residual fluid. Next, the distribution of fluid volumes between the primary and secondary dressings was calculated for each test as the percentage of fluid retained in the primary versus the secondary dressing, with respect to the corresponding total exudate volume (the theoretical value of which is also calculable, as the product of the predetermined flow rate and the time of operation of the robotic wound system).10
Fiber Directionality. For gelling fibre dressings, the directionality of the fibres, which typically is related to the manufacturing technology of these primary dressings (ie, PVA vs CMC), likely affects the performances of the dressing product, such as the sorptivity (the fibres become the structural conductors for the capillary action) and the durability (the fibres provide structural support and mechanical tolerance against forces that are aligned with their primary direction). Accordingly, the researchers assessed the directionality of the fibres in the two primary dressing types by digital image processing of microscopy images of the dressing surfaces, which were acquired using a light optical stereo microscope (Axiolab A450909; Carl Zeiss AG, Oberkochen, Germany). The micrographs of the dressing surfaces were acquired in transmitted light mode using a 1.25× magnification objective, a C-mounted digital camera (Swift Cam SC1803; Swift Optical Instruments Inc, Schertz Texas) and the Swift Imaging software (version 3.0, Swift Optical Instruments Inc.). Five fields of view (FOVs) were captured at consistent surface locations from two primary dressing specimens of each type: One FOV was located at the center of the dressing, and the other four FOVs formed a cross around the dressing center, with each such peripheral FOV located at a distance of 2.5 cm from the dressing edges. This resulted in a total of 15 digital micrographs of the FOVs per dressing type, each with dimensions of 4,912 × 3,684 pixels (1 square pixel = 0.919 µm2). For the purpose of the fibre directionality analyses, the acquired FOVs were further divided into three rectangular sub-FOVs, each with dimensions of 1445×3288 pixels. The fibre directionality analyses were conducted using the postacquisition plugin “OrientationJ” of the ImageJ software suite (version 1.X),27,28 which segments the fibres in the digital micrographs and calculates the probability function for their planar orientation in each analyzed sub-FOV. After calibrating this code and visually verifying its performances, the normalised histograms of the fibre orientations in the studied primary dressings were extracted.
Strength of the Primary Dressings After Simulated Use. Immediately after the simulated use sessions, the tensile strength of each primary dressing specimen was tested using an electromechanical testing machine (Instron model 5944; Instron Co) equipped with a 2kN load cell, following a protocol that is based on ASTM D882-02.29 Primary dressing specimens prepared according to the above testing standard were stretched at a deformation rate of 50 mm/min until ultimate failure occurred. Based on the resulting force-deformation data, stress-strain curves of the dressings after simulated use were plotted and the area under the stress-strain curve, which is the strain energy density (SED) to failure, was calculated for each test using a dedicated MATLAB computer code (ver. R2019a; MathWorks, Inc, Natick, Massachusetts). Based on these microscopy analyses of the fibre orientations, the ExAg-PVA dressing was treated as a structure without a specific directional preference (ie, test specimens from this dressing type were prepared and mechanically tested at random directions). However, the Ag-CMC silver-containing primary dressing, which has a specific directional preference of its fibres (as further detailed in the Results), was tested in two different configurations: where its principal fibre direction was fully aligned with the loading axis of the material testing machine, and where the fibres were out of such alignment.
Statistical analyses
All the experiments reported above were conducted in replicates of six and descriptive statistics of means and SDs were calculated for the retained fluid volumes, the distribution of fluid contents between the primary and secondary dressings per each simulated use duration (5, 10, and 15 hours), and the SED to failure of the primary dressings (depending on the directionality of the fibres with respect to the loading axis, as noted previously). Next, analyses of variance (ANOVA), followed by post-hoc Tukey-Kramer multiple pairwise comparisons, were run to identify potential differences between the dressing performances in the previously described fluid management (sorptivity) and material strength tests. Specifically, two-way ANOVAs for the factors of the usage time and the primary dressing type were conducted for the fluid retention and fluid distribution data. In addition, a three-way ANOVA for the factors of the usage time, the primary dressing type, and the directionality of the tensile test with respect to the fibre orientation (in the primary dressing that exhibited directional preference of fibre orientation) was performed for the material strength data. Only the longer exposure times of 10 and 15 hours, for which substantial fluid mass had accrued in the tested primary dressings, were considered for the latter three-way ANOVA. With respect to the directionality factor, based on the microscopy analyses, the last ANOVA considered the ExAg-PVA dressing, which did not show any specific and consistent directional preference of its fibres, as having a single strength (SED-to-failure) property. However, the Ag-CMC had two strength properties, namely, the strength measured (1) when the fibres were fully aligned with the loading axis of the material testing machine and, (2) when they were out of such alignment. P <.05 was considered statistically significant.
Results
When examined in isolation, the absorbency of the ExAg-PVA primary dressing was lower (approximately 11-22%) than that of the Ag-CMC primary silver dressing (Figure 2a). However, this difference was due to a more effective transfer of the exudate-like fluid from the ExAg-PVA dressing to the secondary dressing, as evident when examining the data for the fluid distribution between the primary and secondary dressings (Figure 2b). Specifically, when functioning in a pair with the ExAg-PVA dressing, the secondary dressing contained approximately twice the amount of fluid at the 10-hour time point and 1.5-times the amount of fluid after 15 hours with respect to the comparator pair (Figure 2b). The dynamics of the fluid distribution between the primary and secondary dressings over time (Figure 2b) further revealed that the reservoir of the secondary dressing began to receive fluid no earlier than 5 hours from the time of the dressing application (Figure 2b). After 15 hours, the secondary dressing shared approximately 54.2% of the retained fluid when the primary dressing was ExAg-PVA but only 36.7% when the Ag-CMC primary dressing was used (P < .05; Figure 2b). Importantly, these results represent the performances of the dressing pairs and therefore, better reflect real-world clinical practice, as opposed to assessments of the function of wound dressings in isolation (Figure 2b).
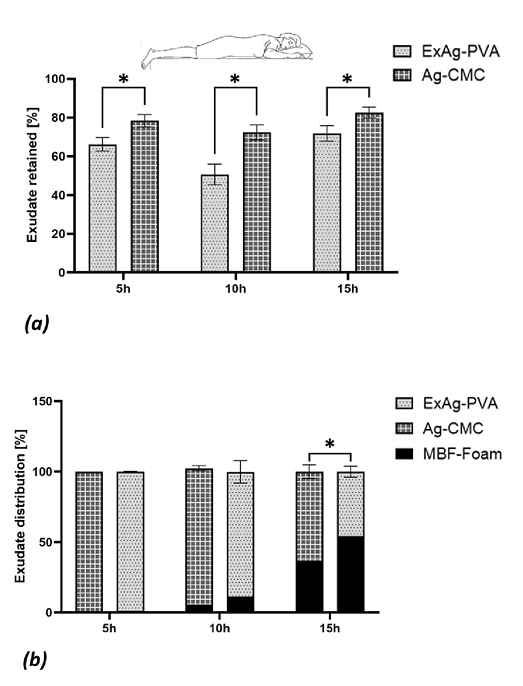
Figure 2. Fluid absorption and retention performances of the tested dressings
(a) The fluid retained in the primary dressings, reflecting the sorptivity of these dressings (reported as percentage of the total fluid volume retained in the primary and secondary dressings plus the residual fluid in the simulated wound bed). (b) The fluid distribution between the primary and secondary dressings after 5, 10, and 15 hours of simulated use in offloaded wounds (as in a prone position). The error bars are the SDs from the mean values of six test repetitions per test configuration and an asterisk indicates a statistically significant difference in the relevant outcome measure (P < .01).
The digital microscopy image analyses of the primary dressings indicated that the ExAg-PVA dressing had no distinguishable directional fibre preference. Specifically, to verify the relative lack of directional preference of the ExAg-PVA dressing with respect to that of the Ag-CMC primary silver-containing dressing, the researchers calculated the integral bounded between the fibre orientation histogram curve and the 0.5 (midpoint) level for the two primary dressings. This integral is defined here as the fibre orientation index (FOI). When a dressing does not exhibit a directional preference of its fibres, the positive and negative areas between the aforementioned histogram curve and the 0.5 level approximately cancel each other out, which results in a relatively low FOI value. The analyses of the FOI data indicated that the ExAg-PVA dressing had a statistically significant, approximately 3.9-fold lower FOI (15.6 ± 11.8) with respect to that of the Ag-CMC primary silver-containing dressing (60.8 ± 48.8; P < .05 for five different microscope FOVs on each dressing type). This FOI property ratio quantitatively demonstrates the strong preference of the fibre alignment in the Ag-CMC primary dressing toward the direction of the visible reinforcing seams in that dressing (the 90° direction marked in Figure 3a). Of note, the fibre orientation histogram of the latter (Ag-CMC) dressing was always above the midpoint level, which again indicates a strong directional preference (Figure 3a). Visual inspection of the microscopy data confirmed that the majority of the fibres in the Ag-CMC primary dressing were aligned and grouped together to connect to the vertical (90°-oriented) visible seams. The micrographs further demonstrated numerous elliptically shaped voids with characteristic maximum length dimensions of approximately 400 to 600 µm in the Ag-CMC primary dressing (Figure 3a). These findings, of a preferred fibre orientation and abundant presence of noncircular voids, justified the selection of the Ag-CMC primary silver-containing dressing as having a specific directional preference (ie, along its visible seams) for the purpose of further mechanical testing, as follows.
For the mechanical testing of the primary dressings post simulated use, the later time points of 10 and 15 hours of fluid exposure were selected because the previous results indicated that at 10 hours and afterward, both primary dressing types had transferred fluid to their paired secondary dressings (Figure 2b). Thus, at the 10- and 15-hour timepoints, both primary dressing types used their fluid reservoirs in a manner indicating that they were indeed tested at their “wet” state. Further, based on the results of the microscopy analyses, the ExAg-PVA dressing was tested as a structure without a specific directional preference (ie, irrespective of the direction by which test specimens were cut from this dressing type), whereas the Ag-CMC dressing was tested in two different configurations: fully aligned with the primary fibre orientation (90° direction), which is the direction of the visible seams, and out of such alignment (ie, randomly selected but different from the 90° direction).
The SED-to-failure data for the two primary dressing types are shown in Figure 3b and demonstrate considerable differences in mechanical behaviors of the post-use dressing types, particularly concerning the ductility of the ExAg-PVA dressing versus the Ag-CMC product. Ductility is the degree to which a material or structure can sustain plastic/irreversible deformations and continue to absorb strain energy under tensile loading before catastrophic failure occurs. Interestingly, the ExAg-PVA dressing appeared to gain ductility as it absorbed more fluid and gelled and accordingly, at 15 hours, it had 1.7-times greater SED-to-failure than it did at 10 hours. In contrast, gelling transformation did not translate into greater ductility for the Ag-CMC primary dressing; its SED-to-failure data were indistinguishable for the 10- and 15-hour time points (Figure 3b). Moreover, the aforementioned strength tests clearly indicated that the main loadbearing structure in the Ag-CMC primary dressing was, indeed, the reinforcing (visible) seams and the (near) 90°-oriented fibres. When tested out of alignment, the strength of the Ag-CMC primary dressing dropped significantly, by more than 8-fold (P < .05). With respect to the mechanical strength of the ExAg-PVA dressing, the Ag-CMC primary dressing had an out-of-alignment strength that was approximately four and six times lower for the 10- and 15-hour time points, respectively (P < .05).
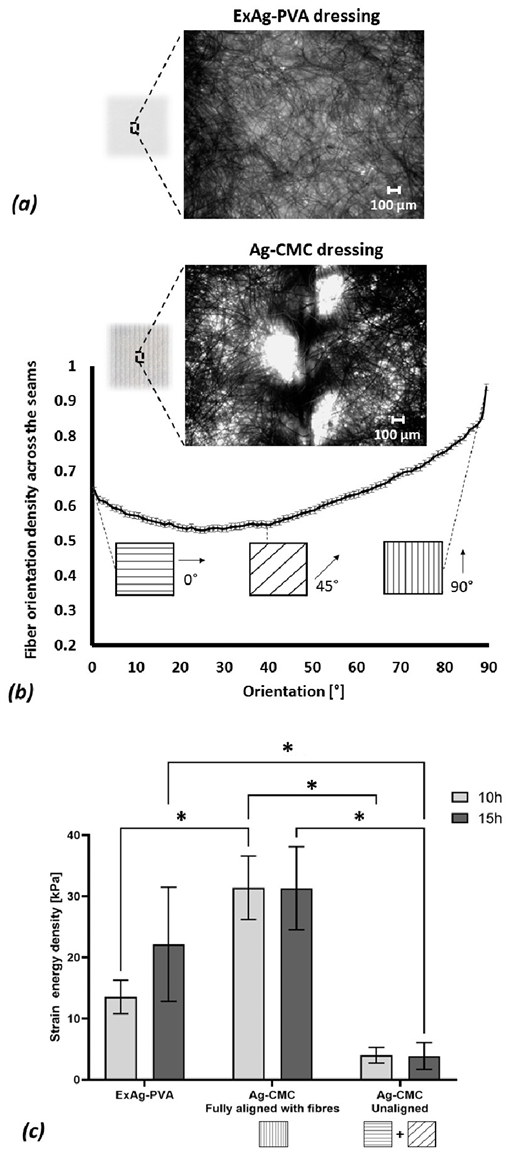
Figure 3. Structure-function analyses of the tested primary wound dressings
(a) An example of a microscopic image of the Exufiber Ag+ (ExAg-PVA) dressing. (b) Representative microscopy image analysis of the fiber orientation in the Ag-sodium carboxymethyl cellulose (CMC) dressing, showing the normalised planar distribution of fiber orientations in this primary dressing type. (c) The strain energy density to failure of the two tested primary dressing types post simulated use of 10 and 15 hours, where the Ag-CMC product has been tested in two configurations, either in full alignment of the principal direction of the fibers of the dressing with the loading axis of the testing machine, or out of such alignment. The error bars are the SDs from the mean values of six test repetitions per test configuration and an asterisk indicates a statistically significant difference in the relevant outcome measure (P < .01).
Discussion
Wound exudates are critical for tissue repair—they facilitate cell mobility and transport of signaling molecules and growth factors across the wound bed. However, excess exudate production may lead to maceration, become a medium for infections, or prolong the inflammation period.30,31 Thus, excess exudate amounts should be absorbed and retained in therapeutic dressings to support the natural wound-healing process. Clinical practice in treating cavity wounds as well as other highly exuding wounds (such as venous leg ulcers and burns) is to use a nonadherent wound filler as the primary dressing to induce a moist wound-healing environment while maximising dressing contact with the wound bed for effective absorbency. A secondary dressing is then applied to close the wound and protect it from potential mechanical traumas and pathogen invasion while also allowing evaporation of the exudate and release of byproduct gases. The secondary dressing also potentially provides an additional reservoir for absorbency and retention of the wound fluids, but it strongly depends on the sorptivity of the primary dressing for effective exudate management. Hence, for effective treatments, the primary and secondary dressings must work in synergy; both dressings should share the retained fluid mass as equally as possible and not approach their maximum fluid absorption capacity until a dressing change is indicated.3,10,11 Of note, for clinical realism, sorptivity should be assessed by testing a wound dressing pair using a relatively viscous, not watery, test fluid, which was the approach of the current study.10,11 New exudate cannot enter a primary dressing if there is no space for it at the wound-contacting aspect of the dressing; however, the existence of such available space depends on adequate transport of existing exudate from the primary to the secondary dressing.10,11 The capillary action that enables this fluid movement is inversely proportional to the square root of the viscosity of the transferred fluid (see Equation 2 in Lustig et al10); that is, the more viscous the fluid, the more difficult it is for it to be transported against gravity upward to the secondary dressing in any offloaded wound.10 Of note, nonoffloaded wounds may occur in real-world clinical practice and include, for example, wounds that are subjected to body weight forces such as plantar diabetic foot ulcers or sacral pressure injuries in patients who are ventilated supine, or wounds that are compressed by a medical device such as compression stockings applied on venous leg ulcers. The current study and configuration of the robotic exuding wounds apply to off-loaded wounds only; the additional biophysical complexity that arises from the action of bodyweight or external (eg, medical device-related) forces on a wound or its vicinity was not taken into account.
Gelling fibre dressings based on PVA or CMC fibres are used as primary dressings on a variety of highly exuding wound types. These dressings are meant to form a soft, cohesive gel when in contact with exudate, which induces the necessary moisture in the wound. However, such dressings must exhibit sufficient capillary action (sorptivity) to effectively transfer any excess exudate fluids away from the wound bed and prevent their pooling at the wound-dressing interfaces or within any undermining or tunneling spaces.3,10,11 In this work, a robotic phantom system of multiple simulated wound replicates was developed and used to evaluate the synergy in fluid absorbency and retention performances (facilitated through sorptivity) of two market-leading silver-containing gelling fibre primary dressing products when used with a secondary foam dressing, as per clinical practice. The ability of these primary dressings to stay intact while being subjected to pulling forces post simulated use sessions (ie, to exhibit clinically relevant durability) was further tested. These pulling forces mimic the mechanical effect of the forces that a clinician would apply with his/her gloved fingers or forceps when removing a used dressing and replacing it with a new one.
The ExAg-PVA was substantially more effective in transferring exudate simulants to the secondary foam dressing compared with the Ag-CMC. The ExAg-PVA dressing contained less fluid at each time point, and its paired secondary dressing accepted that fluid and retained it at increasing amounts over time. The latter results are particularly innovative because they reveal, for the first time in the literature, that the sharing process initiates between 5 and 10 hours after application of the dressings and amplifies thereafter. Specifically, the ExAg-PVA primary dressing delivers greater fluid amounts for absorbency and retention by the secondary dressing, approximately 2- and 1.5-fold the amounts of fluid at the 10- and 15-hour time points, respectively, with reference to the comparator dressing pair. The more fluid that is transferred to the secondary dressing, the greater the available capacity of the primary dressing to manage new inflowing exudates. Thus, laboratory evaluations must assess the function of wound dressings in the relevant clinical context (ie, measuring the function of the primary-secondary dressing pair as opposed to testing dressing products in isolation). Importantly, these experimental results demonstrate that the extent and rate of fluid sharing depend on the dressing materials and composition, indicating that there are more and less optimal choices of primary-secondary dressing combinations.
Nevertheless, sorptivity and the associated absorbency and retention performances are only one aspect to consider when assessing the safety and effectiveness of wound dressings through bioengineering laboratory testing. The mechanical strength of a primary dressing must be sufficient to endure the forces that occur throughout the life cycle of the dressing, including under the extraction forces that a clinician applies when the dressing is removed. Despite being exposed to the aggressive chemical and thermodynamic environment of the wound, a dressing must not disintegrate or leave debris or particles in the wound. Any debris (even microparticles) that originate from the primary dressing and spread onto the wound surface may initiate a foreign-body reaction whereby the immune system attempts to form granuloma (aggregation of macrophages and fibroblasts around each particle to isolate it from the body tissues). Such events consume valuable inflammatory and tissue repair efforts, which detract from the local biologic healing resources (eg, the potential numbers of the immune and fibroblast cells that are available for the tissue repair task).3,10,15,32
The microscopy image analyses did not show a consistent, strong directional preference of the fibres in the ExAg-PVA dressing, indicating low directional strength preference compared with the Ag-CMC, which did demonstrate a strong directional preference associated with its weave structure, specifically toward the visible reinforcing seams of the dressing. The durability testing results were consistent with the aforementioned microscopy findings for the Ag-CMC. Specifically, the Ag-CMC demonstrated poor mechanical strength when the direction of the pulling forces did not fully align with that of the reinforcing seams. Moreover, the current mechanical testing indicated that the strength of the Ag-CMC dressing is dominantly provided by the visible reinforcing seams and the closely aligned fibres; this imposes a real-world requirement (not presented by the manufacturer) that a clinician removing the dressing should be aware of the orientation of the seams and attempt to pull in that specific direction so as to avoid accidental (partial or complete) tearing. Yet, when removing a primary dressing from the wound cavity, the likelihood that a nurse would (blindly) pull the dressing at a specific orientation that exactly matches the primary fibre orientation of the dressing approaches zero. Moreover, removing a dressing in line with its primary fibre orientation is made even harder if the dressing takes on the same color as the exudate while in the wound. Because dressings are typically folded in the wound cavity and most of their structure is invisible, even if a nurse would hypothetically attempt to pull the dressing in a specific direction (to conform with the dressing’s optimal mechanical energy absorption to failure properties), then still, from a cost-effectiveness perspective, a dressing requiring removals at specific orientation and extra attention to that aspect adds to the clinical workload. The above implies that in real-world, clinically relevant scenarios, the Ag-CMC would have a four to six times lower strength (ie, mechanical energy absorption to failure) than that of the ExAg-PVA dressing, and the Ag-CMC dressing is therefore much more likely to leave debris or particles in a wound. The likelihood of such dressing failure events increases further when a wound has undermining, is tunneled, or has sticky or rough surfaces, all of which may be associated with greater pullout forces required to release the used dressing to be changed.
As with any experimental study, there are limitations in the ability to mimic in vivo processes and the large variety of clinical scenarios. Accordingly, in future work, additional experiments focusing on typically nonoffloaded wounds such as venous leg ulcers, are warranted. There is also a need to test additional wound dressing types and technologies from various manufacturers and include the aspect of cost-effectiveness versus the measured performance parameters. Other sensors and post analyses can potentially be added to the apparatus (and to each wound simulant unit) or be integrated in the testing methodology, such as intrawound continuous pH monitoring or mass spectrometry of the residual fluids following dressing usage periods. Further progress can be achieved by introducing exudate substitutes that contain specific microbiomes that may represent different wound etiologies, such as infected pressure injuries or diabetic foot ulcers. All of these future improvements would require additional validation and reliability studies before informing clinical practice.
Conclusions
Using an automated robotic phantom system of multiple open cavity wounds, the authors evaluated the absorbency and retention and therefore the sorptivity performances of silver-containing gelling fibre dressings paired with a secondary foam dressing. The mechanical durability of the primary silver-containing dressings was tested after simulated use. The current experimental system and protocol were designed with emphasis on the clinical relevance of the bioengineering laboratory testing, to reproduce how wound dressings are used in practice and consider the real-world scenarios that may be associated with their failure. Consistent with the previous published work of the authors, sorptivity and durability were again identified as critical factors that should be assessed when evaluating wound dressings in laboratory testing.3,10,11 The present findings further underpin that wound dressings belonging to a certain product category, such as silver-containing gelling fibre dressings, are not all the same, and the specific absorption, retention, and, importantly, the ability to synergistically work with a secondary dressing (which good sorptivity enables) differ across products, depending on the specific materials and composition of the dressing.3,10,32,33 The present experimental data revealed that the ExAg-PVA dressing has better sorptivity and durability than the comparator Ag-CMC product. Moreover, the authors described the dynamics of the fluid sharing between primary and secondary dressings and identified the importance of not having a specific fibre directionality in a primary dressing for durability and safe post-use removals. The comparative quantification of these capabilities should help both clinical and nonclinical decision-makers to assess and select the wound dressings that best meet the needs of their patients. As with any preclinical work, the current laboratory findings need to be validated against randomised controlled trials with appropriate sample sizes of different wound etiologies. The role of the laboratory work reported here is primarily to guide such potential clinical research to focus on the novel aspects of fluid sharing between the primary and secondary wound dressings, and the ability of the primary dressings to remain intact during removals, topics that have been poorly addressed in the literature thus far.
Acknowledgment
This project has received funding from the European Union’s Horizon 2020 research and innovation program under the Marie Skłodowska-Curie Grant was also partially supported by the Israeli Ministry of Science & Technology (Medical Devices Program grant no. 3-17421, awarded to Prof Amit Gefen in 2020) and by Mölnlycke Health Care (Gothenburg, Sweden). The authors thank Ms Orel Belo, the Laboratory Engineer at the Gefen Laboratory, for supporting the experimental work. The authors have disclosed no other financial relationships related to this article. Submitted July 23, 2021; accepted in revised form November 1, 2021; published online ahead of print March 14, 2022. Copyright Advances in Skin & Wound Care and the World Council of Enterostomal Therapists.
Conflict of interest
The authors declare no conflicts of interest.
Funding
The authors received no funding for this study.
Dynamique de manipulation des fluides et durabilité des pansements à fibres gélifiantes contenant de l'argent testés dans un système robotisé de traitement des plaies
Aleksei Orlov, Adi Lustig, Angela Grigatti and Amit Gefen
DOI: https://doi.org/10.33235/wcet.42.2.15-23
Résumé
Objectif Développer un un système de fantôme robotisé contenant plusieurs répliques de plaies simulées pour déterminer la synergie des performances d'absorption et de rétention des fluides (sorption) et la durabilité mécanique après utilisation simulée des pansements primaires à fibres gélifiantes contenant de l'argent lorsqu'ils sont utilisés avec un pansement secondaire, conformément à la pratique clinique.
Méthodes À l'aide d'un système robotisé contenant six simulateurs de plaies identiques, les auteurs ont testé les performances de sorption du pansement primaire Exufiber Ag+ (Mölnlycke Health Care, Göteborg, Suède) (ExAg-alcool polyvinylique [PVA]) par rapport à un produit de comparaison leader sur le marché, lorsqu'il est utilisé avec un pansement secondaire en mousse. La durabilité des pansements primaires après une utilisation simulée a été étudiée par la suite par des tests mécaniques de traction.
Résultats Le pansement primaire ExAg-PVA a libéré des quantités de fluide plus importantes pour l'absorption et la rétention par le pansement secondaire en mousse, environ 2 et 1,5 fois plus que la paire de pansements de comparaison après 10 et 15 heures, respectivement. Le pansement ExAg-PVA était également beaucoup moins sensible à la direction des forces de traction et, par conséquent, présentait une résistance mécanique après utilisation environ quatre et six fois supérieure à celle de l'autre pansement primaire (lorsque ce dernier a été testé hors alignement avec ses coutures visibles) après 10 et 15 heures, respectivement.
Conclusions La dynamique de la sorption et du partage des fluides entre les pansements primaires et secondaires ainsi que l'effet de la préférence directionnelle de la résistance des pansements primaires pour une durabilité adéquate, résultant en des retraits post-utilisation sûrs, ont été décrits. La quantification comparative de ces capacités devrait aider les décideurs praticiens cliniques et non praticiens à choisir les pansements qui répondent le mieux aux besoins de leurs patients.
Copyright ©2022 l'auteur ou les auteurs. Il s'agit d'un article en accès libre distribué selon les termes de la licence Creative Commons Attribution-Non Commercial-No Derivatives License 4.0 (CCBY-NC-ND), qui permet de télécharger et de partager le travail à condition qu'il soit correctement cité. L'œuvre ne peut être modifiée d'aucune façon ni utilisée à des fins commerciales sans l'autorisation de la revue.
Introduction
Les plaies de tous types, y compris les plaies cavitaires chroniques telles que les lésions de pression, constituent l'un des problèmes médicaux les plus graves, les plus coûteux et les plus courants. Près de 2,5% de la population américaine souffre de plaies, ce qui est similaire, par exemple, à la prévalence des accidents vasculaires cérébraux aux États-Unis.1–4 Le vieillissement de la population et l'augmentation de la prévalence du diabète et de l'obésité entraînent une forte croissance de la demande de soins avancés et économiques des plaies afin d'améliorer les résultats pour les patients. Les pansements jouent un rôle essentiel dans tous les aspects de la cicatrisation des plaies. Conçus, par essence, comme un substitut artificiel temporaire à la peau intacte, les pansements de traitement protègent la plaie et gèrent les exsudats résultant des processus inflammatoires péri-lésionnels. La présence et la composition des exsudats soutiennent généralement la fonction des cellules réparatrices des tissus et des tissus nouvellement générés. Ainsi, dans un processus normal de réparation des tissus, le taux d'exsudat et de ses constituants correspondra à la phase de guérison.5–7 Cependant, une prolongation anormale de la phase inflammatoire, comme c'est le cas dans les plaies chroniques, peut perturber le contrôle physiologique de la production d'exsudat, entraînant des quantités excessives d'exsudat ou des ratios modifiés de la teneur en protéines qui rendent le fluide épais, très visqueux, voire collant.5
Des pansements efficaces sont nécessaires pour gérer les fluides exsudatifs sécrétés à des taux et de viscosité variables, dans la même plaie à des moments différents, ou pour des plaies de même étiologie mais de patients différents. Une pratique clinique courante consiste à insérer un pansement primaire par l'ouverture de la plaie pour former le réservoir de première ligne pour l'absorption et la rétention des fluides sur le lit de la plaie. Un pansement secondaire est ensuite placé au-dessus de la cavité (et du pansement primaire) pour assurer une protection mécanique et biologique, ainsi que pour constituer un second récipient pour les fluides accumulés. Les pansements à fibres gélifiantes composés de fibres d'alcool polyvinylique (PVA) ou de carboxyméthylcellulose sodique (CMC) sont largement utilisés comme pansements primaires en raison de leur capacité à piéger les fluides par transformation en phase gel8 (des exemples de ces pansements primaires commerciaux sont répertoriés dans la base de données de ressources woundsource.com9 dans la catégorie de produits de pansement " pansements à fibres gélifiantes "). Une variante de ces pansements primaires à fibres gélifiantes est celle qui contient des ions d'argent pour induire un effet antimicrobien supplémentaire. Pour délivrer des traitements efficaces, un pansement primaire et un pansement secondaire doivent fonctionner en synergie, c'est-à-dire qu'aucun des deux pansements ne doit approcher sa capacité maximale d'absorption des fluides dans le temps d'utilisation indiqué.3,10–12
Les performances d'un pansement dépendent principalement de la composition spécifique du matériau, de la structure et de la technologie de fabrication du pansement. Ces caractéristiques, associées au protocole clinique pertinent, à l'environnement spécifique de la plaie et au type de pansement secondaire apparié, ont un impact sur la sûreté et l'efficacité du pansement primaire. Deux propriétés d'interaction fluide-structure qui sont pertinentes pour la fonction des pansements primaires sont la " sorption", la capacité d'une structure de pansement à transférer l'exsudat excessif du lit de la plaie vers le pansement secondaire par capillarité,10,13 et la " durabilité", la capacité d'un pansement à résister au poids du corps du patient et à d'autres forces mécaniques appliquées pendant les changements de façon à rester intact dans la plaie pendant la période d'utilisation ou lors du retrait.10,13
Dans les années 1970, il a été signalé que la présence de particules de pansement de gaze dans les plaies "agit comme un corps étranger et peut retarder la cicatrisation". Leur abandon a été associé à une accélération de la cicatrisation".14 Plus récemment, Chakravarthy et ses collègues15 ont documenté la désintégration grossièrement visible de pansements modernes (hydrocolloïdes) dans des plaies. La désintégration des pansements était associée à des cellules géantes inflammatoires, preuve pathologique d'une réaction à corps étranger, ce qui souligne l'importance de la durabilité à l'échelle macroscopique et microscopique. Plus précisément, Chakravarthy et al.15 ont évalué la densité des cellules géantes dans des coupes histologiques de tissu extraites de plaies dans un modèle porcin de cicatrisation des plaies, puis colorées à l'hématoxyline et à l'éosine. Ils ont documenté la présence d'un matériau étranger (c'est-à-dire des débris de pansement) à proximité des cellules géantes sur les lames histologiques, ce qui est en corrélation avec la fragmentation observée de certains des pansements hydrocolloïdes testés lors de leur retrait pendant les changements de pansement.15
Par conséquent, des pansements ou des paires de pansements aux performances médiocres peuvent provoquer un équilibre hydrique sous-optimal, des dommages mécaniques aux tissus, des réactions à corps étranger ou une combinaison de ces événements indésirables. Ces modes de défaillance des pansements doivent être identifiés par des tests méthodologiques en laboratoire de bio-ingénierie afin que les allégations médicales puissent être contrôlées par les organismes de réglementation et que les défaillances de pansements dans les contextes cliniques puissent être évitées. Dans ce contexte, les auteurs continuent à investir des efforts de recherche dans le développement et l'amélioration des méthodes de tests précliniques et de laboratoire pour une évaluation objective, quantitative et standardisée des performances des pansements.3,10,11,13 Les auteurs présentent ici un nouveau système de fantôme robotisé qui contient plusieurs répliques de plaies simulées pour l'essai simultané des pansements. Le système a été développé et utilisé pour déterminer la synergie des performances d'absorption et de rétention des fluides de deux pansements primaires à fibres gélifiantes contenant de l'argent. Les méthodes, l'équipement et les protocoles présentés ici constituent la base de la prochaine étape des tests de performance cliniquement pertinents pour les pansements, axés sur la sûreté et l'efficacité.
Méthodes
Plaies exsudatives robotisées
Les chercheurs ont développé et utilisé un système de fantôme robotisé comprenant six répliques de plaies. Chaque unité de plaie de ce système simulait une plaie exsudative de 2,5 cm de profondeur (figure 1). Les six unités de plaie comprenaient trois couches de simulants de tissus mous synthétiques (figure 1). La couche supérieure, représentant la peau péri-lésionnelle, était constituée d'un caoutchouc de silicone transparent de 5 mm d'épaisseur (RTV615, Momentive Performance Materials Inc, Waterford, New York). Une couche de 8 mm d'épaisseur de gel de paraffine ("candle-gel", Ziv Chemicals Ltd., Holon, Israël) a été placée sous cette couche de "peau", pour représenter le tissu adipeux. La couche inférieure (d'une épaisseur de 12 mm) représentant le muscle squelettique était à nouveau constituée de caoutchouc de silicone (identique à celui utilisé comme simulant de peau). Le module d'élasticité du matériau en caoutchouc de silicone susmentionné, mesuré par des tests de traction uni-axiale à l'aide d'une machine électromécanique de test des matériaux (Instron modèle 5944, Instron Co, Norwood, Massachusetts) conformément à la norme ASTM D412-06,16 est de 1,5 MPa, ce qui est caractéristique des tissus cutanés comme des tissus musculaires soumis à de grandes déformations.17–19 Le module d'élasticité du gel de paraffine utilisé pour représenter le tissu adipeux a été mesuré par des tests d'indentation préalables20 et s'est révélé être de 5 kPa, ce qui est similaire à la rigidité constatée des tissus adipeux natifs.21 Pour simuler la sécrétion continue d'exsudat à partir des constructions de plaies décrites ci-dessus, un tube d'irrigation perforé en spirale a été placé dans chaque lit de plaie simulé et traversait la structure du fantôme pour se connecter à un pousse-seringue programmable multicanaux (NE-1600, New Era Pump Systems Inc, Farmingdale, New York) (figure 1). La surface humide effective formée dans les lits de plaie simulés par cet élément d'irrigation était d'environ 24 cm2, correspondant à une profondeur d'irrigation effective d'environ 2,5 cm. Le pousse-seringue multicanaux a permis un contrôle précis du volume du débit et du taux de libération d'un fluide de substitution de l'exsudat délivré dans les lits de plaie simulés. La formule sûre et reproductible du fluide de substitution d’exsudat est basée sur la gomme de xanthane (C35H49O29). Elle a été précédemment développée par le groupe de recherche des auteurs pour être utilisée avec les systèmes de fantôme de plaies robotisés. Cette formule facilite le contrôle de la viscosité du fluide et du niveau de pH pour représenter de manière adéquate les caractéristiques physiques des exsudats natifs.10-13,22 Deux solutions d'exsudat ont été préparées, avec des viscosités élevées et faibles de 0,23 Pa×s et 0,06 Pa×s, respectivement. La densité du fluide était de 1,03 g/ml pour les deux. Une lampe chauffante infrarouge a été placée au-dessus des six répliques de plaies afin de les maintenir à une température de 33 ± 2° C.23 Les températures ont été contrôlées via un thermomètre numérique (Newtron TM-5005-SINGLE I/P, MRC Laboratory Equipment Ltd, Holon, Israël).

Figure 1. Le dispositif expérimental et ses composants a) Schéma d'une coupe transversale à travers une seule unité de simulateur de "plaie" montrant les différentes couches de simulant tissulaire et leurs épaisseurs respectives, la forme et la profondeur de la "cavité de la plaie" et la configuration du tube d'irrigation en spirale. (b) Une photographie du système de fantôme robotisé comprenant les six répliques de la plaie et l'unité de contrôle. (c) Vue rapprochée d'une seule plaie simulée. (d) Zoom sur le "lit de la plaie" exsudatif simulé
Traitements simulés
Deux types de pansements primaires à fibres gélifiantes de 10×10 cm ont été étudiés: Exufiber Ag+ (Mölnlycke Health Care AB, Göteborg, Suède) avec des fibres de PVA (ExAg-PVA) et un produit de pansement équivalent, disponible dans le commerce et leader sur le marché, contenant de la CMC sodique comme matériau gélifiant (Ag-CMC). Le pansement Ag-CMC est une compresse souple, stérile et non tissée, composée de fibres hydrocolloïdes de CMC sodique imprégnées de 1,2% d'argent ionique.24-26 Il est indiqué pour une utilisation clinique dans divers types de plaies, aiguës et chroniques, et ses propriétés physiques et antibactériennes ont été décrites en détail par ailleurs.24-26 Il convient de noter que, bien que les deux types de pansements primaires sélectionnés pour cette étude - à base de PVA et de CMC - soient constitués de matériaux distincts et produits par des technologies de fabrication différentes, ils sont tous deux indiqués en clinique pour le comblement de plaies cavitaires, ce qui a justifié la comparaison actuelle. Mepilex Border Flex (MBF-Foam, Mölnlycke Health Care), un pansement multicouche avec bordure en mousse de silicone, a été utilisé comme pansement secondaire pour couvrir les plaies simulées dans tous les tests. Le MBF-Foam est un pansement à cinq couches qui comprend (de la surface extérieure du pansement au côté face à la plaie): un film de support, une couche de rétention, une couche d'étalement, une couche absorbante en mousse (qui transporte l'exsudat vers la couche d'étalement) et une couche de contact avec la plaie.
Avant l’application des pansements sur les plaies simulées, chaque pansement (primaire ou secondaire) a été pesé. Les pansements ont ensuite été appliqués conformément aux instructions du fabricant. Les plaies simulées étaient positionnées vers le haut, de sorte que les pansements testés devaient absorber et retenir le substitut d'exsudat par capillarité (c'est-à-dire contre la gravité). Le système robotisé a été activé avec un débit de 2 mL/h. Pour déterminer l'évolution dans le temps des performances d'absorption des pansements testés et, surtout, la dynamique de la répartition des fluides entre les pansements primaires et secondaires, les produits ont été testés pour plusieurs durées d'utilisation simulée: 5, 10 et 15 heures.
Études sur les pansements
Rétention et répartition des fluides entre les pansements primaires et secondaires. Après l'utilisation simulée dans le système fantôme robotisé, les pansements ont été pesés à nouveau pour calculer le gain de masse net de chaque pansement dû à l'absorption de liquide; tous les liquides résiduels non retenus ont été soigneusement collectés dans les cavités de la plaie et également pesés. Après avoir converti les masses de fluide mesurées en volumes (en divisant les masses de fluide absorbées et résiduelles par la densité du fluide), le volume total de l'exsudat a été calculé séparément pour chaque test comme la somme des volumes de fluide dans les pansements primaires et secondaires plus le volume du fluide résiduel. Ensuite, la répartition des volumes de fluide entre les pansements primaires et secondaires a été calculée pour chaque test comme le pourcentage de fluide retenu dans le pansement primaire versus le pansement secondaire, par rapport au volume total d'exsudat correspondant (dont la valeur théorique est également calculable, comme produit du débit prédéterminé et du temps de fonctionnement du système robotisé de traitement des plaies).10
Directionnalité des fibres. Pour les pansements à fibres gélifiantes, la directionnalité des fibres, qui est généralement liée à la technologie de fabrication de ces pansements primaires (c'est-à-dire PVA contre CMC), affecte probablement les performances du pansement, telles que la sorption (les fibres deviennent les conducteurs structurels de la capillarité) et la durabilité (les fibres fournissent un support structurel et une tolérance mécanique contre les forces qui sont alignées avec leur direction principale). En conséquence, les chercheurs ont évalué la directionnalité des fibres dans les deux types de pansements primaires par traitement numérique des images microscopiques des surfaces des pansements, qui ont été obtenues à l'aide d'un stéréo-microscope optique léger (Axiolab A450909, Carl Zeiss AG, Oberkochen, Allemagne). Les micrographies des surfaces des pansements ont été obtenues en mode lumière transmise à l'aide d'un objectif à grossissement 1,25× , d'un appareil photo numérique monté sur le site C (Swift Cam SC1803, Swift Optical Instruments Inc, Schertz, Texas) et du logiciel Swift Imaging (version 3.0, Swift Optical Instruments Inc.). Cinq champs de vision (CDV) ont été capturés à des emplacements de surface cohérents sur deux spécimens de pansement primaire de chaque type: Un CDV était situé au centre du pansement, et les quatre autres CDV formaient une croix autour du centre du pansement, chacun de ces CDV périphériques étant situé à une distance de 2,5 cm des bords du pansement. On a ainsi obtenu un total de 15 micrographies numériques des CDV par type de pansement, chacune ayant des dimensions de 4912 × 3684 pixels (1 pixel carré = 0,919 µm2). Pour les analyses de la directionnalité des fibres, les CDV obtenus ont été divisés en trois sous-CDV rectangulaires, chacun ayant des dimensions de 1445 × 3288 pixels. Les analyses de la directionnalité des fibres ont été réalisées à l'aide du plug-in post-acquisition "OrientationJ" de la suite logicielle ImageJ (version 1.X),27,28 qui segmente les fibres dans les micrographies numériques et calcule la fonction de probabilité de leur orientation planaire dans chaque sous-CDV analysé. Après le calibrage de ce code et la vérification visuelle de ses performances, les histogrammes normalisés des orientations des fibres dans les pansements primaires étudiés ont été extraits.
Résistance des pansements primaires après une utilisation simulée. Immédiatement après les sessions d'utilisation simulée, la résistance à la traction de chaque échantillon de pansement primaire a été testée à l'aide d'une machine électromécanique de test (Instron modèle 5944, Instron Co) équipée d'une cellule de charge de 2kN, selon un protocole basé sur la norme ASTM D882-02.29 Les échantillons de pansement primaire préparés conformément à la norme de test ci-dessus ont été étirés à une vitesse de déformation de 50 mm/min jusqu'à la rupture finale. Sur la base des données force-déformation obtenues, les courbes contrainte-déformation des pansements après utilisation simulée ont été tracées et l'aire sous la courbe contrainte-déformation, qui représente la densité d'énergie de déformation (DED) jusqu'à la rupture, a été calculée pour chaque test à l'aide d'un code informatique MATLAB dédié (ver. R2019a, MathWorks, Inc, Natick, Massachusetts). Sur la base de ces analyses microscopiques de l’orientation des fibres, le pansement ExAg-PVA a été traité comme une structure sans préférence directionnelle spécifique (c'est-à-dire que les échantillons de test de ce type de pansement ont été préparés et testés mécaniquement dans des directions aléatoires). Cependant, le pansement primaire Ag-CMC contenant de l'argent, dont les fibres ont une préférence directionnelle spécifique (comme indiqué plus en détail ci-dessous dans Résultats), a été testé dans deux configurations différentes: l’une dans laquelle la direction des fibres principales était entièrement alignée avec l'axe de chargement de la machine de test des matériaux, et l’autre dans laquelle les fibres n'étaient pas alignées.
Analyses statistiques
Toutes les expériences rapportées ci-dessus ont été menées en répliques de six et les statistiques descriptives des moyennes et des écarts types ont été calculées pour les volumes de liquide retenus, la répartition des contenus de liquide entre les pansements primaires et secondaires pour chaque durée d'utilisation simulée (5, 10 et 15 heures), et la DED-à rupture des pansements primaires (en fonction de la directionnalité des fibres par rapport à l'axe de chargement, comme indiqué précédemment). Ensuite, des analyses de variance (ANOVA), suivies de comparaisons multiples par paires post-hoc Tukey-Kramer, ont été effectuées pour identifier les différences potentielles entre les performances des pansements dans les tests de gestion des fluides (sorption) et les tests de résistance des matériaux décrits précédemment. Plus précisément, des ANOVA à deux voies pour les facteurs de durée d'utilisation et de type de pansement primaire ont été réalisées pour les données de rétention et de répartition des fluides. En outre, une ANOVA à trois voies pour les facteurs de temps d'utilisation, de type de pansement primaire et de directionnalité du test de traction par rapport à l'orientation des fibres (dans le pansement primaire qui présentait une préférence directionnelle de l'orientation des fibres) a été réalisée pour les données de résistance du matériau. Seuls les temps d'exposition plus longs de 10 et 15 heures, pour lesquels une masse de liquide substantielle s'était accumulée dans les pansements primaires testés, ont été pris en compte pour la dernière ANOVA à trois voies. En tenant compte du facteur de directionnalité, sur la base des analyses microscopiques, la dernière ANOVA a considéré le pansement ExAg-PVA, qui n'a montré aucune préférence directionnelle spécifique et cohérente de ses fibres, comme ayant une seule propriété de résistance (DED-à rupture). Cependant, l'Ag-CMC avait deux propriétés de résistance, à savoir la résistance mesurée (1) lorsque les fibres étaient complètement alignées avec l'axe de chargement de la machine de test des matériaux et (2) lorsqu'elles n'étaient pas alignées. P <,05 a été considéré comme statistiquement significatif.
Résultats
Lorsqu'il était examiné isolément, le pouvoir absorbant du pansement primaire ExAg-PVA était plus faible (de 11 à 22% environ) que celui du pansement primaire Ag-CMC (figure 2a). Toutefois, cette différence était due à un transfert plus efficace du fluide de type exsudat du pansement ExAg-PVA vers le pansement secondaire, comme le montre l'examen des données relatives à la répartition du fluide entre les pansements primaire et secondaire (figure 2b). Plus précisément, lorsqu'il fonctionnait en paire avec le pansement ExAg-PVA, le pansement secondaire contenait environ deux fois plus de liquide au bout de 10 heures et 1,5 fois plus de liquide au bout de 15 heures par rapport à la paire de comparateurs (figure 2b). La dynamique de la répartition du fluide entre les pansements primaire et secondaire au fil du temps (figure 2b) a révélé que le réservoir du pansement secondaire a commencé à recevoir du fluide au plus tôt 5 heures après l'application du pansement (figure 2b). Après 15 heures, le pansement secondaire partageait environ 54,2% du fluide retenu lorsque le pansement primaire était ExAg-PVA, mais seulement 36,7% lorsque le pansement primaire Ag-CMC était utilisé (P < ,05 ; Figure 2b). Il est important de noter que ces résultats représentent les performances des paires de pansements et reflètent donc mieux la pratique clinique réelle, par opposition aux évaluations de la fonction des pansements testés seuls (figure 2b).

Figure 2. Performances d'absorption et de rétention des fluides des pansements testés (a) Le fluide retenu dans les pansements primaires, reflétant la sorption de ces pansements (rapportée en pourcentage du volume total de fluide retenu dans les pansements primaires et secondaires plus le fluide résiduel dans le lit de la plaie simulée). (b) La répartition des fluides entre les pansements primaires et secondaires après 5, 10 et 15 heures d'utilisation simulée sur des plaies hors pression (comme en position couchée). Les barres d'erreur représentent les écarts-types des valeurs moyennes de six répétitions de test par configuration de test et un astérisque indique une différence statistiquement significative dans la mesure de résultat pertinente (P < ,01).
Les analyses des images de microscopie numérique des pansements primaires ont indiqué que le pansement ExAg-PVA ne présentait pas de préférence directionnelle des fibres distincte. Plus précisément, pour vérifier l'absence relative de préférence directionnelle du pansement ExAg-PVA par rapport à celle du pansement primaire Ag-CMC contenant de l'argent, les chercheurs ont calculé l'intégrale délimitée entre la courbe de l'histogramme d'orientation des fibres et le niveau 0,5 (point médian) pour les deux pansements primaires. Cette intégrale est définie ici comme l'indice d'orientation des fibres (IOF). Lorsqu'un pansement ne présente pas de préférence directionnelle des fibres, les zones positives et négatives entre la courbe de l'histogramme susmentionné et le niveau 0,5 s'annulent approximativement, ce qui se traduit par une valeur de l’IOF relativement faible. Les analyses des données de l’IOF ont indiqué que le pansement ExAg-PVA présentait un IOF statistiquement significatif, environ 3,9 fois inférieur (15,6 ± 11,8) à celui du pansement primaire Ag-CMC contenant de l'argent (60,8 ± 48,8; P < ,05 pour cinq IOF de microscope différents sur chaque type de pansement). Ce ratio de propriété de l’IOF démontre quantitativement la forte préférence de l'alignement des fibres dans le pansement primaire Ag-CMC vers la direction des coutures de renforcement visibles dans ce pansement (la direction de 90° marquée dans la figure 3a). Il convient de noter que l'histogramme d'orientation des fibres du dernier pansement (Ag-CMC) était toujours supérieur au niveau du point médian, ce qui indique à nouveau une forte préférence directionnelle (figure 3a). L'inspection visuelle des données microscopiques a confirmé que la majorité des fibres du pansement primaire Ag-CMC étaient alignées et regroupées pour se relier aux coutures visibles verticales (orientées à 90°). Les micrographies ont également mis en évidence de nombreux vides de forme elliptique avec des dimensions caractéristiques de longueur maximale d'environ 400 à 600 µm dans le pansement primaire Ag-CMC (Figure 3a). Ces constatations d'une orientation préférentielle des fibres et d'une présence abondante de vides non circulaires ont justifié la sélection du pansement primaire Ag-CMC contenant de l'argent comme ayant une préférence directionnelle spécifique (c'est-à-dire le long de ses coutures visibles) aux fins de tests mécaniques supplémentaires, comme suit.
Pour les tests mécaniques des pansements primaires après une utilisation simulée, les points de temps les plus éloignés de 10 et 15 heures d'exposition au fluide ont été sélectionnés car les résultats précédents indiquaient qu'à 10 heures et après, les deux types de pansements primaires avaient transféré du fluide vers leurs pansements secondaires appariés (figure 2b). Ainsi, aux points de temps de 10 et 15 heures, les deux types de pansements primaires ont utilisé leurs réservoirs de fluide d'une manière indiquant qu'ils ont effectivement été testés à leur état "humide". En outre, sur la base des résultats des analyses microscopiques, le pansement ExAg-PVA a été testé en tant que structure sans préférence directionnelle spécifique (c'est-à-dire indépendamment de la direction dans laquelle les échantillons de test ont été découpés dans ce type de pansement), tandis que le pansement Ag-CMC a été testé dans deux configurations différentes: totalement aligné avec l'orientation principale des fibres (direction à 90°), qui est la direction des coutures visibles, et hors de cet alignement (c'est-à-dire sélectionné au hasard mais différent de la direction à 90°).
Les données DED-à rupture pour les deux types de pansements primaires sont présentées dans la figure 3b et démontrent des différences considérables dans les comportements mécaniques des types de pansements post-utilisation, en particulier concernant la ductilité du pansement ExAg-PVA par rapport au produit Ag-CMC. La ductilité est le degré auquel un matériau ou une structure peut supporter des déformations plastiques ou irréversibles et continuer à absorber l'énergie de déformation sous une charge de traction avant qu'une rupture catastrophique ne se produise. Il est intéressant de noter que le pansement ExAg-PVA a semblé gagner en ductilité au fur et à mesure qu'il absorbait plus de fluide et se gélifiait et, par conséquent, à 15 heures, il présentait une DED-à rupture 1,7 fois plus élevé qu'à 10 heures. En revanche, la transformation gélifiante ne s'est pas traduite par une plus grande ductilité pour le pansement primaire Ag-CMC; ses données DED-à rupture étaient indiscernables pour les points de temps de 10 et 15 heures (Figure 3b). En outre, les tests de résistance susmentionnés ont clairement indiqué que la principale structure porteuse dans le pansement primaire Ag-CMC était, en effet, les coutures (visibles) de renforcement et les fibres orientées à (presque) 90°. Lorsqu'il a été testé hors alignement, la résistance du pansement primaire Ag-CMC a chuté de manière significative, de plus de 8 fois (P < ,05). En ce qui concerne la résistance mécanique du pansement ExAg-PVA, le pansement primaire Ag-CMC présentait une résistance hors alignement environ quatre et six fois inférieure pour les points de temps de 10 et 15 heures, respectivement (P < ,05).

Figure 3. Analyses structure-fonction des pansements primaires testés (a) Exemple d'image microscopique du pansement Exufiber Ag+ (ExAg-PVA). (b) Analyse d'images microscopiques représentatives de l'orientation des fibres dans le pansement Ag-carboxyméthylcellulose sodique (CMC), montrant la distribution planaire normalisée des orientations des fibres dans ce type de pansement primaire. (c) Densité d'énergie de déformation jusqu'à la rupture des deux types de pansements primaires testés après une utilisation simulée de 10 et 15 heures, pour laquelle le produit Ag-CMC a été testé dans deux configurations, soit en alignement complet de la direction principale des fibres du pansement avec l'axe de chargement de la machine de test, soit hors de cet alignement. Les barres d'erreur représentent les écarts-types des valeurs moyennes de six répétitions de test par configuration de test et un astérisque indique une différence statistiquement significative dans la mesure de résultat pertinente (P < ,01).
Discussion
Les exsudats des plaies sont essentiels à la réparation des tissus: ils facilitent la mobilité des cellules ainsi que le transport des molécules de signalisation et des facteurs de croissance dans le lit de la plaie. Cependant, une production excessive d'exsudat peut entraîner une macération, devenir un milieu propice aux infections ou prolonger la période d'inflammation.30,31 Ainsi, les quantités excessives d'exsudat doivent être absorbées et retenues dans les pansements thérapeutiques afin de d’aider au processus naturel de cicatrisation. La pratique clinique dans le traitement des plaies cavitaires ainsi que d'autres plaies fortement exsudatives (telles que les ulcères veineux de jambe et les brûlures) consiste à utiliser un produit de comblement non adhérent comme pansement primaire afin d'induire un environnement humide pour la cicatrisation de la plaie tout en optimisant le contact du pansement avec le lit de la plaie pour une absorption efficace. Un pansement secondaire est ensuite appliqué pour fermer la plaie et la protéger des traumatismes mécaniques potentiels et de l'invasion d’agents pathogènes, tout en permettant l'évaporation de l'exsudat et la libération des gaz produits. Le pansement secondaire peut également constituer un réservoir supplémentaire pour l'absorption et la rétention des fluides de la plaie, mais il dépend fortement de la sorption du pansement primaire pour une gestion efficace des exsudats. Par conséquent, pour des traitements efficaces, les pansements primaires et secondaires doivent travailler en synergie. Les deux pansements doivent partager la masse de fluide retenue de manière aussi égale que possible et ne pas approcher leur capacité d'absorption maximale de fluide avant que le changement de pansement ne soit indiqué.3,10,11 Il convient de noter que, pour des raisons de réalisme clinique, la sorption doit être évaluée en testant une paire de pansements à l'aide d'un fluide-test relativement visqueux et non aqueux, ce qui était l'approche adoptée dans la présente étude.10,11 Un nouvel exsudat ne peut pas pénétrer dans un pansement primaire s'il n'y a pas d'espace pour lui sur la face du pansement en contact avec la plaie; cependant, l'existence d'un tel espace disponible dépend du transport adéquat de l'exsudat existant du pansement primaire au pansement secondaire.10,11 L’action de capillarité qui permet ce mouvement de fluide est inversement proportionnelle à la racine carrée de la viscosité du fluide transféré (voir l'équation 2 de Lustig et al.10); c'est-à-dire que plus le fluide est visqueux, plus il est difficile pour lui d'être transporté contre la gravité vers le haut jusqu'au pansement secondaire dans toute plaie non soumise à pression.10 Il convient de noter que les plaies soimises à pression peuvent être rencontrées dans la pratique clinique réelle et comprennent, par exemple, les plaies soumises aux forces du poids du corps, telles que les ulcères plantaires du pied diabétique ou les lésions de pression sacrales chez les patients ventilés en décubitus dorsal, ou les plaies comprimées par un dispositif médical, telles que les bas de compression appliqués sur les ulcères veineux de jambe. L'étude et la configuration actuelles des plaies exsudatives robotisées ne s'appliquent qu'aux plaies non soumises à pression; la complexité biophysique supplémentaire qui résulte de l'action du poids du corps ou de forces externes (par exemple, liées à un dispositif médical) sur une plaie ou la zone environante n'a pas été prise en compte.
Les pansements à fibres gélifiantes à base de fibres PVA ou CMC sont utilisés comme pansements primaires sur divers types de plaies très exsudatives. Ces pansements sont censés former un gel mou et cohésif au contact de l'exsudat, ce qui induit l'humidité nécessaire dans la plaie. Cependant, ces pansements doivent présenter une action capillaire suffisante (sorption) pour transférer efficacement tout excès de fluides exsudatifs hors du lit de la plaie et empêcher leur accumulation aux interfaces plaie-pansement ou dans les espaces minés ou les tunnels .3,10,11 Dans ce travail, un système de fantôme robotisé composé de plusieurs répliques de plaies simulées a été développé et utilisé pour évaluer la synergie des performances d'absorption et de rétention des fluides (facilitées par la sorption) de deux pansements primaires en fibres gélifiantes contenant de l'argent, leaders sur le marché, lorsqu'ils sont utilisés avec un pansement secondaire en mousse, conformément à la pratique clinique. La capacité de ces pansements primaires à rester intacts lorsqu'ils sont soumis à des forces de traction après des sessions d'utilisation simulées (c'est-à-dire à présenter une durabilité cliniquement pertinente) a ensuite été testée . Ces forces de traction imitent l'effet mécanique des forces qu'un soignants appliquerait avec ses doigts gantés ou ses pinces pour retirer un pansement usagé et le remplacer par un nouveau.
L'ExAg-PVA était nettement plus efficace pour transférer les simulants d'exsudat sur le pansement secondaire en mousse que l'Ag-CMC. Le pansement ExAg-PVA contenait moins de fluide à chaque point de temps, et le pansement secondaire apparié a toléré ce fluide et l'a retenu en quantité croissante au fil du temps. Ces derniers résultats sont particulièrement innovants car ils révèlent, pour la première fois dans la littérature, que le processus de partage s'initie entre 5 et 10 heures après l'application des pansements et s'amplifie par la suite. Plus précisément, le pansement primaire ExAg-PVA fournit de plus grandes quantités de fluide pour l'absorption et la rétention par le pansement secondaire, environ 2 fois et 1,5 fois les quantités de fluide aux points de temps de 10 et 15 heures, respectivement, par rapport à la paire de pansements de comparaison. Plus la quantité de liquide transférée vers le pansement secondaire est importante, plus la capacité disponible du pansement primaire à gérer les nouveaux exsudats entrants est grande. Ainsi, les évaluations en laboratoire doivent mesurer la fonction des pansements dans un contexte clinique pertinent (c'est-à-dire mesurer la fonction de la paire de pansements primaire-secondaire par opposition au test des produits de pansement seuls. Il est important de noter que ces résultats expérimentaux démontrent que l'étendue et le taux de partage du fluide dépendent des matériaux et de la composition du pansement, ce qui indique qu'il existe des choix plus ou moins optimaux de combinaisons de pansements primaires et secondaires.
Néanmoins, la sorption et les performances d'absorption et de rétention associées ne sont qu'un aspect à prendre en compte lors de l'évaluation de la sûreté et de l'efficacité des pansements par le biais de tests en laboratoire de bio-ingénierie. La résistance mécanique d'un pansement primaire doit être suffisante pour supporter les forces qui s’exercent tout au long du cycle de vie du pansement, y compris les forces d'extraction qu'un soignant applique lorsque le pansement est retiré. Bien qu'il soit exposé à l'environnement chimique et thermodynamique agressif de la plaie, un pansement ne doit pas se désintégrer ou laisser des débris ou des particules dans la plaie. Tout débris (même les microparticules) provenant du pansement primaire et se répandant sur la surface de la plaie peut déclencher une réaction à corps étranger par laquelle le système immunitaire tente de former un granulome (agrégation de macrophages et de fibroblastes autour de chaque particule pour l'isoler des tissus de l'organisme). De tels événements consomment des efforts précieux en matière d'inflammation et de réparation des tissus, ce qui nuit aux ressources locales de guérison biologique (par exemple, le nombre potentiel de cellules immunitaires et fibroblastiques disponibles pour la tâche de réparation des tissus).3,10,15,32
Les analyses d'images microscopiques n'ont pas montré une préférence directionnelle forte et cohérente des fibres dans le pansement ExAg-PVA, indiquant une faible préférence de force directionnelle par rapport à l'Ag-CMC, qui a démontré une forte préférence directionnelle associée à sa structure de tissage, spécifiquement vers les coutures de renforcement visibles du pansement. Les résultats des tests de durabilité étaient cohérents avec les résultats microscopiques susmentionnés pour l'Ag-CMC. Plus précisément, l'Ag-CMC a fait preuve d'une faible résistance mécanique lorsque la direction des forces de traction n'était pas totalement alignée avec celle des coutures de renforcement. De plus, les tests mécaniques actuels indiquent que la résistance du pansement Ag-CMC est principalement assurée par les coutures de renforcement visibles et les fibres étroitement alignées; cela impose une exigence réelle (non présentée par le fabricant) selon laquelle un soignant qui retire le pansement doit être conscient de l'orientation des coutures et tenter de tirer dans cette direction spécifique afin d'éviter une déchirure accidentelle (partielle ou complète). Pourtant, lors du retrait d'un pansement primaire de la cavité de la plaie, la probabilité qu'une infirmière ou un infirmier tire (aveuglément) le pansement selon une orientation spécifique correspondant exactement à l'orientation des fibres principales du pansement est proche de zéro. De plus, retirer un pansement en respectant l'orientation de ses fibres principales est encore plus difficile si le pansement prend la couleur de l'exsudat lorsqu'il est dans la plaie. Étant donné que les pansements sont généralement pliés dans la cavité de la plaie et que la majeure partie de leur structure est invisible, même si une infirmière ou un infirmier tente hypothétiquement de tirer le pansement dans une direction spécifique (pour se conformer aux propriétés optimales d'absorption d'énergie mécanique jusqu'à la rupture du pansement), il n'en reste pas moins que, du point de vue économique, un pansement nécessitant des retraits selon une orientation spécifique et une attention supplémentaire à cet aspect ajoute à la charge de travail clinique. Ce qui précède implique que dans des scénarios réels et cliniquement pertinents, l'Ag-CMC aurait une résistance (c'est-à-dire l'absorption d'énergie mécanique jusqu'à la rupture) quatre à six fois inférieure à celle du pansement ExAg-PVA, et que le pansement Ag-CMC est donc beaucoup plus susceptible de laisser des débris ou des particules dans une plaie. La probabilité d'une telle défaillance du pansement augmente encore lorsqu'une plaie est minée, qu'elle présente des tunnels ou des surfaces collantes ou rugueuses, tous ces éléments pouvant être associés à des forces d'arrachement plus importantes nécessaires pour libérer le pansement usagé à changer.
Comme pour toute étude expérimentale, il existe des limites dans la capacité à imiter les processus in vivo et la grande variété de scénarios cliniques. Par conséquent, dans le cadre de travaux futurs, des expériences supplémentaires portant sur des plaies typiques hors pression, comme les ulcères veineux de jambe, sont justifiées. Il est également nécessaire de tester d'autres types et technologies de pansements provenant de différents fabricants et d'inclure l'aspect économique par rapport aux paramètres de performance mesurés. D'autres capteurs et critères d’analyse peuvent potentiellement être ajoutés à l'appareil (et à chaque unité de simulant de plaie) ou être intégrés dans la méthodologie de test, comme la surveillance continue du pH à l'intérieur de la plaie ou la spectrométrie de masse des fluides résiduels après les périodes d'utilisation du pansement. D'autres progrès peuvent être réalisés en introduisant des substituts d'exsudat qui contiennent des microbiomes spécifiques pouvant représenter différentes étiologies de plaies, comme les lésions de pression infectées ou les ulcères du pied diabétique. Toutes ces améliorations futures nécessiteraient des études supplémentaires de validation et de fiabilité avant de renseigner la pratique clinique.
Conclusions
À l'aide d'un système fantôme robotisé automatisé de multiples plaies à cavité ouverte, les auteurs ont évalué les performances d'absorption et de rétention, et donc de sorption, de pansements à fibres gélifiantes contenant de l'argent, associés à un pansement secondaire en mousse. La durabilité mécanique des pansements primaires contenant de l'argent a été testée après une utilisation simulée. Le système et le protocole expérimentaux actuels ont été conçus en mettant l'accent sur la pertinence clinique des tests de laboratoire en bio-ingénierie, afin de reproduire la façon dont les pansements sont utilisés dans la pratique et d'envisager les scénarios du monde réel qui peuvent être associés à leur rupture. Conformément aux travaux publiés précédemment par les auteurs, la sorption et la durabilité ont de nouveau été identifiées comme des facteurs critiques à prendre en compte lors de l'évaluation des pansements en laboratoire.3,10,11 Les résultats actuels soulignent en outre que les pansements appartenant à une certaine catégorie de produits, tels que les pansements à fibres gélifiantes contenant de l'argent, ne sont pas tous identiques, et que l'absorption spécifique, la rétention et, surtout, la capacité à travailler en synergie avec un pansement secondaire (ce que permet une bonne sorption) diffèrent d'un produit à l'autre, en fonction des matériaux et de la composition spécifiques du pansement.3,10,32,33 Les données expérimentales actuelles ont révélé que le pansement ExAg-PVA a de meilleures sorption et durabilité que le produit Ag-CMC de comparaison. De plus, les auteurs ont décrit la dynamique du partage des fluides entre les pansements primaires et secondaires et ont identifié l'importance de l’absence de directionalité spécifique des fibres dans un pansement primaire pour la durabilité et la sûreté du retrait après utilisation. La quantification comparative de ces capacités devrait aider les décideurs cliniques et non cliniques à évaluer et à sélectionner les pansements qui répondent le mieux aux besoins de leurs patients. Comme pour tout travail préclinique, les résultats actuels obtenus en laboratoire doivent être validés par des essais contrôlés randomisés portant sur des échantillons de taille appropriée et portant sur différentes étiologies de plaies. Le rôle du travail de laboratoire rapporté ici est principalement d'orienter cette recherche clinique potentielle pour qu'elle se concentre sur les nouveaux aspects du partage des fluides entre les pansements primaires et secondaires, et sur la capacité des pansements primaires à rester intacts pendant le retrait, des sujets qui ont été peu abordés dans la littérature jusqu'à présent.
Remerciements
Ce projet a reçu un financement du programme de recherche et d'innovation Horizon 2020 de l'Union européenne dans le cadre de la subvention Marie Skłodowska-Curie et a également été partiellement soutenu par le ministère israélien des sciences et de la technologie (bourse du programme des dispositifs médicaux n° 3-17421, accordée au Prof. Amit Gefen en 2020) et par Mölnlycke Health Care (Göteborg, Suède). Les auteurs remercient Mme Orel Belo, l'ingénieure de laboratoire du laboratoire Gefen, pour son soutien au travail expérimental. Les auteurs n'ont déclaré aucun autre lien financier lié à cet article. Soumis le 23 juillet 2021, accepté sous forme révisée le 1er novembre 2021, publié en ligne avant impression le 14 mars 2022. ©Advances in Skin & Wound Care et le World Council of Enterostomal Therapists.
Conflit d'intérêt
Les auteurs ne déclarent aucun conflit d'intérêt.
Financement
Les auteurs n'ont reçu aucun financement pour cette étude.
Author(s)
Aleksei Orlov MSc
Graduate Student, Department of Biomedical Engineering, Tel Aviv University, Israel
Adi Lustig MSc
Graduate Student, Department of Biomedical Engineering, Tel Aviv University, Israel
Angela Grigatti MSc
Graduate Student, Department of Biomedical Engineering, Tel Aviv University, Israel
Amit Gefen* PhD
Professor of Biomedical Engineering and the Herbert J Berman Chair in Vascular Bioengineering,
Department of Biomedical Engineering, Tel Aviv University, Israel
At Tel Aviv University, Department of Biomedical Engineering, Tel Aviv, Israel, Aleksei Orlov, MSc; Adi Lustig, MSc; and Angela Grigatti, MSc, are Graduate Students at the research group of Professor Gefen; and Amit Gefen, PhD, is Professor of Biomedical Engineering and the Herbert J. Berman Chair in Vascular Bioengineering.
* Corresponding author
References
- Sen CK. Human wounds and its burden: an updated compendium of estimates. Adv Wound Care 2019;8:39-48.
- Guest JF, Fuller GW, Vowden P. Cohort study evaluating the burden of wounds to the UK’s National Health Service in 2017/2018: update from 2012/2013. BMJ Open 2020;10:e045253.
- Gefen A, Ousey K. Safe and effective wound care during the COVID-19 pandemic. J Wound Care 2020;29:622-3.
- Sen CK. Human wound and its burden: updated 2020 compendium of estimates. Adv Wound Care (New Rochelle) 2021;10:281-92.
- How To Guide: Managing High Exudate Wounds - A Wounds UK Publication. https://www.wounds-uk.com/resources/details/how-to-guide-managing-high-exudate-wounds. Last accessed February 18, 2022.
- Cutting KF. Wound exudate: composition and functions. Br J Community Nurs 2003;8(Supp3):S4-9.
- Schultz GS, Sibbald RG, Falanga V, et al. Wound bed preparation: a systematic approach to wound management. Wound Repair Regen 2003;11(Supp1):S1-28.
- Junker JPE, Kamel RA, Caterson EJ, Eriksson E. Clinical impact upon wound healing and inflammation in moist, wet, and dry environments. Adv Wound Care 2013;2:348-56.
- Woundsource Resource Database. https://www.woundsource.com/product-category/dressings/gelling-fiber-dressings. Last accessed March 11, 2022.
- Lustig A, Alves P, Call E, Santamaria N, Gefen A. The sorptivity and durability of gelling fibre dressings tested in a simulated sacral pressure ulcer system. Int Wound J 2021;18:194-208.
- Gefen A, Santamaria N. Saturation of a dressing applied to an exuding wound: The gap between clinical judgment and laboratory testing. Wounds Int J 2021;12:20-6.
- Lustig A, Gefen A. Fluid management and strength post-simulated use of primary and secondary dressings for treating diabetic foot ulcers: robotic phantom studies. Int Wound J 2022;19:305-15.
- Lustig A, Gefen A. Three-dimensional shape-conformation performances of wound dressings tested in a robotic sacral pressure ulcer phantom. Int Wound J 2021;18:670-80.
- Wood RA. Disintegration of cellulose dressings in open granulating wounds. Br Med J 1976;1:1444-5.
- Chakravarthy D, Rodway N, Schmidt S, Smith D, Evancho M, Sims R. Evaluation of three new hydrocolloid dressings: retention of dressing integrity and biodegradability of absorbent components attenuate inflammation. J Biomed Mater Res 1994;28:1165-73.
- ASTM D412 - 06, Standard Test Methods for Vulcanized Rubber and Thermoplastic Elastomers - Tension, ASTM International, West Conshohocken, PA, 2006, www.astm.org.
- Xu F, Lu TJ. Chapter 3 Skin Biothermomechanics: modeling and experimental characterization. Adv Appl Mech 2009;43:147-248.
- Kuthe CD, Uddanwadiker RV. Investigation of effect of fiber orientation on mechanical behavior of skeletal muscle. J Appl Biomater Funct Mater 2016;14:e154-62.
- Graham HK, McConnell JC, Limbert G, Sherratt MJ. How stiff is skin? Exp Dermatol 2019;28:4-9.
- Friedman R, Haimy A, Epstein Y, Gefen A. Evaluation of helmet and goggle designs by modeling non-penetrating projectile impacts. Comput Methods Biomech Biomed Engin 2019;22:229-42.
- Gefen A, Haberman E. Viscoelastic properties of ovine adipose tissue covering the gluteus muscles. J Biomech Eng 2007;129:924-30.
- Gefen A. Not all superabsorbent wound dressings are born equal: theory and experiments. J Wound Care 2021;30:738-50.
- Dini V, Salvo P, Janowska A, Di Francesco F, Barbini A, Romanelli M. Correlation between wound temperature obtained with an infrared camera and clinical wound bed score in venous leg ulcers. Wounds 2015;27:274-8.
- Barnea Y, Weiss J, Gur E. A review of the applications of the hydrofiber dressing with silver (Aquacel Ag) in wound care. Ther Clin Risk Manag 2010;6:21-7.
- Walker M, Parsons D. Hydrofiber® Technology: its role in exudate management. Wounds UK 2010;6:31-38.
- Hurlow J. AQUACEL® Ag dressing with Hydrofiber® technology. Adv Wound Care (New Rochelle) 2012;1:104-7.
- Rezakhaniha R, Agianniotis A, Schrauwen JT, et al. Experimental investigation of collagen waviness and orientation in the arterial adventitia using confocal laser scanning microscopy. Biomech Model Mechanobiol 2012;11:461-73.
- Schneider CA, Rasband WS, Eliceiri KW. NIH image to ImageJ: 25 years of image analysis. Nat Methods 2012;9:671-5.
- ASTM D882-02, Standard Test Method for Tensile Properties of Thin Plastic Sheeting, ASTM International, West Conshohocken, PA, 2002, www.astm.org.
- Expert working group; Satellite expert working group. Wound exudate and the role of dressings. A consensus document. Int Wound J 2008;5(Suppl 1):iii-12.
- Harding K, Carville K, Chadwick P, et al. World Union of Wound Healing Societies. World Union of Wound Healing Societies (WUWHS) Consensus Document. Wound exudate: effective assessment and management. Wounds Int 2019. https://www.woundsinternational.com/download/resource/7732.
- Grande A, Sivakumaran D. Assessment of the wet strength and log reduction capacity of a silver alginate dressing. 2016 Symp Adv Wound Care (SAWC) April 13-17. 2016:5.
- Gefen A, Santamaria N, Creehan S, Black J. Patient safety may be compromised if study conclusions are generalized to products that make similar claims but have no equivalent research evidence. J Patient Saf Risk Manag 2019;24:37-45.
