Volume 42 Number 4
Risk assessment for pressure injuries
Elizabeth A Ayello and Barbara A Delmore
Keywords pressure injury, risk factors, risk assessment scales
For referencing Ayello EA & Delmore BA. Risk assessment for pressure injuries. WCET® Journal 2022;42(4):31-37
DOI
https://doi.org/10.33235/wcet.42.4.31-37
Submitted 18 November 2022
Accepted 9 December 2022
Abstract
This manuscript highlights commonly used pressure injury (PI) risk assessment instruments (scales) and other considerations that the clinician should contemplate for use in everyday practice to determine if their patient is at risk for a PI.
Introduction
Each year in November, many professional organisations participate in the Stop Pressure Injuries/Ulcers Day. It provides an opportunity to raise awareness about pressure injuries (PIs) to the general public as well as other healthcare professionals. Preventing PIs is an important part of a clinician’s everyday practice. The intent of this article is to provide a succinct summary of some of the commonly used PI risk assessment instruments (scales) as well as other patient characteristics to consider as part of a comprehensive risk assessment process.
Risk Assessment Overview
The purpose of risk assessment is to identify if a person is at risk for a PI and, if so, implement an individualised prevention plan especially considering modifiable and non-modifiable risk factors1. The 2019 International Guideline with implementation recommendations1 provides assistance for clinicians for best practices for individuals at risk for a PI regardless of the care setting. Risk assessment is one of the key components to consider when preventing PIs. It is a systematic process that at minimum includes examination of the person’s skin for any changes, awareness of any devices, including medical and other objects that can cause pressure, assessment of individual patient characteristics that are known to be risk factors, and assessment using a validated/reliable risk assessment instrument (scale) and the clinician’s clinical judgement.
Risk Assessment Instruments
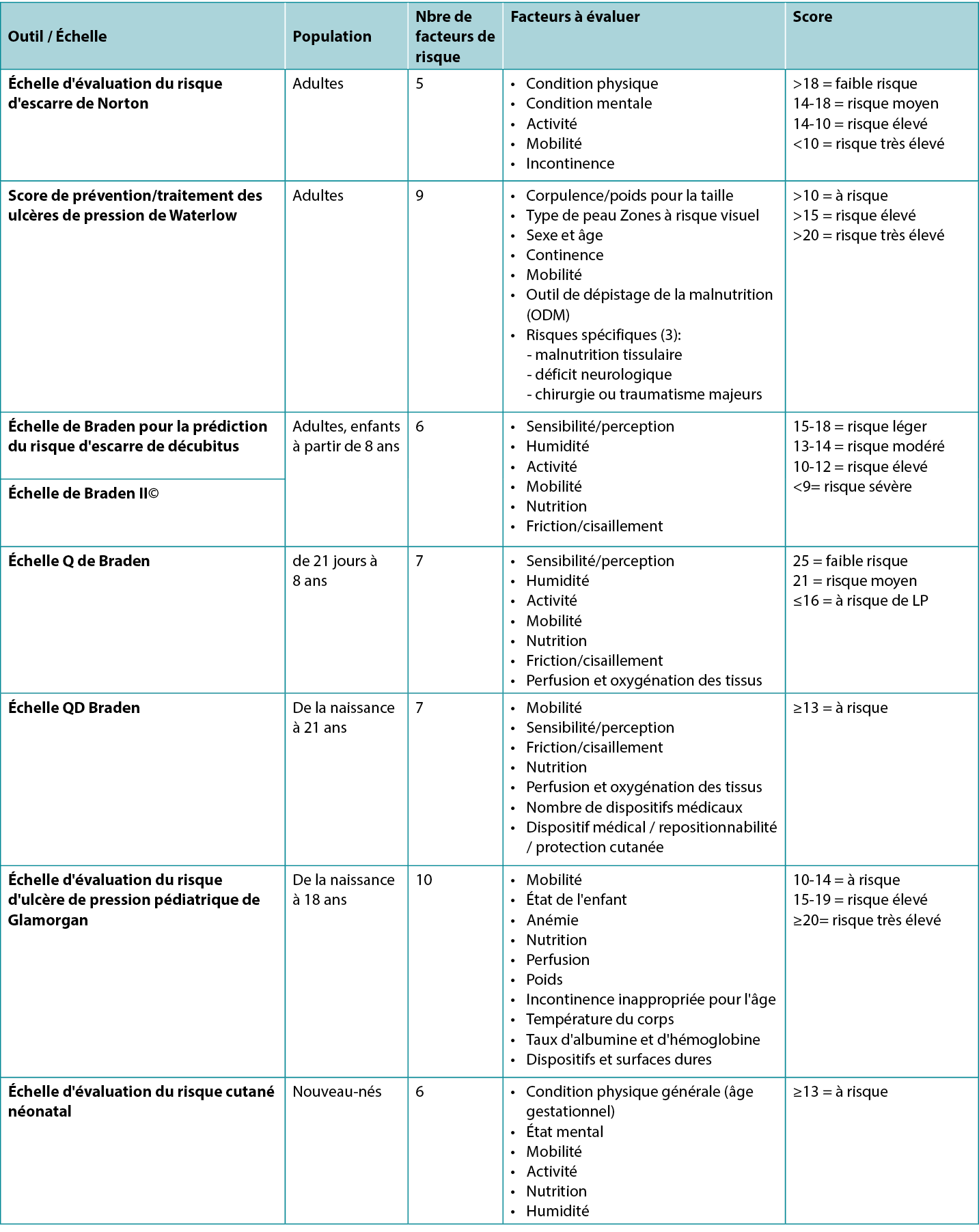
There are several valid and reliable risk assessment instruments (scales) available (Table 1), so it is important to use the one that reflects the age of your population and your practice setting. Some of the risk assessment instruments have a manual of instructions or glossary of terms for their use. The clinician should understand the definition of the terms used in the instrument so that they know how to accurately assess their patient for each of the risk factors outlined in the chosen instrument.
Most practice settings have a specific policy or guidance as to when risk assessments should be performed. The first general practice for performing a risk assessment is upon the person’s admission to a facility, e.g., hospital, long-term care/nursing home, rehabilitation, outpatient setting (e.g., clinics) or homecare assignment. Subsequent risk assessments are based on the clinical setting. For example, in acute care facilities, clinicians perform a risk assessment daily upon transfer to another nursing unit, when the patient’s condition changes, and upon discharge from the facility. In nursing homes or long-term care facilities, clinicians tend to perform risk assessments weekly and upon discharge. In homecare organisations, clinicians tend to perform a risk assessment on every visit, much like outpatient settings. It goes without saying that the clinician should follow the policy of their work setting and accurately evaluate the person according to each risk factor on the instrument. It is important to note that a clinician should also employ their judgment to a person’s PI risk outside of using a risk assessment instrument.
The following section provides a short description of the more commonly used risk assessment instruments.
Adult risk assessment instruments
Norton Pressure Sore Risk-Assessment Scale
Widely acknowledged as the first known scale is the Norton Pressure Sore Risk-Assessment Scale2. It was created in England in 1962 by Doreen Norton. It has five categories (Table 1) to which a number score is assigned based on the descriptor terms. When the numbers are totalled, low risk is determined to be >18, medium risk from 14–18, and lower numbers indicate higher risk, with <10 considered very high risk3.
Waterlow Pressure Ulcer Prevention/Treatment Score
The Waterlow Score was created by Judy Waterlow of the UK in 1985 and was revised in 2005 by Queensland Health4. As seen in Table 1, it has six categories. Additionally, the Malnutrition Screening Tool (MST) is used to assess the person’s nutritional status on this scale. There is also a section entitled ‘Special risks’. The scores are added, with a person being considered at risk when the score is >10, high risk at >15 and very high risk at >20. The back of the scale card has a short summary of prevention strategies as well as the European Pressure Ulcer Advisory Panel (EPUAP) classification definitions; further details can be found at the judy-waterlow.co.uk website5.
Braden Scale for Predicting Pressure Sore Risk
Known by many as the Braden Scale, it was created in the USA by Drs Barbara Braden and Nancy Bergstrom based on a conceptual schema which they published in 19876–8. The Scale has six assessment risk factors – sensory/perception, moisture, activity, mobility, nutrition and friction/shear (Table 1). Several early publications on the validation of the scale were subsequently published8–11. Over the years it has been used around the world and has had much research to validate its use in a variety of skin tones12. Its intended use is for ages 8–100+ years old. A score of 15–18 is considered to be mild risk, 13–14 moderate risk, 10–12 high risk and <9 severe risk.
Braden Scale II©
The Braden Scale for Predicting Pressure Sore Risk was originally published in the late 1980s6–8. Since April 2021, the Braden Scale copyright is now owned by Health Sense Ai and termed the Braden II©13. It has been updated in collaboration with original scale developers, Drs Barbara Braden and Nancy Bergstrom, to the Braden Scale II©. You can apply for copyright permission to use the Braden Scale II© by going to their website (www.bradenscale.com13), completing the licence use forms and paying the fee.
The Braden Scale II© has the same six risk assessment factors as the original Braden Scale – sensory/perception, moisture, activity, mobility, nutrition and friction/shear. Updates to the Braden Scale II© include language to bring the Scale into compliance with currently used taxonomy, like changing pressure sore to pressure injury. In addition, there are updates to the subsection descriptions to facilitate accurate scoring of the instrument among users. There are no changes to the cut scores at which a patient is considered to be at risk, but plan to address in the patient’s plan of care any subscales with higher scores even if the total overall scale score does not indicate the patient is at risk. The Braden Scale II© is available in English, French and Spanish.
To help clinicians score the scale, a glossary of terms has been created and available to use when you obtain copyright use permission. Health Sense AI/HD Nursing also has available several resource materials to help educate clinicians about the Braden Scale II©, including case examples that illustrate how to correctly use the scale13. The Braden Scale II© glossary and training module now make up the Braden Scale II Toolkit© which comes as a package when you licence the Braden Scale II©. This helps ensure staff are trained correctly to use the scale in direct patient care.
Paediatric risk assessment instruments
Braden Q Scale
The Braden Q risk assessment instrument was adapted from the Braden Scale by Curley and colleagues14 and since then has been frequently tested for its reliability and validity15. Its intended use in practice is for paediatric patients aged from 21 days (including corrected to gestational age of 21 days) up to age 8. The instrument includes the same six subscales of the Braden Scale with the addition of a seventh item – tissue perfusion and oxygenation. A score of 25 is considered low risk, 21 is medium risk and 16 or below is considered at risk for a PI (Table 1).
Table 1. Commonly used PI risk assessment instruments (scales) [©Delmore & Ayello 2022]
Braden QD Scale
The Braden QD is one of the newer risk assessment instruments created by Curley and colleagues16 and is based on the Braden Q Scale. Its intended use is for paediatric patients from pre-term ages to 21 years old. It contains five items from the Braden Q (mobility, sensory perception, friction/shear, nutrition, tissue perfusion and oxygenation) plus the addition of number of medical devices and repositionability/skin protection, the latter item specifically addressing medical devices (Table 1). A score of >13 is considered at risk for a PI17.
Glamorgan Paediatric Pressure Ulcer Risk Assessment Scale
This scale was created in the late 2000s as the Glamorgan Paediatric Pressure Ulcer Risk Assessment Scale (Glamorgan Scale) and noted to be the first paediatric risk assessment scale to include devices as one of the risk assessment factors18. Other Scale points address mobility, the child’s condition, anaemia, nutrition, perfusion, weight, incontinence inappropriate for the age, body temperature, albumin and haemoglobin levels, and devices. Any score of 10–14 is considered to be at risk, 15–19 is at high risk, and a score of ≥20 is considered very high risk for a PI.
Neonatal Skin Risk Assessment Scale
This scale was created by Huffines and Logsdon in the late 1990s and was based on the Braden Scale19. It was the first scale tested for reliability and validity for the neonatal population. The neonate is scored based on general physical condition (gestational age), mental state, mobility, activity, nutrition and moisture. A score of ≥13 is considered to be at risk.
Populations at Risk
Older adults
Advanced age (>65 years) is a PI intrinsic risk factor. Much of the risk is from skin changes that occur due to the ageing process such as epidermal thinning and loss of adipose tissue as a protective function. Additionally, disease burden and presence of co-morbidities create PI risk in this population20,21. Assessing risk using a valid and reliable scale is only one component of assessing an older adult’s PI risk. In this case, risk factors should be considered that are not included (e.g., age, disease burden) or reflect the degree of a condition’s severity (e.g., malnutrition)20–22.
Patients with obesity
According to the 2019 International Guideline, patients with obesity are considered a population that requires diligent PI risk assessments23. Obesity is an under recognised complex condition22. The Centers for Disease Control and Prevention (CDC) defines obesity by body mass index (BMI) categories: Class 1, BMI of 30–35kg/m2; Class 2, BMI of 35–40kg/m2; and Class 3, BMI of 40kg/m2 or higher and considered severe24. In this population, PIs occur due to a variety of factors such as malnutrition, diseases and conditions associated with obesity and device-related PIs due to ill-fitting equipment22,23.
Surgical patients
Assessment of the research literature in the 2019 International Guideline supports that the duration of time from when a person is admitted to when they have surgery as well as the length of time they are in surgery may be markers of a patient’s immobility1. Additionally, a person’s American Society of Anesthesiologists (ASA) Physical Status Classification may be a marker of the patient’s clinical status22. All three of these should be considered as risk factors for a person undergoing surgery.
Critical care
Critically ill patients are another special population that should be considered high risk for PI formation and therefore require diligent PI risk assessments23. The reason for this high risk is due to the critical illness of this population, the setting itself, and the abundant presence of medical devices required for treatment25,26. It is paramount to monitor this population closely as the addition of a PI to an already complex situation is considered an additional co-morbidity that can possibly lead to mortality23.
Other Considerations for Risk
Devices and objects
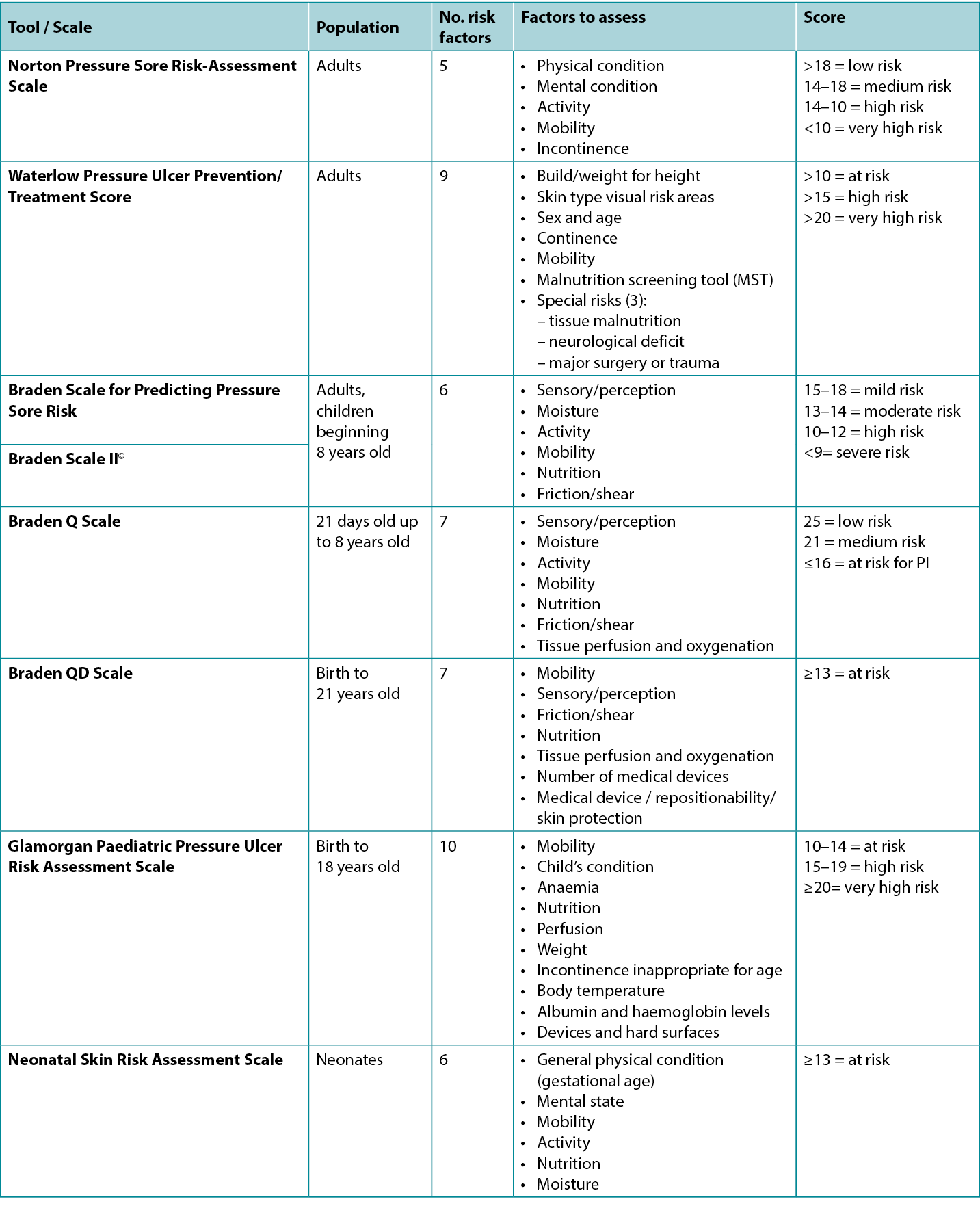
Medical devices and other objects such as eyeglasses and bottle caps can cause PIs27–29. Medical devices are the most frequent aetiology for medical device-related pressure injuries (MDRPI) in neonates and children1,16–18,30 (Figure 1); therefore, consideration for using the Braden QD Scale16 and the Glamorgan Scale18, which both include assessments for medical devices, is warranted.
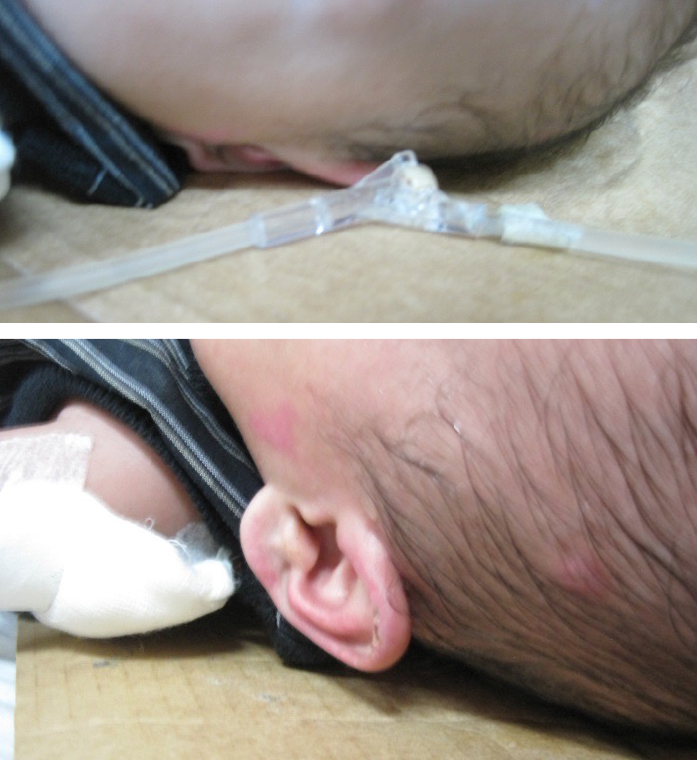
Figure 1. PI that developed from baby lying on IV tubing [©EA Ayello 2015, used with permission]
MDRPI also occur in adults27 (Figure 2). Currently, none of the adult PI risk assessment scales assess for MDRPI even though the 2019 International Guideline does address PI from devices – medical and other sources27. Therefore, raising awareness of devices as an aetiology for device-related PIs in adults is of great importance1,27–29. Consider using the SORE mnemonic to alert staff to medical and other devices that can cause PIs28. Research has supported that MDRPI occur 3 days sooner than other PIs, so staff need to be vigilant in assessing patients who have medical devices29. Remember to keep track of your facility’s MDRPI incidence28. Also, MDRPI on the lip cannot be staged as mucosa, does not keratinise and therefore cannot be staged using the NPIAP staging classification system1,27,28.
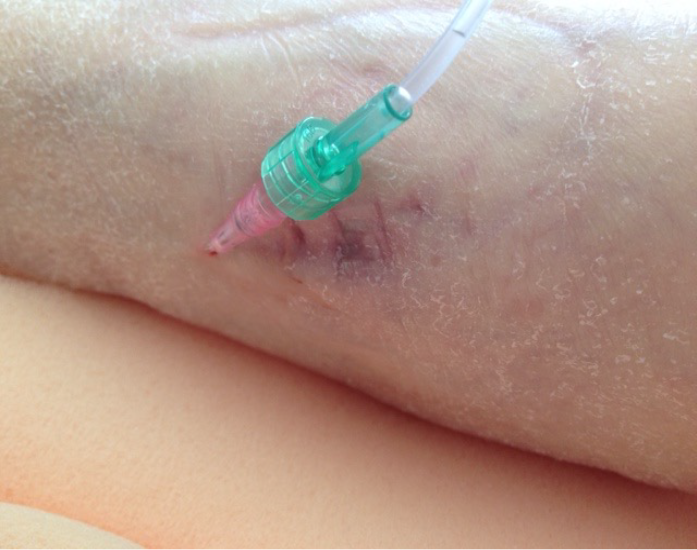
Figure 2. PI as a result of an intravenous (IV) hub that was secured directly to the skin. Notice the imprint on the skin that matches the design of the IV hub [©Delmore 2015, used with permission]
Specific anatomical areas at risk
Heels
Heels are believed to be the second most common anatomical site for PIs31. Due to the anatomy of the heel and limited tissue by the calcaneus, the heel is a particularly vulnerable to risk of a PI31–36 (Figure 3). Two research studies32,33 have provided evidence that patient co-morbidities, specifically diabetes mellitus and vascular disease along with immobility, are risk factors for developing heel PIs and should be considered with assessing a person’s risk for heel PIs along with a validated risk assessment instrument32–34.
Figure 3. Deep tissue pressure injury (DTPI) of the right heel. Unlike Stage 1 PIs that are intact and a lighter red/pink, DTPIs are intact but have a deeper discolouration indicating a deeper level of damage. These full-thickness PIs often evolve to a Stage 3 or 4, or an unstageable PI [©B Delmore & EA Ayello, 2020, used with permission]
In the main analysis (n=337) in one hospital, the predictor variables for heel PIs were diabetes, vascular disease, immobility and Braden Scale <1832. The study was expanded to other hospitals by using data from the New York State Statewide planning and Research Cooperative system (SPARCS)33. The main analysis had 1,697 patients (323 patients who had heel PIs and 1,374 who did not). There were seven significant and independent predictors – diabetes, vascular disease, perfusion issues, impaired nutrition, age >65 years, mechanical ventilation and surgery. Based in part from these two studies, the authors concluded that patient comorbidities, in this instance both diabetes and vascular disease, should be considered as risk factors along with results of formal risk assessment instruments33. Clinicians may find our heels algorithm helpful in their practice34 (Figure 4).
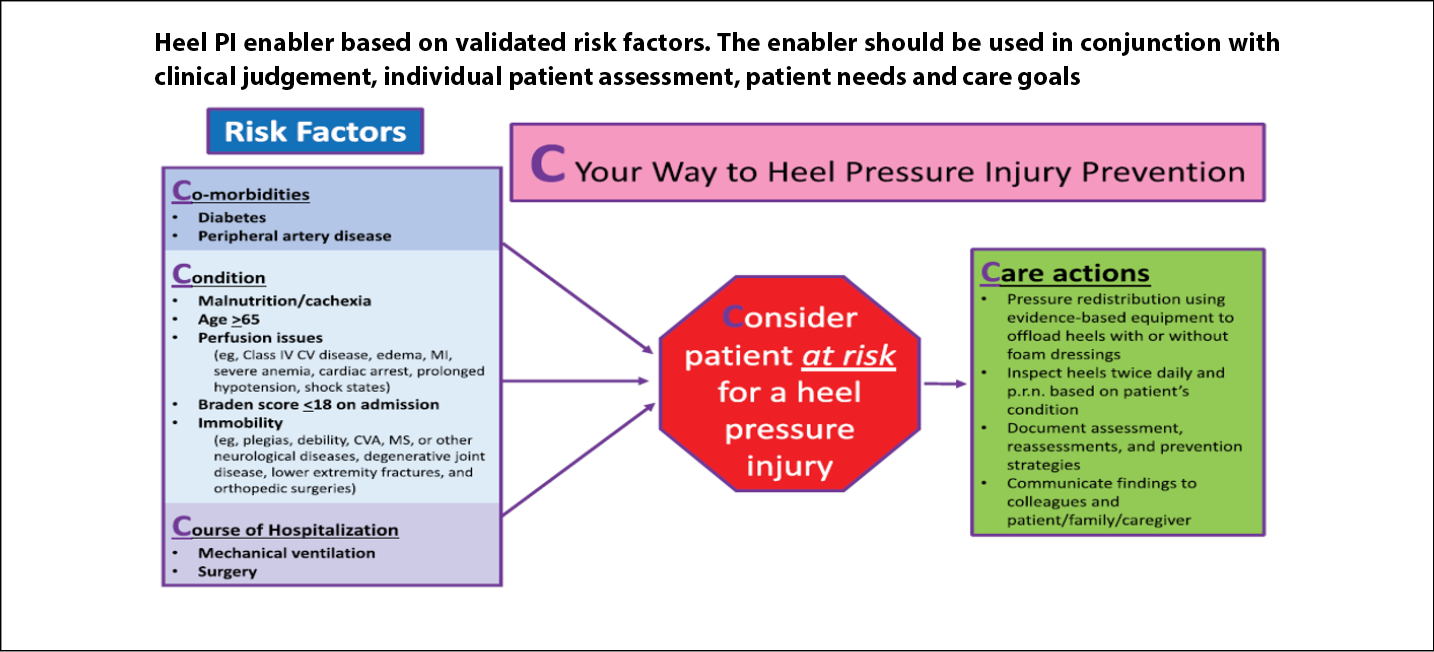
Figure 4. Heel pressure injury algorithm [©Delmore, Ayello & Smart 2020, used with permission]32–34
CV – cardiovascular; CVA – cerebrovascular accident; MI – myocardial infarction; MS – multiple sclerosis
Foot position may also be a risk factor. In another study of 10 healthy male volunteers, there was more strain on the heel tissue when the foot was in external rotation rather than upright (90°)36. Our recent clinical practice point may be helpful to clinicians as to proper foot positioning to help prevent heel PIs34.
Sacrum/coccygeal/ischial tuberosities
The sacrum is the most common anatomical site for PIs. Some research suggests that a patient’s skeletal morphology may be an intrinsic non-modifiable risk for Pl. The work of Gefen37 provides knowledge about changes in persons with spinal cord injury that increase risk for PI. This includes skeletal muscle atrophy, fat infiltration into muscles, bone shape loss leading to flattening of the tips of the ischial tuberosities and thinning of the skin around the ischial tuberositites37.
A recent retrospective case-control study by Delmore and colleagues compared the skeletal sacrococcygeal region of 15 patients with full-thickness PIs to 15 patients without full-thickness PIs using MRIs38. The premise of this study was to determine if the skeletal sacrococcygeal region may act as a possible intrinsic PI risk factor. Findings revealed that patients with full-thickness PIs did have different morphology and morphometry, resembling patients with other conditions. This study also noted that PIs in this region were more located in the coccyx region.
Risk Assessment Instruments and Technology
There is some growing debate in the literature about use of risk assessment scales as they may not capture all important risk factors, so do think about patient comorbidities that may not be captured on a risk assessment scale. There is research to study identification of additional risk factors and/or early indicators for PI including skin temperature39,40 as well as subdermal moisture and imaging41–43. It will be interesting to see how various technologies will reduce cost43. The future of PI risk assessment may include a systematic risk assessment including a valid and reliability scale, patient characteristics such as comorbidities, and technology that will impact on reducing PI incidence.
Conclusion and summary
There are several valid and reliable PI risk assessment scales available for use in practice. Although research continues to provide evidence as to which are the best in terms of predictive ability, identification of patient co-morbidities as well as technology may be additional data to help clinicians identify persons at risk for PIs. It is most important to remember that PI assessment is a process with the care goal of implementing a care plan in a timely manner to prevent avoidable PI44 from occurring.
Conflict of Interest
Dr Ayello was a member of the small working group on medical device-related pressure injuries for the 2019 EPUAP/NPIAP/PPPIA Prevention and treatment of pressure ulcers/injuries1. Dr Delmore is a Board Member of the National Pressure Injury Advisory Panel and is on the Editorial Board for Advances in Skin and Wound Care. She was a member of a small working group on heel pressure injuries for the 2019 EPUAP/NPIAP/PPPIA Prevention and treatment of pressure ulcers/injuries1.
Funding
The authors received no funding for this study.
Évaluation du risque de lésions de pression
Elizabeth A Ayello and Barbara A Delmore
DOI: https://doi.org/10.33235/wcet.42.4.31-37
Résumé
Cet article met en évidence les instruments d'évaluation (échelles) du risque de lésions de pression (LP) couramment utilisés et d'autres considérations que le clinicien devrait envisager d'utiliser dans sa pratique quotidienne pour déterminer si son patient est à risque de LP.
Introduction
Chaque année, en novembre, de nombreuses organisations professionnelles participent à la journée "Stop aux lésions de pression/ulcères". C'est l'occasion de sensibiliser le grand public ainsi que les autres professionnels de santé aux lésions de pression (LP). La prévention des LP est une partie importante de la pratique quotidienne d'un clinicien. L'objectif de cet article est de fournir un résumé succinct de certains instruments d'évaluation (échelles) du risque de LP couramment utilisés, ainsi que d'autres caractéristiques des patients à prendre en compte dans le cadre d'un processus complet d'évaluation du risque.
Aperçu de l'évaluation du risque
L'objectif de l'évaluation du risque est d'identifier si une personne est à risque de LP et, si c'est le cas, de mettre en œuvre un plan de prévention individualisé en tenant compte notamment des facteurs de risque modifiables et non modifiables1. La directive internationale 2019 avec des recommandations de mise en œuvre1 fournit une aide aux cliniciens pour les meilleures pratiques avec les personnes à risque de LP, quel que soit le cadre de soins. L'évaluation du risque est l'un des éléments clés à prendre en compte pour prévenir les LP. Il s'agit d'un processus systématique qui comprend au minimum l'examen de la peau de la personne pour tout changement, la sensibilisation à tout dispositif, y compris les objets médicaux et autres qui peuvent causer une pression, l'évaluation des caractéristiques individuelles du patient qui sont connues pour être des facteurs de risque, et l'évaluation à l'aide d'un instrument d'évaluation (échelle) du risque validé/fiable et de l’avis clinique du praticien.
Instruments d'évaluation du risque
Il existe plusieurs instruments d'évaluation (échelles) du risque valides et fiables (Tableau 1). Il est donc important d'utiliser celui qui correspond à l'âge de votre population et à votre cadre de pratique. Certains des instruments d'évaluation du risque disposent d'un manuel d'instructions ou d'un glossaire pour leur utilisation. Le clinicien doit comprendre la définition des termes utilisés par l'instrument afin de savoir comment évaluer avec précision son patient pour chacun des facteurs de risque décrits dans l'instrument choisi.
La plupart des cadres de pratique ont une politique ou des directives spécifiques en œuvre au moment où les évaluations des risques doivent être effectuées. La première pratique générale pour effectuer une évaluation des risques concerne le moment l'admission de la personne dans un établissement, par exemple un hôpital, une maison de soins de longue durée ou de retraite, un centre de réadaptation, un établissement de soins ambulatoires (par exemple, les services concernés) ou une affectation de soins à domicile. Les évaluations du risque ultérieures se fondent sur le cadre clinique. Par exemple, dans les établissements de soins intensifs, les praticiens effectuent une évaluation des risques tous les jours, lors du transfert vers une autre unité de soins, lorsque l'état du patient change, et lors de sa sortie de l'établissement. Dans les maisons de retraite ou les établissements de soins de longue durée, les soignants ont tendance à effectuer des évaluations du risque chaque semaine et lors de la sortie de l'établissement. Dans les organisations de soins à domicile, les soignants ont tendance à effectuer une évaluation des risques à chaque visite, un peu comme dans les établissements de soins ambulatoires. Il va sans dire que le soignant doit suivre la politique de son cadre de travail et évaluer avec précision la personne en fonction de chaque facteur de risque de l'instrument. Il est important de noter qu'un soignant doit également faire appel à son jugement pour évaluer le risque de LP d'une personne sans utiliser d'instrument d'évaluation du risque.
La section suivante fournit une brève description des instruments d'évaluation du risque les plus couramment utilisés.
Instruments d'évaluation du risque chez les adultes
Échelle d'évaluation du risque d'escarre de Norton
L'échelle d'évaluation du risque d'escarres de Norton est largement identifiée comme la première échelle connue2. Elle a été créée en Angleterre en 1962 par Doreen Norton. Elle comporte cinq catégories (Tableau 1) auxquelles un score numérique est attribué en fonction des termes descripteurs. Lorsque les chiffres sont totalisés, on détermine que le risque faible est >18, le risque moyen de 14 à 18, alors que les chiffres les plus bas indiquent un risque plus élevé, avec <10 considéré comme un risque très élevé3.
Score de prévention/traitement des ulcères de pression de Waterlow
Le score de Waterlow a été créé par Judy Waterlow au Royaume-Uni en 1985 et a été révisé en 2005 par le Queensland Health4. Comme le montre le tableau 1, il comporte six catégories. En outre, l’Outil de dépistage de la malnutrition (ODM) est utilisé pour évaluer l'état nutritionnel de la personne sur cette échelle. Il existe également une section intitulée "Risques particuliers". Les scores sont additionnés, une personne étant considérée à risque lorsque le score est >10, à haut risque à >15 et à très haut risque à >20. Le verso de la carte à échelle comporte un bref résumé des stratégies de prévention ainsi que les définitions de la classification du Groupe d’experts consultatif européen sur les ulcères de pression (EPUAP). De plus amples informations sont disponibles sur le site internet judy-waterlow.co.uk5.
Échelle de Braden pour la prédiction du risque d'escarre de décubitus
Connue par beaucoup sous le nom d'échelle de Braden, elle a été créée aux États-Unis par les docteurs Barbara Braden et Nancy Bergstrom sur la base d'un schéma conceptuel qu'elles ont publié en 19876-8. L'échelle comporte six facteurs d'évaluation du risque: sensoriel/perception, humidité, activité, mobilité, nutrition et friction/cisaillement (Tableau 1). Plusieurs premières publications sur la validation de l'échelle ont été publiées par la suite8-11. Au fil des ans, elle a été utilisée dans le monde entier et de nombreuses recherches ont validé son utilisation pour une variété de couleurs de peau12. Il est destiné aux personnes âgées de 8 à 100 ans et plus. Un score de 15 à 18 est considéré comme un risque léger, de 13 à 14 un risque modéré, de 10 à 12 un risque élevé et <9 un risque sévère.
Échelle de Braden II©
L'échelle de Braden pour prédire le risque d'escarre a été publiée à l'origine à la fin des années 19806-8. Depuis avril 2021, les droits d'auteur (copyright) de l'échelle de Braden sont désormais détenus par Health Sense Ai et elle a été renommée Braden II©13. Elle a été mise à jour en collaboration avec les concepteurs de l'échelle originale, les docteurs Barbara Braden et Nancy Bergstrom, pour devenir l'échelle de Braden II©. Vous pouvez demander l'autorisation d'utiliser l'échelle de Braden II© en vous rendant sur leur site internet (www.bradenscale.com13), en remplissant les formulaires de licence d'utilisation et en payant les droits.
L'échelle de Braden II© comporte les mêmes six facteurs d'évaluation du risque que l'échelle de Braden originale: sensoriel/perception, humidité, activité, mobilité, nutrition et friction/cisaillement. Les mises à jour de l'échelle de Braden II© incluent une terminologie visant à mettre l'échelle en conformité avec la taxonomie actuellement utilisée, comme le remplacement d' « escarre» par «lésion de pression ». En outre, des mises à jour ont été apportées aux descriptions des sous-sections afin de faciliter une notation précise avec l'instrument par les utilisateurs. Il n'y a pas de changement de paliers dans les scores à partir desquels un patient est considéré comme étant à risque, mais il est prévu d'aborder dans le protocole de soins du patient toute sous-échelle dont les scores sont plus élevés, même si le score total de l'échelle globale n'indique pas que le patient est à risque. L'échelle de Braden II© est disponible en anglais, français et espagnol.
Pour aider les praticiens à évaluer l'échelle, un glossaire a été créé et peut être utilisé si vous obtenez l'autorisation pour les droits d'auteur. Health Sense AI/HD Nursing met également à disposition plusieurs ressources documentaires pour contribuer à former les praticiens sur l'échelle de Braden II©, y compris des exemples de cas qui montrentcomment utiliser correctement l'échelle13. Le glossaire et le module de formation de l'échelle de Braden II© font désormais partie de la boîte à outils© de l'échelle de Braden II qui est fournie avec la licence de l'échelle de Braden II©. Cela permet de s'assurer que le personnel est correctement formé à l'utilisation de l’échelle dans les soins directs aux patients.
Instruments pédiatriques d'évaluation du risque
Échelle Q de Braden
L'instrument d'évaluation du risque Q de Braden a été adapté de l'échelle de Braden par Curley et ses collègues14 et, depuis, sa fiabilité et sa validité ont été fréquemment testées15. Son utilisation dans la pratique est prévue pour les patients pédiatriques âgés de 21 jours (y compris corrigés par rapport à l'âge gestationnel de 21 jours) jusqu'à l'âge de 8 ans. L'instrument comprend les mêmes six sous-échelles que l'échelle de Braden, avec l'ajout d'un septième élément - perfusion et oxygénation des tissus. Un score de 25 est considéré comme un risque faible, 21 est un risque moyen et 16 ou moins est considéré comme un risque de LP (Tableau 1).
Tableau 1. Instruments d'évaluation (échelles) du risque de LP couramment utilisés [©Delmore & Ayello 2022]
Échelle QD Braden
Le QD de Braden est l'un des plus récents instruments d'évaluation du risque créé par Curley et ses collègues16, est basé sur l'échelle Q de Braden. Son utilisation est prévue pour les patients pédiatriques, des prématurés jusqu’à l'âge de 21 ans. Il contient cinq items de l’échelle Q de Braden (mobilité, perception sensorielle, friction/cisaillement, nutrition, perfusion et oxygénation des tissus) auxquels s'ajoutent le nombre de dispositifs médicaux et la repositionnabilité/protection de la peau, ce dernier item traitant spécifiquement des dispositifs médicaux (Tableau 1). Un score de >13 est considéré comme un risque de LP17.
Échelle d'évaluation du risque d'ulcère de pression pédiatrique de Glamorgan
Cette échelle a été créée à la fin des années 2000 sous le nom d'échelle d'évaluation du risque d'ulcère de pression pédiatrique de Glamorgan (échelle de Glamorgan) et est considérée comme la première échelle d'évaluation du risque pédiatrique à inclure les dispositifs comme l'un des facteurs d'évaluation du risque18. D'autres points de l'échelle portent sur la mobilité, l'état de l'enfant, l'anémie, la nutrition, la perfusion, le poids, l'incontinence inappropriée pour l'âge, la température corporelle, les taux d'albumine et d'hémoglobine et les dispositifs. Tout score de 10 à 14 est considéré comme à risque, de 15 à 19 comme à haut risque, et un score de ≥20 est considéré comme à très haut risque de LP.
Échelle d'évaluation du risque cutané néonatal
Cette échelle a été créée par Huffines et Logsdon à la fin des années 1990 et s'inspire de l'échelle de Braden19. Il s'agit de la première échelle dont la fiabilité et la validité ont été testées pour la population néonatale. Le nouveau-né est noté en fonction de sa condition physique générale (âge gestationnel), de son état mental, de sa mobilité, de son activité, de sa nutrition et de son hydratation. Un score de ≥13 est considéré comme étant à risque.
Populations à risque
Adultes âgés
L'âge avancé (>65 ans) est un facteur de risque intrinsèque de LP. Une grande part du risque est due aux changements cutanés qui se produisent en raison du processus de vieillissement, tels que l'amincissement de l'épiderme et la perte de tissu adipeux comme fonction de protection. De plus, la charge de morbidité et la présence de comorbidités créent un risque de LP dans cette population20,21. L'évaluation de risque à l'aide d'une échelle valide et fiable n'est qu'un élément de l'évaluation du risque de LP d'une personne âgée. Dans ce cas, il faut tenir compte des facteurs de risque qui ne sont pas inclus (par exemple, l'âge, la charge de morbidité) ou qui reflètent le degré de sévérité d'une affection (par exemple, la malnutrition)20-22.
Patients souffrant d'obésité
Selon la Directive internationale 2019, les patients souffrant d'obésité sont considérés comme une population nécessitant une évaluation diligente du risque de LP23. L'obésité est une affection complexe insuffisamment reconnue22. Les Centers for Disease Control and Prevention (CDC) définissent l'obésité par des catégories d'indice de masse corporelle (IMC): Classe 1, IMC de 30-35kg/m2; Classe 2, IMC de 35-40kg/m2; et Classe 3, IMC de 40kg/m2 ou plus et considéré comme sévère24. Dans cette population, les PL sont dues à une variété de facteurs tels que la malnutrition, les maladies et les conditions associées à l'obésité alors que les LP liées à des dispositifs sont dues au fait qu’ils sont mal adaptés22,23.
Patients chirurgicaux
L'évaluation de la littérature de recherche dans la directive internationale 2019 montre que la durée entre l'admission d'une personne et son intervention chirurgicale ainsi que la durée de l'intervention chirurgicale peuvent être des marqueurs de l'immobilité d'un patient1. De plus, la classification de l'état physique d'une personne selon la Société américaine des Anesthésiologistes (ASA) peut être un marqueur de l'état clinique du patient22. Ces trois éléments doivent être considérés comme des facteurs de risque pour une personne devant subir une intervention chirurgicale.
Soins intensifs
Les patients en état critique constituent une autre population particulière qui doit être considérée comme présentant un risque élevé de formation de LP et qui doit donc faire l'objet d'une évaluation diligente du risque de LP23. La raison de ce risque élevé est due à l’état critique de cette population, au cadre de soins lui-même et à la présence abondante de dispositifs médicaux nécessaires au traitement25,26. Il est primordial de suivre de près cette population, car l'ajout d'une LP à une situation déjà complexe est considéré comme une comorbidité supplémentaire pouvant éventuellement conduire à la mortalité23.
Autres considérations relatives au risque
Dispositifs et objets
Les dispositifs médicaux et d'autres objets tels que les lunettes et les bouchons de bouteille peuvent causer des LP27-29. Les dispositifs médicaux sont l'étiologie la plus fréquente des lésions de pression associées aux dispositifs médicaux (MDRPI) chez les nouveau-nés et les enfants1,16-18,30 (Figure 1); il est donc justifié d'envisager l'utilisation de l'échelle QD de Braden16 et de l'échelle de Glamorgan18, qui comprennent toutes deux des évaluations des dispositifs médicaux.

Figure 1. LP développée par un bébé couché sur une tubulure d'intraveineuse [©E. A. Ayello 2015, utilisé avec autorisation]
Les MDRPI surviennent également chez les adultes27 (Figure 2). Actuellement, aucune des échelles d'évaluation du risques de LP chez l'adulte n'évalue les MDRPI, même si la directive internationale de 2019 traite des LP provenant de dispositifs - médicaux et autres sources27. Ll est donc très important de sensibiliser à une étiologie des LP liées aux dispositifs chez les adultes1,27-29. Envisagez d'utiliser le l’ULCÈRE mnémonique pour alerter le personnel sur les dispositifs médicaux et autres sources qui peuvent provoquer des LP28. Des recherches ont confirmé que les MDRPI surviennent 3 jours plus tôt que les autres LP, le personnel doit donc être vigilant lors de l'évaluation des patients dotés de dispositifs médicaux29. N'oubliez pas de suivre l'incidence des MDRPI28 de votre établissement. De plus, une MDRPI sur la lèvre ne peut pas être classée parmi les muqueuse, elle ne se kératinise pas et ne peut donc pas être classée en utilisant le système de classification des stades du NPIAP1,27,28.

Figure 2. LP consécutive à un raccord intraveineux (IV) fixé directement sur la peau. On remarque l'empreinte sur la peau correspondant à la forme du raccord de l'intraveineuse [©Delmore 2015, utilisé avec autorisation]
Zones anatomiques spécifiques à risque
Talons
On pense que les talons sont le deuxième site anatomique le plus fréquent de LP31. En raison de l'anatomie du talon et de la limitation des tissus par le calcanéum, le talon est particulièrement vulnérable au risque de LP31-36 (Figure 3). Deux études32,33 ont démontré que les comorbidités des patients, en particulier le diabète sucré et les maladies vasculaires, ainsi que l'immobilité, sont des facteurs de risque de développement de LP du talon et doivent être prises en compte lors de l'évaluation du risque de LP du talon d'une personne à l'aide d'un instrument d'évaluation du risque validé32-34.

Figure 3. Lésion de pression tissulaire profonde (DTPI) du talon droit. Contrairement aux LP de stade 1 qui sont intactes et d'un rouge/rose plus clair, les DTPI sont intactes mais présentent une décoloration plus profonde indiquant un niveau de dommage plus important. Ces LP de pleine épaisseur évoluent souvent vers un stade 3 ou 4, ou vers une LP instable [©B Delmore & E. A. Ayello, 2020, utilisé avec autorisation]
Dans l'analyse principale (n=337) dans un hôpital, les variables prédictives des LP du talon étaient le diabète, les maladies vasculaires, l'immobilité et l'échelle de Braden <1832. L'étude a été étendue à d'autres hôpitaux en utilisant les données du système SPARCS (Statewide planning and Research Cooperative system) de l'État de New York33. L'analyse principale portait sur 1.697 patients (323 patients qui avaient des LP du talon et 1.374 qui n'en avaient pas). On comptait sept prédicteurs significatifs et indépendants: diabète, maladie vasculaire, problèmes de perfusion, nutrition déficiente, âge >65 ans, ventilation mécanique et chirurgie. En se basant en partie sur ces deux études, les auteurs ont conclu que les comorbidités des patients, en l'occurrence le diabète et les maladies vasculaires, devraient être considérées comme des facteurs de risque au même titre que les résultats des instruments formels d'évaluation du risque33. Les soignants peuvent trouver notre algorithme des talons utile dans leur pratique34 (Figure 4).

Figure 4. Algorithme de lésion de pression du talon [©Delmore, Ayello & Smart 2020, utilisé avec autorisation]32-34
CV - cardiovasculaire; AVC - accident vasculaire cérébral; IM - infarctus du myocarde; SEP - sclérose en plaques
La position du pied peut également constituer un facteur de risque. Dans une autre étude portant sur 10 volontaires de sexe masculin en bonne santé, la tension sur le tissu du talon était plus importante lorsque le pied était en rotation externe plutôt qu'en position verticale (90°)36. Notre récent point de pratique clinique peut être utile aux soignants quant au positionnement correct du pied pour aider à prévenir les LP du talon34.
Tubérosités sacrales/coccygiennes/ischiales
Le sacrum est le site anatomique le plus fréquent de LP. Certaines recherches suggèrent que la morphologie du squelette d'un patient peut constituer un risque intrinsèque non modifiable de LP. Les travaux de Gefen37 fournissent des connaissances sur les changements survenant chez les personnes atteintes de lésions de la moelle épinière qui augmentent le risque de LP. Il s'agit notamment d'une atrophie des muscles squelettiques, d'une infiltration de graisse dans les muscles, d'une perte de forme osseuse entraînant un aplatissement des extrémités des tubérosités ischiales et un amincissement de la peau autour des tubérosités ischiales37.
Une récente étude rétrospective cas-témoins menée par Delmore et ses collègues a comparé la région sacro-coccygienne du squelette de 15 patients présentant des LP de pleine épaisseur à celle de 15 patients ne présentant pas de LP de pleine épaisseur au moyen d'IRM38. Le principe de cette étude était de déterminer si la région sacro-coccygienne du squelette pouvait agir comme un possible facteur de risque intrinsèque de LP. Les résultats ont révélé que les patients développant des LP de pleine épaisseur avaient une morphologie et une morphométrie différentes, ressemblant à celles des patients atteints d'autres pathologies. Cette étude a également noté que les LP dans cette région étaient davantage situées dans la région du coccyx.
Instruments et technologie d'évaluation du risque
L'utilisation des échelles d'évaluation du risque fait l'objet d'un débat croissant dans la littérature, car elles peuvent ne pas prendre en compte tous les facteurs de risque importants. Il faut donc penser aux comorbidités du patient qui peuvent ne pas être prises en compte par une échelle d'évaluation du risque. Des recherches sont en cours pour étudier l'identification de facteurs de risque supplémentaires et/ou d'indicateurs précoces de LP, notamment la température cutanée39,40 ainsi que l'hydratation sous-dermique et l'imagerie41-43. Il sera intéressant de voir comment les différentes technologies permettront de réduire les coûts43. L'avenir de l'évaluation du risque de LP pourrait inclure une évaluation systématique du risque comprenant une échelle valide et fiable, les caractéristiques des patients telles que les comorbidités, et la technologie qui aura un impact sur la réduction de l'incidence des LP.
Conclusion et synthèse
Ll existe plusieurs échelles d'évaluation du risque de LP, valides et fiables, qui peuvent être utilisées dans la pratique. Bien que la recherche continue à fournir des données quant à celles qui sont les meilleures en termes de capacité prédictive, l'identification des comorbidités du patient ainsi que la technologie peuvent constituer des données supplémentaires pour aider les soignants à identifier les personnes à risque de LP. Il est très important de se rappeler que l'évaluation LP est un processus dont l'objectif est de mettre en œuvre un protocole de soins en temps utile pour prévenir le développement des LP évitables44.
Conflit d'intérêt
Le Dr Ayello a été membre du petit groupe de travail sur les lésions de pression liées aux dispositifs médicaux pour l'édition 2019 de l'EPUAP/NPIAP/PPPIA: Prevention and treatment of pressure ulcers/injuries1. Le Dr Delmore est membre du conseil d'administration du Groupe d’experts consultatif national sur les LP et fait partie du comité de rédaction de Advances in Skin and Wound Care. Elle a fait partie d'un petit groupe de travail sur les lésions de pression du talon pour l'édition 2019 de l'EPUAP/NPIAP/PPPIA: Prevention and treatment of pressure ulcers/injuries1.
Financement
Les auteurs n'ont reçu aucun financement pour cette étude.
Author(s)
Elizabeth A Ayello*
PhD, RN, CWON, MAPWCA, FAAN
Co-Editor in Chief, Advances in Skin and Wound Care
Executive Editor Emeritus, WCET® Journal
New York, NY, USA
Barbara A Delmore
PhD, RN, CWCN, MAPWCA, IIWCC-NYU, FAAN
Senior Nurse Scientist, Center for Innovations in the Advancement of Care (CIAC), NYU Langone Health, New York, NY, USA
Clinical Assistant Professor, Hansjörg Wyss Department of Plastic Surgery, NYU Grossman School of Medicine, New York, NY, USA
* Corresponding author
References
- European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel and Pan Pacific Pressure Injury Alliance (EPUAP/NPIAP/PPPIA). Prevention and treatment of pressure ulcers/injuries: clinical practice guideline. The international guideline. Emily Haesler, editor. Perth, WA: Cambridge Media; 2019.
- Norton D, et al. An investigation of geriatric nursing problems in hospital. London, UK: National Corporation for the Care of Old People; 1962.
- Royal Commission into Aged Care Quality and Safety. The Norton Pressure Sore Risk-Assessment Scale Scoring System; n.d. Available from: https://agedcare.royalcommission.gov.au/system/files/2020-06/RCD.9999.0096.0460.pdf
- Waterlow J. Pressure sores: a risk assessment card. Nurs Times 1985;81(48):49–55.
- judy-waterlow.co.uk. The Waterlow Score; 2007. Available from: http://www.judy-waterlow.co.uk/waterlow_score.htm
- Braden B, Bergstrom N, Laguzza V, Homan A. The Braden Scale for Predicting Pressure Sore Risk. Nurs Res 1987;36(4):205–10.
- Braden B, Bergstrom N. A conceptual schema for the study of the etiology of pressure sores scale. Rehab Nurs 1987;12(1):8–12, 16.
- Bergstrom, N, Demuth PJ, Braden BJ. A clinical trial of the Braden Scale for Predicting Pressure Sore Risk. Nurs Clin North Am 1987;22:417–28.
- Bergstrom N, Braden B, Kemp M, Champagne M, Ruby E. Predicting pressure ulcer risk: a multisite study of the predictive validity of the Braden Scale. Nurs Res 1998;47(5):261–269. doi:10.1097/00006199-199809000-00005
- Braden B, Bergstrom N. Predictive validity of the Braden Scale for pressure sore risk in a nursing home population. Res Nurse Health 1994;17:459–70.
- Bergstrom N, Braden B. A prospective study of pressure sore risk among institutionalized elderly. J Am Geriatr Soc 1992;40:742–58.
- Lyder CH, et al. The Braden Scale for pressure ulcer risk: evaluating the predictive validity in Black and Latino/Hispanic elders. App Nurs Res 1999;12(2):60–8.
- Braden Scale II© Predicting Pressure Injuries. Available from: http://www.bradenscale.com.
- Curley MAQ, et al. Predicting pressure ulcer risk in pediatric patients: the Braden Q Scale. Nurs Res 2003;52(1):22–31.
- Noonan C, Quigley S, Curley MAQ. Using the Braden Q Scale to predict pressure ulcer risk in pediatric patients. J Pediatr Nurs 2011;26:566–75.
- Curley MAQ, Hasbani NR, Quigley SM, et al. Predicting pressure injury risk in pediatric patients: the Braden QD Scale. J Pediatr 2018;192:189–195.
- Chamblee TB, Pasek TA, Caillouette CN, et al. How to predict pediatric pressure injury risk with the Braden QD Scale. Am J Nurs 2018;118(11):34–43.
- Willock J, Baharestani MM, Anthony D. The development of the Glamorgan paediatric pressure ulcer risk assessment scale. J Wound Care 2009;18(1):17–21. Available from: http://www.ncbi.nlm.nih.gov/pubmed/19131913
- Huffines B, Logsdon MC. The Neonatal Skin Risk Assessment Scale for predicting skin breakdown in neonates. Issues Compr Pediatr Nurs 1997;20(2):103–114. doi:10.3109/01460869709026881
- European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel and Pan Pacific Pressure Injury Alliance (EPUAP/NPIAP/PPPIA). Chapter 4: Risk factors and risk assessment. In: Haesler E, editor. Prevention and treatment of pressure ulcers/injuries: clinical practice guideline. The international guideline. Perth, WA: Cambridge Media; 2019. p. 38–72.
- Jaul E, Barron J, Rosenzweig JP, Menczel J. An overview of co-morbidities and the development of pressure ulcers among older adults. BMC Geriatr 2018;18(305):1–11. doi:10.1186/s12877-018-0997-7
- Munoz N, Litchford M, Cox J, Nelson JL, Nie AM, Delmore B. National Pressure Injury Advisory Panel White Paper malnutrition and pressure injury risk in vulnerable populations: application of 2019 International Clinical Practice Guideline. Adv Skin Wound Care 2022;35(March):156–165. doi:10.1097/01.ASW.0000816332.60024.05
- European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel and Pan Pacific Pressure Injury Alliance (EPUAP/NPIAP/PPPIA). Chapter 3: Populations with specific pressure injury related needs. In: Haesler E, editor. Prevention and treatment of pressure ulcers/injuries: clinical practice guideline. The international guideline. Perth, WA: Cambridge Media; 2019. p. 28–37.
- Centers for Disease Control and Prevention. Defining adult overweight and obesity; 2021 [cited 2022 Nov 23]. Available from: https://www.cdc.gov/obesity/adult/defining.html
- Cox J. Pressure injury risk factors in adult critical care patients: a review of the literature. Ostomy Wound Manag 2017;63(11):30–43.
- Alderden J, Rondinelli J, Pepper G, Cummins M, Whitney JA. Risk factors for pressure injuries among critical care patients: a systematic review. Int J Nurs Stud 2017;71:97–114. doi:10.1016/j.ijnurstu.2017.03.012
- European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel and Pan Pacific Pressure Injury Alliance (EPUAP/NPIAP/PPPIA). Chapter 11: Device related pressure injuries. In: Haesler E, editor. Prevention and treatment of pressure ulcers/injuries: clinical practice guideline. The international guideline. Perth, WA: Cambridge Media; 2019. p. 181–193.
- Delmore B, Ayello EA. Pressure injuries caused by medical devices and other objects: a clinical update. Am J Nurs 2017;117(12):36–45.
- Kayser SA, VanGilder CA, Ayello EA, Lachenbruch C. Prevalence and analysis of medical device-related pressure injuries: results from the International Pressure Ulcer Prevalence Survey. Adv Skin Wound Care 2018;31(6):276–285.
- Delmore B, Deppisch M, Sylvia C, Luna-Anderson C, Nie AM. Pressure injuries in the pediatric population: a National Pressure Ulcer Advisory Panel White Paper. Adv Skin Wound Care 2019;32(9):394–408. doi:10.1097/01.ASW.0000577124.58253.66
- European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel and Pan Pacific Pressure Injury Alliance (EPUAP/NPIAP/PPPIA). Chapter 9: Heel pressure injuries. In: Haesler E, editor. Prevention and treatment of pressure ulcers/injuries: clinical practice guideline. The international guideline. Perth, WA: Cambridge Media; 2019. p. 145–154.
- Delmore B, Lebovits S, Suggs B, Rolnitzky L, Ayello EA. Risk factors associated with heel pressure ulcers in hospitalized patients. JWOCN 2015;42(3):242–248.
- Delmore B, Ayello EA, Smith D, Rolnitzky L, Chu AS. Refining heel pressure injury risk factors in the hospitalized patient. Adv Skin Wound Care 2019:32(11):512–519.
- Delmore B, Ayello EA. Practice point: heel pressure injuries. Adv Skin Wound Care 2021;34(5):236-237.
- Gefen A. Why is the heel particularly vulnerable to pressure ulcers. Br J Nurs 2017;8;26(Sup20):S62-S74. doi:10.12968/bjon.2017.26.Sup20.S62.
- Tenenbaum S, Shabshin N, Levy A, Herman A, Gefen AJ. Effects of foot posture and heel padding devices on soft tissue deformations under the heel in supine position in males: MRI studies. J Rehabil Res Dev 2013;50(8):1149–56. doi:10.1682/JRRD/2012.10.0183.
- Gefen A. Tissue changes in patients following spinal cord injury and implications for wheelchair cushions and tissue loading: a literature review. Ostomy Wound Manage 2014;60(2):34–45.
- Delmore B, Sprigle S, Samim M, et al. Does sacrococcygeal skeletal morphology and morphometry influence pressure injury formation in adults. Adv Skin Wound Care 2022;35(11):586–95.
- Sprigle S, et al. Clinical skin temperature measurement to predict incipient pressure ulcers. Adv Skin Wound Care 2001;14(3):133–37.
- Langemo D, Spahn JG. A reliability study using long-wave infrared thermography device to identify relative tissue temperature variations of the body surface and underlying tissue. Adv Skin Wound Care 2017;30(3):109–119.
- Bates-Jensen BM, McCreath HE, Pongquan V. Subdermal moisture is associate with early pressure ulcer damage in nursing home residents with dark skin tones. JWOCN 2009;36(3):277–84.
- Ross G, Gefen A. Assessment of sub-epidermal moisture by direct measurement of tissue biocapacitance. Med Eng Physic 2019;73:92–99.
- Koerner, S, Adams D, Harper SL, Black JM, Langemo DK. Use of thermal imaging to identify deep-tissue pressure injury on admission reduces clinical and financial burdens of hospital-acquired pressure injuries. Adv Skin Wound Care 2019;32(7):312–20.
- Wound, Ostomy and Continence Nurses Society. (2017). WOCN Society position paper: Avoidable versus unavoidable pressure ulcers (injuries). Mt. Laurel, NJ: Author.
