Volume 43 Number 1
WHAM evidence summary: traditional hypochlorite solutions
Emily Haesler, Keryln Carville
Keywords Traditional wound management, hypochlorite, Eusol, Dakin’s® solution, Milton® solution
For referencing Haesler E & Carville K. WHAM evidence summary: traditional hypochlorite solutions . WCET® Journal 2023; 43(1):35-40
DOI https://doi.org/10.33235/wcet.43.1.35-40
Clinical question
What is the best available evidence for use of traditional hypochlorite solutions for reducing wound infection and/or improving wound healing?
Summary
Traditional hypochlorites have been used to manage local wound infection since their introduction in the early 1900s1. Traditional hypochlorite solutions are those that have a high pH varying from 7.5 to 11.82-5. In contrast, recently developed hypochlorite solutions are pH-neutral, making them more appropriate for application to healing wound tissue. Level 5 bench research has demonstrated that traditional hypochlorite solutions have anti-bacterial properties;6-8 however, the effect may be short-lived9. Although Level 5 bench research has suggested that traditional hypochlorite solutions are toxic to cells and may delay wound healing,6, 8, 10, 11 Level 1 and 2 evidence2, 12-16 showed that acceptable healing outcomes can be achieved using traditional hypochlorite solutions, with one study demonstrating superior outcomes compared to an inert solution.17 Level 1 and 4 evidence12, 13, 16-20 indicated that traditional hypochlorite solutions are associated with reduction in signs and symptoms of local wound infection. Level 1 and 2 evidence13, 14, 16 showed that topical phenytoin13, 16, honey14 and nanocrystalline silver gel16 achieved better outcomes than a traditional hypochlorite solution, and these options could be considered in settings with access. The risk of delaying healing of the wound should be considered in the context of managing local wound infection and reducing the risk of spreading and systemic infection, when alternative less cytotoxic antiseptics are not available in the setting.
Clinical practice recommendations
All recommendations should be applied with consideration to the wound, the person, the health professional and the clinical context.
|
Traditional hypochlorite solutions could be applied to infected wounds in low resource settings in which less cytotoxic antiseptic solutions are not accessible (Grade B). |
Sources of evidence: search and appraisal
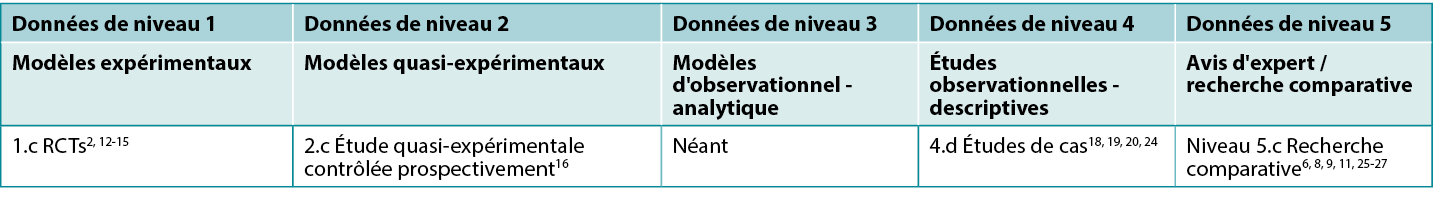
This summary was conducted using methods published by the Joanna Briggs Institute.21-23 The summary is based on a literature search combining search terms related to hypochlorites/EUSOL/Dakin’s® solution/Milton® solution and wound infection. Searches were conducted in the Cumulative Index to Nursing and Allied Health Literature (CINAHL), PubMed®, Google Scholar and Health Internetwork Access to Research Initiative (Hinari) databases and in the Cochrane Library for evidence conducted in human wounds reporting the use of traditional hypochlorite preparations published to October 2022 in English. Levels of evidence for intervention studies are reported in Table 1.
Table 1. Levels of evidence for clinical studies

Background
Traditional hypochlorites are preparations that occur as a reaction between chlorine and an alkaline salt, most commonly sodium or calcium 28, 29. They typically have a pH from 7.5 up to 11.8.2-5 Commonly used traditional hypochlorites include household bleach, Dakin’s® solution, Edinburgh University Solution of Lime (EUSOL) and Milton® solution. (N.b., no evidence on the use of Milton® solution for wound healing was identified).
Dakin’s® solution is a preparation of bleach diluted in distilled water to 0.5% concentration for clinical use. In some reports of its use, traditional Dakin’s® solution is diluted to half or quarter strength by mixing with additional water19. The preparation was developed by Henry Dakin on the war fields in France in 1915 to manage wound infection and to improve clinical outcomes for bullet and shrapnel wounds28, 30, 31. Bench research has demonstrated Dakin’s® solution has action against a range of microorganisms and biofilms, including (but not limited to) S. aureus, C. albicans, E. coli, K. pneumoniae, and P. aeruginosa6, 8, 9, 17, 25, 27 (Level 5).
EUSOL solution is made from chlorinated lime (calcium oxide) and boric acid (sodium salts) at a 0.25% concentration2, 24, 32, 33.The solution, which was also developed in the early 1900s, is traditionally used as a debriding agent and to manage infection.32, 34
Traditional hypochlorites are unstable and have a short shelf life.29, 34 They have a high pH2-5, which is associated with impaired wound healing. Both full strength (0.5%) Dakin’s® solution8 and half strength (0.25%) Dakin’s® solution6 have been reported to be cytotoxic to fibroblasts in laboratory studies, raising concerns that traditional hypochlorites at their full concentration may delay wound healing11, 16, 29-31, 34-36. To address these limitations, hypochlorites are now prepared electro-chemically to produce contemporary hypochlorites referred to as super-oxidised solutions29, 37. Although super-oxidised solutions have a longer shelf-life and a neutral pH, and they appear to have a good safety profile,29, 38 they are not universally available. In low resource settings, traditional hypochlorites are still used for managing wound infection39, 40.
Clinical evidence on Dakin’s® solution
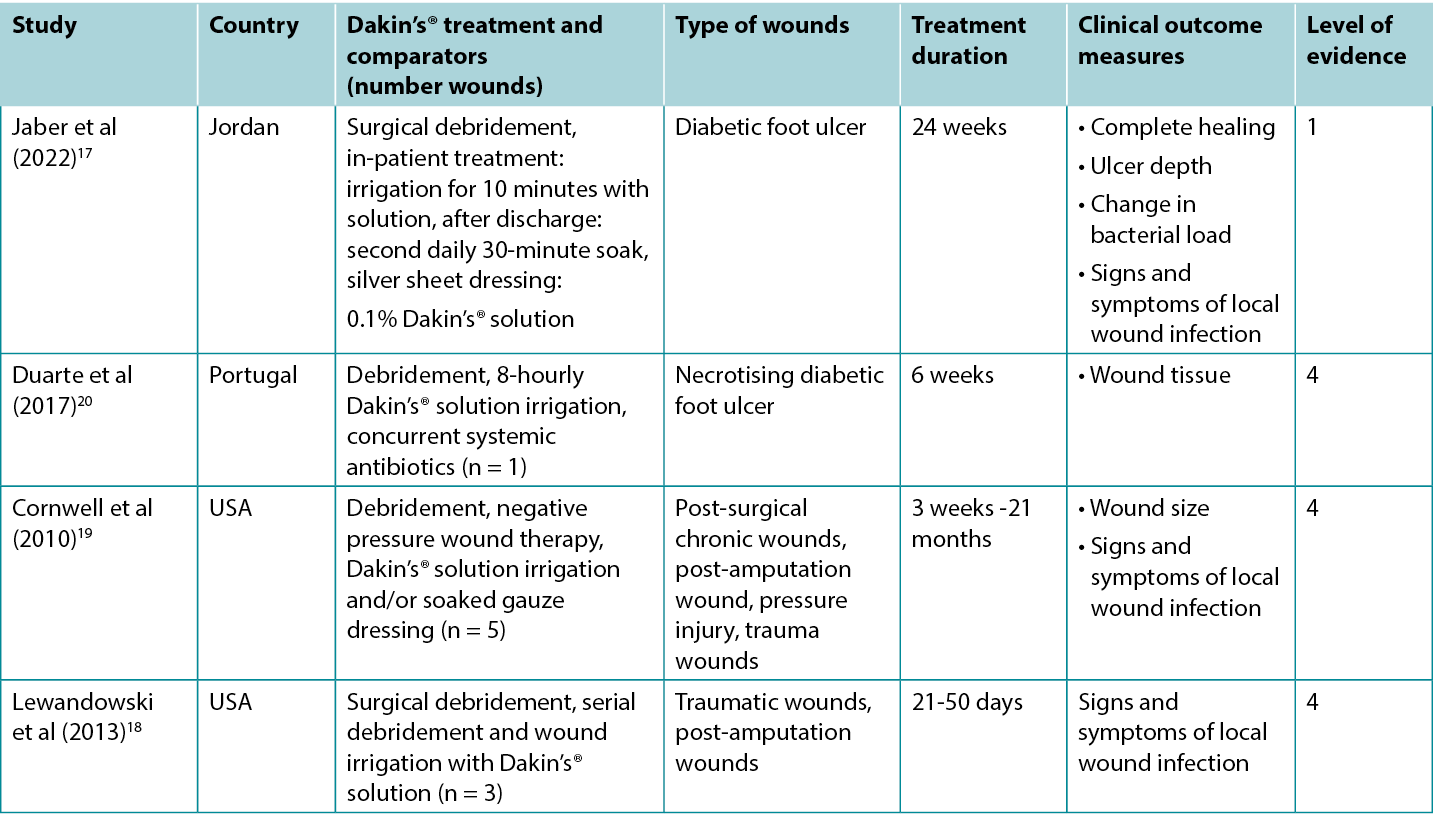
Studies reporting clinical outcomes of interest for treatment with traditional Dakin’s® solution are summarised in Table 2.
Table 2. Summary of the evidence for Dakin’s solution
Dakin’s® solution for promoting wound healing
An RCT17 at high risk of bias explored the use of Dakin’s® solution for treating infected diabetic foot ulcers (DFUs). Ulcers were surgically debrided on admission and received evidence based DFU care in conjunction with daily 10-minute irrigation with either Dakin’s® solution diluted to 0.1% concentration or normal saline, followed by application of a silver sheet dressing. Treatment was delivered in hospital for at least five days. On discharge, patients cleansed their own wounds every second day by soaking the DFU for 30 minutes in the assigned solution. Treatment continued for at least three months. Approximately 35% of DFUs treated with Dakin’s® solution were totally healed compared to 4% in the control group (odds ratio 11.9, 95% confidence interval 2.53 – 55.5, p < 0.001)17 (Level 1).
Dakin’s® solution for treating signs and symptoms of wound infection
In the RCT17 comparing Dakin’s® solution to normal saline for DFUs, quantitative wound swab analysis showed DFUs treated with Dakin’s solution had a reduction from baseline in microbial load of 1 log cycle or more after five days (statistically significant versus control, p < 0.001). Local wound infection resolved in more DFUs treated with Dakin’s® solution compared to normal saline (35.6% versus 4.4%, p = not reported)17 (Level 1).
There are numerous case reports18-20 of infected wounds of various aetiologies that have been successfully treated with regimens that include regular irrigation with Dakin’s® solution. Many of the wounds were reported to be extensive and deep, with exposed ligament and bone and/or necrotising tissue. Wounds were either confirmed or suspected to be colonised with anaerobic bacteria20 or fungal organisms18. To treat wound odour19, wound exudate19 and extensive slough18-20 (all recognised signs and symptoms of local wound infection41) wounds were surgically debrided and regularly irrigated with full, half or quarter strength Dakin’s® solution. Many of the regimens also included systemic antibiotics, serial surgical debridement, negative pressure wound therapy and split skin grafting. The cases were reported to achieve resolution of signs and symptoms of local wound infection and development of healthy granulation tissue or complete epithelialisation18-20 (Level 4).
Clinical evidence on EUSOL solution
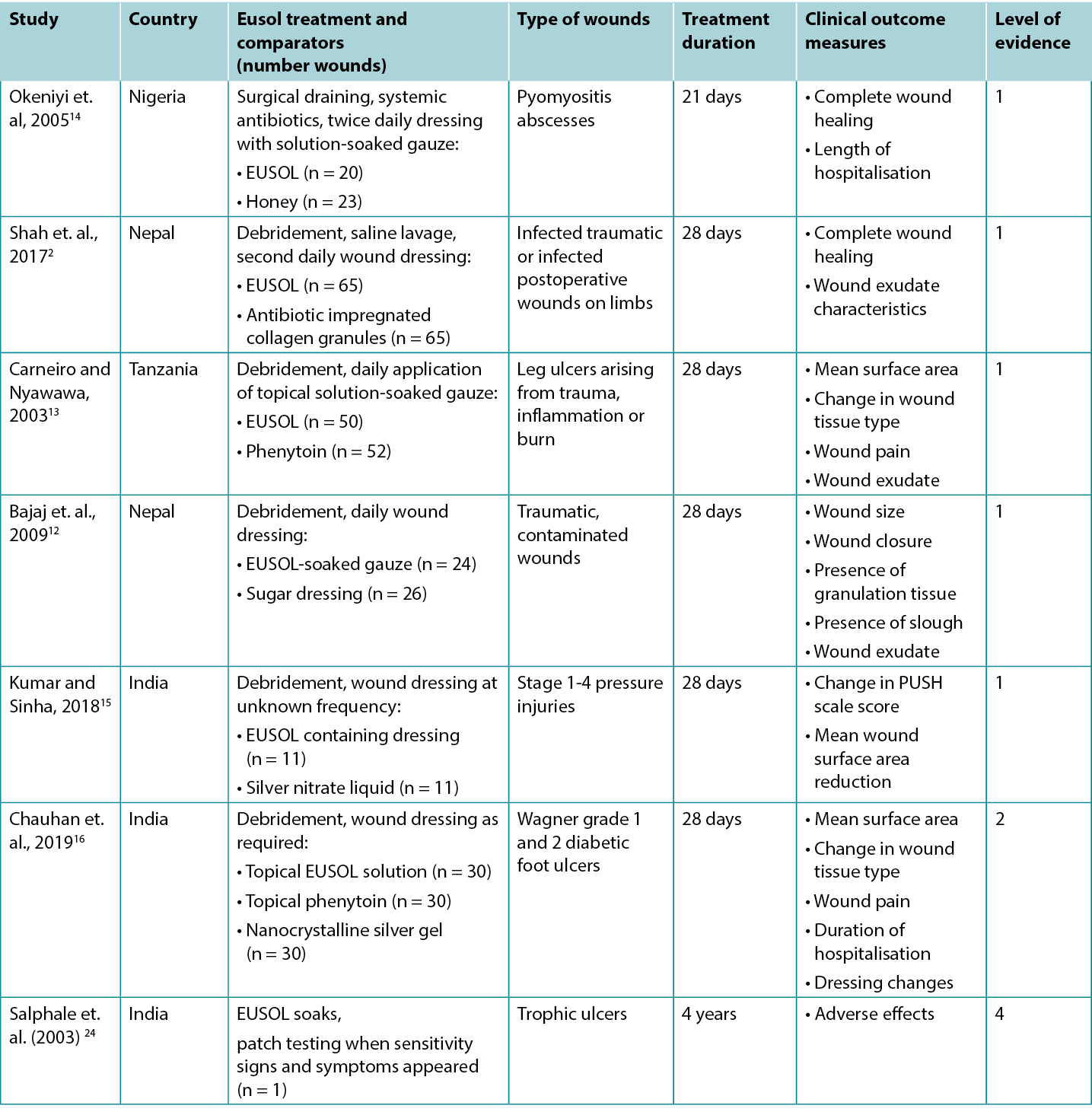
Studies reporting clinical outcomes of interest for treatment with traditional Edinburgh Solution of Lime (EUSOL) solution are summarised in Table 3.
Table 3. Summary of the evidence for EUSOL solution
EUSOL solution for improving wound healing
Five Level 1 studies and one Level 2 study provided evidence on EUSOL for improving healing of wounds of various aetiologies. In the first RCT14 (32 children with 43 wounds), which was at moderate risk of bias, open wounds (surgically excised pyomyositis abscesses) were packed twice daily with either EUSOL-soaked gauze or honey-soaked gauze. At 3-week follow-up, 55% of the EUSOL-treated abscesses achieved complete healing; compared to the 87% healing rate in the honey group (p < 0.047)14 (Level 1).
The second RCT,2 also at high risk of bias, reported use of EUSOL dressings to treat infected traumatic wounds. In this study, EUSOL was compared with an antibiotic-impregnated collagen granule dressing. At 4-week follow-up, 53.8% of the EUSOL-treated wounds were completely healed, and the remaining wounds had healthy granulation tissue. This was not statistically significantly different from the group treated with collagen granules, of which 69% completely healed, with the remainder achieving healthy granulation (p = 0.416)2 (Level 1).
A comparison of EUSOL-soaked gauze to sugar dressings is reported in a third RCT12 at high risk of bias that was conducted in traumatic, contaminated wounds (n = 50). After four weeks of daily wound dressings, wounds treated with the EUSOL dressing achieved superior results to the wounds treated with sugar dressings, including wound size reduction (p = 0.0042), achievement of granulation (p = 0.0048) and wound closure rate (p = 0.008)12 (Level 1).
In a fourth RCT13 at high risk of bias, chronic leg ulcers (n = 102) were treated daily with debridement followed by application of either EUSOL or topical phenytoin. Ulcers that achieved uniform granulation were treated with skin grafts. Wound surface area and presence of granulation tissue were evaluated weekly during the 28-day treatment period. The ulcers treated with EUSOL showed a mean reduction in surface area of about 60% over 28 days; this improvement appeared to be inferior to the topical phenytoin group (p = not reported). Although 86% of the ulcers receiving EUSOL achieved healthy granulation by 28 days, this was statistically significantly poorer outcome than the phenytoin group13 (Level 1).
The final RCT15, which was also at high risk of bias, reported a comparison of EUSOL-soaked gauze with a topical silver nitrate (0.01% w/v) liquid for treating pressure injuries (PIs) in people with spinal cord injury (n = 22). The groups were matched for severity of PIs at baseline. All Stage 1 PIs healed within two weeks of treatment. For Stage 2 PIs, those treated with EUSOL decreased in wound size by a mean of 47% after four weeks. For Stage 3 PIs treated with EUSOL, the average reduction in wound area at 4 weeks was 17%, compared with a mean size reduction of 26% for the silver-based treatment (p values = not reported). No Stage 4 PIs healed in the 4-week study duration15 (Level 1).
In a comparative study,16 which was at high risk of bias, EUSOL solution was compared to phenytoin powder and nanocrystalline silver gel for promoting healing in DFUs of Wagner grade 1 (superficial ulcer) and grade 2 (deep ulcer). The DFUs were surgically debrided as required and treated for up to four weeks with the assigned topical treatment. At 4-week follow-up, 73.33% of the DFUs treated with EUSOL solution had granulation tissue in the wound bed (p > 0.05). At baseline the mean ulcer size in the EUSOL-treated group was 16.66 cm2 ± 7.52 cm2, reducing to a mean of 7.7cm2 ± 6.65 cm2 by the end of four weeks, which may be clinically significant for patients. However, the EUSOL-treated DFUs achieved statistically significantly inferior results compared with those treated with phenytoin powder or nanocrystalline silver gel16 (Level 2).
EUSOL solution for reducing signs and symptoms of wound infection
Four of the above studies2, 12, 13, 16 reported reduction in signs and symptoms that are associated with local wound infection, including wound-associated pain, wound exudate, and a sloughy wound surface.41
In the study comparing EUSOL to topical phenytoin, the people with EUSOL-treated ulcers reported reduction in severe wound-associated pain and improvement in wound exudate by the second week of treatment13. Although the topical phenytoin group had superior outcomes at week two, there was no statistically significant difference by 28 days In the study comparing EUSOL dressings to sugar dressings, fewer wounds treated with EUSOL had a sloughy wound surface (p = 0.0034) and exudate level (p = 0.011) after four weeks.12 The infected wounds that were treated with EUSOL in the RCT by Shah et. al. (2017) 2 showed improvement in wound exudate characteristics by the fourth week of treatment and this was not statistically significantly different (p = 0.24) to the exudate profile of the antibiotic-impregnated collagen granule group2 (Level 1).
In the study conducted in DFUs,16 EUSOL solution was associated with a small reduction in pain after four weeks of treatment (mean pain score reduction of 1.87 ± 1.57 on a five-point visual analogue scale). This was unlikely to be clinically significant.16 (Level 2).
Considerations for use
Adverse effects reported with traditional hypochlorites
- Contact sensitivity to traditional hypochlorites has been observed in rare cases24 (Level 4).
- Although skin irritation,34 mild pain on application9and chemical burns with using the solution at inappropriate concentrations16 have been associated with traditional hypochlorites, these adverse events were not observed in the studies reported in this evidence summary.
Preparation of solutions in low resource settings
- A 0.5% Dakin’s® solution can be prepared with 25 mL household bleach mixed with 2 teaspoons of baking soda (bicarbonate of soda/sodium bicarbonate) in 1 L of clean water40. The solution has a short shelf-life,28, 29 and bench research has suggested the solution may provide inadequate antibacterial effect within 24 hours of preparation9. Therefore, the solution should be prepared every 24 hours40.
- A EUSOL solution can be prepared with 12.5 g sodium hypochlorite (bleaching powder) and 12.5 g of boric acid combined in 1 L of clean, lukewarm water. The solution has a short shelf life and preparation immediately before use is recommended2, 24, 32, 33.
Conflict of interest
The authors declare no conflicts of interest in accordance with International Committee of Medical Journal Editors (ICMJE) standards.
About WHAM evidence summaries
WHAM evidence summaries are consistent with methodology published in Munn Z, Lockwood C, Moola S. The development and use of evidence summaries for point of care information systems: A streamlined rapid review approach, Worldviews Evid Based Nurs. 2015;12(3):131-8.
Methods are outlined in resources published by the Joanna Briggs Institute21-23 and on the WHAM Collaborative website: http://WHAMwounds.com. WHAM evidence summaries undergo peer-review by an international, multidisciplinary Expert Reference Group. WHAM evidence summaries provide a summary of the best available evidence on specific topics and make suggestions that can be used to inform clinical practice. Evidence contained within this summary should be evaluated by appropriately trained professionals with expertise in wound prevention and management, and the evidence should be considered in the context of the individual, the professional, the clinical setting and other relevant clinical information.
Copyright © 2023 Wound Healing and Management Collaborative, Curtin Health Innovations Research Institute, Curtin University
Synthèse de données WHAM : solutions traditionnelles d'hypochlorite
Emily Haesler, Keryln Carville
DOI: https://doi.org/10.33235/wcet.43.1.35-40
Question clinique
Quelles sont les meilleures données probantes disponibles sur l'utilisation de solutions traditionnelles d'hypochlorite pour réduire l'infection des plaies et/ou améliorer la cicatrisation ?
Synthèse
Les solutions traditionnelles d'hypochlorite sont utilisées pour traiter l'infection locale des plaies depuis leur introduction au début des années 19001. Les solutions traditionnelles d'hypochlorite sont celles qui ont un pH élevé variant de 7,5 à 11,82-5. En revanche, les solutions d'hypochlorite récemment développées ont un pH neutre, ce qui les rend plus appropriées pour une application sur les tissus d’une plaie en cours de cicatrisation. Niveau 5 La recherche en laboratoire a démontré que les solutions traditionnelles d'hypochlorite ont des propriétés antibactériennes6-8 ; cependant, l'effet peut être de courte durée9. Bien que des recherches de niveau 5 aient suggéré que les solutions traditionnelles d'hypochlorite sont toxiques pour les cellules et peuvent retarder la cicatrisation des plaies,6, 8, 10, 11 des données probantes de niveau 1 et 22, 12-16 ont montré que des résultats de cicatrisation acceptables peuvent être obtenus en utilisant des solutions traditionnelles d'hypochlorite, notamment une étude démontrant des résultats supérieurs par rapport à une solution inerte.17 Des données probantes de niveau 1 et 412, 13, 16-20 ont indiqué que les solutions traditionnelles d'hypochlorite sont associées à une réduction des signes et des symptômes d'infection locale des plaies. Des données probantes de niveau 1 et 213, 14, 16 ont montré que la phénytoïne topique13, 16, le miel14 et le gel d'argent nanocristallin16 donnaient de meilleurs résultats qu'une solution traditionnelle d'hypochlorite, et ces options pourraient être envisagées lorsqu’elles sont localement accessibles. Le risque de retarder la cicatrisation de la plaie doit être considéré dans le contexte de la prise en charge de l'infection locale de la plaie et de la réduction du risque de propagation et d'infection systémique, lorsque d'autres antiseptiques moins cytotoxiques ne sont pas disponibles localement.
Recommandations pour la pratique clinique
Toutes les recommandations doivent être appliquées en tenant compte de la plaie, de la personne, du professionnel de santé et du contexte clinique.
|
Les solutions traditionnelles d'hypochlorite peuvent être appliquées aux plaies infectées dans les régions à faibles ressources où des solutions antiseptiques moins cytotoxiques ne sont pas accessibles (grade B). |
Sources des données : recherche et évaluation
Cette synthèse a été réalisée en utilisant les méthodes éditées par le Joanna Briggs Institute.21-23 La synthèse est basée sur une recherche bibliographique combinant les termes de recherche associés à hypochlorites/EUSOL/solution de Dakin®/solution de Milton® et à infection des plaies. Les recherches ont été effectuées dans les bases de données Cumulative Index to Nursing and Allied Health Literature (CINAHL), PubMed®, Google Scholar et Health Internetwork Access to Research Initiative (Hinari), ainsi que dans la bibliothèque Cochrane pour les données probantes sur des plaies humaines faisant état de l'utilisation de préparations traditionnelles à base d'hypochlorite, publiées en anglais jusqu'en octobre 2022. Les niveaux de données des études d'intervention sont indiqués dans le tableau 1.
Tableau 1. Niveaux de données des études cliniques
Contexte
Les solutions traditionnelles d'hypochlorite sont des préparations qui résultent d'une réaction entre le chlore et un sel alcalin, le plus souvent du sodium ou du calcium 28, 29. Elles ont généralement un pH compris entre 7,5 et 11,8.2-5 Les solutions traditionnelles d'hypochlorite les plus couramment utilisées sont l'eau de Javel, la solution de Dakin® , la solution de chaux de l'université d'Édimbourg (EUSOL) et la solution de Milton® . (N.B., aucune donnée sur l'utilisation de la solution de Milton® pour la cicatrisation n'a été identifiée).
La solution de Dakin® est une préparation d'eau de Javel diluée dans de l'eau distillée à une concentration de 0,5 % pour un usage clinique. Dans certains rapports d'utilisation, la solution traditionnelle de Dakin® est diluée à la moitié ou au quart de sa concentration en ajoutant de l'eau au mélange19. La préparation a été mise au point par Henry Dakin sur les champs de bataille en France en 1915 pour gérer l'infection des plaies et améliorer les résultats cliniques des blessures par balles et par éclats d'obus28, 30, 31. Des recherches comparatives ont démontré que la solution de Dakin® agit contre une série de micro-organismes et de biofilms, y compris (mais sans s'y limiter) S. aureus, C. albicans, E. coli, K. pneumoniae et P. aeruginosa6, 8, 9, 17, 25, 27 (niveau 5).
La solution EUSOL est composée de chaux chlorée (oxyde de calcium) et d'acide borique (sels de sodium) à une concentration de 0,25 %2, 24, 32, 33. La solution, qui a également été développée au début des années 1900, est traditionnellement utilisée comme agent de débridement et pour traiter l'infection32, 34
Les solutions traditionnelles d'hypochlorite sont instables et ont une durée de conservation courte.29, 34 Elles ont un pH élevé2-5, associé à une mauvaise cicatrisation des plaies. La solution de Dakin® non diluée (0,5 %)8 et la solution de Dakin® dont la concentration est réduite de moitié (0,25 %)6 se sont révélées l’une comme l’autre cytotoxiques pour les fibroblastes dans des études de laboratoire, ce qui fait craindre que les solutions traditionnelles d'hypochlorite fortement concentrées ne retardent la cicatrisation des plaies11, 16, 29-31, 34-36. Pour remédier à ces limitations, les hypochlorites sont désormais préparés électrochimiquement afin de produire des hypochlorites contemporains appelés solutions super-oxydées29, 37. Bien que les solutions super-oxydées aient une durée de conservation plus longue et un pH neutre, et qu'elles semblent avoir un bon profil de sécurité,29, 38 elles ne sont pas disponibles partout. Dans les régions à faibles ressources, les hypochlorites traditionnels sont encore utilisés pour traiter l'infection des plaies39, 40.
Données cliniques sur la solution de Dakin®
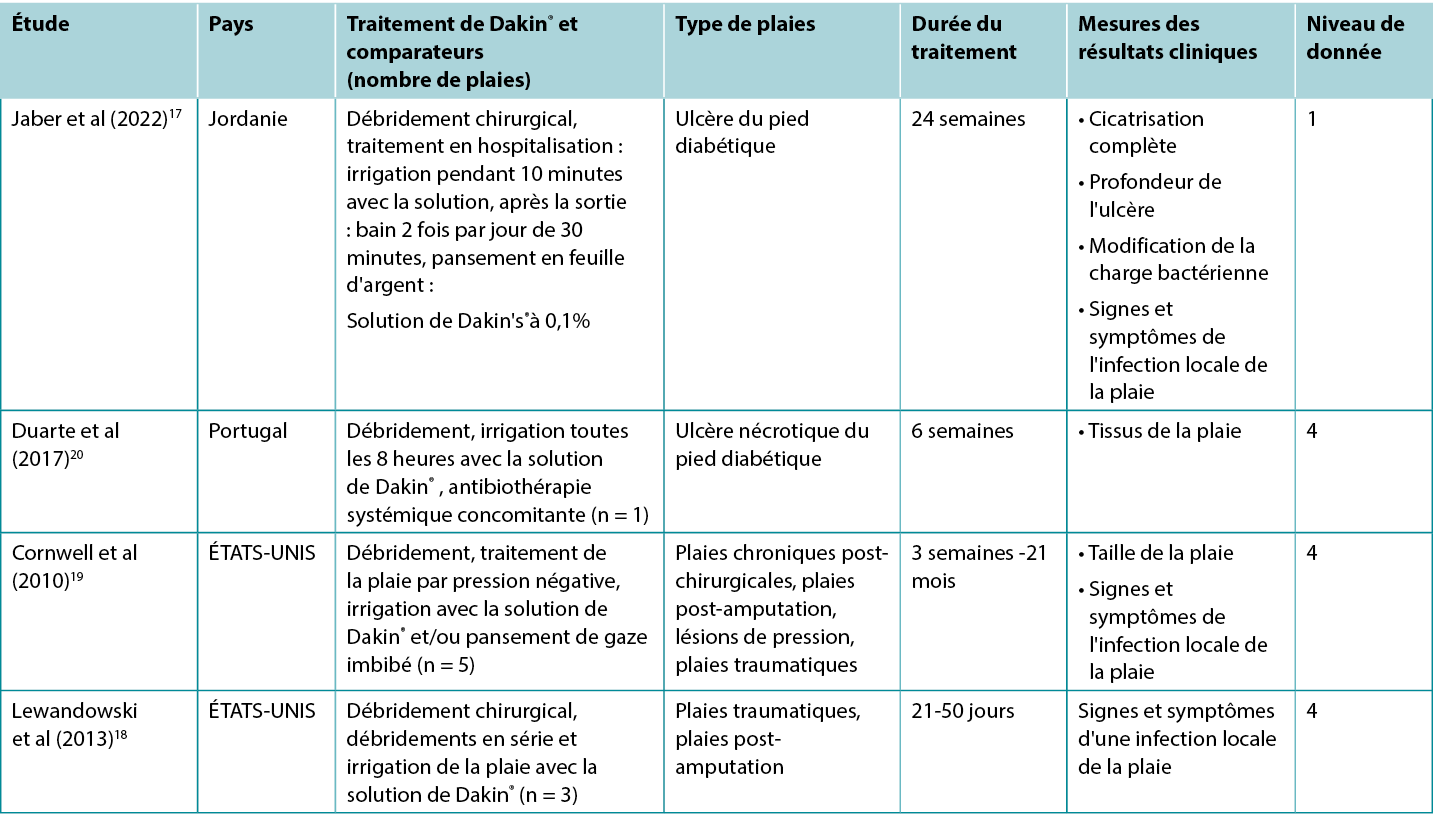
Les études rapportant des résultats cliniques intéressants pour les traitements avec la solution de Dakin® traditionnelle sont synthétisées dans le tableau 2.
Tableau 2. Synthèse des données pour la solution de Dakin
Solution de Dakin® pour favoriser la cicatrisation des plaies
Un ECR17 présentant un risque élevé de biais a étudié l'utilisation de la solution de Dakin® pour traiter les ulcères du pied diabétique (UPD) infectés. Les ulcères ont été débridés chirurgicalement à l'admission et ont reçu des soins d’ UPD basés sur des données probantes, en conjonction avec une irrigation quotidienne de 10 minutes par une solution de Dakin® diluée à 0,1 % ou une solution saline normale, suivie de l'application d'un pansement de feuille d'argent. Le traitement a été administré à l'hôpital pendant au moins cinq jours. À leur sortie, les patients nettoyaient eux-mêmes leurs plaies tous les deux jours en trempant leur UPD pendant 30 minutes dans la solution choisie. Le traitement s'est poursuivi pendant au moins trois mois. Environ 35 % des UPD traités avec la solution de Dakin® ont totalement cicatrisé, contre 4 % dans le groupe témoin (rapport de cotes 11,9, intervalle de confiance à 95 % 2,53 - 55,5, p < 0,001)17 (niveau 1).
Solution de Dakin® pour le traitement des signes et symptômes d'infection des plaies
Dans l'ECR17 comparant la solution de Dakin® au sérum physiologique pour les UPD, l'analyse quantitative des écouvillons a montré que les UPD traités avec la solution de Dakin présentaient une réduction de la charge microbienne de 1 cycle logarithmique ou plus après cinq jours (statistiquement significative par rapport au contrôle, p < 0,001). L'infection locale de la plaie s'est résorbée dans un plus grand nombre d'UPD traités avec la solution de Dakin® qu'avec le sérum physiologique (35,6 % contre 4,4 %, p = non rapporté)17 (niveau 1).
Il existe de nombreux compte-rendus de cas18-20 de plaies infectées d'étiologies diverses qui ont été traitées avec succès grâce à des protocoles comprenant une irrigation régulière avec une solution de Dakin® . Nombre de plaies étaient décrites comme étant étendues et profondes, avec des ligaments et des os exposés et/ou des tissus nécrosés. La colonisation des plaies par des bactéries anaérobies20 ou des organismes fongiques a été confirmée ou suspectée18. Pour traiter l'odeur de la plaie19, l'exsudat de laplaie19 et la desquamation importante18-20 (tous les signes et symptômes reconnus d'une infection locale de la plaie41), les plaies ont été débridées chirurgicalement et régulièrement irriguées avec une solution de Dakin® à pleine, demi ou quart de concentration. De nombreux protocoles comprenaient également des antibiotiques systémiques, un débridement chirurgical en série, une thérapie de la plaie par pression négative et une greffe de morceaux de peau. Dans les cas rapportés, les signes et symptômes d'infection locale de la plaie ont disparu et un tissu de granulation sain ou une épithélialisation complète s'est développé18-20 (niveau 4).
Données cliniques sur la solution EUSOL
Les études rapportant des résultats cliniques intéressants pour les traitements avec la solution traditionnelle de chaux d’Edinburgh (EUSOL) sont synthétisées dans le tableau 3.
Tableau 3. Synthèse des données probantes pour la solution EUSOL
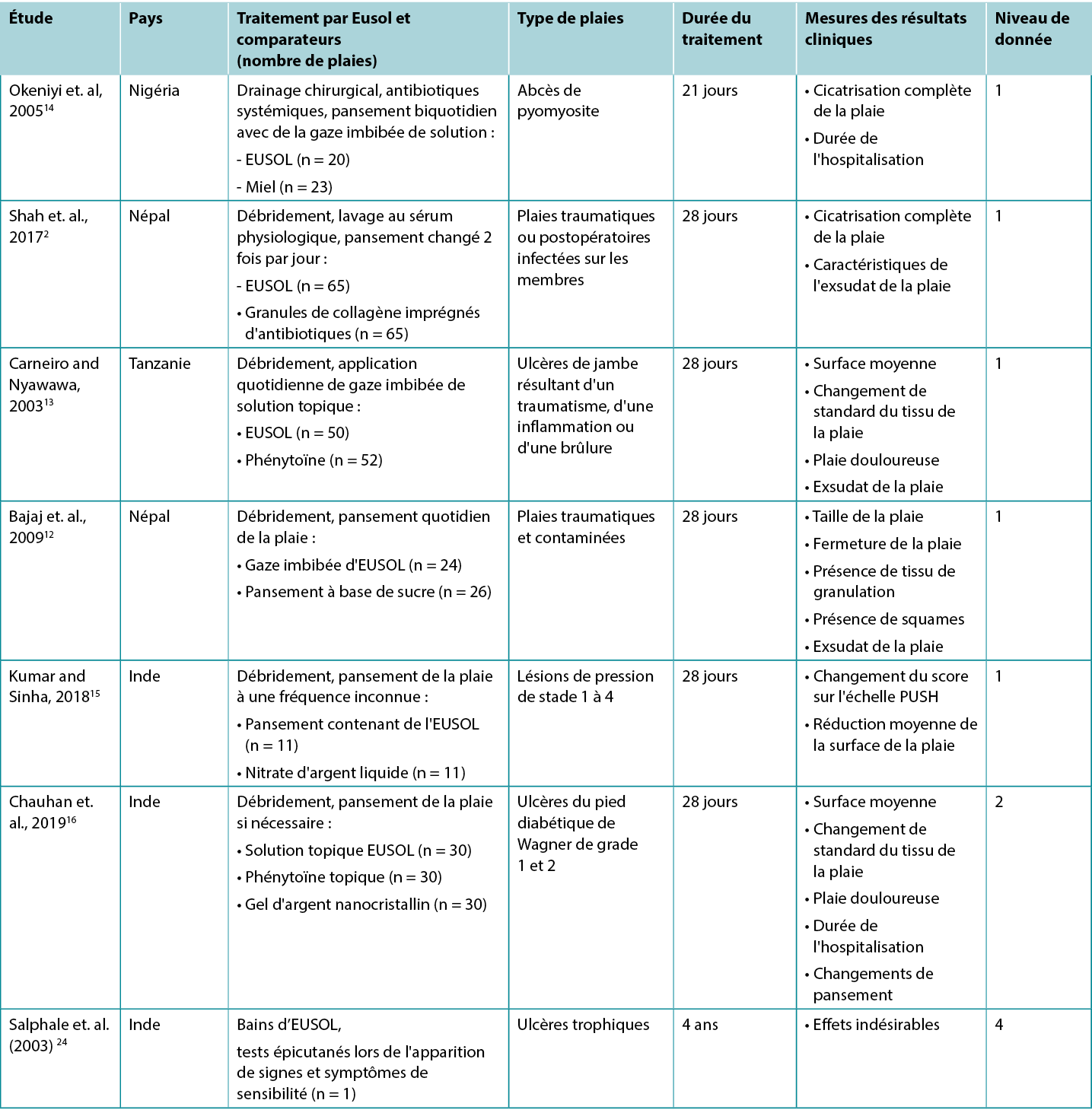
Solution EUSOL pour améliorer la cicatrisation des plaies
Cinq études de niveau 1 et une étude de niveau 2 ont fourni des données probantes sur EUSOL pour l’amélioration la cicatrisation de plaies d'étiologies diverses. Dans le premier ECR14 (32 enfants avec 43 plaies), qui présentait un risque de biais modéré, les plaies ouvertes (abcès de pyomyosite excisés chirurgicalement) ont été bandées deux fois par jour avec de la gaze imbibée d'EUSOL ou de la gaze imbibée de miel. Après trois semaines de suivi, 55 % des abcès traités par EUSOL ont complètement cicatrisé, contre 87 % dans le groupe traité au miel (p < 0,047)14 (niveau 1).
Le deuxième ECR,2 qui présentait également un risque élevé de biais, faisait état de l'utilisation de pansements EUSOL pour traiter les plaies traumatiques infectées. Dans cette étude, EUSOL a été comparée à un pansement de granules de collagène imprégné d'antibiotiques. Après 4 semaines de suivi, 53,8 % des plaies traitées par EUSOL étaient complètement cicatrisées, et les autres plaies présentaient un tissu de granulation sain. Ce résultat n'est pas statistiquement différent de celui du groupe traité avec des granules de collagène, dont 69 % ont complètement cicatrisé, les autres ayant obtenu une granulation saine (p = 0,416)2 (niveau 1).
Une comparaison entre la gaze imbibée d'EUSOL et les pansements à base de sucre est rapportée dans un troisième ECR12 à haut risque de biais, mené sur des plaies traumatiques et contaminées (n = 50). Après quatre semaines de pansements quotidiens, les plaies traitées avec un pansement EUSOL ont obtenu des résultats supérieurs aux plaies traitées avec des pansements à base de sucre, y compris la réduction de la taille de la plaie (p = 0,0042), l'obtention d'une granulation (p = 0,0048) et le taux de fermeture de la plaie (p = 0,008)12 (niveau 1).
Dans un quatrième ECR13 présentant un risque de biais élevé, des ulcères de jambe chroniques (n = 102) ont été traités quotidiennement par débridement suivi d’une application d'EUSOL ou de phénytoïne topique. Les ulcères qui ont atteint une granulation uniforme ont été traités par des greffes de peau. La surface de la plaie et la présence de tissu de granulation ont été évaluées chaque semaine pendant la période de traitement de 28 jours. Les ulcères traités avec EUSOL ont montré une réduction moyenne de la surface d'environ 60 % sur 28 jours ; cette amélioration semble être inférieure à celle du groupe traité avec la phénytoïne topique (p = non rapporté). Bien que 86 % des ulcères traités avec EUSOL aient atteint une granulation saine au bout de 28 jours, il s'agissait d'un résultat statistiquement plus faible que celui du groupe phénytoïne13 (niveau 1).
Le dernier ECR15, qui présentait également un risque de biais élevé, comparait une gaze imbibée d'EUSOL à un liquide topique à base de nitrate d'argent (0,01 % p/v) pour traiter les lésions de pression (LP) chez des personnes souffrant de lésions de la moelle épinière (n = 22). Les groupes ont été appariés en fonction de la sévérité des LP au départ. Toutes les LP de stade 1 ont guéri dans les deux semaines suivant le traitement. Pour les LP de stade 2, la taille des plaies des patients traités par EUSOL a diminué en moyenne de 47 % après quatre semaines. Pour les LP de stade 3 traitées avec EUSOL, la réduction moyenne de la surface de la plaie à 4 semaines était de 17 %, contre une réduction moyenne de 26 % pour le traitement à base d'argent (valeurs p = non communiquées). Aucune LP de stade 4 n'a cicatrisé au cours des 4 semaines de l'étude15 (niveau 1).
Dans une étude comparative16, qui présentait un risque élevé de biais, la solution EUSOL a été comparée à la poudre de phénytoïne et au gel d'argent nanocristallin pour favoriser la cicatrisation des UPD de Wagner de grade 1 (ulcère superficiel) et de grade 2 (ulcère profond). Les UPD ont été débridées chirurgicalement si nécessaire et traitées pendant quatre semaines avec le traitement topique choisi. Après 4 semaines de suivi, 73,33 % les UPD traités avec la solution EUSOL présentaient un tissu de granulation dans le lit de la plaie (p > 0,05). Au départ, la taille moyenne de l'ulcère dans le groupe traité par EUSOL était de 16,66 cm2 ± 7,52 cm2, se réduisant à une moyenne de 7,7 cm2 ± 6,65 cm2 à la fin des quatre semaines, ce qui peut être cliniquement significatif pour les patients. Cependant, les UPD traités par EUSOL ont obtenu des résultats statistiquement significativement inférieurs à ceux des UPD traités par la poudre de phénytoïne ou le gel d'argent nanocristallin16 (niveau 2).
Solution EUSOL pour réduire les signes et symptômes d'infection des plaies
Quatre des études susmentionnées2, 12, 13, 16 ont fait état d'une réduction des signes et symptômes associés à l'infection locale de la plaie, notamment la douleur associée à la plaie, l'exsudat de la plaie et une surface de la plaie squameuse.41
Dans l'étude comparant EUSOL à la phénytoïne topique, les personnes souffrant d'ulcères traités par EUSOL ont fait état d'une réduction de la douleur sévère associée à la plaie et d'une amélioration de l'exsudat de la plaie dès la deuxième semaine de t raitement13. Bien que le groupe phénytoïne topique ait obtenu des résultats supérieurs à la deuxième semaine, il n'y avait pas de différence statistiquement significative à 28 jours. Dans l'étude comparant les pansements EUSOL aux pansements à base de sucre, moins de plaies traitées avec EUSOL présentaient une surface de plaie squameuse (p = 0,0034) et un niveau d'exsudat (p = 0,011) après quatre semaines.12 Les plaies infectées qui ont été traitées avec EUSOL dans l'ECR de Shah et al. (2017)2 ont montré une amélioration des caractéristiques de l'exsudat de la plaie dès la quatrième semaine de traitement, sans différence statistiquement significative (p = 0,24) avec le profil d'exsudat du groupe de granules de collagène imprégnés d'antibiotiques2(niveau 1).
Dans l'étude menée sur les UPD16, la solution EUSOL a été associée à une légère réduction de la douleur après quatre semaines de traitement (réduction moyenne du score de douleur de 1,87 ± 1,57 sur une échelle visuelle analogique à cinq points). Il est peu probable que cela soit cliniquement significatif.16 (niveau 2).
Considérations relatives à l'utilisation
Effets indésirables rapportés avec les hypochlorites traditionnels
- Une sensibilité de contact aux hypochlorites traditionnels a été observée dans de rares cas24 (niveau 4).
- Bien que des irritations cutanées34, des douleurs légères lors de l'application9 et des brûlures chimiques lors de l'utilisation de la solution à des concentrations inappropriées16 aient été associées aux hypochlorites traditionnels, ces effets indésirables n'ont pas été observés dans les études rapportées dans cette synthèse de données.
Préparation de solutions dans des environnements à faibles ressources
- Une solution de Dakin® à 0,5 % peut être préparée avec 25 mL d'eau de Javel mélangée à 2 cuillères à café de bicarbonate de soude dans 1 litre d'eau propre40. La solution a une courte durée de conservation,28, 29 et des recherches comparatives ont suggéré que la solution peut avoir un effet antibactérien inadéquat dans les 24 heures suivant la préparation9. La solution doit donc être préparée toutes les 24 heures40.
- Une solution EUSOL peut être préparée avec 12,5 g d'hypochlorite de sodium (poudre blanchissante) et 12,5 g d'acide borique combinés dans 1 L d'eau propre et tiède. La solution se conserve peu de temps et il est recommandé de la préparer immédiatement avant l’utilisation2, 24, 32, 33.
Conflit d'intérêt
Les auteurs ne déclarent aucun conflit d'intérêt conformément aux normes du Comité international des éditeurs de revues médicales (ICMJE).
À propos des synthèses de données WHAM
Munn Z., Lockwood C., Moola S. Le développement et l'utilisation de synthèses de données pour les systèmes d'information sur les soins : Une approche simplifiée d'examen rapide, Worldviews Evid Based Nurs. 2015;12(3):131-8.
Les méthodes sont décrites dans les ressources publiées par l'Institut Joanna Briggs21-23 et sur le site internet de la collaboration WHAM : http://WHAMwounds.com. Les synthèses de données WHAM sont soumises à l’examen de pairs membres d’un groupe de référence international multidisciplinaire d'experts en plaies. Les synthèses de données WHAM fournissent une synthèse des meilleures données probantes disponibles sur des sujets spécifiques et font des suggestions qui peuvent être utilisées pour renseigner la pratique clinique. Les données contenues dans cette synthèse doivent être évaluées par des professionnels dûment formés et spécialisés dans la prévention et la prise en charge des plaies, et les données doivent être considérées dans le contexte de l'individu, du professionnel, du cadre clinique et de tout autre information clinique pertinente.
Copyright © 2023 Wound Healing and Management Collaborative, Curtin Health Innovations Research Institute, Université Curtin
Author(s)
Emily Haesler
PhD P Grad Dip Adv Nurs (Gerontics), BN, FWA
Adjunct Professor, Curtin University, Curtin Health Innovation Research Institute, Wound Healing and Management (WHAM) Collaborative
Keryln Carville
RN PhD STN(Cred) CF FWA
Professor, Silver Chain Group and Curtin University, Curtin Health Innovation Research Institute, Wound Healing and Management (WHAM) Collaborative
References
- Broughton G, Burris D. War and medicine: A brief history of the military’s contribution to wound care through World War I. Adv Wound Care, 2010;1:3-7.
- Shah AB, Maharjan R, Shrestha BP, Chaudhary P. A randomized controlled trial comparing EUSOL versus antibiotic loaded collagen granules as dressing agents in the management of traumatic infected wounds. Int J Orthop Sci 2017;3(2):157-162. DOI: 10.22271/ortho.2017.v3.i2c.24
- Alpha Medical Solutions. 2018. Milton® Anti-bacterial solution. Available from: https://www.alphamedicalsolutions.com.au/content/Milton-Anti-Bacterial-Solution-MSDS-Feb-2019.pdf. [Accessed Jan 2023].
- Ataman Chemicals. 2020. Sodium hypochlorite. Available from: https://www.atamanchemicals.com/sodium-hypochlorite_u24324/. [Accessed Jan 2023].
- Black J. Ten top tips: Wound irrigation. Wounds Int, 2022;13(2):2-4.
- Heggers J, Sazy J, Stenberg B, Strock L, McCauley R, Hernom D, Robson M. Bacterial and wound healing properties of sodium hypochlorite solutions: The 1991 Lindberg Award. J Burn Care Rehabil, 1991;12(5):420-4.
- Lessing M, McNulty A. Intermittent exposure to wound irrigation solutions disrupts P. aeruginosa and S. aureus immature biofilms in vitro. Wound Rep Reg Conf: 22nd Annual Meeting of the Wound Healing Society, 2012;20(2):A28.
- Lineaweaver W, McMorris S, Soucy D, Howard R. Cellular and bacterial toxicities of topical antimicrobials. Plast Reconstr Surg, 1985;75(3):394-6.
- Cotter J, Fader R, Lilley C, Herndon D. Chemical parameters, antimicrobial activities, and tissue toxicity of 0.1 and 0.5% sodium hypochlorite solutions. Antimicrob Agents Chemother, 1985;28(1):118-22.
- Wilson J, Mills J, Prather I, Dimitrijevich S. A toxicity index of skin and wound cleansers used on in vitro fibroblasts and keratinocytes. Adv Skin Wound Care, 2005;18(7):373-8.
- Bennett L, Rosenblum R, Perlov C, Davidson J, Barton R, Nanney L. An in vivo comparison of topical agents on wound repair. Plast Reconstr Surg, 2001;108(3):675-68.
- Bajaj G, Karn N, Shrestha B, Kumar P, Singh M. A randomised controlled trial comparing eusol and sugar as dressing agents in the treatment of traumatic wounds. Tropical Doctor, 2009;39(1):1-3.
- Carneiro P, Nyawawa E. Topical phenytoin versus EUSOL in the treatment of non-malignant chronic leg ulcers. East Afr Med J, 2003;80(3):124-9.
- Okeniyi J, Olubanjo O, Ogunlesi T, Oyelami O. Comparison of healing of incised abscess wounds with honey and EUSOL dressing. JACM, 2005;11(3):511-3.
- Kumar A, Sinha VK. Comparative study of EUSOL and Silverstream in healing of pressure sore in traumatic spinal cord injury patients. Int J Orthop Sci 2018;4(1):228-234. DOI: 10.22271/ortho.2018.v4.i1d.33
- Chauhan A, Patel BK, Sharma PP, Mehta FS. A prospective, randomized, controlled study For efficacy of phenytoin sodium powder, Eusol solution, nanocrystalline silver gel in diabetic foot ulcer. International Journal of Contemporary Surgery, 2019;7(2):1-7.
- Jaber D, Younes N, Khalil E, Albsoul-Younes A, Mismar A, Nassar M, Al-Bakri A. Effect of diluted Dakin’s solution versus standard care on diabetic foot ulcer management: A randomized controlled trial. J Am Pod Med Assoc, 2022;112(1):1-11.
- Lewandowski L, Purcell R, Fleming M, Gordon WT. The Use of Dilute Dakin’s Solution for the Treatment of Angioinvasive Fungal Infection in the Combat Wounded: A Case Series. Military Medicine, 2013;178(4):e503-e7.
- Cornwell P, Arnold-Long M, Barss S, Varnado M. The use of Dakin’s solution in chronic wounds: a clinical perspective case series. J Wound Ostomy Continence Nurs, 2010;37(1):94-104.
- Duarte B, Cabete J, Formiga A, Neves J. Dakin’s solution: is there a place for it in the 21st century? Int Wound J, 2017;14(6):918-20.
- Aromataris E, Munn Z, editors. Joanna Briggs Institute Reviewer’s Manual. https://reviewersmanual.joannabriggs.org/, Joanna Briggs Institute; 2017.
- Joanna Briggs Institute Levels of Evidence and Grades of Recommendation Working Party. New JBI Grades of Recommendation. Adelaide: Joanna Briggs Institute; 2013.
- The Joanna Briggs Institute Levels of Evidence and Grades of Recommendation Working Party. Supporting Document for the Joanna Briggs Institute Levels of Evidence and Grades of Recommendation. www.joannabriggs.org: Joanna Briggs Institute; 2014.
- Salphale P, Shenoi S. Contact sensitivity to calcium hypochlorite. Contact Derm, 2003;48(3):162.
- Doughty D. A rational approach to the use of topical antiseptics. J Wound Ostomy Cont Nurs, 1994;21(6):224-31.
- Barrigah-Benissan K, Ory J, Dunyach-Remy C, Pouget C, Lavigne JP, Sotto A. Antibiofilm properties of antiseptic agents used on Pseudomonas aeruginosa isolated from diabetic foot ulcers. Int J Mol Si, 2022;23(19).
- Huang C, Tao S, Yuan J, Li X. Effect of sodium hypochlorite on biofilm of Klebsiella pneumoniae with different drug resistance. Am J Infect Control, 2022;50(8):922-8.
- Levine JM. Dakin’s Solution: Past, Present, and Future. Adv Skin Wound Care, 2013;26(9):410-4.
- Serena T, Serena L, Al-Jalodi O, Patel K, Breisinger K. The efficacy of sodium hypochlorite antiseptic: a double-blind, randomised controlled pilot study. J Wound Care, 2022;31(2):S32-S5.
- Georgiadis J, Nascimento VB, Donat C, Okereke I, Shoja MM. Dakin’s Solution: “One of the most important and far-reaching contributions to the armamentarium of the surgeons”. Burns, 2019;45(7):1509-17.
- Ueno CM, Mullens CL, Luh JH, Wooden WA. Historical review of Dakin’s solution applications. J Plast Reconstr Aesthet Surg, 2018;71(9):e49-e55.
- Shah A. Exposure - Eusol treatment for burn wounds. Burns Incl Therm Inj, 1985;11:297-300.
- Leaper D. Eusol: Still awaiting proper clinical trials. BMJ, 1992;304(6832):930.
- Catlin L. The use of hypochlorite solutions in wound management. BJN, 1992;1(5):226-9.
- Duarte B, Formiga A, Neves J. Dakin’s solution in the treatment of severe diabetic foot infections. Int Wound J, 2020;17:277-84.
- Farrow S, Toth B. The place of Eusol in wound management. Nurs Stand, 1991;5(22):25-7.
- Eftekharizadeh F, Dehnavieh R, Noori Hekmat S, Mehrolhassani MH. Health technology assessment on super oxidized water for treatment of chronic wounds. Med J Islam Repub Iran, 2016;30:384.
- Haesler E. Evidence Summary: Super-oxidised solutions for chronic wounds. Wound Practice and Research, 2020;28(3):145-7.
- Benskin LL. A review of the literature informing affordable, available wound management choices for rural areas of tropical developing countries. Ostomy Wound Manage, 2013. Oct;59(10):20-41.
- Ottesen TD, Qudsi RA, Kahanu AK, Baptiste BJ, Woolley PM, Socci AR, Dyer GSM. The Continued Utility and Viability of Dakin’s Solution in Both High- and Low-resource Settings. Arch Bone Jt Surg, 2020. Mar;8(2):198-203.
- International Wound Infection Institute (IWII). Wound Infection in Clinical Practice. Wounds International; 2022.

