Volume 43 Number 4
Examining the association of immunosuppressants and wound healing: a narrative review
Aria Appoo, Brandon L Christensen, Ranjani Somayaji
Keywords wound healing, Calcineurin inhibitors, glucocorticoids, immunosuppressants, monoclonal antibodies, mTOR inhibitors
For referencing Appoo A, Christensen BL and Somayaji R . Examining the association of immunosuppressants and wound healing: a narrative review. WCET® Journal 2023;43(4):32-39.
DOI
10.33235/wcet.43.4.32-39
Submitted 1 February 2023
Accepted 23 May 2023
Abstract
Objective A review of recent literature to provide clinicians with an understanding of how different classes of immunosuppressants affect wound healing.
Data sources A literature search was conducted in PubMed, Google Scholar, and the University of Calgary Health Sciences Library.
Study Selection Studies chosen for inclusion were screened initially based on title using key words including “immunosuppressive medication, wound healing, and immunosuppression.” If the title and/or abstract contained these key words and addressed wound healing related to immunosuppressant medications and had been published after 2000, they were included in the review. When human data was not available for an immunosuppressant (class), animal studies were included.
Data Extraction Selected papers underwent full text review and summarisation.
Data Synthesis Data were synthesised in a descriptive manner. Corticosteroids and mechanistic target of rapamycin (mTOR) inhibitors most consistently demonstrate detrimental effects on wound healing. For other classes of immunosuppressants, evidence is limited with varying effects on wound healing described.
Conclusions Larger high-quality studies are required to better understand the effects of immunosuppressants particularly with development of new classes of these drugs on wound healing in order to identify those at highest risk of impairing wound healing.
Introduction
Immunosuppressants are medications with a variety of indications including in solid organ and hematopoietic transplants along with autoimmune diseases. They function by suppressing the activity of various components of the adaptive immune system thus diminishing the cascade of inflammatory response to normal host tissue or modulating the natural rejection response to transplanted materials.1 The main classes of immunosuppressants are corticosteroids/glucocorticoids,2,3 calcineurin inhibitors,2,4,5 mechanistic target of rapamycin (mTOR) inhibitors,2,4 polyclonal antibodies,2,4 monoclonal antibodies,2,4 and antiproliferative agents.2 For the purpose of this review, wounds are defined as an opening in the skin as a result of surgery, trauma, or disease that is susceptible to infection.
The immune system plays an important role in the prevention of infection but also the healing process of wounds, with the inflammatory effects leading to cellular proliferation and secretion of important intra and extracellular components.6 With immunosuppressants, the immune system is modulated, thus potentially affecting a wound’s healing time and susceptibility to infection.7 With a growing number of patients on immunosuppressing medications, particularly post-surgical transplant patients, the effect of immunosuppressants on wound healing is an important issue to be considered. This review article aims to provide clinicians with an understanding of how different classes of immunosuppressants affect wound healing.
Materials/methods
A literature search between 2000 through 2021 was conducted using the generic names of a number of commonly used immunosuppressants (glucocorticoids/corticosteroids, mTOR inhibitors, methotrexate, monoclonal antibodies, polyclonal antibodies, calcineurin inhibitors, mycophenolate, azathioprine) as well as the terms “wound healing” and “immunosuppression”. The primary database searched was PubMed. This was supplemented by Google Scholar and the University of Calgary Health Science Library database. When possible, the search was in the following format “immunosuppressant name [MeSH Terms] AND “wound healing [MeSH Terms].” If the immunosuppressant name was not available as a MeSH term, then the term was searched with no restriction applied. Article titles were then screened for relevance to the review based on whether wound healing was described in relation to the immunosuppressive medication/class. The abstract was screened similarly and included in the review accordingly. If the article compared various immunosuppressants, discussed their effects on wound healing, measured wound healing or deleterious effects on wounds it was considered relevant. If search terms did not identify human subject studies, then studies that used animals to evaluate immunosuppressive effects on wound healing were included. When no data was available from 2000 onwards, a historic search was conducted for the relevant immunosuppressive medications.
All included studies were summarised descriptively including immunosuppressive mechanism of action, study subjects, and evidence of effects on wound healing.
Results
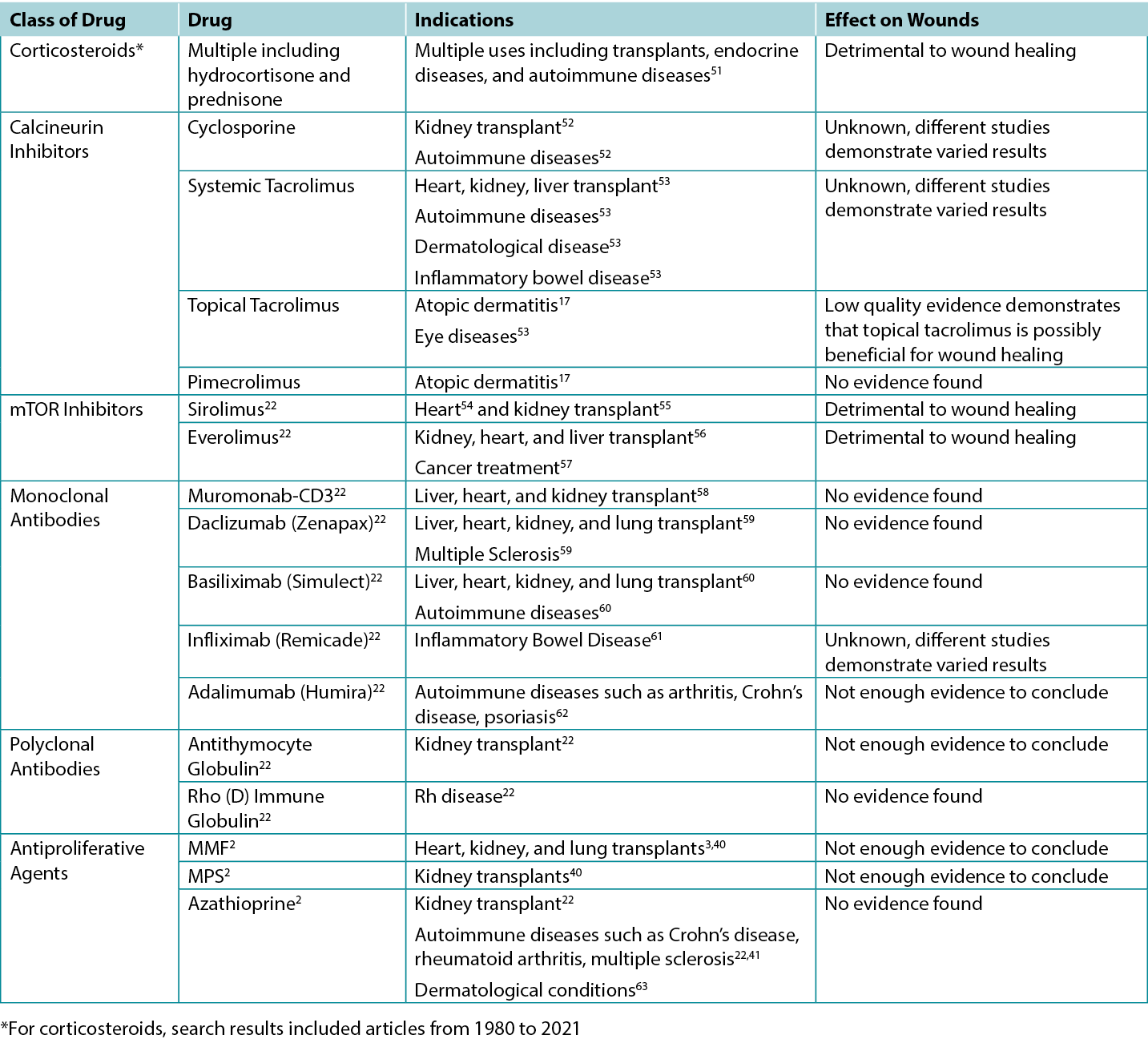
The studies screened relevant to this review were used to inform the various categories outlined below. A total of 200 article titles and abstracts were initially screened and 61 articles were included for review. Summary tables highlighting the results of clinical and animal studies are summarised in Table 1. The specific indications for various immunosuppressants including their possible impacts on wounds are outlined in Table 2.
Table 1. Studies Comparing the Effects of Different Immunosuppressants on Wounds
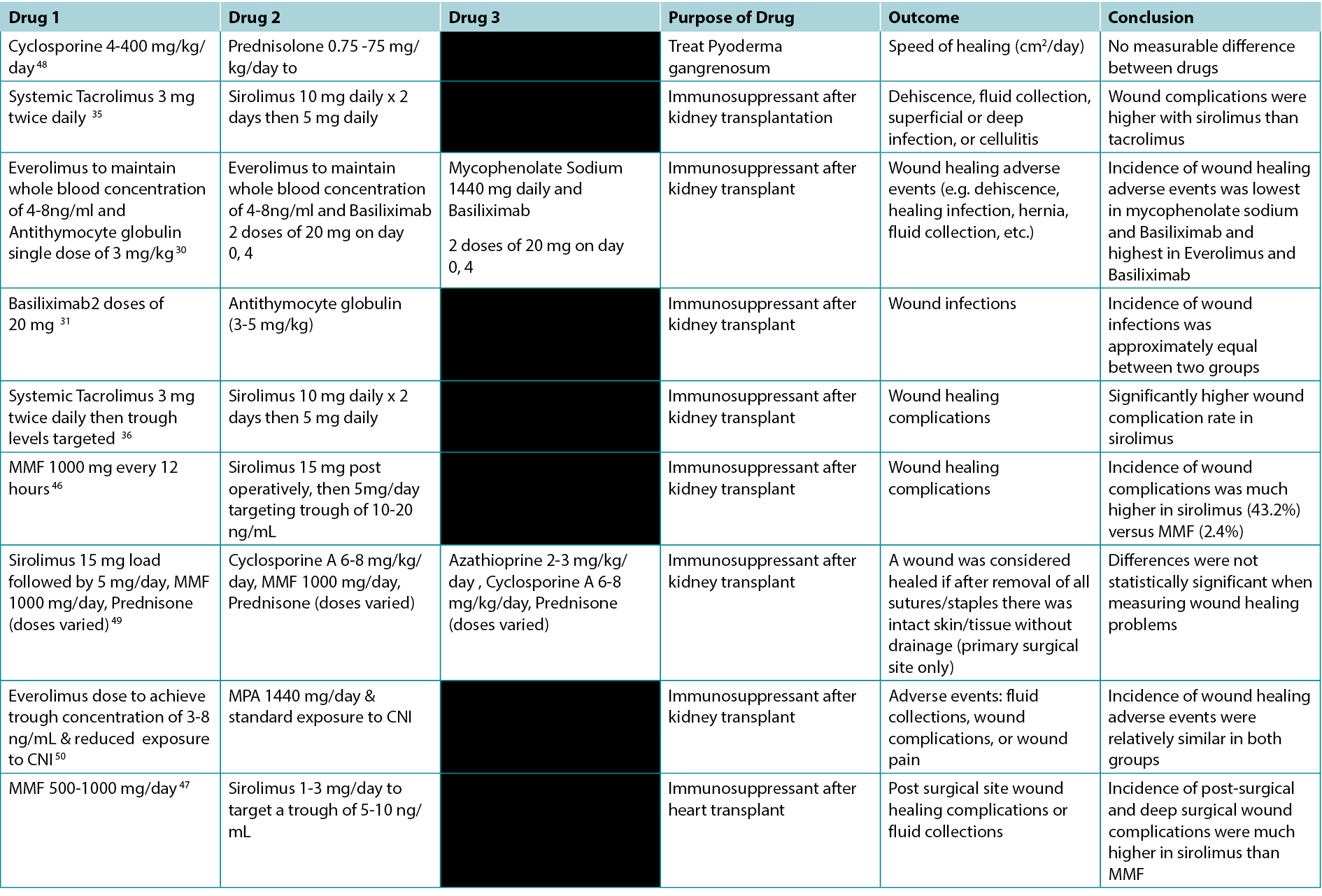
Table 2. Overview of Indications and Wound Effects of Various Immunosuppressants
Calcineurin Inhibitors
Calcineurin inhibitors (CNI) are used as immunosuppressants for a variety of different autoimmune diseases, organ transplants, dermatological conditions, and in chronic wounds.8 There are three main types of CNI’s: cyclosporine (systemic), tacrolimus (systemic and topical), pimecrolimus (topical).9 CNI’s work by binding to part of the calcineurin molecule found in human cells, thus stopping the release of certain cytokines that are responsible for activating T cells.8 Therefore, CNI’s disable one of the main arms of the body’s adaptive immune response.
Systemic
There are a lack of studies directly focusing on the effects of CNI’s on wound healing in humans; however, many basic science studies on animals have been performed. Two such studies using rats compared the effect of various doses of systemic tacrolimus versus a control, testing the breaking strengths of the wounds created through surgery. One of the rat studies concluded that tacrolimus does not affect wound healing10 while the other study concluded that tacrolimus is detrimental to wound healing.11 At the same time, case reports using systemic tacrolimus as a treatment for ulcers in a person with lichen planus and pyoderma gangrenosum demonstrated treatment success with this therapy.12
No recent human studies were found regarding the effect of cyclosporine and wound healing. Two other studies using rats also yielded contradictory results. These rat studies focused on the effects of cyclosporine on different markers in the body that signify effective wound healing. One study comparing cyclosporine to methylprednisone demonstrated that cyclosporine had no suppressive effect on the various inflammatory and biochemical markers compared to the glucocorticoid therapy13 whereas the other study showed that cyclosporine had a negative effect on the markers.14 In a different study, after receiving a lung transplant, dogs were assigned to a specific immunosuppressant drug or no immunosuppressant drug and, similar to control, Cyclosporine A was shown to have no significant effect on the healing of the surgical wound as measured by breaking strength in comparison to glucocorticoid and azathioprine immunosuppression.15 Overall, the literature on systemic calcineurin inhibitors and wound healing is dated with a heterogeneity of comparators and mixed results on wound healing.
Topical
Calcineurin inhibitors (tacrolimus and pimecrolimus) are used as topical ointments most commonly for dermatological conditions such as atopic dermatitis but also for chronic dermatologic conditions such as pyoderma gangrenosum.16–18 Some case studies have shown tacrolimus effective at healing complex leg ulcers in the context of venous insufficiency or necrobiosis lipoidica, when regular treatment strategies have been ineffective.19,20 Furthermore, a rat-based study with acute cutaneous injury demonstrated that wounds treated with topical tacrolimus healed equally as quickly as the control (petrolatum).21
Monoclonal Antibodies:
A variety of different monoclonal antibodies (mAb) therapies exist with indications in transplants and autoimmune disorders such as rheumatoid arthritis and psoriasis.22 In general, mAb work by binding to different receptors and antigens to inhibit the effect of cytokines and other signal pathways that activate the immune system.22 A small prospective cohort study among patients with rheumatoid arthritis undergoing orthopedic surgery demonstrated that there was no increased risk of surgical wound infections or healing complications in patients on infliximab compared to conventional therapy.23 Furthermore, a case report claims that topical infliximab was helpful in healing leg ulcers that were resistant to standard treatment suggesting that inhibiting tumor necrosis factor alpha is helpful to wound healing.24 Similar findings were concluded in a case report for treatment of pyoderma gangrenosum with infliximab resulting in improvement of the ulcer.25 Inhibiting tumor necrosis factor alpha was shown to be further associated with wound healing in venous leg ulcers through the use of Adalimumab systemically.26 However, another study used infliximab on rat abdominal wounds and demonstrated that the tensile strength was significantly lower in the wounds of rats who had been given infliximab compared to those who were the control.27 Overall, the limited literature on the subject to date suggests clinical outcomes thus far are favorable in terms of wound healing.
Polyclonal Antibodies
Polyclonal antibodies (pAb’s) are very similar to mAb’s in function, with slightly varied mechanism of action.28,29 Unlike mAb’s, a group of polyclonal antibodies are created from many different lines of B cells and within the group different pAb’s bind to different epitopes of an antigen. In contrast, mAb’s come from a single line of B cells and can bind to only one antigen.28,29 There are two main pAb’s: Antithymocyte Globulin and Rho (D) Immune Globulin.22 Antithymocyte Globulin also known as Antihuman Thymocyte Globulin is most commonly used as an immunosuppressant after kidney transplantation and works by binding to a variety of lymphocytes and depleting the number of T cells in the body.22 Rho (D) Immune Globulin is used in pregnancies where the mother is Rh- and the fetus is Rh+ and essentially stops the formation of anti Rh+ antibodies in the mother.22
Few studies looking at the effects of pAb’s on wound healing were found. Two studies outlined the effects of antithymocyte globulin and Basiliximab. The first study in patients with renal transplants, where both drugs were combined with everolimus, showed higher rates of adverse effects of wound healing in Basiliximab. 30 The second study demonstrating that the incidence of wound infections was equal in patients taking Basiliximab versus antithymocyte globulin post renal transplant.31 Since white blood cells play a key role in wound healing through secreting necessary cytokines and preventing infection,32 it would be reasonable to hypothesise that antithymocyte globulin will affect wound healing since it reduces the number of white blood cells as well as their regulatory mechanisms.
mTOR Inhibitors
Mechanistic target of rapamycin (mTOR) inhibitors are immunosuppressive drugs that works by interacting with proteins in complex signalling pathways to prevent cells moving into the S phase of the cell cycle and therefore suppressing proliferation.3,22 mTOR predominantly targets T cells, but can also affect B cells.3 Interestingly, mTOR can cause an increase of production of certain inflammatory cytokines such as interleukin-6 and decrease production of interleukin-10, an anti-inflammatory cytokine.3 There are two main mTOR inhibitors: sirolimus and everolimus.3,22 In general, mTOR inhibitors have a variety of applications including cancer therapy.3,22 As an immunosuppressant, they are used after transplants.3,22 Everolimus has been shown to inhibit the proliferation of fibroblast in in vitro models33 suggesting that everolimus could have negative consequences for wound healing since fibroblasts are essential for creating an extracellular matrix and creating a frame for other cells.34 In a study comparing sirolimus and systemic tacrolimus, sirolimus had a wound complication rate of 47% compared to tacrolimus with only 8%.35 This is consistent with another study by Larson et al demonstrating higher wound complications with sirolimus compared to tacrolimus.36 Interestingly, obese patients on sirolimus had very high rates of wound complications leading to the study excluding all patients with obesity.36 In line with previous findings, a study on rats showed that increased sirolimus doses decreases wound strength, which the authors hypothesising this effect may be due to lower levels of VEGF and nitric oxide in rats receiving higher doses of sirolimus.37 In one review authors concluded that mTOR inhibitors are harmful to wound healing in high doses, but seem to have a neutral effect in low does.38 Given early concerns with mTOR inhibitors and wound healing, regimens using these immunosuppressive agents have evolved with lower doses of the mTOR inhibitors and combination therapy. In the large TRANSFORM randomised control trial investigators compared everolimus plus reduced dose CNI to mycophenolic acid plus standard dose CNI (standard care) in patients with renal transplants and showed wound related adverse events were not statistically different (20.6% vs 17.3%; RR 1.19 95%CI 0.99 to 1.43).39 One limitation of this study was close monitor of everolimus concentrations and difficulties achieving the targeted plasma concentrations C0 between 3 and 8 ng/mL.39 Overall, review of the current literature is suggestive that mTOR inhibitors have a detrimental effect on wound healing, especially at higher doses, and that improved dosing regimens may lessen or mitigate this risk.
Antiproliferative Agents
There are three regularly used antiproliferative agents: Mycophenolate mofetil (MMF) and Mycophenolate sodium (MPS) (both inosine monophosphate dehydrogenase (IMPDH) inhibitors) and azathioprine.2,40 IMPDH inhibitors have a similar effect to mTOR inhibitors in terms of their mechanism of immunosuppression. In the body, MMF and MPS are converted into mycophenolic acid which blocks a portion of a pathway that is crucial for DNA synthesis, to decrease proliferation of T cells and B cells.2,5,40 MMF is used for its immunosuppressive effect in heart, kidney, and lung transplants.3,40 MPS is used for kidney transplants.40 Azathioprine is used as an immunosuppressive drug for kidney transplants and autoimmune diseases including rheumatoid arthritis, Crohn’s disease, and multiple sclerosis.22,41 In the body, azathioprine reacts with glutathione and is converted into 6-mercaptupurine after which additional metabolites are generated ultimately blocking purine synthesis and stimulation of T-cells.3,22
When a study compared two different doses of MMF in kidney transplant recipients, incidence of wounds requiring surgical intervention were not significantly different, similarly for wounds treated with local wound care.42 Based on review of article titles as part of our search, no studies regarding the sole effect of azathioprine on external wound healing in humans were found. When azathioprine was compared to a placebo in a rat study, the wounds of the rats who were on azathioprine took longer to heal than those on the placebo suggesting that azathioprine can have detrimental effects on wound healing, but the extent that it would affect humans is unclear.43
Anti-metabolite
Methotrexate is a commonly used folate antagonist immunosuppressive agent, with indications in many rheumatologic disorders. It also has antineoplastic activity in higher doses. Upon absorption, it enters the cell and is converted to methotrexate polyglutamates where it competes for dihydrofolate reductase thus preventing the transformation of folic acid for its use in the building of nucleic acids.6 Like other agents described, there is experimental animal studies with in vitro studies suggesting impairment in wound healing but these effects have not been borne out in clinical studies, particularly in post-surgical wounds.6 Thus, it is recommended this drug be continued postoperatively.
Corticosteroids/Glucocorticoids
Glucocorticoids prevent the formation of inflammatory chemicals like cytokines, cell adhesion molecules, and complement factors.3 By inhibiting interleukin-2 formation, glucocorticoids also prevent T cell proliferation and activation.22 They also impair monocytes and B cells.3,22 Glucocorticoids were the first antirejection drug created, but as time has passed, there has been a movement to phase them out due to their serious side effects.3,22 There is consensus that glucocorticoids are highly detrimental to wound healing since they interfere with many key stages of wound healing such as collagen deposition and synthesis, angiogenesis, fibroblast proliferation, growth factors, and phagocytosis among others.2,3,44,45
Practical considerations for health care providers
Persons with compromised immune systems (due to medications, co-morbidities or age extremes) require additional considerations for chronic wound management. Specific to immunosuppressive medications, health care providers should take a careful history not only of the medications and dosing (including changes in dosing), but also of the underlying conditions requiring these medications (e.g. autoimmune disorders, organ transplantation). As many immunosuppressive medications can impair wound healing, it is crucial for health care providers to assess healing potential early on to set and manage patient expectations. Early referral to medical or surgical specialists to assist with wound care and a team-based approach will be essential given the increased complexity of these individuals. In some cases where wounds are not healing, alternate goals of care for the wound may need to be set (e.g. maintenance or non-healable) if immunosuppressive doses cannot be reduced (assuming it is contributing to poor healing) and should be done in consultation with their primary or specialist care providers. As individuals and populations with comorbidities live longer, taking care of persons with chronic wounds on immunosuppressive medications will become increasingly common and must be recognised early by the wound care clinicians.
Discussion
With the ongoing advances in medicine, the need for immunosuppression in the context of transplant, autoimmune disease and malignancy has increased. In our review, we highlight the poverty of robust studies in this field and highlighted the mixed effects of various immunosuppression on wound healing. High quality evidence exists with respect to the deleterious effects of glucocorticoid therapy as well as mTOR therapy, particularly sirolimus on wound healing. Furthermore, when 4 studies compared sirolimus to either MMF or systemic tacrolimus, all the studies demonstrated sirolimus to be associated with an increased incidence of wound complications.35,36,46,47
The literature on agents such as systemic CNIs is mixed with some suggesting adverse effects on wounds and others suggesting benefit, necessitating additional study focusing directly on this question. Newer topical CNIs have shown little impact on delayed wound healing and in some cases benefit, but additional investigation is warranted for their use in chronic wounds directly. Reassuringly, antiproliferative agents, antimetabolite, and newer monoclonal antibiotics have not shown signal toward diminished healing. However, additional study is needed given the poverty of evidence on wound healing in mAB therapy. Overall, our review found the evidence in this area is dated with variable conclusions surrounding the effects of the immunosuppressant on wound healing. In addition, we found little evidence using human subjects. In general, when immunosuppressives are prescribed after transplants to prevent rejection, patients take more than one drug to effectively prevent rejection. Therefore, challenges exist in performing human studies evaluating the effects of individual drugs in isolation.
As we did not conduct a systematic review, certain articles may have been excluded. We did identify a few key reviews before conducting the search and ensured they were present in the search as one form of validation. As well, given the paucity of literature in this area particularly as it relates to the wound care field, a narrative review adds value to educate and increase awareness when working with individuals on these medications.
With the growing need for immunosuppression, additional study in this field is critical. Future directions include conducting more studies in animal subjects with newer classes of immunosuppressants to identify potential pathways to delayed wound healing and potential ways to mitigate such effects. In addition, more high-quality studies are required to evaluate both individual and combination immunotherapies to better understand the risks and how different immunosuppressants may impact wound healing. In order to explore immunosuppressants as a potential treatment for chronic or complex wounds, it is important for future studies to be conducted on a larger scale, control for confounding clinical factors, such as through randomised control trials.
Conclusions
In conclusion, immunosuppressants range from possibly beneficial to floridly deleterious in wound healing. While there is little conclusive evidence in this field, the effects of immunosuppressants on wound healing is worth exploring to better tailor immunosuppression to patients at risk for or experiencing chronic non-healing wounds. Reassuringly, our findings suggest not all immunosuppressants are harmful with some potentially offering benefit to wound treatment when conventional therapies has failed, opening up the possibility of a new treatment option for wounds.
Acknowledgements
University of Alberta Highschool Youth Researcher Summer Program.
Conflict of Interest
The authors declare no conflicts of interest.
Funding
The authors received no funding for this study.
Examen de l'association entre les immunosuppresseurs et la cicatrisation des plaies : une analyse narrative
Aria Appoo, Brandon L Christensen, Ranjani Somayaji
DOI: 10.33235/wcet.43.4.32-39
Resumé
Objectif Une revue de la littérature récente pour permettre aux cliniciens de comprendre comment les différentes classes d'immunosuppresseurs affectent la cicatrisation des plaies.
Sources des données Une recherche documentaire a été effectuée dans PubMed, Google Scholar et la bibliothèque des sciences de la santé de l'Université de Calgary.
Sélection des études Les études retenues pour inclusion ont été sélectionnées initialement sur la base du titre en utilisant des mots clés tels que "immunosuppresseurs, cicatrisation et immunosuppression" Si le titre et/ou le résumé contenait ces mots-clés et traitait de la cicatrisation des plaies liée aux médicaments immunosuppresseurs et avait été publié après 2000, elles ont été incluses dans la revue. Lorsque des données chez l’homme n'étaient pas disponibles pour un immunosuppresseur (classe), des études sur les animaux ont été incluses.
Extraction des données Les articles sélectionnés ont fait l'objet d'un examen complet du texte et d'un résumé.
Synthèse des données Les données ont été synthétisées de manière descriptive. Les corticostéroïdes et les inhibiteurs de la cible mécaniste de la rapamycine (mTOR) ont le plus souvent des effets néfastes sur la cicatrisation des plaies. Pour d'autres classes d'immunosuppresseurs, les données probantes sont limitées et les effets sur la cicatrisation des plaies sont variables.
Conclusions Des études plus grandes de haute qualité sont nécessaires pour mieux comprendre les effets des immunosuppresseurs, en particulier avec le développement de nouvelles classes de ces médicaments, sur la cicatrisation des plaies, afin d'identifier ceux qui présentent le risque le plus élevé d'entraver la cicatrisation des plaies.
Introduction
Les immunosuppresseurs sont des médicaments aux indications variées, notamment pour les transplantations d'organes solides et hématopoïétiques, ainsi que pour les maladies auto-immunes. Ils agissent en supprimant l'activité de divers composants du système immunitaire adaptatif, diminuant ainsi la cascade de réponses inflammatoires aux tissus normaux de l'hôte ou modulant la réponse naturelle de rejet aux matériaux transplantés1 Les principales classes d'immunosuppresseurs sont les corticostroïdes/glucocorticoïdes,2,3 les inhibiteurs de la calcineurine,2,4,5 les inhibiteurs de la cible mécaniste de la rapamycine (mTOR),2,4 les anticorps polyclonaux,2,4 les anticorps monoclonaux,2,4 et les agents antiprolifératifs.2 Dans le cadre de cette analyse, les plaies sont définies comme une ouverture dans la peau résultant d'une intervention chirurgicale, d'un traumatisme ou d'une maladie et qui est susceptible d'être infectée.
Le système immunitaire joue un rôle important dans la prévention des infections mais aussi dans le processus de cicatrisation des plaies, les effets inflammatoires entraînant une prolifération cellulaire et la sécrétion de composants intra et extracellulaires importants.6 Avec les immunosuppresseurs, le système immunitaire est modulé, ce qui peut affecter le temps de cicatrisation d'une plaie et sa susceptibilité à l’infection.7 Avec un nombre croissant de patients sous immunosuppresseurs, en particulier les patients ayant subi une transplantation post-chirurgicale, l'effet des immunosuppresseurs sur la cicatrisation des plaies est une question importante à prendre en compte. Cet article de synthèse vise à fournir aux cliniciens une compréhension de la façon dont les différentes classes d'immunosuppresseurs affectent la cicatrisation des plaies.
Matériaux/méthodes
Une recherche bibliographique a été effectuée de 2000 à 2021 en utilisant les noms génériques d'un certain nombre d'immunosuppresseurs couramment utilisés (glucocorticoïdes/corticostéroïdes, inhibiteurs de mTOR, méthotrexate, anticorps monoclonaux, anticorps polyclonaux, inhibiteurs de la calcineurine, mycophénolate, azathioprine) ainsi que les termes "cicatrisation des plaies" et "immunosuppression". La principale base de données consultée est PubMed. Ces données ont été complétées avec Google Scholar et la base de données de la bibliothèque des sciences de la santé de l'université de Calgary. Dans la mesure du possible, la recherche a été effectuée sous le format suivant : "nom de l'immunosuppresseur [termes MeSH]" ET "cicatrisation des plaies [termes MeSH]." Si le nom de l'immunosuppresseur n'était pas disponible en tant que terme MeSH, le terme a été recherché sans aucune restriction. Les titres des articles ont ensuite été examinés pour vérifier leur pertinence par rapport à l’analyse, en se basant sur le fait que la cicatrisation des plaies était décrite en relation avec le médicament ou la classe d'immunosuppresseurs. Le résumé a fait l'objet d'un examen similaire et a été inclus dans l’analyse en conséquence. Si l'article comparait différents immunosuppresseurs, discutait de leurs effets sur la cicatrisation des plaies, mesurait la cicatrisation des plaies ou les effets délétères sur les plaies, il était considéré comme pertinent. Si les termes de recherche n'ont pas permis d'identifier des études sur des sujets humains, les études utilisant des animaux pour évaluer les effets immunosuppresseurs sur la cicatrisation des plaies ont été incluses. Lorsqu'aucune donnée n'était disponible à partir de 2000, une recherche historique a été effectuée pour les immunosuppresseurs concernés.
Toutes les études incluses ont été résumées de manière descriptive, y compris le mécanisme d'action immunosuppresseur, les sujets de l'étude et les données probantes sur les effets sur la cicatrisation des plaies.
Résultats
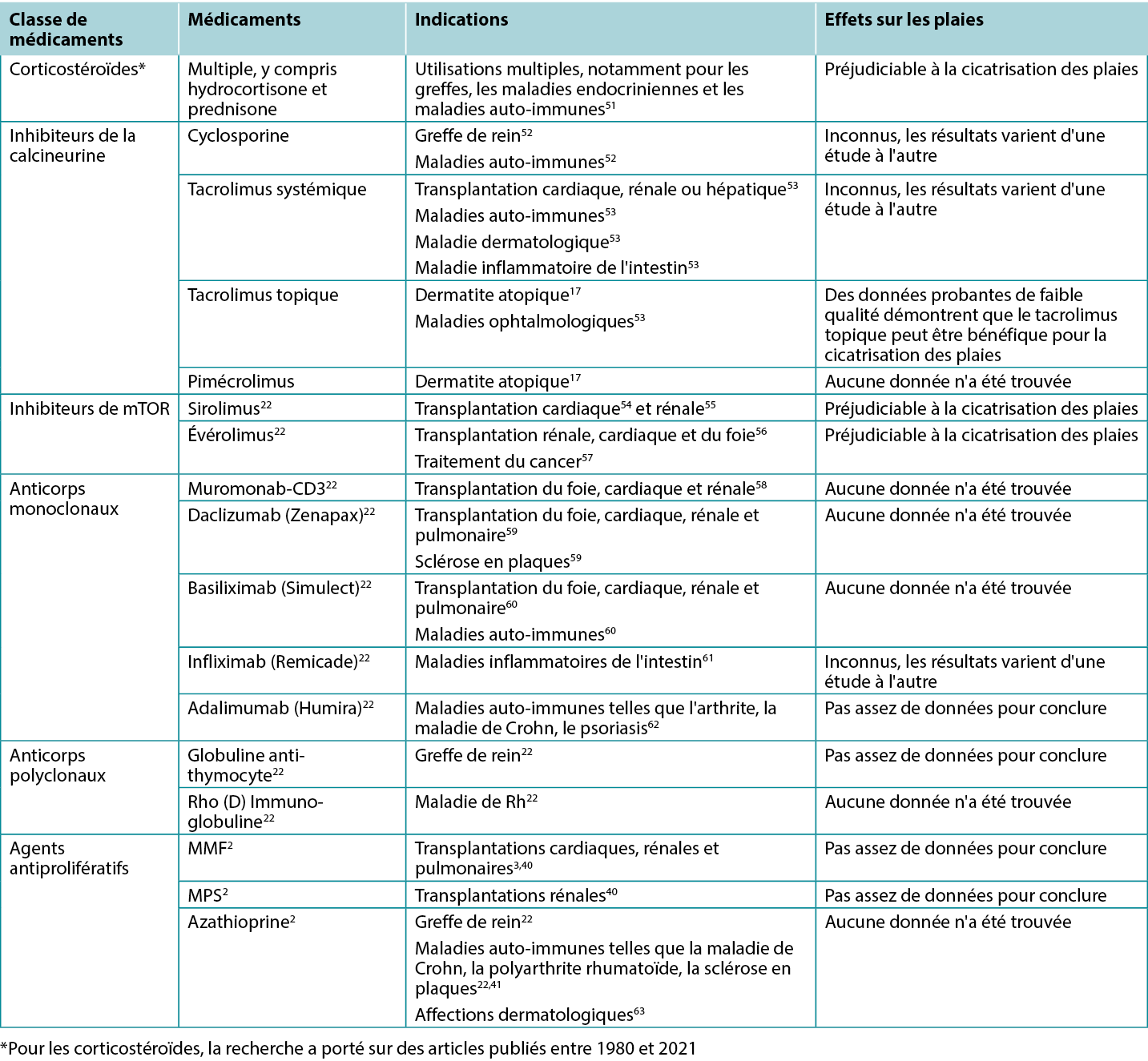
Les études présélectionnées pertinentes pour cette analyse ont été utilisées pour renseigner les différentes catégories décrites ci-dessous. Au total, 200 titres et résumés d'articles ont fait l'objet d'une première sélection et 61 articles ont été retenus pour l’analyse. Les tableaux récapitulatifs des résultats des études cliniques et animales sont rassemblés dans le Tableau 1. Les indications spécifiques des différents immunosuppresseurs, y compris leurs effets possibles sur les plaies, sont présentées dans le Tableau 2.
Tableau 1. Études comparant les effets de différents immunosuppresseurs sur les plaies
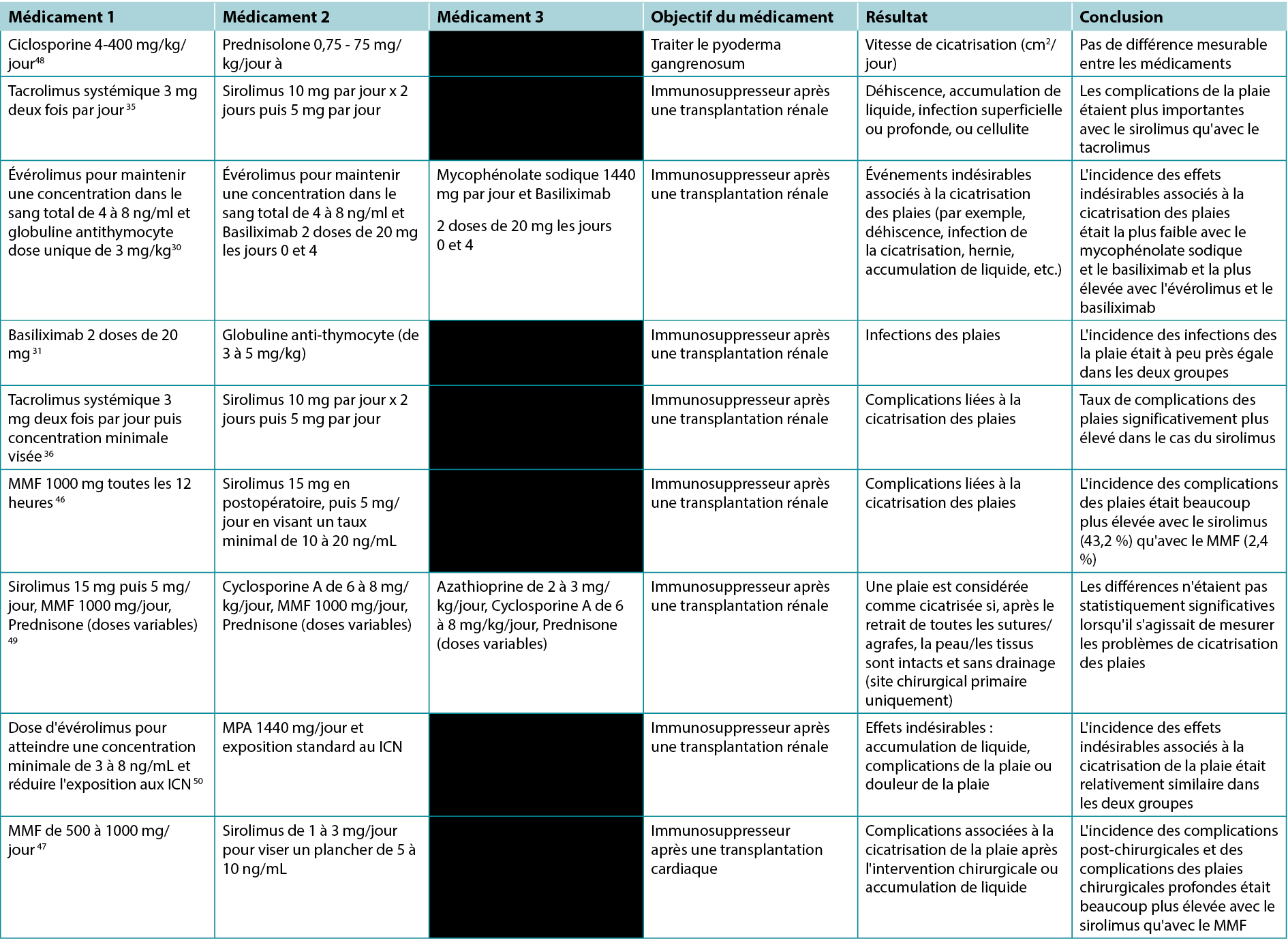
Tableau 2. Aperçu des indications et des effets sur les plaies de divers immunosuppresseurs
Inhibiteurs de la calcineurine
Les inhibiteurs de la calcineurine (ICN) sont utilisés comme immunosuppresseurs dans le cadre de diverses maladies auto-immunes, de greffes d'organes, d'affections dermatologiques et de plaies chroniques8 Il existe trois principaux types d'ICN : la cyclosporine (systémique), le tacrolimus (systémique et topique) et le pimécrolimus (topique).9 Les ICN agissent en se liant à une partie de la molécule de calcineurine présente dans les cellules humaines, stoppant ainsi la libération de certaines cytokines responsables de l'activation des lymphocytes T.8 Par conséquent, les ICN désactivent l'une des principales voies de la réponse immunitaire adaptative de l'organisme.
Systémique
Il n'existe pas d'études portant directement sur les effets des ICN sur la cicatrisation des plaies chez l'homme ; toutefois, de nombreuses études scientifiques fondamentales ont été réalisées sur des animaux. Deux études de ce type menées sur des rats ont comparé l'effet de différentes doses de tacrolimus systémique par rapport à un contrôle, en testant la résistance à la rupture des plaies créées par la chirurgie. L'une des études sur les rats a conclu que le tacrolimus n'affectait pas la cicatrisation des plaies10 tandis que l'autre étude a conclu que le tacrolimus nuisait à la cicatrisation des plaies.11 Parallèlement, des compte-rendu de cas utilisant le tacrolimus systémique comme traitement des ulcères chez une personne atteinte de lichen plan et de pyoderma gangrenosum ont démontré le succès du traitement avec cette thérapie.12
Aucune étude chez l’homme récente n'a été trouvée concernant l'effet de la ciclosporine sur la cicatrisation des plaies. Deux autres études menées sur des rats ont également donné des résultats contradictoires. Ces études sur les rats se sont concentrées sur les effets de la cyclosporine sur différents marqueurs de l'organisme qui indiquent une cicatrisation efficace des plaies. Une étude comparant la ciclosporine à la méthylprednisone a démontré que la ciclosporine n'avait pas d'effet suppressif sur les différents marqueurs inflammatoires et biochimiques par rapport au traitement par glucocorticoïde13 alors que l'autre étude a montré que la ciclosporine avait un effet négatif sur les marqueurs.14 Dans une autre étude, après avoir reçu une transplantation pulmonaire, des chiens ont été assignés à un médicament immunosuppresseur spécifique ou à aucun médicament immunosuppresseur et, comme pour le contrôle, il a été démontré que la cyclosporine A n'avait pas d'effet significatif sur la cicatrisation de la plaie chirurgicale mesurée par sa résistance à la rupture en comparaison avec les immunosuppresseurs glucocorticoïdes et l’azathioprine.15 Dans l'ensemble, la littérature sur les inhibiteurs systémiques de la calcineurine et la cicatrisation des plaies est datée avec une hétérogénéité des comparateurs et des résultats mitigés sur la cicatrisation des plaies.
Topique
Les inhibiteurs de la calcineurine (tacrolimus et pimécrolimus) sont utilisés sous forme de pommades topiques, le plus souvent pour des affections dermatologiques telles que la dermatite atopique, mais aussi pour des affections dermatologiques chroniques telles que le pyoderma gangrenosum.16-18 Certaines études de cas ont montré l'efficacité du tacrolimus pour la cicatrisation d'ulcères de jambe complexes dans le contexte d'une insuffisance veineuse ou d'une nécrobiose lipoïdique, lorsque les stratégies de traitement habituelles ont été inefficaces.19,20 En outre, une étude basée sur le rat avec des lésions cutanées aiguës a démontré que les plaies traitées avec du tacrolimus topique cicatrisaient aussi rapidement que le contrôle (pétrolatum).21
Anticorps monoclonaux :
Il existe une variété de traitements à base d'anticorps monoclonaux (AcM) avec des indications dans les greffes et les troubles auto-immuns tels que la polyarthrite rhumatoïde et le psoriasis.22 En général, les AcM agissent en se liant à différents récepteurs et antigènes pour inhiber l'effet des cytokines et d'autres voies de signalisation qui activent le système immunitaire.22 Une petite étude de cohorte prospective chez des patients atteints de polyarthrite rhumatoïde et subissant une chirurgie orthopédique a démontré qu'il n'y avait pas de risque accru d'infections des plaies chirurgicales ou de complications de la cicatrisation chez les patients sous infliximab par rapport au traitement conventionnel.23 En outre, un compte-rendu de cas affirme que l'infliximab topique a été utile dans la cicatrisation des ulcères de jambe qui étaient résistants au traitement standard, ce qui suggère que l'inhibition du facteur de nécrose tumorale alpha est utile à la cicatrisation des plaies.24 Des résultats similaires ont été obtenus dans un compte-rendu de cas de traitement du pyoderma gangrenosum par l'infliximab, qui a entraîné une amélioration de l'ulcère.25 L 'inhibition du facteur de nécrose tumorale alpha s'est avérée être associée à la cicatrisation des ulcères de jambe veineux grâce à l'utilisation de l'adalimumab par voie systémique.26 Cependant, une autre étude a utilisé l'infliximab sur des plaies abdominales de rats et a démontré que la résistance à la traction était significativement plus faible dans les plaies des rats ayant reçu de l'infliximab que dans celles du groupe témoin.27 Dans l'ensemble, la littérature limitée sur le sujet à ce jour suggère que les résultats cliniques sont jusqu'à présent favorables en termes de cicatrisation des plaies.
Anticorps polyclonaux
Les anticorps polyclonaux (AcP) ont une fonction très similaire à celle des AcM, avec un mécanisme d'action légèrement différent.28,29 Contrairement aux AcM, un groupe d'anticorps polyclonaux est créé à partir de nombreuses lignées différentes de cellules B et, au sein du groupe, différents AcP se lient à différents épitopes de l’antigène. En revanche, les AcM proviennent d'une seule lignée de cellules B et ne peuvent se lier qu'à un seul antigène.28,29 Il existe deux principaux AcP : L'immunoglobuline anti-thymocyte et l'immunoglobuline Rho (D).22 L'immunoglobuline anti-thymocyte, également connue sous le nom de globuline thymocyte antihumaine, est le plus souvent utilisée comme immunosuppresseur après une transplantation rénale et agit en se liant à divers lymphocytes et en réduisant le nombre de lymphocytes T dans le corps.22 L'immunoglobuline Rho (D) est utilisée dans les grossesses où la mère est Rh- et le fœtus Rh+ et arrête essentiellement la formation d'anticorps anti-Rh+ chez la mère.22
Peu d'études portant sur les effets des AcP sur la cicatrisation des plaies ont été trouvées. Deux études ont décrit les effets de la globuline anti-thymocyte et du Basiliximab. La première étude menée chez des patients ayant subi une transplantation rénale, dans laquelle les deux médicaments étaient associés à l'évérolimus, a montré des taux plus élevés d'effets indésirables sur la cicatrisation des plaies dans le cas du basiliximab. 30 La seconde étude a démontré que l'incidence des infections de plaie était la même chez les patients prenant du basiliximab que chez ceux prenant des globulines anti-thymocytes après une transplantation rénale.31 Comme les globules blancs jouent un rôle clé dans la cicatrisation des plaies en sécrétant les cytokines nécessaires et en prévenant les infections,32 il serait raisonnable de supposer que les globulines anti-thymocytes affectent la cicatrisation des plaies puisqu'elles réduisent le nombre de globules blancs ainsi que leurs mécanismes de régulation.
Inhibiteurs de mTOR
Les inhibiteurs de la cible mécaniste de la rapamycine (mTOR) sont des médicaments immunosuppresseurs qui fonctionnent en interagissant avec des protéines dans des voies de signalisation complexes pour empêcher les cellules de passer à la phase S du cycle cellulaire et donc supprimer la prolifération.3,22 La mTOR cible principalement les cellules T, mais peut également affecter les cellules B.3 Il est intéressant de noter que la mTOR peut entraîner une augmentation de la production de certaines cytokines inflammatoires telles que l'interleukine-6 et une diminution de la production d'interleukine-10, une cytokine anti-inflammatoire.3 Il existe deux principaux inhibiteurs de mTOR : le sirolimus et l'évérolimus.3,22 En général, les inhibiteurs de mTOR ont une variété d'applications, y compris le traitement du cancer.3,22 En tant qu'immunosuppresseur, ils sont utilisés après les transplantations.3,22 Il a été démontré que l'évérolimus inhibe la prolifération des fibroblastes dans des modèles in vitro33 , ce qui suggère que l'évérolimus pourrait avoir des conséquences négatives sur la cicatrisation des plaies puisque les fibroblastes sont essentiels pour créer une matrice extracellulaire et créer un cadre pour d'autres cellules.34 Dans une étude comparant le sirolimus et le tacrolimus systémique, le sirolimus présentait un taux de complications des plaies de 47 %, contre seulement 8 % pour le tacrolimus.35 Ceci est cohérent avec une autre étude de Larson et al. démontrant des complications des plaies plus élevées avec le sirolimus qu'avec le tacrolimus.36 Il est intéressant de noter que les patients obèses sous sirolimus présentaient des taux très élevés de complications des plaies, ce qui a conduit l'étude à exclure tous les patients souffrant d'obésité.36 Dans la lignée des résultats précédents, une étude sur les rats a montré qu'une augmentation des doses de sirolimus diminuait la résistance des plaies, les auteurs émettant l'hypothèse que cet effet pourrait être dû à des niveaux plus faibles de VEGF et d'oxyde nitrique chez les rats recevant des doses plus élevées de sirolimus.37 Dans une analyse, les auteurs ont conclu que les inhibiteurs de mTOR sont nocifs pour la cicatrisation des plaies à fortes doses, mais semblent avoir un effet neutre à faibles doses.38 Compte tenu des préoccupations initiales concernant les inhibiteurs de mTOR et la cicatrisation des plaies, les protocoles utilisant ces agents immunosuppresseurs ont évolué vers des doses plus faibles d'inhibiteurs de mTOR et des traitements combinés. Dans l'important essai contrôlé randomisé TRANSFORM, les investigateurs ont comparé l'évérolimus associé à une dose réduite de ICN à l'acide mycophénolique associé à une dose standard d’ ICN (traitement standard) chez des patients ayant subi une transplantation rénale et ont montré que les événements indésirables associés à la plaie n'étaient pas statistiquement différents (20,6 % contre 17,3 % ; RR 1,19 95 % CI de 0,99 à 1,43).39 L'une des limites de cette étude était la surveillance étroite des concentrations d'évérolimus et les difficultés à atteindre les concentrations plasmatiques ciblées C0 entre 3 et 8 ng/mL.39 Dans l'ensemble, l'examen de la littérature actuelle suggère que les inhibiteurs de mTOR ont un effet néfaste sur la cicatrisation des plaies, en particulier à des doses élevées, et que des schémas posologiques améliorés peuvent diminuer ou atténuer ce risque.
Agents antiprolifératifs
Trois agents antiprolifératifs sont régulièrement utilisés : Le mycophénolate mofétil (MMF) et le mycophénolate sodique (MPS) (tous deux inhibiteurs de l'inosine monophosphate déshydrogénase (IMPDH)) et l'azathioprine.2,40 Les inhibiteurs de l'IMPDH ont un effet similaire aux inhibiteurs de mTOR en termes de mécanisme d'immunosuppression. Dans l'organisme, le MMF et le MPS sont transformés en acide mycophénolique qui bloque une partie de la voie cruciale pour la synthèse de l'ADN, afin de diminuer la prolifération des cellules T et des cellules B.2,5,40 Le MMF est utilisé pour son effet immunosuppresseur dans les transplantations cardiaques, rénales et pulmonaires.3,40 Le MPS est utilisé pour les transplantations rénales.40 L'azathioprine est utilisée comme médicament immunosuppresseur pour les greffes de rein et les maladies auto-immunes, notamment la polyarthrite rhumatoïde, la maladie de Crohn et la sclérose en plaques.22,41 Dans l'organisme, l'azathioprine réagit avec le glutathion et est convertie en 6-mercaptupurine, après quoi d'autres métabolites sont générés, bloquant finalement la synthèse de la purine et la stimulation des lymphocytes T.3,22
Lorsqu'une étude a comparé deux doses différentes de MMF chez des transplantés rénaux, l'incidence des plaies nécessitant une intervention chirurgicale n'était pas significativement différente, de même pour les plaies traitées avec des soins locaux.42 Sur la base de l'examen des titres d'articles dans le cadre de notre recherche, aucune étude concernant le seul effet de l'azathioprine sur la cicatrisation des plaies externes chez l'homme n'a été trouvée. Lorsque l'azathioprine a été comparée à un placebo dans une étude sur les rats, les plaies des rats sous azathioprine ont mis plus de temps à cicatriser que celles des rats sous placebo, ce qui suggère que l'azathioprine peut avoir des effets néfastes sur la cicatrisation des plaies, mais l'étendue de ses effets chez l’homme n'est pas claire.43
Anti-métabolite
Le méthotrexate est un agent immunosuppresseur antagoniste des folates couramment utilisé, avec des indications dans de nombreux troubles rhumatologiques. Il a également une activité antinéoplasique à des doses plus élevées. Lors de l'absorption, il pénètre dans la cellule et est converti en polyglutamates de méthotrexate où il entre en compétition avec la dihydrofolate réductase, empêchant ainsi la transformation de l'acide folique pour son utilisation dans la construction des acides nucléiques.6 Comme pour d'autres agents décrits, il existe des études expérimentales sur les animaux avec des études in vitro suggérant une altération de la cicatrisation des plaies, mais ces effets n'ont pas été confirmés par des études cliniques, en particulier dans les plaies postopératoires.6 Il est donc recommandé de poursuivre l'administration de ce médicament après l'opération.
Corticostéroïdes/Glucocorticoïdes
Les glucocorticoïdes empêchent la formation de substances chimiques inflammatoires telles que les cytokines, les molécules d'adhésion cellulaire et les facteurs de complément.3 En inhibant la formation d'interleukine-2, les glucocorticoïdes empêchent également la prolifération et l'activation des lymphocytes T.22 Ils altèrent également les monocytes et les lymphocytes B.3,22 Les glucocorticoïdes ont été les premiers médicaments antirejet créés, mais au fil du temps, un mouvement s'est mis en place pour les éliminer progressivement en raison de leurs effets secondaires sévères.3,22 Il existe un consensus sur le fait que les glucocorticoïdes sont très préjudiciables à la cicatrisation des plaies car ils interfèrent avec de nombreuses étapes-clés de la cicatrisation des plaies telles que le dépôt et la synthèse du collagène, l'angiogenèse, la prolifération des fibroblastes, les facteurs de croissance et la phagocytose, entre autres.2,3,44,45
Considérations pratiques pour les prestataires de soins de santé
Les personnes dont le système immunitaire est affaibli (en raison de médicaments, de comorbidités ou d'âge extrême) doivent faire l'objet de considérations supplémentaires pour la prise en charge des plaies chroniques. En ce qui concerne les médicaments immunosuppresseurs, les prestataires de soins de santé doivent établir un historique minutieux non seulement des médicaments et de leur dosage (y compris les changements de dosage), mais aussi des conditions sous-jacentes nécessitant ces médicaments (par exemple, les troubles auto-immuns, la transplantation d'organes). Comme de nombreux médicaments immunosuppresseurs peuvent entraver la cicatrisation des plaies, il est essentiel que les prestataires de soins de santé évaluent le potentiel de cicatrisation dès le début afin de définir et de prendre en charge les attentes des patients. L'orientation précoce vers des spécialistes médicaux ou chirurgicaux pour aider au traitement des plaies et une approche fondée sur le travail d'équipe seront essentielles compte tenu de la complexité accrue présentée par ces personnes. Dans certains cas où les plaies ne cicatrisent pas, il peut être nécessaire de fixer d'autres objectifs de soins pour la plaie (par exemple, d’entretien ou non-cicatrisable) si les doses d'immunosuppresseurs ne peuvent pas être réduites (en supposant qu'elles contribuent à la mauvaise cicatrisation) et cela doit être fait en consultation avec leurs prestataires de soins primaires ou spécialisés. Avec l'allongement de la durée de vie des individus et des populations présentant des comorbidités, la prise en charge des personnes souffrant de plaies chroniques sous traitement immunosuppresseur deviendra de plus en plus fréquente et doit être reconnue précocement par les praticiens cliniques spécialisés dans le traitement des plaies.
Discussion
Avec les progrès constants de la médecine, le besoin d'immunosuppression dans le contexte des transplantations, des maladies auto-immunes et des tumeurs malignes s'est accru. Dans notre analyse, nous soulignons la pauvreté des études robustes dans ce domaine et mettons en évidence les effets mitigés de diverses immunosuppressions sur la cicatrisation des plaies. Il existe des données probantes de haute qualité concernant les effets délétères des traitements glucocorticoïdes ainsi que des traitements mTOR, en particulier le sirolimus, sur la cicatrisation des plaies. En outre, lorsque 4 études ont comparé le sirolimus au MMF ou au tacrolimus systémique, toutes les études ont montré que le sirolimus était associé à une incidence accrue de complications des plaies.35,36,46,47
La littérature sur les agents tels que les INC systémiques est mitigée, certains suggérant des effets néfastes sur les plaies et d'autres des avantages, ce qui nécessite des études supplémentaires axées directement sur cette question. Les nouveaux INC topiques ont montré peu d'impact sur le retard de cicatrisation et, dans certains cas, un bénéfice, mais des recherches supplémentaires sont justifiées pour leur utilisation directe dans les plaies chroniques. Il est rassurant de constater que les agents antiprolifératifs, les antimétabolites et les nouveaux antibiotiques monoclonaux n'ont pas montré de signes de diminution de la cicatrisation. Cependant, des études supplémentaires sont nécessaires étant donné la pauvreté des données probantes sur la cicatrisation des plaies dans le cadre d’un traitement AcM. Dans l'ensemble, notre analyse a révélé que les données probantes dans ce domaine sont datées et que les conclusions concernant les effets de l'immunosuppresseur sur la cicatrisation des plaies sont variables. En outre, nous n'avons trouvé que peu de données sur des sujets humains. En général, lorsque des immunosuppresseurs sont prescrits après une greffe pour prévenir le rejet, les patients prennent plus d'un médicament pour prévenir efficacement le rejet. Il est donc difficile de réaliser des études humaines évaluant les effets de médicaments spécifiques isolés.
Comme nous n'avons pas effectué d'examen systématique, certains articles ont pu être exclus. Nous avons identifié quelques analyses-clés avant d'effectuer la recherche et nous nous sommes assurés qu'elles étaient présentes dans la recherche, ce qui constitue une forme de validation. En outre, étant donné la rareté de la littérature dans ce domaine, en particulier en ce qui concerne le traitement des plaies, une analyse narrative apporte une valeur ajoutée à la formation et à la sensibilisation dans le cadre du travail avec des personnes prenant ces médicaments.
Compte tenu du besoin croissant d'immunosuppression, il est essentiel de poursuivre les études dans ce domaine. Les orientations futures comprennent la réalisation de plus d'études sur des sujets animaux avec de nouvelles classes d'immunosuppresseurs afin d'identifier les voies potentielles du retard de cicatrisation et les moyens potentiels d'atténuer ces effets. En outre, des études de haute qualité sont nécessaires pour évaluer les immunothérapies spécifiques et combinées afin de mieux comprendre les risques et l'impact que les différents immunosuppresseurs peuvent avoir sur la cicatrisation des plaies. Afin d'explorer les immunosuppresseurs en tant que traitement potentiel des plaies chroniques ou complexes, il est important que les futures études soient menées à plus grande échelle et contrôlent les facteurs cliniques confondants, par exemple par le biais d'essais contrôlés randomisés.
Conclusions
En conclusion, les immunosuppresseurs peuvent être bénéfiques ou très nocifs pour la cicatrisation des plaies. Bien qu'il y ait peu de données probantes concluantes dans ce domaine, les effets des immunosuppresseurs sur la cicatrisation des plaies méritent d'être explorés afin de mieux adapter l'immunosuppression aux patients présentant un risque ou souffrant de plaies chroniques non-cicatrisantes De manière rassurante, nos résultats suggèrent que tous les immunosuppresseurs ne sont pas nocifs et que certains d'entre eux peuvent être bénéfiques pour le traitement des plaies lorsque les traitements conventionnels ont échoué, ce qui ouvre la possibilité d'une nouvelle option de traitement des plaies.
Remerciements
Programme d'été des jeunes chercheurs des écoles secondaires de l'Université de l'Alberta.
Conflit d'intérêt
Les auteurs ne déclarent aucun conflit d'intérêt.
Financement
Les auteurs n'ont reçu aucun financement pour cette étude.
Author(s)
Aria Appoo
Medical Student, University of Oxford, Oxford, UK
Brandon L Christensen
BMSc MD
Resident Physician, University of Calgary, Division of Infectious Diseases, Calgary, Alberta, Canada
Ranjani Somayaji
BScPT MD MPH
Assistant Professor, University of Calgary, Departments of Medicine, Microbiology, Immunology and Infectious Disease and Community Health Sciences, Calgary, Alberta, Canada
References
- Fireman M, DiMartini AF, Armstrong SC, Cozza KL. Immunosuppressants. Psychosomatics. 2004;45(4). doi:10.1176/appi.psy.45.4.354
- Taylor AL, Watson CJE, Bradley JA. Immunosuppressive agents in solid organ transplantation: Mechanisms of action and therapeutic efficacy. Crit Rev Oncol Hematol. 2005;56(1). doi:10.1016/j.critrevonc.2005.03.012
- Weltz A, Scalea J, Popescu M, Xu J, Bromberg JS. Mechanisms of Immunosuppressive Drugs. In: Kidney Transplantation. Springer New York; 2014. doi:10.1007/978-1-4939-0342-9_12
- Subramanian S, Trence DL. Immunosuppressive Agents: Effects on Glucose and Lipid Metabolism. Endocrinol Metab Clin North Am. 2007;36(4). doi:10.1016/j.ecl.2007.07.003
- Mika A, Stepnowski P. Current methods of the analysis of immunosuppressive agents in clinical materials: A review. J Pharm Biomed Anal. 2016;127. doi:10.1016/j.jpba.2016.01.059
- Pountos I, Giannoudis P V. Effect of methotrexate on bone and wound healing. Expert Opin Drug Saf. 2017;16(5):535-545. doi:10.1080/14740338.2017.1310839
- Willems MCM, van der Vliet JA, Lomme RMLM, Hendriks T. Tacrolimus Does Not Affect Early Wound Healing in a Rodent Model of Bowel Anastomoses and Abdominal Wall Closure. PLoS One. 2013;8(9). doi:10.1371/journal.pone.0076348
- Azzi JR, Sayegh MH, Mallat SG. Calcineurin Inhibitors: 40 Years Later, Can’t Live Without …. The Journal of Immunology. 2013;191(12). doi:10.4049/jimmunol.1390055
- Safarani OA, Patel J. Calcineurin Inhibitors. StatPearls Publishing; 2021.
- Willems MCM, van der Vliet JA, Lomme RMLM, Hendriks T. Tacrolimus Does Not Affect Early Wound Healing in a Rodent Model of Bowel Anastomoses and Abdominal Wall Closure. PLoS One. 2013;8(9). doi:10.1371/journal.pone.0076348
- Schäffer MR, Fuchs N, Proksch B, Bongartz M, Beiter T, Becker HD. TACROLIMUS IMPAIRS WOUND HEALING. Transplantation. 1998;65(6). doi:10.1097/00007890-199803270-00008
- The Effect of Tacrolimus on Lower Extremity Ulcers: A Case Study and Review of the Literature. Wound Manag Prev. 2008;54(4).
- Nemlander A, Ahonen J, Wiktorowicz K, et al. Effect of Cyclosporine on Wound Healing An Analysis With Viscous Cellulose Sponges. Transplantation. 1983;36(1):1-5.
- Petri J, Schurk S, Gebauer S, Haustein U. Cyclosporine A delays wound healing and apoptosis and suppresses activin beta-A expression in rats. European Journal of Dermatology. 1998;8(2):104-113.
- Goldberg M, Lima O, Morgan E, et al. A comparison between cyclosporin A and methylprednisolone plus azathioprine on bronchial healing following canine lung autotransplantation. J Thorac Cardiovasc Surg. 1983;85(6). doi:10.1016/S0022-5223(19)37469-0
- Sussman G. The use of topical calcineurin inhibitors in chronic wound management. Wound Practice & Research: Journal of the Australian Wound Management Association. 2000;26(3):140-145.
- Frazier W, Bhardwaj N. Atopic Dermatitis: Diagnosis and Treatment. Am Fam Physician. 2020;101(10):590-598.
- Lyon C, Stapleton M, Smith A, Mendelsohn S, Beck M, Griffiths C. Topical tacrolimus in the management of peristomal pyoderma gangrenosum. Journal of Dermatological Treatment. 2001;12(1). doi:10.1080/095466301750163518
- Ginocchio L, Draghi L, Darvishian F, Ross FL. Refractory Ulcerated Necrobiosis Lipoidica: Closure of a Difficult Wound with Topical Tacrolimus. Adv Skin Wound Care. 2017;30(10). doi:10.1097/01.ASW.0000521867.98577.a5
- Mackelfresh J, Soon S, Arbiser JL. Combination Therapy of Doxycycline and Topical Tacrolimus for Venous Ulcers. JAMA Dermatol. 2005;141(11). doi:10.1001/archderm.141.11.1476
- Namkoong S, Chung J, Yoo J, et al. Topical tacrolimus does not negatively impact acute skin wound healing. Exp Dermatol. 2013;22(5). doi:10.1111/exd.12131
- Khan MM. Immunopharmacology. Springer US; 2008. doi:10.1007/978-0-387-77976-8
- Bibbo C, Goldberg JW. Infectious and Healing Complications after Elective Orthopaedic Foot and Ankle Surgery during Tumor Necrosis Factor-Alpha Inhibition Therapy. Foot Ankle Int. 2004;25(5). doi:10.1177/107110070402500510
- Streit M, Beleznay Z, Braathen LR. Topical application of the tumour necrosis factor-alpha antibody infliximab improves healing of chronic wounds. Int Wound J. 2006;3(3). doi:10.1111/j.1742-481X.2006.00233.x
- Hewitt D, Tait C. Use of infliximab in pyoderma gangrenosum. Australasian Journal of Dermatology. 2007;48(2). doi:10.1111/j.1440-0960.2007.00344.x
- Fox JD, Baquerizo-Nole KL, Keegan BR, et al. Adalimumab treatment leads to reduction of tissue tumor necrosis factor-alpha correlated with venous leg ulcer improvement: a pilot study. Int Wound J. 2016;13(5). doi:10.1111/iwj.12497
- Lopes JV, Freitas LAM de, Marques RD, Bocca AL, Sousa JB de, Oliveira PG de. Analysis of the tensile strength on the healing of the abdominal wall of rats treated with infliximab. Acta Cir Bras. 2008;23(5). doi:10.1590/S0102-86502008000500009
- Larrañaga MD, Lewis S, Richard J, Robert A, eds. Polyclonal Antibodies. In: Hawley’s Condensed Chemical Dictionary. 16th ed. Wiley; 2016.
- Johnson M. Monoclonal Antibodies. In: Longe JL, ed. Gale Encyclopedia of Nursing and Allied Health. 4th ed. Credo Reference; 2018.
- Ueno P, Felipe C, Ferreira A, et al. Wound Healing Complications in Kidney Transplant Recipients Receiving Everolimus. Transplantation. 2017;101(4). doi:10.1097/TP.0000000000001392
- Patel S, Pankewycz O, Kohli R, et al. Obesity in Renal Transplantation: The Role of Induction Therapy on Long-Term Outcomes. Transplant Proc. 2011;43(2). doi:10.1016/j.transproceed.2011.01.040
- Kordestani SS. Atlas of Wound Healing. (Abyaneh S, Fayyazbakhsh, eds.). Elsevier; 2019.
- Azzola A, Havryk A, Chhajed P, et al. Everolimus and mycophenolate mofetil are potent inhibitors of fibroblast proliferation after lung transplantation1. Transplantation. 2004;77(2). doi:10.1097/01.TP.0000101822.50960.AB
- P. B. Wound healing and the role of fibroblasts. J Wound Care. 2013;22(8). doi:10.12968/jowc.2013.22.8.407
- Dean PG, Lund WJ, Larson TS, et al. Wound-Healing Complications After Kidney Transplantation: A Prospective, Randomized Comparison Of Sirolimus And Tacrolimus1. Transplantation. 2004;77(10). doi:10.1097/01.TP.0000123082.31092.53
- Larson TS, Dean PG, Stegall MD, et al. Complete Avoidance of Calcineurin Inhibitors in Renal Transplantation: A Randomized Trial Comparing Sirolimus and Tacrolimus. American Journal of Transplantation. 2006;6(3). doi:10.1111/j.1600-6143.2005.01177.x
- Schäffer M, Schier R, Napirei M, Michalski S, Traska T, Viebahn R. Sirolimus impairs wound healing. Langenbecks Arch Surg. 2007;392(3). doi:10.1007/s00423-007-0174-5
- Nashan B, Citterio F. Wound Healing Complications and the Use of Mammalian Target of Rapamycin Inhibitors in Kidney Transplantation. Transplantation. 2012;94(6). doi:10.1097/TP.0b013e3182551021
- Citterio F, Henry M, Kim DY, et al. Wound healing adverse events in kidney transplant recipients receiving everolimus with reduced calcineurin inhibitor exposure or current standard-of-care: Insights from the 24 month TRANSFORM study. Expert Opin Drug Saf. Published online 2020:1339-1348. doi:10.1080/14740338.2020.1792441
- Staatz CE, Tett SE. Clinical Pharmacokinetics and Pharmacodynamics of Mycophenolate in Solid Organ Transplant Recipients. Clin Pharmacokinet. 2007;46(1). doi:10.2165/00003088-200746010-00002
- Casetta I, Iuliano G, Filippini G. Azathioprine for multiple sclerosis. Cochrane Database of Systematic Reviews. Published online October 17, 2007. doi:10.1002/14651858.CD003982.pub2
- Flechner SM, Feng J, Mastroianni B, et al. The Effect of 2-Gram Versus 1-Gram Concentration Controlled Mycophenolate Mofetil on Renal Transplant Outcomes Using Sirolimus-Based Calcineurin Inhibitor Drug-Free Immunosuppression. Transplantation. 2005;79(8). doi:10.1097/01.TP.0000155430.52845.51
- Ginestal R, Pérez-Köhler B, Pérez-López P, et al. Comparing the influence of two immunosuppressants (fingolimod, azathioprine) on wound healing in a rat model of primary and secondary intention wound closure. Wound Repair and Regeneration. 2019;27(1). doi:10.1111/wrr.12685
- Wicke C. Effects of Steroids and Retinoids on Wound Healing. Archives of Surgery. 2000;135(11). doi:10.1001/archsurg.135.11.1265
- Anstead G. Steroids, retinoids, and wound healing. Adv Wound Care (New Rochelle). 1998;11(6):277-285.
- Valente JF, Hricik D, Weigel K, et al. Comparison of Sirolimus vs. Mycophenolate Mofetil on Surgical Complications and Wound Healing in Adult Kidney Transplantation. American Journal of Transplantation. 2003;3(9). doi:10.1034/j.1600-6143.2003.00185.x
- Kuppahally S, Al-Khaldi A, Weisshaar D, et al. Wound Healing Complications with De Novo Sirolimus Versus Mycophenolate Mofetil-Based Regimen in Cardiac Transplant Recipients. American Journal of Transplantation. 2006;6(5p1). doi:10.1111/j.1600-6143.2006.01282.x
- Ormerod AD, Thomas KS, Craig FE, et al. Comparison of the two most commonly used treatments for pyoderma gangrenosum: results of the STOP GAP randomised controlled trial. BMJ. 2015;350(jun12 3). doi:10.1136/bmj.h2958
- Flechner SM, Zhou L, Derweesh I, et al. The impact of sirolimus, mycophenolate mofetil, cyclosporine, azathioprine, and steroids on wound healing in 513 kidney-transplant recipients. Transplantation. 2003;76(12). doi:10.1097/01.TP.0000093502.26208.42
- Citterio F, Henry M, Kim DY, et al. Wound healing adverse events in kidney transplant recipients receiving everolimus with reduced calcineurin inhibitor exposure or current standard-of-care: insights from the 24-month TRANSFORM study. Expert Opin Drug Saf. 2020;19(10). doi:10.1080/14740338.2020.1792441
- Kapugi M, Cunningham K. Corticosteroids. Orthopaedic Nursing. 2019;38(5):336-339. doi:10.1097/NOR.0000000000000595
- Ponticelli C. Cyclosporine: From Renal Transplantation to Autoimmune Diseases. Ann N Y Acad Sci. 2005;1051(1):551-558. doi:10.1196/annals.1361.099
- Akar Y, Yucel G, Durukan AH, Yucel I, Arici G. Laboratory Science. Systemic toxicity of tacrolimus given by various routes and the response to dose reduction. Clin Exp Ophthalmol. 2005;33(1):53-59. doi:10.1111/j.1442-9071.2005.00942.x
- Kurian K, Addisu A. Sirolimus: A Novel Immunosuppressive Drug in Heart Transplantation. Recent Pat Cardiovasc Drug Discov. 2009;4(3):187-191. doi:10.2174/157489009789152294
- Sehgal SN. Sirolimus: its discovery, biological properties, and mechanism of action. Transplant Proc. 2003;35(3):S7-S14. doi:10.1016/S0041-1345(03)00211-2
- van Gelder T, Fischer L, Shihab F, Shipkova M. Optimizing everolimus exposure when combined with calcineurin inhibitors in solid organ transplantation. Transplant Rev. 2017;31(3):151-157. doi:10.1016/j.trre.2017.02.007
- Falkowski S, Woillard JB. Therapeutic Drug Monitoring of Everolimus in Oncology: Evidences and Perspectives. Ther Drug Monit. 2019;41(5):568-574. doi:10.1097/FTD.0000000000000628
- Bethesda (MD): National Institute of Diabetes and Digestive and Kidney Diseases. LiverTox: Clinical and Research Information on Drug-Induced Liver Injury.; 2020.
- Bethesda (MD): National Institute of Diabetes and Digestive and Kidney Diseases. LiverTox: Clinical and Research Information on Drug-Induced Liver Injury.; 2017. Accessed February 10, 2022. https://www-ncbi-nlm-nih-gov.ezproxy.lib.ucalgary.ca/books/NBK548018/
- Bethesda (MD): National Institute of Diabetes and Digestive and Kidney Diseases. LiverTox: Clinical and Research Information on Drug-Induced Liver Injury.; 2017. Accessed February 10, 2022. https://www-ncbi-nlm-nih-gov.ezproxy.lib.ucalgary.ca/books/NBK548587/
- Lichtenstein L, Ron Y, Kivity S, et al. Infliximab-Related Infusion Reactions: Systematic Review. J Crohns Colitis. 2015;9(9):806-815. doi:10.1093/ecco-jcc/jjv096
- Tracey D, Klareskog L, Sasso EH, Salfeld JG, Tak PP. Tumor necrosis factor antagonist mechanisms of action: A comprehensive review. Pharmacol Ther. 2008;117(2):244-279. doi:10.1016/j.pharmthera.2007.10.001
- Chavez-Alvarez S, Herz-Ruelas M, Villarreal-Martinez A, Ocampo-Candiani J, Garza-Garza R, Gomez-Flores M. Azathioprine: its uses in dermatology. An Bras Dermatol. 2020;95(6):731-736. doi:10.1016/j.abd.2020.05.003
