Volume 44 Number 2
Atopic Dermatitis: clinical aspects and treatments
Ryan S Q Geng, R Gary Sibbald
Keywords eczema, risk factors, atopic dermatitis, anti-inflammatory therapies, biologics, lesions, phototherapy, trials
For referencing Geng RSQ, Sibbald RG. Atopic Dermatitis: clinical aspects and treatments. WCET® Journal 2024;44(2):29-36
DOI 10.33235/wcet.44.2.29-36
Abstract
Atopic Dermatitis is the most common eczematous inflammatory skin condition, presenting with lesions that typically appear as poorly demarcated erythematous and scaly papules and plaques. The lesions most commonly occur on flexural surfaces of the knees, elbows, and wrists and are associated with moderate to severe itching. This article focuses on the clinical presentation of atopic dermatitis and treatment options. Other related topics include epidemiology, pathogenesis, risk factors, triggers, and differential diagnoses.
Introduction
Atopic dermatitis (AD), or atopic eczema, is the most common eczematous inflammatory skin condition, with a lifetime prevalence of 15%.1 Although patients of all ages can be affected, onset peaks in infancy, with 90% of cases occurring before 5 years of age.2 Notably, the prevalence of AD has increased two- to threefold over the past 3 decades.3
The pathogenesis of AD is multifactorial and involves a complex interplay between the skin barrier, genetic factors, and environmental exposures. Skin barrier dysfunction can be characterised by increased transepidermal water loss, increased skin pH, or decreased levels of ceramides, humectants, and structural proteins. Other challenges to skin barrier function include aberrant filaggrin (FLG; a protein that binds keratin fibers in epidermis) expression or excess soap usage, which can also increase skin permeability.4 As mast cells and basophils become sensitised to environmental antigens, type I immunoglobulin E-mediated hypersensitivity reaction, cytokine release, and inflammation are triggered, often resulting in intense itching. Scratching of the lesions results in further damage to the skin barrier, referred to as the itch-scratch cycle. Chronically, this can lead to worsening inflammation and lichenification.5
With the physical discomfort and cosmetic appearance of AD lesions, patients can experience significant psychosocial challenges, including social distress, embarrassment, and activity limitation.6 Given the potential impact on quality of life and increasing incidence, this review will focus on the clinical features of AD and available treatment options.
Risk Factors
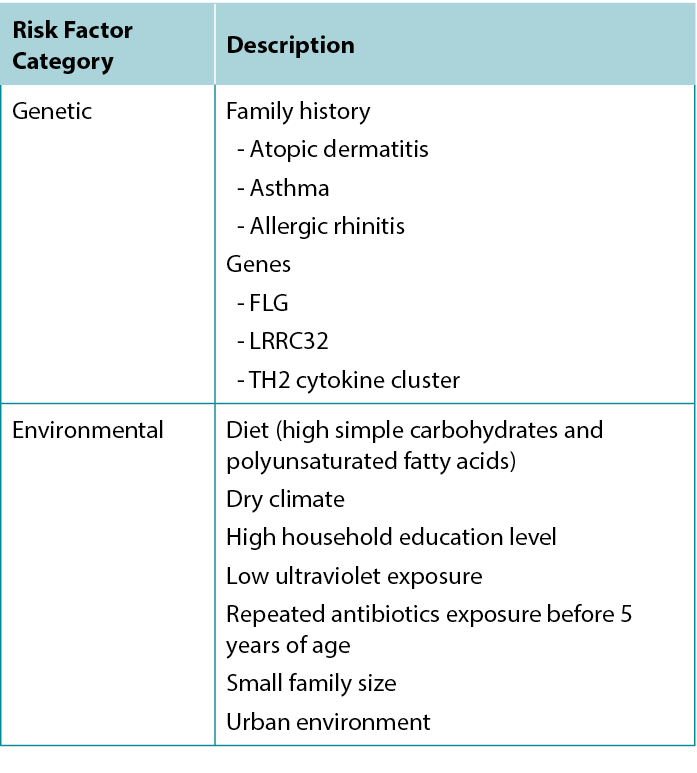
Atopic dermatitis is part of the atopic triad consisting of AD, asthma, and allergic rhinitis. There are several risk factors for developing AD, with the strongest predictor being a positive family history for any atopic disease, especially AD. The implicated genes include FLG, TH2 cytokine cluster, and LRRC32 (which encodes glycoprotein A repetitions predominant).7
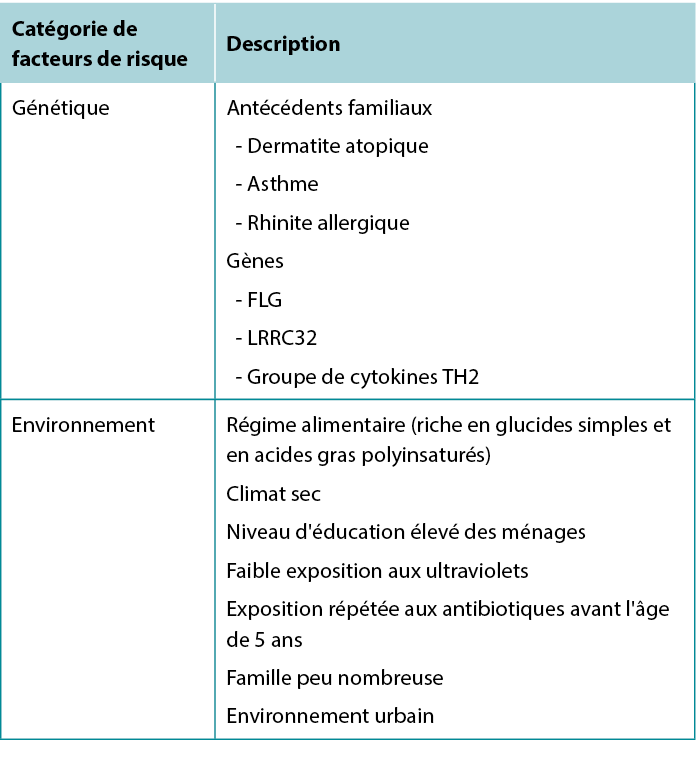
Environmental risk factors have also been identified: Living in an urban environment, dry climate, low UV light exposure, and a diet high in simple carbohydrates and polyunsaturated fatty acids are all associated with increased risk of AD.7 Table 1 summarises risk factors associated with AD.
Table 1 Factors associated with increased risk of developing Atopic Dermatitis.
Clinical classifications
Although the clinical presentation of AD is heterogeneous with various features and symptoms, lesions are typically characterised as poorly demarcated, scaly, and erythematous papules that coalesce into plaques with severe itching that are most commonly found on flexural surfaces of knees, elbows, and wrists. The clinical features of AD are outlined in Table 2, with the essential, major, and minor features being indicated based on American Academy of Dermatology guidelines.2 Because of the wide variation in clinical presentation of AD, there is a broad differential, outlined in Table 3. Classification of AD is based on biomarker serology (IgE), acuity of presentation, and age at onset. Clinical presentations of AD are provided in Figure 1.
Table 2 Features and symptoms of AD.
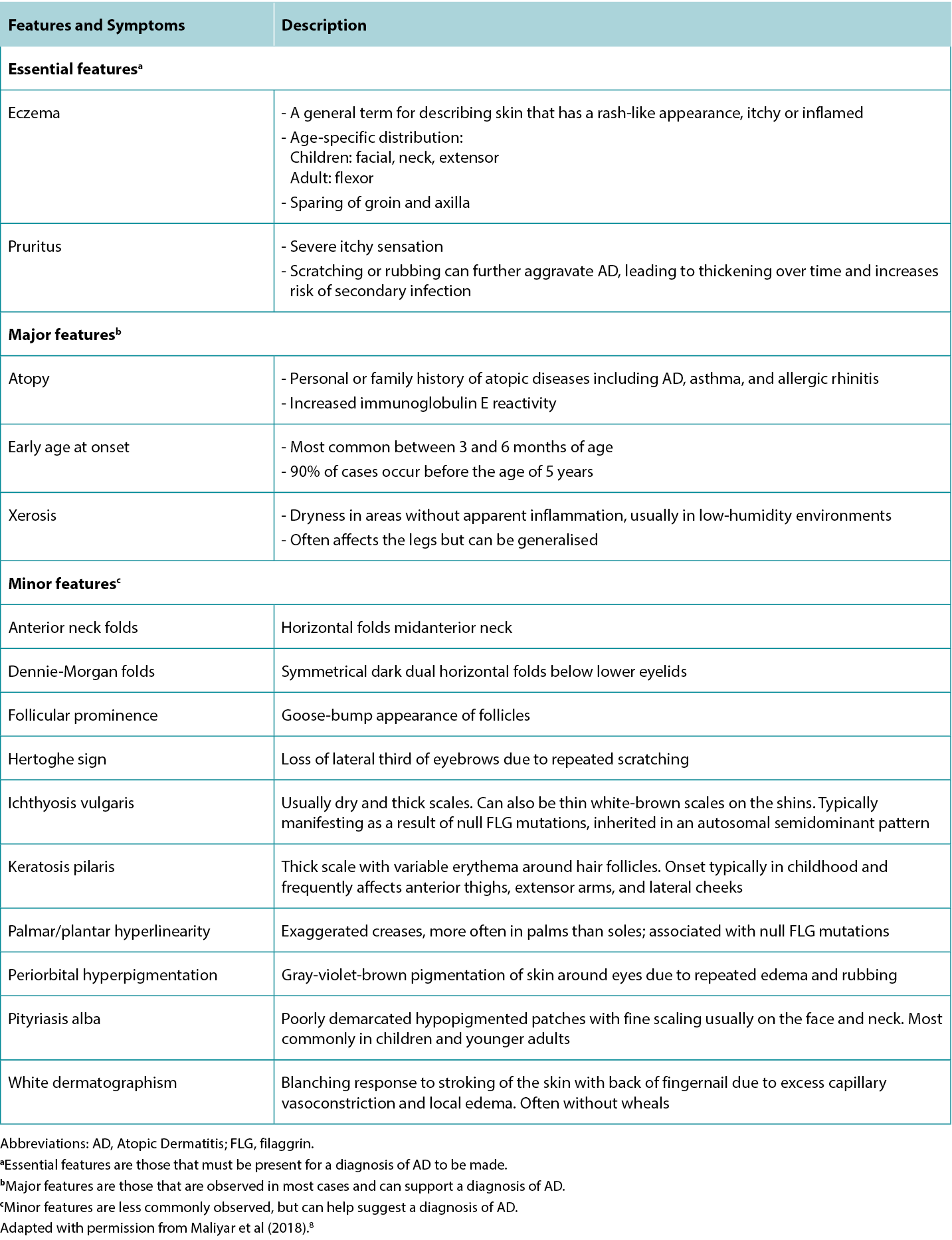
Table 3 Differential diagnoses of Atopic Dermatitis and distinguishing features.

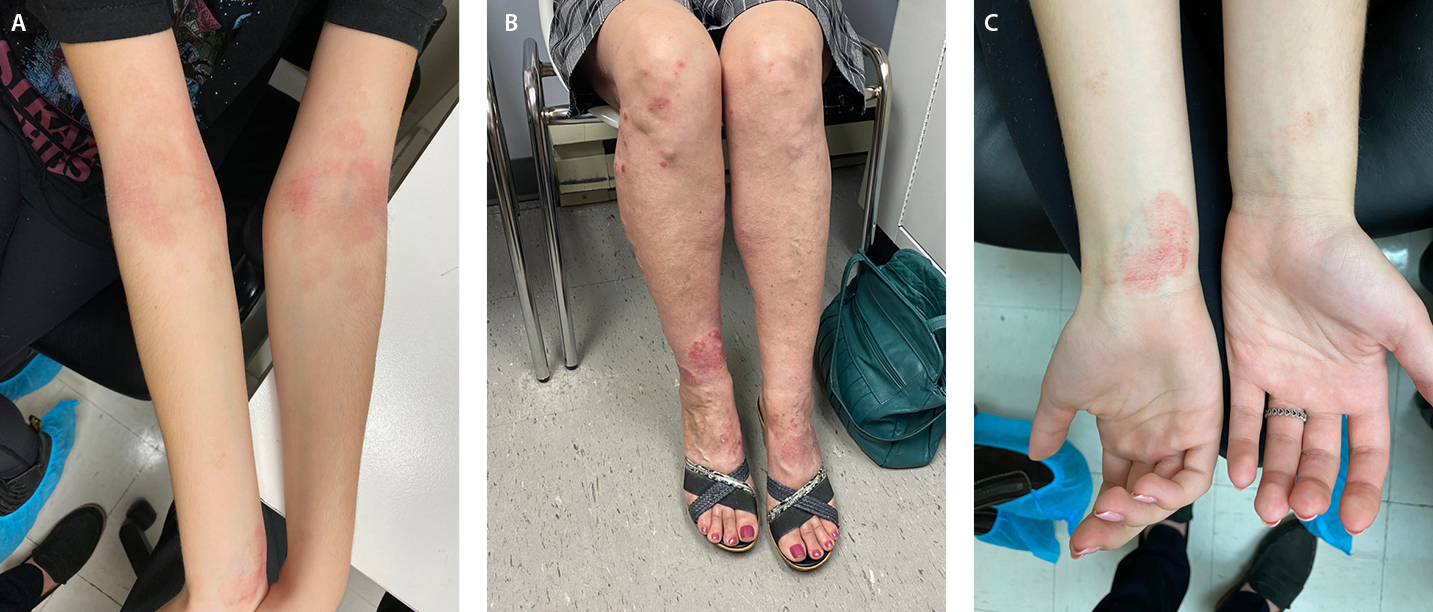
Figure 1 Clinical presentations of Atopic Dermatitis
A, Poorly demarcated erythematous plaques with fine scale on flexural aspect of the elbow. B, Well-demarcated erythematous plaques distributed on the dorsal aspect of the feet, ankle, and below the knee. C, Poorly demarcated erythematous patch on the flexural aspect of the wrist.
Classification by Serum IgE Levels
Extrinsic. The extrinsic subtype is characterised by elevated total IgE levels (>200 kU/L) in response to specific protein allergens, typically from the Dermatophagoides genus of mites, including Dermatophagoides pteronyssinus and Dermatophagoides farina. The main elevated cytokines include interleukin 4 (IL-4), IL-5, and IL-13, characteristic of a TH2 response. The extrinsic subtype arises from impaired skin barrier function, with 20% to 30% of patients having pathogenic FLG variants, and is much more common than the intrinsic subtype.9
Intrinsic. The intrinsic subtype is characterised by normal total IgE levels (<200 kU/L) and shows a sexual predilection toward women. The main elevated cytokine is interferon γ, characteristic of a TH1 response. Although the skin barrier is intact in the intrinsic subtype, metals and haptens can still penetrate the skin and trigger a response.9
Classification by Acuity of Presentation
Individual lesions of AD can be classified based on the acuity of presentation into acute, subacute, or chronic categories. An individual with AD may present with a combination of lesions in any of these different stages.
Acute. Acute lesions appear as poorly demarcated erythematous papulovesicular papules and plaque eruptions with blistering, weeping, and/or crusting. Widespread edema may also be present, with or without scales. Scratching can lead to erosions and pustules that are susceptible to secondary infection, primarily with Staphylococcus aureus.10
Subacute. Subacute lesions appear as poorly demarcated erythematous scaly plaques and papules.10
Chronic. Chronic lesions can involve lichenification (thickening of skin with increased visibility of skin markings) due to repeated scratching over time and scale.10
Classification by Age at Onset
Infantile (2 weeks to 2 years of age). Infantile-onset AD typically presents with lesions characterised as itchy papules and vesicles with associated serous exudate and/or crusting, most commonly affecting the head and neck. Lesions usually first appear as erythema and scaling on the cheeks, which then extend to the forehead, scalp, and neck. Extensor surfaces are also often involved as a result of trauma from crawling. Over time, scratching and rubbing can result in crusting and lichenification (thickening and increased skin surface markings).8
Childhood (2 years of age through puberty). In childhood-onset AD, facial involvement is less prominent, and instead the feet, ankles, wrists, and the flexural aspect of the knees and elbows are more commonly involved. Lesions are typically dry with lichenified plaques, papules, erosions (breakdown of epidermis with epidermal base), and/or crusts.8
Adult (postpuberty). Similar to childhood-onset AD, adult-onset AD primarily involves flexural regions, but also more commonly affects the face and neck. Lesions typically present as symmetrical, dry, scaly plaques, and papules. Excoriations and lichenification are commonly observed, whereas crusting and exudation are less frequent.8
Severity scoring
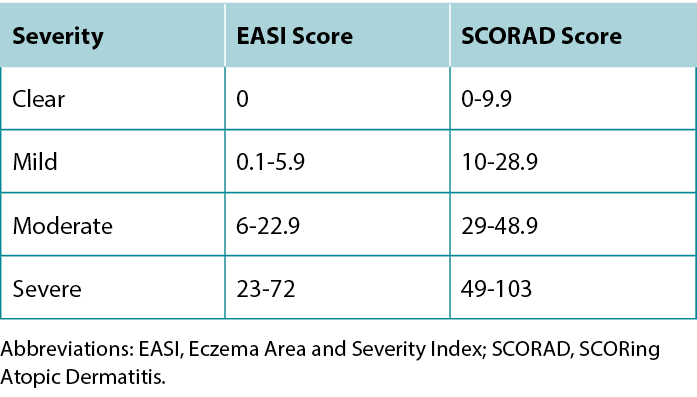
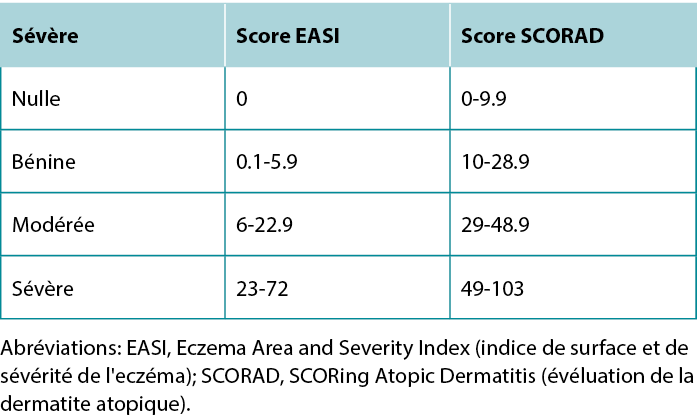
Once a diagnosis of AD has been achieved, describing the severity of the disease can guide treatment selection. The most commonly used severity scoring tools are the Eczema Area and Severity Index (EASI) and SCORing Atopic Dermatitis (SCORAD). Although both tools include the extent of erythema, swelling, excoriation, lichenification, and body area affected, the SCORAD also considers subjective patient measures.11 A summary of the severity grading strata for EASI and SCORAD is provided in Table 4.
Table 4 EASI and SCORAD severity grading strata.
AD treatments
Several treatment options are available for treating AD lesions to provide symptomatic relief for patients and break the itch-scratch cycle to prevent disease progression and development of secondary infection. Counsel patients to regularly use moisturisers with emollients, humectants, and occlusive agents to improve the skin barrier, provide some itch relief, and prevent future flares.12 Patients with AD should avoid products with fragrances to minimise potential exposure to allergens. Discuss the importance of identifying and avoiding factors that trigger or exacerbate AD lesions.13 A list of common trigger factors is provided in Table 5, and a summary of treatment options for AD is provided in Table 6.
Table 5 Triggers and exacerbating factors of Atopic Dermatitis.

Table 6 Treatment options for Atopic Dermatitis.
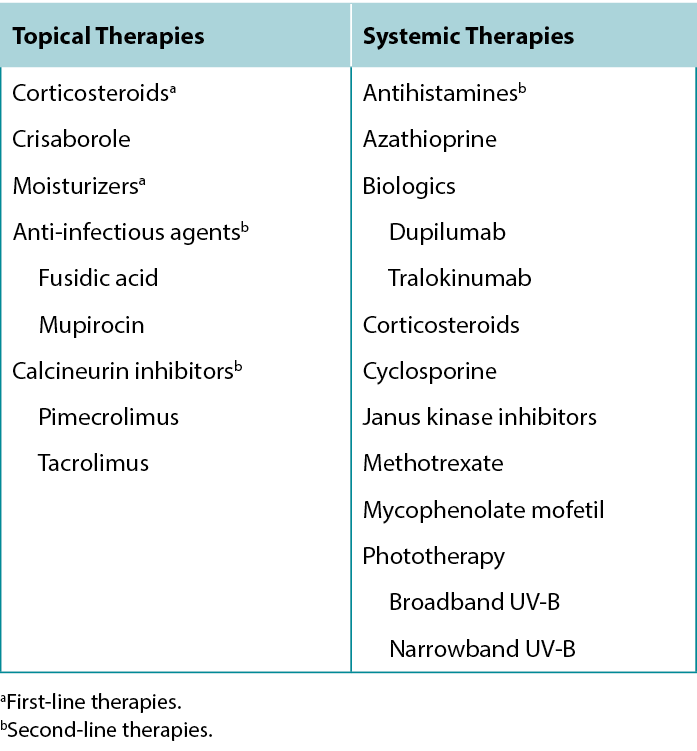
Pharmaceutical Topical Treatments
Topical moisturisers. Regular usage of moisturisers is the cornerstone of AD therapy. Moisturisers can contain a combination of humectants, occlusives, and emollients that help protect the skin barrier. Humectants are hydrophilic substances that hold onto water, occlusives are hydrophobic substances that form a physical layer over the skin to trap water below, and emollients fill spaces between dead skin cells to soften the skin.
In addition to helping patients manage dryness and itchiness of active AD lesions, moisturisers can also prolong relapse. In a trial involving 44 patients with AD lesions cleared by betamethasone 0.1% cream, those who applied an urea-containing moisturising cream as the sole maintenance therapy relapsed after more than 180 days on average, compared with 30 days for patients who did not use any maintenance therapy.14
Topical corticosteroids. Corticosteroids have anti-inflammatory properties that are used for treating acute flares and itchiness. In a trial involving 40 patients, those treated with mometasone furoate 0.1% cream nightly for 4 weeks achieved a 77% reduction in SCORAD score compared with 17% for Vaseline control (P < .001).15 Corticosteroids are classified by their potency, and choice of corticosteroid should be guided by the patient’s age, region of the body affected, and severity of disease. Generally, low-potency corticosteroids are used for milder disease, younger patients, and in areas involving the face and folds (intertriginous regions).8 Long-term topical corticosteroid use is associated with further decreased skin-barrier function, skin atrophy, telangiectasia, and purpura and can induce or aggravate rosacea and perioral dermatitis. As such, corticosteroids are only recommended for short-term treatment of flares and symptom management. Intradermal corticosteroid injections can also be provided to provide fast-acting relief for acute flares.
Topical calcineurin inhibitors (tacrolimus and pimecrolimus). Tacrolimus and pimecrolimus are calcineurin inhibitors with anti-inflammatory properties and skin barrier-preserving properties used in treating AD. In one trial, 49 patients who applied tacrolimus 0.1% ointment twice daily for up to 22 days achieved 72% reduction in EASI score compared with 26% for vehicle (P < .001).16 Unlike corticosteroids, long-term tacrolimus or pimecrolimus use is not associated with skin atrophy; they can be used to reduce corticosteroid load or for maintenance.17 Patients may experience burning or stinging upon application, but cooling the product in the refrigerator prior to application can alleviate this sensation.
Topical phosphodiesterase-4 inhibitors (crisaborole). Crisaborole is a phosphodiesterase-4 inhibitor with efficacy in treating AD through downregulating the production of proinflammatory cytokines. In one study involving 400 patients, those treated with crisaborole 2% ointment twice daily for 4 weeks achieved a mean reduction of 60% in EASI score compared with 43% for vehicle (P = .0002).18 Crisaborole is generally well tolerated and is another steroid-sparing option for treating AD.
Topical anti-infectious agents. Anti-infectious agents are typically used as adjunctive therapies in cases where there is accompanying infection or if it is believed that a microbial factor (eg, S aureus) is aggravating the AD.
Fusidic acid and mupirocin are antibiotics used for targeting staphylococcal and streptococcal bacteria and can be effective in treating AD if S aureus colonisation is a contributing pathogenesis factor. In one trial involving 239 patients, those treated with fusidic acid 2% plus hydrocortisone 1% cream showed significant improvements in factors including erythema, itching, and scaling compared with patients treated with fusidic acid 2% cream or hydrocortisone 1% cream alone (P = .009).19
Soaking with bleach (sodium hypochlorite) is another option for reducing colonisation by S aureus. Patients can mix a quarter to a half cup of 6% bleach solution with a bathtub full of water and soak for 5 to 10 minutes.
Systemic Pharmaceutical Treatments
Corticosteroids. Although corticosteroids can be taken orally, this is often not recommended due to rebound flares on cessation and adverse effects associated with systemic corticosteroid use (eg, weight gain, diabetes, muscle loss, gastrointestinal bleeds, etc). However, systemic corticosteroids may have benefits for treating severe acute flares.20
Calcineurin inhibitors (cyclosporine). Cyclosporine is a calcineurin inhibitor with anti-inflammatory properties that is useful in treating severe or recalcitrant forms of AD that have failed to respond to topic therapy. In one trial involving 46 patients, those who were treated with cyclosporine 5 mg/kg per day for 6 weeks achieved a mean 55% improvement in total body severity assessment score; in contrast, those with placebo worsened by 4% (P = .0002).21 Although cyclosporine offers rapid relief, its effects are not long-lasting, and maintenance therapy is required to prevent relapse.22 Renal impairment is a concern for initiating cyclosporine treatment and must be carefully monitored.
Purine analogs (azathioprine). Azathioprine is a corticosteroid-sparing immunosuppressant used in several inflammatory skin diseases including AD. In a trial involving 37 patients, those treated with azathioprine 2.5 mg/kg per day for 12 weeks reported a mean 26% improvement on factors including erythema, dryness, and lichenification compared with 3% for placebo (P < .01).23 Although azathioprine has similar indications for usage in treating AD as cyclosporine, it is less preferred for acute flares because it does not act as fast. Hepatotoxicity is a concern for initiating azathioprine treatment.
Folic acid inhibitors (methotrexate). Methotrexate has immunosuppressive properties and can be used in low doses to suppress AD symptoms and flares in moderate to severe cases. In a study involving 40 patients, methotrexate was as effective as cyclosporine.24 Patients treated with methotrexate 7.5 mg/wk achieved a mean reduction of 26 SCORAD points compared with a 25-point reduction for those treated with cyclosporine 2.5 mg/kg per day (P = .93).24 Similar to azathioprine, hepatotoxicity should be considered.
Inosine monophosphate dehydrogenase inhibitors (mycophenolate mofetil). Mycophenolate mofetil is another immunosuppressant with efficacy in treating AD. In a pilot study, 10 patients treated with 2 g/d for 4 weeks followed by 1 g/d for 4 weeks achieved a 55% decrease in SCORAD score (P < .01).25 Mycophenolate does not act as fast as corticosteroids or cyclosporine, but it can achieve satisfactory clinical control with fewer adverse effects and be used for maintenance therapy.
Biologics. Currently, the only approved biologics for treating AD are dupilumab and tralokinumab, both of which target the IL-13 signalling pathway. However, many other biologics are in development.
Dupilumab. Dupilumab is an IL-4/IL-13 inhibitor used in treating moderate to severe cases of AD that are recalcitrant to other topical and systemic therapies. In a trial with 671 patients, 38% of patients treated with dupilumab 300 mg subcutaneously every 2 weeks and 37% of those treated weekly for 16 weeks achieved clear or almost clear on the Investigator’s Global Assessment scale compared with 10% for placebo (P < .001).26 Dupilumab greatly improves inflammation and itchiness without dose-limiting toxicity but is an expensive treatment.
Tralokinumab. Tralokinumab is an IL-13 inhibitor with similar indications for use as dupilumab. In a trial with 802 patients, 25% of those treated with tralokinumab 300 mg subcutaneously every 2 weeks for 16 weeks achieved EASI 75 compared with 13% of patients in the control group (P < .001).27 Whereas both tralokinumab and dupilumab are effective, tralokinumab is associated with a lower risk of conjunctivitis.
Janus kinase inhibitors. Janus kinase (JAK) inhibitors are small-molecule inhibitors that target the JAK signalling pathway, which is associated with several proinflammatory cytokines. In a trial involving 560 patients, 80% of those treated with upadacitinib 30 mg daily for 16 weeks achieved EASI 75 compared with 16% for placebo (P < .0001).28 In addition to offering high-target specificity like the biologics, JAK inhibitors can be applied topically (tofacitinib, ruxolitinib, delgocitinib) or taken orally (tofacitinib, baricitinib, abrocitinib, upadacitinib), offering a simpler route of administration.
Currently, three JAK inhibitors have been approved by the US Food and Drug Administration for use in AD. The first was ruxolitinib, a JAK1/2 inhibitor that was approved in 2021. The newer JAK1 selective inhibitors, upadacitinib and abrocitinib, were approved in 2022. Because of the novelty of these agents, their safety information may not be comprehensive, and clinicians should practice extra caution. Janus kinase inhibitors have black box warnings including increased risk of serious infection, malignancy, and lipid level changes. The US Food and Drug Administration added additional black box warnings for JAK inhibitors in 2022 because of an increased risk of adverse cardiovascular events, including heart attack, stroke, and blood clot formation. However, this finding was from a trial studying the incidence of major adverse cardiovascular events in patients over the age of 50 years with rheumatoid arthritis and at least one cardiovascular risk factor being treated with tofacitinib, with nearly 100% of patients taking methotrexate and more than 50% taking prednisone concurrently.29 Although clinicians should always pay close attention to black box warnings, it should be noted that the patient demographics in that study are not representative of AD patients, nor does the treatment regimen represent one that would be used in patients with AD.
Antihistamines. Antihistamines are used as an adjunctive treatment in AD to provide itch relief but do not treat the underlying disease itself. Even so, histamines should be considered in patients experiencing great discomfort due to the itchiness, because breaking the itch-scratch cycle is key to preventing disease progression and complications. This is especially relevant for patients who experience difficulty sleeping, in which case sedating antihistamines can provide relief.30
For relieving itch at night, use first-generation antihistamines (eg, diphenhydramine, hydroxyzine, etc), which provide a sedative effect to aid in sleep. For daytime, it is best to use second-generation antihistamines (eg, cetirizine, bilastine, etc), which are much less sedating because of their diminished ability to cross the blood-brain barrier.
Phototherapy
Phototherapy is another option for patients whose AD cannot be controlled solely with topical therapy or who have extensive bodily involvement. Phototherapy modalities have shown efficacy in treating AD, including broadband UV-B and narrowband UV-B. Narrowband UV-B is considered first-line phototherapy, but its use can be limited by overheating and sweating, which can flare AD.31
Conclusions
Atopic dermatitis is the most common eczematic inflammatory skin condition, and it may reduce patients’ quality of life because of physical discomfort (itching, sleep disturbances) and adverse cosmetic effects. Management of AD often involves a combination of targeting the underlying disease and symptom management to break the itch-scratch cycle to prevent further exacerbation and promote disease remission. This can be achieved through the regular use of moisturisers and avoidance of triggers combined with either topical or systemic therapies.
Practice pearls
- Atopic dermatitis can be classified according to serum IgE levels, age at onset, and time of presentation.
- Atopic dermatitis lesions typically appear as poorly demarcated, scaly, and erythematous plaques associated with severe itching, most commonly found on flexural surfaces of knees, elbows, wrists, and sides of fingers.
- Use of moisturisers with emollient, humectant, or occlusive agents and avoidance of triggers are key to treatment.
- Symptomatic treatment to relieve physical discomfort and break the itch-scratch cycle can improve quality of life and prevent further exacerbation.
- Therapies with anti-inflammatory properties are the cornerstone of ad treatment.
Conflict of Interest
The authors declare no conflicts of interest.
Funding
The authors received no funding for this study.
Dermatite atopique: aspects cliniques et traitements
Ryan S Q Geng, R Gary Sibbald
DOI: 10.33235/wcet.44.2.29-36
Résumé
La dermatite atopique est l'affection cutanée inflammatoire eczémateuse la plus courante. Elle se manifeste par des lésions qui prennent généralement la forme de papules et de plaques érythémateuses et squameuses mal délimitées. Les lésions apparaissent le plus souvent sur les surfaces de flexion des genoux, des coudes et des poignets et sont associées à des démangeaisons modérées à sévères. Cet article se concentre sur la présentation clinique de la dermatite atopique et sur les options de traitement. L'épidémiologie, la pathogénie, les facteurs de risque, les déclencheurs et les diagnostics différentiels sont d'autres sujets connexes.
Introduction
La dermatite atopique (AD), ou eczéma atopique, est l'affection cutanée inflammatoire eczémateuse la plus courante, avec une prévalence de 15% au cours de la vie.1 Bien que des patients de tous âges puissent être affectés, l'apparition est maximale dans la petite enfance, avec 90% des cas avant l'âge de 5 ans.2 À noter que la prévalence de la AD a été multipliée par deux ou trois au cours des trois dernières décennies.3
La pathogenèse de la ADest multifactorielle et implique une interaction complexe entre la barrière cutanée, les facteurs génétiques et les expositions environnementales. Le dysfonctionnement de la barrière cutanée peut se caractériser par une augmentation de la perte d'eau transépidermique, une augmentation du pH de la peau ou une diminution des niveaux de céramides, d'humectants et de protéines structurelles. L'expression aberrante de la filaggrine (FLG, une protéine qui lie les fibres de kératine dans l'épiderme) ou l'utilisation excessive de savon, qui peut également accroître la perméabilité de la peau, constituent d'autres défis pour la fonction de barrière cutanée.4 Lorsque les mastocytes et les basophiles sont sensibilisés aux antigènes environnementaux, une réaction d'hypersensibilité médiée par l'immunoglobuline E de type I, la libération de cytokines et l'inflammation sont déclenchées, ce qui se traduit souvent par des démangeaisons intenses. Le grattage des lésions entraîne une détérioration supplémentaire de la barrière cutanée, appelée cycle démangeaison-grattage. De manière chronique, cela peut entraîner une aggravation de l'inflammation et de la lichénification.5
Compte tenu de l'inconfort physique et de l'aspect esthétique des lésions de la AD, les patients peuvent être confrontés à des problèmes psychosociaux importants, notamment la détresse sociale, la gêne et la limitation des activités.6 Étant donné l'impact potentiel sur la qualité de vie et l'incidence croissante de la AD, cette étude se concentrera sur les caractéristiques cliniques de la AD et sur les options thérapeutiques disponibles.
Facteurs de risque
La dermatite atopique fait partie de la triade atopique composée de la AD, de l'asthme et de la rhinite allergique. Il existe plusieurs facteurs de risque de développer une AD, le plus important étant l'existence d'antécédents familiaux positifs pour toute maladie atopique, en particulier la AD. Les gènes impliqués sont FLG, le groupe de cytokines TH2 et LRRC32 (qui code pour la glycoprotéine A répétitive prédominante).7
Des facteurs de risque environnementaux ont également été identifiés: le fait de vivre dans un environnement urbain, un climat sec, une faible exposition aux rayons UV et une alimentation riche en glucides simples et en acides gras polyinsaturés sont tous associés à un risque accru de AD.7 Le tableau 1 résume les facteurs de risque associés à la AD.
Tableau 1 Facteurs associés à un risque accru de développer une dermatite atopique.
Classifications cliniques
Bien que la présentation clinique de la AD soit hétérogène, avec des caractéristiques et des symptômes variés, les lésions se caractérisent typiquement par des papules érythémateuses, squameuses et mal délimitées, qui fusionnent en plaques avec de fortes démangeaisons, le plus souvent sur les surfaces de flexion des genoux, des coudes et des poignets. Les caractéristiques cliniques de la AD sont présentées dans le tableau 2, les caractéristiques essentielles, majeures et mineures étant indiquées sur la base des directives de l’Académie américaine de dermaologie.2 En raison de la grande variation de la présentation clinique de la AD, il existe un large différentiel, présenté dans le tableau 3. La classification des AD est basée sur la sérologie des biomarqueurs (IgE), l'acuité de la présentation et l'âge d'apparition. Les présentations cliniques de la AD sont indiquées dans la figure 1.
Tableau 2 Caractéristiques et symptômes de la AD.
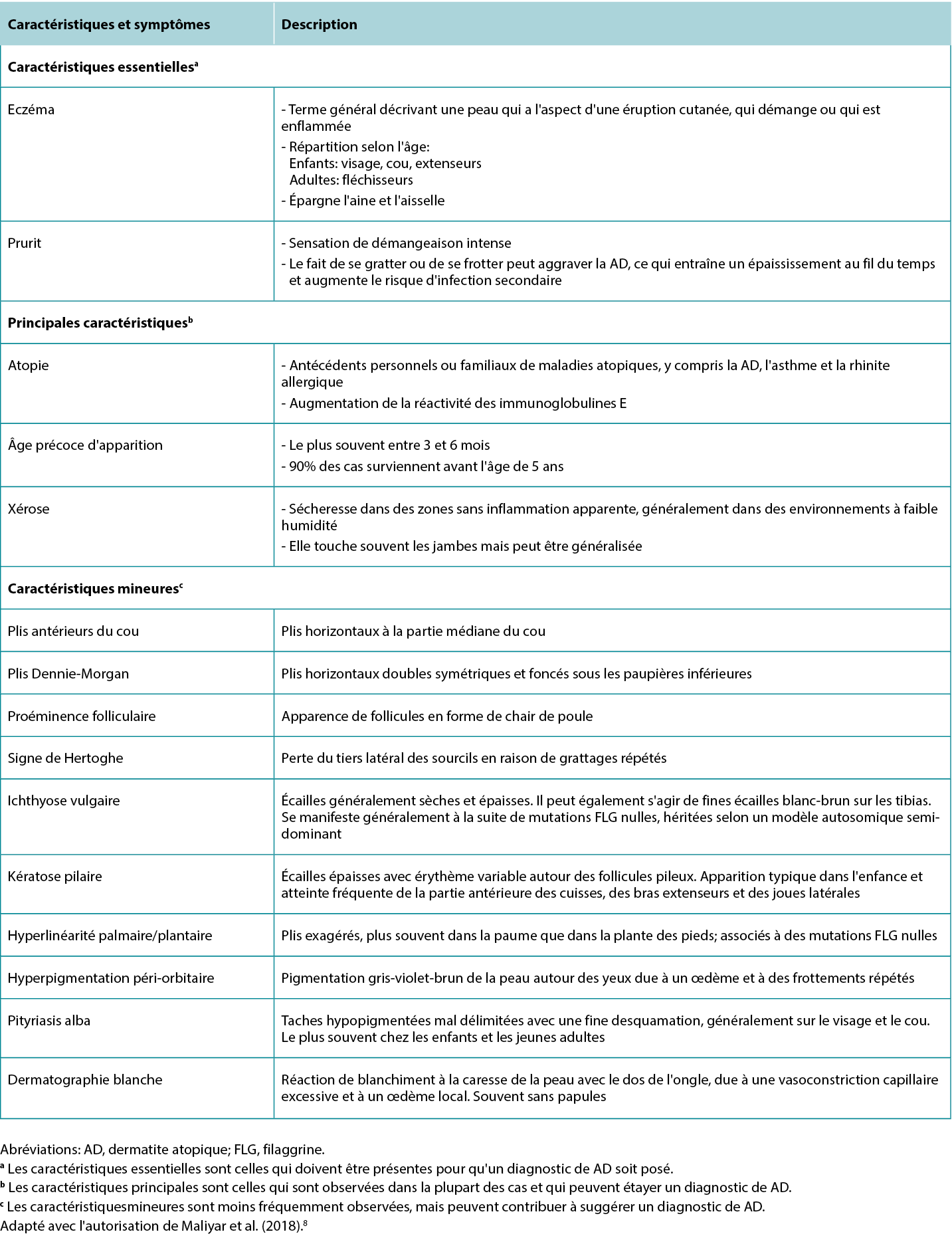
Tableau 3 Diagnostics différentiels de la dermatite atopique et caractéristiques distinctives.


Figure 1 Présentations cliniques de la dermatite atopique
A, plaques érythémateuses mal délimitées avec des squames fines sur la face de flexion du coude. B, plaques érythémateuses bien délimitées réparties sur la face dorsale des pieds, des chevilles et sous le genou. C, tache érythémateuse mal délimitée sur la face de flexion du poignet.
Classification en fonction des taux d'IgE sériques
Extrinsèque. Le sous-type extrinsèque se caractérise par des taux élevés d'IgE totales (>200 kU/L) en réponse à des allergènes protéiques spécifiques, généralement issus du genre Dermatophagoïdes , notamment Dermatophagoïdes pteronyssinus et Dermatophagoïdes farina. Les principales cytokines élevées sont l'interleukine 4 (IL-4), l'IL-5 et l'IL-13, caractéristiques d'une réponse TH2. Le sous-type extrinsèque résulte d'une altération de la fonction de barrière cutanée, 20 à 30% des patients présentant des variantes pathogènes de FLG, et est beaucoup plus fréquent que le sous-type intrinsèque.9
Intrinsèque. Le sous-type intrinsèque se caractérise par des taux d'IgE totales normaux (<200 kU/L) et présente une prédilection sexuée pour les femmes. La principale cytokine élevée est l'interféron γ, caractéristique d'une réponse TH1. Bien que la barrière cutanée soit intacte dans le sous-type intrinsèque, les métaux et les haptènes peuvent encore pénétrer dans la peau et déclencher une réponse.9
Classification selon l'acuité de la présentation
Les lésions individuelles de la AD peuvent être classées, en fonction de l'acuité de la présentation, dans les catégories aiguë, subaiguë ou chronique. Une personne atteinte de AD peut présenter une combinaison de lésions à n'importe lequel de ces différents stades.
Aiguë. Les lésions aiguës se présentent sous la forme de papules érythémateuses mal délimitées et d'éruptions en plaques avec des cloques, des suintements et/ou des croûtes. Un œdème généralisé peut également être présent, avec ou sans écailles. Le grattage peut entraîner des érosions et des pustules susceptibles de provoquer une infection secondaire, principalement par Staphylococcus aureus.10
Subaiguë. Les lésions subaiguës se présentent sous la forme de plaques et de papules érythémateuses et squameuses mal délimitées.10
Chronique. Les lésions chroniques peuvent entraîner une lichénification (épaississement de la peau avec augmentation de la visibilité des marques cutanées) due à un grattage répété au fil du temps et de la gradation.10
Classification selon l'âge à l'apparition des symptômes
Infantile (de 2 semaines à 2 ans). La AD infantile se manifeste typiquement par des lésions caractérisées par des papules et des vésicules prurigineuses associées à un exsudat séreux et/ou à des croûtes, affectant le plus souvent la tête et le cou. Les lésions apparaissent d'abord sous forme d'érythème et de desquamation sur les joues, puis s'étendent au front, au cuir chevelu et au cou. Les surfaces extensives sont également souvent touchées à la suite d'un traumatisme causé par la marche à quatre pattes. Avec le temps, le grattage et le frottement peuvent entraîner la formation de croûtes et une lichénification (épaississement et augmentation des marques à la surface de la peau).8
Enfance (de 2 ans à la puberté). Dans la AD infantile, l'atteinte faciale est moins importante, et ce sont plutôt les pieds, les chevilles, les poignets et les surfaces de flexion des genoux et des coudes qui sont le plus souvent touchés. Les lésions sont typiquement sèches avec des plaques lichénifiées, des papules, des érosions (rupture de l'épiderme avec la base épidermique) et/ou des croûtes.8
Adulte (post-puberté). Comme la AD infantile, la AD de l'adulte touche principalement les zones de flexion, mais aussi plus fréquemment le visage et le cou. Les lésions se présentent généralement sous forme de plaques et de papules symétriques, sèches et squameuses. Des excoriations et une lichénification sont fréquemment observées, tandis que les croûtes et l'exsudation sont moins fréquentes.8
Évaluation de la sévérité
Une fois le diagnostic de AD posé, la description de la sévérité de la maladie peut guider le choix du traitement. Les outils d'évaluation de la sévérité les plus couramment utilisés sont l’Indice de surface et de sévérité de l’eczéma (EASI) et l’ Évaluation de la dermatite atopique (SCORAD). Bien que les deux outils prennent en compte l'étendue de l'érythème, du gonflement, de l'excoriation, de la lichénification et de la surface corporelle affectée, le SCORAD tient également compte des mesures subjectives du patient.11 Le tableau 4 présente un résumé des strates d'évaluation de la sévérité pour l'EASI et le SCORAD.
Tableau 4: strates de gradation de la sévérité EASI et SCORAD.
Traitements de la ad
Plusieurs options thérapeutiques sont disponibles pour traiter les lésions de la AD afin de soulager les symptômes des patients et de rompre le cycle démangeaison-grattage dans le but de prévenir la progression de la maladie et le développement d’une infection secondaire. Conseiller aux patients d’utiliser régulièrement des crèmes hydratantes contenant des émollients, des humectants et des agents occlusifs afin d’améliorer la barrière cutanée, soulage les démangeaisons et prévient de nouvelles poussées.12 Les patients souffrant de AD doivent éviter les produits parfumés afin de minimiser l’exposition potentielle aux allergènes. Discuter de l’importance d’identifier et d’éviter les facteurs qui déclenchent ou exacerbent les lésions de la AD.13 Une liste des facteurs déclenchants courants est fournie dans le tableau 5, et une synthèse des options de traitement de la AD est fournie dans le tableau 6.
Tableau 5 Déclencheurs et facteurs d'aggravation de la dermatite atopique.
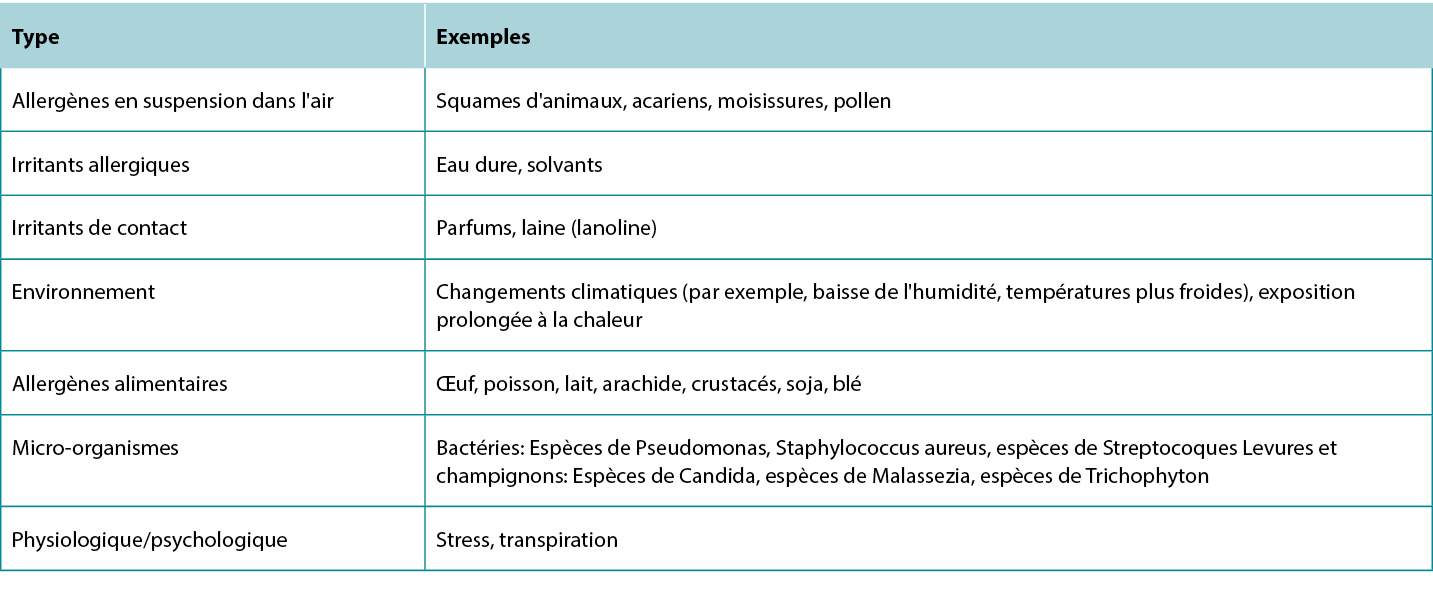
Tableau 6 Options de traitement de la dermatite atopique.
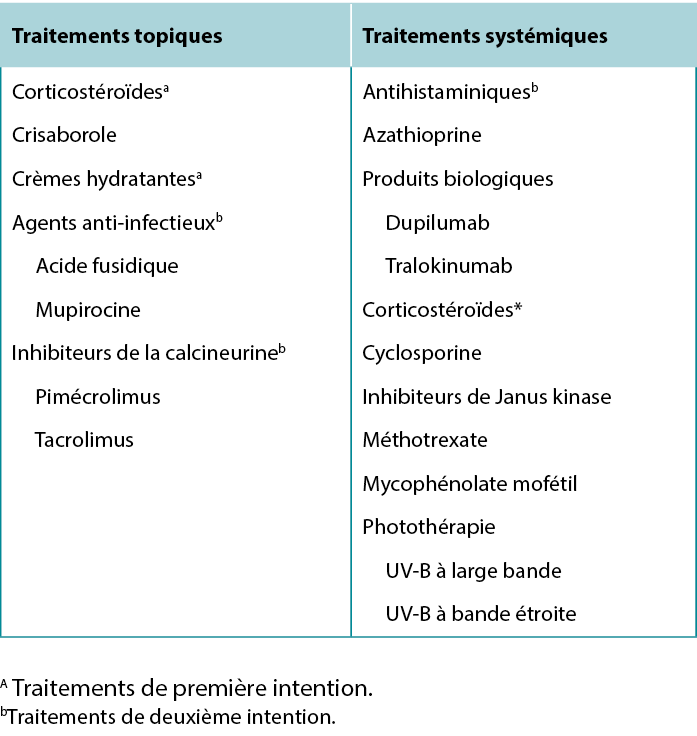
Traitements topiques pharmaceutiques
Hydratants topiques. L’utilisation régulière de crèmes hydratantes est la pierre angulaire du traitement de la AD. Les crèmes hydratantes peuvent contenir une combinaison d’humectants, d’occlusifs et d’émollients qui aident à protéger la barrière cutanée. Les humectants sont des substances hydrophiles qui retiennent l’eau, les occlusifs sont des substances hydrophobes qui forment une couche physique sur la peau pour retenir l’eau en dessous, et les émollients remplissent les espaces entre les cellules mortes pour adoucir la peau.
Outre le fait d’aider les patients à gérer la sécheresse et les démangeaisons des lésions actives d’une AD, les crèmes hydratantes peuvent également retarder les rechutes. Dans un essai portant sur 44 patients présentant des lésions de AD éliminées par la crème de bétaméthasone à 0,1%, ceux qui appliquaient une crème hydratante contenant de l’urée comme seul traitement d’entretien ont rechuté après plus de 180 jours en moyenne, contre 30 jours pour les patients qui n’utilisaient aucun traitement d’entretien.14
Corticostéroïdes topiques. Les corticostéroïdes ont des propriétés anti-inflammatoires et sont utilisés pour traiter les poussées aiguës et les démangeaisons. Dans un essai portant sur 40 patients, ceux traités avec la crème de furoate de mométasone à 0,1% tous les soirs pendant 4 semaines ont obtenu une réduction de 77% du score SCORAD, contre 17% pour le contrôle à la vaseline (P<0.001).15 Les corticostéroïdes sont classés en fonction de leur puissance, et le choix du corticostéroïde doit être guidé par l'âge du patient, la région du corps affectée et la sévérité de la maladie. En général, les corticostéroïdes de faible puissance sont utilisés dans les cas moins sévères, chez les jeunes patients et dans les zones impliquant le visage et les plis (régions intertrigineuses).8 L'utilisation à long terme de corticostéroïdes topiques est associée à une diminution supplémentaire de la fonction de barrière cutanée, à une atrophie de la peau, à des télangiectasies et à un purpura, et peut induire ou aggraver la rosacée et la dermatite péribuccale. Les corticostéroïdes ne sont donc recommandés que pour le traitement à court terme des poussées et la gestion des symptômes. Des injections intradermiques de corticostéroïdes peuvent également être réalisées pour soulager rapidement les poussées aiguës.
Inhibiteurs topiques de la calcineurine (tacrolimus et pimécrolimus). Le tacrolimus et le pimécrolimus sont des inhibiteurs de la calcineurine dotés de propriétés anti-inflammatoires et de préservation de la barrière cutanée, utilisés dans le traitement de la AD. Dans un essai, 49 patients ayant appliqué une pommade au tacrolimus à 0.1% deux fois par jour pendant 22 jours ont obtenu une réduction de 72% du score EASI, contre 26% pour le vecteur (P<0.001).16 Contrairement aux corticostéroïdes, l'utilisation à long terme du tacrolimus ou du pimécrolimus n'est pas associée à une atrophie cutanée; ils peuvent être utilisés pour réduire la charge de corticostéroïdes ou pour l'entretien.17 Les patients peuvent ressentir une sensation de brûlure ou de picotement lors de l'application, mais le refroidissement du produit au réfrigérateur avant l'application peut atténuer cette sensation.
Inhibiteurs topiques de la phosphodiestérase-4 (crisaborole). Le crisaborole est un inhibiteur de la phosphodiestérase-4 efficace dans le traitement de la AD par la réduction de la production de cytokines pro-inflammatoires. Dans une étude portant sur 400 patients, ceux traités avec une pommade de crisaborole à 2% deux fois par jour pendant 4 semaines ont obtenu une réduction moyenne de 60% du score EASI contre 43% pour le vecteur (P=0.0002).18 Le crisaborole est généralement bien toléré et constitue une autre option d'économie stéroïdienne pour le traitement de la AD.
Agents anti-infectieux topiques. Les agents anti-infectieux sont généralement utilisés comme traitement d'appoint en cas d'infection concomitante ou si l'on pense qu'un facteur microbien (par exemple, S aureus) aggrave la AD.
L'acide fusidique et la mupirocine sont des antibiotiques utilisés pour cibler les bactéries staphylococciques et streptococciques et peuvent être efficaces dans le traitement de la AD si la colonisation par S. aureus est un facteur pathogène contributif. Dans un essai portant sur 239 patients, ceux traités à l'acide fusidique à 2% associé à une crème d'hydrocortisone à 1% ont montré des améliorations significatives des facteurs tels que l'érythème, les démangeaisons et la desquamation par rapport aux patients traités avec une crème d'acide fusidique à 2% ou une crème d'hydrocortisone à 1% seule (P=0.009).19
Le trempage à l'eau de Javel (hypochlorite de sodium) est une autre option pour réduire la colonisation par S aureus. Les patients peuvent mélanger un quart à une demi-tasse de solution d'eau de Javel à 6% avec une baignoire remplie d'eau et y tremper pendant 5 à 10 minutes.
Traitements pharmaceutiques systémiques
Corticostéroïdes. Bien que les corticostéroïdes puissent être pris par voie orale, cela n'est souvent pas recommandé en raison des du rebond des poussées à l'arrêt du traitement et des effets indésirables associés à l'utilisation de corticostéroïdes systémiques (par exemple, prise de poids, diabète, perte musculaire, saignements gastro-intestinaux, etc.) Cependant, les corticostéroïdes systémiques peuvent présenter des avantages pour le traitement des poussées aiguës sévères.20
Inhibiteurs de la calcineurine (ciclosporine). La ciclosporine est un inhibiteur de la calcineurine aux propriétés anti-inflammatoires, utile dans le traitement des formes sévères ou récalcitrantes de la AD qui n'ont pas répondu au traitement symptomatique. Dans un essai portant sur 46 patients, ceux qui ont été traités par la ciclosporine à raison de 5 mg/kg par jour pendant 6 semaines ont obtenu une amélioration moyenne de 55% du score total d'évaluation de la sévérité corporelle; en revanche, ceux qui ont reçu un placebo ont vu leur état empirer de 4% (P=0.0002).21 Bien que la ciclosporine apporte un soulagement rapide, ses effets ne sont pas durables et un traitement d'entretien est nécessaire pour prévenir les rechutes.22 L'insuffisance rénale est un problème lors de l'instauration d'un traitement à la ciclosporine et doit être surveillée de près.
Analogues de la purine (azathioprine). L'azathioprine est un immunosuppresseur qui évite les corticostéroïdes et qui est utilisé dans plusieurs maladies inflammatoires de la peau, dont la AD. Dans un essai portant sur 37 patients, ceux traités avec 2.5 mg/kg d'azathioprine par jour pendant 12 semaines ont fait état d'une amélioration moyenne de 26% sur des facteurs tels que l'érythème, la sécheresse et la lichénification, contre 3% pour le placebo (P<0.01).23 Bien que l'azathioprine ait des indications similaires à celles de la cyclosporine pour le traitement de la AD, elle est moins recommandée pour les poussées aiguës car elle n'agit pas aussi rapidement. L'hépatotoxicité est un problème pour l'instauration d'un traitement à l'azathioprine.
Inhibiteurs de l'acide folique (méthotrexate). Le méthotrexate a des propriétés immunosuppressives et peut être utilisé à faibles doses pour supprimer les symptômes et les poussées de AD dans les cas modérés à sévères. Dans une étude portant sur 40 patients, le méthotrexate s'est avéré aussi efficace que la cyclosporine. 24 Les patients traités avec 7.5 mg/semaine de méthotrexate ont obtenu une réduction moyenne de 26 points SCORAD, contre une réduction de 25 points pour ceux traités avec 2.5 mg/kg de cyclosporine par jour (P= 0.93).24 Comme pour l'azathioprine, l'hépatotoxicité doit être prise en compte.
Inhibiteurs de l'inosine monophosphate déshydrogénase (mycophénolate mofétil). Le mycophénolate mofétil est un autre immunosuppresseur efficace dans le traitement de la AD. Dans une étude pilote, 10 patients traités avec 2 g/d pendant 4 semaines suivies de 1 g/d pendant 4 semaines ont obtenu une diminution de 55% du score SCORAD (P<0.01).25 Le mycophénolate n'agit pas aussi rapidement que les corticostéroïdes ou la cyclosporine, mais il permet d'obtenir un contrôle clinique satisfaisant avec moins d'effets indésirables et peut être utilisé comme traitement d'entretien.
Produits biologiques. Actuellement, les seuls médicaments biologiques approuvés pour le traitement de la AD sont le dupilumab et le tralokinumab, qui ciblent tous deux la voie de signalisation de l'IL-13. Cependant, de nombreux autres produits biologiques sont en cours de développement.
Dupilumab. Le dupilumab est un inhibiteur de l'IL-4/IL-13 utilisé pour traiter les cas modérés à sévères de la AD qui sont récalcitrants aux autres thérapies topiques et systémiques. Dans un essai portant sur 671 patients, 38% des patients traités avec 300 mg de dupilumab par voie sous-cutanée toutes les 2 semaines et 37% de ceux traités chaque semaine pendant 16 semaines ont obtenu un résultat clair ou plutôt clair sur l'Échelle d'évaluation globale de l'investigateur, contre 10% pour le placebo (P< 0.001).26 Le dupilumab améliore considérablement l'inflammation et les démangeaisons sans toxicité limitant la dose, mais il s'agit d'un traitement onéreux.
Tralokinumab. Le tralokinumab est un inhibiteur de l'IL-13 dont les indications d'utilisation sont similaires à celles du dupilumab. Dans un essai portant sur 802 patients, 25% des patients traités par 300 mg de tralokinumab par voie sous-cutanée toutes les 2 semaines pendant 16 semaines ont atteint un EASI 75, contre 13% des patients du groupe témoin (P< 0.001).27 Si le tralokinumab et le dupilumab sont tous deux efficaces, le tralokinumab est associé à un risque plus faible de conjonctivite.
Inhibiteurs de Janus kinase. Les inhibiteurs de Janus kinase (JAK) sont de petites molécules qui ciblent la voie de signalisation JAK, associée à plusieurs cytokines pro-inflammatoires. Dans un essai portant sur 560 patients, 80% de ceux traités par 30 mg d'upadacitinib par jour pendant 16 semaines ont atteint un EASI 75, contre 16% pour le placebo (P< 0.0001).28 En plus d'offrir une spécificité de cible élevée comme les médicaments biologiques, les inhibiteurs de JAK peuvent être appliqués par voie topique (tofacitinib, ruxolitinib, delgocitinib) ou pris par voie orale (tofacitinib, baricitinib, abrocitinib, upadacitinib), ce qui offre une voie d'administration plus simple.
Actuellement, trois inhibiteurs de JAK ont été approuvés par la Food and Drug Administration américaine pour le traitement de la AD. Le premier était le ruxolitinib, un inhibiteur de JAK1/2 qui a été approuvé en 2021. Les nouveaux inhibiteurs sélectifs de JAK1, l'upadacitinib et l'abrocitinib, ont été approuvés en 2022. En raison de la nouveauté de ces agents, les informations relatives à leur sécurité peuvent ne pas être complètes et les cliniciens doivent faire preuve d'une grande prudence. Les inhibiteurs de Janus kinase font l'objet d'avertissements dans la boîte noire, notamment en ce qui concerne le risque accru d'infections graves, de tumeurs malignes et de modifications du taux de lipides. En 2022, la Food and Drug Administration a ajouté des avertissements supplémentaires dans la boîte noire pour les inhibiteurs de JAK en raison d'un risque accru d'événements cardiovasculaires indésirables, notamment les crises cardiaques, les accidents vasculaires cérébraux et la formation de caillots sanguins. Cependant, ce résultat provient d'un essai étudiant l'incidence des événements cardiovasculaires indésirables majeurs chez des patients de plus de 50 ans atteints de polyarthrite rhumatoïde et présentant au moins un facteur de risque cardiovasculaire, traités par tofacitinib, avec près de 100% des patients prenant du méthotrexate et plus de 50% prenant de la prednisone simultanément.29 Bien que les cliniciens doivent toujours prêter une attention particulière aux avertissements de la boîte noire, il convient de noter que les caractéristiques démographiques des patients de cette étude ne sont pas représentatives des patients souffrant de AD, et que le régime de traitement ne représente pas non plus celui qui serait utilisé chez les patients souffrant de AD.
Antihistamines. Les antihistaminiques sont utilisés comme traitement d'appoint pour la AD afin de soulager les démangeaisons, mais ils ne traitent pas la maladie sous-jacente elle-même. Néanmoins, les histamines doivent être envisagées chez les patients qui éprouvent une grande gêne en raison des démangeaisons, car il est essentiel de rompre le cycle démangeaison-grattage pour prévenir la progression de la maladie et les complications. Ceci est particulièrement important pour les patients qui éprouvent des difficultés à dormir, auquel cas les antihistaminiques sédatifs peuvent apporter un soulagement.30
Pour soulager les démangeaisons nocturnes, utiliser des antihistaminiques de première génération (diphénhydramine, hydroxyzine, etc.), qui ont un effet sédatif pour faciliter le sommeil. Pour la journée, il est préférable d'utiliser des antihistaminiques de deuxième génération (par exemple, la cétirizine, la bilastine, etc.), qui sont beaucoup moins sédatifs en raison de leur capacité réduite à traverser la barrière hémato-encéphalique.
Photothérapie
La photothérapie est une autre option pour les patients dont la AD ne peut être contrôlée uniquement par un traitement topique ou qui présentent une atteinte corporelle étendue. Les modalités de la photothérapie ont montré leur efficacité dans le traitement de la AD, y compris les UV-B à large bande et les UV-B à bande étroite. Les UV-B à bande étroite sont considérés comme la photothérapie de première intention, mais leur utilisation peut être limitée par la surchauffe et la transpiration, qui peuvent aggraver la AD.31
Conclusions
La dermatite atopique est l'affection cutanée inflammatoire eczémateuse la plus courante. Elle peut réduire la qualité de vie des patients en raison de l'inconfort physique (démangeaisons, troubles du sommeil) et des effets cosmétiques indésirables. La prise en charge de la AD associe souvent le ciblage de la maladie sous-jacente et la gestion des symptômes pour rompre le cycle démangeaison-grattage afin d'éviter toute nouvelle exacerbation et de favoriser la rémission de la maladie. L'utilisation régulière de crèmes hydratantes et l'évitement des facteurs déclenchants, combinés à des thérapies topiques ou systémiques, permettent d'y parvenir.
Joyaux de la pratique
- La dermatite atopique peut être classée en fonction des taux d’IgE sériques, de l’âge d’apparition et du moment de la présentation.
- Les lésions de la dermatite atopique se présentent généralement sous la forme de plaques érythémateuses, squameuses et mal délimitées, associées à de fortes démangeaisons, le plus souvent sur les surfaces de flexion des genoux, des coudes, des poignets et des côtés des doigts.
- L’utilisation de crèmes hydratantes contenant des agents émollients, humidifiants ou occlusifs et l’évitement des facteurs déclenchants sont des éléments clés du traitement.
- Un traitement symptomatique visant à soulager la gêne physique et à rompre le cycle démangeaison-grattage peut améliorer la qualité de vie et prévenir une nouvelle exacerbation.
- Les traitements aux propriétés anti-inflammatoires sont la pierre angulaire du traitement de la AD.
Financement
Les auteurs n’ont reçu aucun financement pour cette étude.
Author(s)
Ryan S Q Geng*
MSc
Temerty School of Medicine, University of Toronto, Toronto, Ontario, Canada
R Gary Sibbald
MD Med FRCPC (Med Derm) FAAD MAPWCA JM
Dalla Lana School of Public Health & Division of Dermatology,
Department of Medicine, University of Toronto
* Corresponding author
References
- Deckers IA, McLean S, Linssen S, Mommers M, van Schayck CP, Sheikh A. Investigating international time trends in the incidence and prevalence of atopic eczema 1990-2010: a systematic review of epidemiological studies. PLoS One 2012;7(7):e39803.
- Eichenfield LF, Tom WL, Chamlin SL, et al. Guidelines of care for the management of atopic dermatitis: section 1. Diagnosis and assessment of atopic dermatitis. J Am Acad Dermatol 2014;70(2):338-51.
- Asher MI, Montefort S, Bjorksten B, et al. Worldwide time trends in the prevalence of symptoms of asthma, allergic rhinoconjunctivitis, and eczema in childhood: ISAAC phases one and three repeat multicountry cross-sectional surveys. Lancet 2006;368(9537):733-43.
- O’Regan GM, Sandilands A, McLean WHI, Irvine AD. Filaggrin in atopic dermatitis. J Allergy Clin Immunol 2008;122(4):689-93.
- Perkin MR, Strachan DP, Williams HC, Kennedy CT, Golding J, Team AS. Natural history of atopic dermatitis and its relationship to serum total immunoglobulin E in a population-based birth cohort study. Pediatr Allergy Immunol 2004;15(3):221-9.
- Gochnauer H, Valdes-Rodriguez R, Cardwell L, Anolik RB. The psychosocial impact of atopic dermatitis. Adv Exp Med Biol 2017;1027:57-69.
- Weidinger S, Beck LA, Bieber T, Kabashima K, Irvine AD. Atopic dermatitis. Nat Rev Dis Primers 2018;4(1):1.
- Maliyar K, Sibbald C, Pope E, Sibbald GR. Diagnosis and management of atopic dermatitis: a review. Adv Skin Wound Care 2018;31(12):538-50.
- Tokura Y, Hayano S. Subtypes of atopic dermatitis: from phenotype to endotype. Allergol Int 2022;71(1):14-24.
- Wolff K, Johnson RA, Saavedra AP, Roh EK. Atopic dermatitis. Fitzpatrick’s Color Atlas and Synopsis of Clinical Dermatology. New York: McGraw-Hill Education; 2017:34-40.
- Chopra R, Vakharia PP, Sacotte R, et al. Severity strata for Eczema Area and Severity Index (EASI), modified EASI, Scoring Atopic Dermatitis (SCORAD), objective SCORAD, Atopic Dermatitis Severity Index and body surface area in adolescents and adults with atopic dermatitis. Br J Dermatol 2017;177(5):1316-21.
- Ellis C, Luger T, Abeck D, et al. International Consensus Conference on Atopic Dermatitis II (ICCAD II): clinical update and current treatment strategies. Br J Dermatol 2003;148 Suppl 63:3-10.
- Jones SM. Triggers of atopic dermatitis. Immunol Allergy Clin North Am 2002;22(1):55-72.
- Wiren K, Nohlgard C, Nyberg F, et al. Treatment with a barrier-strengthening moisturizing cream delays relapse of atopic dermatitis: a prospective and randomized controlled clinical trial. J Eur Acad Dermatol Venereol 2009;23(11):1267-72.
- Islam MZ, Ali ME, Wahab MA, Khondker L, Siddique MRU. Efficacy of topical mometasone furoate 0.1% cream in the treatment of atopic dermatitis. Med Today 2014;26(1):36-40.
- Boguniewicz M, Fiedler VC, Raimer S, Lawrence ID, Leung DY, Hanifin JM. A randomized, vehicle-controlled trial of tacrolimus ointment for treatment of atopic dermatitis in children. Pediatric Tacrolimus Study Group. J Allergy Clin Immunol 1998;102(4 Pt 1):637-44.
- Queille-Roussel C, Paul C, Duteil L, et al. The new topical ascomycin derivative SDZ ASM 981 does not induce skin atrophy when applied to normal skin for 4 weeks: a randomized, double-blind controlled study. Br J Dermatol 2001;144(3):507-13.
- Ma L, Zhang L, Kobayashi M, et al. Efficacy and safety of crisaborole ointment in Chinese and Japanese patients aged ≥2 years with mild-to-moderate atopic dermatitis. J Dermatol 2023;50:847-55.
- Ramsay CA, Savoie JM, Gilbert M, Gidon M, Kidson P. The treatment of atopic dermatitis with topical fusidic acid and hydrocortisone acetate. J Eur Acad Dermatol Venereol 1996;7:S15-S22.
- Goh MS, Yun JS, Su JC. Management of atopic dermatitis: a narrative review. Med J Aust 2022;216(11):587-93.
- Van Joost T, Heule F, Korstanje M, van den Broek MJ, Stenveld HJ, van Vloten WA. Cyclosporin in atopic dermatitis: a multicentre placebo-controlled study. Br J Dermatol 1994;130(5):634-40.
- Lee SS, Tan AW, Giam YC. Cyclosporin in the treatment of severe atopic dermatitis: a retrospective study. Ann Acad Med Singap 2004;33(3):311-3.
- Berth-Jones J, Takwale A, Tan E, et al. Azathioprine in severe adult atopic dermatitis: a double-blind, placebo-controlled, crossover trial. Br J Dermatol 2002;147(2):324-30.
- Tsakok T, Flohr C. Methotrexate vs. ciclosporin in the treatment of severe atopic dermatitis in children: a critical appraisal. Br J Dermatol 2014;170(3):496-8.
- Grundmann-Kollmann M, Podda M, Ochsendorf F, Boehncke W-H, Kaufmann R, Zollner TM. Mycophenolate mofetil is effective in the treatment of atopic dermatitis. Arch Dermatol 2001;137(7):870-3.
- Simpson EL, Bieber T, Guttman-Yassky E, et al. Two phase 3 trials of dupilumab versus placebo in atopic dermatitis. N Engl J Med 2016;375(24):2335-48.
- Wollenberg A, Blauvelt A, Guttman-Yassky E, et al. Tralokinumab for moderate-to-severe atopic dermatitis: results from two 52-week, randomized, double-blind, multicentre, placebo-controlled phase III trials (ECZTRA 1 and ECZTRA 2). Br J Dermatol 2021;184(3):437-49.
- Guttman-Yassky E, Teixeira HD, Simpson EL, et al. Once-daily upadacitinib versus placebo in adolescents and adults with moderate-to-severe atopic dermatitis (Measure Up 1 and Measure Up 2): results from two replicate double-blind, randomised controlled phase 3 trials. Lancet 2021;397(10290):2151-68.
- Ytterberg SR, Bhatt DL, Mikuls TR, et al. Cardiovascular and cancer risk with tofacitinib in rheumatoid arthritis. N Engl J Med 2022;386(4):316-26.
- Klein PA, Clark RA. An evidence-based review of the efficacy of antihistamines in relieving pruritus in atopic dermatitis. Arch Dermatol 1999;135(12):1522-5.
- Rodenbeck DL, Silverberg JI, Silverberg NB. Phototherapy for atopic dermatitis. Clin Dermatol 2016;34(5):607-13.
