Volume 40 Number 4
A quality improvement project comparing two treatments for deep-tissue pressure injuries to feet and lower legs of long-term care residents
Autumn Henson and Laurie Kennedy-Malone
Keywords pressure injury, deep-tissue pressure injury, lower-extremity injury, long-term care, offloading, polymeric membrane dressings, skin barrier film
For referencing Henson A and Kennedy-Malone L. A quality improvement project comparing two treatments for deep-tissue pressure injuries to feet and lower legs of long-term care residents. WCET® Journal 2020;40(4):30-35
DOI https://doi.org/10.33235/wcet.40.4.30-35
Abstract
Objective To retrospectively examine clinical outcomes from a feasibility study that compared two treatment options for deep-tissue pressure injuries (DTPIs), including the clinical indicators increasing the risk of deteriorating DTPIs among long-term care residents.
Methods A retrospective chart audit of 40 DTPIs from 33 long-term care residents in two long-term care facilities were conducted to compare 1: polymeric membrane dressings (PMDs) with offloading; and 2: a skin barrier film with offloading.
Results Of the 13 DTPIs treated with PMDs, only 23% deteriorated to a stage 3 or 4 pressure injury (PI), whereas of the 27 DTPIs treated with skin barrier film, 41% deteriorated to a stage 3 or 4 PI. The clinical factors found to increase the risk of developing and deteriorating DTPIs included weight loss, hypoalbuminemia, debility, dementia, coronary artery disease, and cerebrovascular disease.
Conclusions The PMD group’s DTPIs evolved into fewer open PIs despite having higher percentages of clinical indicators for DTPIs. The project findings support the use of PMD dressings for DTPIs; however, more robust research is warranted.
Introduction
A pressure injury (PI) is pressure-related damage to a local area of skin and the underlying tissue, generally over a bony prominence.1 These injuries present a significant challenge for the staff of long-term care facilities (LTCFs) and affect their residents’ quality of life, escalating healthcare costs, readmissions, risk of infection, pain, depression, and death.2,3 Deep-tissue pressure injuries (DTPIs) are PIs that occur under intact skin, which are thought to first develop in the deep tissues of the body and then appear on the skin surface4 as nonblanchable red, purple, or maroon discoloration or a blood-filled blister.1
Despite current treatment, these injuries often rapidly become open wounds.4 Typically, DTPI treatment aims to prevent further damage and avoid devolution to stage 3 or 4 PI.4 However, there is limited research on DTPI treatment, so this quality improvement project was implemented to retrospectively analyse the findings of a feasibility study that compared a drug-free polymeric membrane dressing (PMD) with the use of a skin barrier film among residents in two LTCFs with DTPIs on their feet and lower legs. The PMD is a foam dressing designed to reduce inflammatory factors and edema related to skin damage while requiring infrequent dressing changes.5 The PMD was chosen because of its easy accessibility and supply in the study LTCFs. Skin barrier films come in multiple forms and comprise a transparent coating to protect skin from trauma and moisture.6 The previous DTPI treatments used in the two facilities were a skin barrier film and offloading; despite using the skin barrier film twice a day, the facilities continued to see deteriorating DTPIs, prompting the feasibility study.
Along with the current treatment concerns regarding DTPIs, research is ongoing to ascertain whether there are clinical indicators that influence the evolution of DTPIs into open wounds. In LTCFs, most residents have multiple comorbidities that influence PI risk, including DTPIs.7 Further studies are needed to conclusively establish the clinical indicators that potentially contribute to DTPIs so they can be mitigated.
Background and Clinical Problem
The prevalence of DTPIs has increased threefold since 2006, presumably because of the classification of DTPIs, which were defined in 2007. This increased the awareness of DTPIs.4 Changes in regulations and improvements in prevention and treatment have not reduced their incidence, and the number and cost of all PIs continue to increase.8 In addition to causing pain and suffering for LTCF residents, DTPIs cost LTCFs as much as $3.3 billion annually.9
The most common location for a DTPI is on the heel. Heels are mostly bony prominences covered by a thin layer of skin with little padding or protection from pressure.10,11 Further, other medical conditions, such as respiratory and/or cardiovascular issues, increase the time residents spend supine, and they often require the head of the bed to be elevated, which places additional pressure on the feet and legs.10-13 The same pressure mechanisms damage the soft tissues of the lateral areas of the foot and toes; because of chronic lateral positioning, these areas often experience sustained, unrelieved pressure.11
Shearing is a common risk factor to consider in the evolution of DTPIs.13,14 The layers of skin stretched against a surface with friction and pressure result in damage on the surface and deeper internal tissues.14 Shearing risk includes passive repositioning of residents, elevating the head of the bed, and involuntary active movements involving spasms or tremors from medical conditions, which increase the constant positioning/pressure of the feet against the mattress.14 The risk of pressure and shearing consequently increases the risk of deterioration of DTPIs of the feet and lower legs.4,14,15
In addition to the lack of standard treatment for DTPIs, there is concern about whether DTPI deterioration could be affected by certain clinical indicators. In many LTCFs, a large percentage of residents with limited mobility and debility have a higher risk of developing a PI. As residents age, the number of medical conditions they encounter increases.7 Published studies show that medical conditions such as anemia, diabetes mellitus, fecal or urinary incontinence, vascular disease, or malnutrition increase the risk of developing PIs and (more recently) DTPIs.3,4,7,16 Of these risk factors, anemia has been most commonly associated with an increased risk of DTPIs.3,4 A review by Gefen et al13 notes that variables such as fever, uncontrolled cardiovascular disease, or respiratory acidosis could also increase the risk of DTPIs. Accordingly, this project not only compared two different treatment options for DTPIs, but also considered the resident’s clinical indicators and their potential influence on DTPI deterioration.
The treatment of DTPIs generally falls into one of two categories: offloading and application. In a Cochrane systematic review, McGinnis and Stubbs17 studied heel pressure-reducing devices for offloading in the treatment of heel ulcers. According to their results, there is no single device available that meets all of the criteria for comfort in the prevention and treatment of heel ulcers by removing pressure with offloading. There also is a need for further research into relieving heel pressure and treating PIs with offloading.17 Van Leen et al18 reviewed pressure-reducing techniques for PI treatment in a longitudinal study in a Dutch LTCF. Offloading the feet and lower legs led to a statistically significant decrease in PIs from 16.6% to 5.5%, with the most benefit for patients with medium to high risk of PIs. Over the years of the study, 57.8% of the patients at medium to high risk of PI with documented offloading of feet and legs (as well as educational intervention) were less likely to develop a PI.18
The other category of treatment is the application of dressings. A randomised controlled study by Sullivan19 evaluated the treatment of DTPIs with dressings and demonstrated that 74% of DTPIs decreased in size or resolved with the use of a self-adherent, multilayered, silicone-based border foam dressing. Of the 128 DTPIs in this study, only one opened to deeper tissue, and the other injuries either did not open or opened to the dermis with a mean healing time of 17.8 days. Essentially, the multilayered foam dressings decreased deterioration and improved resolution time.19
Campbell et al16 evaluated the use of padded-heel dressings to treat heel wounds. The treatment group showed 100% improvement among the 20 participants, whereas only 13 of 20 wounds in the control group closed. The study also demonstrated that the treatment group required less time and financial expense to heal.16
The National Pressure Injury Advisory Panel recommends the use of offloading and preventive dressings on residents who are at high risk of developing heel ulcers.20 Levy et al15 observed that prophylactic dressings applied to the heels decreased the risk of DTPIs by reducing stress and shear. Ultimately, the use of dressings to protect skin and offload pressure and shearing is widely recommended, although comparison studies are limited and warranted.
Methods
The purpose of this project was to retrospectively compare, analyse, and evaluate the documented deterioration of DTPIs to open PI among residents using two different treatments. The secondary purpose was to determine the prevalence of clinical indicators known to contribute to the development of DTPIs in the PMD group versus the skin barrier film group.
This project sought to answer the following research questions:
(1) Do PMDs and foot offloading reduce deterioration of DTPIs for residents 55 years or older better than skin barrier film with offloading?
(2) What was the prevalence of various clinical indicators among residents who developed a DTPI on their foot and/or lower extremity, and would a change in treatment have an impact on the evolution of the DTPI?
Study Initiation and Ethics
An analysis of administrative data collected by the quality assurance and performance improvement team from two LTCFs during 2014 and 2015 showed that 36% of DTPIs evolved into open stage 3 or 4 PIs when treated with offloading and the twice-daily application of a skin barrier film. This finding was the catalyst to perform a feasibility study comparing the skin barrier film with PMDs for DTPIs that developed between October 2015 and May 2017 in the two facilities. The PMD was chosen because it was new to the facilities’ formulary lists, was easily accessible, and had evidence of benefit for other types of wounds.
This retrospective comparative analysis project conducted in fall 2017 examined the outcomes for the 33 residents with a total of 40 DTPIs included in the feasibility study. Researchers conducted a systematic chart audit comparing the treatments of PMD or skin barrier film for the sample of residents with DTPIs and based on the type of treatment used from October 2015 to May 2017. Charts were included in the project if the resident had a DTPI to the feet and lower legs, were at least 55 years old, and were treated with either PMDs or skin barrier film with offloading.
During the feasibility study, each resident in each group had an ongoing order for offloading to the DTPI. The residents chosen for the PMD group either provided consent for the new treatment or permission was granted by the resident’s responsible party. Treatment with PMD included cutting the PMD to a size slightly larger than the DTPI as well as the application of a transparent medical dressing to cover the PMD once applied. The dressing was changed twice a week. The skin barrier film wipes were applied twice daily, and skin was allowed to dry following the application. The university’s institutional review board deemed the current project exempt. The LTCFs’ corporate holding company, administrative leadership teams, and medical providers’ board members approved the project.
Setting and Participants
The two participating LTCFs are Medicare and Medicaid approved, with private pay residents and a bed capacity of approximately 90 and 110 residents, respectively. They are in the southeastern US. These facilities provide short- and long-term care services that include rehabilitation and complex medical care for residents with reduced physical and mental functioning and multiple comorbidities such as PIs and DTPIs.
Data were extracted, deidentified, audited for the inclusion criteria, and given to the principal investigator by chart auditors. The sample was developed based on resident treatment, with the skin barrier group comprising 23 residents with 27 DTPIs, and the PMD group, 10 residents with 13 DTPIs.
Data Collection and Outcome Measures
Trained medical records experts from each facility extracted previously recorded data from the electronic medical record program called the Electronic Charting System. The data collectors were trained by the principal investigator as to what specific data to extrapolate and code for data entry. The data collectors received standardised training from the investigator to ensure the accuracy of the data collection and the systematic retrieval of the information. Data were retrieved from the electronic medical record on each resident for every DTPI documented. The generated data reports were deidentified and transferred into a private, secure PDF file by the data collectors. The PDF file was then coded and converted into a Microsoft Excel form and organised into a secure database and stored in a password-protected file for retrieval by the principal investigator for analysis.
Data extracted from the medical charts consisted of both demographics and clinical indicators. Demographics included resident age, sex, and ethnicity. The clinical indicators included laboratory test results (anemia and hypoalbuminemia screening), chronic diseases/comorbidities, health history, functional status, and Braden Scale scores.
The Braden Scale is an assessment tool used to determine the risk of developing a PI. The Braden Scale scoring ranges from less than 9 to 32. The lower the Braden Scale score, the higher the risk of developing a PI.21 Residents with albumin levels less than 3.2 g/dL (reference range, 3.5-5.2 g/dL) demonstrated hypoalbuminemia, which may reflect a decrease in nutrition status in certain patient populations.7 Anemia was identified as a hemoglobin level below the reference range of 12 to 15 g/dL. Chronic diseases and comorbidities were identified with a diagnosis or International Classification of Diseases, 10th Revision code and included peripheral vascular disease, dementia, coronary artery disease, and/or cerebrovascular disease.
Further data included history of previous PI and recent orthopedic history such as any fracture or surgery to the lower half of the body. In addition, information on the resident’s level of activities of daily living support and any history of chronic involuntary movements was retrieved. Weight changes were also noted, that is, whether each resident had weight gain or weight loss prior to the identification of the DTPI(s).
Any diagnosis of peripheral vascular disease noted in the residents’ chart was captured in the data collection. Because no residents had a documented ankle-brachial pressure index to confirm diagnosis, residents with peripheral artery disease were excluded. In addition, residents with previously diagnosed diabetic or arterial ulcers were excluded.
The outcome variables included DTPI deterioration and PI stage at the time of opening, if applicable.
Statistical Analysis
The Microsoft Excel Descriptive Statistics Tool (Redmond, Washington) was used to analyse the data from the two groups. Descriptive statistics were used to describe the sample. Independent χ2 tests were used to compare each group with the clinical outcomes of opening or not opening. P < .05 was considered statistically significant.
Results
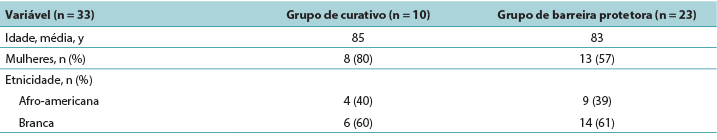
The majority of participants were White women with a mean age of 84 years. The PMD group was slightly older than the skin barrier film group (Table 1).
Table 1. Demographics of Residents with deep-tissue pressure injury by treatment group
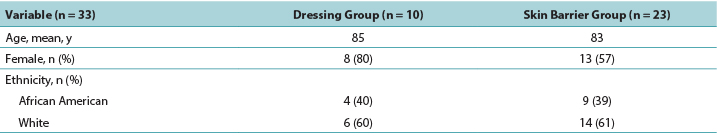
A simple statistical analysis compared the primary outcome measure between groups; according to the independent χ2 test, the difference was not statistically significant (P = .3160). In the PMD group, 23% of the DTPIs deteriorated to an open PI, whereas 41% of the DTPIs in skin barrier film group opened to a stage 3 or 4 PI. Of the DTPIs that opened, only two of the PMD group wounds opened to a stage 3 PI, and only one opened to a stage 4 PI. Of the DTPIs in the skin barrier film group, seven DTPIs opened to a stage 3 PI, and four opened to a stage 4 PI (Table 2).
Table 2. Wound outcomes
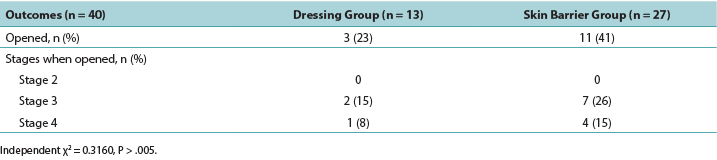
Descriptive data were generated for the clinical indicators that increased the risk of developing a DTPI (Table 3). The PMD group had more residents with known clinical indicators for DTPIs. The number of residents needing two people to assist in their activities of daily living was a significant factor, representing 80% of the PMD group and 61% of the skin barrier film group. Residents in both groups had an average Braden Scale score of 15, indicating at least a moderate risk of developing a DTPI. Weight loss and lower albumin scores were implicated, especially for the PMD group, with 90% seeing weight loss and 60% hypoalbuminemia. The residents with severe dementia (PMD, 60%; skin barrier film, 30%) also demonstrated a higher risk of DTPI, as well as residents with a diagnosis of coronary artery disease or cerebrovascular disease (PMD, 90%; skin barrier film, 78%). To investigate shearing, data were collected on residents who had abnormal lower extremity movement such as tremors or spasms. In the PMD group, this clinical indicator may have contributed to the development of DTPIs in 70% of the residents. Interestingly, anemia was an indicator for DTPIs (PMD, 40%; skin barrier film, 39%), although not to the significance level noted in other studies.
Table 3. Clinical Indicators of Residents with deep-tissue pressure injury by treatment group
Discussion
This retrospective project concluded that skin barrier film and offloading did not prevent the deterioration of DTPIs. Only three DTPIs evolved into an open wound in the PMD group, compared with 11 of the DTPIs in the skin barrier film group. Although this project did not have the statistical power to demonstrate significance, results indicate a possible benefit to changing the current treatment from the skin barrier film with offloading to PMDs with offloading.
This project found a higher risk of deteriorating DTPIs in the residents with more clinical indicators, in accordance with previous studies.7,16 Many of the LTCF residents’ medical conditions continue to be significant indicators, including weight loss, lower albumin levels, abnormal movements such as spasms or tremors, coronary artery disease, and cerebrovascular disease.4,16 Indicators such as anemia, previous orthopedic surgeries or fractures, peripheral vascular disease, and severe dementia were associated with a moderate risk of deteriorating DTPIs; previous studies found these were high-risk indicators.4,7,16 Interestingly, the PMD group had more clinical indicators for DTPI deterioration on average and yet had better outcomes. This demonstrates that treatment and management can outweigh the effects of clinical indicators for DPTI progression.
Limitations
The convenience sample size was small because of the total number of residents with diagnosed DTPI during the feasibility study period. Although all of the data collectors were trained by one person at the same time, there was no interrater reliability testing. Further, the diagnosis of DTPI was extracted by the data collectors based on provider diagnosis, because an International Classification of Diseases, 10th Revision code for DTPI was not established until 2019. Finally, it is important to note that PMDs may not be available in all healthcare settings, limiting the generalisability of the findings.
Implications for Clinical Practice
Offloading and repositioning of LTCF residents continue to be the recommended treatment for DTPIs. However, complications related to deteriorating DTPIs affect LTCF residents and strain the healthcare system. This project compares two different treatments for DTPIs, while considering the clinical indicators that may increase the risk of DTPI deterioration. Although further evidence is needed to address the cost-effectiveness of these treatments, PMD likely reduced the deterioration of DTPIs. Therefore, PMDs may be attractive to facilities striving to deliver efficient healthcare for their residents, especially those with high-risk residents.
Conclusions
Although prevention is crucial, once a DTPI has developed, having a fast and reliable treatment option to prevent further deterioration is of the utmost importance. By addressing DTPIs with offloading and screening for clinical indicators of deterioration, along with a preventive treatment such as PMD, the trajectory for these injuries could be vastly improved.
Conflict of Interest
The authors declare no conflicts of interest.
Funding
The authors received no funding for this study.
Um projeto de melhoria de qualidade comparando dois tratamentos para lesão por pressão tissular profunda nos pés e pernas de residentes de cuidados de longo prazo
Autumn Henson and Laurie Kennedy-Malone
DOI: https://doi.org/10.33235/wcet.40.4.30-35
Resumo
Objetivo Examinar retrospectivamente os resultados clínicos de um estudo de viabilidade que comparou duas opções de tratamento para lesões por pressão tissular profunda (LPTPs), incluindo os indicadores clínicos que aumentam o risco de agravar as LPTPs em residentes de cuidados prolongados.
Métodos Um auditoria retrospectiva do quadro de 40 LPTPs de 33 residentes de cuidados de longo prazo em dois estabelecimentos de cuidados de longo prazo foi conduzida para comparar 1: curativos de membrana polimérica (PMDs, do inglês polymeric membrane dressings) com alívio de pressão; e 2: uma película protetora da pele com alívio de pressão.
Resultados Das 13 LPTPs tratadas com PMD, apenas 23% se agravaram a uma lesão por pressão (LP) estágio 3 ou 4, enquanto das 27 LPTPs tratadas com a película protetora da pele, 41% se agravaram a uma LP estágio 3 ou 4. Os fatores clínicos que aumentam o risco de desenvolver e agravar as LPTPs incluíram perda de peso, hipoalbuminemia, debilidade, demência, doença arterial coronariana e doença cerebrovascular.
Conclusões O grupo das LPTPs com PMD evoluiu em menos LPs abertas, embora tenha maiores porcentagens de indicadores clínicos para LPTPs. Os achados do projeto apoiam o uso de curativos PMD para LPTPs; no entanto, pesquisas mais robustas são necessárias.
Introdução
Uma lesão por pressão (LP) é um dano relacionado à pressão em uma área local da pele e tecido adjacente, geralmente sobre uma proeminência óssea.1 Essas lesões apresentam um desafio significativo para os funcionários de estabelecimentos de cuidados de longo prazo (ECLPs) e afetam a qualidade de vida de seus residentes, aumentando os custos com atendimento médico, readmissões, risco de infecção, dor, depressão e óbito.2,3 As lesões por pressão tissular profundas (LPTPs) são LPs que ocorrem por baixo da pele intacta, as quais acredita-se que se desenvolvam primeiro nos tecidos profundos do corpo para depois aparecer na superfície da pele4 como descoloração não branqueável vermelha, roxa ou marrom ou como uma bolha preenchida por sangue.1
Apesar dos tratamentos atuais, essas lesões geralmente se tornam feridas abertas rapidamente.4 Tipicamente, o tratamento de uma LPTP procura prevenir maiores danos e evitar a evolução para uma LP estágio 3 ou 4.4 No entanto, há poucas pesquisas sobre o tratamento das LPTPs, então este projeto de melhoria de qualidade foi implementado para analisar retrospectivamente os achados de um estudo de viabilidade que comparou um curativo de membrana polimérica (PMD) sem remédios com o uso de uma película protetora da pele entre residentes de dois ECLPs com LPTPs em seus pés e pernas. O PMD é um curativo de espuma desenvolvido para reduzir os fatores inflamatórios e edemas relacionados aos danos cutâneos ao mesmo tempo em que não demanda trocas frequentes.5 O PMD foi escolhido devido a sua fácil disponibilidade e fornecimento nos ECLPs do estudo. As películas protetoras da pele apresentam várias formas e consiste em uma cobertura transparente para proteger a pele de traumas e umidade.6 Os tratamentos anteriores para LPTPs usados nos dois estabelecimentos eram uma película protetora de pele e alívio de pressão; apesar do uso da película duas vezes ao dia, os estabelecimentos continuaram a perceber agravamento nas LPTPs, impulsionando este estudo de viabilidade.
Junto com as preocupações dos tratamento atuais em relação às LPTPs, a pesquisa é contínua para averiguar se há indicadores clínicos que influenciam a evolução das LPTPs para feridas abertas. Nos ECLPs, a maioria dos residentes apresentam várias comorbidades que influenciam o risco de desenvolvimento de LPs, incluindo a LPTP.7 Mais estudos são necessários para estabelecer categoricamente os indicadores clínicos que potencialmente contribuem para as LPTPs para que elas possam ser mitigadas.
Histórico e problema clínico
A prevalência das LPTPs triplicou desde 2006, presumivelmente devido à classificação das LPTPs, que foram definidas em 2007. Isso aumentou a conscientização sobre as LPTPs.4 Mudanças nos regulamentos e melhorias na prevenção e tratamento não reduziram essa incidência e os números e custos de todas as LPs continuam a subir.8 Além de causar dor e sofrimento aos residentes dos ECLPs, as LPTPs custam cerca de $3,3 bilhões por ano.9
O local mais comum para desenvolvimento de uma LPTP é o calcanhar. Os calcanhares são principalmente proeminências ósseas cobertas por uma fina camada de pele com pouco acolchoamento ou proteção contra pressão.10,11 Além disso, outras condições médicas, tais como problemas respiratórios ou cardiovasculares, aumentam o tempo em que os residentes passam em posição supina, e eles geralmente necessitam que a cabeceira da cama fique elevada, o que coloca mais pressão em seus pés e pernas.10-13 Os mesmos mecanismos de pressão danificam os tecidos moles das áreas laterais dos pés e dedos; por causa do posicionamento lateral crônico, essas áreas normalmente experimentam pressão sustentada e não aliviada.11
O cisalhamento é um fator de risco comum a se considerar na evolução das LPTPs.13,14 As camadas da pele esticadas contra uma superfície com atrito e pressão resultam no dano nos tecidos superficiais e internos mais profundos.14 O risco de cisalhamento inclui o reposicionamento passivo dos residentes, a elevação da cabeceira da cama e os movimentos ativos involuntários, tais como espasmos e tremores de condições médicas, que aumentam o posicionamento/pressão constante do pé contra o colchão.14 O risco de pressão e cisalhamento consequentemente aumenta o risco de agravamento das LPTPs nos pés e pernas.4,14,15
Além da falta de um tratamento padrão para a LPTP, há uma preocupação sobre se o agravamento de uma LPTP pode ser afetado por certos indicadores clínicos. Em muitos ECLPs, uma grande porcentagem dos residentes com mobilidade limitada e debilidade tem maior risco de desenvolver uma LP. Conforme os residentes envelhecem, o número de condições médicas que eles enfrentam aumenta.7 Estudos publicados mostram que condições médicas tais como anemia, diabetes mellitus, incontinência fecal ou urinária, doença vascular, ou desnutrição aumenta o risco de desenvolvimento de LPs e (mais recentemente) LPTPs.3,4,7,16 Desses fatores de risco, a anemia tem sido a mais comumente associada com um maior risco de desenvolver LPTPs.3,4 Uma revisão de Gefen et al13 notou que variáveis tais como febre, doença cardiovascular descontrolada ou acidose respiratória também podem aumentar o risco de desenvolvimento de uma LPTP. Assim, este projeto não apenas comparou as duas opções de tratamento para as LPTPs, mas também considerou os indicadores clínicos dos residentes e sua potencial influência no agravamento da LPTPs.
O tratamento das LPTPs geralmente cai em uma de duas categorias: alívio de pressão e aplicação. Em uma revisão sistemática da Cochrane, McGinnis e Stubbs17 estudaram aparelhos de redução da pressão nos calcanhares para alívio de pressão no tratamento de úlceras no calcanhar. De acordo com seus resultados, não há um único aparelho disponível que cumpra com todos os critérios para conforto na prevenção e tratamento de úlceras no calcanhar removendo a pressão com alívio de pressão. Também há a necessidade de mais pesquisas no alívio da pressão no calcanhar e tratamento das LPs com alívio de pressão. 17 Van Leen et al18 revisaram técnicas de redução da pressão para o tratamento de LPs em um estudo longitudinal em um ECLP holandês. O alívio da pressão nos pés e pernas levou a uma redução estatisticamente significativa em LPs de 16,6% para 5,5%, com maior benefício em pacientes com médio a alto risco de desenvolver LPs. Durante os anos do estudo, 57,8% dos pacientes em médio a alto risco de desenvolver LPs com alívio de pressão documentado nos pés e pernas (bem como intervenção educacional) eram menos propensos a desenvolver uma LP.18
A outra categoria de tratamento é a aplicação de curativos. Um estudo controlado randomizado feito por Sullivan19 avaliou o tratamento das LPTPs com curativos e demonstrou que 74% das LPTPs diminuíram em tamanho ou se resolveram com o uso de um curativo de espuma auto-aderente, multicamadas e com borda à base de silicone. Das 128 LPTPs desse estudo, apenas uma se abriu ao tecido mais profundo, e as outras lesões ou não abriram ou abriram até a derme com um período médio de cicatrização de 17,8 dias. Essencialmente, os curativos de espuma multicamadas diminuíram o agravamento e melhoraram o tempo de cicatrização.19
Campbell et alet al16 avaliou o uso de curativos acolchoados para o calcanhar para tratar feridas no calcanhar. O grupo de tratamento mostrou uma melhora de 100% entre os 20 participantes, enquanto apenas 13 das 20 feridas no grupo de controle se fechou. O estudo também demonstrou que o grupo de tratamento precisou de menos tempo e recursos financeiros para a cicatrização.16
O Painel Consultivo Nacional de Lesões por Pressão recomenda o uso de alívio de pressão e curativos preventivos em residentes com alto risco de desenvolvimento de úlceras no calcanhar.20 Levy et al15 observaram que curativos profiláticos aplicados ao calcanhar reduziam o risco de LPTPs pela redução do estresse e cisalhamento. Finalmente, o uso de curativos para proteger a pele e aliviar a pressão e o cisalhamento é amplamente recomendado, embora estudos comparativos sejam limitados e necessários.
Métodos
O objetivo deste projeto era comparar, analisar e avaliar retrospectivamente o agravamento documentado de LPTPs para LPs abertas entre residentes usando dois tipos diferentes de tratamento. O objetivo secundário era determinar a prevalência de indicadores clínicos conhecidos por contribuir para o desenvolvimento de LPTPs no grupo com PMD versus grupo com película protetora da pele.
O projeto procurou responder às seguintes perguntas:
(1) O uso de PMDs e o alívio de pressão no pé reduz o agravamento das LPTPs dos residentes com 55 ou mais melhor que a película protetora da pele com alívio de pressão?
(2) Qual foi a prevalência de vários indicadores clínicos entre residentes que desenvolveram uma LPTP em seus pés e/ou extremidades inferiores, e uma mudança de tratamento teria algum impacto na evolução da LPTP?
Início do estudo e ética
Uma análise de dados administrativos coletados pela equipe de garantia de qualidade e melhoria de desempenho de dois ECLPs durante 2014 e 2015 mostrou que 36% das LPTPs evoluíram para uma LP aberta estágio 3 ou 4 quando tratadas com alívio de pressão e aplicação diária de uma película protetora da pele. Essa descoberta foi o catalisador para a realização de um estudo de viabilidade comparando a película protetora da pele com os PMDs para as LPTPs desenvolvidas entre outubro de 2015 e maio de 2017 em dois estabelecimentos. O PMD foi escolhido porque era novidade nas listas de formulário dos estabelecimentos, era facilmente acessível e havia evidência de seu benefício para outros tipos de feridas.
O projeto de análise comparativa retrospectiva conduzida no outono de 2017 examinou os resultados de 33 residentes com um total de 40 LPTPs incluídas no estudo de viabilidade. Os pesquisadores conduziram uma auditoria sistemática de quadro comparando os tratamentos de PMD ou película protetora da pele para a amostra de residentes com LPTPs e baseado no tipo de tratamento utilizado de outubro de 2015 a maio de 2017. Os quadros foram incluídos no projeto se o residente tivesse uma LPTP no pé ou perna, tivesse pelo menos 55 anos e fosse tratado com PMDs ou película protetora da pele com alívio de pressão.
Durante o estudo de viabilidade, cada residente de cada grupo tinha um pedido em andamento para o alívio de pressão para a LPTP. Os residentes escolhidos para o grupo de PMD ou forneceram consentimento para o novo tratamento ou a permissão foi dada pelo responsável do residente. O tratamento com PMD incluiu o corte do PMD em tamanho um pouco maior que a LPTP, bem como a aplicação de um curativo médico transparente para cobrir o PMD após sua aplicação. O curativo era trocado duas vezes por semana. Os lenços de película protetora da pele foram aplicados duas vezes ao dia, com secagem natural da pele após a aplicação. O conselho de análise institucional da universidade considerou o projeto atual isento. A empresa controladora dos ECLPs, as equipes de liderança administrativa e os membros do conselho dos provedores de serviços médicos aprovaram o projeto.
Contexto e participantes
Os dois ECLPs são aprovados pelo Medicare e Medicaid, com residentes privados e uma capacidade para aproximadamente 90 a 110 residentes, respectivamente. Eles estão localizados na região sudeste dos EUA. Esses estabelecimentos fornecem serviços de cuidados de longo e curto prazo, incluindo a reabilitação e cuidados médicos complexos para residentes com capacidade física e mentais reduzidas e diversas comorbidades, tais como LPs e LPTPs.
Os dados foram extraídos, desidentificados, auditados para os critérios de inclusão, e repassados ao investigador principal pelos auditores do quadro. A amostra foi desenvolvida com base no tratamento, do residente com o grupo de película protetora da pele contando com 23 residentes com 27 LPTPs, e o grupo de PMD com 10 residentes com 13 LPTPs.
Coleta de dados e medição dos resultados
Os especialistas treinados em registros médicos de cada estabelecimento extraíram os dados previamente registrados do programa de registros médicos chamado Electronic Charting System. Os coletores de dados foram treinados pelo investigador principal em relação a quais dados específicos extrapolar e codificar para a inserção de dados. Os coletores de dados receberam treinamento padronizado pelo investigador para garantir a precisão da coleta de dados e resgate sistemático das informações. Os dados foram resgatados do relatório médico eletrônico de cada residente para cada LPTP documentada. Os relatórios de dados gerados foram desidentificados e transferidos para um arquivo PDF seguro e privado pelos coletores de dados. O arquivo PDF foi então codificado e convertido para um formulário do Microsoft Excel e organizado em uma base de dados segura e armazenada em um arquivo protegido por senha para resgate pelo investigador principal para análise.
Os dados extraídos dos quadros médicos consistiram tanto em dados demográficos quanto indicadores clínicos. Os dados demográficos incluíram a idade, sexo e etnicidade dos residentes. Os indicadores clínicos incluíram resultados de testes laboratoriais (teste de anemia e hipoalbuminemia), doenças/comorbidade crônicas, histórico de saúde, estado funcional e pontuações da Escala de Braden.
A Escala de Braden é uma ferramenta de avaliação usada para determinar o risco de desenvolvimento de uma LP. A pontuação da Escala de Braden varia de menos de 9 a 32. Quanto menor a pontuação da Escala de Braden, maior o risco de desenvolvimento de uma LP.21 Os residentes com níveis de albumina inferiores a 3,2 g/dL (reference faixa, 3,5-5,2 g/dL) demonstraram hipoalbuminemia, o que pode refletir uma diminuição da situação nutritiva em algumas populações de pacientes.7 A anemia foi identificada com um nível de hemoglobina inferior reference à faixa de 12 a 15 g/dL. As doenças crônicas e as comorbidades foram identificadas com um diagnóstico ou código da Classificação Internacional de Doenças, 10a. revisão, e incluíram doença vascular periférica, demência, doença arterial coronariana e/ou doença cerebrovascular.
Mais dados incluíram o histórico de outras LPs e histórico ortopédico recente, tais como quaisquer fraturas ou cirurgia nos membros inferiores do corpo. Além disso, o nível de atividades de suporte da vida cotidiana do residente e qualquer histórico de movimentos involuntários crônicos foram recuperados. Mudanças de peso também foram observadas, isto é, se cada residente havia ganhado ou perdido peso antes da identificação da LPTP.
Qualquer diagnóstico de doença vascular periférica observado no quadro dos residentes foi capturado na coleta de dados. Como nenhum residente tinha um índice de pressão tornozelo-braquial documentado para confirmar o diagnóstico, os residentes com doença arterial periférica foram excluídos. Além disso, os residentes com diagnóstico anterior de diabetes ou úlceras arteriais também foram excluídos. As variáveis dos resultados incluíram o agravamento da LPTP e estágio da LP no momento da abertura, se aplicável.
Análise estatística
A ferramenta de Estatística Descritiva do Microsoft Excel (Redmond, Washington) foi usada para analisar os dados dos dois grupos. Estatísticas descritivas foram usadas para descrever a amostra. Testes χ2 de independência foram usados para comparar cada grupo com os resultados clínicos de abertura ou não abertura. P < 0,05 foi considerado estatisticamente significativo.
Resultados
A maioria dos participantes eram mulheres com idade média de 84 anos. O grupo de PMD era ligeiramente mais velho que o grupo de película protetora da pele (Tabela 1).
Tabela 1. Dados demográficos dos residentes com lesão por pressão tissular profunda por grupo de tratamento
Uma análise estatística simples comparou a medida do resultado primário entre os grupos; de acordo com o teste de independênciaχ2, a diferença não foi estatisticamente significativa (P = 0,3160). No grupo de PMD, 23% das LPTPs agravaram para uma LP aberta, enquanto 41% das LPTPs no grupo de película protetora da pele se abriram para uma LP estágio 3 or 4. Das LPTPs que se abriram, apenas duas das lesões do grupo de PMD se abriram para uma LP estágio 3, e apenas uma para LP estágio 4. Das LPTPs do grupo de película de barreira cutânea, sete LPTPs se abriram para LPs estágio 3 e quatro para uma LP estágio 4 (Tabela 2).
Tabela 2. Resultados da ferida

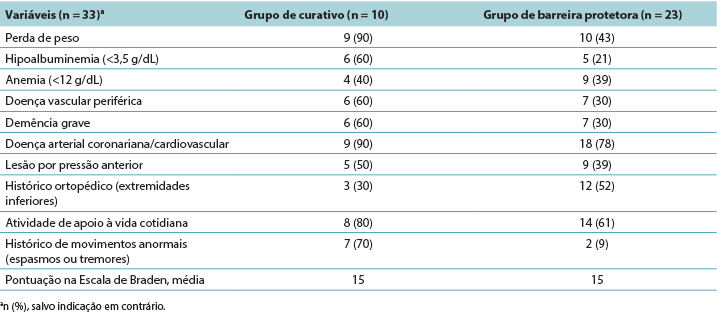
Dados descritivos foram gerados para os indicadores clínicos que aumentaram o risco de desenvolvimento de uma LPTP (Tabela 3). O grupo de PMD teve mais residentes com indicadores clínicos conhecidos para as LPTPs. O número de residentes que necessitavam de duas pessoas para assistí-los em suas atividades cotidianas foi um fator significativo, representando 80% do grupo de PMD e 61% do grupo de película protetora da pele. Os residentes dos dois grupos tinham uma pontuação média na Escala de Braden de 15 pontos, indicando pelo menos um risco moderado de desenvolvimento de uma LPTP. Perda de peso e pontuações mais baixas de albumina foram implicados, especialmente para o grupo PMD, com 90% tendo perda de peso e 60% hipoalbuminemia. Os residentes com demência grave (PMD, 60%; película protetora da pele, 30%) também demonstraram um risco maior de desenvolvimento de uma LPTP, bem como os residentes com diagnóstico de doença arterial periférica ou doença cerebrovascular (PMD, 90%; película protetora da pele, 78%). Para investigar o cisalhamento, dados foram coletados em residentes que tiveram movimentos anormais nas extremidades inferiores, tais como tremores ou espasmos. No grupo de PMD, o indicador clínico pode ter contribuído para o desenvolvimento da LPTP em 70% dos residentes. Curiosamente, a anemia foi um indicador da LPTP (PMD, 40%, película de protetora da pele, 39%), embora não ao mesmo nível de significância observado em outros estudos.
Tabela 3. Indicadores clínicos dos residentes com lesão por pressão tissular profunda por grupo de tratamento
Discussão
Este projeto retrospectivo concluiu que a película protetora da pele e o alívio de pressão não preveniram o agravamento das LPTPs. Apenas três LPTPs evoluíram para uma ferida aberta no grupo de PMD, em comparação às 11 LPTPs no grupo de película protetora da pele. Embora este projeto não tenha tido o poder estatístico para demonstrar significância, os resultados indicam um possível benefício em mudar o tratamento atual da película protetora da pele com alívio de pressão para o PMD com alívio de pressão.
O projeto achou um maior risco de agravamento das LPTPs nos residentes com mais indicadores clínicos, em consonância com os estudos anteriores.7,16 Muitas das condições médicas dos residentes dos ECLPs continuam a ser indicadores significativos, incluindo a perda de peso, níveis mais baixos de albumina, movimentos anormais, tais como espasmos e tremores, doença arterial coronária e doença cerebrovascular.4,16 Indicadores tais como anemia, cirurgias ou fraturas ortopédicas anteriores, doença vascular periférica e demência grave foram associados a um risco moderado de of agravamento das LPTPs; estudos anteriores acharam que esses eram indicadores de alto risco.4,7,16 Curiosamente, o grupo de PMD tinha em média mais indicadores clínicos para o agravamento das LPTPs e, mesmo assim, apresentou melhores resultados. Isso demonstra que o tratamento e o gerenciamento pode superar os efeitos de indicadores clínicos para a progressão das LPTPs.
Limitações
O tamanho da amostra de conveniência foi pequeno devido ao número total de residentes com LPTP diagnosticada durante o período do estudo de viabilidade. Embora todos os coletores de dados tenham sido treinados por uma pessoa ao mesmo tempo, não houve teste de confiabilidade entre avaliadores. Além disso, o diagnóstico da LPTP foi extraído pelos coletores de dados baseado no diagnóstico do provedor, pois não foi estabelecido um código para a LPTP na Classificação Internacional de Doenças, 10a revisão, até 2019. Finalmente, é importante notar que os PMDs podem não estar disponíveis em todos os cenários de assistência médica, limitando a generalização dos resultados.
Implicações para a prática clínica
O alívio de pressão e o reposicionamento dos residentes dos ECLPs continuam a ser recomendados para o tratamento das LPTPs. No entanto, as complicações relacionadas ao agravamento das LPTPs afetam os residentes dos ECLPs e colocam pressão no sistema de saúde. Este projeto compara dois tratamentos diferentes para as LPTPs, enquanto considera os indicadores clínicos que podem aumentar o risco de agravamento de uma LPTP. Embora mais evidências sejam necessárias para abordar a relação custo-eficácia desses tratamentos, o PMD provavelmente reduziu o agravamento das LPTPs. Portanto, os PMDs podem ser atraentes para estabelecimentos que se esforçam para oferecer cuidados de saúde eficientes para seus residentes, especialmente aqueles com residentes de alto risco.
Conclusões
Embora a prevenção seja fundamental, uma vez que uma LPTP tenha sido desenvolvida, ter uma opção de tratamento fácil e confiável para prevenir o agravamento é de extrema importância. Ao abordar as LPTPs com o alívio de pressão e fazer uma triagem para os indicadores clínicos do agravamento, junto com um tratamento preventivo, tal como o PDM, a trajetória dessas lesões pode melhorar significativamente.
Conflito de interesse
As autoras declaram não haver conflitos de interesse.
Financiamento
As autoras não receberam financiamento para este estudo.
Author(s)
Autumn Henson*
DNP, GNP-BC, WCC Nurse Practitioner, Physicians Eldercare, Winston-Salem, North Carolina.
Laurie Kennedy-Malone
PhD, GNP-BC, FAANP, FGSA Professor of Nursing, University of North Carolina at Greensboro.
* Corresponding author
References
- National Pressure Injury Advisory Panel. NPIAP Pressure Injury Stages. 2016. https://cdn.ymaws.com/npiap.com/resource/resmgr/online_store/npiap_pressure_injury_stages.pdf. Last accessed June 15, 2020.
- Peart J. The aetiology of deep tissue injury: a literature review. Br J Nurs 2016;25(15):840-3.
- Honaker J, Brockopp D, Moe K. Suspected deep tissue injury profile. Adv Skin Wound Care 2014;27(3):133-40.
- Preston A, Rao A, Strauss R, Stamm R, Zalman D. Deep tissue pressure injury. Am J Nurs 2017;117(5):50-7.
- Gefen A. The future of pressure ulcer prevention is here: detecting and targeting inflammation early. EWMA 2018;19(2):7-13.
- Kestrel Health Information. Liquid skin protectors/sealants. WoundSource. 2019. www.woundsource.com/print/product-category/skin-care/liquid-skin-protectantssealants. Last accessed June 6, 2020.
- Ahn H, Cowan L, Garvan C, Lyon D, Stechmiller J. Risk factors for pressure ulcers including suspected deep tissue injury in nursing home facility residents. Adv Skin Wound Care 2016;29(4):178-90.
- Centers for Medicare & Medicaid Services. Nursing Home Data Compendium 2015 Edition. 2015. www.cms.gov/Medicare/Provider-Enrollment-and-Certification/CertificationandComplianc/Downloads/nursinghomedatacompendium_508-2015.pdf. Last accessed June 6, 2020.
- Agency for Healthcare Research & Quality. AHRQ’s Safety Program for Nursing Homes: On-Time Pressure Ulcer Prevention. 2016. www.ahrq.gov/professionals/systems/long-term-care/resources/ontime/pruprev/index.html. Last accessed June 6, 2020.
- Grothier L. Management of residents with heel located pressure damage. J Community Nurs 2013;27(5):42-6.
- Levy A, Gefen A. Computer modeling studies to assess whether a prophylactic dressing reduces the risk for DTI in the heels of supine residents with diabetes. Ostomy Wound Manage 2016;62(4):42-52.
- Santamaria N, Gerdtz M, Sage S, et al. A randomized controlled trial of the effectiveness of soft silicone multi-layered foam dressings in the prevention of sacral and heel pressure ulcers in trauma and critically ill patients: the border trial. Int Wound J 2013;12(3):302-8.
- Gefen A, Farid K, Shaywitz I. A review of deep tissue injury development detection and prevention: shear savvy. Ostomy Wound Manage 2013;59(2):26-35.
- Cutting K. Improving patient outcomes: bridging the gap between science and efficacy. Br J Nurs 2016;25(6):S28-S32.
- Levy A, Frank M, Gefen A. The biomechanical efficacy of dressings in preventing heel ulcers. J Tissue Viability 2015;24(1):1-11.
- Campbell N, Campbell D, Turner A. A retrospective quality improvement study comparing use versus nonuse of a padded heel dressing to offload heel ulcers of different etiologies. Ostomy Wound Manage 2015;61(11):44-52.
- McGinnis E, Stubbs N. Pressure-relieving devices for treating heel pressure ulcers. Cochrane Database Syst Rev 2014;12(2):1-31.
- Van Leen M, Schols J, Hovius S, Halfens R. A secondary analysis of longitudinal prevalence data to determine the use of pressure ulcer preventive measures in Dutch nursing homes, 2005-2014. Ostomy Wound Manage 2017;63(09):10-20.
- Sullivan R. Use of a soft silicone foam dressing to change the trajectory of destruction associated with suspected deep tissue pressure ulcers. Medsurg Nurs 2015;24(4):237-42.
- National Pressure Injury Advisory Panel. Pressure injury prevention points. 2016. https://npiap.com/page/PreventionPoints#:~:text=Inspect%20all%20of%20the%20skin,elbows%20and%20beneath%20medical%20devices. Last accessed June 15, 2020.
- Kalowes P, Messina V, Li M. Five-layered soft silicone foam dressing to prevent pressure ulcers in the intensive care unit. Am J Crit Care 2016;25(6):e108-19.