Volume 42 Number 3
Pressure injury management in critically ill patients with COVID-19 in a makeshift hospital in Indonesia: A report of two cases
Kezia Eveline, Hemma W Indirayani, Rachmaniar Pramanasari, Firas F Alkaff
Keywords pressure injury, COVID-19, Case report, ICU, Indonesia
For referencing Eveline K et al. Pressure injury management in critically ill patients with COVID-19 in a makeshift hospital in Indonesia: A report of two cases. WCET® Journal 2022;42(3):23-29
DOI
https://doi.org/10.33235/wcet.42.3.23-29
Submitted 9 January 2022
Accepted 15 March 2022
Abstract
Patients who are critically ill with COVID-19 need ventilation support in the ICU. However, ICU patients are at higher risk of developing a pressure injury (PI). Unfortunately, PI prevention is not optimally implemented in Indonesia, especially in the makeshift hospitals created during the COVID-19 pandemic.
Here, the authors report two cases of critically ill COVID-19 patients who developed large sacral PIs during hospitalisation in a makeshift hospital in Indonesia. The first patient developed a grade III, 7 cm × 7 cm sacral PI on the 14th day of hospitalisation. The second patient developed a grade IV, 12 cm × 8 cm sacral PI on the 16th day of hospitalisation. Both patients had elevated D-dimer levels and used a noninvasive ventilator for one week.
The wounds were treated with surgical debridement, silver hydrogel dressing, and hydrocolloid dressing, and complemented with static air mattress overlay.
The authors recommend that in situations where there is a shortage of healthcare workers, the government should provide pressure-redistribution devices and silicone foam dressings for all critically ill patients to prevent PI development and lighten the workload of healthcare workers.
Copyright Advances in Skin & Wound Care and the World Council of Enterostomal Therapists®.
Introduction
COVID-19 has a wide clinical spectrum.1 Although the majority of those infected with COVID-19 are asymptomatic or have only mild symptoms, older adults and those with comorbidities are more likely to become critically ill.2 Among patients who are critically ill with COVID-19, the majority develop acute respiratory distress syndrome (ARDS), a life-threatening form of respiratory failure with a high mortality rate.3,4 Patients who develop ARDS require ventilation support in the ICU. However, patients in the ICU are also at higher risk of pressure injury (PI) development due to prolonged immobilisation.5
Unfortunately, PI prevention measures are not optimally implemented in Indonesia,8 especially in the makeshift hospitals created during the COVID-19 pandemic. Here, the authors report two cases of critically ill COVID-19 patients who developed large PIs during hospitalisation in a makeshift hospital in one of the largest cities in Indonesia. Written informed consent was provided by the legal guardian (for case 1) and by the subject of the case (for case 2) to publish the case details and associated images. The authors highlight challenges in PI management during the COVID-19 pandemic and propose several suggestions to aid PI prevention.
Case report
Case 1
A 40-year-old man with a medical history of schizophrenia and intellectual disability presented to the ER with the chief complaints of irritability, fever, dry cough, and shortness of breath. Three days before admission, the patient developed a fever of 38° C at home. On physical examination at the ER, the patient’s temperature was 37.8° C, BP was 120/80 mmHg, heart rate was 102 beats per minute, respiratory rate was 24 breaths per minute, and oxygen saturation was 85% without any oxygen support. Lung auscultation revealed rales in the left lung and chest X-ray revealed pulmonary infiltrates in the left lung (Figure 1). Laboratory evaluation showed elevated D-dimers (>20.000 ng/mL FEU) and hypoalbuminemia (2.2 mg/dl). Based on the initial evaluation, COVID-19 infection was suspected. A nasopharynx specimen was taken for COVID-19 reverse transcriptase-polymerase chain reaction evaluation to confirm the COVID-19 diagnosis.
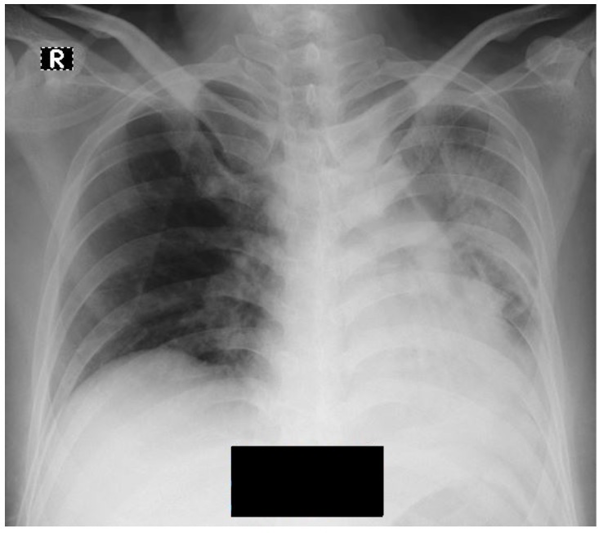
Figure 1. Chest x-ray in case 1,X-ray showing infiltrate in left lung.
While waiting for the test result, the patient was given 15 liters per minute oxygen via nonrebreathing mask and treated with intravenous moxifloxacin 400 mg daily, intravenous acetylcysteine 500 mg daily, intravenous albumin 50 grams daily, and 40 mg subcutaneous enoxaparin twice daily. To treat the symptoms of schizophrenia, the patient was given oral clozapine 50 mg twice daily, oral quetiapine 200 mg twice daily, and oral trihexyphenidyl 2mg twice daily. Because the patient was uncooperative, the patient was restrained on the bed after his legal guardian provided written consent. A foley catheter was then inserted and a diaper was used. The following day, the patient’s COVID-19 test result came back positive. The patient was then given additional treatment of intravenous oseltamivir 75 mg twice daily.
During hospitalisation, the patient’s oxygen saturation was not improving. On day 10, blood gas analysis showed uncompensated respiratory acidosis (pH 7.28, PO2 122 mmHg, PCO2 51.8 mmHg, and HCO3 24.9 mEq/L) with Jackson Reese circuit oxygen support. The patient also developed ARDS (PaO2/FiO2 ratio 122). Because this makeshift hospital lacked mechanical ventilators, a noninvasive ventilator was used. The patient had mean arterial pressure of 60 mmHg and Glasgow Coma Scale of 8, indicating ongoing septic shock. Thus, intravenous norepinephrine (0.1 mcg/kg/min) was administered continuously using syringe pump. Because the patient was immobilised, 30 minutes right-oblique and 30 minutes left-oblique passive mobilisation was undertaken every 8 hours. The restraints were released prior to mobilisation and retied after mobilisation to the new position. To maintain nutrition intake, a nasogastric feeding tube was inserted. The required nutrition was calculated by the dietitian and given as milk feeding.
Due to the limited number of healthcare workers (HCWs) available every shift and their high workloads, PI risk assessment was not performed. However, the patient’s skin was inspected every 8 hours during diaper changes. On day 14, a 7 cm × 7 cm bilateral sacral wound was noted with epithelial surface and superficial wound bed (Figure 2a). The wound was cleansed using normal saline and wound irrigation solution and a silver hydrogel dressing was applied to the wound bed. A hydrocolloid foam dressing was placed on top of the silver hydrogel dressing and extended 2 cm around the wound to protect the peri-wound skin from maceration. To prevent urine or fecal contamination, nonsterile gauze was placed above the hydrocolloid foam dressing and fixed with retention tape. In addition, a static air mattress overlay was placed on the bed as a pressure-redistribution device (PRD). The wound dressing was changed every 3 days, or earlier if contaminated with urine or feces.
On day 18, the sacral wound enlarged to 15 cm × 10 cm with slough and suspicion of “deeper ulceration” (Figure 2b). Surgical debridement was then performed by the nurses at the bedside. After surgical debridement, fascia was seen as the wound bed (Figure 2c). According to the 2016 National Pressure Ulcer Advisory Panel (NPUAP) staging system,10 the wound was classified as grade III. Because of the deep cavity wound, sterile gauze was placed in the cavity to fill the space after applying a silver hydrogel dressing onto the wound bed. The wound dressing was changed every 2 days instead of every 3 days, or earlier if contaminated with urine or feces. When needed, surgical debridement was performed again. On day 26, granulation began to appear from the wound (Figure 2d). The patient was discharged on day 39. Nurses followed up with weekly home visits until the wound was completely closed to evaluate the wound-healing process, perform surgical debridement if needed, change the wound dressing, and teach family members how to change the wound dressing in between home visits.
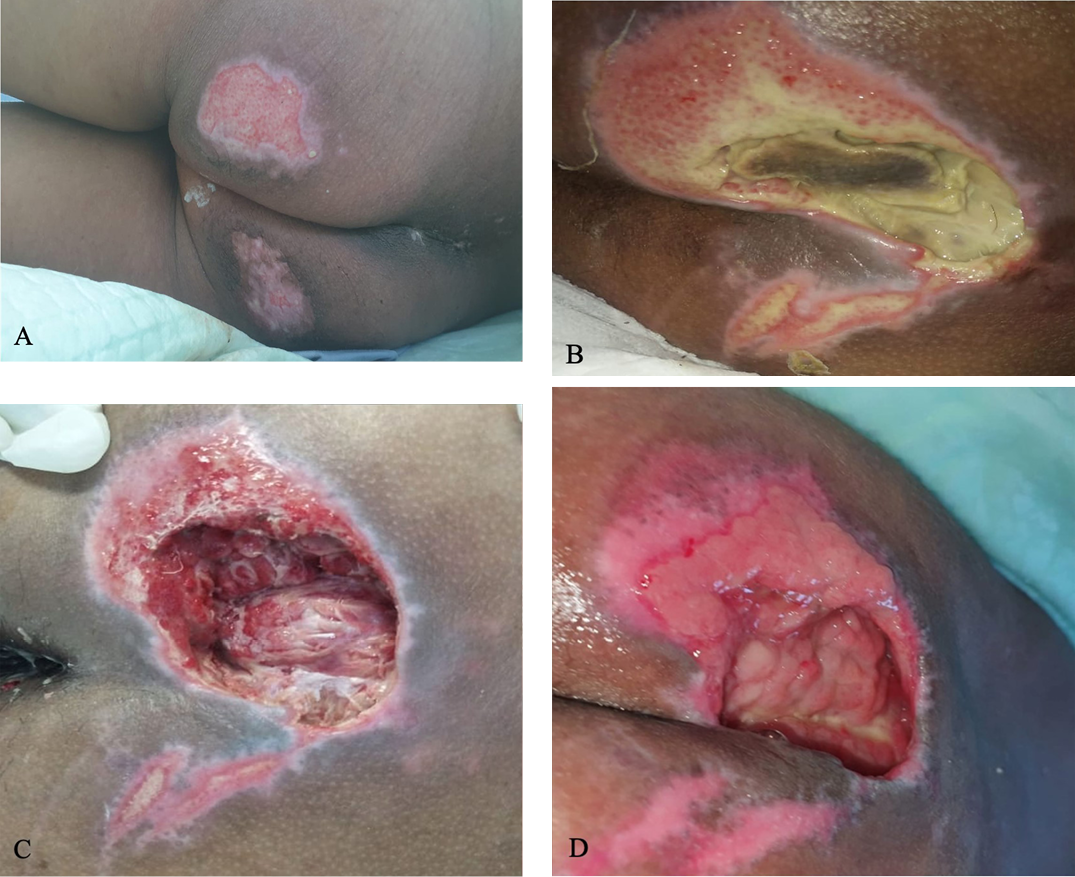
Figure 2. Sacral ulcer in case 1
A) Sacral ulcer with epithelial wound bed measuring 7 cm × 7 cm on day 14. B) Covered by slough and suspicion of “deeper ulcer,” measuring 15 cm × 10 cm on day 18. C) Minimal slough and fascia in the wound bed after surgical debridement and wound dressing, 15 cm x 10 cm with depth of 6 cm on day 22. D) Granulation tissue on day 26, measuring 10 cm × 6 cm.
Case 2
A 59-year-old man with a medical history of type 2 diabetes mellitus, hypertension, and cerebrovascular accident (CVA) presented to the ER with the chief complaints of fever, cough, and shortness of breath. Five days earlier, the patient had developed a cough and fever of 38.5° C at home. The patient tested positive for COVID-19 3 days before presenting to the ER. On physical examination at the ER, the temperature was 37.5° C, BP was 140/90 mmHg, heart rate was 110 beats per minute, respiratory rate was 24 breaths per minute, and oxygen saturation was 75% without any oxygen support. The patient had left-side hemiplegia due to the CVA. Lung auscultation revealed rales in both lungs. Chest X-ray revealed bilateral pulmonary opacities and cardiomegaly (Figure 3). Laboratory evaluation showed elevated D-dimers (2.100 ng/mL FEU), elevated interleukin-6 level (120 pg/mL), and hypoalbuminemia (2.8 mg/dl). Based on the initial evaluation, the patient was diagnosed with COVID-19 and recent CVA.
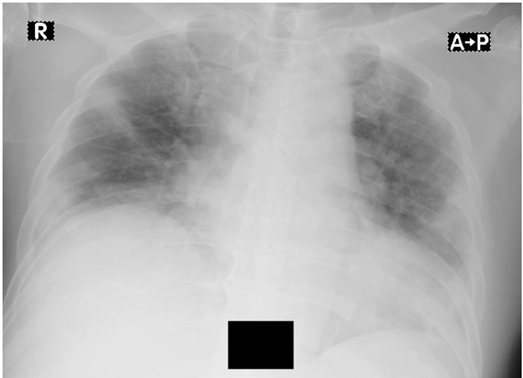
Figure 3. Chest x-ray in case 2
X-ray showing infiltrate in both lungs and cardiomegaly with cardio-thoracic ratio of 60%.
The patient was given 15 liters per minute oxygen via Jackson Rees circuit and treated with intravenous moxifloxacin 400 mg daily, intravenous acetylcysteine 500 mg daily, intravenous albumin 50 grams daily, subcutaneous heparin 5000 International Unit (IU), intravenous dexamethasone 6 mg daily, 400 mg intravenous Tocilizumab single dose, and oral oseltamivir 75 mg twice daily. To treat the hypertension, the patient was given oral amlodipine 10 mg once daily and oral candesartan 16 mg once daily. The patient also received subcutaneous long actin insulin 20 IU once daily and rapid acting insulin 16 IU thrice daily to treat the diabetes mellitus.
During hospitalisation, the patient’s oxygen saturation was not improving. On day 7, blood gas analysis showed uncompensated respiratory acidosis (pH 7.3, PO2 150 mmHg, PCO2 50.2 mmHg, and HCO3 23.5 mEq/L) with Jackson Reese circuit oxygen support. The patient developed ARDS (PaO2/FiO2 ratio 150) and was given a noninvasive ventilator due to the lack of mechanical ventilators. Because the patient was immobilised, 30 minutes right-oblique and 30 minutes left-oblique passive mobilisation was undertaken every 8 hours. To maintain nutritional intake, a nasogastric feeding tube was inserted; milk feeding was calculated by a dietician.
Due to the limited number of HCWs every shift and their high workloads, PI risk assessment was not performed. However, the patient’s skin was inspected every 8 hours during diaper changes. On day 16, a 12 cm × 8 cm sacral wound with suspicion of “deeper ulceration” was found on both sides of the sacrum (Figure 4a). On day 18, central necrotic tissue was present (Figure 4b). Nurses performed surgical debridement at the bedside (Figure 4c) and the wound was cleansed using normal saline and wound irrigation solution. A silver hydrogel dressing was applied on the wound bed and a hydrocolloid foam dressing was placed on top of the silver hydrogel dressing and extended 2 cm around the wound to protect the peri-wound skin from maceration. To prevent urine or fecal contamination, nonsterile gauze was placed above the hydrocolloid foam dressing and fixed with retention tape. Further, a static air mattress overlay was placed on the bed as a PRD. The wound dressing was changed every 3 days, or earlier if contaminated with urine or feces. When needed, surgical debridement was performed again.
Two days after treatment, the wound bed was more profound than the initial wound with bone and tendon exposure (Figure 4d). According to the 2016 NPUAP staging system,10 the wound was grade IV. Because of the deep cavity wound, the cavity was filled with sterile gauze after applying a silver hydrogel dressing onto the wound bed. The wound dressing was changed every 2 days instead of every 3 days, or earlier if contaminated with urine or feces. On day 25, granulation tissue presented on the ulcer (Figure 4e) and by day 30, the ulcer had narrowed (Figure 4f). The patient was discharged on day 35. Nurses followed up with weekly home visits until the wound was completely closed to evaluate the wound-healing process, perform surgical debridement if needed, change the wound dressing, and teach family members how to change the wound dressing in between the scheduled home visits.
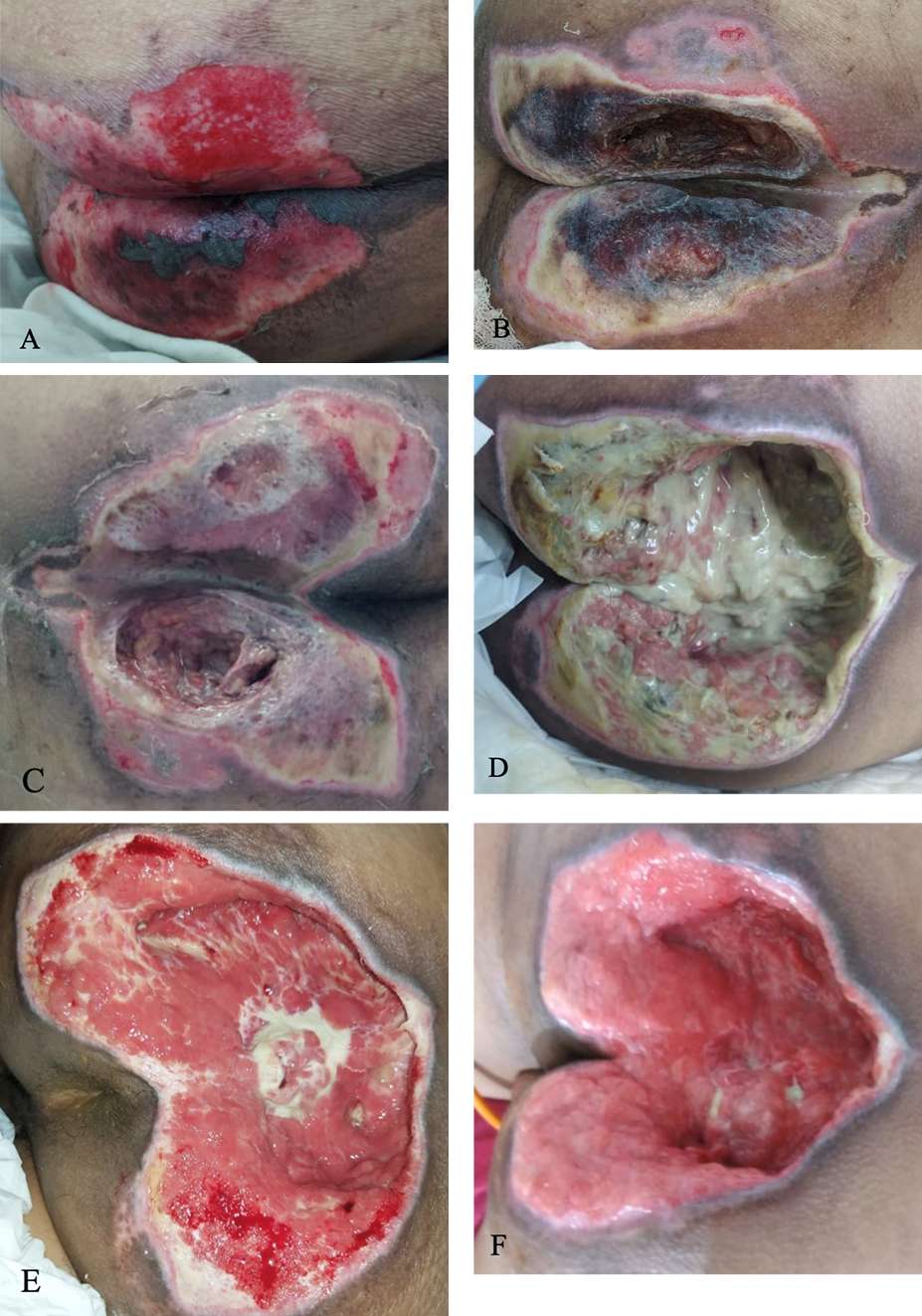
Figure 4. Sacral ulcer in case 2
A) Sacral ulcer on both side of buttocks with epithelial wound bed and necrotic tissue on central side, measuring 12 cm x 8 cm on day 16. B) Covered with both slough and necrotic tissue, measuring 12 cm x 10 cm on day 18. C) After surgical debridement on day 18. D) Covered with massive slough, depth of 7 cm on day 20. E) Granulation tissue and minimal slough on day 25. F) Granulation tissue on day 30.
Discussion
As reflected in the latest NPUAP definition of PI, the main factors influencing PI development are pressure, shear, and soft tissue tolerance.10 Pressure refers to sustained pressure on a local point, whereas shearing force occurs when two opposing surfaces slide in opposite directions. When pressure and shear disrupt blood flow and local tissue hypoxia lasts for a critical period of time, tissue damage results. However, at what intensity and duration of force tissue damage occurs depends on the tissue tolerance.12 Pressure injuries usually occur in bony areas such as the sacrum.13
Researchers have identified a number of PI risk factors, including immobility, being confined to bed, malnutrition, dehydration, infection, urinary and bowel incontinence, diabetes, vascular disease, and vasopressor use.14-16 Sedated patients are particularly prone to PI because they do not perceive painful stimuli from intense and prolonged pressure and are not able to actively change their position in bed.7,17,18 Recently, it has been reported that patients who are critically ill with COVID-19 are also at higher risk of PI.19 These patients have reduced perfusion and are more likely to develop systemic coagulopathy, which leads to decreased tissue tolerance.19 In the first case, the patient was critically ill with COVID-19 and required a vasopressor. This patient had impaired mental health as a comorbidity. People with severe mental health impairment such as schizophrenia tend to have poor diet and may neglect their personal hygiene, causing similar conditions to having urinary and bowel incontinence.13 In the second case, the patient was also critically ill with COVID-19 and had CVA and diabetes mellitus as comorbidities.
Pressure injury is associated with prolonged hospitalisation.20-22 The length of stay was 39 days for the first case report patient and 35 days for the second patient. The first patient could have been discharged 9 days earlier if there were no PI present; the second patient could have been discharged 5 days earlier. In a previous case series of three severely ill patients with COVID-19, PIs were first noted between 7 and 19 days after hospitalisation.19 For the patients described herein, PI was noted on day 14 of hospitalisation for the first patient, and on day 16 for the second patient.
According to the latest guidelines, comprehensive PI risk assessment, preventive skin care, and early mobilisation and repositioning are some of the PI management strategies that should be considered.23 In terms of patients who are critically ill with COVID-19, Tang et al24 found that PIs can be managed by improving the underlying contributing factors, providing PRD with proper positioning, improving mobility, minimising excessive moisture, correcting malnutrition, and performing close daily monitoring of the PI including the dressing, surrounding skin, and any possible complications.
However, proper PI management translates to an extra workload for nurses. Unfortunately, due to significant staffing shortages, HCWs’ workload during the COVID-19 pandemic in Indonesia is already high.9 In this makeshift hospital, there are only one doctor and three nurses on every shift, resulting in a HCW-to-patient ratio of 1:5. In addition, most of the patients with COVID-19 were critically ill. With a very unbalanced HCW-to-patient ratio and resultant high workload for the HCWs, it is not possible to follow the guidelines for proper PI management. As a result, PI risk assessment was not performed when patients arrived at the makeshift hospital; mobilisation and skin assessment were performed every 8 hours (once per HCW’s working shift) instead of being individualised according to risk assessment.
With regard to PRDs, a recent study found that PRD use was associated with an 88% reduced risk of PI development in high risk ICU patients.25 Similarly, a previous systematic review also concluded that PRD should be provided to patients who are at high risk of PI development.26 Pressure-redistribution devices help prevent PIs by decreasing the magnitude and duration of pressure as well as reducing the shear and friction between the patient and the bed surface.10,25 Thus, providing PRDs for all critically ill patients with COVID-19 would be a beneficial strategy for PI prevention. However, in the makeshift hospital, only two PRDs are available, and thus are allocated for PI treatment and not for PI prevention.
Based on the difficulties experienced during the COVID-19 pandemic, the authors recommend several PI prevention strategies for hospitals with HCW shortages:23,28
Re-educate HCWs about PI management
Conduct skin assessments as often as possible
Ensure patients have adequate nutrition and hydration
Use PRDs for all patients who are critically ill with COVID-19
Apply silicone foam dressings over the bony prominences that serve as the main pressure points in all critically ill patients with COVID-19.
Conclusions
Patients who are critically ill with COVID-19 are also at greater risk of PI development during hospitalisation. In a situation where there is a shortage of HCWs, governments should compensate by providing additional PRDs and silicone foam dressings for all critically ill patients to prevent PI development and lighten the workload of HCWs.
Conflict of Interest
The authors declare no conflicts of interest.
Funding
The authors received no funding for this study.
Gestão de lesões por pressão em pacientes críticos com COVID-19 num hospital improvisado na Indonésia: Um relatório de dois casos
Kezia Eveline, Hemma W Indirayani, Rachmaniar Pramanasari, Firas F Alkaff
DOI: https://doi.org/10.33235/wcet.42.3.23-29
Sumário
Os pacientes que se encontram gravemente doentes com COVID-19 precisam de apoio de ventilação na UCI. No entanto, os doentes em UCI correm num risco mais elevado de desenvolver uma lesão por pressão (IP). Infelizmente, a prevenção de IP não é implementada de forma otimizada na Indonésia, especialmente nos hospitais improvisados que foram criados durante a pandemia de COVID-19.
Aqui, os autores relatam dois casos de doentes críticos da COVID-19 que desenvolveram grandes IP sacrais durante a hospitalização num hospital improvisado na Indonésia. O primeiro paciente desenvolveu uma IP sacral de grau III, 7 cm × 7 cm no 14º dia de hospitalização. O segundo paciente desenvolveu uma IP sacral de grau IV, 12 cm × 8 cm no 16º dia de hospitalização. Ambos os pacientes tinham níveis elevados de D-dímero e utilizaram um ventilador não invasivo durante uma semana.
As feridas foram tratadas através de desbridamento cirúrgico, penso de hidrogel de prata e penso hidrocolóide e complementadas com colchão de ar estático sobreposto.
Os autores recomendam que, em situações de escassez de profissionais de saúde, o governo forneça dispositivos de redistribuição de pressão e pensos de espuma de silicone para todos os pacientes gravemente doentes, de forma a evitar o desenvolvimento de IP e aliviar a carga de trabalho dos profissionais de saúde.
Copyright Avanços em Cuidados de Pele e de Feridas e o Conselho Mundial de Terapeutas Enterostomais®.
Introdução
A COVID-19 possui um amplo espectro clínico.1 Embora a maioria das pessoas infetadas com COVID-19 sejam assintomáticas ou tenham apenas sintomas ligeiros, os adultos mais idosos e aqueles que apresentam comorbidades são mais propensos a doença grave.2 Entre os pacientes que estão gravemente doentes com COVID-19, a maioria desenvolve a síndrome de insuficiência respiratória aguda (SDRA), uma forma de insuficiência respiratória que ameaça a vida com uma elevada taxa de mortalidade.3,4 Os pacientes que desenvolvem SDRA necessitam de apoio de ventilação na UCI. No entanto, os pacientes na UCI correm também um maior risco de desenvolvimento de lesões por pressão (IP) devido a uma mobilização prolongada.5
Infelizmente, as medidas de prevenção de IP não são implementadas da melhor forma na Indonésia,8 especialmente nos hospitais improvisados que foram criados durante a pandemia da COVID-19. Aqui, os autores relatam dois casos de pacientes críticos de COVID-19 que desenvolveram grandes IPP durante a hospitalização num hospital improvisado numa das maiores cidades da Indonésia. O consentimento informado por escrito foi dado pelo tutor legal (para o caso 1) e pelo sujeito do caso (para o caso 2) para que fossem publicados os detalhes do caso e as imagens associadas. Os autores destacam os desafios na gestão da IP durante a pandemia de COVID-19 e propõem várias sugestões para ajudar na sua prevenção da IP.
Relatório de caso
Estudo de caso 1
Um homem de 40 anos com um historial médico de esquizofrenia e incapacidade intelectual apresentou-se nas Urgências sendo as suas principais queixas a irritabilidade, febre, tosse seca e falta de ar. Três dias antes da admissão, o doente desenvolveu em casa uma febre de 38°C. Ao exame físico no SU, a temperatura do doente era 37,8°C, a PA era 120/80 mmHg, o ritmo cardíaco era 102 batimentos por minuto, o ritmo respiratório era de 24 respirações por minuto e a saturação de oxigénio era de 85% sem qualquer suporte de oxigénio. A auscultação pulmonar revelou incrustações no pulmão esquerdo e a radiografia ao tórax revelou infiltração pulmonar no pulmão esquerdo (Figura 1). A avaliação laboratorial mostrou elevados dímeros D (>20,000 ng/mL FEU) e hipoalbuminemia (2,2 mg/dl). Com base na avaliação inicial, suspeitou-se de infeção por COVID-19. Foi colhida uma amostra de nasofaringe para avaliação da reação de transcriptase-polimerase inversa em cadeia da COVID-19, para confirmação do diagnóstico de COVID-19.

Figura 1. Raio-x do tórax no caso 1, raio-x mostrando infiltração no pulmão esquerdo.
Enquanto esperava pelo resultado do teste, o paciente recebia 15 litros de oxigénio por minuto através de máscara não respiratória e era tratado com moxifloxacina intravenosa 400 mg diários, acetilcisteína intravenosa 500 mg diários, albumina intravenosa 50 gramas diários e 40 mg de enoxaparina subcutânea duas vezes por dia. Para tratar os sintomas de esquizofrenia, foi administrada ao doente clozapina oral 50 mg duas vezes por dia, quetiapina oral 200 mg duas vezes por dia e trihexyphenidyl oral 2 mg duas vezes por dia. Como o paciente não cooperava, o paciente foi retido na cama após o seu tutor legal ter dado o seu consentimento por escrito. Um cateter de foley foi então inserido e uma fralda foi utilizada. No dia seguinte, o resultado do teste COVID-19 do paciente voltou a ser positivo. O doente recebeu então tratamento adicional de 75 mg de oseltamivir intravenoso duas vezes por dia.
Durante a hospitalização, a saturação de oxigénio do paciente não apresentava melhorias. No dia 10, a análise dos gases sanguíneos mostrou acidose respiratória não compensada (pH 7,28, PO2 122 mmHg, PCO2 51,8 mmHg e HCO3 24,9 mEq/L) com suporte de oxigénio do circuito Jackson Reese. O paciente também desenvolveu SDRA (rácio PaO2/FiO2 122). Devido à falta de ventiladores mecânicos neste hospital improvisado, foi utilizado um ventilador não-invasivo. O paciente apresentava uma pressão arterial média de 60 mmHg e uma escala de coma de Glasgow de 8, indicando choque séptico contínuo. Desta forma, a norepinefrina intravenosa (0,1 mcg/kg/min) foi administrada continuamente usando uma bomba de seringa. Pelo motivo de o paciente se encontrar imobilizado, 30 minutos de mobilização passiva direita-oblíqua e 30 minutos de mobilização passiva esquerda-oblíqua foram realizados a cada 8 horas. As amarras foram libertadas antes da mobilização e refeitas após a mobilização para a nova posição. Para manter a ingestão nutricional, foi inserida uma sonda de alimentação nasogástrica. A nutrição necessária foi calculada pelo dietista e ministrada na forma de leite.
Devido ao número limitado de profissionais de saúde (HCWs) disponíveis em cada um dos turnos e à sua elevada carga de trabalho, não foi realizada a avaliação de risco de IP. No entanto, durante as trocas de fraldas realizadas a cada 8 horas, a pele do paciente era inspecionada. No dia 14, foi observada uma ferida sacral bilateral de 7 cm × 7 cm com superfície epitelial e leito superficial da ferida (Figura 2a). A ferida foi limpa usando uma solução salina normal e uma solução de irrigação de ferida e um penso de hidrogel de prata foi aplicado no leito da ferida. Um penso de espuma hidrocolóide foi colocado em cima do penso de hidrogel de prata e estendeu-se 2 cm à volta da ferida para proteger de maceração a pele peri-ferida. Para prevenir a contaminação por urina ou fezes, foi colocada gaze não esterilizada por cima do penso de espuma hidrocolóide e fixada com fita de retenção. Além disso, foi colocado um colchão de ar estático sobre a cama como dispositivo de redistribuição de pressão (DRP). O penso da ferida era mudado de 3 em 3 dias, ou mais cedo se estivesse contaminado com urina ou fezes.
No dia 18, a ferida sacral aumentou para 15 cm × 10 cm com viscosidade e suspeita de "ulceração mais profunda" (Figura 2b). O desbridamento cirúrgico do leito da ferida foi então realizado no leito pelos enfermeiros. Após o desbridamento cirúrgico, foi identificada fáscia constituindo o leito da ferida (Figura 2c). De acordo com o sistema de graduação do National Pressure Ulcer Advisory Panel de 2016 (NPUAP),10 a ferida foi classificada como sendo de grau III. Devido à profunda cavidade da ferida, foi colocada gaze esterilizada na cavidade da mesma para preencher o espaço após a aplicação de um penso de hidrogel de prata no leito da ferida. O penso da ferida era mudado a cada 2 dias em vez de a cada 3 dias, ou mais cedo se fosse contaminado com urina ou fezes. Quando necessário, foi novamente realizado o desbridamento cirúrgico. No dia 26, a partir da ferida começou a aparecer granulação (Figura 2d). O paciente teve alta no dia 39. Os enfermeiros acompanharam o paciente com visitas domiciliárias semanais até a ferida estar completamente fechada para avaliar o processo de cicatrização, realizar desbridamento cirúrgico se necessário, mudar o penso da ferida e também para ensinar aos familiares como mudar o penso da ferida entre as visitas domiciliárias.

Figura 2. Úlcera sacral no caso 1
A) Úlcera sacral com leito de ferida epitelial medindo 7 cm × 7 cm no dia 14. B) Coberto por viscosidade e suspeita de "úlcera mais profunda", medindo 15 cm × 10 cm no dia 18. C) Viscosidade mínima e fascia no leito da ferida após desbridamento cirúrgico e curativo da ferida, 15 cm x 10 cm com profundidade de 6 cm no dia 22. D) Tecido de granulação no dia 26, medindo 10 cm × 6 cm.
Estudo de caso 2
Um homem de 59 anos com uma história médica de diabetes mellitus tipo 2, hipertensão e acidente vascular cerebral (AVC) apresentou-se nas Urgências com queixas principais de febre, tosse e falta de ar. Cinco dias antes, o doente tinha desenvolvido em casa tosse e febre de 38,5°C. 3 dias antes de se apresentar nas urgências, o doente testou positivo para a COVID-19. No exame físico no SU a temperatura era de 37,5° C, a PA era de 140/90 mmHg, a frequência cardíaca era de 110 batimentos por minuto, a frequência respiratória era de 24 respirações por minuto e a saturação de oxigénio era de 75% sem qualquer suporte de oxigénio. O doente apresentava hemiplegia do lado esquerdo devido ao AVC. A auscultação pulmonar revelou incrustações em ambos os pulmões. A radiografia do tórax revelou opacidades pulmonares bilaterais e cardiomegalia (Figura 3). A avaliação laboratorial mostrou elevados níveis de D-dimers (2,100 ng/mL FEU), níveis elevados de interleucina-6 (120 pg/mL) e de hipoalbuminemia (2,8 mg/dl). Com base na avaliação inicial, o doente foi diagnosticado com COVID-19 e AVC recente.

Figura 3. Raio-X ao tórax no caso 2
Raio-X mostrando infiltração tanto nos pulmões como na cardiomegalia com relação cárdio-torácica de 60%.
O paciente recebeu 15 litros de oxigénio por minuto através do circuito de Jackson Rees e foi tratado com moxifloxacina intravenosa 400 mg diários, acetilcisteína intravenosa 500 mg diários, albumina intravenosa 50 gramas diários, heparina subcutânea 5000 Unidade Internacional (IU), dexametasona intravenosa 6 mg diários, 400 mg intravenosos Tocilizumab dose única e oseltamivir oral 75 mg duas vezes por dia. Para tratar a hipertensão, o paciente recebeu amlodipina oral 10 mg uma vez por dia e candesartan oral 16 mg igualmente uma vez por dia. O doente recebeu também insulina subcutânea de ação longa 20 IU uma vez por dia e insulina de ação rápida 16 IU três vezes por dia para tratamento da diabetes mellitus.
Durante a hospitalização, a saturação de oxigénio do paciente não apresentava melhorias. No dia 7, a análise dos gases sanguíneos mostrou acidose respiratória não compensada (pH 7,3, PO2 150 mmHg, PCO2 50,2 mmHg e HCO3 23,5 mEq/L) com suporte de oxigénio do circuito Jackson Reese. O paciente desenvolveu SDRA (rácio PaO2/FiO2 150) e recebeu um ventilador não invasivo devido à falta de ventiladores mecânicos. Pelo motivo de o paciente se encontrar imobilizado, 30 minutos de mobilização passiva direita-oblíqua e 30 minutos de mobilização passiva esquerda-oblíqua foram realizados a cada 8 horas. Para manter a ingestão nutricional, foi inserida uma sonda de alimentação nasogástrica; a alimentação de leite foi calculada por um dietista.
Devido ao número limitado de HCWs em cada turno e à sua elevada carga de trabalho, a avaliação de risco de IP não foi realizada. No entanto, durante as trocas de fraldas realizadas a cada 8 horas, a pele do paciente era inspecionada. No dia 16, foi observada uma ferida sacral de 12 cm × 8 cm com suspeita de "ulceração mais profunda" em ambos os lados do sacro (Figura 4a). No dia 18, estava presente tecido necrótico central (Figura 4b). Os enfermeiros efetuaram o desbridamento cirúrgico do leito (Figura 4c) e a ferida foi limpa utilizando solução salina normal e solução de irrigação da ferida. Um penso de hidrogel de prata foi aplicado no leito da ferida e um penso de espuma hidrocolóide foi colocado em cima do penso de hidrogel de prata e estendido 2 cm à volta da ferida para proteger da maceração a pele peri-ferida. Para prevenir a contaminação por urina ou fezes, foi colocada gaze não esterilizada por cima do penso de espuma hidrocolóide e fixada com fita de retenção. Além disso, foi colocado um colchão de ar estático sobre a cama como DRP. O penso da ferida era mudado de 3 em 3 dias, ou mais cedo se estivesse contaminado com urina ou fezes. Quando necessário, foi novamente realizado o desbridamento cirúrgico.
Dois dias após o tratamento, o leito da ferida era mais profundo do que a ferida inicial, com exposição óssea e tendinosa (Figura 4d). De acordo com o sistema de graduação da NPUAP de 2016,10 a ferida foi classificada como sendo de grau IV. Devido profunda cavidade da ferida, a cavidade foi preenchida com gaze esterilizada após a aplicação de um penso de hidrogel de prata no leito da ferida. O penso da ferida era mudado a cada 2 dias em vez de a cada 3 dias, ou mais cedo se fosse contaminado com urina ou fezes. No dia 25, a úlcera apresentava tecido de granulação (Figura 4e) e no dia 30, a úlcera tinha-se estreitado (Figura 4f). O paciente teve alta no 35º dia. Os enfermeiros acompanharam o paciente com visitas domiciliárias semanais até a ferida estar completamente fechada para avaliar o processo de cicatrização, realizar desbridamento cirúrgico se necessário, mudar o penso da ferida e ensinar aos familiares como mudar o penso da ferida entre as visitas domiciliárias programadas.

Figura 4. Úlcera sacral no caso 2
A) Úlcera sacral em ambos os lados das nádegas, com leito de ferida epitelial e tecido necrótico no lado central, medindo 12 cm x 8 cm no dia 16. B) Coberto tanto com viscosidade como com tecido necrótico, medindo 12 cm x 10 cm no dia 18. C) Após desbridamento cirúrgico no dia 18. D) Coberta com viscosidade maciça, profundidade de 7 cm no dia 20. E) Tecido de granulação e viscosidade mínima no dia 25. F) Tecido de granulação no dia 30.
Discussão
Como refletido na última definição NPUAP de IP, os principais fatores que influenciam o desenvolvimento da IP são a pressão, o cisalhamento, e a tolerância dos tecidos moles.10 A pressão refere-se à pressão sustentada num ponto local, enquanto a força de cisalhamento ocorre quando duas superfícies opostas deslizam em direções opostas. Quando a pressão e o cisalhamento interrompem o fluxo sanguíneo e a hipoxia local dos tecidos ocorre durante um período crítico de tempo, resultam danos nos tecidos. No entanto, a intensidade e a duração dos danos forçados dos tecidos depende da tolerância dos tecidos.12 As lesões por pressão ocorrem geralmente em áreas ósseas, tais como o sacro.13
Os investigadores identificaram uma série de fatores de risco de IP, incluindo imobilidade, estar confinado ao leito, desnutrição, desidratação, infeção, incontinência urinária e intestinal, diabetes, doença vascular e uso de vasopressores.14-16 Os pacientes sedados são particularmente propensos à IP porque não percebem estímulos dolorosos de pressão intensa e prolongada e não são capazes de mudar ativamente a sua posição na cama.7,17,18 Recentemente, tem sido relatado que os pacientes que estão gravemente doentes com COVID-19 também se encontram em maior risco de IP.19 Estes pacientes têm perfusão reduzida e são mais propensos a desenvolver coagulopatia sistémica, o que leva a uma menor tolerância dos tecidos.19 No primeiro caso, o paciente estava gravemente doente com COVID-19 e necessitava de um vasopressor. Este paciente tinha a saúde mental afetada como uma comorbidade. As pessoas com graves problemas de saúde mental, tais como a esquizofrenia, tendem a ter uma dieta pobre e podem negligenciar a sua higiene pessoal, causando condições semelhantes à incontinência urinária e intestinal.13 No segundo caso, o doente também estava gravemente doente com COVID-19 e tinha AVC e diabetes mellitus como comorbidades.
As lesões por pressão estão associadas a uma hospitalização prolongada.20-22 A duração da hospitalização foi de 39 dias para o primeiro paciente do relatório de caso e de 35 dias para o segundo paciente. O primeiro paciente poderia ter tido alta 9 dias antes se não tivesse existido IP; o segundo paciente poderia ter tido alta 5 dias antes. Numa série de casos anteriores em três pacientes gravemente doentes com COVID-19, os IPs foram registados pela primeira vez entre 7 e 19 dias após a hospitalização.19 Para os pacientes aqui descritos, o IP foi anotado no dia 14 de hospitalização para o primeiro paciente e no dia 16 para o segundo paciente.
De acordo com as últimas diretrizes, a avaliação abrangente dos riscos da IP, os cuidados preventivos da pele e a mobilização e reposicionamento precoces são algumas das estratégias de gestão da IP que devem ser consideradas.23 Em termos de pacientes críticos com COVID-19, Tang et al24 descobriram que as IP podem ser geridas melhorando os fatores contribuidores subjacentes, fornecendo DRP com posicionamento adequado, melhorando a mobilidade, minimizando a humidade excessiva, corrigindo a desnutrição, e realizando um acompanhamento diário próximo da IP, incluindo o penso, a pele circundante e quaisquer possíveis complicações.
No entanto, a gestão adequada da IP traduz-se numa carga de trabalho adicional para os enfermeiros. Infelizmente, devido à escassez significativa de pessoal, a carga de trabalho dos HCW durante a pandemia de COVID-19 na Indonésia é já elevada.9 Neste hospital improvisado, existe apenas um médico e três enfermeiros em cada turno, o que resulta numa proporção de 1:5 entre o HCW e o paciente. Além disso, a maioria dos pacientes com COVID-19 estavam gravemente doentes. Com uma relação muito desequilibrada entre o HCW e o paciente e a elevada carga de trabalho daí resultante para os HCW, não é possível seguir as diretrizes para uma gestão adequada da IP. Como resultado, a avaliação de risco de IP não foi realizada quando os pacientes chegaram ao hospital improvisado; a mobilização e avaliação da pele foram realizadas a cada 8 horas (uma vez por turno de trabalho do HCW) em vez de serem individualizadas de acordo com a respetiva avaliação de risco.
Em relação às DRP, um estudo recente descobriu que a utilização de DRP estava associada a uma redução de 88% do risco de desenvolvimento de IP em pacientes de UCI de alto risco.25 Do mesmo modo, uma revisão sistemática anterior também concluiu que as DRP deveriam ser fornecidas a pacientes que se encontram em alto risco de desenvolvimento de IP.26 Os dispositivos de redistribuição de pressão ajudam a prevenir as IP, diminuindo a magnitude e a duração da pressão, reduzindo o cisalhamento e o atrito entre o paciente e a superfície do leito.10,25 Assim, fornecer DRPs para todos os pacientes críticos com COVID-19 seria uma estratégia benéfica para a prevenção de IP. No entanto, no hospital improvisado, apenas dois DRPs estão disponíveis, sendo por esse motivo atribuídos para tratamento de IP e não para prevenção de IP.
Com base nas dificuldades experimentadas durante a pandemia COVID-19, os autores recomendam várias estratégias de prevenção de IP para hospitais com escassez de HCW:23,28
Reeducar os HCWs sobre a gestão de IP
Com a maior frequência possível, conduzir avaliações cutâneas
Assegurar uma nutrição e hidratação adequadas aos pacientes.
Usar DRPs em todos os pacientes que estão gravemente doentes com COVID-19
Em todos os pacientes gravemente doentes com COVID-19, aplicar pensos de espuma de silicone sobre as saliências ósseas que servem de pontos de pressão principais.
Conclusões
Os pacientes que estão gravemente doentes com COVID-19 correm também um maior risco de desenvolvimento de IP durante a sua hospitalização. Numa situação em que há falta de HCWs, os governos deveriam compensar fornecendo DRPs adicionais e pensos de espuma de silicone para todos os pacientes gravemente doentes, de forma a prevenir o desenvolvimento de IP e aliviar a carga de trabalho dos HCWs.
Conflito de interesses
Os autores declaram não haver conflitos de interesse.
Financiamento
Os autores não receberam qualquer financiamento para este estudo.
Author(s)
Kezia Eveline MD
Plastic Reconstructive and Aesthetic Surgery Resident, Faculty of Medicine Universitas Airlangga, Dr Soetomo General Academic Hospital, Surabaya, Indonesia
Hemma W Indirayani MD
Internist, Menur Mental Hospital, Surabaya, Indonesia
Rachmaniar Pramanasari MD
Plastic Reconstructive and Aesthetic Surgeon, Airlangga University Hospital, Surabaya, Indonesia
Firas F Alkaff* MD
Lecturer, Division of Pharmacology and Therapy, Department of Anatomy, Histology and Pharmacology, Faculty of Medicine Universitas Airlangga
PhD Researcher, Division of Nephrology, Department of Internal Medicine, University Medical Centre, Groningen, The Netherlands
* Corresponding author
Kezia Eveline, MD is Plastic Reconstructive and Aesthetic Surgery Resident at Faculty of Medicine Universitas Airlangga, Dr. Soetomo General Academic Hospital, Surabaya, Indonesia. Hemma W. Indriyani, MD is Internist at Menur Mental Hospital, Surabaya. Rachmaniar Pramanasari, MD, is Plastic Reconstructive and Aesthetic Surgeon at Airlangga University Hospital, Surabaya. Firas F. Alkaff, MD is Lecturer at Division of Pharmacology and Therapy, Department of Anatomy, Histology, and Pharmacology, Faculty of Medicine Universitas Airlangga and PhD Researcher at Division of Nephrology, Department of Internal Medicine, University Medical Center Groningen, Groningen, The Netherlands
Kezia Eveline, MD é residente de Cirurgia Plástica Reconstrutiva e Estética na Faculdade de Medicina Universitas Airlangga, Dr. Soetomo General Academic Hospital, Surabaya, Indonésia. Hemma W. Indriyani, MD é Internista no Hospital Mental Menur, Surabaya. Rachmaniar Pramanasari, MD, é Cirurgião Plástico Reconstrutivo e Estético no Hospital Universitário de Airlangga, Surabaya. Firas F. Alkaff, MD é Docente na Divisão de Farmacologia e Terapia, Departamento de Anatomia, Histologia e Farmacologia, Faculdade de Medicina Universitas Airlangga e Investigador Doutor na Divisão de Nefrologia, Departamento de Medicina Interna, Centro Médico Universitário de Groningen, Groningen, Países Baixos
References
- Ramos-Casals M, Brito-Zeron P, Mariette X. Systemic and organ-specific immune-related manifestations of COVID-19. Nat Rev Rheumatol 2021;17:315-32.
- Gao YD, Ding M, Dong X, et al. Risk factors for severe and critically ill COVID-19 patients: a review. Allergy 2021;76:428-55.
- Xu W, Sun NN, Gao HN, et al. Risk factors analysis of COVID-19 patients with ARDS and prediction based on machine learning. Sci Rep 2021;11:2933.
- Yang X, Yu Y, Xu J, et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study. Lancet Respir Med 2020;8:475-81.
- Challoner T, Vesel T, Dosanjh A, Kok K. The risk of pressure ulcers in a proned COVID population. Surgeon 2021;S1479-666X(21)00121-9.
- He M, Tang A, Ge X, Zheng J. Pressure ulcers in the intensive care unit: an analysis of skin barrier risk factors. Adv Skin Wound Care 2016;29:493-8.
- Keller BP, Wille J, van Ramshorst B, van der Werken C. Pressure ulcers in intensive care patients: a review of risks and prevention. Intensive Care Med 2002;28:1379-88.
- Amir Y, Lohrmann C, Halfens RJ, Schols JM. Pressure ulcers in four Indonesian hospitals: prevalence, patient characteristics, ulcer characteristics, prevention and treatment. Int Wound J 2017;14:184-93.
- Mahendradhata Y, Andayani N, Hasri ET, et al. The capacity of the Indonesian healthcare system to respond to COVID-19. Front Public Health 2021;9:649819.
- Edsberg LE, Black JM, Goldberg M, McNichol L, Moore L, Sieggreen M. Revised National Pressure Ulcer Advisory Panel pressure injury staging system: revised pressure injury staging system. J Wound Ostomy Continence Nurs 2016;43:585-97.
- Defloor T. The risk of pressure sores: a conceptual scheme. J Clin Nurs 1999;8:206-16.
- Mervis JS, Phillips TJ. Pressure ulcers: Pathophysiology, epidemiology, risk factors, and presentation. J Am Acad Dermatol 2019;81:881-90.
- Bhattacharya S, Mishra RK. Pressure ulcers: current understanding and newer modalities of treatment. Indian J Plast Surg 2015;48(1):4-16.
- Cox J, Roche S. Vasopressors and development of pressure ulcers in adult critical care patients. Am J Crit Care 2015;24:501-10.
- Ahn H, Cowan L, Garvan C, Lyon D, Stechmiller J. Risk factors for pressure ulcers including suspected deep tissue injury in nursing home facility residents: analysis of national minimum data set 3.0. Adv Skin Wound Care 2016;29:178-90; quiz E1.
- Mawhirt SL, Frankel D, Diaz AM. Cutaneous manifestations in adult patients with COVID-19 and dermatologic conditions related to the COVID-19 pandemic in health care workers. Curr Allergy Asthma Rep 2020;20(12):75.
- Nedergaard HK, Haberlandt T, Toft P, Jensen HI. Pressure ulcers in critically ill patients - preventable by non-sedation? A substudy of the NONSEDA-trial. Intensive Crit Care Nurs 2018;44:31-5.
- Sasabe Y, Niitani M, Teramoto C, et al. Deep sedation predicts pressure injury in patients admitted to intensive care units. Nurs Crit Care 2022;DOI: 10.1111/nicc.12753.
- Young S, Narang J, Kumar S, et al. Large sacral/buttocks ulcerations in the setting of coagulopathy: a case series establishing the skin as a target organ of significant damage and potential morbidity in patients with severe COVID-19. Int Wound J 2020;17:2033-7.
- Triantafyllou C, Chorianopoulou E, Kourkouni E, Zaoutis TE, Kourlaba G. Prevalence, incidence, length of stay and cost of healthcare-acquired pressure ulcers in pediatric populations: a systematic review and meta-analysis. Int J Nurs Stud 2021;115:103843.
- Gupta P, Shiju S, Chacko G, et al. A quality improvement programme to reduce hospital-acquired pressure injuries. BMJ Open Qual 2020;9(3):e000905.
- Allman RM, Goode PS, Burst N, Bartolucci AA, Thomas DR. Pressure ulcers, hospital complications, and disease severity: impact on hospital costs and length of stay. Adv Wound Care 1999;12:22-30.
- European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel, Pan Pacific Pressure Injury Alliance. Prevention and Treatment of Pressure Ulcers/Injuries: Clinical Practice Guideline. The International Guideline. EPUAP/NPIAP/PPPIA; 2019.
- Tang J, Li B, Gong J, Li W, Yang J. Challenges in the management of critical ill COVID-19 patients with pressure ulcer. Int Wound J 2020;17:1523-4.
- Bai DL, Liu TW, Chou HL, Hsu YL. Relationship between a pressure redistributing foam mattress and pressure injuries: an observational prospective cohort study. PLoS One 2020;15(11):e0241276.
- McInnes E, Jammali-Blasi A, Bell-Syer SE, Dumville JC, Middleton V, Cullum N. Support surfaces for pressure ulcer prevention. Cochrane Database Syst Rev 2015;9:CD001735.
- Shi C, Dumville JC, Cullum N. Support surfaces for pressure ulcer prevention: a network meta-analysis. PLoS One 2018;13(2):e0192707.
- Team V, Team L, Jones A, Teede H and Weller CD (2021) Pressure Injury Prevention in COVID-19 Patients With Acute Respiratory Distress Syndrome. Front. Med. 7:558696. doi: 10.3389/fmed.2020.558696



