Volume 43 Number 1
WHAM evidence summary: traditional hypochlorite solutions
Emily Haesler, Keryln Carville
Keywords Traditional wound management, hypochlorite, Eusol, Dakin’s® solution, Milton® solution
For referencing Haesler E & Carville K. WHAM evidence summary: traditional hypochlorite solutions . WCET® Journal 2023; 43(1):35-40
DOI https://doi.org/10.33235/wcet.43.1.35-40
Clinical question
What is the best available evidence for use of traditional hypochlorite solutions for reducing wound infection and/or improving wound healing?
Summary
Traditional hypochlorites have been used to manage local wound infection since their introduction in the early 1900s1. Traditional hypochlorite solutions are those that have a high pH varying from 7.5 to 11.82-5. In contrast, recently developed hypochlorite solutions are pH-neutral, making them more appropriate for application to healing wound tissue. Level 5 bench research has demonstrated that traditional hypochlorite solutions have anti-bacterial properties;6-8 however, the effect may be short-lived9. Although Level 5 bench research has suggested that traditional hypochlorite solutions are toxic to cells and may delay wound healing,6, 8, 10, 11 Level 1 and 2 evidence2, 12-16 showed that acceptable healing outcomes can be achieved using traditional hypochlorite solutions, with one study demonstrating superior outcomes compared to an inert solution.17 Level 1 and 4 evidence12, 13, 16-20 indicated that traditional hypochlorite solutions are associated with reduction in signs and symptoms of local wound infection. Level 1 and 2 evidence13, 14, 16 showed that topical phenytoin13, 16, honey14 and nanocrystalline silver gel16 achieved better outcomes than a traditional hypochlorite solution, and these options could be considered in settings with access. The risk of delaying healing of the wound should be considered in the context of managing local wound infection and reducing the risk of spreading and systemic infection, when alternative less cytotoxic antiseptics are not available in the setting.
Clinical practice recommendations
All recommendations should be applied with consideration to the wound, the person, the health professional and the clinical context.
|
Traditional hypochlorite solutions could be applied to infected wounds in low resource settings in which less cytotoxic antiseptic solutions are not accessible (Grade B). |
Sources of evidence: search and appraisal
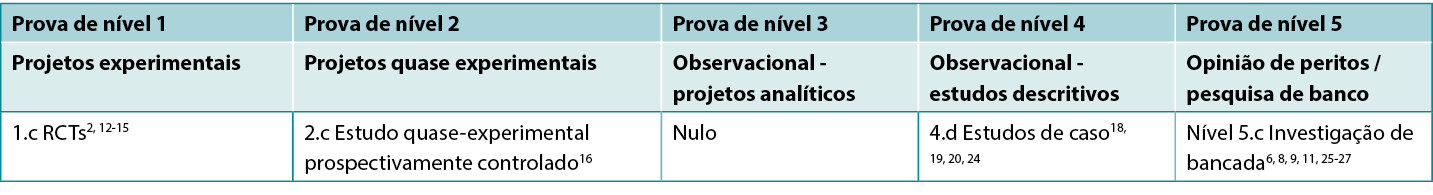
This summary was conducted using methods published by the Joanna Briggs Institute.21-23 The summary is based on a literature search combining search terms related to hypochlorites/EUSOL/Dakin’s® solution/Milton® solution and wound infection. Searches were conducted in the Cumulative Index to Nursing and Allied Health Literature (CINAHL), PubMed®, Google Scholar and Health Internetwork Access to Research Initiative (Hinari) databases and in the Cochrane Library for evidence conducted in human wounds reporting the use of traditional hypochlorite preparations published to October 2022 in English. Levels of evidence for intervention studies are reported in Table 1.
Table 1. Levels of evidence for clinical studies

Background
Traditional hypochlorites are preparations that occur as a reaction between chlorine and an alkaline salt, most commonly sodium or calcium 28, 29. They typically have a pH from 7.5 up to 11.8.2-5 Commonly used traditional hypochlorites include household bleach, Dakin’s® solution, Edinburgh University Solution of Lime (EUSOL) and Milton® solution. (N.b., no evidence on the use of Milton® solution for wound healing was identified).
Dakin’s® solution is a preparation of bleach diluted in distilled water to 0.5% concentration for clinical use. In some reports of its use, traditional Dakin’s® solution is diluted to half or quarter strength by mixing with additional water19. The preparation was developed by Henry Dakin on the war fields in France in 1915 to manage wound infection and to improve clinical outcomes for bullet and shrapnel wounds28, 30, 31. Bench research has demonstrated Dakin’s® solution has action against a range of microorganisms and biofilms, including (but not limited to) S. aureus, C. albicans, E. coli, K. pneumoniae, and P. aeruginosa6, 8, 9, 17, 25, 27 (Level 5).
EUSOL solution is made from chlorinated lime (calcium oxide) and boric acid (sodium salts) at a 0.25% concentration2, 24, 32, 33.The solution, which was also developed in the early 1900s, is traditionally used as a debriding agent and to manage infection.32, 34
Traditional hypochlorites are unstable and have a short shelf life.29, 34 They have a high pH2-5, which is associated with impaired wound healing. Both full strength (0.5%) Dakin’s® solution8 and half strength (0.25%) Dakin’s® solution6 have been reported to be cytotoxic to fibroblasts in laboratory studies, raising concerns that traditional hypochlorites at their full concentration may delay wound healing11, 16, 29-31, 34-36. To address these limitations, hypochlorites are now prepared electro-chemically to produce contemporary hypochlorites referred to as super-oxidised solutions29, 37. Although super-oxidised solutions have a longer shelf-life and a neutral pH, and they appear to have a good safety profile,29, 38 they are not universally available. In low resource settings, traditional hypochlorites are still used for managing wound infection39, 40.
Clinical evidence on dakin’s® solution
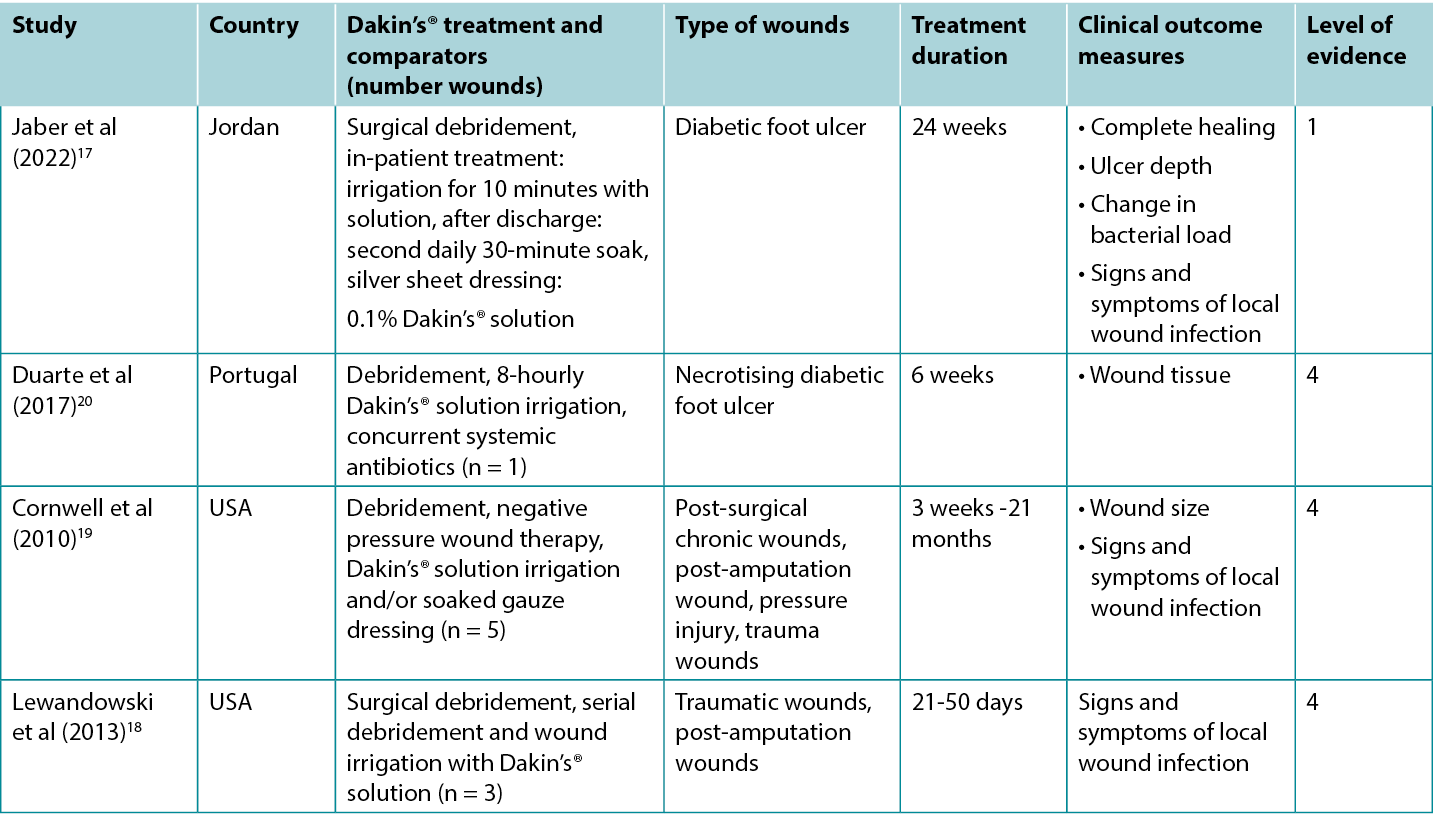
Studies reporting clinical outcomes of interest for treatment with traditional Dakin’s® solution are summarised in Table 2.
Table 2. Summary of the evidence for Dakin’s solution
Dakin’s® solution for promoting wound healing
An RCT17 at high risk of bias explored the use of Dakin’s® solution for treating infected diabetic foot ulcers (DFUs). Ulcers were surgically debrided on admission and received evidence based DFU care in conjunction with daily 10-minute irrigation with either Dakin’s® solution diluted to 0.1% concentration or normal saline, followed by application of a silver sheet dressing. Treatment was delivered in hospital for at least five days. On discharge, patients cleansed their own wounds every second day by soaking the DFU for 30 minutes in the assigned solution. Treatment continued for at least three months. Approximately 35% of DFUs treated with Dakin’s® solution were totally healed compared to 4% in the control group (odds ratio 11.9, 95% confidence interval 2.53 – 55.5, p < 0.001)17 (Level 1).
Dakin’s® solution for treating signs and symptoms of wound infection
In the RCT17 comparing Dakin’s® solution to normal saline for DFUs, quantitative wound swab analysis showed DFUs treated with Dakin’s solution had a reduction from baseline in microbial load of 1 log cycle or more after five days (statistically significant versus control, p < 0.001). Local wound infection resolved in more DFUs treated with Dakin’s® solution compared to normal saline (35.6% versus 4.4%, p = not reported)17 (Level 1).
There are numerous case reports18-20 of infected wounds of various aetiologies that have been successfully treated with regimens that include regular irrigation with Dakin’s® solution. Many of the wounds were reported to be extensive and deep, with exposed ligament and bone and/or necrotising tissue. Wounds were either confirmed or suspected to be colonised with anaerobic bacteria20 or fungal organisms18. To treat wound odour19, wound exudate19 and extensive slough18-20 (all recognised signs and symptoms of local wound infection41) wounds were surgically debrided and regularly irrigated with full, half or quarter strength Dakin’s® solution. Many of the regimens also included systemic antibiotics, serial surgical debridement, negative pressure wound therapy and split skin grafting. The cases were reported to achieve resolution of signs and symptoms of local wound infection and development of healthy granulation tissue or complete epithelialisation18-20 (Level 4).
Clinical evidence on eusol solution
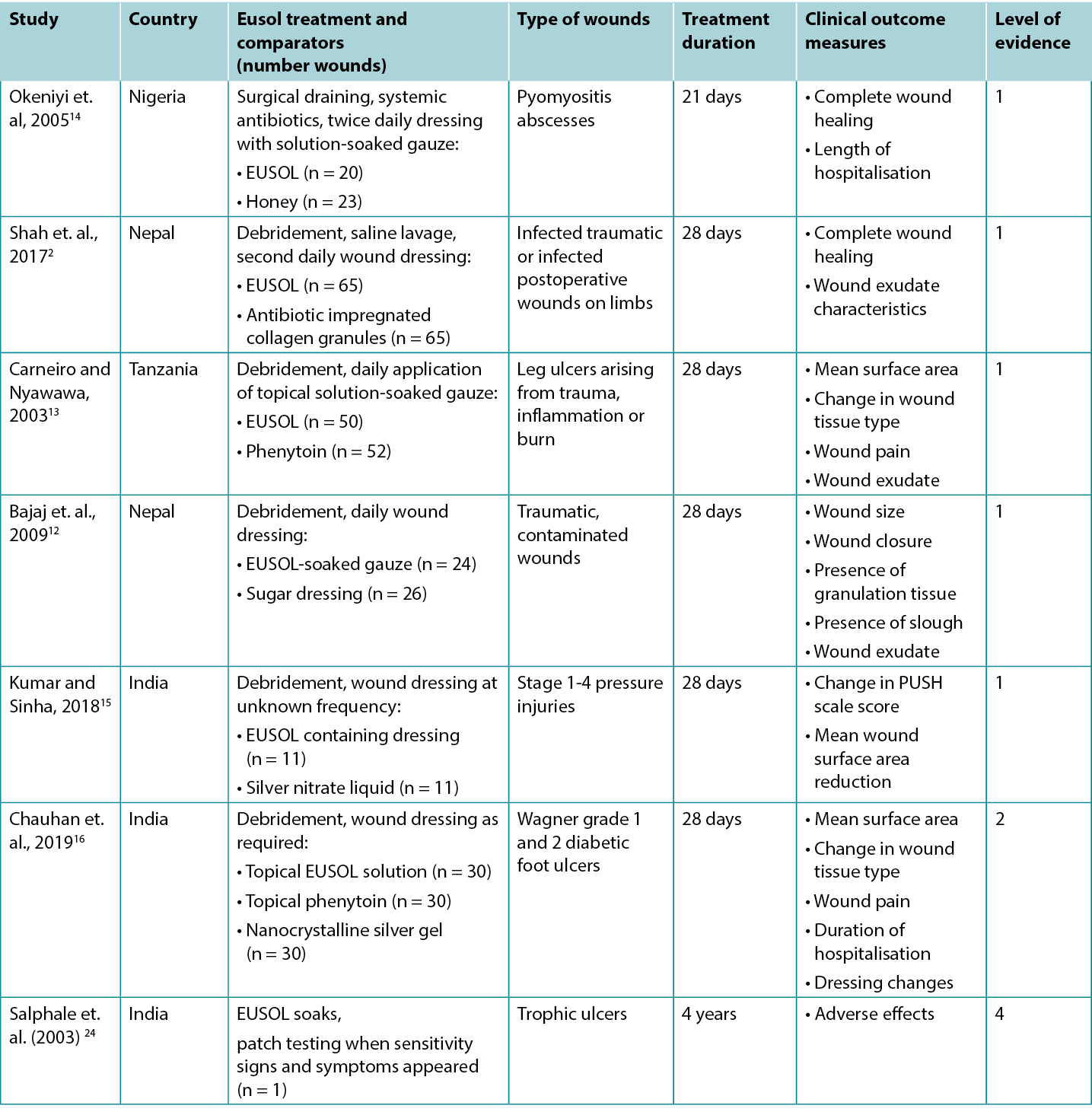
Studies reporting clinical outcomes of interest for treatment with traditional Edinburgh Solution of Lime (EUSOL) solution are summarised in Table 3.
Table 3. Summary of the evidence for EUSOL solution
EUSOL solution for improving wound healing
Five Level 1 studies and one Level 2 study provided evidence on EUSOL for improving healing of wounds of various aetiologies. In the first RCT14 (32 children with 43 wounds), which was at moderate risk of bias, open wounds (surgically excised pyomyositis abscesses) were packed twice daily with either EUSOL-soaked gauze or honey-soaked gauze. At 3-week follow-up, 55% of the EUSOL-treated abscesses achieved complete healing; compared to the 87% healing rate in the honey group (p < 0.047)14 (Level 1).
The second RCT,2 also at high risk of bias, reported use of EUSOL dressings to treat infected traumatic wounds. In this study, EUSOL was compared with an antibiotic-impregnated collagen granule dressing. At 4-week follow-up, 53.8% of the EUSOL-treated wounds were completely healed, and the remaining wounds had healthy granulation tissue. This was not statistically significantly different from the group treated with collagen granules, of which 69% completely healed, with the remainder achieving healthy granulation (p = 0.416)2 (Level 1).
A comparison of EUSOL-soaked gauze to sugar dressings is reported in a third RCT12 at high risk of bias that was conducted in traumatic, contaminated wounds (n = 50). After four weeks of daily wound dressings, wounds treated with the EUSOL dressing achieved superior results to the wounds treated with sugar dressings, including wound size reduction (p = 0.0042), achievement of granulation (p = 0.0048) and wound closure rate (p = 0.008)12 (Level 1).
In a fourth RCT13 at high risk of bias, chronic leg ulcers (n = 102) were treated daily with debridement followed by application of either EUSOL or topical phenytoin. Ulcers that achieved uniform granulation were treated with skin grafts. Wound surface area and presence of granulation tissue were evaluated weekly during the 28-day treatment period. The ulcers treated with EUSOL showed a mean reduction in surface area of about 60% over 28 days; this improvement appeared to be inferior to the topical phenytoin group (p = not reported). Although 86% of the ulcers receiving EUSOL achieved healthy granulation by 28 days, this was statistically significantly poorer outcome than the phenytoin group13 (Level 1).
The final RCT15, which was also at high risk of bias, reported a comparison of EUSOL-soaked gauze with a topical silver nitrate (0.01% w/v) liquid for treating pressure injuries (PIs) in people with spinal cord injury (n = 22). The groups were matched for severity of PIs at baseline. All Stage 1 PIs healed within two weeks of treatment. For Stage 2 PIs, those treated with EUSOL decreased in wound size by a mean of 47% after four weeks. For Stage 3 PIs treated with EUSOL, the average reduction in wound area at 4 weeks was 17%, compared with a mean size reduction of 26% for the silver-based treatment (p values = not reported). No Stage 4 PIs healed in the 4-week study duration15 (Level 1).
In a comparative study,16 which was at high risk of bias, EUSOL solution was compared to phenytoin powder and nanocrystalline silver gel for promoting healing in DFUs of Wagner grade 1 (superficial ulcer) and grade 2 (deep ulcer). The DFUs were surgically debrided as required and treated for up to four weeks with the assigned topical treatment. At 4-week follow-up, 73.33% of the DFUs treated with EUSOL solution had granulation tissue in the wound bed (p > 0.05). At baseline the mean ulcer size in the EUSOL-treated group was 16.66 cm2 ± 7.52 cm2, reducing to a mean of 7.7cm2 ± 6.65 cm2 by the end of four weeks, which may be clinically significant for patients. However, the EUSOL-treated DFUs achieved statistically significantly inferior results compared with those treated with phenytoin powder or nanocrystalline silver gel16 (Level 2).
EUSOL solution for reducing signs and symptoms of wound infection
Four of the above studies2, 12, 13, 16 reported reduction in signs and symptoms that are associated with local wound infection, including wound-associated pain, wound exudate, and a sloughy wound surface.41
In the study comparing EUSOL to topical phenytoin, the people with EUSOL-treated ulcers reported reduction in severe wound-associated pain and improvement in wound exudate by the second week of treatment13. Although the topical phenytoin group had superior outcomes at week two, there was no statistically significant difference by 28 days In the study comparing EUSOL dressings to sugar dressings, fewer wounds treated with EUSOL had a sloughy wound surface (p = 0.0034) and exudate level (p = 0.011) after four weeks.12 The infected wounds that were treated with EUSOL in the RCT by Shah et. al. (2017) 2 showed improvement in wound exudate characteristics by the fourth week of treatment and this was not statistically significantly different (p = 0.24) to the exudate profile of the antibiotic-impregnated collagen granule group2 (Level 1).
In the study conducted in DFUs,16 EUSOL solution was associated with a small reduction in pain after four weeks of treatment (mean pain score reduction of 1.87 ± 1.57 on a five-point visual analogue scale). This was unlikely to be clinically significant.16 (Level 2).
Considerations for use
Adverse effects reported with traditional hypochlorites
- Contact sensitivity to traditional hypochlorites has been observed in rare cases24 (Level 4).
- Although skin irritation,34 mild pain on application9and chemical burns with using the solution at inappropriate concentrations16 have been associated with traditional hypochlorites, these adverse events were not observed in the studies reported in this evidence summary.
Preparation of solutions in low resource settings
- A 0.5% Dakin’s® solution can be prepared with 25 mL household bleach mixed with 2 teaspoons of baking soda (bicarbonate of soda/sodium bicarbonate) in 1 L of clean water40. The solution has a short shelf-life,28, 29 and bench research has suggested the solution may provide inadequate antibacterial effect within 24 hours of preparation9. Therefore, the solution should be prepared every 24 hours40.
- A EUSOL solution can be prepared with 12.5 g sodium hypochlorite (bleaching powder) and 12.5 g of boric acid combined in 1 L of clean, lukewarm water. The solution has a short shelf life and preparation immediately before use is recommended2, 24, 32, 33.
Conflict of interest
The authors declare no conflicts of interest in accordance with International Committee of Medical Journal Editors (ICMJE) standards.
About wham evidence summaries
WHAM evidence summaries are consistent with methodology published in Munn Z, Lockwood C, Moola S. The development and use of evidence summaries for point of care information systems: A streamlined rapid review approach, Worldviews Evid Based Nurs. 2015;12(3):131-8.
Methods are outlined in resources published by the Joanna Briggs Institute21-23 and on the WHAM Collaborative website: http://WHAMwounds.com. WHAM evidence summaries undergo peer-review by an international, multidisciplinary Expert Reference Group. WHAM evidence summaries provide a summary of the best available evidence on specific topics and make suggestions that can be used to inform clinical practice. Evidence contained within this summary should be evaluated by appropriately trained professionals with expertise in wound prevention and management, and the evidence should be considered in the context of the individual, the professional, the clinical setting and other relevant clinical information.
Copyright © 2023 Wound Healing and Management Collaborative, Curtin Health Innovations Research Institute, Curtin University
Resumo das evidências do WHAM: soluções de hipoclorito tradicionais
Emily Haesler, Keryln Carville
DOI: https://doi.org/10.33235/wcet.43.1.35-40
Questão clínica
Qual é a melhor evidência disponível para a utilização de soluções tradicionais de hipoclorito para a redução da infeção em feridas e/ou melhorar a cicatrização de feridas?
Resumo
Os hipocloritos tradicionais têm sido utilizados para controlar a infeção local em feridas desde a sua introdução no início dos anos 19001. As soluções hipoclorito tradicionais são aquelas que apresentam um pH elevado, variando de 7,5 a 11,82-5. Em contraste, as soluções de hipoclorito recentemente desenvolvidas apresentam um pH neutro, tornando-as mais apropriadas para aplicação na cicatrização do tecido da ferida. A investigação de bancada de nível 5 demonstrou que as soluções de hipoclorito tradicionais apresentam propriedades anti-bacterianas;6-8 no entanto, o efeito pode ser de curta duração9. Embora a investigação de nível 5 tenha sugerido que as soluções de hipoclorito tradicionais são tóxicas para as células e podem atrasar a cicatrização da ferida,6, 8, 10, 11, evidências de Nível 1 e de Nível 22, 12-16 demonstraram que é possível obter resultados de cicatrização aceitáveis utilizando soluções de hipoclorito tradicionais, com um estudo a demonstrar resultados superiores em comparação os obtidos com uma solução inerte.17 Evidências de Nível 1 e de Nível 4 12,13,16-20 indicaram que as soluções de hipoclorito tradicionais estão associadas à redução dos sinais e dos sintomas de infeção local da ferida. Evidências de Nível 1 e de Nível 213,14,16 demonstraram que a fenitoína tópica13,16, bmel14 e o gel de prata nanocristalino16 alcançaram melhores resultados do que uma solução de hipoclorito tradicional e estas opções poderiam ser consideradas em cenários em que estejam acessíveis. O risco de retardar a cicatrização da ferida deve ser considerado no contexto da gestão do local da infeção da ferida e da redução do risco de propagação e de infeção sistémica, quando localmente não existem antissépticos alternativos menos citotóxicos.
Recomendações de prática clínica
Todas as recomendações devem ser aplicadas tendo em consideração a ferida, a pessoa, o profissional de saúde e o contexto clínico.
|
As soluções hipoclorito tradicionais podem ser aplicadas em feridas infetadas em locais com poucos recursos, em que não são acessíveis soluções antissépticas menos citotóxicas (Grau B). |
Origem das evidências pesquisa e avaliação
Este resumo foi elaborado utilizando os métodos publicados pelo Instituto Joanna Briggs.21-23 O resumo baseia-se numa pesquisa bibliográfica que combina termos de pesquisa relacionados com hipocloritos/EUSOL/solução Dakin's® /solução Milton® e infeção de feridas. As pesquisas foram realizadas no Cumulative Index to Nursing and Allied Health Literature (CINAHL), PubMed®, nas bases de dados do Google Scholar and Health Internetwork Access to Research Initiative (Hinari) e na Biblioteca Cochrane para evidências relacionadas com feridas humanas relatando o uso de preparações tradicionais de hipoclorito publicadas em inglês até Outubro de 2022. Os níveis de evidência para estudos de intervenção encontram-se relatados no Quadro 1.
Quadro 1. Níveis de evidência para estudos clínicos
Antecedentes
Os hipocloritos tradicionais são preparações que se obtêm através de uma reação entre o cloro e um sal alcalino, mais comumente sódio ou cálcio28, 29. Apresentam tipicamente um pH de 7,5 até 11,8,2-5 Os hipocloritos tradicionais comummente utilizados incluem a lixívia doméstica, a solução Dakin® , a Solução de Cal da Universidade de Edimburgo (EUSOL) e a solução Milton®. (N.b., não foram identificadas provas sobre a utilização da solução Milton® para a cicatrização de feridas).
A solução de Dakin® para uso clínico é uma preparação de lixívia diluída a 0,5% de concentração em água destilada. Em alguns relatórios da sua utilização, a solução tradicional de Dakin® é diluída até metade ou até um quarto da sua força, através da sua mistura com água adicional19. A preparação foi desenvolvida em 1915 por Henry Dakin nos campos de guerra em França, para controlar a infeção de feridas e melhorar os resultados clínicos de feridas de balas e de estilhaços28, 30, 31. A investigação de bancada demonstrou que a solução Dakin® tem acção contra uma série de microrganismos e biofilmes, incluindo (mas não limitado a) S. aureus, C. albicans, E. coli, K. pneumoniae e P. aeruginosa6, 8, 9, 17, 25, 27 (Nível 5).
A solução EUSOL é constituída por cal clorada (óxido de cálcio) e por ácido bórico (sais de sódio) a uma concentração de 0,25%2, 24, 32, 33.A solução, que também foi desenvolvida no início dos anos 1900, é tradicionalmente utilizada como agente de desbridamento e para controlar infecções.32, 34
Os hipocloritos tradicionais são instáveis e têm uma vida útil curta.29, 34 Apresentam um pH elevado2-5, o qual está associado a uma cicatrização deficiente das feridas. Tanto a solução de Dakin® 8 de força total (0,5%) como a solução de Dakin® 6 de meia resistência (0,25%), têm sido reportadas como sendo citotóxicos para fibroblastos em estudos de laboratório, originando preocupações de que os hipocloritos tradicionais na sua concentração total possam atrasar a cicatrização das feridas11, 16, 29-31, 34-36. Para fazer face a estas limitações, os hipocloritos são atualmente preparados electroquimicamente para produzirem hipocloritos contemporâneos denominados soluções superoxidadas29, 37. Embora as soluções superoxidadas possuam um prazo de validade mais longo e um pH neutro e pareçam ter um bom perfil de segurança,29, 38 estas não estão universalmente disponíveis. Em locais com poucos recursos disponíveis, os hipocloritos tradicionais ainda são utilizados para tratar a infeção de feridas39, 40.
Evidências clínicas da solução Dakin®
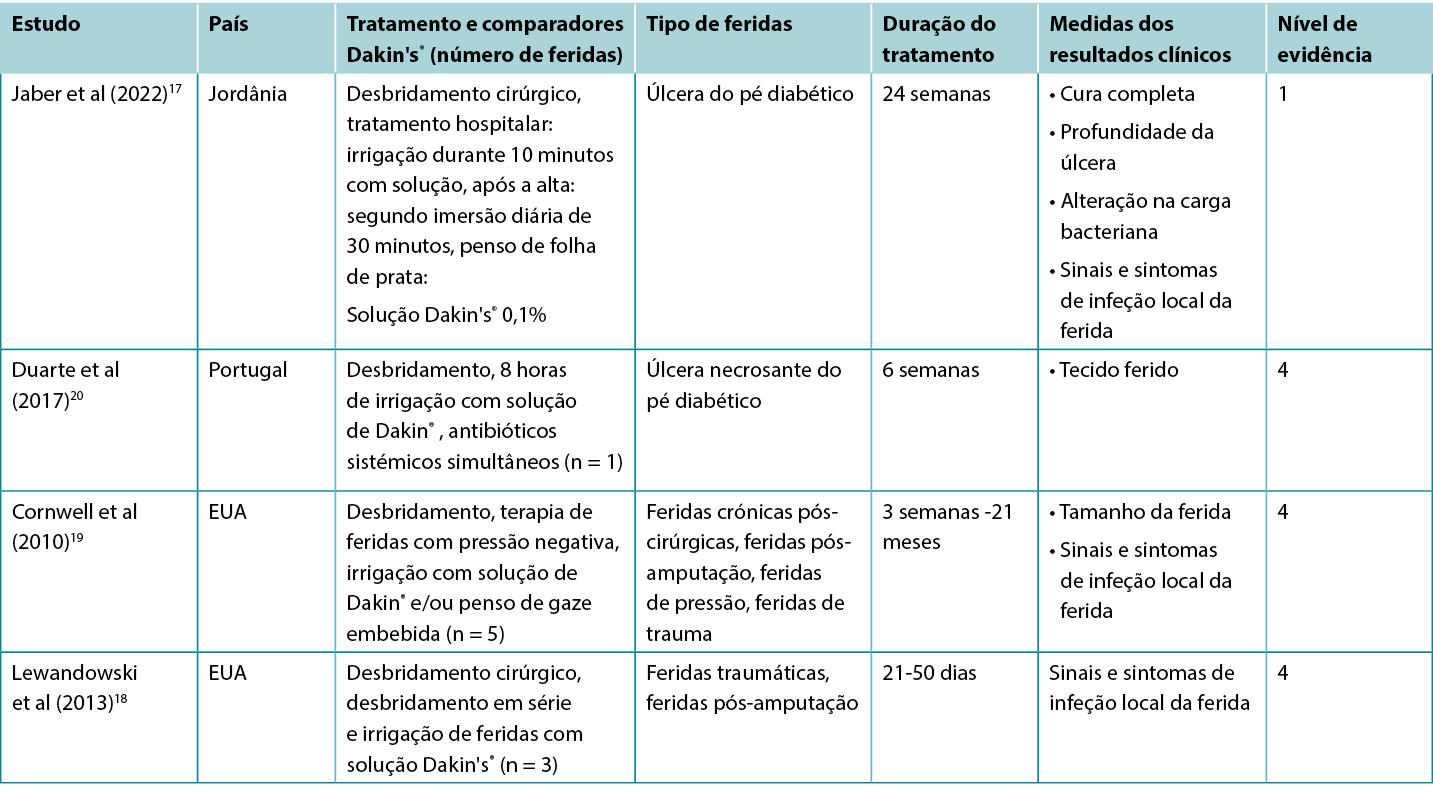
Os estudos que relatam resultados clínicos de interesse para O tratamento com a solução tradicional de Dakin® estão resumidos no Quadro 2.
Quadro 2. Resumo das evidências para a solução de Dakin
A solução Dakin® para promover a cicatrização de feridas
Um RCT17 com elevado risco de enviesamento explorou a utilização da solução Dakin® para o tratamento das úlceras do pé diabético infetado (DFUs). As úlceras foram desbridadas cirurgicamente na admissão e receberam cuidados DFU baseados em evidências conjuntamente com irrigação diária durante 10 minutos com solução de Dakin® diluída a 0,1% de concentração ou com soro fisiológico normal, seguida da aplicação de um penso de folha de prata. O tratamento foi realizado no hospital durante pelo menos cinco dias. Após a alta, os pacientes encarregaram-se de limpar as suas próprias feridas de dois em dois dias, mergulhando o DFU durante 30 minutos na solução atribuída. O tratamento foi aplicado durante pelo menos três meses. Aproximadamente 35% das DFUs tratadas com a solução de Dakin® foram totalmente curadas em comparação com 4% no grupo de controlo (razão de probabilidade 11,9, intervalo de confiança 95% 2,53 - 55,5, p < 0,001)17 (Nível 1).
Solução Dakin® para o tratamento de sinais e de sintomas de infeção de feridas
Na RCT17, comparando a solução de Dakin® com a solução salina normal para DFUs, a análise quantitativa das DFUs tratadas com a solução de Dakin mostrou que as DFUs tratadas com a solução de Dakin tiveram uma redução da carga microbiana de base de 1 ciclo log ou mais após cinco dias (estatisticamente significativa versus controlo, p < 0,001). A infeção de ferida local foi resolvida em mais DFUs tratadas com solução de Dakin® em comparação com a solução salina normal (35,6% versus 4,4%, p = não reportado)17 (Nível 1).
Existem numerosos relatos de casos18-20 de feridas infetadas com várias etiologias que foram tratadas com sucesso com regimes que incluem irrigação regular com a solução de Dakin® . Muitas das feridas foram reportadas como sendo extensas e profundas, com ligamento e osso expostos e/ou tecido necrosante. As feridas foram confirmadas ou suspeitas de serem colonizadas por bactérias anaeróbias20 ou por organismos fúngicos18. Para tratar o odor da ferida19, o exsudado da ferida19 e a viscosidade extensiva18-20 (todos os sinais e sintomas reconhecidos de infeção local da ferida41) as feridas foram desbridadas cirurgicamente e irrigadas regularmente com solução de Dakin® completa, meia ou um quarto de força. Muitos dos regimes também incluíam antibióticos sistémicos, desbridamento cirúrgico em série, terapia de feridas com pressão negativa e enxerto da pele gretada. Os casos relatados alcançaram a resolução dos sinais e dos sintomas de infeção local da ferida, com desenvolvimento de tecido de granulação saudável ou epitelização completa18-20 (Nível 4).
Evidências clínicas sobre a solução EUSOL
Os estudos que relatam os resultados clínicos relevantes para o tratamento com a tradicional solução de Cal de Edimburgo (EUSOL) estão resumidos no Quadro 3.
Quadro 3. Resumo das evidências para a solução EUSOL
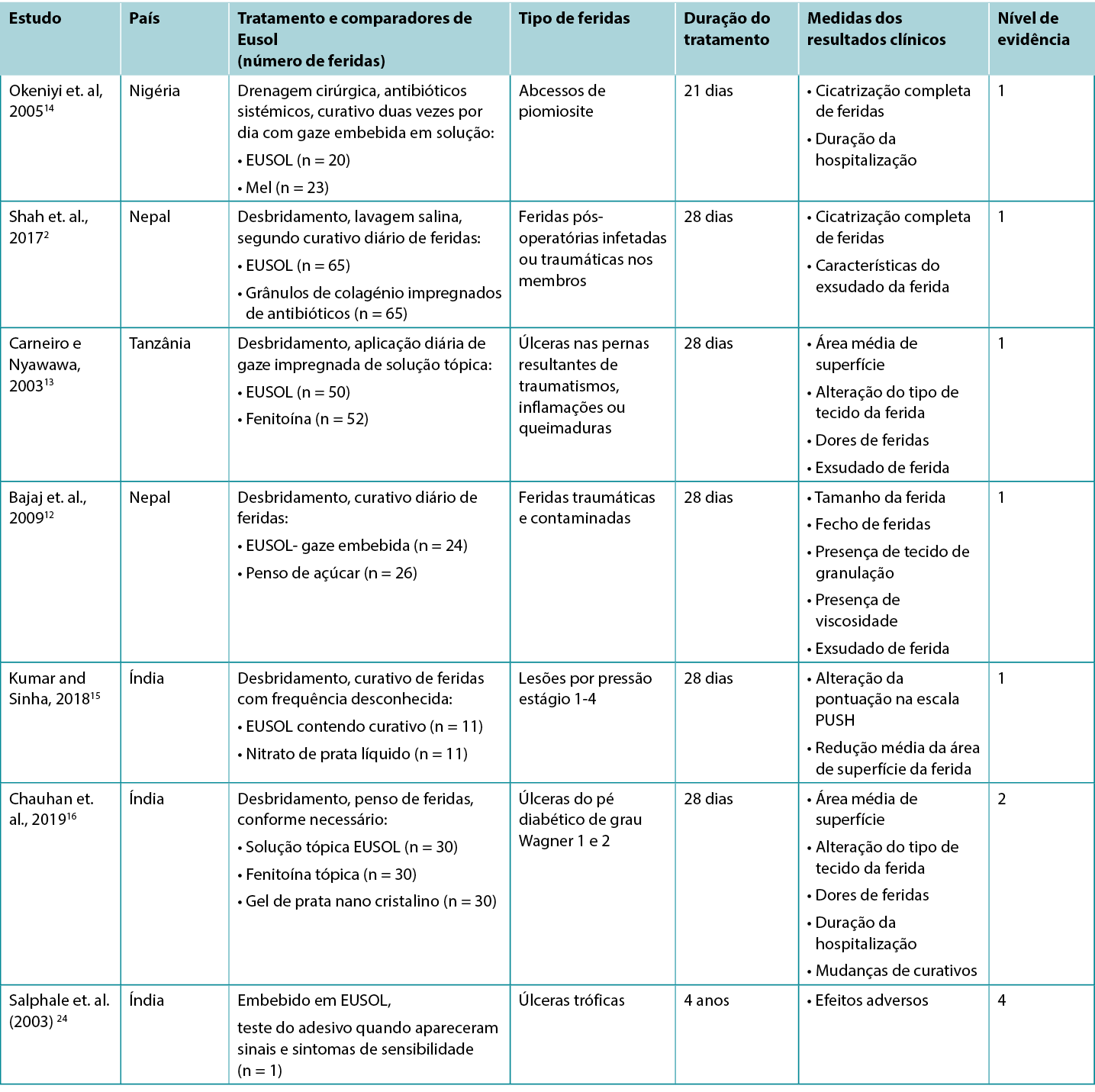
Solução EUSOL para a melhoria da cicatrização de feridas
Cinco estudos de Nível 1 e um estudo de Nível 2 forneceram provas sobre EUSOL para a melhoria da cicatrização de feridas de várias etiologias. No primeiro RCT14 (32 crianças com 43 feridas), que apresentava um risco moderado de enviesamento, as feridas abertas (abcessos de piomiosite excisados cirurgicamente) eram protegidas duas vezes por dia com gaze embebida em EUSOL ou com gaze embebida em mel. Ao final de 3 semanas de seguimento, 55% dos abcessos tratados com EUSOL alcançaram uma cura completa; em comparação com a taxa de cura de 87% no grupo tratado com mel (p < 0,047)14 (Nível 1).
O segundo RCT,2 apresentando um elevado risco de enviesamento, relatou o uso de pensos EUSOL para o tratamento de feridas traumáticas infetadas. Neste estudo, o EUSOL foi comparado com um penso de grânulos de colagénio impregnado com antibióticos. Ao final de 4 semanas de seguimento, 53,8% das feridas tratadas com EUSOL estavam completamente cicatrizadas e as restantes feridas apresentavam um tecido de granulação saudável. Este resultado não foi estatisticamente diferente do grupo tratado com grânulos de colagénio, dos quais 69% cicatrizaram completamente, com os restantes alcançando uma granulação saudável (p = 0,416)2 (Nível 1).
Uma comparação de gaze embebida em EUSOL com pensos de açúcar é relatada num terceiro RCT12 com elevado risco de enviesamento, o qual foi conduzido em feridas traumáticas e contaminadas (n = 50). Após quatro semanas de curativos diários, as feridas tratadas com o penso EUSOL obtiveram resultados superiores aos das feridas tratadas com pensos de açúcar, incluindo a redução do tamanho da ferida (p = 0,0042), a obtenção de granulação (p = 0,0048) e taxa de encerramento da ferida (p = 0,008)12 (Nível 1).
Numa quarta RCT13 com elevado risco de enviesamento, as úlceras crónicas das pernas (n = 102) foram tratadas diariamente com desbridamento seguido da aplicação de EUSOL ou de fenitoína tópica. As úlceras que obtiveram granulação uniforme foram tratadas com enxertos de pele. Durante o período de tratamento de 28 dias, a área de superfície da ferida e a presença de tecido de granulação foram avaliadas semanalmente. As úlceras tratadas com EUSOL apresentaram uma redução média da área de superfície de cerca de 60% em 28 dias; esta melhoria pareceu ter sido inferior ao grupo fenitoína tópica (p = não reportado). Embora 86% das úlceras que receberam EUSOL tenham alcançado granulação saudável em 28 dias, este resultado foi estatisticamente mais pobre do que o grupo da fenitoína13 (Nível 1).
O RCT15 final, que também apresentava um elevado risco de enviesamento, relatou uma comparação de gaze embebida em EUSOL com um líquido tópico de nitrato de prata (0,01% p/v) para tratamento de lesões por pressão (PIs) em pessoas com lesões da medula espinal (n = 22). Os grupos foram comparados quanto à severidade dos PIs no início do estudo. Todos os PIs da Fase 1 cicatrizaram no prazo de duas semanas após o tratamento. Para PIs de Fase 2, as lesões tratadas com EUSOL diminuíram a dimensão da ferida em uma média de 47% após quatro semanas. Para PIs de Fase 3 tratadas com EUSOL, a redução média da área da ferida em 4 semanas foi de 17%, em comparação com uma redução média de dimensão de 26% para o tratamento à base de prata (valores de p = não reportados). Nenhuma PIs de fase 4 cicatrizou durante as 4 semanas de duração do estudo15 (Nível 1).
Num estudo comparativo,16 que apresentava um elevado risco de enviesamento, a solução EUSOL foi comparada com pó de fenitoína e com gel de prata nano cristalino para promover a cura em DFUs de grau Wagner 1 (úlcera superficial) e de grau 2 (úlcera profunda). As DFUs foram desbridadas cirurgicamente conforme necessário e tratadas por até quatro semanas com o tratamento tópico atribuído. Ao final de 4 semanas de seguimento, 73,33% das DFUs tratadas com solução EUSOL apresentavam tecido de granulação no leito da ferida (p > 0,05). No início do estudo, o tamanho médio da úlcera no grupo tratado com EUSOL era de 16,66 cm2 ± 7,52 cm2, reduzindo para uma média de 7,7 cm2 ± 6,65 cm2 ao final de quatro semanas, o que pode ser clinicamente significativo para os pacientes. No entanto, as DFUs tratadas com EUSOL obtiveram resultados estatisticamente significativamente inferiores em comparação com aquelas tratadas com pó de fenitoína ou com gel de prata nanocristalino16 (Nível 2).
Solução EUSOL para reduzir os sinais e os sintomas de infeção de feridas
Quatro dos estudos acima mencionados2, 12, 13, 16 relataram redução dos sinais e dos sintomas que estão associados à infeção local da ferida, incluindo dor associada à ferida, exsudado da ferida e uma superfície da ferida com viscosidade.41
Na segunda semana de tratamento do estudo que compara o EUSOL à fenitoína tópica, as pessoas com úlceras tratadas com EUSOL relataram redução da dor intensa associada à ferida e melhoria do exsudado da ferida13. Embora o grupo fenitoína tópica tivesse apresentado resultados superiores na segunda semana, não existiu diferença estatisticamente significativa ao final de 28 dias No estudo que comparou os pensos EUSOL com os pensos de açúcar, após quatro semanas menos feridas tratadas com EUSOL apresentavam uma superfície de ferida viscosa com um declive (p = 0,0034) e nível de exsudado (p = 0,011).12 As feridas infetadas que foram tratadas com EUSOL no RCT por Shah et. al. (2017) 2 mostrou uma melhoria nas características do exsudado da ferida até à quarta semana de tratamento e isso não foi significativamente diferente (p = 0,24) do perfil do exsudado no grupo do colagénio granulado impregnado de antibióticos2 (Nível 1).
No estudo realizado em DFUs,16 a solução EUSOL foi associada a uma ligeira redução da dor após quatro semanas de tratamento (redução média da pontuação de dor de 1,87 ± 1,57 numa escala analógica visual de cinco pontos). Era pouco provável que este resultado fosse clinicamente significativo.16 (Nível 2).
Considerações de utilização
Efeitos adversos reportados com hipocloritos tradicionais
- Em casos raros foi observada sensibilidade de contacto aos hipocloritos tradicionais24 (Nível 4).
- Embora a irritação cutânea,34 as dores ligeiras na aplicação9 e queimaduras químicas com a utilização da solução em concentrações inadequadas16 tenham sido associadas aos hipocloritos tradicionais, esses eventos adversos não foram observados nos estudos relatados neste resumo de evidências.
Preparação de soluções em contextos de recursos limitados
- Uma solução 0,5% de Dakin® pode ser preparada utilizando 25 ml de lixívia doméstica misturada com 2 colheres de chá de bicarbonato de sódio (bicarbonato de sódio/soda) em 1 L de água limpa40. A solução tem um prazo de validade curto,28, 29 e a investigação de bancada sugeriu que a solução pode fornecer um efeito antibacteriano inadequado no prazo de 24 horas após a sua preparação9. Portanto, a solução deve ser preparada a cada 24 horas40.
- Uma solução EUSOL pode ser preparada com 12,5 g de hipoclorito de sódio (pó branqueador) e com 12,5 g de ácido bórico, combinados em 1 L de água limpa e morna. A solução tem um prazo de validade curto, pelo que se recomenda que seja preparada imediatamente antes da sua utilização2, 24, 32, 33.
Conflito de interesses
Em conformidade com as normas do Comité Internacional de Editores de Revistas Médicas (ICMJE), os autores declaram não existirem conflitos de interesse.
Sobre os resumos de evidências da WHAM
Os resumos de evidências da WHAM são consistentes com a metodologia publicada em Munn Z, Lockwood C, Moola S. O desenvolvimento e utilização de resumos de provas para sistemas de informação em pontos de atendimento: Uma abordagem simplificada de revisão rápida, Worldviews Evid Based Nurs. 2015;12(3):131-8.
Os métodos estão descritos nos recursos publicados pelo Instituto Joanna Briggs21-23 e na página web do WHAM Collaborative: http://WHAMwounds.com. Os resumos de evidências do WHAM passam por uma revisão por pares por um Grupo de Referência de Especialistas multidisciplinar e internacional. Os resumos de evidências da WHAM fornecem um resumo das melhores provas disponíveis sobre tópicos específicos e apresentam sugestões que podem ser utilizadas para informar a prática clínica. As evidências contidas neste resumo devem ser avaliadas por profissionais devidamente formados e com conhecimentos especializados na prevenção e gestão de feridas e as provas devem ser consideradas no contexto do indivíduo e do profissional, do ambiente clínico e de outras informações clínicas relevantes.
Copyright © 2023 Wound Healing and Management Collaborative, Curtin Health Innovations Research Institute, Curtin University
Author(s)
Emily Haesler
PhD P Grad Dip Adv Nurs (Gerontics), BN, FWA
Adjunct Professor, Curtin University, Curtin Health Innovation Research Institute, Wound Healing and Management (WHAM) Collaborative
Keryln Carville
RN PhD STN(Cred) CF FWA
Professor, Silver Chain Group and Curtin University, Curtin Health Innovation Research Institute, Wound Healing and Management (WHAM) Collaborative
References
- Broughton G, Burris D. War and medicine: A brief history of the military’s contribution to wound care through World War I. Adv Wound Care, 2010;1:3-7.
- Shah AB, Maharjan R, Shrestha BP, Chaudhary P. A randomized controlled trial comparing EUSOL versus antibiotic loaded collagen granules as dressing agents in the management of traumatic infected wounds. Int J Orthop Sci 2017;3(2):157-162. DOI: 10.22271/ortho.2017.v3.i2c.24
- Alpha Medical Solutions. 2018. Milton® Anti-bacterial solution. Available from: https://www.alphamedicalsolutions.com.au/content/Milton-Anti-Bacterial-Solution-MSDS-Feb-2019.pdf. [Accessed Jan 2023].
- Ataman Chemicals. 2020. Sodium hypochlorite. Available from: https://www.atamanchemicals.com/sodium-hypochlorite_u24324/. [Accessed Jan 2023].
- Black J. Ten top tips: Wound irrigation. Wounds Int, 2022;13(2):2-4.
- Heggers J, Sazy J, Stenberg B, Strock L, McCauley R, Hernom D, Robson M. Bacterial and wound healing properties of sodium hypochlorite solutions: The 1991 Lindberg Award. J Burn Care Rehabil, 1991;12(5):420-4.
- Lessing M, McNulty A. Intermittent exposure to wound irrigation solutions disrupts P. aeruginosa and S. aureus immature biofilms in vitro. Wound Rep Reg Conf: 22nd Annual Meeting of the Wound Healing Society, 2012;20(2):A28.
- Lineaweaver W, McMorris S, Soucy D, Howard R. Cellular and bacterial toxicities of topical antimicrobials. Plast Reconstr Surg, 1985;75(3):394-6.
- Cotter J, Fader R, Lilley C, Herndon D. Chemical parameters, antimicrobial activities, and tissue toxicity of 0.1 and 0.5% sodium hypochlorite solutions. Antimicrob Agents Chemother, 1985;28(1):118-22.
- Wilson J, Mills J, Prather I, Dimitrijevich S. A toxicity index of skin and wound cleansers used on in vitro fibroblasts and keratinocytes. Adv Skin Wound Care, 2005;18(7):373-8.
- Bennett L, Rosenblum R, Perlov C, Davidson J, Barton R, Nanney L. An in vivo comparison of topical agents on wound repair. Plast Reconstr Surg, 2001;108(3):675-68.
- Bajaj G, Karn N, Shrestha B, Kumar P, Singh M. A randomised controlled trial comparing eusol and sugar as dressing agents in the treatment of traumatic wounds. Tropical Doctor, 2009;39(1):1-3.
- Carneiro P, Nyawawa E. Topical phenytoin versus EUSOL in the treatment of non-malignant chronic leg ulcers. East Afr Med J, 2003;80(3):124-9.
- Okeniyi J, Olubanjo O, Ogunlesi T, Oyelami O. Comparison of healing of incised abscess wounds with honey and EUSOL dressing. JACM, 2005;11(3):511-3.
- Kumar A, Sinha VK. Comparative study of EUSOL and Silverstream in healing of pressure sore in traumatic spinal cord injury patients. Int J Orthop Sci 2018;4(1):228-234. DOI: 10.22271/ortho.2018.v4.i1d.33
- Chauhan A, Patel BK, Sharma PP, Mehta FS. A prospective, randomized, controlled study For efficacy of phenytoin sodium powder, Eusol solution, nanocrystalline silver gel in diabetic foot ulcer. International Journal of Contemporary Surgery, 2019;7(2):1-7.
- Jaber D, Younes N, Khalil E, Albsoul-Younes A, Mismar A, Nassar M, Al-Bakri A. Effect of diluted Dakin’s solution versus standard care on diabetic foot ulcer management: A randomized controlled trial. J Am Pod Med Assoc, 2022;112(1):1-11.
- Lewandowski L, Purcell R, Fleming M, Gordon WT. The Use of Dilute Dakin’s Solution for the Treatment of Angioinvasive Fungal Infection in the Combat Wounded: A Case Series. Military Medicine, 2013;178(4):e503-e7.
- Cornwell P, Arnold-Long M, Barss S, Varnado M. The use of Dakin’s solution in chronic wounds: a clinical perspective case series. J Wound Ostomy Continence Nurs, 2010;37(1):94-104.
- Duarte B, Cabete J, Formiga A, Neves J. Dakin’s solution: is there a place for it in the 21st century? Int Wound J, 2017;14(6):918-20.
- Aromataris E, Munn Z, editors. Joanna Briggs Institute Reviewer’s Manual. https://reviewersmanual.joannabriggs.org/, Joanna Briggs Institute; 2017.
- Joanna Briggs Institute Levels of Evidence and Grades of Recommendation Working Party. New JBI Grades of Recommendation. Adelaide: Joanna Briggs Institute; 2013.
- The Joanna Briggs Institute Levels of Evidence and Grades of Recommendation Working Party. Supporting Document for the Joanna Briggs Institute Levels of Evidence and Grades of Recommendation. www.joannabriggs.org: Joanna Briggs Institute; 2014.
- Salphale P, Shenoi S. Contact sensitivity to calcium hypochlorite. Contact Derm, 2003;48(3):162.
- Doughty D. A rational approach to the use of topical antiseptics. J Wound Ostomy Cont Nurs, 1994;21(6):224-31.
- Barrigah-Benissan K, Ory J, Dunyach-Remy C, Pouget C, Lavigne JP, Sotto A. Antibiofilm properties of antiseptic agents used on Pseudomonas aeruginosa isolated from diabetic foot ulcers. Int J Mol Si, 2022;23(19).
- Huang C, Tao S, Yuan J, Li X. Effect of sodium hypochlorite on biofilm of Klebsiella pneumoniae with different drug resistance. Am J Infect Control, 2022;50(8):922-8.
- Levine JM. Dakin’s Solution: Past, Present, and Future. Adv Skin Wound Care, 2013;26(9):410-4.
- Serena T, Serena L, Al-Jalodi O, Patel K, Breisinger K. The efficacy of sodium hypochlorite antiseptic: a double-blind, randomised controlled pilot study. J Wound Care, 2022;31(2):S32-S5.
- Georgiadis J, Nascimento VB, Donat C, Okereke I, Shoja MM. Dakin’s Solution: “One of the most important and far-reaching contributions to the armamentarium of the surgeons”. Burns, 2019;45(7):1509-17.
- Ueno CM, Mullens CL, Luh JH, Wooden WA. Historical review of Dakin’s solution applications. J Plast Reconstr Aesthet Surg, 2018;71(9):e49-e55.
- Shah A. Exposure - Eusol treatment for burn wounds. Burns Incl Therm Inj, 1985;11:297-300.
- Leaper D. Eusol: Still awaiting proper clinical trials. BMJ, 1992;304(6832):930.
- Catlin L. The use of hypochlorite solutions in wound management. BJN, 1992;1(5):226-9.
- Duarte B, Formiga A, Neves J. Dakin’s solution in the treatment of severe diabetic foot infections. Int Wound J, 2020;17:277-84.
- Farrow S, Toth B. The place of Eusol in wound management. Nurs Stand, 1991;5(22):25-7.
- Eftekharizadeh F, Dehnavieh R, Noori Hekmat S, Mehrolhassani MH. Health technology assessment on super oxidized water for treatment of chronic wounds. Med J Islam Repub Iran, 2016;30:384.
- Haesler E. Evidence Summary: Super-oxidised solutions for chronic wounds. Wound Practice and Research, 2020;28(3):145-7.
- Benskin LL. A review of the literature informing affordable, available wound management choices for rural areas of tropical developing countries. Ostomy Wound Manage, 2013. Oct;59(10):20-41.
- Ottesen TD, Qudsi RA, Kahanu AK, Baptiste BJ, Woolley PM, Socci AR, Dyer GSM. The Continued Utility and Viability of Dakin’s Solution in Both High- and Low-resource Settings. Arch Bone Jt Surg, 2020. Mar;8(2):198-203.
- International Wound Infection Institute (IWII). Wound Infection in Clinical Practice. Wounds International; 2022.




