Volume 44 Number 2
Atopic Dermatitis: clinical aspects and treatments
Ryan S Q Geng, R Gary Sibbald
Keywords eczema, risk factors, atopic dermatitis, anti-inflammatory therapies, biologics, lesions, phototherapy, trials
For referencing Geng RSQ, Sibbald RG. Atopic Dermatitis: clinical aspects and treatments. WCET® Journal 2024;44(2):29-36
DOI 10.33235/wcet.44.2.29-36
Abstract
Atopic Dermatitis is the most common eczematous inflammatory skin condition, presenting with lesions that typically appear as poorly demarcated erythematous and scaly papules and plaques. The lesions most commonly occur on flexural surfaces of the knees, elbows, and wrists and are associated with moderate to severe itching. This article focuses on the clinical presentation of atopic dermatitis and treatment options. Other related topics include epidemiology, pathogenesis, risk factors, triggers, and differential diagnoses.
Introduction
Atopic dermatitis (AD), or atopic eczema, is the most common eczematous inflammatory skin condition, with a lifetime prevalence of 15%.1 Although patients of all ages can be affected, onset peaks in infancy, with 90% of cases occurring before 5 years of age.2 Notably, the prevalence of AD has increased two- to threefold over the past 3 decades.3
The pathogenesis of AD is multifactorial and involves a complex interplay between the skin barrier, genetic factors, and environmental exposures. Skin barrier dysfunction can be characterised by increased transepidermal water loss, increased skin pH, or decreased levels of ceramides, humectants, and structural proteins. Other challenges to skin barrier function include aberrant filaggrin (FLG; a protein that binds keratin fibers in epidermis) expression or excess soap usage, which can also increase skin permeability.4 As mast cells and basophils become sensitised to environmental antigens, type I immunoglobulin E-mediated hypersensitivity reaction, cytokine release, and inflammation are triggered, often resulting in intense itching. Scratching of the lesions results in further damage to the skin barrier, referred to as the itch-scratch cycle. Chronically, this can lead to worsening inflammation and lichenification.5
With the physical discomfort and cosmetic appearance of AD lesions, patients can experience significant psychosocial challenges, including social distress, embarrassment, and activity limitation.6 Given the potential impact on quality of life and increasing incidence, this review will focus on the clinical features of AD and available treatment options.
Risk Factors
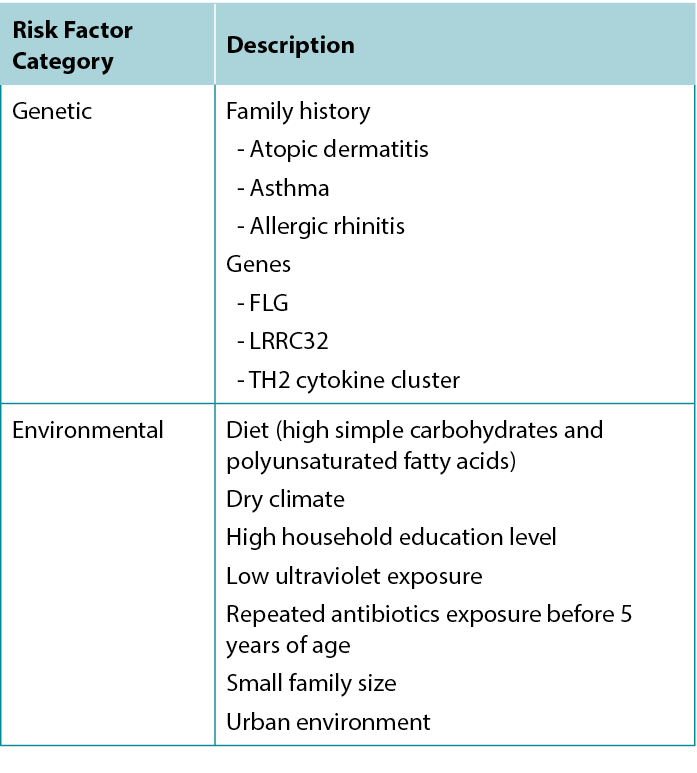
Atopic dermatitis is part of the atopic triad consisting of AD, asthma, and allergic rhinitis. There are several risk factors for developing AD, with the strongest predictor being a positive family history for any atopic disease, especially AD. The implicated genes include FLG, TH2 cytokine cluster, and LRRC32 (which encodes glycoprotein A repetitions predominant).7
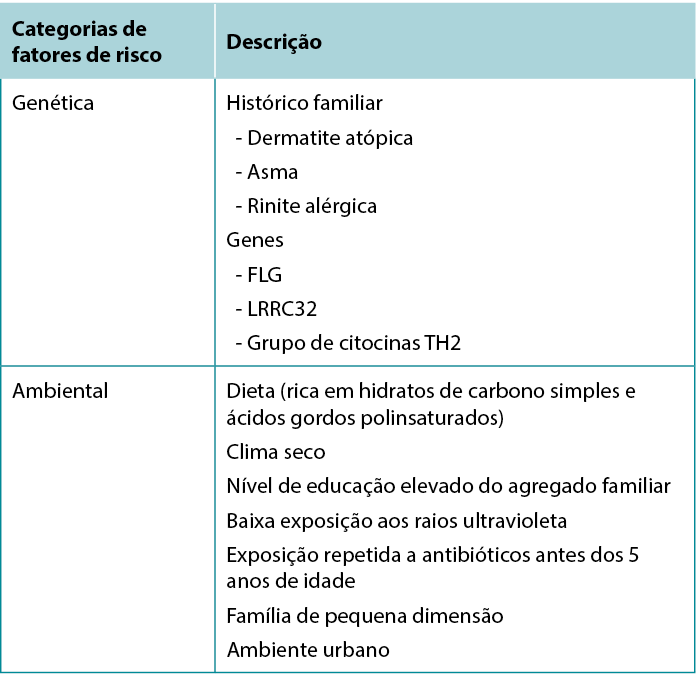
Environmental risk factors have also been identified: Living in an urban environment, dry climate, low UV light exposure, and a diet high in simple carbohydrates and polyunsaturated fatty acids are all associated with increased risk of AD.7 Table 1 summarises risk factors associated with AD.
Table 1 Factors associated with increased risk of developing Atopic Dermatitis.
Clinical classifications
Although the clinical presentation of AD is heterogeneous with various features and symptoms, lesions are typically characterised as poorly demarcated, scaly, and erythematous papules that coalesce into plaques with severe itching that are most commonly found on flexural surfaces of knees, elbows, and wrists. The clinical features of AD are outlined in Table 2, with the essential, major, and minor features being indicated based on American Academy of Dermatology guidelines.2 Because of the wide variation in clinical presentation of AD, there is a broad differential, outlined in Table 3. Classification of AD is based on biomarker serology (IgE), acuity of presentation, and age at onset. Clinical presentations of AD are provided in Figure 1.
Table 2 Features and symptoms of AD.
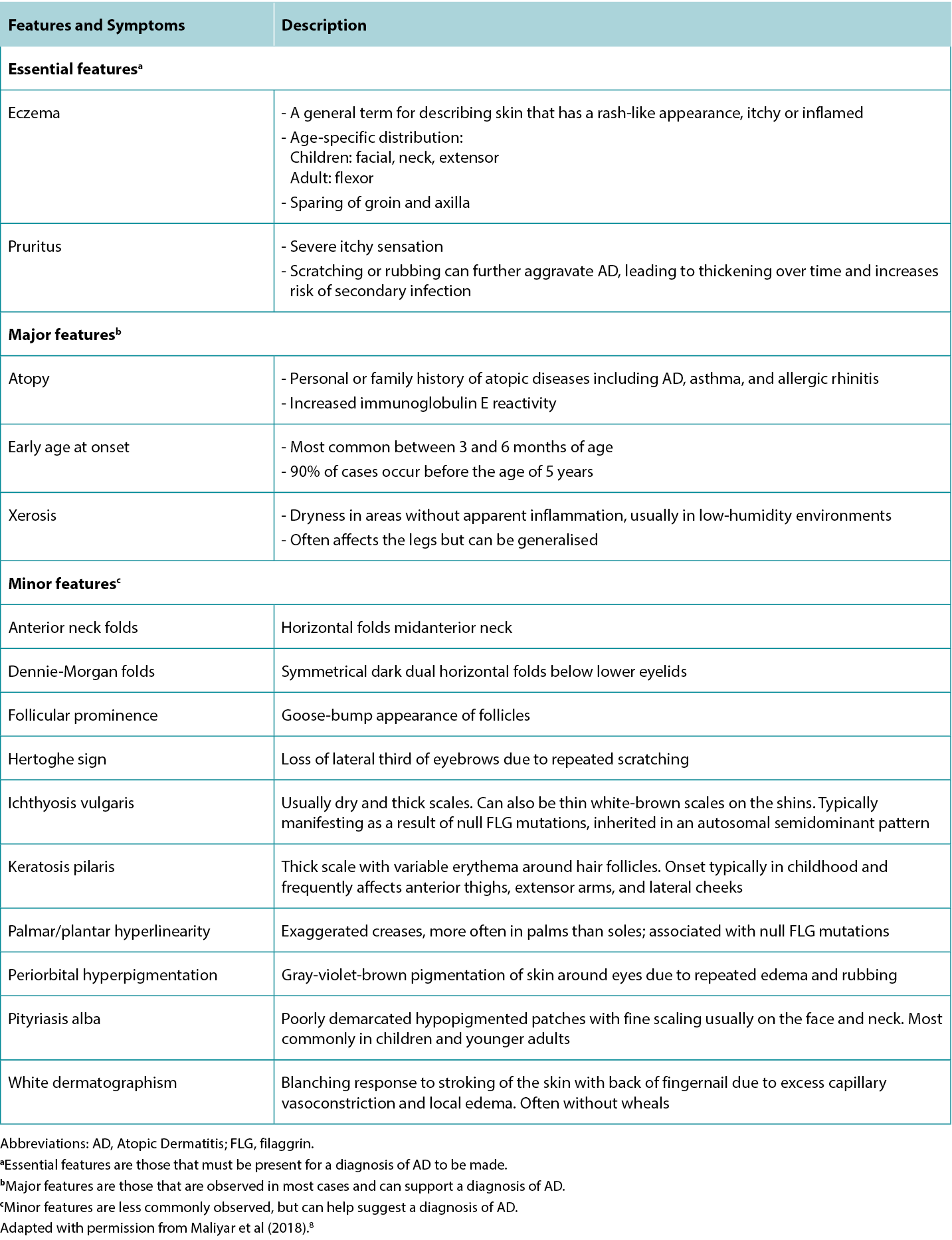
Table 3 Differential diagnoses of Atopic Dermatitis and distinguishing features.

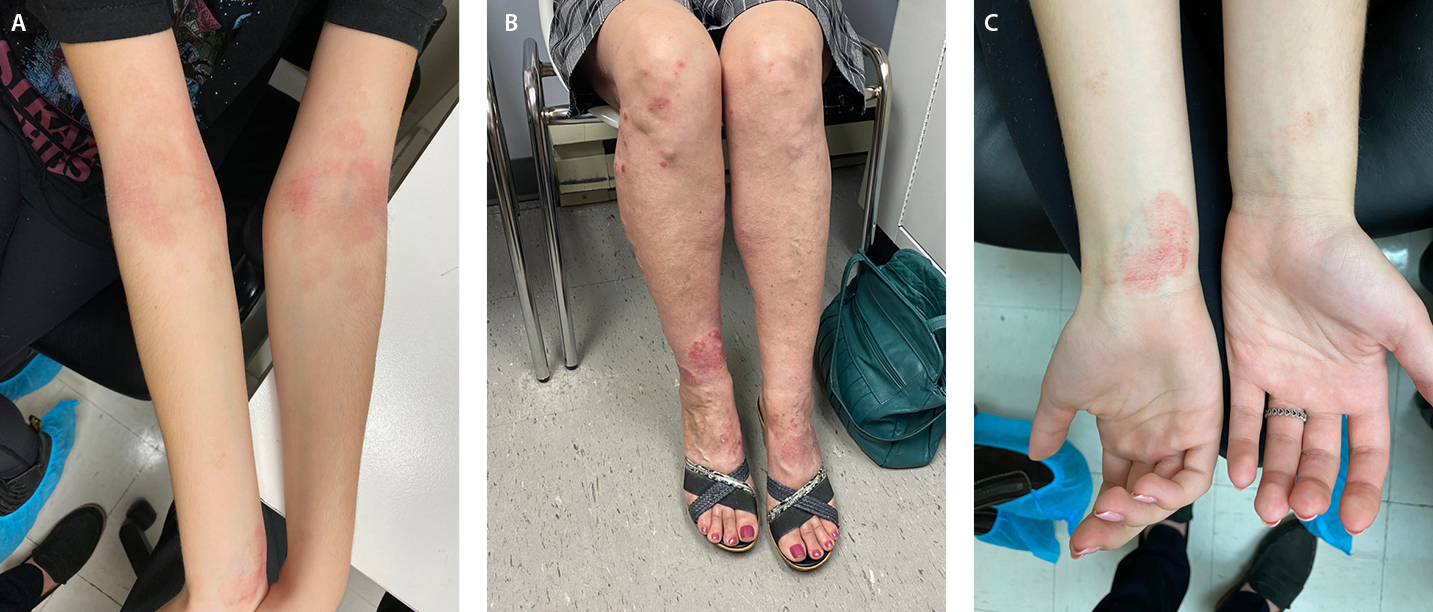
Figure 1 Clinical presentations of Atopic Dermatitis
A, Poorly demarcated erythematous plaques with fine scale on flexural aspect of the elbow. B, Well-demarcated erythematous plaques distributed on the dorsal aspect of the feet, ankle, and below the knee. C, Poorly demarcated erythematous patch on the flexural aspect of the wrist.
Classification by Serum IgE Levels
Extrinsic. The extrinsic subtype is characterised by elevated total IgE levels (>200 kU/L) in response to specific protein allergens, typically from the Dermatophagoides genus of mites, including Dermatophagoides pteronyssinus and Dermatophagoides farina. The main elevated cytokines include interleukin 4 (IL-4), IL-5, and IL-13, characteristic of a TH2 response. The extrinsic subtype arises from impaired skin barrier function, with 20% to 30% of patients having pathogenic FLG variants, and is much more common than the intrinsic subtype.9
Intrinsic. The intrinsic subtype is characterised by normal total IgE levels (<200 kU/L) and shows a sexual predilection toward women. The main elevated cytokine is interferon γ, characteristic of a TH1 response. Although the skin barrier is intact in the intrinsic subtype, metals and haptens can still penetrate the skin and trigger a response.9
Classification by Acuity of Presentation
Individual lesions of AD can be classified based on the acuity of presentation into acute, subacute, or chronic categories. An individual with AD may present with a combination of lesions in any of these different stages.
Acute. Acute lesions appear as poorly demarcated erythematous papulovesicular papules and plaque eruptions with blistering, weeping, and/or crusting. Widespread edema may also be present, with or without scales. Scratching can lead to erosions and pustules that are susceptible to secondary infection, primarily with Staphylococcus aureus.10
Subacute. Subacute lesions appear as poorly demarcated erythematous scaly plaques and papules.10
Chronic. Chronic lesions can involve lichenification (thickening of skin with increased visibility of skin markings) due to repeated scratching over time and scale.10
Classification by Age at Onset
Infantile (2 weeks to 2 years of age). Infantile-onset AD typically presents with lesions characterised as itchy papules and vesicles with associated serous exudate and/or crusting, most commonly affecting the head and neck. Lesions usually first appear as erythema and scaling on the cheeks, which then extend to the forehead, scalp, and neck. Extensor surfaces are also often involved as a result of trauma from crawling. Over time, scratching and rubbing can result in crusting and lichenification (thickening and increased skin surface markings).8
Childhood (2 years of age through puberty). In childhood-onset AD, facial involvement is less prominent, and instead the feet, ankles, wrists, and the flexural aspect of the knees and elbows are more commonly involved. Lesions are typically dry with lichenified plaques, papules, erosions (breakdown of epidermis with epidermal base), and/or crusts.8
Adult (postpuberty). Similar to childhood-onset AD, adult-onset AD primarily involves flexural regions, but also more commonly affects the face and neck. Lesions typically present as symmetrical, dry, scaly plaques, and papules. Excoriations and lichenification are commonly observed, whereas crusting and exudation are less frequent.8
Severity scoring
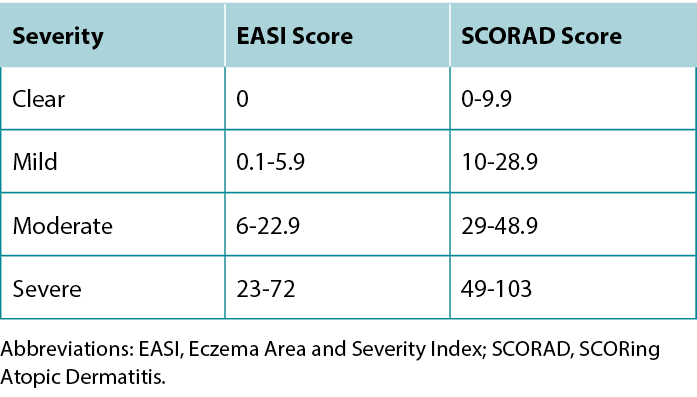
Once a diagnosis of AD has been achieved, describing the severity of the disease can guide treatment selection. The most commonly used severity scoring tools are the Eczema Area and Severity Index (EASI) and SCORing Atopic Dermatitis (SCORAD). Although both tools include the extent of erythema, swelling, excoriation, lichenification, and body area affected, the SCORAD also considers subjective patient measures.11 A summary of the severity grading strata for EASI and SCORAD is provided in Table 4.
Table 4 EASI and SCORAD severity grading strata.
AD treatments
Several treatment options are available for treating AD lesions to provide symptomatic relief for patients and break the itch-scratch cycle to prevent disease progression and development of secondary infection. Counsel patients to regularly use moisturisers with emollients, humectants, and occlusive agents to improve the skin barrier, provide some itch relief, and prevent future flares.12 Patients with AD should avoid products with fragrances to minimise potential exposure to allergens. Discuss the importance of identifying and avoiding factors that trigger or exacerbate AD lesions.13 A list of common trigger factors is provided in Table 5, and a summary of treatment options for AD is provided in Table 6.
Table 5 Triggers and exacerbating factors of Atopic Dermatitis.

Table 6 Treatment options for Atopic Dermatitis.
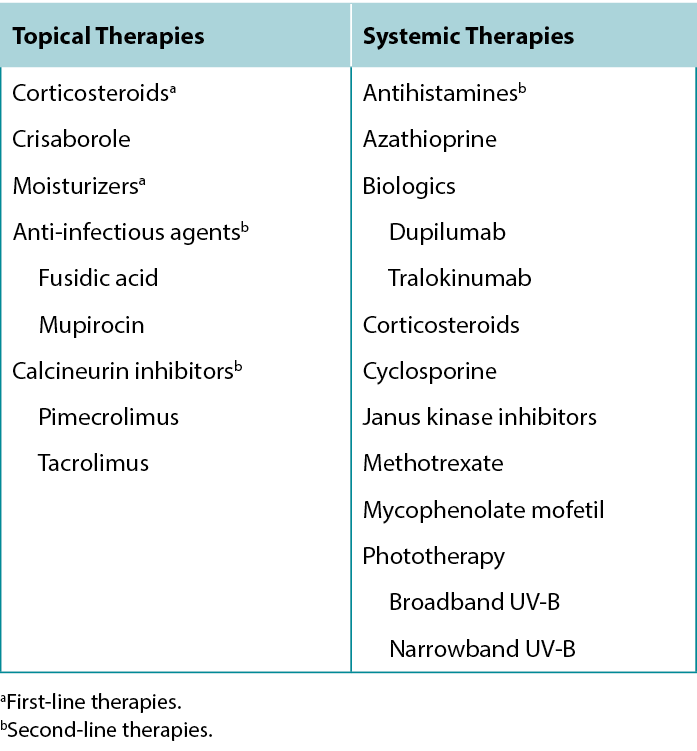
Pharmaceutical Topical Treatments
Topical moisturisers. Regular usage of moisturisers is the cornerstone of AD therapy. Moisturisers can contain a combination of humectants, occlusives, and emollients that help protect the skin barrier. Humectants are hydrophilic substances that hold onto water, occlusives are hydrophobic substances that form a physical layer over the skin to trap water below, and emollients fill spaces between dead skin cells to soften the skin.
In addition to helping patients manage dryness and itchiness of active AD lesions, moisturisers can also prolong relapse. In a trial involving 44 patients with AD lesions cleared by betamethasone 0.1% cream, those who applied an urea-containing moisturising cream as the sole maintenance therapy relapsed after more than 180 days on average, compared with 30 days for patients who did not use any maintenance therapy.14
Topical corticosteroids. Corticosteroids have anti-inflammatory properties that are used for treating acute flares and itchiness. In a trial involving 40 patients, those treated with mometasone furoate 0.1% cream nightly for 4 weeks achieved a 77% reduction in SCORAD score compared with 17% for Vaseline control (P < .001).15 Corticosteroids are classified by their potency, and choice of corticosteroid should be guided by the patient’s age, region of the body affected, and severity of disease. Generally, low-potency corticosteroids are used for milder disease, younger patients, and in areas involving the face and folds (intertriginous regions).8 Long-term topical corticosteroid use is associated with further decreased skin-barrier function, skin atrophy, telangiectasia, and purpura and can induce or aggravate rosacea and perioral dermatitis. As such, corticosteroids are only recommended for short-term treatment of flares and symptom management. Intradermal corticosteroid injections can also be provided to provide fast-acting relief for acute flares.
Topical calcineurin inhibitors (tacrolimus and pimecrolimus). Tacrolimus and pimecrolimus are calcineurin inhibitors with anti-inflammatory properties and skin barrier-preserving properties used in treating AD. In one trial, 49 patients who applied tacrolimus 0.1% ointment twice daily for up to 22 days achieved 72% reduction in EASI score compared with 26% for vehicle (P < .001).16 Unlike corticosteroids, long-term tacrolimus or pimecrolimus use is not associated with skin atrophy; they can be used to reduce corticosteroid load or for maintenance.17 Patients may experience burning or stinging upon application, but cooling the product in the refrigerator prior to application can alleviate this sensation.
Topical phosphodiesterase-4 inhibitors (crisaborole). Crisaborole is a phosphodiesterase-4 inhibitor with efficacy in treating AD through downregulating the production of proinflammatory cytokines. In one study involving 400 patients, those treated with crisaborole 2% ointment twice daily for 4 weeks achieved a mean reduction of 60% in EASI score compared with 43% for vehicle (P = .0002).18 Crisaborole is generally well tolerated and is another steroid-sparing option for treating AD.
Topical anti-infectious agents. Anti-infectious agents are typically used as adjunctive therapies in cases where there is accompanying infection or if it is believed that a microbial factor (eg, S aureus) is aggravating the AD.
Fusidic acid and mupirocin are antibiotics used for targeting staphylococcal and streptococcal bacteria and can be effective in treating AD if S aureus colonisation is a contributing pathogenesis factor. In one trial involving 239 patients, those treated with fusidic acid 2% plus hydrocortisone 1% cream showed significant improvements in factors including erythema, itching, and scaling compared with patients treated with fusidic acid 2% cream or hydrocortisone 1% cream alone (P = .009).19
Soaking with bleach (sodium hypochlorite) is another option for reducing colonisation by S aureus. Patients can mix a quarter to a half cup of 6% bleach solution with a bathtub full of water and soak for 5 to 10 minutes.
Systemic Pharmaceutical Treatments
Corticosteroids. Although corticosteroids can be taken orally, this is often not recommended due to rebound flares on cessation and adverse effects associated with systemic corticosteroid use (eg, weight gain, diabetes, muscle loss, gastrointestinal bleeds, etc). However, systemic corticosteroids may have benefits for treating severe acute flares.20
Calcineurin inhibitors (cyclosporine). Cyclosporine is a calcineurin inhibitor with anti-inflammatory properties that is useful in treating severe or recalcitrant forms of AD that have failed to respond to topic therapy. In one trial involving 46 patients, those who were treated with cyclosporine 5 mg/kg per day for 6 weeks achieved a mean 55% improvement in total body severity assessment score; in contrast, those with placebo worsened by 4% (P = .0002).21 Although cyclosporine offers rapid relief, its effects are not long-lasting, and maintenance therapy is required to prevent relapse.22 Renal impairment is a concern for initiating cyclosporine treatment and must be carefully monitored.
Purine analogs (azathioprine). Azathioprine is a corticosteroid-sparing immunosuppressant used in several inflammatory skin diseases including AD. In a trial involving 37 patients, those treated with azathioprine 2.5 mg/kg per day for 12 weeks reported a mean 26% improvement on factors including erythema, dryness, and lichenification compared with 3% for placebo (P < .01).23 Although azathioprine has similar indications for usage in treating AD as cyclosporine, it is less preferred for acute flares because it does not act as fast. Hepatotoxicity is a concern for initiating azathioprine treatment.
Folic acid inhibitors (methotrexate). Methotrexate has immunosuppressive properties and can be used in low doses to suppress AD symptoms and flares in moderate to severe cases. In a study involving 40 patients, methotrexate was as effective as cyclosporine.24 Patients treated with methotrexate 7.5 mg/wk achieved a mean reduction of 26 SCORAD points compared with a 25-point reduction for those treated with cyclosporine 2.5 mg/kg per day (P = .93).24 Similar to azathioprine, hepatotoxicity should be considered.
Inosine monophosphate dehydrogenase inhibitors (mycophenolate mofetil). Mycophenolate mofetil is another immunosuppressant with efficacy in treating AD. In a pilot study, 10 patients treated with 2 g/d for 4 weeks followed by 1 g/d for 4 weeks achieved a 55% decrease in SCORAD score (P < .01).25 Mycophenolate does not act as fast as corticosteroids or cyclosporine, but it can achieve satisfactory clinical control with fewer adverse effects and be used for maintenance therapy.
Biologics. Currently, the only approved biologics for treating AD are dupilumab and tralokinumab, both of which target the IL-13 signalling pathway. However, many other biologics are in development.
Dupilumab. Dupilumab is an IL-4/IL-13 inhibitor used in treating moderate to severe cases of AD that are recalcitrant to other topical and systemic therapies. In a trial with 671 patients, 38% of patients treated with dupilumab 300 mg subcutaneously every 2 weeks and 37% of those treated weekly for 16 weeks achieved clear or almost clear on the Investigator’s Global Assessment scale compared with 10% for placebo (P < .001).26 Dupilumab greatly improves inflammation and itchiness without dose-limiting toxicity but is an expensive treatment.
Tralokinumab. Tralokinumab is an IL-13 inhibitor with similar indications for use as dupilumab. In a trial with 802 patients, 25% of those treated with tralokinumab 300 mg subcutaneously every 2 weeks for 16 weeks achieved EASI 75 compared with 13% of patients in the control group (P < .001).27 Whereas both tralokinumab and dupilumab are effective, tralokinumab is associated with a lower risk of conjunctivitis.
Janus kinase inhibitors. Janus kinase (JAK) inhibitors are small-molecule inhibitors that target the JAK signalling pathway, which is associated with several proinflammatory cytokines. In a trial involving 560 patients, 80% of those treated with upadacitinib 30 mg daily for 16 weeks achieved EASI 75 compared with 16% for placebo (P < .0001).28 In addition to offering high-target specificity like the biologics, JAK inhibitors can be applied topically (tofacitinib, ruxolitinib, delgocitinib) or taken orally (tofacitinib, baricitinib, abrocitinib, upadacitinib), offering a simpler route of administration.
Currently, three JAK inhibitors have been approved by the US Food and Drug Administration for use in AD. The first was ruxolitinib, a JAK1/2 inhibitor that was approved in 2021. The newer JAK1 selective inhibitors, upadacitinib and abrocitinib, were approved in 2022. Because of the novelty of these agents, their safety information may not be comprehensive, and clinicians should practice extra caution. Janus kinase inhibitors have black box warnings including increased risk of serious infection, malignancy, and lipid level changes. The US Food and Drug Administration added additional black box warnings for JAK inhibitors in 2022 because of an increased risk of adverse cardiovascular events, including heart attack, stroke, and blood clot formation. However, this finding was from a trial studying the incidence of major adverse cardiovascular events in patients over the age of 50 years with rheumatoid arthritis and at least one cardiovascular risk factor being treated with tofacitinib, with nearly 100% of patients taking methotrexate and more than 50% taking prednisone concurrently.29 Although clinicians should always pay close attention to black box warnings, it should be noted that the patient demographics in that study are not representative of AD patients, nor does the treatment regimen represent one that would be used in patients with AD.
Antihistamines. Antihistamines are used as an adjunctive treatment in AD to provide itch relief but do not treat the underlying disease itself. Even so, histamines should be considered in patients experiencing great discomfort due to the itchiness, because breaking the itch-scratch cycle is key to preventing disease progression and complications. This is especially relevant for patients who experience difficulty sleeping, in which case sedating antihistamines can provide relief.30
For relieving itch at night, use first-generation antihistamines (eg, diphenhydramine, hydroxyzine, etc), which provide a sedative effect to aid in sleep. For daytime, it is best to use second-generation antihistamines (eg, cetirizine, bilastine, etc), which are much less sedating because of their diminished ability to cross the blood-brain barrier.
Phototherapy
Phototherapy is another option for patients whose AD cannot be controlled solely with topical therapy or who have extensive bodily involvement. Phototherapy modalities have shown efficacy in treating AD, including broadband UV-B and narrowband UV-B. Narrowband UV-B is considered first-line phototherapy, but its use can be limited by overheating and sweating, which can flare AD.31
Conclusions
Atopic dermatitis is the most common eczematic inflammatory skin condition, and it may reduce patients’ quality of life because of physical discomfort (itching, sleep disturbances) and adverse cosmetic effects. Management of AD often involves a combination of targeting the underlying disease and symptom management to break the itch-scratch cycle to prevent further exacerbation and promote disease remission. This can be achieved through the regular use of moisturisers and avoidance of triggers combined with either topical or systemic therapies.
Practice pearls
- Atopic dermatitis can be classified according to serum IgE levels, age at onset, and time of presentation.
- Atopic dermatitis lesions typically appear as poorly demarcated, scaly, and erythematous plaques associated with severe itching, most commonly found on flexural surfaces of knees, elbows, wrists, and sides of fingers.
- Use of moisturisers with emollient, humectant, or occlusive agents and avoidance of triggers are key to treatment.
- Symptomatic treatment to relieve physical discomfort and break the itch-scratch cycle can improve quality of life and prevent further exacerbation.
- Therapies with anti-inflammatory properties are the cornerstone of ad treatment.
Conflict of Interest
The authors declare no conflicts of interest.
Funding
The authors received no funding for this study.
Dermatite atópica: aspetos clínicos e tratamentos
Ryan S Q Geng, R Gary Sibbald
DOI: 10.33235/wcet.44.2.29-36
Sumário
A dermatite atópica é a doença inflamatória eczematosa mais comum da pele, apresentando lesões que tipicamente aparecem como pápulas e como placas eritematosas e escamosas mal demarcadas. As lesões ocorrem mais frequentemente nas superfícies de flexão dos joelhos, nos cotovelos e pulsos e estão associadas a prurido moderado a grave. Este artigo centra-se na apresentação clínica da dermatite atópica e nas opções de tratamento. Outros tópicos relacionados incluem a epidemiologia, a patogénese, os fatores de risco, os fatores desencadeantes e os diagnósticos diferenciais.
Introdução
A dermatite atópica (AD), ou eczema atópico, é a doença inflamatória eczematosa mais comum da pele, com uma prevalência de 15% ao longo da vida.1 Embora possam ser afetados pacientes de todas as idades, o início da doença atinge o seu pico na infância, com 90% dos casos a ocorrerem antes dos 5 anos de idade.2 A prevalência da AD aumentou duas a três vezes ao longo das últimas 3 décadas.3
A patogénese da AD é multifatorial e envolve interações complexas entre a barreira cutânea, fatores genéticos e exposições ambientais. A disfunção da barreira cutânea pode ser caracterizada pelo aumento da perda de água trans epidérmica, pelo aumento do pH da pele ou pela diminuição dos níveis de ceramidas, de humectantes e de proteínas estruturais. Outros desafios à função de barreira da pele incluem a expressão anómala de filagrina (FLG; uma proteína que liga as fibras de queratina na epiderme) ou o uso excessivo de sabão, o que também pode aumentar a permeabilidade da pele.4 À medida que os mastócitos e os basófilos estão sensíveis aos antigénios ambientais, é desencadeada uma reação de hipersensibilidade mediada pela imunoglobulina E do tipo I, a libertação de citocinas e a inflamação, que resulta frequentemente em prurido intenso. O coçar das lesões resulta em mais danos na barreira cutânea, designando-se por ciclo comichão-arranhão. De forma crónica, isto pode levar a um agravamento da inflamação e da liquenificação.5
Com o desconforto físico e com a aparência cosmética das lesões da AD, os pacientes podem enfrentar desafios psicossociais significativos, incluindo angústia social, embaraço e limitação de atividade.6 Dado o potencial impacto na qualidade de vida e com o aumento da incidência, esta revisão centrar-se-á nas características clínicas da AD e nas opções de tratamento disponíveis.
Fatores de risco
A dermatite atópica faz parte da tríade atópica que consiste na AD, asma e rinite alérgica. Existem vários fatores de risco para o desenvolvimento da AD, sendo o preditor mais forte uma história familiar positiva para qualquer doença atópica, especialmente a AD. Os genes implicados incluem o FLG, o grupo de citocinas TH2 e o LRRC32 (que codifica a glicoproteína A de repetição predominante).7
Foram igualmente identificados fatores de risco ambientais: Viver num ambiente urbano, um clima seco, baixa exposição à luz UV e uma dieta rica em hidratos de carbono simples e ácidos gordos polinsaturados estão todos associados a um maior risco de AD.7 No Quadro 1 resumem-se os fatores de risco associados à AD.
Quadro 1 Fatores associados ao aumento do risco de desenvolver Dermatite Atópica.
Classificações clínicas
Embora a apresentação clínica da AD seja heterogénea, com várias características e sintomas, as lesões são tipicamente caracterizadas pela existência de pápulas mal demarcadas, escamosas e eritematosas que coalescem em placas com prurido intenso, mais frequentemente encontradas nas superfícies de flexão dos joelhos, cotovelos e pulsos. As características clínicas da AD são descritas no Quadro 2, sendo as características essenciais, principais e secundárias indicadas com base nas diretrizes da Academia Americana de Dermatologia.2 Devido à grande variação na apresentação clínica da AD, existe um amplo diferencial, descrito no Quadro 3. A classificação da AD baseia-se na serologia do biomarcador (IgE), na acuidade da apresentação e na idade de início. As apresentações clínicas da AD são apresentadas na Figura 1.
Quadro 2 Características e sintomas da AD.
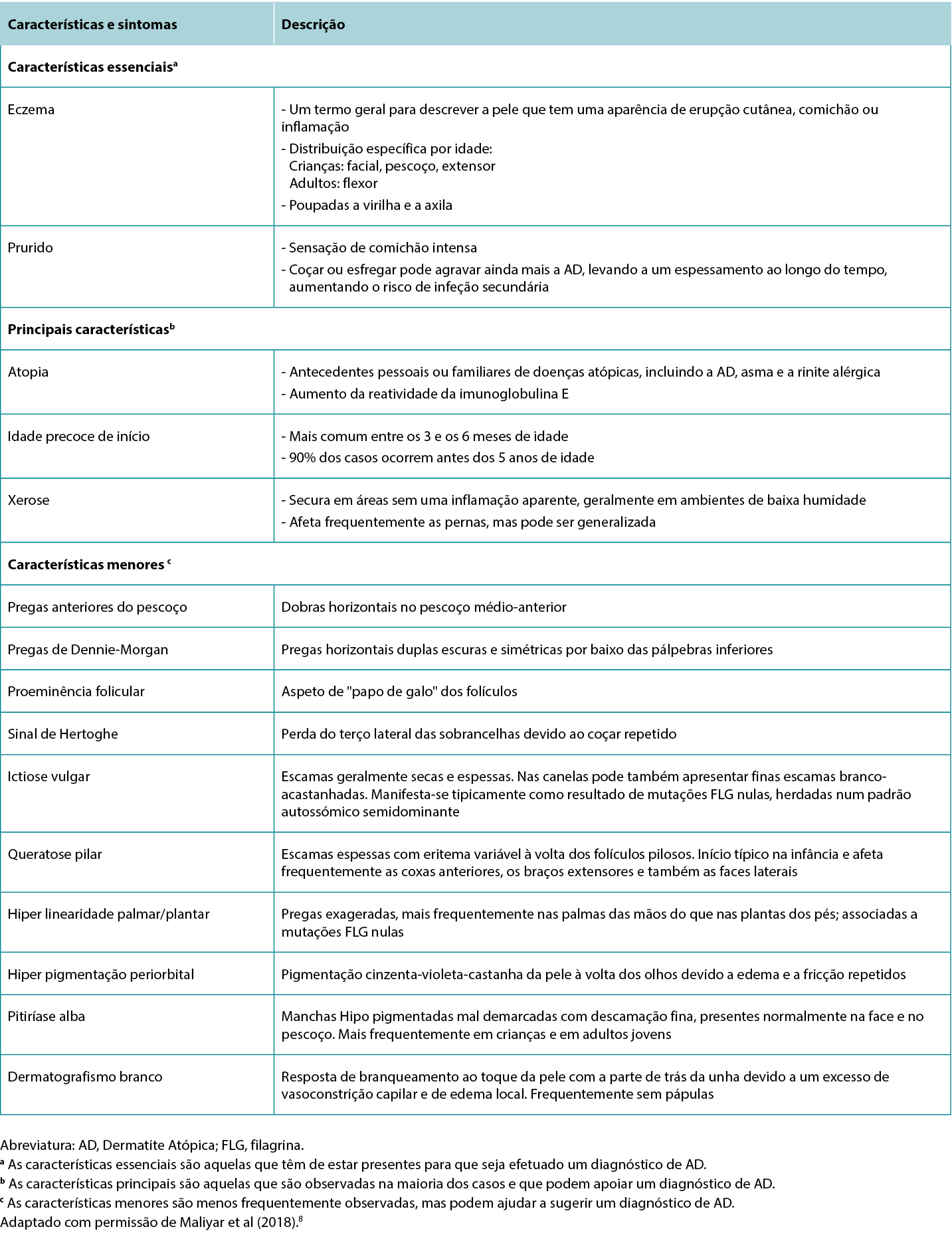
Quadro 3 Diagnósticos diferenciais da Dermatite Atópica e características distintivas.
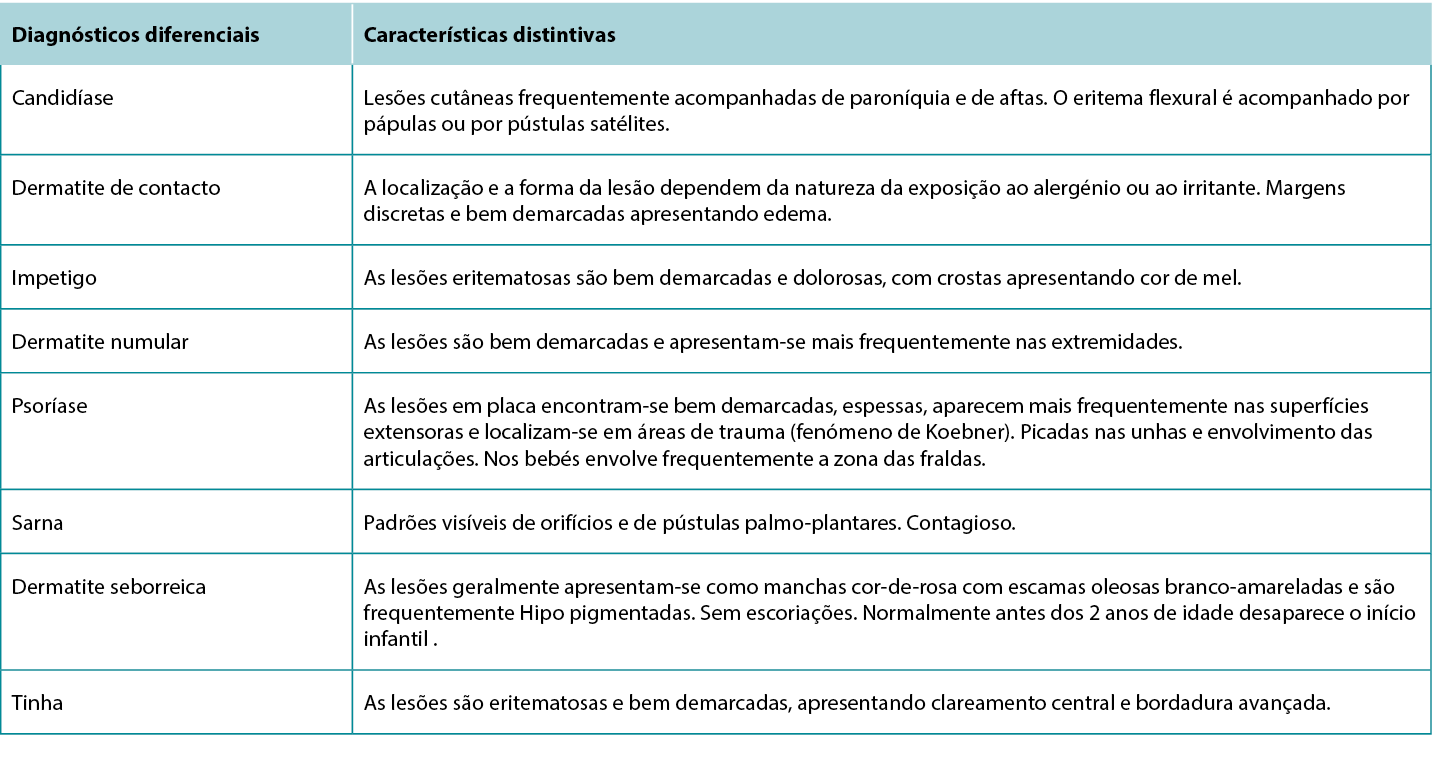

Figura 1 Apresentações clínicas da Dermatite Atópica
A, Placas eritematosas mal demarcadas com escamas finas no aspeto flexural do cotovelo. B, Placas eritematosas bem demarcadas distribuídas pela face dorsal dos pés, tornozelo e abaixo do joelho. C, Mancha eritematosa mal demarcada na zona de flexão do pulso.
Classificação por níveis séricos de IgE
Extrínseco. O subtipo extrínseco caracteriza-se por níveis elevados de IgE total (>200 kU/L) em resposta a alergénios proteicos específicos, tipicamente do género Dermatophagoides de ácaros, incluindo Dermatophagoides pteronyssinus e Dermatophagoides farina. As principais citocinas elevadas incluem a interleucina 4 (IL-4), IL-5 e IL-13, características de uma resposta TH2. O subtipo extrínseco resulta de uma função de barreira cutânea deficiente, com 20% a 30% dos pacientes com variantes patogénicas de FLG, sendo muito mais comum do que o subtipo intrínseco.9
Intrínseco. O subtipo intrínseco é caracterizado por níveis normais de IgE total (<200 kU/L) e mostra uma predileção sexual pelas mulheres. A principal citocina elevada é o interferão γ, caraterístico de uma resposta TH1. Embora a barreira cutânea esteja intacta no subtipo intrínseco, os metais e os haptenos podem ainda penetrar na pele e vir a desencadear uma resposta.9
Classificação por acuidade de apresentação
Com base na acuidade da apresentação, as lesões individuais da AD podem ser classificadas em categorias agudas, subagudas ou crónicas. Um indivíduo com AD pode apresentar uma combinação de lesões em qualquer uma destas diferentes fases.
Aguda. As lesões agudas apresentam-se como pápulas papulovesiculares eritematosas mal demarcadas e através de erupções em placas com bolhas, lacrimejamento e/ou formação de crostas. Pode também estar presente um edema generalizado, com ou sem escamas. O coçar pode originar erosões e pústulas que são suscetíveis de infeção secundária, em particular com Staphylococcus aureus.10
Subaguda. As lesões subagudas manifestam-se como placas e pápulas escamosas eritematosas mal demarcadas.10
Crónica. As lesões crónicas podem envolver liquenificação (espessamento da pele com aumento da visibilidade das marcas cutâneas) devido ao coçar repetido ao longo do tempo e à escala.10
Classificação por idade de início
Infantil (desde 2 semanas a 2 anos de idade). A AD de início infantil apresenta-se tipicamente com lesões caracterizadas por pápulas e vesículas pruriginosas com exsudado seroso e/ou crostas associadas, mais frequentemente afetando a cabeça e o pescoço. As lesões normalmente aparecem primeiro como eritema e descamação nas bochechas, que depois se estendem à testa, ao couro cabeludo e ao pescoço. As superfícies extensoras são também frequentemente afetadas devido a traumatismos provocados pelo gatinhar. Com o tempo, o coçar e esfregar pode resultar em crostas e em liquenificação (espessamento e aumento das marcas na superfície da pele).8
Infância (desde os 2 anos de idade até à puberdade). Na AD de início na infância, o envolvimento facial é menos proeminente e, em vez disso, os pés, os tornozelos, os pulsos e o aspeto flexural dos joelhos e cotovelos são mais frequentemente envolvidos. As lesões apresentam-se tipicamente secas com placas liquenificadas, pápulas, erosões (rutura da epiderme com a base epidérmica) e/ou crostas.8
Adulto (pós-puberdade). Semelhante à AD infantil, a AD no adulto envolve principalmente as regiões flexurais, mas também afeta com mais frequência a face e o pescoço. As lesões apresentam-se tipicamente através de placas e pápulas simétricas, secas e escamosas. É frequente observarem-se escoriações e liquenificação, enquanto as crostas e a exsudação são menos frequentes.8
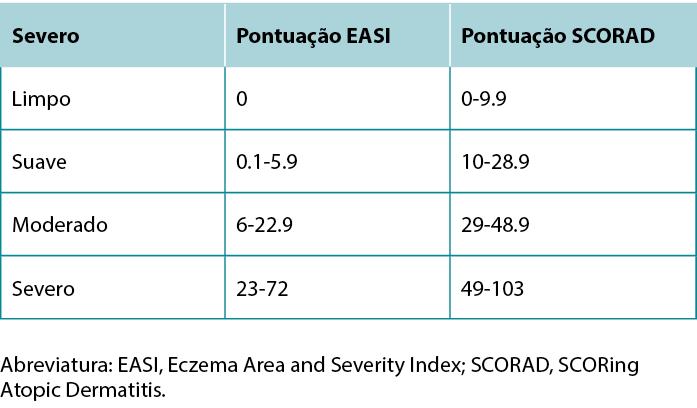
Pontuação da gravidade
Uma vez realizado o diagnóstico de AD, a descrição da gravidade da doença pode orientar a seleção do tratamento. As ferramentas para avaliação da gravidade mais frequentemente utilizadas são o Eczema Area and Severity Index (EASI) e o SCORing Atopic Dermatitis (SCORAD). Embora ambas as ferramentas incluam a extensão do eritema, tumefação, escoriação, liquenificação e área corporal afetada, o SCORAD também considera medidas subjetivas do doente.11 O Quadro 4 apresenta um resumo dos estratos de classificação da gravidade para o EASI e o SCORAD.
Quadro 4 Estratos de classificação da gravidade EASI e SCORAD.
Tratamentos da ad
Estão disponíveis várias opções para o tratamento das lesões da AD para proporcionar alívio sintomático aos pacientes e quebrar o ciclo comichão-arranhão, de forma a evitar a progressão da doença e o desenvolvimento de uma infeção secundária. Aconselhar os pacientes a utilizar com regularidade hidratantes com emolientes, humectantes e agentes oclusivos para melhorar a barreira cutânea, proporcionar algum alívio do prurido e prevenir futuras crises.12 Os pacientes com AD devem evitar produtos com fragrâncias para minimizar uma potencial exposição a alergénios. Discuta a importância de identificar e evitar fatores que desencadeiam ou exacerbam as lesões da AD.13 No Quadro 5 apresentam-se uma lista de fatores desencadeantes comuns e o Quadro 6 apresenta um resumo das opções de tratamento para a AD.
Quadro 5 Fatores desencadeantes e exacerbantes da Dermatite Atópica.

Quadro 6 Opções de tratamento para a Dermatite Atópica.

Tratamentos farmacêuticos tópicos
Hidratantes tópicos. A pedra angular da terapia da AD consiste na utilização regular de hidratantes. Os hidratantes podem conter uma combinação de humectantes, de oclusivos e de emolientes que ajudam a proteger a barreira cutânea. Os humectantes são substâncias hidrofílicas que retêm a água, os oclusivos são substâncias hidrofóbicas que formam uma camada física sobre a pele de forma a reter a água por baixo e os emolientes preenchem os espaços entre as células mortas da pele para a suavizar.
Para além de ajudarem os pacientes a gerir a secura e a comichão das lesões ativas da AD, os hidratantes podem também prolongar a recidiva. Num ensaio que envolveu 44 pacientes com lesões de AD tratadas com betametasona 0.1% em creme, aqueles que aplicaram um creme hidratante contendo ureia como única terapêutica de manutenção tiveram uma recaída após mais de 180 dias, em média, em comparação com 30 dias para os pacientes que não utilizaram qualquer terapêutica de manutenção.14
Corticosteroides tópicos. Os corticosteroides apresentam propriedades anti-inflamatórias que são utilizadas para o tratamento de crises agudas e de comichão. Num ensaio que envolveu 40 pacientes, os que foram tratados todas as noites, durante 4 semanas com furoato de mometasona 0.1% em creme, obtiveram uma redução de 77% na pontuação SCORAD, em comparação com 17% no caso do controlo com vaselina (P<0.001).15 Os corticosteroides são classificados pela sua potência e a escolha do corticosteroide deve ser orientada pela idade do doente, pela região do corpo afetada e pela gravidade da doença. Geralmente, os corticosteroides de baixa potência são utilizados em doenças mais ligeiras, em pacientes mais jovens e em áreas que envolvem a face e as pregas (regiões intertriginosas).8 A utilização prolongada de corticosteroides tópicos está associada a uma maior diminuição da função da barreira cutânea, atrofia cutânea, telangiectasia e púrpura, podendo também induzir ou agravar a rosácea e a dermatite perioral. Como tal, os corticosteroides só são recomendados para o tratamento de curto prazo das crises e para o controlo dos sintomas. Para proporcionar um alívio rápido das crises agudas podem também ser administradas injeções intradérmicas de corticosteroides.
Inibidores tópicos da calcineurina (tacrolimus e pimecrolimus). O tacrolimus e o pimecrolimus são inibidores da calcineurina que apresentam propriedades anti-inflamatórias e de preservação da barreira cutânea utilizados no tratamento da AD. Num ensaio, 49 pacientes que aplicaram tacrolimus 0.1% pomada duas vezes por dia até 22 dias obtiveram uma redução de 72% na pontuação do EASI, em comparação com 26% para o veículo (P<0.001).16 Ao contrário dos corticosteroides, a utilização prolongada de tacrolimus ou pimecrolimus não está associada a atrofia cutânea; podem ser utilizados de forma a reduzir a carga de corticosteroides ou para manutenção.17 Os pacientes podem sentir ardor ou picadas durante a aplicação, mas o arrefecimento do produto no frigorífico antes da aplicação pode aliviar esta sensação.
Inibidores tópicos da fosfodiesterase-4 (crisaborol). O crisaborol é um inibidor da fosfodiesterase-4 com eficácia no tratamento da AD através da regulação negativa da produção de citocinas pró-inflamatórias. Num estudo que envolveu 400 pacientes, aqueles que foram tratados com crisaborol 2% pomada duas vezes por dia durante 4 semanas obtiveram uma redução média de 60% na pontuação EASI, em comparação com 43% para o veículo (P=0.0002).18 O crisaborol é geralmente bem tolerado e é uma outra opção de tratamento da AD que não utiliza esteroides.
Agentes anti-infeciosos tópicos. Os agentes anti-infeciosos são normalmente utilizados como terapêutica adjuvante nos casos em que existe uma infeção associada ou se se acredita que um fator microbiano (por exemplo, S aureus) está a agravar a AD.
O ácido fusídico e a mupirocina são antibióticos utilizados para combater as bactérias estafilocócicas e estreptocócicas e podem ser eficazes no tratamento da AD se a colonização por S aureus for um fator patogénico contribuinte. Num ensaio que envolveu 239 pacientes, os pacientes tratados com ácido fusídico a 2% mais creme de hidrocortisona a 1% apresentaram melhorias significativas em fatores como o eritema, o prurido e a descamação, em comparação com os pacientes tratados apenas com creme de ácido fusídico a 2% ou creme de hidrocortisona a 1% (P=0.009).19
A imersão em lixívia (hipoclorito de sódio) é uma outra opção para reduzir a colonização por S aureus. Os pacientes podem misturar um quarto a meia chávena de solução de lixívia a 6% em uma banheira cheia de água e deixar em imersão durante 5 a 10 minutos.
Tratamentos farmacêuticos sistémicos
Corticosteroids. Embora os corticosteroides possam ser tomados por via oral, tal não é frequentemente recomendado devido às crises de recuperação após a interrupção e aos efeitos adversos associados à utilização de corticosteroides sistémicos (por exemplo, aumento de peso, diabetes, perda muscular, hemorragias gastrointestinais, etc.). No entanto, os corticosteroides sistémicos podem ter benefícios no tratamento de crises agudas graves.20
Inibidores da calcineurina (ciclosporina). A ciclosporina é um inibidor da calcineurina com propriedades anti-inflamatórias que é útil no tratamento de formas graves ou recalcitrantes da AD que não responderam à terapêutica tópica. Num ensaio que envolveu 46 pacientes, os que foram tratados com ciclosporina 5 mg/kg por dia durante 6 semanas obtiveram uma melhoria média de 55% na pontuação total da avaliação da gravidade corporal; em contraste, os que receberam placebo pioraram 4% (P=0.0002).21 Embora a ciclosporina ofereça um alívio rápido, os seus efeitos não são duradouros e é necessária uma terapêutica de manutenção para evitar recaídas.22 A insuficiência renal é uma preocupação para iniciar o tratamento com ciclosporina e esta deve ser cuidadosamente monitorizada.
Análogos das purinas (azatioprina). A azatioprina é um imunossupressor optimizador de corticosteroides utilizado em várias doenças inflamatórias da pele, incluindo a AD. Num ensaio que envolveu 37 pacientes, os que foram tratados com azatioprina 2.5 mg/kg por dia durante 12 semanas relataram uma melhoria média de 26% em fatores que incluíam eritema, secura e liquenificação, em comparação com 3% para o placebo (P<0.01).23 Embora a azatioprina tenha indicações semelhantes às da ciclosporina para o tratamento da AD, é menos preferida para crises agudas porque não atua tão rapidamente. A hepatotoxicidade constitui uma preocupação para o início do tratamento com azatioprina.
Inibidores do ácido fólico (metotrexato). O metotrexato tem propriedades imunossupressoras e em casos moderados a graves pode ser utilizado em doses baixas para suprimir os sintomas e as crises de AD. Num estudo que envolveu 40 pacientes, o metotrexato foi tão eficaz como a ciclosporina.24 Os pacientes tratados com metotrexato 7.5 mg/wk obtiveram uma redução média de 26 pontos SCORAD, em comparação com uma redução de 25 pontos para os pacientes tratados com ciclosporina 2.5 mg/kg por dia (P=0.93).24 Tal como com a azatioprina, a hepatotoxicidade deve ser considerada.
Inibidores da inosina monofosfato desidrogenase (micofenolato mofetil). O micofenolato de mofetil é outro imunossupressor que demonstra eficácia no tratamento da AD. Num estudo-piloto, 10 pacientes tratados com 2 g/d durante 4 semanas, seguidos de 1 g/d durante 4 semanas, obtiveram uma diminuição de 55% na pontuação SCORAD (P<0.01).25 O micofenolato não atua tão rapidamente como os corticosteroides ou como a ciclosporina, mas pode permitir alcançar um controlo clínico satisfatório com menos efeitos adversos e ser utilizado como terapêutica de manutenção.
Produtos biológicos. Atualmente, os únicos produtos biológicos aprovados para o tratamento da AD são o dupilumab e o tralokinumab, ambos dirigidos à via de sinalização da IL-13. De qualquer forma, estão a ser desenvolvidos muitos outros produtos biológicos.
Dupilumab. O dupilumab é um inibidor da IL-4/IL-13 utilizado no tratamento de casos moderados a graves de AD que são relutantes a outras terapias tópicas e sistémicas. Num ensaio com 671 pacientes, 38% dos pacientes tratados com dupilumab 300 mg por via subcutânea de 2 em 2 semanas e 37% dos pacientes tratados semanalmente durante 16 semanas obtiveram um resultado claro ou quase claro na escala de Avaliação Global do Investigador, em comparação com 10% para o placebo (P<0.001).26 Dupilumab melhora consideravelmente a inflamação e coceira sem toxicidade limitante da dose, mas é um tratamento caro.
Tralokinumab. O tralokinumab é um inibidor da IL-13 com indicações de utilização semelhantes às do dupilumab. Num ensaio com 802 pacientes, 25% dos pacientes tratados com tralokinumab 300 mg por via subcutânea de 2 em 2 semanas durante 16 semanas obtiveram EASI de 75, em comparação com 13% dos pacientes do grupo de controlo (P<0.001).27 Enquanto o tralocinumab e o dupilumab são eficazes, o tralocinumab está associado a um menor risco de conjuntivite.
Inibidores da Janus kinase. Os inibidores da Janus kinase (JAK) são inibidores de pequenas moléculas que têm como alvo a via de sinalização JAK, a qual está associada a várias citocinas pró-inflamatórias. Num ensaio que envolveu 560 pacientes, 80% dos pacientes tratados com upadacitinib 30 mg por dia durante 16 semanas atingiram um EASI de 75, em comparação com 16% para o placebo (P<0.0001).28 Para além de oferecerem uma elevada especificidade alvo tais como os biológicos, os inibidores da JAK podem ser aplicados topicamente (tofacitinib, ruxolitinib, delgocitinib) ou tomados por via oral (tofacitinib, baricitinib, abrocitinib, upadacitinib), desse modo oferecendo uma via de administração mais simples.
Atualmente, três inibidores da JAK foram aprovados pela Food and Drug Administration dos US para utilização na AD. O primeiro foi o ruxolitinib, um inibidor da JAK1/2, o qual foi aprovado em 2021. Os mais recentes inibidores seletivos da JAK1, upadacitinib e abrocitinib, foram aprovados em 2022. Devido à novidade destes agentes, a informação sobre a sua segurança pode não ser exaustiva, pelo que os clínicos devem considerar um cuidado acrescido. Os inibidores da Janus quinase têm avisos de caixa negra que incluem o aumento do risco de infeção grave, malignidade e alterações dos níveis lipídicos. A Food and Drug Administration dos US acrescentou avisos adicionais de caixa negra para os inibidores de JAK em 2022 devido a um risco acrescido de acontecimentos cardiovasculares adversos, incluindo ataque cardíaco, acidente vascular cerebral e formação de coágulos sanguíneos. No entanto, este resultado foi obtido num ensaio que estudou a incidência de eventos cardiovasculares adversos graves em pacientes com mais de 50 anos, com artrite reumatoide e pelo menos um fator de risco cardiovascular tratados com tofacitinib, com quase 100% dos pacientes a tomarem metotrexato e mais de 50% a tomarem prednisona em simultâneo.29 Embora os médicos devam prestar sempre muita atenção às advertências das caixas negras, deve notar-se que os dados demográficos dos pacientes nesse estudo não são representativos dos pacientes com AD, nem o regime de tratamento representa um regime que seria utilizado em pacientes com AD.
Anti-histamínicos. Os anti-histamínicos são utilizados como tratamento adjuvante na AD para aliviar a comichão, mas em si não tratam a doença subjacente. Mesmo assim, as histaminas devem ser consideradas nos pacientes que sentem um grande desconforto devido à comichão, porque quebrar o ciclo comichão-arranhão é fundamental para se conseguir prevenir a progressão da doença e as complicações. Isto é especialmente relevante para os pacientes que têm dificuldade em dormir, caso em que os anti-histamínicos sedativos podem proporcionar um alívio.30
Para aliviar a comichão durante a noite, utilizar anti-histamínicos de primeira geração (por exemplo, difenidramina, hidroxizina, etc.), os quais possuem um efeito sedativo que ajuda a dormir. Durante o dia, é preferível utilizar anti-histamínicos de segunda geração (por exemplo, cetirizina, bilastina, etc.), os quais são muito menos sedativos devido à sua menor capacidade em atravessar a barreira hematoencefálica.
Fototerapia
A fototerapia é uma outra opção para os pacientes cuja AD não pode ser controlada apenas com terapêutica tópica ou que apresentam um envolvimento corporal extenso. As modalidades de fototerapia têm demonstrado eficácia no tratamento da AD, incluindo a UV-B de banda larga e a UV-B de banda estreita. A UV-B de banda estreita é considerada a fototerapia de primeira linha, mas a sua utilização pode ser limitada pelo sobreaquecimento e pela transpiração, as quais podem desencadear a AD.31
Conclusões
A dermatite atópica é a doença inflamatória eczematosa mais comum da pele e esta pode reduzir a qualidade de vida dos pacientes devido ao desconforto físico (comichão, perturbações do sono) e aos efeitos cosméticos adversos. A gestão da AD envolve frequentemente uma combinação de tratamento da doença subjacente e de gestão dos sintomas para ser possível quebrar o ciclo comichão-arranhão, a fim de evitar novas exacerbações e dessa forma promover a remissão da doença. Isto pode ser conseguido através da utilização regular de hidratantes e da prevenção dos fatores desencadeantes, combinados com terapias tópicas ou sistémicas.
Lições práticas
- A dermatite atópica pode ser classificada em função dos níveis séricos de IgE, da idade de início e do momento da apresentação.
- As lesões da dermatite atópica aparecem tipicamente como placas mal demarcadas, escamosas e eritematosas associadas a prurido intenso, mais frequentemente encontradas nas superfícies de flexão dos joelhos, cotovelos, pulsos e lados dos dedos.
- A utilização de hidratantes com agentes emolientes, humectantes ou oclusivos e a prevenção de fatores desencadeantes são fundamentais para o seu tratamento.
- O tratamento sintomático para aliviar o desconforto físico e quebrar o ciclo comichão-arranhão pode melhorar a qualidade de vida e dessa forma evitar novas exacerbações.
- Terapias com propriedades anti-inflamatórias são a pedra angular do tratamento da DA.
Conflito de Interesses
Os autores declaram não existirem conflitos de interesse.
Financiamento
Os autores não receberam financiamento para este estudo.
Author(s)
Ryan S Q Geng*
MSc
Temerty School of Medicine, University of Toronto, Toronto, Ontario, Canada
R Gary Sibbald
MD Med FRCPC (Med Derm) FAAD MAPWCA JM
Dalla Lana School of Public Health & Division of Dermatology,
Department of Medicine, University of Toronto
* Corresponding author
References
- Deckers IA, McLean S, Linssen S, Mommers M, van Schayck CP, Sheikh A. Investigating international time trends in the incidence and prevalence of atopic eczema 1990-2010: a systematic review of epidemiological studies. PLoS One 2012;7(7):e39803.
- Eichenfield LF, Tom WL, Chamlin SL, et al. Guidelines of care for the management of atopic dermatitis: section 1. Diagnosis and assessment of atopic dermatitis. J Am Acad Dermatol 2014;70(2):338-51.
- Asher MI, Montefort S, Bjorksten B, et al. Worldwide time trends in the prevalence of symptoms of asthma, allergic rhinoconjunctivitis, and eczema in childhood: ISAAC phases one and three repeat multicountry cross-sectional surveys. Lancet 2006;368(9537):733-43.
- O’Regan GM, Sandilands A, McLean WHI, Irvine AD. Filaggrin in atopic dermatitis. J Allergy Clin Immunol 2008;122(4):689-93.
- Perkin MR, Strachan DP, Williams HC, Kennedy CT, Golding J, Team AS. Natural history of atopic dermatitis and its relationship to serum total immunoglobulin E in a population-based birth cohort study. Pediatr Allergy Immunol 2004;15(3):221-9.
- Gochnauer H, Valdes-Rodriguez R, Cardwell L, Anolik RB. The psychosocial impact of atopic dermatitis. Adv Exp Med Biol 2017;1027:57-69.
- Weidinger S, Beck LA, Bieber T, Kabashima K, Irvine AD. Atopic dermatitis. Nat Rev Dis Primers 2018;4(1):1.
- Maliyar K, Sibbald C, Pope E, Sibbald GR. Diagnosis and management of atopic dermatitis: a review. Adv Skin Wound Care 2018;31(12):538-50.
- Tokura Y, Hayano S. Subtypes of atopic dermatitis: from phenotype to endotype. Allergol Int 2022;71(1):14-24.
- Wolff K, Johnson RA, Saavedra AP, Roh EK. Atopic dermatitis. Fitzpatrick’s Color Atlas and Synopsis of Clinical Dermatology. New York: McGraw-Hill Education; 2017:34-40.
- Chopra R, Vakharia PP, Sacotte R, et al. Severity strata for Eczema Area and Severity Index (EASI), modified EASI, Scoring Atopic Dermatitis (SCORAD), objective SCORAD, Atopic Dermatitis Severity Index and body surface area in adolescents and adults with atopic dermatitis. Br J Dermatol 2017;177(5):1316-21.
- Ellis C, Luger T, Abeck D, et al. International Consensus Conference on Atopic Dermatitis II (ICCAD II): clinical update and current treatment strategies. Br J Dermatol 2003;148 Suppl 63:3-10.
- Jones SM. Triggers of atopic dermatitis. Immunol Allergy Clin North Am 2002;22(1):55-72.
- Wiren K, Nohlgard C, Nyberg F, et al. Treatment with a barrier-strengthening moisturizing cream delays relapse of atopic dermatitis: a prospective and randomized controlled clinical trial. J Eur Acad Dermatol Venereol 2009;23(11):1267-72.
- Islam MZ, Ali ME, Wahab MA, Khondker L, Siddique MRU. Efficacy of topical mometasone furoate 0.1% cream in the treatment of atopic dermatitis. Med Today 2014;26(1):36-40.
- Boguniewicz M, Fiedler VC, Raimer S, Lawrence ID, Leung DY, Hanifin JM. A randomized, vehicle-controlled trial of tacrolimus ointment for treatment of atopic dermatitis in children. Pediatric Tacrolimus Study Group. J Allergy Clin Immunol 1998;102(4 Pt 1):637-44.
- Queille-Roussel C, Paul C, Duteil L, et al. The new topical ascomycin derivative SDZ ASM 981 does not induce skin atrophy when applied to normal skin for 4 weeks: a randomized, double-blind controlled study. Br J Dermatol 2001;144(3):507-13.
- Ma L, Zhang L, Kobayashi M, et al. Efficacy and safety of crisaborole ointment in Chinese and Japanese patients aged ≥2 years with mild-to-moderate atopic dermatitis. J Dermatol 2023;50:847-55.
- Ramsay CA, Savoie JM, Gilbert M, Gidon M, Kidson P. The treatment of atopic dermatitis with topical fusidic acid and hydrocortisone acetate. J Eur Acad Dermatol Venereol 1996;7:S15-S22.
- Goh MS, Yun JS, Su JC. Management of atopic dermatitis: a narrative review. Med J Aust 2022;216(11):587-93.
- Van Joost T, Heule F, Korstanje M, van den Broek MJ, Stenveld HJ, van Vloten WA. Cyclosporin in atopic dermatitis: a multicentre placebo-controlled study. Br J Dermatol 1994;130(5):634-40.
- Lee SS, Tan AW, Giam YC. Cyclosporin in the treatment of severe atopic dermatitis: a retrospective study. Ann Acad Med Singap 2004;33(3):311-3.
- Berth-Jones J, Takwale A, Tan E, et al. Azathioprine in severe adult atopic dermatitis: a double-blind, placebo-controlled, crossover trial. Br J Dermatol 2002;147(2):324-30.
- Tsakok T, Flohr C. Methotrexate vs. ciclosporin in the treatment of severe atopic dermatitis in children: a critical appraisal. Br J Dermatol 2014;170(3):496-8.
- Grundmann-Kollmann M, Podda M, Ochsendorf F, Boehncke W-H, Kaufmann R, Zollner TM. Mycophenolate mofetil is effective in the treatment of atopic dermatitis. Arch Dermatol 2001;137(7):870-3.
- Simpson EL, Bieber T, Guttman-Yassky E, et al. Two phase 3 trials of dupilumab versus placebo in atopic dermatitis. N Engl J Med 2016;375(24):2335-48.
- Wollenberg A, Blauvelt A, Guttman-Yassky E, et al. Tralokinumab for moderate-to-severe atopic dermatitis: results from two 52-week, randomized, double-blind, multicentre, placebo-controlled phase III trials (ECZTRA 1 and ECZTRA 2). Br J Dermatol 2021;184(3):437-49.
- Guttman-Yassky E, Teixeira HD, Simpson EL, et al. Once-daily upadacitinib versus placebo in adolescents and adults with moderate-to-severe atopic dermatitis (Measure Up 1 and Measure Up 2): results from two replicate double-blind, randomised controlled phase 3 trials. Lancet 2021;397(10290):2151-68.
- Ytterberg SR, Bhatt DL, Mikuls TR, et al. Cardiovascular and cancer risk with tofacitinib in rheumatoid arthritis. N Engl J Med 2022;386(4):316-26.
- Klein PA, Clark RA. An evidence-based review of the efficacy of antihistamines in relieving pruritus in atopic dermatitis. Arch Dermatol 1999;135(12):1522-5.
- Rodenbeck DL, Silverberg JI, Silverberg NB. Phototherapy for atopic dermatitis. Clin Dermatol 2016;34(5):607-13.



