Volume 44 Number 3
Examining the association of immunosuppressants and wound healing: a narrative review
Aria Appoo, Brandon L Christensen, Ranjani Somayaji
Keywords wound healing, Calcineurin inhibitors, glucocorticoids, immunosuppressants, monoclonal antibodies, mTOR inhibitors
For referencing Appoo A, Christensen BL, Somayaji R. Examining the association of immunosuppressants and wound healing: a narrative review. WCET® Journal 2024;44(3):12-19.
DOI 10.33235/wcet.44.3.12-19
Abstract
Objective To review how different classes of immunosuppressants affect wound healing.
Data Sources A literature search was conducted in PubMed, Google Scholar, and the University of Calgary Health Sciences Library.
Study Selection The researchers initially screened article titles using key words such as “immunosuppressive medication,” “wound healing,” and “immunosuppression.” Articles in which the title and/or abstract contained these key words, that addressed wound healing related to immunosuppressant medications, and were published after 2000 were included in the review. When human data were not available for an immunosuppressant (class), animal studies were included.
Data Extraction The 61 included articles underwent full text review and summarisation.
Data Synthesis: All included studies were summarised descriptively including immunosuppressive mechanism of action, study participants or subjects, and evidence of effects on wound healing.
Conclusions Corticosteroids and mechanistic target of rapamycin inhibitors most consistently demonstrate detrimental effects on wound healing. For other classes of immunosuppressants, evidence is limited with varying effects on wound healing described. Larger, high-quality studies are required to better understand the effects of immunosuppressants, including those with new mechanisms of action, to identify those with the most impact on wound healing.
Introduction
Immunosuppressants are medications with a variety of indications including in solid organ and hematopoietic transplants and autoimmune diseases. They function by suppressing the activity of various components of the adaptive immune system, thus diminishing the cascade of inflammatory response to normal host tissue or modulating the natural rejection response to transplanted materials.1 The main classes of immunosuppressants are corticosteroids/glucocorticoids,2,3 calcineurin inhibitors (CNIs),2,4,5 mechanistic target of rapamycin (mTOR) inhibitors,2,4 monoclonal antibodies (mAbs),2,4 polyclonal antibodies (pAbs),2,4 and antiproliferative agents.2 For the purpose of this review, wounds are defined as an opening in the skin as a result of surgery, trauma, or disease that is susceptible to infection.
The immune system plays an important role in infection prevention as well as the healing process of wounds; inflammatory effects lead to cellular proliferation and secretion of important intracellular and extracellular components.6 With immunosuppressants, the immune system is modulated, thus potentially affecting a wound’s healing time and susceptibility to infection.7 With a growing number of patients on immunosuppressing medications, particularly patients postsurgical transplant, the effect of immunosuppressants on wound healing is an important issue. This review article aims to provide clinicians with an understanding of how different classes of immunosuppressants affect wound healing.
Methods
The authors conducted a literature search using the generic names of several common immunosuppressants (glucocorticoids/corticosteroids, mTOR inhibitors, methotrexate, mAbs, pAbs, CNIs, mycophenolate, azathioprine), as well as the terms “wound healing” and “immunosuppression.” The primary database searched was PubMed, supplemented by Google Scholar and the University of Calgary Health Science Library database. When possible, the search formatted as follows: “immunosuppressant name [MeSH Terms] AND “wound healing [MeSH Terms].” If the immunosuppressant name was not available as a MeSH term, then the term was searched with no restriction applied. The search was limited to articles in English published between 2000 and 2021.
The researchers screened article titles and abstracts for relevance. Articles were considered relevant if they compared various immunosuppressants, discussed their effects on wound healing, and measured wound healing or reported deleterious effects on wounds. If search terms did not identify any studies with human participants, the authors then included studies that used animals to evaluate the immunosuppressive effects of a given drug class on wound healing. When no data were available from 2000 onward, researchers conducted a historic search for the relevant immunosuppressive medications.
All included studies were summarised descriptively including immunosuppressive mechanism of action, study participants/subjects, and evidence of effects on wound healing.
Results
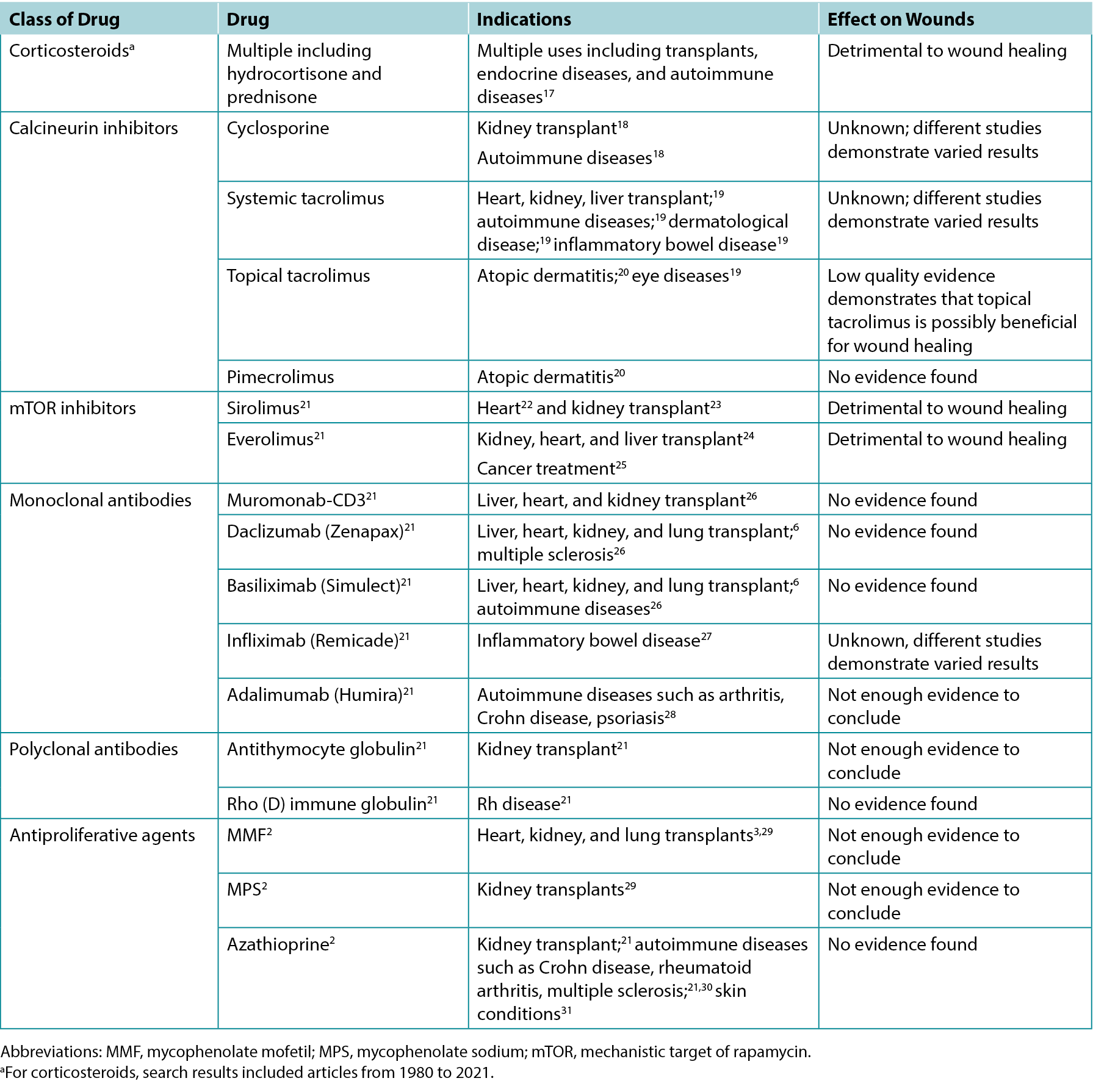
The authors screened 200 article titles and abstracts, and of these, 61 articles were included in the review. Table 1 highlights the results of select clinical and animal studies. The specific indications for various immunosuppressants including their possible impacts on wounds are outlined in Table 2.
Table 1. Select studies comparing the effects of different immunosuppressants on wound healing
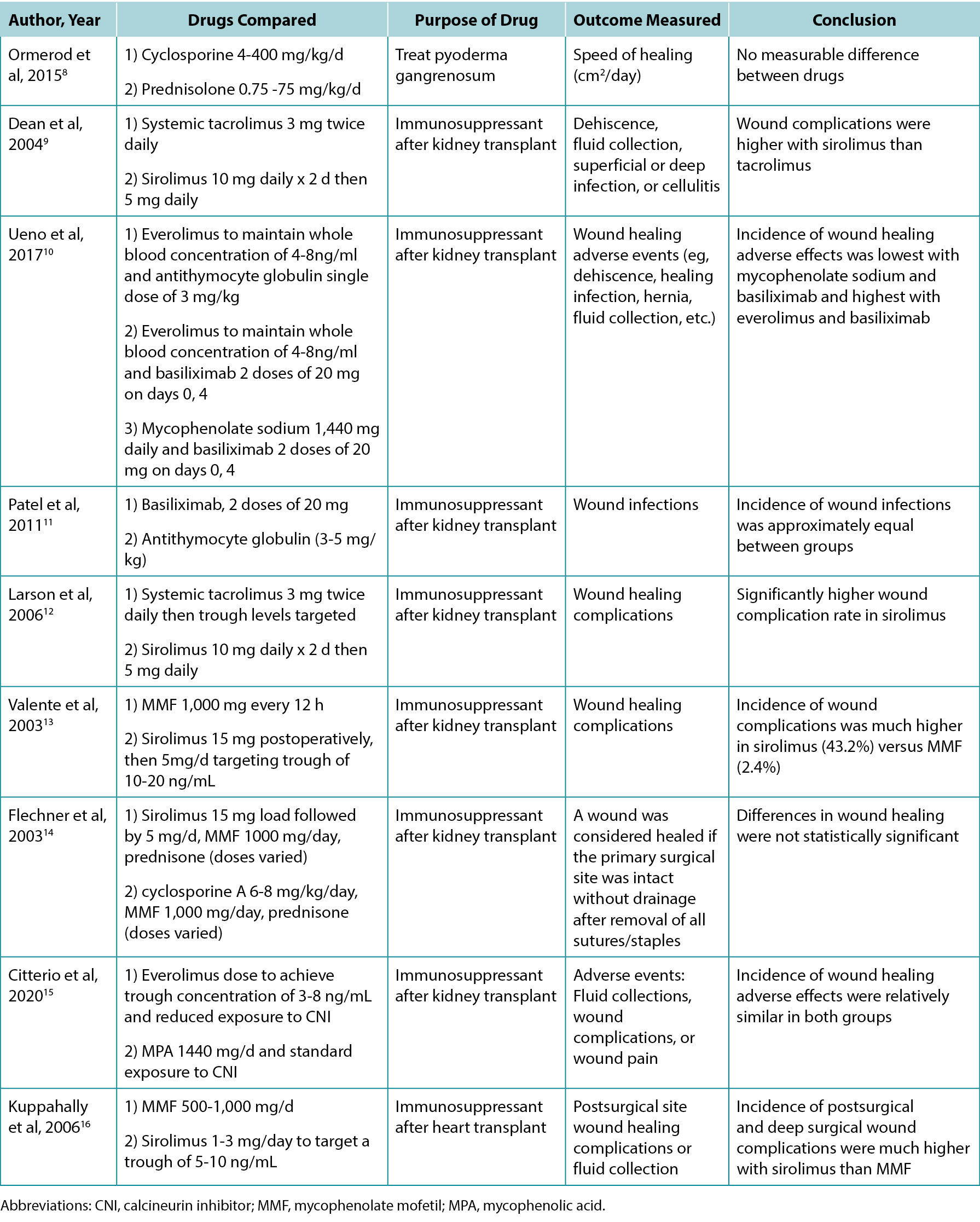
Table 2. Overview of indications and wound effects of various immunosuppressants
Calcineurin inhibitors
Calcineurin inhibitors are used for a variety of autoimmune diseases, organ transplants, dermatologic conditions, and chronic wounds.32 There are three main types of CNIs: cyclosporine (systemic), tacrolimus (systemic and topical), and pimecrolimus (topical).33 They work by binding to part of the calcineurin molecule found in human cells, thus stopping the release of certain cytokines that are responsible for activating T cells.32 Therefore, CNIs disable one of the main arms of the body’s adaptive immune response.
Systemic. Few studies have focused on the effects of CNIs on wound healing in humans; however, many basic science studies on animals have been performed. Two such studies using rats compared the effect of various doses of systemic tacrolimus versus a control, testing the breaking strengths of the wounds created through surgery.7,34 Willems et al7 concluded that tacrolimus does not affect wound healing, whereas Schäffer et al34 concluded that tacrolimus is detrimental to wound healing. In a case report using systemic tacrolimus as a treatment for ulcers in a person with lichen planus and pyoderma gangrenosum, Miller35 demonstrated treatment success with this therapy.
No recent human studies have investigated the effect of cyclosporine on wound healing, and two studies using rat models yielded contradictory results. These rat studies focused on the effects of cyclosporine on different markers in the body that signify effective wound healing.36,37 Nemlander et al36 compared cyclosporine to methylprednisolone and found that cyclosporine A had no suppressive effect on various inflammatory and biochemical markers in comparison with the glucocorticoid therapy. In contrast, Petri et al37 found that cyclosporine A had a negative effect on other markers within granulation fibroblasts, most notably activin A among procollagen 1, integrin 1, interleukin 6, transforming growth factor 1, and keratinocyte growth factor. In another animal study, Goldberg et al38 assigned dogs to one of three groups – no immunosuppression, methylprednisolone plus azathioprine, or cyclosporine A – after a lung transplant. They found that cyclosporine A had no significant effect on the healing of the surgical wound as measured by breaking strength in comparison with glucocorticoid and azathioprine immunosuppression. Overall, the literature on systemic CNIs and wound healing is limited with a heterogeneity of comparators and mixed results on wound healing.
Topical. Topical CNIs (tacrolimus and pimecrolimus) are often used for dermatologic conditions such as atopic dermatitis or pyoderma gangrenosum.20,39,40 Some case studies have shown that tacrolimus is effective at healing complex leg ulcers in the context of venous insufficiency or necrobiosis lipoidica when regular treatment strategies have been ineffective.41,42 Further, a rat-based study with acute cutaneous injury demonstrated that wounds treated with topical tacrolimus versus control (petrolatum) did not differ in healing speed.43
Monoclonal antibodies
There are a variety of different mAb therapies with indications in transplants and autoimmune disorders such as rheumatoid arthritis and psoriasis.21 In general, mAbs work by binding to different receptors and antigens to inhibit the effect of cytokines and other signal pathways that activate the immune system.21 In a small prospective cohort study among patients with rheumatoid arthritis undergoing orthopedic surgery, Bibbo and Goldberg44 found that there was no increased risk of surgical wound infections or healing complications in patients on infliximab versus conventional therapy. Further, Streit et al45 reported a case in which topical infliximab was helpful in healing leg ulcers that were resistant to standard treatment, suggesting that inhibiting tumor necrosis factor α is helpful for wound healing. Similarly, there was a case report that treated pyoderma gangrenosum with infliximab resulting in ulcer improvement.46 Inhibiting tumor necrosis factor α was further associated with wound healing in venous leg ulcers through the systemic use of adalimumab.47 However, a study that used infliximab on rat abdominal wounds found that tensile strength was significantly lower in the wounds of rats who had been given infliximab versus control.48 Overall, the literature is limited but suggests clinical outcomes may be favourable in terms of wound healing.
Polyclonal Antibodies
Polyclonal antibodies are very similar to mAbs in function, with slightly varied mechanism of action.49,50 Unlike mAbs, a group of pAbs is created from many different lines of B cells, and different pAbs bind to different epitopes of an antigen. In contrast, mAbs come from a single line of B cells and can bind to only one antigen.49,50
There are two main pAbs: antithymocyte globulin (also known as antihuman thymocyte globulin) and rho (ρ) immune globulin.21 Antithymocyte globulin is most commonly used as an immunosuppressant after kidney transplantation and works by binding to a variety of lymphocytes and depleting the number of T cells in the body.21 Rho immune globulin is used in pregnancies in which the gestational parent is Rh- and the fetus is Rh+ to essentially stop the formation of anti-Rh+ antibodies in the mother.21
Few studies have investigated the effects of pAbs on wound healing. However, two studies outlined the effects of antithymocyte globulin and basiliximab. Ueno et al10 investigated the use of these drugs combined with everolimus in patients with renal transplants. They reported higher rates of adverse effects on wound healing with basiliximab.10 Patel et al11 demonstrated that the incidence of wound infections was equal in patients taking basiliximab versus antithymocyte globulin after renal transplant. White blood cells play a key role in wound healing by secreting necessary cytokines and preventing infection51; thus, it is reasonable to hypothesise that antithymocyte globulin would affect wound healing because it reduces the number of white blood cells and their regulatory mechanisms.
mTOR Inhibitors
Mechanistic target of rapamycin inhibitors interact with proteins in complex signaling pathways to prevent cells from moving into the S phase of the cell cycle and therefore suppressing proliferation.3,21 Although mTOR predominantly targets T cells, it can also affect B cells.3 Interestingly, mTOR can increase production of certain inflammatory cytokines such as interleukin 6 and decrease production of interleukin 10, an anti-inflammatory cytokine.3 There are two main mTOR inhibitors: sirolimus and everolimus.3,21 In general, mTOR inhibitors have a variety of applications including cancer therapy and after transplants.3,21 Everolimus inhibits the proliferation of fibroblasts in in vitro models,52 suggesting that it could have negative consequences for wound healing because fibroblasts are essential for creating an extracellular matrix and scaffolding other cells.53 In a study comparing sirolimus and systemic tacrolimus, sirolimus had a wound complication rate of 47%, whereas the rate with tacrolimus was only 8%.9 This is consistent with another study by Larson et al12 demonstrating more frequent wound complications with sirolimus compared with tacrolimus. Those authors found that patients with obesity who were on sirolimus had very high rates of wound complications; as a result, the authors excluded all patients with obesity from the study.12 In line with previous findings, a study on rats showed that increased sirolimus doses decreased breaking strength.54 The authors hypothesised that this effect may be caused by lower levels of vascular endothelial growth factor and nitric oxide in rats receiving higher doses of sirolimus.54 In a review article, Nashan and Citterio55 concluded that mTOR inhibitors are harmful to wound healing in high doses, but seem to have a neutral effect in low does. Given early concerns with mTOR inhibitors and wound healing, regimens using these immunosuppressive agents have evolved with lower doses of the mTOR inhibitors and combination therapy. In the large TRANSFORM (Advancing renal TRANSplant eFficacy and safety Outcomes with an eveRoliMus-based regimen) randomised controlled trial, Citterio et al15 compared everolimus plus reduced-dose CNI with mycophenolic acid plus standard-dose CNI (standard care) in patients with renal transplants. They found that wound-related adverse events did not differ between groups (20.6% vs 17.3%; risk ratio, 1.19; 95% CI, 0.99 to 1.43).15 One limitation of this study was close monitoring of everolimus concentrations and difficulties achieving the targeted plasma concentrations C0 between 3 and 8 ng/mL.15 Overall, the current literature suggests that mTOR inhibitors have a detrimental effect on wound healing, especially at higher doses, and that improved dosing regimens may lessen or mitigate this risk.
Antiproliferative agents
There are three regularly used antiproliferative agents: mycophenolate mofetil (MMF), mycophenolate sodium (MPS), and azathioprine.2,29 Both MMF and MPS are inosine monophosphate dehydrogenase inhibitors. They have a similar effect to mTOR inhibitors in terms of their mechanism of immunosuppression. In the body, MMF and MPS are converted into mycophenolic acid, which blocks a portion of a pathway that is crucial for DNA synthesis to decrease proliferation of T and B cells.2,5,29 Whereas MMF is used for its immunosuppressive effect in heart, kidney, and lung transplants,3,29 MPS is used for kidney transplants.29 Azathioprine is used as an immunosuppressive drug for kidney transplants as well as autoimmune diseases, including rheumatoid arthritis, Crohn disease, and multiple sclerosis.21,30 Azathioprine reacts with glutathione in the body and is converted into 6-mercaptopurine. Additional metabolites are then generated, ultimately blocking purine synthesis and T-cell stimulation.3,21
In a study comparing two different doses of MMF in kidney transplant recipients, Flechner et al56 found no significant difference in the incidence of wounds requiring surgical intervention, similarly for wounds treated with local wound care. In analysing article titles for the present review, the authors did not find any studies regarding the sole effect of azathioprine on external wound healing in humans. However, Ginestal et al57 compared the effects of azathioprine versus placebo in a rat study. They found that the wounds of the rats who were on azathioprine took longer to heal than those on the placebo, suggesting that azathioprine may have detrimental effects on wound healing, but the extent that it would affect humans is unclear.57
Antimetabolite
Methotrexate is a commonly used folate antagonist with indications in many rheumatologic disorders. It also has antineoplastic activity in higher doses. Upon absorption, it enters the cell and is converted to methotrexate polyglutamates where it competes for dihydrofolate reductase, thus preventing the transformation of folic acid for its use in the building of nucleic acids.6 Experimental in vitro animal studies suggest that methotrexate may impair wound healing, but these effects have not been borne out in clinical studies, particularly in postsurgical wounds.6 Thus, it is recommended that this drug be continued postoperatively.
Corticosteroids/Glucocorticoids
Glucocorticoids prevent the formation of inflammatory chemicals such as cytokines, cell-adhesion molecules, and complement factors.3 By inhibiting interleukin 2 formation, glucocorticoids also prevent T-cell proliferation and activation.21 They also impair monocytes and B cells.3,21 Glucocorticoids were the first antirejection drugs created; however, there has been a movement to phase them out because of their serious adverse effects.3,21 Glucocorticoids are highly detrimental to wound healing because they interfere with many key stages, such as collagen deposition and synthesis, angiogenesis, fibroblast proliferation, growth factors, and phagocytosis, among others.2,3,58,59
Practical considerations for healthcare providers
Persons with compromised immune systems (due to medications, comorbidities, or age) require additional considerations for chronic wound management. Specific to immunosuppressive medications, healthcare providers should take a careful history not only of the medications and dosing (including changes in dosing), but also of the underlying conditions requiring these medications (eg, autoimmune disorders, organ transplantation). Because many immunosuppressive medications can impair wound healing, it is crucial for healthcare providers to assess healing potential early on to set and manage patient expectations. Early referral to medical or surgical specialists to assist with wound care and a team-based approach is essential, given the increased complexity of caring for these individuals. In cases when wounds are not healing, set alternate goals of care for the wound with the patient (eg, maintenance or nonhealable) if immunosuppressive doses cannot be reduced (assuming it is contributing to poor healing); undertake changes in consultation with the patient’s primary or specialist care providers. As individuals and populations with comorbidities live longer, caring for persons with chronic wounds on immunosuppressive medications will become increasingly common and wound care clinicians must be proactive in managing these patients.
Discussion
With the ongoing advances in medicine, the need for immunosuppression in the context of transplant, autoimmune disease, and malignancy has increased. This review highlights the paucity of robust studies in this field and the mixed effects of various immunosuppression on wound healing. High-quality evidence exists with respect to the deleterious effects of glucocorticoid therapy and mTOR therapy (particularly sirolimus) on wound healing. Four studies compared sirolimus with either MMF or systemic tacrolimus, and all four demonstrated that sirolimus was associated with an increased incidence of wound complications.9,12,13,16
The literature on agents such as systemic CNIs is mixed, with some suggesting adverse effects on wounds and others suggesting benefits; additional research focusing on this question is needed. Newer topical CNIs have shown little impact on delayed wound healing and, in some cases, may benefit healing, but additional investigation is warranted for their use in chronic wounds directly. Studies indicate that antiproliferative agents, antimetabolites, and newer mABs do not negatively impact wound healing. However, additional research is needed, given the lack of evidence on wound healing in mAB therapy.
Overall, the evidence in this area is limited and draws variable conclusions surrounding the effects of immunosuppressants on wound healing. In particular, few studies have included human participants. In general, when immunosuppressives are prescribed after transplants to prevent rejection, patients take more than one drug to effectively prevent rejection. Therefore, challenges exist in performing human studies evaluating the effects of individual drugs in isolation.
Because this was not a systematic review, the authors may not have identified all relevant articles. However, as one form of validation, the authors identified a few key reviews before conducting the literature search and then ensured these articles appeared in the search as expected. Given the paucity of literature in this area, particularly as it relates to the wound care field, a narrative review adds value to educate and increase awareness when working with individuals on these medications.
With the growing need for immunosuppression, additional study in this field is critical. Future research should investigate newer classes of immunosuppressants in animal models to identify potential pathways to delayed wound healing and potential ways to mitigate such effects. Further, additional high-quality human studies that evaluate both individual and combination immunotherapies are required to better understand the risks and how different immunosuppressants may impact wound healing. To explore immunosuppressants as a potential treatment for chronic or complex wounds, it is important for future studies to be conducted on a large scale and control for confounding clinical factors, such as through randomised controlled trials.
Conclusions
Immunosuppressants range from possibly beneficial to clearly deleterious in terms of wound healing. There is little conclusive evidence in this field, and the effects of immunosuppressants on wound healing are worth exploring further to better tailor immunosuppression to patients at risk for or experiencing chronic, nonhealing wounds. Some immunosuppressants may offer benefits in wound treatment when conventional therapies have failed, opening up the possibility of a new treatment option for wounds.
Acknowledgments
Alberta Innovates High School Youth Research Summer (HYRS) Program, which provided an educational stipend to the lead author for her work on this and other projects.
Conflict of Interest
The authors declare no conflicts of interest.
Funding
The authors have disclosed no financial relationships related to this article.
Examinar a associação entre imunossupressores e a cicatrização de feridas: uma revisão narrativa
Aria Appoo, Brandon L Christensen, Ranjani Somayaji
DOI: 10.33235/wcet.44.3.12-19
Sumário
Objetivo Analisar a forma como as diferentes classes de imunossupressores afetam a cicatrização de feridas.
Fontes de dados Foi efetuada uma pesquisa bibliográfica na PubMed, no Google Scholar e na Biblioteca de Ciências da Saúde da Universidade de Calgary.
Seleção do estudo Inicialmente os investigadores analisaram os títulos dos artigos utilizando palavras-chave como "medicação imunossupressora", "cicatrização de feridas" e "imunossupressão" Se o título e/ou sumário contivessem estas palavras-chave e abordassem a cicatrização de feridas relacionada com medicamentos imunossupressores e ainda tivessem sido publicados após 2000, estes eram incluídos na revisão. Foram incluídos estudos em animais quando não existiam dados humanos disponíveis para um imunossupressor (classe).
Extração de dados Os 61 artigos incluídos foram submetidos a uma revisão e resumo do texto integral.
Síntese de dados: Todos os estudos incluídos foram resumidos descritivamente, incluindo o mecanismo de ação imunossupressor, participantes ou sujeitos do estudo e as evidências dos efeitos na cicatrização de feridas.
ConclusõesOs corticosteróides e os inibidores da rapamicina de alvo mecanicista demonstram, de forma mais consistente, efeitos nocivos na cicatrização de feridas. Relativamente a outras classes de imunossupressores, as evidências são limitadas, encontrando-se descritos efeitos variáveis na cicatrização de feridas. São necessários estudos de maior dimensão e de alta qualidade para se compreender melhor os efeitos dos imunossupressores, incluindo aqueles com novos mecanismos de ação, para identificar os que têm maior impacto na cicatrização de feridas.
Introdução
Os imunossupressores são medicamentos com uma variedade de indicações, incluindo transplantes de órgãos sólidos e hematopoiéticos, bem como para doenças autoimunes. Funcionam suprimindo a atividade de vários dos componentes do sistema imunitário adaptativo, dessa forma diminuindo a cascata de reação inflamatória ao tecido normal do hospedeiro ou modulando a resposta de rejeição natural a materiais transplantados.1 As principais classes de imunossupressores são os corticosteróides/glucocorticóides,2, 3 os inibidores da calcineurina (CNIs),2, 4, 5 os inibidores de alvo mecanístico da rapamicina (mTOR),2,4 os anticorpos policlonais (pAbs),2, 4 os anticorpos monoclonais (mAbs),2, 4 e os agentes antiproliferantes.2 Para efeitos desta revisão, as feridas são definidas como uma abertura na pele resultante de uma cirurgia, traumatismo ou de uma doença suscetível de infeção.
O sistema imunitário desempenha um papel importante na prevenção de infeções, mas também no processo de cicatrização de feridas, com os efeitos inflamatórios a conduzirem à proliferação celular e à secreção de importantes componentes intra e extracelulares.6 Com os imunossupressores, o sistema imunitário é modulado, afetando potencialmente o tempo de cicatrização de uma ferida e a sua suscetibilidade a infecções.7 Com um número crescente de pacientes a tomar medicamentos imunossupressores, particularmente pacientes pós-cirúrgicos de transplantes, o efeito dos imunossupressores na cicatrização de feridas constitui uma questão importante a considerar. Este artigo de revisão tem como objetivo facultar aos clinicos um entendimento da forma como as diferentes classes de imunossupressores afetam a cicatrização de feridas.
Métodos
Os autores efetuaram uma pesquisa bibliográfica utilizando os nomes genéricos de vários imunossupressores comuns (glucocorticóides/corticosteróides, inibidores de mTOR, metotrexato, mAbs, pAbs, CNIs, micofenolato, azatioprina), assim como os termos "cicatrização de feridas" e "imunossupressão" A principal base de dados pesquisada foi a PubMed, complementada pelo Google Scholar e pela base de dados da Biblioteca de Ciências da Saúde da Universidade de Calgary. Sempre que possível, a pesquisa foi formatada da seguinte forma: "nome do imunossupressor [Termos MeSH] E "cicatrização de feridas [Termos MeSH]” Se o nome do imunossupressor não estivesse disponível como um termo MeSH, então o termo foi pesquisado sem qualquer restrição. A pesquisa foi limitada a artigos em inglês publicados entre 2000 e 2021.
Os investigadores analisaram os títulos e os resumos dos artigos para verificar a sua relevância. Os artigos foram considerados relevantes se comparassem vários imunossupressores, discutissem os seus efeitos na cicatrização de feridas e medissem a cicatrização de feridas ou se relatassem efeitos deletérios nas feridas. Se os termos de pesquisa não identificassem quaisquer estudos com participantes humanos, então os autores incluíram estudos que utilizaram animais para avaliar os efeitos imunossupressores de uma determinada classe de fármacos na cicatrização de feridas. Quando não existiam dados disponíveis a partir de 2000, foi realizada uma pesquisa histórica para as medicações imunossupressoras relevantes.
Todos os estudos incluídos foram resumidos descritivamente, incluindo o mecanismo de ação imunossupressor, os participantes/sujeitos do estudo e as evidências dos efeitos na cicatrização de feridas.
Resultados
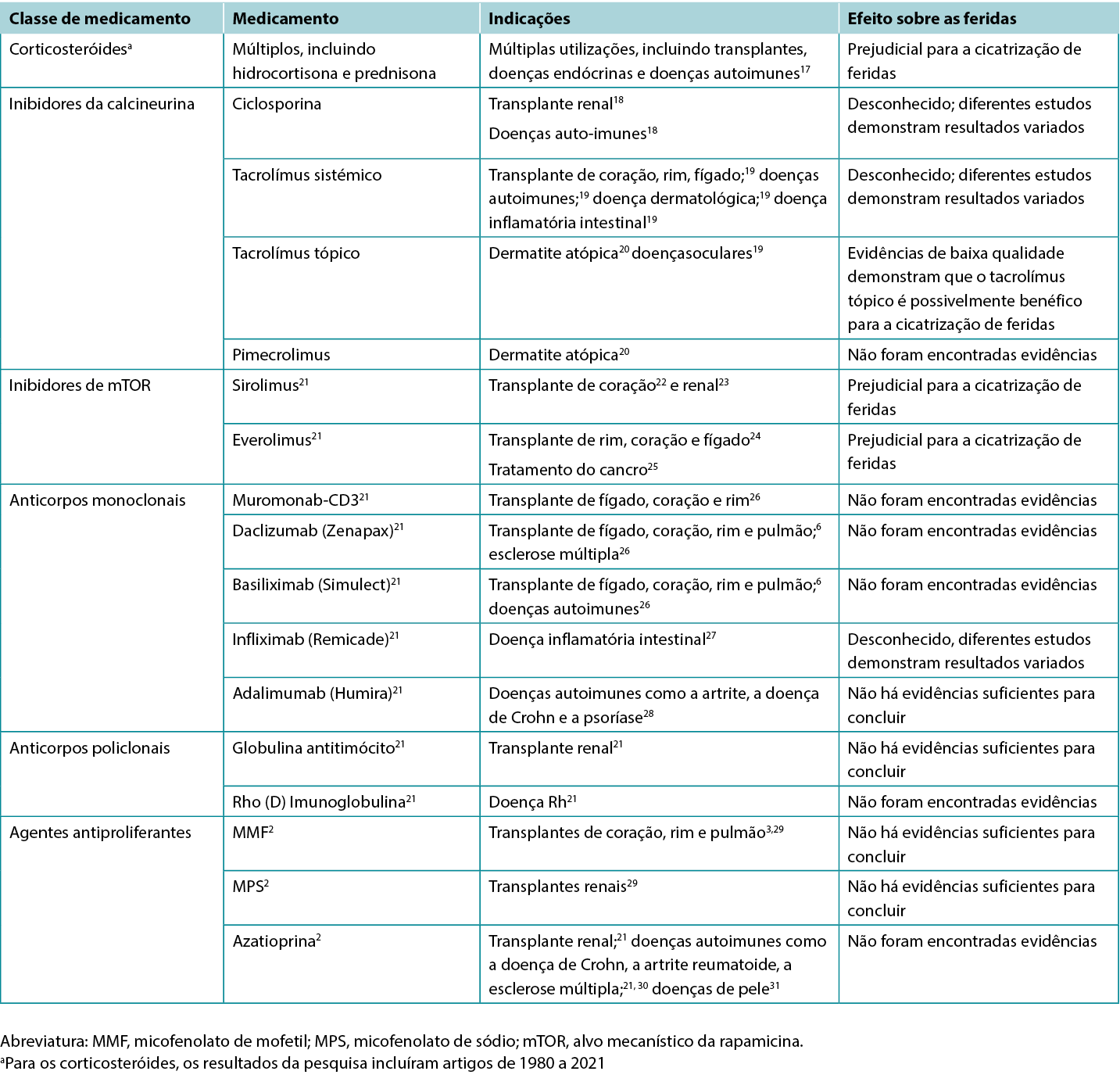
Os autores examinaram 200 títulos e resumos de artigos e destes, 61 artigos foram incluídos na revisão. A Tabela 1 destaca os resultados de estudos clínicos e de estudos de animais selecionados. Na Tabela 2 encontram-se descritas as indicações específicas para vários imunossupressores, incluindo os seus possíveis impactos nas feridas.
Tabela 1. Estudos que comparam os efeitos de diferentes imunossupressores na cicatrização de feridas
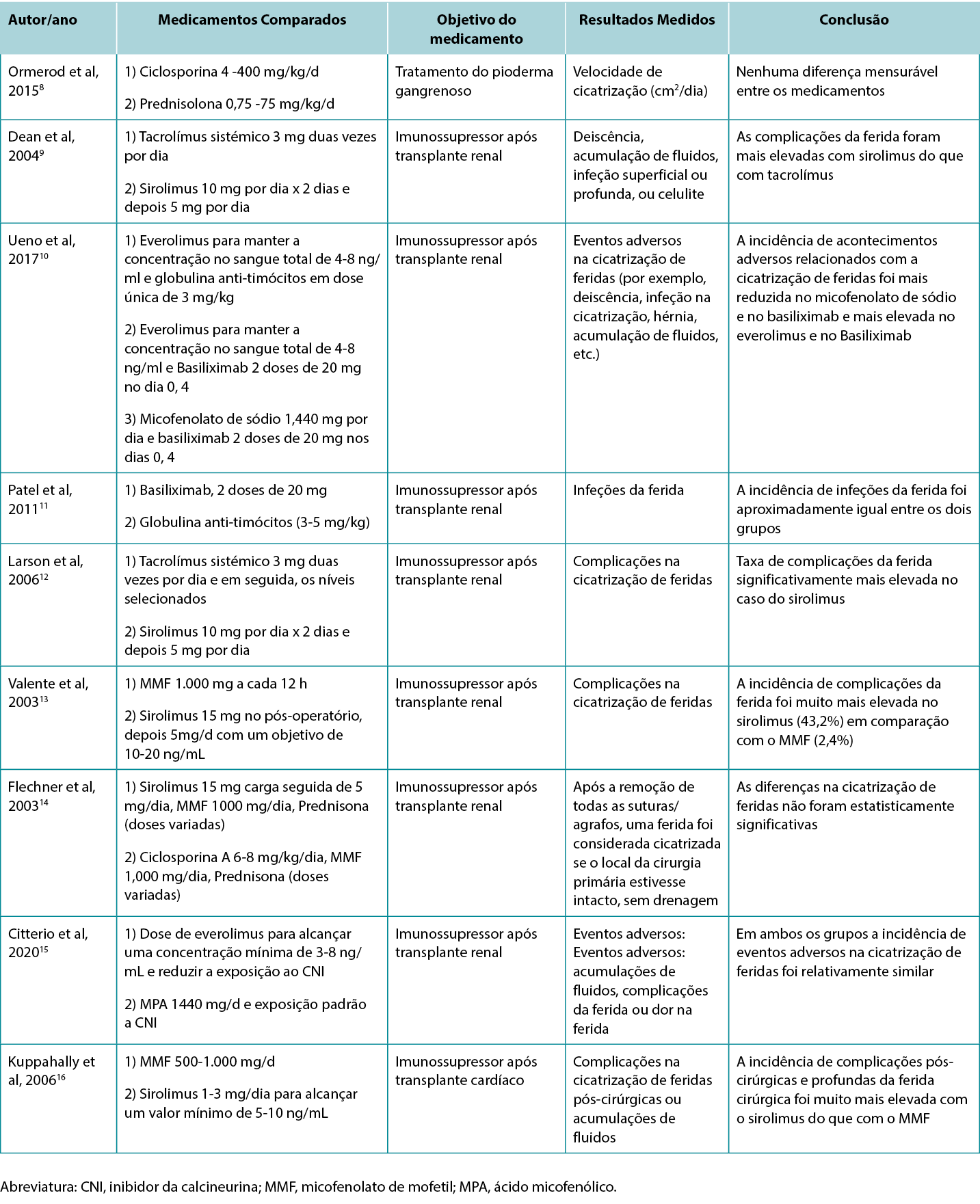
Tabela 2. Visão Geral das Indicações e dos Efeitos nas Feridas de Vários Imunossupressores
Inibidores da calcineurina
Os inibidores da calcineurina (CNI) são utilizados como imunossupressores para uma variedade de doenças autoimunes, transplantes de órgãos, doenças dermatológicas e para feridas crónicas.32 Existem três tipos principais de CNIs: ciclosporina (sistémica), tacrolímus (sistémica e tópica), pimecrolimus (tópica).33 Os CNI actuam ligando-se à parte da molécula de calcineurina que se encontra nas células humanas, impedindo assim a libertação de determinadas citocinas responsáveis pela ativação das células T.32 Por conseguinte, os CNIs desativam um dos principais mecanismos da resposta imunitária adaptativa do organismo.
Sistémico. Faltam estudos que incidam diretamente sobre os efeitos dos CNIs na cicatrização de feridas em seres humanos; no entanto, em animais foram realizados muitos estudos científicos básicos. Dois destes estudos, realizados em ratos, compararam o efeito de várias doses de tacrolímus sistémico versus um controlo, testando a resistência à rutura das feridas criadas através de cirurgia.7, 34 Willems et al7 concluíram que o tacrolímus não afeta a cicatrização de feridas, enquanto Schäffer et al34 concluíram que o tacrolímus é prejudicial à cicatrização de feridas. Num relato de caso que utilizou tacrolímus sistémico como tratamento para úlceras numa pessoa com líquen plano e com pioderma gangrenoso,Miller35 demonstrou o sucesso do tratamento com esta terapêutica.
Em relação ao efeito da ciclosporina na cicatrização de feridas não foram efetuados estudos recentes em seres humanos, sendo que dois estudos realizados em modelos de ratos produziram resultados contraditórios. Estes estudos em ratos centraram-se nos efeitos da ciclosporina em diferentes marcadores do corpo que significam uma cicatrização efetiva das feridas.36, 37 Nemlander et al36 compararam a ciclosporina com a metilprednisolona e concluíram que a ciclosporina A não tinha qualquer efeito supressor em vários marcadores inflamatórios e bioquímicos, em comparação com a terapia com glucocorticóides. Em contraste, Petri et al37 verificaram que a ciclosporina A tinha um efeito negativo noutros marcadores existentes nos fibroblastos de granulação, nomeadamente a activina A entre o procolagénio 1, a integrina 1, a interleucina 6, o fator de crescimento transformador 1 e o fator de crescimento dos queratinócitos. Noutro estudo com animais, Goldberg et al38 atribuíram a cães um de três grupos - sem imunossupressão, metilprednisolona mais azatioprina ou ciclosporina A - após um transplante pulmonar. Verificaram que a ciclosporina A não teve qualquer efeito significativo na cicatrização da ferida cirúrgica, medida pela força de rutura, em comparação com a imunossupressão com glucocorticóides e com azatioprina. Em geral, a literatura sobre os CNIs sistémicos e a cicatrização de feridas é limitada, com uma heterogeneidade de comparativos e com resultados mistos sobre a cicatrização de feridas.
Tópicos. Os inibidores da calcineurina (tacrolímus e pimecrolimus) são utilizados como pomadas tópicas mais frequentemente em doenças dermatológicas como a dermatite atópica, mas também em doenças dermatológicas crónicas como o pioderma gangrenoso.20, 39, 40 Alguns estudos de caso demonstraram que o tacrolímus é eficaz na cicatrização de úlceras complexas das pernas, no contexto de insuficiência venosa ou de necrobiose lipoídica, quando as estratégias de tratamento regulares demonstraram ter sido ineficazes.41, 42 Além disso, um estudo realizado em ratos com lesões cutâneas agudas, demonstrou que as feridas tratadas com tacrolímus tópico cicatrizaram tão rapidamente como o controlo (petrolato).43
Anticorpos monoclonais
Há uma variedade de diferentes terapias com mAb com indicações para transplantes e para doenças auto-imunes, tais como a artrite reumatoide e a psoríase.21 Em geral, os mAbs funcionam ligando-se a diferentes recetores e antigénios para inibir o efeito das citocinas e de outras vias de sinalização que ativam o sistema imunitário.21 Num pequeno estudo de coorte prospetivo entre pacientes com artrite reumatoide submetidos a cirurgia ortopédica, Bibbo e Goldberg44 verificaram que não havia um risco acrescido de infeções da ferida cirúrgica ou de complicações de cicatrização nos pacientes que tomavam infliximab, em comparação com a terapêutica convencional. Além disso, Streit et al45 relataram um caso em que o infliximab tópico foi útil para a cicatrização de úlceras da perna que demonstravam ser resistentes ao tratamento padrão, sugerindo que a inibição do fator de necrose tumoral α é útil para a cicatrização de feridas. Da mesma forma, foi relatado um caso em que o pioderma gangrenoso foi tratado com infliximab, resultando numa melhoria da úlcera.46 A inibição do fator de necrose tumoral α foi ainda associada à cicatrização de feridas em úlceras venosas da perna, através da utilização sistémica de adalimumab.47 No entanto, um estudo que utilizou infliximab em feridas abdominais de ratos concluiu que a resistência à tração era significativamente inferior nas feridas dos ratos que tinham recebido infliximab, em comparação com o controlo.48 De modo geral, a literatura é limitada, mas sugere que os resultados clínicos podem ser favoráveis em termos de cicatrização de feridas.
Anticorpos policlonais
Os anticorpos policlonais (pAbs) são muito semelhantes aos mAbs em termos de função, com um mecanismo de ação ligeiramente diferente.49, 50 Ao contrário dos mAbs, um grupo de pAbs é criado a partir de muitas linhas diferentes de células B e dentro do grupo, sendo que diferentes pAbs ligam-se a diferentes epítopos de um antigénio. Em contraste, os mAbs têm origem em uma única linha de células B e podem ligar-se apenas a um antigénio.49, 50
Existem dois pAbs principais: A globulina anti-timócitos e a globulina imunitária Rho (ρ).21 A globulina anti-timócito, também conhecida como globulina anti-timócitos humanos, é utilizada mais frequentemente como imunossupressor após o transplante renal e atua ligando-se a uma variedade de linfócitos, dessa forma reduzindo o número de células T no organismo.21 A globulina imunitária Rho é utilizada em gestações em que a mãe é Rh- e o feto é Rh+ e essencialmente impede a formação na mãe de anticorpos anti-Rh+.21
Foram encontrados poucos estudos sobre os efeitos dos pAbs na cicatrização de feridas. Dois estudos descreveram os efeitos da globulina anti-timócitos e do Basiliximab. Ueno et al10 investigaram a utilização destes fármacos em combinação com everolimus, em pacientes com transplante renal. Relataram taxas mais elevadas de efeitos adversos na cicatrização de feridas com basiliximab.10 Patel et al11 demonstraram que a incidência de infeções da ferida era igual em pacientes a tomar basiliximab versus globulina anti-timócitos após transplante renal. Os glóbulos brancos desempenham um papel fundamental na cicatrização de feridas, segregando as citocinas necessárias e prevenindo a infecção51; assim, é razoável colocar a hipótese de que a globulina anti-timócitos possa afetar a cicatrização de feridas porque reduz o número de glóbulos brancos e os seus mecanismos reguladores.
Inibidores de mTOR
Os inibidores da rapamicina de alvo mecanístico interagem com proteínas em cadeias de transmissão complexas para dessa forma impedir que as células passem para a fase S do ciclo celular, suprimindo assim a proliferação.3, 21 Embora o mTOR vise predominantemente as células T, também pode afetar as células B.3 Curiosamente, o mTOR pode aumentar a produção de certas citocinas inflamatórias, como a interleucina 6 e diminuir a produção de interleucina 10, uma citocina anti-inflamatória.3 Existem dois inibidores principais de mTOR: o sirolimus e o everolimus.3, 21 Em geral, os inibidores de mTOR têm uma variedade de aplicações, incluindo a terapia do cancro e após transplantes.3,21 O everolimus inibe a proliferação de fibroblastos em modelos in vitro,52 o que sugere que poderá ter consequências negativas na cicatrização de feridas, uma vez que os fibroblastos são essenciais para a criação de uma matriz extracelular e para a construção de suportes para outras células53 Num estudo que comparou o sirolimus e o tacrolímus sistémico, o sirolimus teve uma taxa de complicações da ferida de 47%, enquanto a taxa com o tacrolímus foi de apenas 8%.9 Estes resultados são consistentes com outro estudo de Larson et al12, o qual demonstrou complicações da ferida mais frequentes com o sirolimus, quando comparado com o tacrolímus. Estes autores descobriram que os pacientes com obesidade e que estavam a tomar sirolimus apresentavam taxas muito elevadas de complicações de feridas; como resultado, os autores excluíram do estudo todos os pacientes com obesidade.12 Em linha com descobertas anteriores, um estudo realizado em ratos demonstrou que o aumento das doses de sirolimus diminuía a resistência à rutura.54 Os autores colocaram a hipótese de este efeito poder ser causado por níveis mais baixos de fator de crescimento endotelial vascular e de óxido nítrico em ratos que receberam doses mais elevadas de sirolimus.54 Num artigo de revisão, Nashan e Citterio55 concluíram que os inibidores de mTOR são prejudiciais para a cicatrização de feridas em doses elevadas, mas em doses baixas parecem ter um efeito neutro. Dadas as preocupações iniciais com os inibidores de mTOR e a cicatrização de feridas, os regimes que utilizam estes agentes imunossupressores evoluíram para doses mais baixas dos inibidores de mTOR e para terapia combinada. No grande ensaio aleatório controlado TRANSFORM (Advancing renal TRANSplant eFficacy and safety Outcomes with an eveRoliMus-based regimen), Citterio et al15 compararam o everolimus associado a CNI em dose reduzida com o ácido micofenólico combinado com CNI em dose padrão (tratamento padrão) em pacientes com transplantes renais. Descobriram que os eventos adversos relacionados com a ferida não diferiram entre os grupos (20,6% vs 17,3%; rácio de risco, 1,19; CI 95%, 0,99 a 1,43).15 Uma limitação deste estudo foi a medição rigorosa das concentrações de everolimus e as dificuldades em atingir as concentrações plasmáticas pretendidas, C0 entre 3 e 8 ng/mL.15 Em geral, a literatura atual sugere que os inibidores de mTOR têm um efeito nocivo na cicatrização de feridas, especialmente em doses mais elevadas e que regimes de dosagem melhorados podem permitir diminuir ou atenuar este risco.
Agentes antiproliferantes
Existem três agentes antiproliferantes regularmente utilizados: micofenolato de mofetil (MMF), micofenolato de sódio (MPS) e azatioprina.2, 29 Tanto o MMF como o MPS são inibidores da inosina monofosfato desidrogenase. Em termos do seu mecanismo de imunossupressão têm um efeito semelhante ao dos inibidores de mTOR. No organismo, o MMF e o MPS são convertidos em ácido micofenólico, o qual bloqueia uma parte de uma cadeia crucial na síntese de DNA, para diminuir a proliferação de células T e de células B.2, 5, 29 Pelo seu efeito imunossupressor o MMF é utilizado em transplantes de coração, de rins e de pulmões.3, 29 O MPS é utilizado em transplantes renais.29 A azatioprina é utilizada como fármaco imunossupressor em transplantes renais e em doenças autoimunes, incluindo artrite reumatoide, a doença de Crohn e a esclerose múltipla.21, 30 No organismo, a azatioprina reage com o glutatião e é convertida em 6-mercaptupurina. São então gerados metabolitos adicionais, os quais acabam por bloquear a síntese de purinas e a estimulação das células T.3, 21
Num estudo que comparou duas doses diferentes de MMF em recetores de transplante renal, Flechner et al56 não encontraram qualquer diferença significativa na incidência de feridas que necessitassem de intervenção cirúrgica, de forma semelhante às feridas tratadas com cuidados locais. Ao analisar os títulos dos artigos para a presente revisão, os autores não encontraram quaisquer estudos relativos ao efeito exclusivo da azatioprina relativamente à cicatrização de feridas externas em seres humanos. No entanto, Ginestal et al57 num estudo com ratos compararam os efeitos da azatioprina com os de um placebo. Descobriram que as feridas dos ratos que tomavam azatioprina demoravam mais tempo a cicatrizar do que as dos que tomavam placebo, o que sugere que a azatioprina pode ter efeitos prejudiciais na cicatrização de feridas, mas não é claro até que ponto poderia afetar os seres humanos.57
Antimetabolito
O metotrexato é um agente imunossupressor antagonista do folato frequentemente utilizado, com indicações em muitas doenças reumatológicas. Em doses mais elevadas tem também atividade antineoplásica. Ao ser absorvido, entra na célula e é convertido em poliglutamatos de metotrexato, passando a competir com a dihidrofolato redutase, impedindo assim a transformação do ácido fólico que é utilizado na produção dos ácidos nucleicos.6 À semelhança de outros dos agentes descritos, existem estudos experimentais em animais, com estudos in vitro, que sugerem uma diminuição da cicatrização de feridas, mas estes efeitos não foram confirmados em estudos clínicos, nomeadamente em feridas pós-cirúrgicas.6 Por esta razão, recomenda-se a continuação deste fármaco no pós-operatório.
Corticosteróides/Glucocorticóides
Os glucocorticóides impedem a formação de substâncias químicas inflamatórias, como as citocinas, as moléculas de adesão celular e os fatores do complemento.3 Ao inibir a formação de interleucina 2, os glucocorticóides também impedem a proliferação e a ativação das células T.21 Também afetam os monócitos e as células B.3, 21 Os glucocorticóides foram o primeiro fármaco anti-rejeição criado, mas, com o passar do tempo, tem existido uma tendência para gradualmente os eliminar devido aos seus graves efeitos secundários.3, 21 É consensual que os glucocorticóides são altamente prejudiciais para a cicatrização de feridas, uma vez que, entre outros, interferem com muitas fases-chave da cicatrização de feridas, tais como a deposição e a síntese de colagénio, angiogénese, proliferação de fibroblastos, fatores de crescimento e a fagocitose.2,3,58,59
Considerações práticas para os prestadores de cuidados de saúde
As pessoas com sistemas imunitários comprometidos (devido a medicamentos, comorbilidades ou extremos etários) requerem considerações adicionais para a gestão de feridas crónicas. Especificamente em relação às medicações imunossupressoras, os prestadores de cuidados de saúde devem elaborar um historial cuidadoso não só dos medicamentos e da dosagem (incluindo alterações na mesma), mas também das doenças subjacentes que possam requerer estes medicamentos (por exemplo, doenças autoimunes, transplante de órgãos). Uma vez que muitas medicações imunossupressoras podem prejudicar a cicatrização de feridas, é fundamental que numa fase inicial os prestadores de cuidados de saúde avaliem o potencial de cicatrização, para poderem definir e gerir as expectativas dos pacientes. Dada a complexidade acrescida destes indivíduos, será essencial uma abordagem baseada em equipas e um encaminhamento precoce para especialistas médicos ou cirúrgicos para auxiliar nos cuidados de feridas. Nalguns casos em que as feridas não estão a cicatrizar, pode ser necessário definir objetivos alternativos para o tratamento da ferida (por exemplo, manutenção ou não cicatrização) se as doses de imunossupressores não puderem ser reduzidas (partindo do princípio de que estão a contribuir para uma cicatrização deficiente), o qual deverá ser realizado em consulta com os seus prestadores de cuidados primários ou especializados. À medida que os indivíduos e as populações com comorbilidades vivem durante mais tempo, cuidar de pessoas com feridas crónicas que também tomam medicações imunossupressoras tornar-se-á cada vez mais comum e deverá ser reconhecido de forma proactiva pelos clínicos responsáveis pelos cuidados de feridas.
Discussão
Devido aos avanços contínuos da medicina, aumentou a necessidade de imunossupressão no contexto de transplantes, doença autoimune e de malignidades. Esta revisão realça a escassez de estudos sólidos neste domínio e os efeitos mistos de várias imunossupressões na cicatrização de feridas. Existem evidências da elevada qualidade na cicatrização de feridas relativamente aos efeitos deletérios da terapêutica com glucocorticoides, bem como da terapêutica com mTOR (em particular o sirolimus). Além disso, quando 4 estudos compararam o sirolimus com o MMF ou com o tacrolímus sistémico, todos os estudos demonstraram que o sirolimus estava associado a um aumento da incidência de complicações da ferida.9, 12, 13, 16
A literatura sobre agentes como os CNIs sistémicos é mista, com alguns a sugerir efeitos adversos nas feridas e outros a sugerir benefícios; é necessária investigação adicional centrada nesta questão. Os mais recentes CNIs tópicos demonstraram ter pouco impacto na cicatrização retardada de feridas e, em alguns casos, podem beneficiar a cicatrização, mas é necessária uma investigação adicional para a sua utilização direta em feridas crónicas. Os estudos indicam que os agentes antiproliferantes, os antimetabolitos e os novos mABs não têm um impacto negativo na cicatrização de feridas. No entanto, dada a escassez das evidências sobre a cicatrização de feridas na terapia com mAB são necessários estudos adicionais.
De um modo geral, as provas neste domínio são limitadas e permitem tirar conclusões variáveis sobre os efeitos dos imunossupressores na cicatrização de feridas. Em particular, poucos estudos incluíram participantes humanos. Em geral, quando após os transplantes são prescritos imunossupressores como prevenção da rejeição, os pacientes tomam mais do que um medicamento para prevenir eficazmente a rejeição. Por conseguinte, existem desafios na realização de estudos em seres humanos que possam permitir avaliar os efeitos de medicamentos específicos separadamente.
Como não se tratou de uma revisão sistemática, os autores poderão não ter identificado todos os artigos relevantes. No entanto, como forma de validação, os autores identificaram algumas revisões-chave antes de efetuarem a pesquisa bibliográfica e, em seguida, certificaram-se de que esses artigos estavam incluídos na pesquisa como esperado. Além disso, dada a escassez de literatura nesta área, particularmente no que diz respeito ao campo dos cuidados de feridas, uma revisão narrativa acrescenta valor, para educar e aumentar a sensibilização, quando se trabalha com indivíduos que tomam esta medicação.
Considerando a crescente necessidade de imunossupressão, é fundamental um estudo adicional neste domínio. A investigação futura deve investigar novas classes de imunossupressores em modelos animais para identificar potenciais causas para o atraso na cicatrização de feridas e potenciais formas de atenuar esses efeitos. Além disso, são necessários mais estudos de alta qualidade para avaliar imunoterapias individuais e combinadas, para compreender melhor os riscos e a forma como os diferentes imunossupressores poderão afetar a cicatrização de feridas. A fim de explorar os imunossupressores como um potencial tratamento para feridas crónicas ou complexas, é importante que os estudos futuros sejam conduzidos em maior escala e que controlem os fatores clínicos de interferência, por exemplo, através de ensaios de controlo aleatórios.
Conclusões
Os imunossupressores variam de possivelmente benéficos a claramente deletérios em termos de cicatrização de feridas. Embora neste campo existam poucas evidências conclusivas, vale a pena explorar os efeitos dos imunossupressores na cicatrização de feridas, de forma a poder adaptar melhor a imunossupressão aos pacientes em risco ou com feridas crónicas que não cicatrizam. Alguns imunossupressores podem oferecer benefícios no tratamento de feridas quando as terapias convencionais falharam, abrindo a possibilidade de uma nova opção de tratamento de feridas.
Agradecimentos
Alberta Innovates High School Youth Research Summer (HYRS) Program, que concedeu uma bolsa de estudo à autora principal pelo seu trabalho neste e em outros projetos.
Conflito de Interesses
Os autores declaram não existirem conflitos de interesse.
Financiamento
Os autores não revelaram quaisquer relações financeiras relacionadas com este artigo.
Author(s)
Aria Appoo
Medical Student, University of Oxford, Oxford, United Kingdom
Brandon L Christensen*
MD
Resident Physician, Division of Infectious Diseases
University of Calgary, Alberta, Canada
Ranjani Somayaji
BScPT MD MPH
Assistant Professor, Departments of Medicine, Microbiology
Immunology and Infectious Disease and Community Health Sciences
* Corresponding author
References
- Fireman M, DiMartini AF, Armstrong SC, Cozza KL. Immunosuppressants. Psychosomatics 2004;45(4):354-60.
- Taylor AL, Watson CJE, Bradley JA. Immunosuppressive agents in solid organ transplantation: mechanisms of action and therapeutic efficacy. Crit Rev Oncol Hematol 2005;56(1):23-46.
- Weltz A, Scalea J, Popescu M, Xu J, Bromberg JS. Mechanisms of immunosuppressive drugs. In: Kidney Transplantation. New York: Springer; 2014:127-42.
- Subramanian S, Trence DL. Immunosuppressive agents: effects on glucose and lipid metabolism. Endocrinol Metab Clin North Am 2007;36(4):891-905.
- Mika A, Stepnowski P. Current methods of the analysis of immunosuppressive agents in clinical materials: a review. J Pharm Biomed Anal 2016;127:207-31.
- Pountos I, Giannoudis P V. Effect of methotrexate on bone and wound healing. Expert Opin Drug Saf 2017;16(5):535-45.
- Willems MCM, van der Vliet JA, Lomme RMLM, Hendriks T. Tacrolimus does not affect early wound healing in a rodent model of bowel anastomoses and abdominal wall closure. PLoS One 2013;8(9):e76348.
- Ormerod AD, Thomas KS, Craig FE, et al. Comparison of the two most commonly used treatments for pyoderma gangrenosum: results of the STOP GAP randomised controlled trial. BMJ 2015;350:h2958.
- Dean PG, Lund WJ, Larson TS, et al. Wound-healing complications after kidney transplantation: a prospective, randomized comparison of sirolimus and tacrolimus. Transplantation 2004;77(10):1555-61.
- Ueno P, Felipe C, Ferreira A, et al. Wound healing complications in kidney transplant recipients receiving everolimus. Transplantation 2017;101(4):844-50.
- Patel S, Pankewycz O, Kohli R, et al. Obesity in renal transplantation: the role of induction therapy on long-term outcomes. Transplant Proc 2011;43(2):469-71.
- Larson TS, Dean PG, Stegall MD, et al. Complete avoidance of calcineurin inhibitors in renal transplantation: a randomized trial comparing sirolimus and tacrolimus. Am J Transplant 2006;6(3):514-22.
- Valente JF, Hricik D, Weigel K, et al. Comparison of sirolimus vs. mycophenolate mofetil on surgical complications and wound healing in adult kidney transplantation. Am J Transplant 2003;3(9):1128-34.
- Flechner SM, Zhou L, Derweesh I, et al. The impact of sirolimus, mycophenolate mofetil, cyclosporine, azathioprine, and steroids on wound healing in 513 kidney-transplant recipients. Transplantation 2003;76(12):1729-34.
- Citterio F, Henry M, Kim DY, et al. Wound healing adverse events in kidney transplant recipients receiving everolimus with reduced calcineurin inhibitor exposure or current standard-of-care: insights from the 24 month TRANSFORM study. Expert Opin Drug Saf 2020;19(10):1339-48.
- Kuppahally S, Al-Khaldi A, Weisshaar D, et al. Wound healing complications with de novo sirolimus versus mycophenolate mofetil-based regimen in cardiac transplant recipients. Am J Transplant 2006;6(5Pt1)986-92.
- Kapugi M, Cunningham K. Corticosteroids. Orthop Nurs 2019;38(5):336-9.
- Ponticelli C. Cyclosporine: from renal transplantation to autoimmune diseases. Ann N Y Acad Sci 2005;1051(1):551-8.
- Akar Y, Yucel G, Durukan AH, Yucel I, Arici G. Systemic toxicity of tacrolimus given by various routes and the response to dose reduction. Clin Exp Ophthalmol 2005;33(1):53-9.
- Frazier W, Bhardwaj N. Atopic dermatitis: diagnosis and treatment. Am Fam Physician 2020;101(10):590-8.
- Khan MM. Immunopharmacology. New York, NY: Springer US; 2008.
- Kurian K, Addisu A. Sirolimus: a novel immunosuppressive drug in heart transplantation. Recent Pat Cardiovasc Drug Discov 2009;4(3):187-91.
- Sehgal SN. Sirolimus: its discovery, biological properties, and mechanism of action. Transplant Proc 2003;35(3):S7-14.
- Van Gelder T, Fischer L, Shihab F, Shipkova M. Optimizing everolimus exposure when combined with calcineurin inhibitors in solid organ transplantation. Transplant Rev 2017;31(3):151-7.
- Falkowski S, Woillard JB. Therapeutic drug monitoring of everolimus in oncology: evidences and perspectives. Ther Drug Monit 2019;41(5):568-74.
- National Institutes of Diabetes and Digestive and Kidney Diseases. Clinical and Research Information on Drug-Induced Liver Injury. LiverTox. 2012. February 5, 2024. https://www.ncbi.nlm.nih.gov/books/NBK547852/. Last accessed January 25, 2024.
- Lichtenstein L, Ron Y, Kivity S, et al. Infliximab-related infusion reactions: systematic review. J Crohns Colitis 2015;9(9):806-15.
- Tracey D, Klareskog L, Sasso EH, Salfeld JG, Tak PP. Tumor necrosis factor antagonist mechanisms of action: a comprehensive review. Pharmacol Ther 2008;117(2):244-79.
- Staatz CE, Tett SE. Clinical Pharmacokinetics and pharmacodynamics of mycophenolate in solid organ transplant recipients. Clin Pharmacokinet 2007;46(1):13-58.
- Casetta I, Iuliano G, Filippini G. Azathioprine for multiple sclerosis. Cochrane Database Syst Rev 2007;2007(4):CD003982.
- Chavez-Alvarez S, Herz-Ruelas M, Villarreal-Martinez A, Ocampo-Candiani J, Garza-Garza R, Gomez-Flores M. Azathioprine: its uses in dermatology. An Bras Dermatol 2020;95(6):731-6.
- Azzi JR, Sayegh MH, Mallat SG. Calcineurin inhibitors: 40 years later, can’t live without. J Immunol 2013;191(12):5785-91.
- Safarani OA, Patel J. Calcineurin Inhibitors. StatPearls Publishing; 2021.
- Schäffer MR, Fuchs N, Proksch B, Bongartz M, Beiter T, Becker HD. Tacrolimus impairs wound healing: a possible role of decreased nitric oxide synthesis. Transplantation 1998;65(6):813-8.
- Miller S. The effect of tacrolimus on lower extremity ulcers: a case study and review of the literature. Wound Manag Prev 2008;54(4):36-42.
- Nemlander A, Ahonen J, Wiktorowicz K, et al. Effect of cyclosporine on wound healing an analysis with viscous cellulose sponges. Transplantation 1983;36(1):1-5.
- Petri J, Schurk S, Gebauer S, Haustein U. Cyclosporine A delays wound healing and apoptosis and suppresses activin beta-A expression in rats. Eur J Dermatol 1998;8(2):104-13.
- Goldberg M, Lima O, Morgan E, et al. A comparison between cyclosporin A and methylprednisolone plus azathioprine on bronchial healing following canine lung autotransplantation. J Thorac Cardiovasc Surg 1983;85(6):821-6.
- Sussman G. The use of topical calcineurin inhibitors in chronic wound management. Wound Pract Res 2000;26(3):140-5.
- Lyon C, Stapleton M, Smith A, Mendelsohn S, Beck M, Griffiths C. Topical tacrolimus in the management of peristomal pyoderma gangrenosum. J Dermatol Treat 2001;12(1):13-7.
- Ginocchio L, Draghi L, Darvishian F, Ross FL. Refractory ulcerated necrobiosis lipoidica: closure of a difficult wound with topical tacrolimus. Adv Skin Wound Care 2017;30(10):469-72.
- Mackelfresh J, Soon S, Arbiser JL. Combination therapy of doxycycline and topical tacrolimus for venous ulcers. JAMA Dermatol 2005;141(11):1476-7.
- Namkoong S, Chung J, Yoo J, et al. Topical tacrolimus does not negatively impact acute skin wound healing. Exp Dermatol 2013;22(5):369-71.
- Bibbo C, Goldberg JW. Infectious and healing complications after elective orthopaedic foot and ankle surgery during tumor necrosis factor-alpha inhibition therapy. Foot Ankle Int 2004;25(5):331-5.
- Streit M, Beleznay Z, Braathen LR. Topical application of the tumour necrosis factor-alpha antibody infliximab improves healing of chronic wounds. Int Wound J 2006;3(3):171-9.
- Hewitt D, Tait C. Use of infliximab in pyoderma gangrenosum. Australas J Dermatol 2007;48(2):95-8.
- Fox JD, Baquerizo-Nole KL, Keegan BR, et al. Adalimumab treatment leads to reduction of tissue tumor necrosis factor-alpha correlated with venous leg ulcer improvement: a pilot study. Int Wound J 2016;13(5):963-6.
- De Lopes JV, Freitas LAM, Marques RD, Bocca AL, de Sousa JB, de Oliveira PG. Analysis of the tensile strength on the healing of the abdominal wall of rats treated with infliximab. Acta Cir Bras 2008;23(5):441-6.
- Larrañaga MD, Lewis S, Richard J, Robert A, eds. Polyclonal antibodies. In: Hawley’s Condensed Chemical Dictionary. 16th ed. Hoboken, NJ: Wiley; 2016.
- Johnson M. Monoclonal antibodies. In: Longe JL, ed. Gale Encyclopedia of Nursing and Allied Health. 4th ed. Credo Reference; 2018.
- Kordestani SS. Wound healing process. In: Atlas of Wound Healing. Abyaneh MS, Fayyazbakhsh F, eds. Elsevier; 2019:11-22.
- Azzola A, Havryk A, Chhajed P, et al. Everolimus and mycophenolate mofetil are potent inhibitors of fibroblast proliferation after lung transplantation. Transplantation 2004;77(2):275-80.
- Bainbridge, P. Wound healing and the role of fibroblasts. J Wound Care, 2013;22(8):407-412.
- Schäffer M, Schier R, Napirei M, Michalski S, Traska T, Viebahn R. Sirolimus impairs wound healing. Langenbecks Arch Surg 2007;392(3):207-303.
- Nashan B, Citterio F. Wound healing complications and the use of mammalian target of rapamycin inhibitors in kidney transplantation. Transplantation 2012;94(6):547-61.
- Flechner SM, Feng J, Mastroianni B, et al. The effect of 2-gram versus 1-gram concentration controlled mycophenolate mofetil on renal transplant outcomes using sirolimus-based calcineurin inhibitor drug-free immunosuppression. Transplantation 2005;79(8):926-34.
- Ginestal R, Pérez-Köhler B, Pérez-López P, et al. Comparing the influence of two immunosuppressants (fingolimod, azathioprine) on wound healing in a rat model of primary and secondary intention wound closure. Wound Repair Regen 2019;27(1):59-68.
- Wicke C. Effects of steroids and retinoids on wound healing. Arch Surg 2000;135(11):1265-70.
- Anstead G. Steroids, retinoids, and wound healing. Adv Wound Care (New Rochelle) 1998;11(6):277-85.



