Volume 39 Number 3
Application of irrigation and negative pressure wound therapy (INPWT) to treat diabetic foot gangrene: a case report
Ai-hua Chen, Huiling Liu, Chunmei Zhang and Ping Zou
Keywords negative pressure wound therapy, Diabetic foot gangrene, irrigation, moist dressing
For referencing Chen A et al. Application of irrigation and negative pressure wound therapy (INPWT) to treat diabetic foot gangrene: a case report. WCET® Journal 2019; 39(3):20–25
DOI https://doi.org/10.33235/wcet.39.3.20-25
Abstract
This case study summarises the treatment of a patient with diabetic foot gangrene. By undergoing irrigation and negative pressure wound therapy (INPWT) with moist dressing, foot amputation was avoided. The treatment process included: the comprehensive assessment of systemic and local condition; choosing suitable debridement such as sharp surgical debridement; preventing the spread of infection; applying INPWT to reduce endotoxin absorption; and active treatments of primary disease such as controlling blood sugar and blood pressure, and improving microcirculation and nutrition. After 2 months of vigorous INPWT, the patient’s wound bed improved. After the application of a moist dressing, the wound closed and healed successfully at 3 months.
Introduction
The global prevalence of diabetes mellitus is 8.5%, with roughly 90% of cases being type 2 diabetes1,2. Over the last several decades, the prevalence of diabetes has drastically increased worldwide – with rates quadrupling since 19802. This can be attributed to a quickly aging population, general population growth, and increased incidences of obesity. It is estimated that there will be nearly 550 million people with diabetes globally by 2030, making diabetes a key public health issue and a global concern. China currently houses the most diabetics in the world. According to the latest epidemiological survey conducted by the National Health Committee in 2018, 11.6% of the Chinese population has diabetes, totalling 114 million people. Furthermore, China has a low treatment rate (32.2%) and control rate (49.2%), resulting in many incidences of complications, including the risk of heart disease, stroke, blindness, kidney failure and amputation. These complications have serious consequences on the quality of life of patients.
One of the most prevalent comorbidities of diabetes is foot ulcers. The World Health Organization (WHO) classifies a diabetic foot disease as a foot infection, ulcer and/or deep tissue damage related to local nerve abnormality and lower limb distal peripheral vascular pathological changes3. The incidence of foot ulcers in individuals with diabetes is 6.3%, with a lifetime incidence of between 19–34% in this population4,5. A main concern with foot ulcers in people with diabetes is the prolonged period the wound takes to heal. The likelihood of the wounds healing decreases in diabetics due to a number of factors, including circulatory dysfunction, hyperglycaemia, neuropathy, hypoxia and impaired neuropeptide signalling, as well as comorbidities such as end-stage kidney disease, congestive heart failure and peripheral artery disease4,6. Many of these factors contributed to the initial development of the diabetic foot ulcers. Additional factors that advance ulcer development include a high body mass index, foot deformity, being of the male gender, prolonged infliction of diabetes, advanced age, and poor foot self-care habits7.
For individuals with diabetic foot ulcers, the infection rate is over 50%8. Infection is a process comprised of invading microorganisms, the body’s inflammatory response to the invasion, and tissue degradation and destruction9. Factors that contribute to an infection in an individual with diabetic foot ulcers include wounds that last longer than 30 days, deep wounds, wounds that were caused traumatically, and wounds that are comorbid with peripheral arterial disease8,9.
Additionally, if diabetic foot ulcers become infected they may progress to gangrene10. Diabetic foot gangrene is the final stage of diabetic foot disease, which is often comorbid with nerve and vascular lesions of other organs2. Infections can include osteomyelitis, cellulitis, abscesses, fasciitis or septic arthritis11. These infections can be caused by both fungi and bacteria such as Staphylococcus, Proteobacteria, Pseudomonas aeruginosa, Streptococcus and coliform bacteria10.
Due to infection and slow healing times, diabetic foot ulcers may eventually lead to the need for amputation; individuals with diabetic foot ulcers are 10–20 times more likely to need amputation compared with their non-diabetic counterparts2,7. Amputation can lead to additional complications – the 5-year survival rate post-amputation is 30% for individuals with diabetes4. One study found that amputation rates were around 46–78% for moderate to severe infections respectively8.
Infection is generally managed through antibiotic therapy, surgical intervention and wound debridement8,11. Other adjunct therapies used with these methods include negative pressure wound therapy (NPWT) and hyperbaric oxygen therapy. Comprehensive treatment and local management of diabetic foot gangrene is therefore important to reduce the amputation rate of patients with diabetic foot disease, to maintain foot function and mobility, and to improve the quality of life for individuals afflicted with diabetic foot disease12.
NPWT is a form of wound management wherein negative pressure is exhibited across the entire surface area of the wound and is maintained by a dressing that is sealed and connected via a tube to an external vacuum. It acts to bring the edges of the wound together in healing – this promotes granulation tissue formation, reduces oedema, thereby increasing microcirculation, and removes small debris and exudate via suction13. This therapy can be combined with other approaches, such as instillation, which delivers a controlled amount of a cleansing solution – such as antiseptics or antibiotics – in order to treat diabetic foot infections13,14.
In May 2016, a case of Wagner IV diabetic foot gangrene was admitted to our hospital. This paper will explore the clinical history of the patient, patient assessment and treatment. After 3 months of treatment, the patient’s wound was healed successfully, and foot amputation was avoided.
Case report
Clinical history and assessment
The patient was an 88-year-old male who was admitted to the hospital on 22 May 2016. He had experienced polydipsia and polyuria for more than 3 years. Upon physical examination, the patient had a temperature of 37.8oC, pulse of 84 beats/min, and blood pressure of 160/90 mmHg. The patient appeared alert and oriented. The patient had a fasting blood glucose of 11 mmol/L, haemoglobin of 110 g/L, albumin level of 38.1 g/L, and a white blood cell count of 11x109/L.
The right side of dorsalis pedis artery pulse was weak and the front of his right foot appeared black–purple in colour. The patient’s first and second toe were missing on the right foot, with toes three, four and five appearing purple–black with necrosis. Tissue was only partially connected with the plantar skin. Yellowish tissue covered 100% of the wound bed, with large amounts of grey, purulent, malodourous exudate at the wound site indicating severe infection. The edge of wound was irregular with oedema, high skin temperature and appeared purple–black. The patient’s skin temperature on his right lower limb was higher than that of the left lower limb. The wound was classified as a Wagner Grade 4. On a numeric rating scale, pain was scored by the patient as eight out of 10 on a scale where 0 is no pain and 10 the worse pain.
The patient’s admission diagnosis was as follows: type II diabetes mellitus and diabetic foot gangrene and infection; coronary atherosclerotic heart disease with unstable angina, with a chronic non-ST segment elevations myocardial infarction event 2 years previously, arrhythmia, and third stage of paroxysmal atrial fibrillation; hypertension level 3 (high risk); cerebral infarction sequela; and artery plaque formation in double lower limbs. The doctor recommended amputation of the foot, but the patient refused.
In June 2016 the patient was referred to an enterostomal (ET) nurse for foot treatment and wound care. The patient had right femoral artery stenosis (90%) and popliteal artery and posterior tibial artery stenosis (61%, 80%). A right lower extremity artery stent was implanted, which was in place for 5 months, and resulted in positive postoperative arterial blood flow. After a comprehensive assessment, the ET nurse found no contraindications in the patient to NPWT. This is the first case of using irrigation and NPWT (INPWT) in this large hospital to treat diabetic foot ulcer. Factors affecting wound healing in the patient were being of an older age, and having a variety of comorbidities such as diabetes, cardiovascular disease, poor nutrition, long-term chronic disease as well as poor mental health.
Systemic treatment
As outlined above, the treatment process included preventing the spread of infection, as well as active treatments of primary disease such as controlling blood sugar and blood pressure, and improving microcirculation and nutrition.
The goal for wound healing rate is 0.2 cm per week, but when the wound bacterial count is at or above 106/mm2, healing speed is expected to decrease to 0.055 cm/week. The more serious a bacterial infection, the slower wound healing is to be expected3. It is therefore vital to have systemic infection control practices in place when performing local wound management. The patient was prescribed a peracillin sodium intravenous infusion at a rate of 2.5 g once per 8 hours. Wound cultures showed growth of Staphylococcus aureus and Pseudomonas aeruginosa, suggesting the need for ofloxacin; therefore, a levofloxacin sodium chloride injection of 0.4 g was given through intravenous infusion once a day for 1 week. The patient’s temperature was normal, and his condition was stable.
To control blood glucose, phosphate sieglidine tablets at a dosage of 100 mg were given orally once a day. The patient was also prescribed acarbosaccharides (baicana) 50 mg orally three times a day, which helped control his fasting blood glucose at 7 mmol/l and postprandial blood glucose around 10 mmol/l.
To reduce blood pressure, the patient was given amberyl mertolol (betatolak) 47.5 mg orally once a day, mononitrate isosorbate sustained-release capsule (isole) 50 mg orally once a day, and valsartan lodipine (combination of amlodipine 5 mg and valsartan 80) one tablet orally once every 12 hours, which kept blood pressure at 130/80 mmHg.
The patient was given pancreatopeptidase (yi-open) 240 units orally three times daily to increase local blood circulation and promote wound healing. The patient had anaemia, low protein, and other nutritional deficiencies which affected wound healing. To counterbalance this, the patient was given a high protein and high vitamin diet which was distributed via small meals under the precondition of controlling blood sugar.
Wound management process
To manage the wound, the inactivated tissue was removed to prevent the spread of infection. Necrotic tissues and microorganisms were also removed to prevent the absorption of toxins. To promote granulation growth, the patient’s dead bone tissue was also excised, and the sinus cavity was closed. Eschar was removed to repair the wound edge and promote epithelium creep. The edges of the wound were trimmed to protect granulation and epithelial tissue. Skin moisturisers were used around the wound to promote blood circulation.
At initial wound management (28 June 2016), an iodine solution was used to disinfect the wound, and a sodium chloride solution was used to rinse the wound. Tissue cultures were taken from the wound to assist in guiding antimicrobial therapy. Surgical debridement was used to remove senescent cells and decrease bacterial burden. INPWT was then applied to the wound. The irrigation liquid that was used was 0.01% iodide normal saline (NaCl 500ml+5% iodide 10 ml), with a speed of 20 drops per min. The negative pressure was kept between 80–125 mmHg (Figure 1).
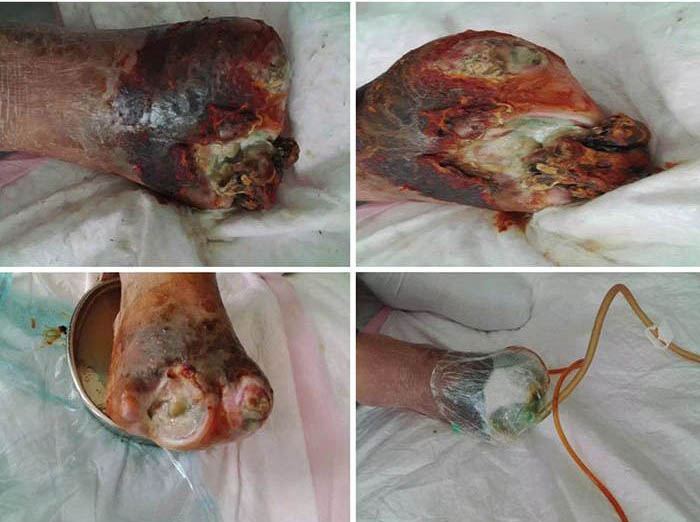
Figure 1. Initial stage of wound management (28 June 2016).
At the second stage of wound management (5 July), the wound bed was 50% erythematous and 50% yellowish (Figure 2). The wound continued to have a foul odour, with oedema around the wound, dark pigmentation, and edge impregnation. Treatment included continued debridement, and other methods as stated before. INPWT was also continued.
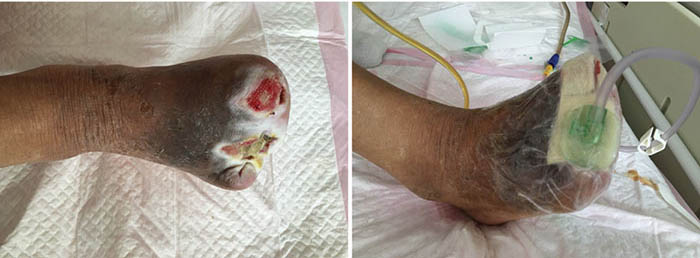
Figure 2. Second stage of wound management (5 July 2016).
At third stage management (8 July), after the removal of the dead bone, sinus cavities 3.5 cm and 2.5 cm in depth were found in the first and third digits respectively (Figure 3). The total size of wound was 3x7.5 cm. To heal the wounds, conservative debridement was applied, with washing of the sinus cavities and an implanted sponge to ensure that washing fluid reached the bottom of the sinus cavity without leaving a dead cavity. Continued INPWT was used in the treatment.
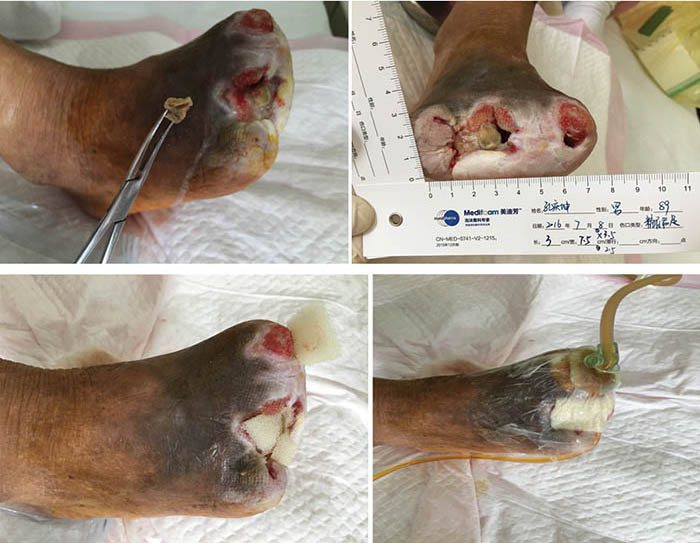
Figure 3. Third stage of wound management (8 July 2016).
After roughly 6 weeks of treatment, at ninth stage of wound management (12 August), the sinus cavity in the first toe closed (Figure 4). The wound bed was fully erythematous. The wound was managed with continued conservative debridement using NPWT; however, irrigation was discontinued.
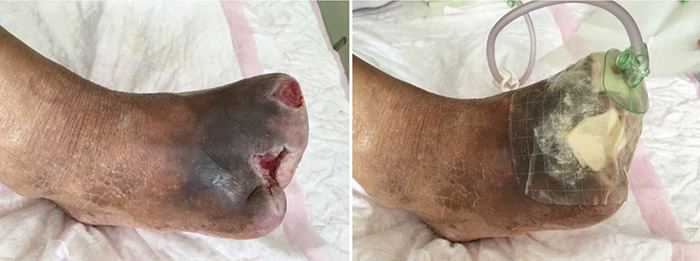
Figure 4. Ninth stage of wound management (12 August 2016).
At the 12th stage of wound management (23 August), the wound bed continued to be fully erythematous (Figure 5). The edges of the wound were macerated, and the wound no longer smelled foul. Conservative debridement to remove necrotic tissue was applied. NPWT was stopped and treatment was switched to moist dressings. A hydrocolloid film was applied to the inner later of the dressing to promote epithelisation, while a silicon foam dressing was applied to the outer layer to promote the absorption of exudate.
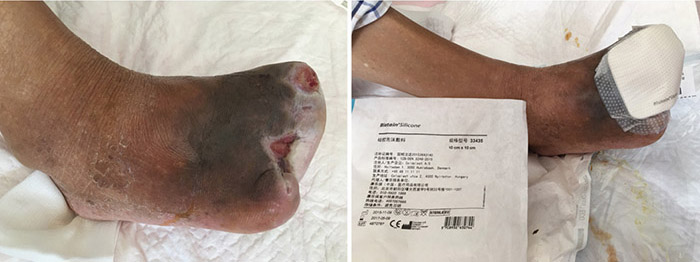
Figure 5. Twelfth stage of wound management (23 August 2016).
At the 15th stage of wound management at 3 months (27 September), toes one and three were totally healed through wound care management (Figure 6). Figure 7 shows a comparison of the initial presentation and the wound after 3 months of treatment. Figure 8 shows the fully healed wound in May 2019, some 3 years after initial presentation.
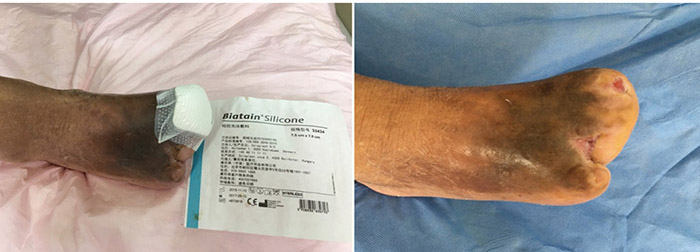
Figure 6. Fifteenth stage of wound management (27 September 2016).
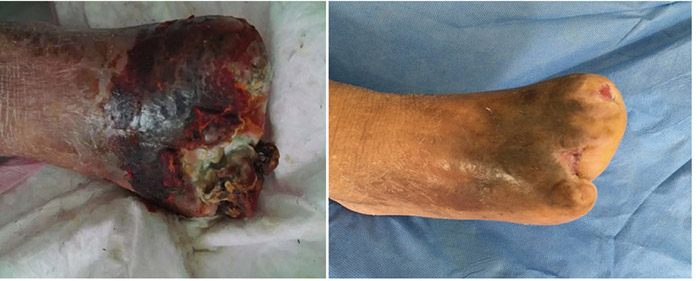
Before treatment Three months later
Figure 7. Comparison of treatment from initial presentation to after 3 months of treatment.
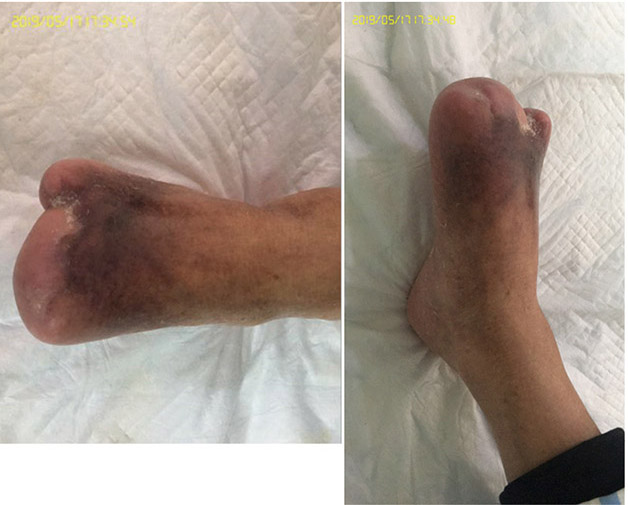
Figure 8. Fully healed wound, 3 years after initial presentation (May 2019).
Prevention
Diabetic foot is prone to relapse after healing or may reoccur in the other foot. Therefore, prevention is of vital importance. The patient needs to control their blood sugar levels and blood pressure, refrain from smoking, and participate in a consistent exercise regime. Moreover, the patient needs to diligently preform self-checkups on the problematic foot daily, practise proper foot care, wear comfortable diabetic shoes, practise regular foot hygiene, and visit the hospital for annual checkups. If any issues should arise, the patient must contact a diabetic podiatrist for examination and early treatment.
Discussion
This case report indicated that INPWT can be used to treat diabetic foot ulcers when combined with other therapies to promote wound healing. The total treatment process lasted for 3 months and cost 27,500 RMB. The success in wound treatment prevented foot amputation which could negatively impact patient health and quality of life. In addition, life-threatening infection and sepsis were prevented. The patient and their family were very satisfied with the effectiveness of the treatment.
Managing a wound in a diabetic foot is a clinical challenge – it requires multiple care strategies which are interdependent in order to reach the ultimate goal of wound healing. The literature suggests that the treatment process of a diabetic foot ulcer is lengthy, expensive and has a low curation rate12. However, this case study adds to the growing body of knowledge about utilising INPWT and adjunct therapies to heal advanced diabetic foot ulcers.
In the case of our patient, INPWT, managing patient comorbidities, and good nutrition played key roles in successfully healing his wound. The INPWT used a water bath therapy combined with closed aspiration. The main principle of INPWT is to bathe the infected wound in the cleansing solution to dissolve debris such as liquefied necrotic tissue or bacteria, inflammatory mediators, and purulent secretions. Debris can then be removed from the wound bed through a suction device. When an abundance of irrigation solution is utilised, the concentration of harmful cellular debris and metabolic by-products is effectively lowered, thus efficiently eliminating harmful substances on the surface of the wound.
Fully draining the wound secretions also reduced the wound burden and promoted local blood circulation, speeding up growth of granulation tissue15. Draining is an important process as bacterial by-products – such as endotoxins and metalloproteases from cellular metabolism during the colonisation process – can interfere with wound healing at various stages. This interference can occur through increased metabolic demands, negative microcirculatory changes, and can signal an inflammatory response. INPWT acts to produce mechanical stress on cells, removes interstitial fluid, and stimulates new cell proliferation. Meanwhile, the irrigated solution enhances these affects or introduces antimicrobial properties16.
The successful healing of our patient’s wound matches other research findings regarding INPWT. Gabriel et al.16 found that instillation of an irrigation solution in combination with NPWT enhanced wound healing through autolytic processes, prevention of glycocalyx establishment, mechanical debridement, and increased the viscosity of wound exudate which allowed for easier removal through the INPWT system. Additionally, Zelen and colleagues14 found that INPWT was effective at closing both small and large wounds resulting from diabetic neuropathy by promoting epithelialisation and granulation at the wound.
Our patient’s case was of greater complexity as he had many comorbidities alongside a severe wound infection. In addition to managing the patient’s local wound, emphasis was therefore placed on systemic treatment such glycaemic control, blood pressure reduction, improving microcirculation and ensuring better nutritional status. These strategies are in alignment with the Practical guidelines on the management and prevention of the diabetic foot 201117 which notes the importance of proper nutrition and maintaining blood sugar levels at less than 8 mmol/L.
Another study highlighted the importance of good nutrition for preventing amputation in individuals with diabetic foot ulcers. Their findings illuminated how nutritional status has a significant impact on limb preservation. The proposed mechanism through which poor nutritional status impacts wound healing is multi-faceted. Nutrients are lost in wound exudate, and comorbidities can impact nutrient uptake which are major concerns due to the metabolic requirements for the products of wound healing such as collagen formation and fibroblast proliferation18. Thus, if nutrition is inadequate, wound healing can be delayed or severe progressions in the ulcer can develop and lead to the need for amputation. Through comprehensive treatment, the patient’s wound healed successfully, and amputation was avoided. A plethora of research has demonstrated that amputation will drastically decrease quality of life, therefore avoiding amputation was of vital importance for the patient19.
Conflict of Interest
The authors declare no conflicts of interest. The patient consented to the usage of the photographs in this article.
Funding
The authors received no funding for this study.
Aplicación de irrigación y de terapia de presión negativa en la cicatrización de heridas (INPWT) para tratar la gangrena en el pie diabético: un informe de caso
Ai-hua Chen, Huiling Liu, Chunmei Zhang and Ping Zou
DOI: https://doi.org/10.33235/wcet.39.3.20-25
Resumen
Este estudio de caso resume el tratamiento de un paciente con gangrena en el pie diabético. Al someterse a irrigación y terapia de presión negativa en la cicatrización de heridas (INPWT, por sus siglas en inglés) con vendaje húmedo, se evitó la amputación del pie. El proceso del tratamiento incluyó: la evaluación integral de la condición sistémica y local; la elección adecuada del desbridamiento, tales como desbridamiento quirúrgico agudo; prevención de la diseminación de la infección; aplicación de INPWT para reducir la absorción de la endotoxina y tratamientos activos de la enfermedad primaria, tales como el control de la glucemia y de la tensión arterial, y el mejoramiento de la microcirculación y la nutrición. Después de dos meses de INPWT intensa, mejoró el lecho de la herida del paciente. Después de la aplicación de un vendaje húmedo, la herida se cerró y se cicatrizó con éxito a los tres meses.
Introducción
La prevalencia global de la diabetes sacarina es de 8,5 % y aproximadamente el 90 % de los casos son diabetes tipo 21,2. En las últimas décadas, la prevalencia de la diabetes aumentó drásticamente a nivel mundial, los índices se cuadriplicaron desde 19802. Esto puede ser atribuido a una población que envejece rápidamente, al crecimiento de la población en general y al aumento de la incidencia de la obesidad. Se estima que habrá casi 550 millones de personas con diabetes a nivel mundial para 2030, lo que convierte a la diabetes en un problema de salud pública clave y en una preocupación global. China tiene actualmente la mayor cantidad de personas con diabetes en el mundo. Según las últimas encuestas epidemiológicas realizadas por el Comité Nacional de Salud en 2018, un 11,6 % de la población china tiene diabetes, lo que corresponde a un total de 114 millones de personas. Además, China tiene un bajo índice de tratamiento (32,2 %) y de control (49,2 %) que da como resultado muchas incidencias de complicaciones, entre las que se incluyen el riesgo de enfermedad cardíaca, de accidente cerebrovascular, de ceguera, de insuficiencia renal y de amputación. Estas complicaciones tienen consecuencias graves para la calidad de vida de los pacientes.
Una de las comorbilidades de mayor prevalencia de la diabetes es úlceras en el pie. La Organización Mundial de la Salud (OMS) clasifica a la enfermedad del pie diabético como una infección del pie, úlcera o daño del tejido profundo relacionado con la anormalidad nerviosa local y con los cambios en la patología vascular periférica distal de las extremidades inferiores3. La incidencia de las úlceras en el pie de las personas con diabetes es de un 6,3 % y una incidencia de por vida de entre un 19 y 34 % en la población4,5. La preocupación principal con respecto a las úlceras en el pie de las personas con diabetes es el largo período que tarda en cicatrizar la herida. La probabilidad de cicatrización de las heridas disminuye en las personas con diabetes debido a una serie de factores, que incluyen la disfunción circulatoria, la hiperglucemia, la neuropatía, la hipoxia y el síntoma de deficiencia de neuropéptidos, así como también a comorbilidades, tales como la enfermedad renal al final del estadio, la insuficiencia cardíaca congestiva y la enfermedad arterial periférica4,6. Muchos de estos factores contribuyeron al desarrollo inicial de las úlceras del pie diabético. Los factores adicionales que fomentan el desarrollo de la úlcera incluyen un alto índice de masa corporal, la deformidad del pie, el género masculino, la exposición prolongada a la diabetes, la edad avanzada y los hábitos deficientes de autocuidado del pie7.
Para las personas con úlcera del pie diabético, el índice de infección supera el 50 %8. La infección es un proceso que comprende la invasión de microorganismos, la respuesta inflamatoria del cuerpo a la invasión y la degradación y destrucción del tejido9. Los factores que contribuyen a una infección en una persona con úlcera del pie diabético incluye heridas que duran más de 30 días, heridas profundas, heridas que fueron causadas de manera traumática, y heridas que son comórbidas con la enfermedad arterial periférica8,9.
Además, si las úlceras del pie diabético se infectan, pueden avanzar hasta llegar a una gangrena.10. La gangrena del pie es la etapa final de la enfermedad del pie diabético que, a menudo es comórbida con las lesiones nerviosas y vasculares de otros órganos2. Las infecciones pueden incluir osteomielitis, celulitis, abscesos, fascitis o artritis séptica11. Estas infecciones pueden estar provocadas tanto por hongos como por bacterias, tales como Staphylococcus, proteobacteria, Pseudomonas aeruginosa, Streptococcus y bacterias coliformes10.
Debido a la infección y a los tiempos lentos de cicatrización, las úlceras del pie diabético pueden derivar eventualmente en la necesidad de amputación; las personas con úlceras del pie diabético tienen entre 10 y 20 veces más de probabilidad de necesitar una amputación en comparación con sus contrapartes no diabéticas2,7. La amputación puede llevar a complicaciones adicionales: el índice de supervivencia de 5 años posteriores a la amputación es de un 30 % para las personas con diabetes4. Un estudio encontró que los índices de amputación estaban entre un 46 y 78 % para las infecciones moderadas a graves, respectivamente8.
La infección se maneja generalmente con un tratamiento antibiótico, una intervención quirúrgica y un desbridamiento quirúrgico8,11. Otros tratamientos complementarios usados con estos métodos incluyen la terapia de presión negativa en la cicatrización de heridas (TPN) y la oxigenoterapia hiperbárica. Por consiguiente, el tratamiento integral y el tratamiento local de la gangrena en el pie es importante para reducir el índice de amputación en los pacientes con la enfermedad del pie diabético para mantener la función del pie y la movilidad, y para mejorar la calidad de vida de las personas afectadas por la enfermedad del pie diabético12.
La TPN es una forma de tratar las heridas en la que se expone la presión negativa a toda el área de la superficie y se mantiene con un vendaje que se sella y se conecta mediante un tubo a un vacío externo. Actúa para juntar los bordes de la herida para la cicatrización; esto fomenta la formación de tejido de granulación, reduce los edemas y, por consiguiente, aumenta la microcirculación y quita los pequeños residuos y exudados mediante succión13. Esta terapia se puede combinar con otros métodos, tales como instilación, que envía una cantidad controlada de solución de limpieza, tales como antisépticos o antibióticos, a fin de tratar las infecciones del pie diabético13,14.
En mayo de 2016, se internó en nuestro hospital un paciente con caso de gangrena en un pie diabético de clasificación IV en el sistema Wagner. Este documento analizará la historia clínica del paciente, la evaluación y el tratamiento del paciente. Después de 3 meses de tratamiento, la herida del paciente cicatrizó con éxito y se evitó la amputación del pie.
Informe de caso
Historia clínica y evaluación
El paciente era un hombre de 88 años que fue internado en el hospital el 22 de mayo de 2016. Había tenido polidipsia y poliuria durante más de tres años. En la exploración física, el paciente tenía 37,8 oC de temperatura, pulso de 84 pulsaciones por minuto y tensión arterial de 160/90 mmHg. El paciente parecía estar atento y orientado. El paciente tenía una glucemia en ayunas de 11 mmol/L, una hemoglobina de 110 g/L, un nivel de albúmina de 38,1 g/L y un recuento de leucocitos de 11x109/L.
El lado derecho del pulso arterial del dorsalis pedis era débil y la parte de adelante del pie derecho tenía un color púrpura negro. El paciente no tenía los dedos gordo y mayor del pie derecho, y los otros dedos tenían un color púrpura negro con necrosis. El tejido solo se conectaba parcialmente con la piel plantar. Un tejido amarillento cubría el 100 % del lecho de la herida, con grandes cantidades de exudados grises, purulentos y malolientes en el lugar de la herida, lo que indicaba una infección grave. El borde de la herida era irregular con edema, piel con alta temperatura y tenía un aspecto púrpura negro. La temperatura de la piel del paciente en su extremidad inferior derecha era superior a la de la extremidad inferior izquierda. La herida estaba clasificada como de Grado 4 según el sistema de Wagner. En una escala de clasificación numérica, el dolor estaba valorado por el paciente como ocho de diez en la escala, en la cual 0 era sin dolor y 10 era el peor dolor.
El diagnóstico del paciente al momento de la internación era el siguiente: diabetes sacárida tipo II y gangrena en el pie e infección; cardiopatía isquémica con angina inestable e infarto de miocardio crónico sin elevación del segmento ST, ocurrido hacía dos años; arritmia, y tercer estadio de fibrilación auricular paroxística; hipertensión de nivel 3 (alto riesgo); secuela de infarto cerebral; y formación de placa en las arterias en ambas extremidades inferiores. El médico recomendó la amputación del pie, pero el paciente se negó.
En junio de 2016, el paciente fue derivado al personal de enfermería para el tratamiento enterostomal (TE) para el cuidado de la herida y el tratamiento del pie. El paciente tenía estenosis en la arteria femoral derecha (90 %) y estenosis en la arteria poplítea y en la arteria tibial posterior (61 %, 80 %). Se colocó una endoprótesis arterial en la extremidad inferior derecha, que permaneció en el lugar durante 5 meses y que dio como resultado un flujo sanguíneo arterial posoperatorio positivo. Después de una evaluación exhaustiva, el personal de enfermería de TE no encontró ninguna contraindicación para aplicarle la NTPW al paciente. Este es el primer caso de uso de irrigación y de la TPN (INPWT) en este hospital grande para tratar úlcera del pie diabético. Los factores que afectaban la cicatrización de la herida en el paciente eran la edad avanzada y las diferentes comorbilidades, tales como diabetes, enfermedad cardiovascular, nutrición deficiente, enfermedad crónica de largo plazo, así como también salud mental deficiente.
Tratamiento sistémico
Según la descripción que figura arriba, el proceso de tratamiento incluía evitar la diseminación de la infección, así como también los tratamientos activos de la enfermedad primaria, tales como el control de la glucemia y de la tensión arterial, y mejorar la microcirculación y la nutrición.
El objetivo para la tasa de cicatrización de heridas es de 0,2 cm por semana, pero cuando el recuento bacteriano de la herida es de 106/mm2 o superior, se espera que la velocidad de cicatrización disminuya a 0,055 cm/semana. Se supone que cuanto más grave es la infección bacteriana, más lenta es la cicatrización de la herida3. Por consiguiente, cuando se realiza el tratamiento local de las heridas es esencial tener implementadas prácticas de control de infecciones sistémicas. Se le recetó al paciente una infusión endovenosa con [piperacilina] sódica a un índice de 2,5 g una vez cada 8 horas. Los cultivos de la herida mostraron un crecimiento de Staphylococcus aureus y Pseudomonas aeruginosa, lo que sugería la necesidad de darle ofloxacina; por consiguiente, se le administró una inyección de cloruro de sodio [y] levofloxacina de 0,4 g por infusión endovenosa una vez por día durante 1 semana. La temperatura del paciente era normal y su condición era estable.
Para controlar la glucemia, se le administraron comprimidos de “sieglidine” fosfato por vía oral, a una dosis de 100 mg una vez por día. Al paciente también se le recetó carbosacárido (baicana) 50 mg, por vía oral, tres veces por día, lo que ayudó a que su glucemia en ayunas fuera de 7 mmol/l y su glucemia posprandial de aproximadamente 10 mmol/l.
Para reducir la tensión arterial, al paciente se le suministraron “amberyl [metoprolol] (betatolak)” 47,5 mg, por vía oral, una vez por día, cápsulas de liberación lenta de isosorbato de mononitrato (isola) 50 mg, por vía oral una vez por día, y un comprimido por vía oral de “lodipino” y valsartán (combinación de amlodipino 5 mg y valsartán 80), una vez cada 12 horas, lo que mantuvo la tensión arterial a 130/80 mmHg.
Al paciente se le administraron 240 unidades de peptidasa pancreática (yi-open) tres veces por día para aumentar la circulación sanguínea y fomentar la cicatrización de la herida. El paciente tenía anemia, proteínas bajas y otras deficiencias nutricionales que dificultaban la cicatrización de la herida. Para contrarrestar esto, al paciente se le dio una dieta rica en proteínas y rica en vitaminas, distribuida en comidas pequeñas bajo la precondición de controlar la glucemia.
Proceso de tratamiento de las heridas
Para tratar la herida, se eliminó el tejido inactivo para evitar la diseminación de la infección. También se eliminaron los tejidos necróticos y los microorganismos para evitar la absorción de toxinas. Para impulsar el crecimiento de la granulación, se extirpó el tejido óseo muerto del paciente y se cerró la cavidad sinusal. Se eliminó una costra para reparar el borde de la herida e impulsar el deslizamiento del epitelio. Se cortaron los bordes de la herida para proteger los tejidos de granulación y epiteliales. Se utilizaron humectantes de la piel alrededor de la herida para fomentar la circulación sanguínea.
Al iniciar el tratamiento de la herida (28 de junio de 2016), se utilizó una solución de yodo para desinfectar la herida y una solución de cloruro de sodio para enjuagarla. Se tomaron cultivos tisulares de la herida para ayudar en la orientación del tratamiento antimicrobiano. Se utilizó el desbridamiento quirúrgico para eliminar las células senescentes y disminuir la carga bacteriana. Después se aplicó la INPWT a la herida. El líquido de irrigación que se utilizó fue solución salina normal [y] de yoduro al 0,01 % (NaCl 500ml+5 % yoduro 10 ml) a una velocidad de 20 gotas por minuto. Se mantuvo la presión negativa entre 80–125 mmHg (Figura 1).
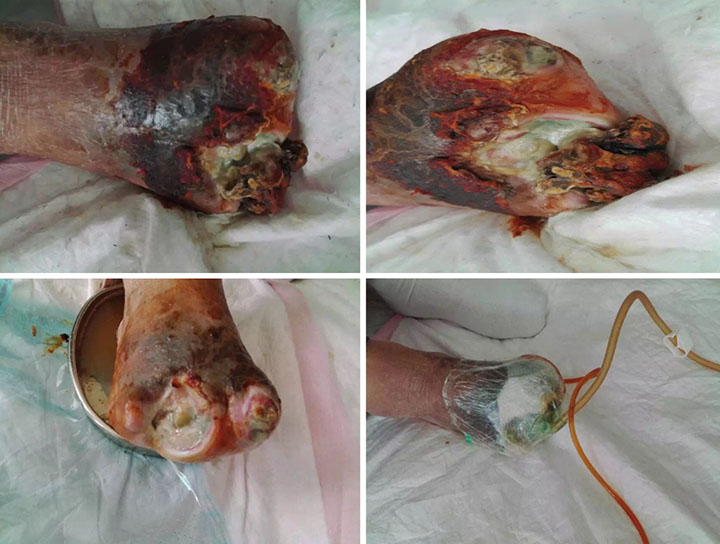
Figura 1. Etapa inicial del tratamiento de las heridas (28 de junio de 2016).
En la segunda etapa del tratamiento de la herida (5 de julio), el lecho de la herida estaba 50 % eritematoso y 50 % amarillento (Figura 2). La herida continuó siendo hedionda con edema alrededor de la misma, pigmentación oscura e impregnación en el borde. El tratamiento incluyó desbridamiento continuo y otros métodos, según lo mencionado anteriormente. También se siguió con la INPWT.
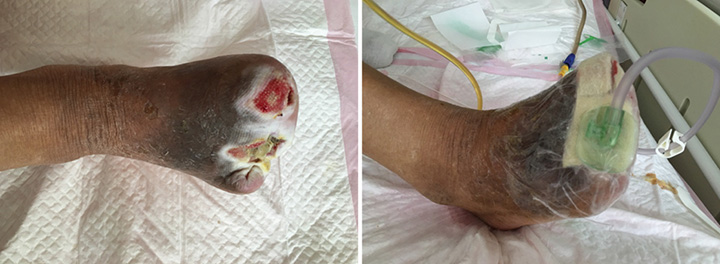
Figura 2. Segunda etapa del tratamiento de las heridas (5 de julio de 2016).
En la tercera etapa del tratamiento (8 de julio), después de extirpar el hueso muerto, se encontró que las cavidades sinusales tenían una profundidad de 3,5 cm y 2,5 cm en el primer y tercer dedo, respectivamente (Figura 3). El tamaño total de la herida era 3 x 7,5 cm. Para cicatrizar las heridas, se aplicó un desbridamiento conservador con lavado de cavidades sinusales y se colocó una esponja para asegurar que el líquido del lavado llegara hasta el fondo de la cavidad sinusal sin dejar una cavidad muerta. Se usó INPWT continuada en el tratamiento.
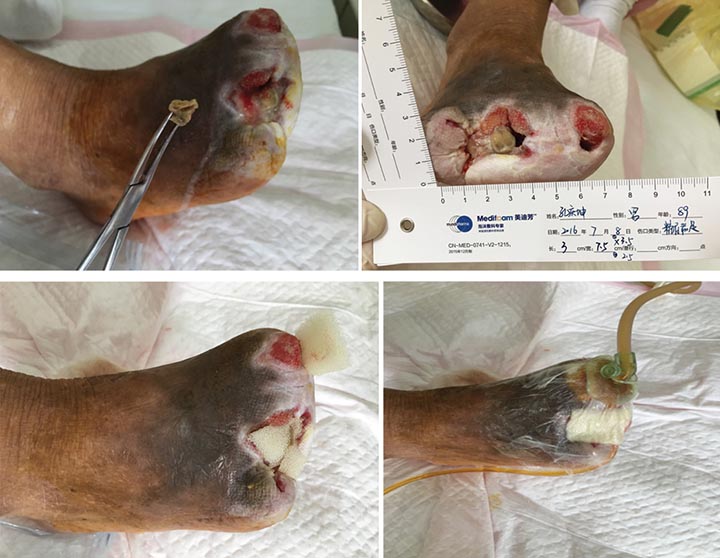
Figura 3. Tercera etapa del tratamiento de las heridas (8 de julio de 2016).
Después de aproximadamente 6 semanas de tratamiento, en la novena etapa del tratamiento de la herida (12 de agosto), la cavidad sinusal del dedo gordo se cerró (Figura 4). El lecho de la herida estaba completamente eritematoso. La herida fue controlada con desbridamiento conservador continuo utilizando la TPN; sin embargo, la irrigación fue suspendida.
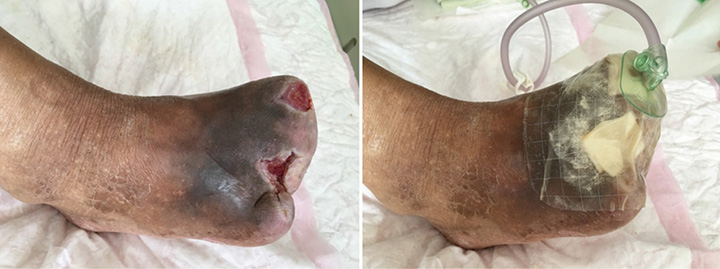
Figura 4. Novena etapa del tratamiento de las heridas (12 de agosto de 2016).
En la 12a etapa del tratamiento de la herida (23 de agosto), el lecho de la herida seguía estando completamente eritematoso (Figura 5). Los bordes de la herida se maceraron y la herida ya no tenía olor fétido. Se aplicó el desbridamiento conservador para extraer el tejido necrótico. Se detuvo la TPN y se cambió el tratamiento por vendajes húmedos. Se colocó una película hidrocoloide en la parte interna del vendaje para fomentar la epitelización, a la vez que se aplicó un apósito con espuma siliconada en la capa externa para fomentar la absorción del exudado.
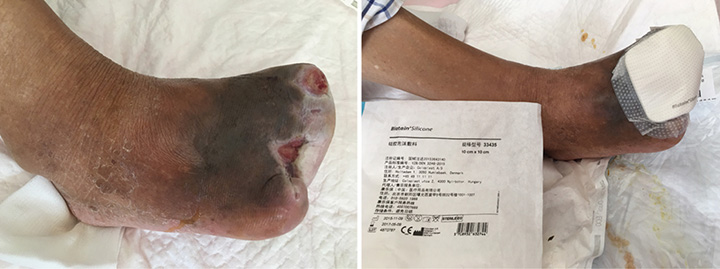
Figura 5. Decimosegunda etapa del tratamiento de las heridas (23 de agosto de 2016).
En la 15a etapa del tratamiento de la herida, a los 3 meses (27 de septiembre), el primer y el tercer dedo estaban totalmente cicatrizados gracias al tratamiento de la herida (Figura 6). La Figura 7 muestra una comparación de la presentación inicial y la herida después de los tres meses de tratamiento. La Figura 8 muestra la herida totalmente cicatrizada en mayo de 2019, aproximadamente tres años después de la presentación inicial.
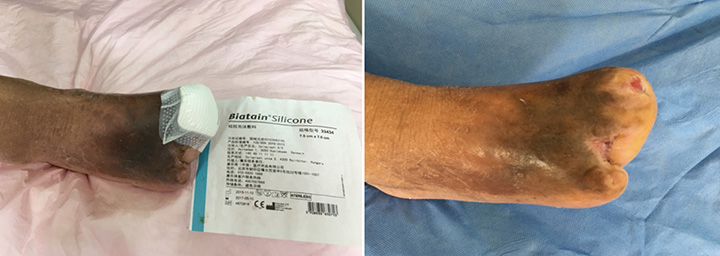
Figura 6. Decimoquinta etapa del tratamiento de las heridas (27 de septiembre de 2016).
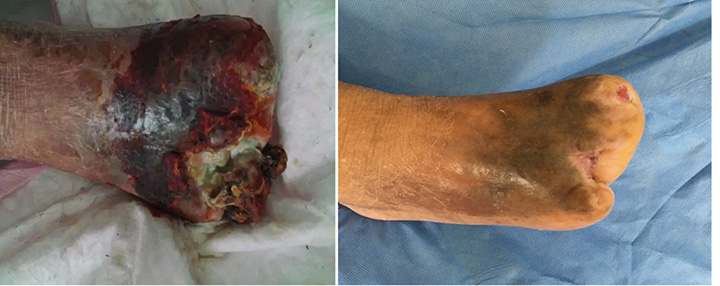
Antes del tratamiento Después de tres meses
Figura 7. Comparación del tratamiento desde la presentación inicial hasta después de los tres meses de tratamiento.
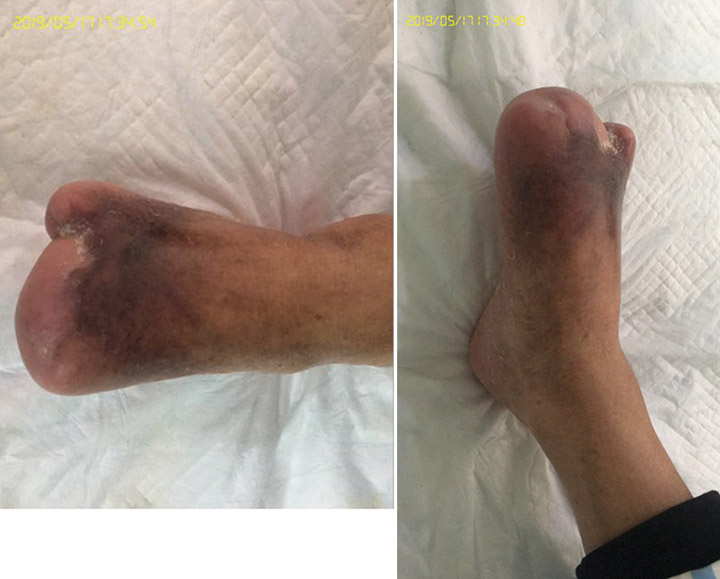
Figura 8. Herida totalmente cicatrizada, tres años después de la presentación inicial (mayo de 2019).
Prevención
El pie diabético es propenso a tener una recidiva después de la cicatrización o puede volver a ocurrir en el otro pie. Por consiguiente, la prevención es de importancia vital. Se deben controlar los niveles de glucemia y la tensión arterial del paciente, que debe abstenerse de fumar y que además debe realizar un régimen de ejercicio constante. Además, el paciente debe hacerse autocontroles del pie problemático a diario, cuidar los pies de manera adecuada, utilizar calzado cómodo para diabéticos, realizar una higiene regular de los pies y asistir al hospital para los controles anuales. En caso de que surja cualquier problema, el paciente debe contactar al podiatra especializado en diabetes para que lo examine y le dé un tratamiento precoz.
Discusión
El presente estudio de caso informa que la INPWT se puede utilizar para tratar las úlceras del pie diabético cuando se combina con otros tratamientos para fomentar la cicatrización de la herida. El proceso total del tratamiento duró 3 meses y tuvo un coste de 27 500 RMB. El éxito del tratamiento de la herida evitó la amputación del pie, hecho que podría haber provocado un impacto negativo en la salud y en la calidad de vida del paciente. Además, se evitó la septicemia y la infección que amenazaba la vida del paciente. El paciente y su familia estuvieron muy satisfechos con la eficacia del tratamiento.
El manejo de una herida en un pie diabético presenta un desafío clínico, requiere de múltiples estrategias de cuidado que son interdependientes a fin de alcanzar el objetivo final de cicatrización de la herida. La bibliografía sugiere que el proceso de tratamiento de una úlcera del pie diabético es extenso y caro, y que tiene un bajo índice de curación12. Sin embargo, este estudio de caso agrega información al creciente conjunto de conocimientos sobre el uso de la INPWT y los tratamientos complementarios para cicatrizar las úlceras del pie diabético.
En el caso de nuestro paciente, la INPWT, el tratamiento de las comorbilidades del paciente y la buena nutrición desempeñaron un papel fundamental para el éxito de la cicatrización de su herida. La INPWT utilizó un tratamiento de baño en agua combinado con una aspiración cerrada. El principio principal de la INPWT es sumergir la herida infectada en una solución limpiadora para disolver residuos tales como el tejido necrótico licuado o las bacterias, los mediadores inflamatorios y las secreciones purulentas. Luego se pueden extraer los residuos del lecho de la herida mediante un dispositivo de succión. Cuando se utiliza abundante solución de irrigación, disminuyen de manera eficaz la concentración de residuos celulares dañinos y los subproductos metabólicos; por lo tanto, se eliminan con eficacia las sustancias dañinas de la superficie de la herida.
El drenaje completo de las secreciones de la herida también redujo la carga de la herida y fomentó la circulación sanguínea local, acelerando el crecimiento del tejido de granulación15. El drenaje es un proceso importante, dado que los subproductos bacterianos -tales como las endotoxinas y las metaloproteasas del metabolismo celular durante el proceso de colonización- pueden interferir en las diferentes etapas de cicatrización de la herida. Esta interferencia puede ocurrir debido a las demandas metabólicas crecientes, cambios microcirculatorios negativos, y pueden indicar una respuesta inflamatoria. La lNPWT actúa para producir estrés mecánico en las células, elimina el líquido intersticial y estimula la proliferación de células nuevas. Mientras tanto, la solución irrigada mejora estos efectos o introduce propiedades antimicrobianas16.
La cicatrización con éxito de la herida de nuestro paciente coincide con otro hallazgo de investigación con respecto a la INPWT. Gabriel y cols.16 encontraron que la instilación de una solución de irrigación combinada con la TPN mejoró la cicatrización de la herida a través de procesos autolíticos, la prevención del establecimiento de glucocáliz, el desbridamiento mecánico y el aumento de la viscosidad del exudado de la herida, lo que permitió una eliminación más fácil a través del sistema de la INPWT. Además, Zelen y colegas14 encontraron que la INPWT era efectiva para cerrar heridas grandes y pequeñas derivadas de la neuropatía del diabético al fomentar la epitelización y la granulación de la herida.
El caso de nuestro paciente era de gran complejidad, dado que él tenía muchas comorbilidades junto con una infección grave de la herida. Además, para manejar la herida local del paciente, por consiguiente, se puso énfasis en la realización de un tratamiento sistémico tal como el control de la glucemia, la reducción de la tensión arterial, el mejoramiento de la microcirculación y la garantía de un mejor estado nutricional. Estas estrategias están en consonancia con las Practical guidelines on the management and prevention of the diabetic foot 201117 que destacan la importancia de una buena nutrición y de mantener los niveles de glucemia a menos de 8 mmol/L.
Otro estudio destacó la importancia de una buena nutrición para evitar la amputación en las personas con úlceras del pie diabético. Sus hallazgos enfatizaron la manera en que el estado nutricional tiene un impacto importante sobre la conservación de la extremidad. El mecanismo propuesto, a través del cual un estado de nutrición deficiente impacta en la cicatrización de la herida, es multifacético. Los nutrientes se pierden en el exudado de la herida y las comorbilidades pueden impactar la infiltración de nutrientes que son una preocupación importante debido a los requisitos metabólicos para los productos de cicatrización de la herida, tales como la formación de colágeno y la proliferación de fibroblastos18. Por lo tanto, si la nutrición no es adecuada, se puede ver demorada la cicatrización de la herida o las progresiones graves en la úlcera pueden desarrollar y llevar a la necesidad de una amputación. Mediante un tratamiento exhaustivo, la herida del paciente cicatrizó con éxito y se evitó la amputación del pie. Un sinnúmero de investigaciones han demostrado que la amputación reduce drásticamente la calidad de vida; por consiguiente, evitar la amputación era de vital importancia para el paciente19.
Conflicto de intereses
Los autores declaran que no hay conflictos de intereses. El paciente dio su consentimiento para usar las fotografías en este artículo.
Financiación
Los autores no recibieron financiación para este estudio.
Author(s)
Ai-hua Chen
ET, RN, BScN
Director of Wenzhou Enterostomal Therapy Nursing Education Programs, Second Affiliated Hospital of Wenzhou Medical University, Wenzhou, Zhejiang Province, P. R. China
Huiling Liu
ET, RN
971 Hospital of the Chinese People’s Liberation Army Navy, Qingdao, Shandong Province, P. R. China
Chunmei Zhang
RN,PhD
Nursing Director of Second Affiliated Hospital and Yuying
Children’s Hospital of Wenzhou Medical University, Wenzhou, Zhejiang Province, P. R. China
Ping Zou*
RN, PhD
Associate Professor, School of Nursing, Nipissing University, Toronto, ON, Canada
Email pingz@nipissingu.ca
* Corresponding author
References
- Chen L, Magliano DJ, Zimmet PZ. The worldwide epidemiology of type 2 diabetes mellitus: present and future perspectives. Nature Rev Endocrin 2012;8(4):228.
- World Health Organization. Global report on diabetes. WHO Press, World Health Organization, 20 Avenue Appia, 1211 Geneva 27, Switzerland: World Health Organization; 2016.
- Xiao-bing F. The treatment of diabetic foot and management of its related chronic refractory wounds. People’s Military Medical Publishing Press; 2013.
- Armstrong DG, Boulton AJ, Bus SA. Diabetic foot ulcers and their recurrence. N Engl J Med 2017;376(24):2367–75.
- Zhang P, Lu J, Jing Y, Tang S, Zhu D, Bi Y. Global epidemiology of diabetic foot ulceration: a systematic review and meta-analysis. Annals Med 2017;49(2):106–16.
- Baltzis D, Eleftheriadou I, Veves A. Pathogenesis and treatment of impaired wound healing in diabetes mellitus: new insights. Adv Ther 2014;31(8):817–36.
- Yazdanpanah L, Nasiri M, Adarvishi S. Literature review on the management of diabetic foot ulcer. World J Diabetes 2015;6(1):37.
- Hobizal KB, Wukich DK. Diabetic foot infections: current concept review. Diabetic Foot Ankle 2012;3(1):18409.
- Lipsky BA, Aragón‐Sánchez J, Diggle M, Embil J, Kono S, Lavery L, et al. IWGDF guidance on the diagnosis and management of foot infections in persons with diabetes. Diabetes/Metab Res Rev;2016;32:45–74.
- Noor S, Zubair M, Ahmad J. Diabetic foot ulcer: a review on pathophysiology, classification and microbial etiology. Diabetes Metabo Synd: Clin Res Rev 2015;9(3):192–9.
- Barshes NR, Sigireddi M, Wrobel JS, Mahankali A, Robbins JM, Kougias P, et al. The system of care for the diabetic foot: objectives, outcomes, and opportunities. Diabetic Foot Ankle 2013;4(1):21847.
- Qiu X, Zhao W, Du X. Clinical analysis of 56 cases of diabetic foot gangrene treatment J North China Uni (natural science edition) 2011;18(4):506–7.
- Back DA, Scheuermann‐Poley C, Willy C. Recommendations on negative pressure wound therapy with instillation and antimicrobial solutions: when, where and how to use: what does the evidence show? Int Wound J 2013;10(s1):32–42.
- Zelen CM, Stover B, Nielson D, Cunningham M. A prospective study of negative pressure wound therapy with integrated irrigation for the treatment of diabetic foot ulcers. Eplasty 2011;11.
- Chou TH. The application of “TIME” principle in the preparation of wound beds. J Chin Nurs 2013;48(9):855–7.
- Gabriel A, Shores J, Heinrich C, Baqai W, Kalina S, Sogioka N, et al. Negative pressure wound therapy with instillation: a pilot study describing a new method for treating infected wounds. Int Wound J 2008;5(3):399–413.
- Bakker K, Apelqvist J, Schaper NC, Board IWGotDFE. Practical guidelines on the management and prevention of the diabetic foot 2011. Diabetes/Metab Res Rev 2012;28:225–31.
- Gau B-R, Chen H-Y, Hung S-Y, Yang H-M, Yeh J-T, Huang C-H, et al. The impact of nutritional status on treatment outcomes of patients with limb-threatening diabetic foot ulcers. J Diabetes Complications 2016;30(1):138–42.
- Laiteerapong N, Karter AJ, Liu JY, Moffet HH, Sudore R, Schillinger D, et al. Correlates of quality-of-life in older adults with diabetes: The Diabetes & Aging Study. Diabetes Care 2011;DC_102424.



