Volume 39 Number 3
Healthcare professionals and interactions with the medical devices industry
Paris Purnell
Keywords compliance, medical devices, nursing profession, ostomy, ethics, industry, healthcare professionals
For referencing Purnell P. Healthcare professionals and interactions with the medical devices industry. WCET® Journal 2019; 39(3):32-36
DOI https://doi.org/10.33235/wcet.39.3.32-36
Abstract
Compliance laws for healthcare professional practices are evolving continuously. It can therefore remain difficult to remain abreast of all laws that apply across all countries. This paper serves as guidance for best practice for healthcare professionals (HCPs) working alongside the medical devices industry.
Introduction
Engaging with product manufacturers and suppliers from within the medical devices industry should, at its best, be a symbiotic relationship where both the healthcare professional (HCP) and the industry representative – henceforth referred to as Industry – derive mutual, yet appropriate, benefits. This relationship should be driven by the ultimate objective of improving patient outcomes. However, this affiliation can be challenging when ensuring objectivity and compliance for both Industry and the HCP. For example, recent global changes of compliance laws designed to govern these affiliations can make it difficult to ensure all parties remain compliant. However, the overall trend is toward transparency by Industry on any such interactions, and these same considerations are increasingly becoming the focus of employers of HCPs as well as the HCP professional bodies.
This paper focuses on global and local laws, codes and market trends in compliance to better inform and protect the HCP. By being more aware of the compliance requirements and legal ramifications when interacting with Industry, the HCP will be in a better position to navigate complex interactions that may place them at risk.
What is Compliance?
Compliance involves a broad series of interactions with HCPs and includes activities such as the promotion of advancements in medical technologies, enhancements in the safe and effective use of medical technologies, research and education activities, and fostering of charitable donations and giving1. For the purposes of this paper, ‘compliance’ is used to describe the ethical code where the first duty of the HCP is to act in the best interests of the patient by working through beneficial relationships with industry in a transparent and ethical manner. Additionally, while the descriptor for a HCP covers most multidisciplinary healthcare workers, this paper refers specifically to the nursing HCPs prescribing medical devices for patients such as ostomy, wound care and continence as this is the audience for this journal. Lastly, medical devices are often highly dependent upon ‘hands on’ HCP interaction from beginning to end, unlike drugs and biologics which act on the human body by pharmacological, immunological or metabolic means2. This often requires Industry to provide HCPs with appropriate instruction, education and training.
As described, compliance laws regarding the interactions of HCPs with Industry are continuously changing. Compounding this challenge, are the variances in the compliance laws by country and sometimes even within that country’s boundaries. Ensuring the HCP is cognisant of the potential pitfalls that may not be apparent when contracting with a manufacturer for either a service or another activity – such as sponsorship – are important considerations. Given the changing face of compliance globally – particularly around some commercial activities that might be considered legal (for now) but not necessarily ethical – it is a timely and worthy discussion to guide the HCP in protecting themselves against potential risk.
International and local Compliance Bodies / Local Trade Associations
There are several international compliance bodies (Figure 1) exerting influences on local Industry and HCP interactions. The larger bodies include AdvaMed (mainly influencing US, Chinese and Latin America activities and companies), MedTech Europe (formerly ‘EucoMed’, covering Europe), APACMed (covering Asia Pacific), and MecoMed (covering the Middle East).

Most countries also have compliance bodies locally which, in turn, often ascribe to at least one of these larger governance bodies. These larger bodies generally set the core principles and ethics that local bodies would engage with as members of the parent body. There are far too many local bodies from a global perspective to create an exhaustive list in this paper. However, from a nursing perspective, there are various registration boards for registered nurses/midwives that operate within each country. These boards each have their own code of ethics and professional standards that influence local practices. For example, Australian nurses ascribe to Australian registration boards such as the Australian Health Practitioners Regulatory Authority and Nursing and Midwifery Board of Australia (NMBA)3, the Wound Ostomy and Continence Nurses Society (WOCN)4 and, of course, the WCET5.
Medical devices are also regulated by local governmental agencies which in turn have their own codes. As one example, the Medical Technology Association of Australia (MTAA) is the governing body regarding compliance for the medical devices industry that includes ostomy products in Australia which has strict codes of conduct and laws regarding interactions between HCPs and Industry. According to the MTAA website6:
In all dealings with Healthcare Professionals, a Company must undertake ethical business practices and socially responsible Industry conduct and must not use any inappropriate inducement or offer any personal benefit or advantage in order to Promote or encourage the use of its products.
This basic definition is a concise summary of what Industry should be following in terms of ethical practices in working with any HCP. One key takeaway message from this simple narrative is the term ‘inducement’. Products must be prescribed on clinical application and suitability. Product usage should not be based upon a ‘quid pro quo’ basis where the HCP and the company are deriving either singular or mutual benefits. This is commonly referred to as ‘corruption’.
As such, while local laws and customs often come into play, an important consideration when the HCP wishes to engage with Industry is to err on the side of caution and follow the rules of the compliance body which are the most stringent. As an example, while some manufacturers in the EU may not necessarily fully ascribe to these bodies, from 2020 MedTech Europe has determined that ALL local trade associations must abide by stricter MedTech Guidelines7. These enforceable ethical standards will be placed on Industry to come into line with all other already compliant manufacturers and service providers.
Corruption and Sponsorship
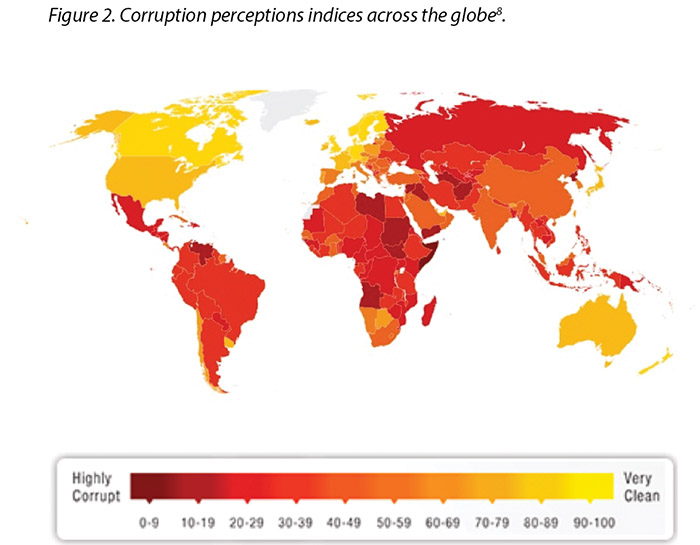
However, laws are constantly changing regarding corruption and sponsorship. Transparency International has developed and mapped the perception of corruption indices across the globe concerning all industries and governments, with darker colours illustrating the perception of higher levels of corruption8; the more yellow (lighter colour), the perception is cleaner and freer from corruption (Figure 2). Yet, while it is good to obtain such a standard, there is an inference that additional scrutiny is required to maintain these standards. This means more oversight into interactions will be assessed. Unfortunately, in recent years, the majority of countries are making little or no progress in ending corruption, while further analysis shows journalists and activists in corrupt countries risk their lives each day in an effort to speak out8.
Previously, direct sponsorship usually involved the selection of the HCP by the Industry and direct payment by Industry to the HCP, their institution, or a third-party vendor for the HCP’s travel, lodging, meals, other transportation expenses, conference registration fees or other costs associated with a third-party educational conferences such as those hosted by the European Council of Enterostomal Therapy (ECET), the Society of Urologic Nurses and Associates (SUNA), the Symposium on Advanced Wound Care (SAWC), WOCN or WCET conferences2. This is being, or has already been, phased out in many countries; MedTech Europe illustrates where direct sponsorship is forbidden7 (Figure 3).
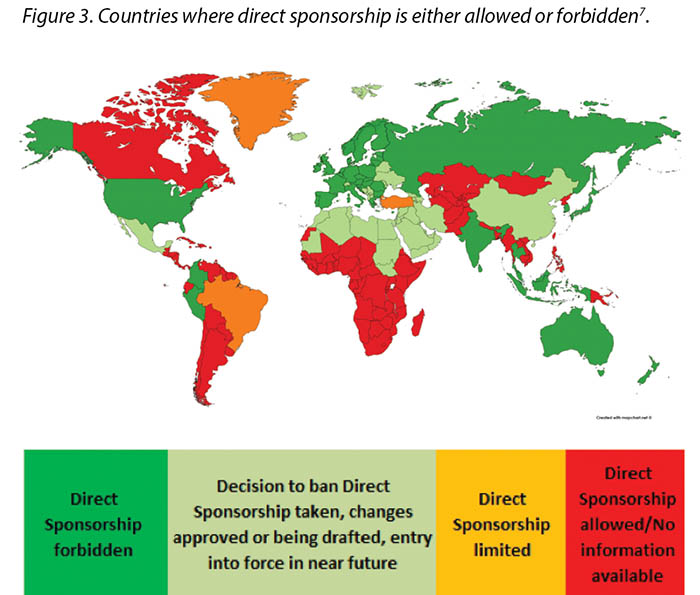
Additionally, the concept of direct sponsorship can mean arrangements where Industry selects or influences the selection of a specific HCP through their institution or professional body, or was provided with advance knowledge of the identity of a specific HCP who might benefit directly from Industry funding2. This practice is an ‘indirect’ method of achieving the same objective of direct sponsorship whereby deliberate sponsorship of a specific HCP still occurs. As such, this is also not permissible. As a consequence, the funding must be indirect via an educational grant. MedTech Europe creates another level by enforcing some transparency requirements for all educational grants provided by the industry to healthcare organizations. Access to the transparency report is available on: https://www.ethicalmedtech.eu/transparent-medtech/
General Rules of Engagement for the HCP with Industry
There are several topics for discussion around some rules of engagement for the HCP with Industry, including entertainment, hospitality, event venues and location, travel, contracting, remuneration / compensation, transparency, gifts and samples. Each of the following discussions regarding these outline global compliance standards.
Entertainment
It is prohibited for Industry to organise Industry events – including social, sporting and/or leisure activity or other forms of entertainment – that has no value in terms of education, for example, providing a famous singer at an event, taking nurses to a spa treatment day as an example of managing patients’ skin issues, creating fun artworks/animals using specific medical devices that have no relation to intended use etc. It is also forbidden for Industry to support such entertainment when part of a third-party event, for example live music, sport event, dancing contest. However, there is some tolerance in a third-party event when such entertainment is outside of the scientific / educational programme, is paid for by the HCP, does not dominate / interfere with the educational programme, and is not the main attraction.
Hospitality
Hospitality in this sense relates to meals and/or accommodation. Accommodation should be subordinate in time, with no extensions of stay unless paid for by the HCP. It should only be for the time of the event/meeting that is necessary. Some of these rules are often determined by type of meeting being arranged, for example if the meeting is classified as ‘active’ or ‘passive’. Active events are where the HCP is expected to actively participate and contribute in the meeting, for example a Clinical Advisory Board or Consensus Panel. In these types of events, the HCP is in essence ‘working’ and it is expected that costs incurred for attending the meeting would be reimbursed by Industry. In contrast, passive events are where Industry is presenting to the audience with no reciprocal interaction being required by the HCP. Regarding product promotional events that are organised by Industry – even if they are educational, for example the launch of a new product – no transportation nor hotel fees should be supported. The HCP is expected to cover these costs themselves as this is considered a passive event. However, modest meals at a passive educational event are permitted.
Generally, the meals and accommodation should focus to the purpose of the event and should be seemed as reasonable, for example such as what the HCP would expect to pay by themselves. Recommendations around these values have been determined by trade associations on local laws, and these have been set up in most countries in the world. Maximum amounts for lunches and dinners have been outlined for every country – the rule to apply is generally that of the law governing the hospitality of the country where the HCP is licensed to practise.
Event venues and locations
Industry should respect the following criteria when selecting a venue for an event.
- Perceived image – how it could be seen by the public.
- Centrality – whether it is centrally located for the participants.
- Ease of access – whether it has easy transportation, is close to airport/venue. A recognised scientific or business centre is preferred.
- Time of year – ideally this should not be associated to a tourist season.
- Adapted to the purpose of the meeting – are the rooms appropriate for their intended use.
An event location where the meeting purpose appears secondary to the location is seen as an inducement for the HCP to attend based on the location and not the content or objective of the meeting. As such, event locations should not be lavish such as five-star, golf facilities, spa retreats etc. If the HCP notices the event venue seems inappropriate (for example an amusement park or a retreat), the HCP should reconsider the event.
Travel
When Industry is arranging travel, it must be directly linked to the meeting length and cannot be extended for the purpose of sightseeing / family visits etc. Industry cannot cover a period of stay beyond the official duration of the event.
Travel is linked only to the purpose of the meeting and, like hospitality, should be modest and reasonable – no business / first class air tickets. Related travel expenses for active meetings such as parking, train fares etc. are reimbursable but should be agreed upon prior to the expense.
Contracting
Industry may engage HCPs as consultants and advisors to provide bona fide consulting and other services, including research studies, participation on ostomy/wound advisory boards, presentations at Industry educational events, and new product development. In selecting the HCP, there should be appropriate criteria that includes:
- Legitimate interest – Industry should not contract with a HCP ‘just in case’ or if there is a lack of in-house competencies.
- Appropriate qualifications – the HCP should be technically and scientifically qualified, with the right competencies to achieve the assignment. Industry should collect a CV for documentation and to justify any compensation.
- No financial gain – selection should be detached from sales to avoid any influence.
Contracts with the HCP shall not be contingent in any way on the prospective consultant’s past, present or potential future purchase, lease, recommendation, prescription, use, supply or procurement of the contractor’s products or services. In other words, there is no ‘quid pro quo’ expectation from Industry that the HCP will use/prescribe their products.
Contracts must involve appropriate documentation to justify the compensation – if any – paid to the HCP. MedTech Europe and AdvaMed have specific requirements for written agreements with the HCP1,7. The contracts also protect Industry by ensuring confidentiality on projects is maintained for new products or strategies so they are not shared with competition. Industry also maintains rights to use the material / research / studies developed by the HCP during the assignment. Lastly, contracts must provide transparency. They ensure information of, and to, the HCP’s employer on the existence of the contract, state exactly what the assignment is, and how much compensation (if any) is paid to the HCP.
Remuneration / compensation
When compensating the HCP for their services, reasonable and fair market value (FMV) compensation should be aligned with the market value for that HCP and the type of service. Guidance on FMV should be sought with compliance officers or the local HCP’s Association, for example the NMBA. In addition, documentation of the type and the length of service with associated remuneration is to be captured and signed off by both Industry and the HCP prior to the event occurring.
Transparency
Before engaging with Industry, as a best practice it is strongly suggested that the HPC should gain approval / notification of the HCP’s employer. While not always mandatory, this transparency covers both parties if there arises any questions regarding conflicts of interest. The employer of the HCP should receive full disclosure of the purpose and scope of consultancy agreement. Additionally, all Industry contracts should contain a clause on the obligation of the HCP to notify the existence of the agreement to their hierarchy. It is prudent to check local requirements.
Gifts
In principle, it is prohibited by Industry to provide gifts to the HCP. Local customs may need examining to determine if this is still permissible. For example, in Japan and Thailand there is frequently an expectation of gifts of thanks. These should not be excessive in nature and should not create any expectations of quid pro quo. Local customs and laws may come into play; however, it is recommended to check with a compliance officer prior to engaging in any gifting activities if there is any ambiguity. In some countries, it is now no longer permissible to give birthday or bereavement cards or flowers, and local laws should be evaluated prior to exploring the potential for providing such gifts.
Industry may provide inexpensive educational items and/or gifts in exceptional circumstances, in accordance with local laws, regulations and industry and professional codes of conduct of the country where the HCP is licensed. Excluded ‘educational’ items are DVD players for playing educational movies, or cameras for wound care as these can be used for other purposes. Acceptable educational gifts can be purely educational (medical) book vouchers, registration to third-party events or educational courses, although these are paid to the third-party only – no cash should be paid direct to any HCP. Again, full transparency is required and documentation should be provided to cover both parties.
Samples
Industry may provide products as samples at no charge in order to enable the HCP to evaluate and/or familiarise themselves with the safe, effective and appropriate use and functionality of the product. This will allow HCPs to determine whether, or when, to use, order, purchase, prescribe or recommend the product and/or service in the future. Provision of samples must not improperly reward, induce and/or encourage HCPs to purchase, lease, recommend, prescribe, use, supply nor procure their products or services.
Any offer and/or supply of samples shall always be done in full compliance with applicable national laws, regulations and industry and professional codes of conduct.
Recent US and European laws, as well as MedTech guidelines in the EU7, require the maintenance of appropriate records in relation to the provision of samples to HCPs, for example recording proof of delivery of samples. These are now to be clearly recorded in the books on a no-charge basis, and this and other conditions applicable for the supply of such samples must be clearly disclosed – in writing and at the time of supply – to HCPs.
The concern is the over-supply of samples (dumping) that may be perceived as an inducement to use the certain products. Samples, as described, should be modest. Anecdotally, for the ostomy Industry, there appears to be an oversupply (stocking) of products at many institutions instead of these institutions purchasing. This practice is possibly in need of further scrutiny.
Red Flags – Warnings
The HCP should become familiar before considering interactions with Industry across multiple issues. There are certain common ‘red flags’ that should create alerts in the mind of the HCP that include situations where there is:
- Wording or phrasing with ‘win’, ‘gift’, or ‘prize’.
- No professional educational relationship associated with the benefit.
- Entertainment.
- A submission for ‘competitions’ judged only by Industry manufacturers (no third-party).
- A value which is high in comparison with the effort required.
- Anything which seems ‘too good to be true’.
- Excessive sampling (dumping) of products.
General Rules of Thumb for Protecting the HCP
- Obtain the full rules of engagement from the device manufacturer.
- Review it with your existing employer’s audit committee /managers.
- Check with your professional body, both local and national.
- Review any available guidelines, both local, national or institutional.
- If in doubt, don’t do anything.
- Consider the ‘optics’ – how might the interaction look if it appeared in the news? Is this clean and free from potential misunderstanding?
Conclusion
There are risks for the HCP when engaging with Industry, and rules and laws are constantly changing. It is difficult to remain ahead and informed of these continuous changes; however, this paper aims to raise awareness of this ever-changing landscape. For the HCP, it is a wise idea to check and follow the rules of engagement, observe the red flags and, if there are any doubts, to err on the side of caution and simply not engage. Ultimately, the goal for each party is to improve patient outcomes and create a prosperous dynamic that is compliant. Interactions between Industry and the HCP are inevitable, but if the relationship is open, honest and transparent, with clear rules of engagement and oversight, these relationships can be extremely fruitful for each party.
Disclaimer
Laws from regulatory bodies are frequently updated. At the time of print, this is a fair assumption of current practices. As always, it remains advisable to seek further guidance from the HCP local regulatory body or employer if there is any doubt before any action/s is taken.
Conflict of Interest
The authors declare no conflicts of interest.
Funding
The authors received no funding for this study.
Profesionales de la salud e interacciones con el sector de dispositivos de uso médico
Paris Purnell
DOI: https://doi.org/10.33235/wcet.39.3.32-36
Resumen
Las leyes de cumplimiento normativo para las prácticas de los profesionales de la salud evolucionan permanentemente. Por consiguiente, puede ser difícil mantenerse al tanto de todas las legislaciones que se aplican en todos los países. Este documento sirve como orientación para las mejores prácticas para los profesionales de la salud (HCP, por sus siglas en inglés) que trabajan junto con el sector de dispositivos de uso médico.
Introducción
Tratar con fabricantes y proveedores de productos del sector de dispositivos de uso médico debería, en el mejor de los casos, ser una relación simbiótica en la que tanto el profesional de la salud (HCP) como el representante del sector -al que de aquí en adelante se hace referencia como el sector- obtengan resultados beneficiosos recíprocos y también adecuados. Esta relación debe estar impulsada por el objetivo final de mejorar los resultados del paciente. Sin embargo, esta asociación puede resultar un desafío al momento de asegurar la objetividad y el cumplimiento normativo tanto del sector como del HCP. Por ejemplo, los recientes cambios globales de las leyes de cumplimiento normativo diseñadas para regular estas asociaciones pueden dificultar el hecho de que todas las partes garanticen el cumplimiento. Sin embargo, la tendencia general es la transparencia del sector respecto de tales interacciones, y estas mismas consideraciones se están tornando cada vez más el foco de los empleadores de los profesionales de la salud, así como también de las entidades profesionales del HCP.
Este documento se enfoca en la legislación global y local, los códigos y las tendencias del mercado para brindar una mejor información y protección al HCP. Al estar más atentos a los requisitos de cumplimiento y a las ramificaciones legales al interactuar con el sector, el HCP estará en una mejor posición para explorar las interacciones complejas que pueden ponerlo en riesgo.
¿Qué es el cumplimiento normativo?
El cumplimiento normativo comprende una amplia gama de interacciones con los HCP e incluye actividades, tales como la promoción de los avances en las tecnologías médicas, el mejoramiento del uso seguro y eficaz de las tecnologías médicas, las actividades de investigación y educativas, y la promoción de donaciones y ofrecimientos1. A los fines de este documento, ‘cumplimiento normativo’ se utiliza para describir el código ético en el que el deber principal del HCP es actuar para los mejores intereses del paciente, trabajando a través de relaciones beneficiosas con el sector de manera ética y transparente. Además, si bien el descriptor para un HCP abarca la mayoría de los trabajadores multidisciplinarios del área de la salud, este documento se refiere específicamente a los profesionales de la salud especializados en enfermería que recetan dispositivos de uso médico a los pacientes, tales como para el cuidado de ostomía, de heridas y de incontinencia, dado que este es el público al que se dirige esta revista. Por último, los dispositivos de uso médico a menudo son altamente dependientes de la interacción ‘práctica’ del HCP desde el principio hasta el final, a diferencia de los medicamentos y los productos biológicos que actúan sobre el cuerpo humano por medios farmacológicos, inmunológicos o metabólicos2. A menudo, esto exige que el sector le proporcione a los HCP instrucción, educación y formación adecuadas.
Según lo descrito, las leyes de cumplimiento normativo con respecto a las interacciones de los HCP con el sector cambian permanentemente. Este reto también forma parte de las varianzas de cada país e incluso, algunas veces, dentro de los límites del mismo país, con respecto al cumplimiento normativo. Otros elementos importantes a tener en cuenta son los de asegurar que el HCP conozca los posibles errores que pueden no ser aparentes al contratar al fabricante para un servicio u otra actividad, tal como el patrocinio. Dada la característica cambiante a nivel global, específicamente con respecto a algunas actividades comerciales que podrían considerarse legales (por ahora), aunque no necesariamente éticas, es un debate oportuno que vale la pena plantear para orientar al HCP a protegerse de un riesgo potencial.
Organismos de cumplimiento normativo locales e internacionales/ Asociaciones comerciales locales
Hay varios organismos de cumplimiento normativo internacionales (Figura 1) que ejercen influencia sobre la interacción entre los HCP y el sector local. Entre los organismos más grandes se incluyen AdvaMed (que influye principalmente las actividades y empresas de los EE. UU., China y América Latina), MedTech Europe (antes ‘EucoMed’, que cubre Europa), APACMed (que cubre Asia Pacífico) y MecoMed (que cubre el Oriente Medio).

La mayoría de los países también tienen organismos de cumplimiento normativo a nivel local que, a su vez, a menudo adhieren a por lo menos uno de dichos organismos de cumplimiento normativo más grandes. Estos organismos más grandes generalmente establecen los principios fundamentales y la ética que los organismos locales deberían aplicar como miembros del órgano rector. Hay demasiados organismos locales, desde una perspectiva global, para elaborar una lista exhaustiva en este documento. Sin embargo, desde la perspectiva de la enfermería, hay varios organismos de matriculación para el personal de enfermería/obstétricas registradas que ejercen en cada país. Estos consejos tienen sus propios códigos de ética y estándares profesionales que regulan las prácticas locales. Por ejemplo, el personal de enfermería de Australia se acoge a los consejos de matriculación de Australia, tales como al Australian Health Practitioners Regulatory Authority and Nursing and Midwifery Board of Australia (NMBA, por sus siglas en inglés)3, a la Wound Ostomy and Continence Nurses Society (WOCN, por sus siglas en inglés)4 y, por supuesto, al WCET5.
Los dispositivos de uso médico también están regulados por los organismos gubernamentales locales que, a su vez, tienen sus propios códigos. Por ejemplo, la Medical Technology Association of Australia (MTAA, por sus siglas en inglés) es el organismo regulador que se encarga del cumplimiento normativo del sector de dispositivos de uso médico que incluye productos para ostomía en Australia, que tiene códigos de conducta estrictos y leyes con respecto a las interacciones entre el sector y los HCP. Según el sitio web de la MTAA6:
En todas las relaciones con los profesionales de la salud, una empresa debe comprometerse a llevar a cabo prácticas comerciales éticas y conductas del sector socialmente responsables, y no debe utilizar ningún incentivo u ofrecimiento de cualquier beneficio o ventaja personal para promover o fomentar el uso de sus productos.
Esta definición básica es un resumen conciso al que se debe atener el sector en lo concerniente a la práctica ética cuando trabaja con los HCP. Una moraleja de esta sencilla descripción es el término ‘incentivo’. Los productos deben recetarse de acuerdo con la aplicación clínica y la pertinencia. El uso del producto no debe basarse en una ‘contraprestación’ en la que el HCP y la empresa se benefician de modo individual singular o recíproco. Generalmente, se hace referencia a esto como ‘corrupción’.
Como tal, si bien las leyes y costumbres locales a menudo entran en juego, cuando el HCP quiere participar en el sector debe tener en cuenta que es mejor que se equivoque por precavido y que siga las más estrictas reglas del organismo encargado del cumplimiento. Por ejemplo, si bien algunos fabricantes en la UE pueden no necesariamente acogerse totalmente a estos organismos, desde 2020 MedTech Europe ha determinado que TODAS las asociaciones comerciales locales deben atenerse a los Lineamientos de Medtech más estrictos7. Estos estándares éticos de cumplimiento se pondrán en práctica en el sector para estar en línea con todos los otros fabricantes y prestadores de servicios que ya los cumplen.
Corrupción y patrocinio
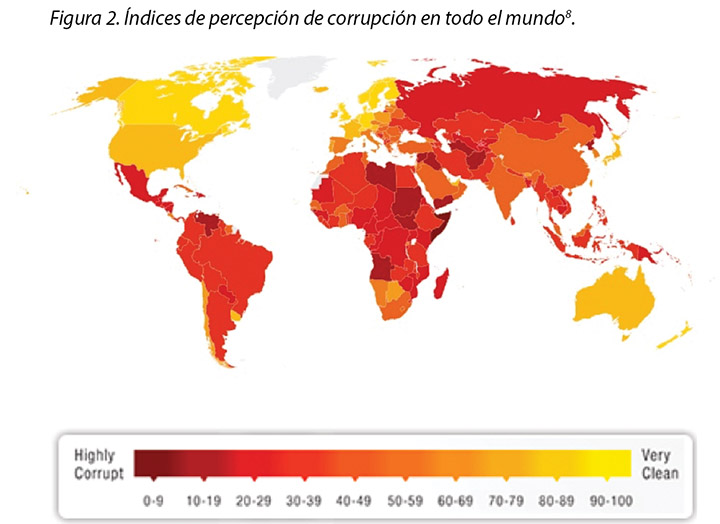
Sin embargo, las leyes respecto de la corrupción y el patrocinio cambian constantemente. Transparency International ha desarrollado y mapeado la percepción de los índices de corrupción en todo el mundo con respecto a los sectores y gobiernos; los colores más oscuros ilustran la percepción de mayores niveles de corrupción8; en los más amarillos (colores más claros), la percepción es más limpia y está más libre de corrupción (Figura 2). Aun así, si bien es bueno lograr dicho estándar, se infiere que es necesario realizar un análisis adicional para mantener estos estándares. Esto implica que se evaluará más la supervisión de las interacciones. Lamentablemente, en los últimos años, la mayoría de los países están avanzando muy poco o nada para terminar con la corrupción, mientras que un análisis más profundo demuestra que los periodistas y activistas de los países más corruptos arriesgan la vida todos los días para hacerse escuchar8.
Con anterioridad, el patrocinio directo generalmente implicaba la elección del HCP por parte del sector y que este sector le hiciera un pago directo al HCP, a su institución o a un proveedor para que el HCP tuviera cubierto el viaje, el alojamiento, las comidas, otros gastos de transporte, los aranceles de inscripción a las conferencias u otros costes asociados con las conferencias educativas de terceros, tales como aquellas organizadas por el European Council of Enterostomal Therapy (ECET), la Society of Urologic Nurses and Associates (SUNA), el Symposium on Advanced Wound Care (SAWC), los congresos de WOCN o WCET2. Esto es, o ya ha sido, descartado en muchos países; MedTech Europe ilustra los lugares donde está prohibido el patrocinio directo7 (Figura 3).
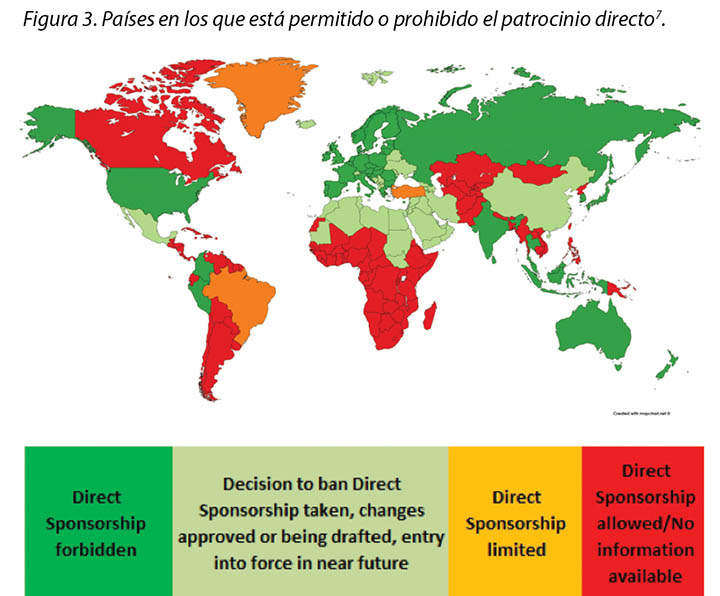
Además, el concepto de patrocinio directo puede implicar arreglos en los que el sector elija o influya en la elección de un HCP específico a través de su institución u organismo profesional, o que recibió información de antemano de la identidad de un HCP específico que podría ser directamente beneficiado por la financiación del sector2. Esta práctica es un método ‘indirecto’ de lograr el mismo objetivo de patrocinio directo por el cual aún existe el patrocinio deliberado de un HCP específico. Como tal, esto tampoco es permisible. Como consecuencia, la financiación debe ser indirecta mediante una beca educativa. MedTech Europe elabora otro nivel al hacer cumplir algunos requisitos de transparencia para todas las becas educativas provistas por el sector para las organizaciones de atención de la salud. El acceso al informe de transparencia está disponible en: https://www.ethicalmedtech.eu/transparent-medtech/.
Reglas de participación generales para el HCP con el sector
Hay varios temas para debatir con respecto a algunas reglas de participación para los HCP con el sector, que incluyen entretenimiento, hospitalidad, lugares y ubicación para eventos, viajes, contratación, remuneración/compensación, transparencia, regalos y muestras. Cada uno de los debates con respecto a éstos describe los estándares de cumplimiento normativo a nivel global.
Entretenimiento
Se prohíbe que el sector organice eventos para la industria -entre los que se incluyen actividades sociales, deportivas o recreativas, u otras formas de entretenimiento- que no tengan valor en términos de educación; por ejemplo, ofrecer un cantante famoso para un evento, llevar al personal de enfermería a un día de tratamiento en un spa para que le sirva de ejemplo de cómo manejar los problemas de la piel de los pacientes, crear diseños artísticos/animales para diversión utilizando dispositivos de uso médico específicos que no tienen relación con el uso previsto, etc. También se prohíbe que el sector respalde dicho entretenimiento cuando forme parte de un evento de un tercero, por ejemplo, música en vivo, evento deportivo, concurso de baile. Sin embargo, hay alguna tolerancia con respecto a un evento de terceros cuando dicho entretenimiento se lleve a cabo fuera de un programa educativo/científico pagado por el HCP, no predomine/interfiera con el programa educativo, y no sea el atractivo principal.
Hospitalidad
La hospitalidad en este sentido se relaciona con las comidas o el alojamiento. El alojamiento debe estar subordinado al tiempo, sin prolongar la estancia a menos que sea pagada por el HCP. Solo debe ser por el tiempo necesario de duración del evento/reunión. A menudo, algunas de estas reglas están determinadas por el tipo de reunión que se organiza; por ejemplo, si la reunión se clasifica como ‘activa’ o ‘pasiva’. Los eventos activos son aquellos en los que se espera que el HCP participe activamente y aporte a la reunión, por ejemplo, un Panel de Asesoramiento Clínico o un Panel de Consenso. En estos tipos de eventos, el HCP en esencia está ‘trabajando’ y se espera que los costes incurridos por asistir a la reunión sean reembolsados por el sector. Por el contrario, los eventos pasivos son los que el sector presenta al público sin que sea necesaria la interacción recíproca del HCP. Con respecto a los eventos promocionales organizados por el sector, aunque sean educativos, este no debe pagar el transporte o los aranceles; por ejemplo, el lanzamiento de un producto nuevo. Se espera que el HCP cubra estos costes por sí mismo, dado que se considera un evento pasivo. Sin embargo, se permiten comidas modestas en un evento de educación pasivo.
Por lo general, las comidas y el alojamiento deben estar focalizados en el objetivo del evento y deben considerarse razonables; por ejemplo, se espera que el HCP pague estos gastos. Las asociaciones comerciales han establecido las recomendaciones en torno a estos valores en las leyes locales, y estas se han establecido en la mayoría de los países del mundo. Los montos máximos para almuerzos y cenas han sido descritos por cada país; generalmente, la regla que se aplica es la de la ley vigente del país donde el HCP tiene licencia para ejercer.
Lugares y ubicación para eventos
El sector debe respetar los siguientes criterios al elegir el lugar del evento.
- Imagen percibida: cómo podría ser visto por el público.
- Centralidad: si está ubicado en un lugar central para los participantes.
- Facilidad de acceso: si es de fácil acceso mediante transporte, cerca de un aeropuerto/lugar de eventos. Se prefiere un centro comercial o científico reconocido.
- Momento del año: idealmente no debe estar asociado con una temporada turística.
- Adaptado al objetivo de la reunión: que los salones sean adecuados para el uso propuesto.
Un sitio para un evento donde el objetivo de la reunión parezca secundario con respecto a la ubicación se percibe como un incentivo para que asista el HCP basado en el lugar y no en el contenido u objetivo de la reunión. Como tal, las ubicaciones de los eventos no deben ser lujosas, tales como instalaciones cinco estrellas, predios de golf o complejos de spa, etc. Si el HCP se da cuenta de que el lugar del evento es inadecuado (por ejemplo, un parque de entretenimientos o un complejo), el HCP debe volver a considerar su participación en el evento.
Viajes
Cuando el sector organiza los viajes, estos deben estar vinculados directamente con la duración de la reunión y no se pueden extender con el fin de visitar la ciudad/realizar visitas de familia, etc. El sector no puede cubrir un período de estancia más allá de la duración oficial del evento.
Los viajes están vinculados solo con el objetivo de la reunión y, al igual que la hospitalidad, deben ser modestos y razonables, sin pasajes aéreos en primera clase o en clase ejecutiva. Los gastos de viajes relacionados para las reuniones activas, tales como estacionamiento, pasajes de tren, etc., son reembolsables, pero se deben acordar antes de realizar el gasto.
Contratos
El sector puede contratar a HCP como consultores y asesores para brindar consultoría y otros servicios de buena fe, que incluyen estudios de investigación, participación en paneles de ostomía/asesoramiento de heridas, presentaciones en eventos educativos en el sector y nuevos desarrollos de productos. Al elegir al HCP, deben utilizarse criterios adecuados que incluyen:
- Interés legítimo: el sector no debe contratar al HCP ‘por las dudas’ o por si hay una falta de competencia interna.
- Calificaciones adecuadas: el HCP debe estar técnica y científicamente cualificado con las competencias adecuadas para lograr esta tarea. El sector debe recopilar los CV para documentación y para justificar cualquier compensación.
- Sin ganancia financiera: la elección no debe estar asociada con las ventas para evitar cualquier influencia.
Los contratos con el HCP no deben, de ningún modo, estar supeditados a la compra, alquiler, recomendación, receta, uso, suministro o adquisición pasada, presente o futura de los productos o servicios del contratista por parte del potencial consultor. En otras palabras, no se espera que haya una ‘contraprestación’ del sector para que el HCP utilice/recete sus productos.
Los contratos deben incluir la documentación adecuada para justificar la compensación, si la hubiere, pagada al HCP. MedTech Europe y AdvaMed tienen requisitos específicos para los acuerdos escritos con el HCP1,7. Los contratos también protegen al sector garantizando que se mantenga la confidencialidad de los proyectos para nuevos productos o estrategias de modo que estos no se compartan con la competencia. El sector también mantiene los derechos para usar el material/la investigación/los estudios desarrollados por el HCP durante la tarea asignada. Por último, los contratos deben ser transparentes. Ellos aseguran la información de y hacia el empleador del HCP respecto de la existencia del contrato, establecen exactamente cuál es la tarea y qué compensación (si la hubiere) se le paga al HCP.
Remuneración/compensación
Cuando se compense al HCP por sus servicios, dicha compensación razonable y acorde al valor razonable de mercado (fair market value, FMV) debe estar en consonancia con el valor de mercado para los servicios prestados por dicho HCP y por el tipo de servicio. Se debe solicitar orientación sobre el FMV a los funcionarios encargados del cumplimiento o a la asociación local de HCP, por ejemplo, la NMBA. Además, se debe retener la documentación correspondiente al tipo y a la duración del servicio con la remuneración correspondiente, que debe estar firmada tanto por el sector como por el HCP antes del evento.
Transparencia
Antes de contratar al sector, como una mejor práctica, se sugiere enfáticamente que el HPC obtenga la aprobación/notificación de su empleador. Si bien no siempre es obligatorio, esta transparencia cubre a ambas partes en caso de que surja alguna cuestión con respecto a los conflictos de intereses. El empleador del HCP debe recibir información completa sobre el objetivo y el alcance del acuerdo de la consultoría. Además, todos los contratos del sector deben contener una cláusula sobre la obligación del HCP de notificar la existencia del acuerdo a su personal jerárquico. Es conveniente verificar los requisitos locales.
Regalos
En principio, se le prohíbe al sector dar regalos al HCP. Puede que sea necesario analizar las costumbres locales para determinar si esto está permitido. Por ejemplo, con frecuencia se espera que en Japón y Tailandia se entreguen regalos de agradecimiento. Estos no deben ser excesivos y no deben crear ninguna expectativa de contraprestación. Pueden entrar en juego las costumbres y leyes locales; sin embargo, en caso de ambigüedad se recomienda verificar con un funcionario responsable del cumplimiento antes de hacer regalos. En algunos países, ya no está permitido dar regalos de cumpleaños, o tarjetas o flores de condolencias, y se deben evaluar las leyes locales antes de analizar la posibilidad de ofrecer dichos regalos.
En circunstancias especiales, el sector puede brindar artículos educativos económicos o regalos según las leyes, las reglamentaciones y los sectores locales, y los códigos de conducta profesional del país donde el HCP tiene la licencia. Se excluyen artículos ‘educativos’ como reproductores de DVD para reproducir películas educativas, o cámaras para el cuidado de heridas, dado que estos se pueden utilizar para otros fines. Los regalos educativos aceptables pueden ser cupones para libros exclusivamente educativos (médicos), inscripción para eventos de terceros o cursos educativos, aunque estos se les pagan solo a terceros; no se debe pagar con efectivo a ningún HCP. Nuevamente, se exige total transparencia y se debe proporcionar la documentación para cubrir a ambas partes.
Muestras
El sector debe ofrecer productos como muestras sin cargo a fin de que el HCP pueda evaluar o familiarizarse con el uso y la funcionalidad segura, eficaz y adecuada del producto. Esto les permitirá a los HCP determinar si, o cuando, usar, ordenar, comprar, recetar o recomendar el producto y/o servicio en el futuro. La entrega de muestras no debe recompensar, inducir o alentar al HCP de manera inadecuada a comprar, alquilar, recetar, usar, suministrar ni adquirir sus productos o servicios.
Cualquier ofrecimiento o entrega de muestras siempre debe hacerse en cumplimiento de las leyes nacionales aplicables, reglamentaciones y código de conducta del sector o profesional.
Las recientes leyes europeas y estadounidenses, así como también los lineamientos MedTech en la UE7 exigen que se lleven los registros adecuados con relación a la provisión de las muestras a los HCP; por ejemplo, registro de comprobantes de entrega de muestras. Ahora se exige que estas se registren en los libros como sin cargo; además, estas y otras condiciones aplicables para la entrega de dichas muestras deben estar claramente declaradas, por escrito y al momento de la entrega, a los HCP.
La preocupación es la sobreoferta de muestras (dumping) que se puede percibir como un incentivo para usar ciertos productos. Las muestras, según lo descrito, deben ser modestas. Como dato anecdótico se puede mencionar que para el sector de ostomía, parece haber una sobreoferta (acopio) de productos en muchas instituciones en lugar de que dichas instituciones compren esos productos. Se necesita un mayor control con respecto a esta práctica.
Signos de alerta, advertencias
El HCP debe familiarizarse antes de tener en cuenta las interacciones con el sector en cuanto a diferentes problemas. Hay ciertos ‘indicadores de alerta’ comunes que deberían generar alertas en la mente del HCP, que incluyen situaciones donde haya:
- Palabras o frases como ‘ganar’, ‘regalo’ o ‘premio’.
- No existe relación profesional educativa asociada con el beneficio.
- Entretenimiento.
- Presentación para ‘concursos’ juzgados solo por los fabricantes del sector (no por terceros).
- Un valor que es alto en comparación con el esfuerzo requerido.
- Cualquier cosa que parezca ‘demasiado buena para ser verdad’.
- Exceso de muestreo (dumping) de productos.
Reglas de oro generales para proteger a los HCP
- Conseguir todas las reglas de participación del fabricante del dispositivo.
- Revisarlas con los gerentes/comité de auditoría del empleador existente.
- Verificarlas con el organismo profesional, tanto local como nacional.
- Revisar cualquier lineamiento, tanto local, nacional o institucional.
- En caso de duda, no haga nada.
- Tenga en cuenta los ‘puntos de vista’, ¿cómo podría verse esta interacción en las noticias? ¿Es esto transparente y está libre de posibles malos entendidos?
Conclusión
Hay riesgos para el HCP al participar con el sector y las reglamentaciones y leyes cambian constantemente. Es difícil permanecer a la vanguardia y estar informados de estos cambios continuos; sin embargo, el objetivo de este documento es generar concienciación de este panorama tan cambiante. Para el HCP, es una idea inteligente verificar y seguir las reglas de participación, observarlos signos de alerta y, si hay dudas, equivocarse por precavido y sencillamente no participar. En última instancia, el objetivo de cada parte es mejorar los resultados del paciente y generar una dinámica próspera que sea compatible. Las interacciones entre el sector y el HCP son inevitables, pero si la relación es abierta, honesta y transparente, con reglas claras de participación y supervisión, estas relaciones pueden ser extremadamente fructíferas para cada parte.
Descargo de responsabilidad
Las leyes de los organismos reguladores se actualizan con frecuencia. Al momento de la impresión, este es un supuesto razonable de las prácticas actuales. Como siempre, si hay alguna duda antes de que actuar sigue siendo recomendable buscar más orientación del organismo regulador local del HCP o empleador.
Conflicto de intereses
Los autores declaran que no hay conflictos de intereses.
Financiación
Los autores no recibieron financiación para este estudio.
Author(s)
Paris Purnell
Senior Manager, Clinical Education
Hollister Incorporated, Illinois, USA
Email paris.purnell@hollister.com
References
- Advanced Medical Technology Association. AdvaMed code of ethics on interactions with U.S. health care professionals [Internet]. Washington: Advanced Medical Technology Association 2018 [cited 2019 July 1]. Available from: https://www.advamed.org/sites/default/files/resource/advamed_u.s._code_of_ethics_final_-_eff._jan_1_2020.pdf
- Advanced Medical Technology Association. AdvaMed code of ethics on interactions with Chinese health care professionals [Internet]. Washington: Advanced Medical Technology Association 2018 [cited 2019 July 1]. Available from: https://www.advamed.org/sites/default/files/resource/revised_china_code_language_-_english_final.pdf
- Nursing and Midwifery Board of Australia. Code of conduct for nurses [Internet]. Melbourne: Nursing and Midwifery Board of Australia 2018 [cited 2019 Sept 4]. Available from: https://www.nursingmidwiferyboard.gov.au/Codes-Guidelines-Statements/Professional-standards.aspx
- Wound Ostomy and Continence Nurses Society. WOCN code of conduct and conflict of interest disclosure statement [Internet]. Mount Laurel, NJ: WOCN 2019 [cited 2019 Sept 4]. Available from: https://app.smartsheet.com/b/form/28f0d3b7212348daac48bb8f35def327
- World Council of Enterostomal Therapists. The WCET mission, vision, values statement [Internet]. Washington: WCET 2018 [cited 2019 Sept 4]. Available from: https://www.wcetn.org/mission-values-a-vision
- Medical Technology Association of Australia. Code of practice E10 [Internet]. Sydney: Medical Technology Association of Australia 2018 [cited 2019 July 1]. Available from: https://www.mtaa.org.au/code-of-practice
- MedTech Europe. Code of ethical business practice: open letter to the healthcare community [Internet]. From the Legal and Compliance team of MedTech Europe. MedTech Europe 2017 [cited 2019 July 1]. Available from: http://www.medtechviews.eu/article/code-ethical-business-practice-open-letter-healthcare-community?
- Transparency International. Corruption perceptions index 2017 [Internet]. Berlin: Transparency International 2018 [cited 2019 July 1]. Available from: https://www.transparency.org/news/feature/corruption_perceptions_index_2017



