Volume 40 Number 4
Skin care for the protection and treatment of incontinence associated dermatitis (IAD) to minimise susceptibility for pressure injury (PI) development
Hiske Smart and R Gary Sibbald
Keywords pressure injuries, incontinence associated dermatitis, IAD, IAD skin protection
For referencing Smart H & Sibbald RG. Skin care for the protection and treatment of incontinence associated dermatitis (IAD) to minimise susceptibility for pressure injury (PI) development. WCET® Journal 2020;40(4):40-44
DOI https://doi.org/10.33235/wcet.40.4.40-44
Abstract
This manuscript summarises the important clinical concept of having a skin care protocol to protect and treat skin against incontinence associated dermatitis (IAD) to prevent and minimise the association IAD has on the subsequent development of pressure injuries (PI).
Skin protection for all skin tones is imperative to protect skin against exaggerated late presentations of IAD.
Introduction
Preserving the barrier function of the skin is an important clinical practice role that is often found in the nursing practice domain. Incontinence associated dermatitis (IAD) frequently includes severe discomfort to patients and tends to develop quickly in white skinned individuals and later, but in exaggerated form, in persons with darker tones of skin; this is due to the first clinical visual cues being obscured and not identified. Using evidence from the literature with clinical examples, the authors will highlight zinc oxide paste as a care option in the clinical setting due to ease of availability and relative low cost.
Incontinence Associated Dermatitis (IAD)
IAD is one of the four aetiologies included in the moisture associated dermatitis (MASD) category. IAD has been defined in the literature as a “form of irritant contact dermatitis that develops from chronic exposure to urine or liquid stool”1–3. The aetiology is believed to be from prolonged exposure of skin to urine or liquid stool (often in combination), with a resulting change of the normal acid pH of the skin into an alkaline pH level.1–6 Once the ‘acid mantle’ of the skin is compromised, the skin can undergo an inflammatory response (erythema) to the moisture from urine and/or faeces and the skin barrier may become compromised1–6.
Red skin (erythema) looks different depending on the natural pigmentation of the skin5. In brown or black skin, the erythema may not appear red but can have a darker tone to the surrounding skin and create diagnostic difficulty in examining the skin (Figure 1). Skin damage prevention is always better than treatment, but early skin damage is often harder to detect in darker skin tones5, leading to late initiation of interventions.
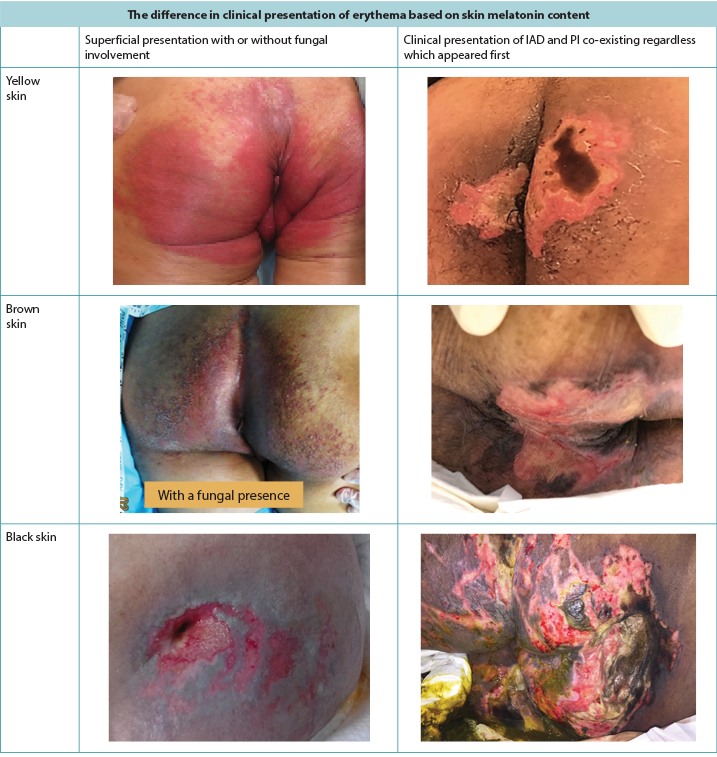
Figure 1. Clinical presentation of erythema and IAD co-existing with PI as seen in darker skin tones (Table and photos © Smart & Sibbald)
Pressure Injuries (PI) and IAD in combination
The literature supports an association between IAD and pressure injury (PI) formation, although the aetiology differs between the two7–11. Lachenbruch et al.8 analysed 176,689 patients and found that 92,889 persons with incontinence had a 16.3% incidence of PIs as opposed to continent persons (n=83,800) with an incidence of 4.1%. IAD was associated with a higher incidence of PIs than predicted by the Braden Risk Scale Score alone. Gray and Giuliano9 evaluated 5,342 patients, of whom 2,492 (46.6%) were incontinent of urine. They concluded that 21.3% of IAD may be associated with secondary yeast infection, immobility and an increased incidence of sacral PIs9.
Clinically, PIs present themselves over distinct bony prominences with distinct borders10. IAD, on the other hand, has a more diffuse appearance that may be present in the perineal area and spread out over the buttock area, causing a distinct dermatitis on the skin in prolonged contact with the incontinence content2,3,5,10. When they co-exist, the IAD diffuse pattern remains in exaggerated form8,9 (Figure 2). McNichol and colleagues4 summarised the literature on the importance of treating IAD aggressively in an attempt to decrease the subsequent development of PIs.
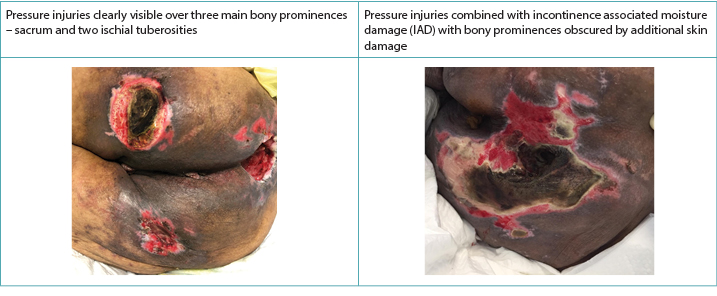
Figure 2. PIs alone and when co-existing with IAD in darker skinned persons (Table and photos © Smart & Sibbald)
Further support to this IAD/PI association is documented in the most recent European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel, and Pan Pacific Pressure Injury Alliance Pressure Injury Guideline10. Three guideline elements are crucial to practice with regards to IAD and PI co-existence. The one relates to the loss of the inert protective ability of the skin with the statement: “Moisture associated skin damage may compromise the epidermis barrier function and hence predispose tissue to pressure injury”10(p.21). The other relates to the ability of skin to tolerate additional forces if compromised by surface moisture: “Skin surface moisture combined with pressure and/or shear can increase the incidence of pressure injuries”10(p.86).
Yet another statement, that may sound contradictory in nature, also advises against ultra-dry dehydrated or flaky skin as a risk factor for skin breakdown when in contact with incontinence content:
Although research directly linking skin moisturizing to reduction in pressure injury incidence is lacking, one epidemiological study in hospitalized individuals with limited mobility (n=286) noted that dry skin was a significant and independent risk factor for pressure injuries in a multi-variate analysis 21 (Level 3 prognostic). Regular application of a moisturizer in a skin hygiene regimen is suggested for promoting skin hydration and preventing other adverse skin conditions, including dry skin and skin tears10(p.86).
Barrier Function and skin protective intervention strategies
The key is to keep skin well moisturised as that maintains the moisture protective gradient of skin4,8,12,13. In white skinned individuals this moisture unit protective gradient is three times lower than in darker skinned persons (2:6 ratio)12. This explains the risk of dry skin as a factor in moisture damage from stool enzymes and urine urea that occurs in white skinned persons far quicker than in persons with darker skin tones. The quality of the stratum corneum is also important as it is on its thinnest on the two opposite ends of the age continuum (babies13 and the frail aged14). Early intervention to treat the cause of the incontinence needs to be achieved in conjunction with a skin care protocol to protect, maintain and restore the skin’s barrier4–8,11.
In clinical practice, raising awareness of staff nurses and non-healthcare professionals and including the person’s family involved in their care about the use of appropriate skin cleansing products is vital. Educational enablers are easy ways to summarise key points and provide caregiver learnings about essential components regarding care. One such educational enabler for IAD skin care is the use of the ACT mnemonic to guide the clinician into a comprehensive skin care approach4 (Figure 3).

Figure 3. Clinical enabler to guide skin care in the presence of IAD
Skin care options
Skin cleansing after episodes of incontinence has evidence at B2 level as an effective intervention to remove residual surface debris from stool or urine on skin10. Neutral soaps or superfatted products15 are better options than ordinary soaps that are too alkaline (pH 9–10). This pH extreme either disrupts the skin’s acid mantle or damages structural proteins present in skin. Proper rinsing and gently patting the skin dry add additional value to skin protection as it prevents vigorous rubbing or massaging that may lead to micro-damage of the skin and substructures10,11.
Use of skin barriers
The natural moisturising factor of skin is achieved by in-built humectants to keep the skin surface moisture content at 10% for intact skin14. Products that do not alter the pH (as bacteria thrive in an alkaline environment10) and provide a barrier from incontinence are preferable and imperative to achieve better skin restoration outcomes4–8,16,17. Moisturisers frequently used in skin protection protocols could be either in a humectant or an emollient form. Humectants are available in many forms that may contain liquid-forming acrylates, ceramides, urea, lactic acid or glycerin, with the purpose to bind water to the skin surface16,17. It may cause local stinging and burning when water is drawn from the deeper layers. If applied after washing or bathing while the skin is still damp (within 2–3 minutes), this is prevented16. Emollients, on the other hand, can be applied at any time; they prevent insensible losses of moisture from the skin surface18. Since skin damaged from IAD can be painful, products that do not sting or burn on application may be better to address patient-centred concerns of pain management.
Zinc oxide as an example of an emollient in IAD preventative care
Zinc oxide is an enhanced barrier that prevents bacteria, contact irritants (e.g. stool, urine) and allergens from penetrating the skin. In zinc oxide ointment preparations, zinc oxide is combined with petrolatum as it creates a ‘stiff’ barrier, providing additional skin adherence and protection. It is less likely to soften or migrate from the skin into any co-existing deeper wound in that same area than with the petrolatum base alone18.
The 2016 Cochrane review on the prevention and treatment of IAD in adults17 cited several trials on zinc ointment that prevented or successfully treated IAD. The zinc oxide ointments do not always need to be removed if the surface is clean, but can be left to fill in the spaces. By using a clean tongue depressor to spread the zinc oxide preparation evenly, it helps to minimise the frictional resistance on the skin often encountered in application. It is well known that the topical application of zinc on skin adds to enhancement of the local defence systems in skin against superficial infection, while increasing epithelium migration to quickly cover any small lesion in the area18. Since the German dermatologist Unna created the zinc oxide paste bandage for venous ulcers in 1895, sufficient evidence has existed on its effect on aiding skin healing, with no currently documented adverse systemic effects encountered16. Although further robust studies are needed, zinc paste preparations are known to be effective skin protectants17 and are safe enough for use on babies13.
From a practice perspective, on skin without erythema or in the presence of mild redness, a zinc oxide barrier can be applied with ease using a gloved hand or tongue depressor. If there are erosions (loss of surface epidermis with an epidermal base as opposed to a dermal or deeper base) or satellite papules or pustules indicating candidiasis, a topical antifungal agent would then be required as a first layer. The antifungal agent can be applied first to the skin as a treatment and then the protective layer of zinc oxide is added as the second layer. This often poses as a practice challenge, as application in the presence of moisture is difficult. By layering the zinc ointment on a carrier medium (either on plain gauze or on impregnated gauze if available) and then applying this carrier as a last layer upside down on the area, this challenge can be averted. If the zinc oxide wears off between episodes of incontinence, a repeat layer can be applied once or twice a day. With consistent episodes of incontinence, skin cleansing, gentle pat drying and barrier ointment application should be repeated every time as soon as the incontinence occurs10,11.
Conclusion
Healthy skin requires it to be intact and have a stratum corneum moisture content of 10%. Incontinence of stool and urine can compromise this barrier in both white and darker skinned persons while adding to susceptibility of IAD and PI development. Skin protection for all skin tones is imperative to protect darker skin against exaggerated late presentations of IAD. Zinc oxide ointment provides an evidence-based ideal skin barrier that is readily available even in the most resource restricted environments. Proper application and use thereof has sufficient evidence10 to incorporate this in skin protective strategies to prevent and treat this common skin problem, especially in the young and aging populations with incontinence issues.
Conflict of Interest
Both authors have received an educational grant from Calmoseptine to teach the WoundPedia course in Manila, Philippines.
Cuidado de la piel para la protección y el tratamiento de la dermatitis asociada a la incontinencia (DAI) para minimizar la predisposición a desarrollar una lesión por presión (PI)
Hiske Smart and R Gary Sibbald
DOI: https://doi.org/10.33235/wcet.40.4.40-44
Resumen
El presente original resume el concepto clínico importante de tener un protocolo para el cuidado de la piel para proteger y tratar la piel con respecto a la dermatitis asociada a la incontinencia (DAI) para prevenir y minimizar la asociación que tiene la DAI en el desarrollo posterior de las lesiones por presión (PI, por sus siglas en inglés).
La protección de la piel para todas las tonalidades de piel es imperativa para proteger la piel de presentaciones tardías y exageradas de la DAI.
Introducción
Una función importante de la práctica clínica que a menudo se encuentra en el área de la práctica de enfermería es la conservación de la función de barrera de la piel. La dermatitis asociada a la incontinencia (DAI) con frecuencia provoca un malestar grave en los pacientes y tiende a desarrollarse rápidamente en personas con piel blanca y después, aunque de manera exagerada, en personas con tonos de piel más oscuros. Esto se debe a que las primeras señales visuales clínicas se oscurecen y no se identifican. Utilizando testimonios de la bibliografía con ejemplos clínicos, los autores siempre destacan la pasta de óxido de zinc como una opción de cuidado en el entorno clínico debido a la facilidad de su disponibilidad y al coste relativamente bajo.
Dermatitis asociada a la incontinencia (DAI)
La DAI es una de las cuatro etiologías incluidas en la categoría de dermatitis asociada a la humedad (MASD). La DAI ha sido definida en la bibliografía como una “forma de dermatitis irritante de contacto que se desarrolla por la exposición crónica a la orina o a las heces líquidas”.1–3 Se cree que la etiología se debe a la exposición prolongada de la piel a la orina o a las heces líquidas (a menudo combinadas), hecho que provoca un cambio del pH ácido normal de la piel a un nivel de pH alcalino.1–6 Una vez que el ‘manto ácido’ de la piel está comprometido, la piel puede tener una respuesta inflamatoria (eritema) a la humedad de la orina o de las heces, y la barrera cutánea puede verse comprometida.1–6
La piel roja (eritema) se ve diferente según la pigmentación natural de la piel.5 En la piel marrón o negra el eritema puede no aparecer rojo, sino que la piel que lo rodea puede tener un tono más oscuro; esto genera dificultad para realizar un diagnóstico al examinar la piel (Figura 1). La prevención del daño de la piel es siempre mejor que el tratamiento, aunque a menudo es más difícil detectar el daño precoz en la piel de tonos de piel más oscuros5, que implica un inicio tardío de las intervenciones.
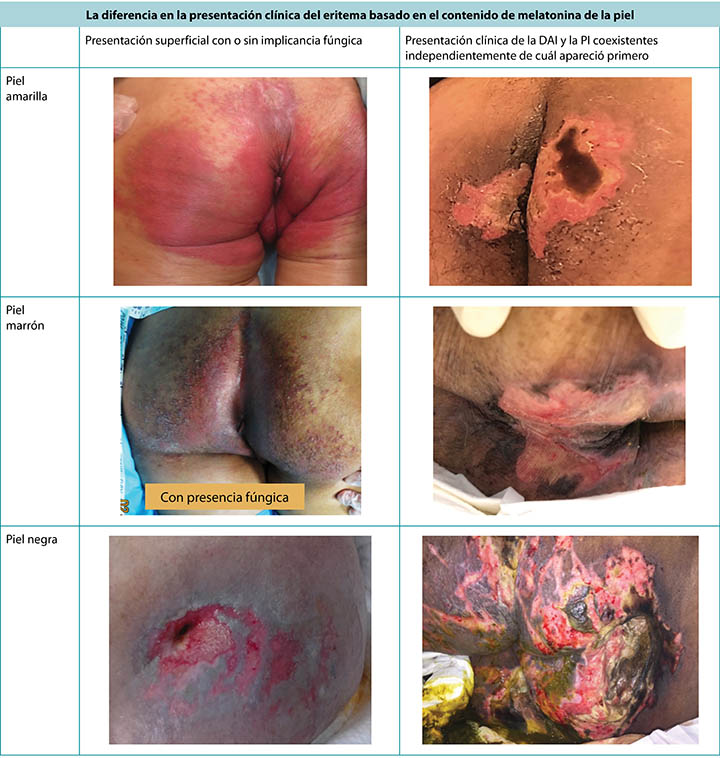
Figura 1. Presentación clínica de eritema y DAI que coexiste con la PI como se ven en tonos de piel más oscuros (Cuadro y fotos © Smart & Sibbald)
Combinación de lesiones por presión (PI) y de DAI
La bibliografía confirma [que existe] una asociación entre la DAI y la formación de lesiones por presión (PI), a pesar de que la etiología difiere entre ambas.7–11 Lachenbruch y cols.8 analizaron a 176 689 pacientes y encontraron que 92 889 personas con incontinencia tenían una incidencia de un 16,3 % de PI en contraposición a las personas continentes (n=83 800) con una incidencia de un 4,1 %. La DAI fue asociada con una incidencia mayor de PI que la establecida por la puntuación de la escala de riesgo de Braden solamente. Gray y Giuliano9 evaluaron a 5342 pacientes, de los cuales 2492 (46,6 %) tenían incontinencia urinaria. Llegaron a la conclusión de que un 21,3 % de las DAI puede estar asociado a una infección secundaria por levaduras, inmovilidad y por una mayor incidencia de la PI sacra.9
Desde el punto de vista clínico, las PI se presentan en distintas prominencias óseas con diferentes bordes.10 La DAI, por otro lado, tiene un aspecto más difuso que puede aparecer en el área perineal y esparcirse hacia el área de las nalgas, provocando una dermatitis diferente en la piel al contacto prolongado con el contenido de la incontinencia.2,3,5,10 Cuando ellas coexisten, el patrón impreciso de la DAI sigue siendo exagerado8,9 (Figura 2). McNichol y colegas4 resumieron la bibliografía sobre la importancia de tratar la DAI de manera agresiva en un intento de disminuir el desarrollo posterior de las PI.
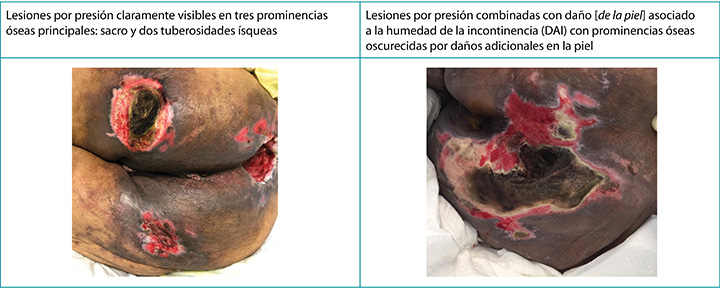
Figura 2. PI solas y cuando coexisten con DAI en personas de piel más oscura (Cuadro y fotos © Smart & Sibbald)
Un mayor respaldo a esta asociación de las DAI/PI se encuentra documentado en los lineamientos más recientes del Panel Consultivo Europeo para las Úlceras por Presión, del Panel Consultivo Nacional para las Lesiones por Presión y de los Lineamientos de la Alianza del Pacífico para las Lesiones por Presión10. Tres elementos de lineamientos son cruciales para la práctica con respecto a la coexistencia de la DAI y de la PI. Una se relaciona con la pérdida de la capacidad protectora inerte de la piel según la [siguiente] afirmación: “El daño de la piel asociado con la humedad puede comprometer la función de barrera de la epidermis y, por consiguiente, predisponer el tejido a la lesión por presión”.10 (p. 21) La otra se relaciona con la capacidad de la piel de tolerar presiones adicionales si se encuentra comprometida por la humedad de la superficie: “La humedad de la superficie de la piel combinada con la presión o la fricción puede aumentar la incidencia de las lesiones por presión”10 (p. 86).
Incluso otra afirmación, que puede sonar contradictoria por naturaleza, también desaconseja la deshidratación de la piel ultra seca o piel escamada como un factor de riesgo de colapso de la piel cuando está en contacto con el contenido de la incontinencia:
A pesar de que falta investigación que relacione de manera directa la humectación de la piel con la incidencia de las lesiones por presión, en un estudio epidemiológico realizado en personas hospitalizadas con movilidad limitada (n=286) se observó que la piel seca era un importante factor de riesgo independiente para las lesiones por presión en 21 análisis de múltiples variantes (pronóstico de nivel 3). Se sugiere la aplicación habitual de un humectante para realizar la higiene de la piel con el objeto de promover la hidratación de la piel y prevenir otras enfermedades perjudiciales de la piel, que incluyen la piel seca y el desgaste de la piel.10 (p. 86)
Función de barrera y estrategias de intervención protectoras de la piel
La clave es mantener la piel bien humectada, dado que eso mantiene la humedad del gradiente protector de la piel.4,8,12,13. En las personas de piel blanca este gradiente protector de la unidad de humectación es tres veces más bajo que en las personas de piel más oscura (proporción 2:6).12 Esto explica el riesgo de piel seca como un factor del daño causado por la humedad producido por las enzimas de las heces y la urea de la orina que aparece en las personas con piel blanca con más rapidez que en [las personas con] tonos de piel más oscuros. También es importante la calidad del estrato córneo, dado que es muy fino en los dos extremos opuestos de todas las edades (bebés13 y edad frágil14). Es necesario lograr la intervención precoz para tratar la causa de las necesidades para incontinencia junto con un protocolo de cuidado de la piel para proteger, mantener y recuperar la barrera cutánea.4–8,11
En la práctica clínica, es esencial generar concienciación en el personal de enfermería y en los profesionales que no son de la salud, e incluir a la familia de las personas para que participe en su cuidado con respecto al uso de los productos adecuados para la limpieza de la piel. Los recursos educativos son maneras fáciles de resumir los puntos clave y brindar a los cuidadores el aprendizaje sobre los componentes esenciales con respecto al cuidado. Uno de esos facilitadores educativos para el cuidado de la piel de DAI es el uso de la nemotecnia ACT (por sus siglas en inglés) para orientar al médico hacia un enfoque integral del cuidado de la piel4 (Figura 3).

Figura 3. Facilitador clínico para dar una orientación con respecto al cuidado de la piel en presencia de una DAI
Opciones para el cuidado de la piel
La limpieza de la piel después de episodios de incontinencia tiene pruebas de nivel B2 como una intervención eficaz para quitar la suciedad residual superficial de las heces o de la orina en la piel.10 Los jabones neutros o productos supergrasos15 son mejores opciones que los jabones comunes que son demasiado alcalinos (pH 9–10). Este pH extremo altera el manto ácido de la piel o daña las proteínas estructurales presentes en la piel. Un enjuague adecuado y golpecitos suaves sobre la piel seca agregan valor adicional a la protección de la piel, dado que evitan el frotado o el masaje en exceso que puede provocar un micro daño en la piel y en las subestructuras.10,11
Uso de barreras cutáneas
El factor humectante natural de la piel se logra por medio de humectantes incorporados para mantener el contenido húmedo de la superficie de la piel a un 10 % para la piel intacta.14 Son preferibles los productos que no alteran el pH (dado que las bacterias prosperan en un entorno alcalino10) y que ofrecen una barrera para la incontinencia, y que son imprescindibles para lograr mejores resultados de recuperación de la piel4–8,16,17. Los humectantes utilizados con frecuencia en los protocolos de protección de la piel podrían ser en forma de humectante o de emolientes. Los humectantes están disponibles de diversas maneras y pueden contener acrilatos formadores de líquidos, ceramidas, urea, ácido láctico o glicerina, con el objetivo de unir el agua a la superficie de la piel.16,17 Esto puede provocar un dolor punzante y ardor local cuando se quita el agua de las capas más profundas. Esto se evita si se los aplica después de lavarse o bañarse mientras la piel aún está húmeda (dentro de los 2 o 3 minutos).16 Los emolientes, por otro lado, se pueden aplicar en cualquier momento; evitan pérdidas insensibles de humedad de la superficie de la piel.18 Dado que la piel dañada por una DAI puede ser dolorosa, los productos que no producen dolor punzante o ardor al aplicarlos pueden ser mejores para abordar las preocupaciones del paciente con respecto al manejo del dolor.
El óxido de zinc es un ejemplo de emoliente para el cuidado preventivo de la DAI
El óxido de zinc es una barrera mejorada que evita que las bacterias, los irritantes de contacto (p. ej. heces, orina) y los alérgenos penetren en la piel. En las preparaciones de ungüentos con óxido de zinc, el óxido de zinc está combinado con la vaselina, dado que genera una barrera ‘rígida’, que brinda mayor adhesión a la piel y protección. Es menos probable que se ablande o que migre de la piel a una herida coexistente más profunda en la misma área que solamente con la base de vaselina.18
La revisión de Cochrane de 2016 sobre la prevención y el tratamiento de las DAI en adultos17 citó varios estudios sobre el ungüento con zinc que previno o trató la DAI de manera exitosa. No siempre es necesario quitar los ungüentos de óxido de zinc si la superficie está limpia, pero se pueden dejar para rellenar espacios. La utilización de un depresor lingual limpio para esparcir la preparación con óxido de zinc de manera uniforme ayuda a minimizar la resistencia de fricción en la piel que a menudo se produce durante la aplicación. Es bien sabido que la aplicación tópica del zinc en la piel aumenta el fortalecimiento de los sistemas de defensa locales de la piel contra infecciones superficiales, a la vez que incrementa la migración epitelial para cubrir con rapidez cualquier pequeña lesión en el área.18 Desde que el dermatólogo alemán Unna creó el vendaje de pasta de óxido de zinc para las úlceras venosas en 1895, han existido pruebas suficientes sobre su efecto para ayudar a cicatrizar la piel, sin que existan efectos sistémicos adversos actualmente documentados.16 Si bien son necesarios más estudios rigurosos, se sabe que las preparaciones de pasta de zinc son eficaces como protectoras de la piel17 y son lo suficientemente seguras para el uso en bebés.13
Desde una perspectiva práctica, se puede aplicar con cuidado una barrera con óxido de zinc sobre la piel sin eritema o en presencia de un enrojecimiento leve utilizando un guante o un depresor lingual. Si hay erosiones (pérdida de epidermis de la superficie con una base epidérmica en contraposición a una base dérmica o más profunda) o pápulas satelitales o pústulas que indican candidiasis, sería necesario utilizar un agente antifúngico tópico como primera capa. Primero se puede aplicar el agente antifúngico a la piel como tratamiento y después agregar la capa protectora de óxido de zinc como segunda capa. A menudo, en la práctica esto presenta un reto, dado que es difícil la aplicación en presencia de humedad. Esta dificultad se puede evitar colocando las capas del ungüento con zinc en un medio portador (ya sea una simple gasa o una gasa impregnada, si está disponible) y luego aplicando el portador como una última capa invertida en el área. Si el óxido de zinc desaparece entre episodios de incontinencia, se puede aplicar otra capa una o dos veces por día. Ante episodios constantes de incontinencia, la limpieza de la piel, el secado con golpecitos suaves y la aplicación del ungüento como barrera se deben repetir todo el tiempo apenas se produce la incontinencia.10,11
Conclusión
Es necesario que la piel sana esté intacta y que tenga un contenido humectante del estrato córneo de un 10 %. La incontinencia de las heces y de la orina puede comprometer esta barrera tanto en las personas blancas como en las de piel más oscura a la vez que aumenta la predisposición al desarrollo de la DAI y de la PI. La protección de la piel para todas las tonalidades de piel es imperativa para proteger la piel más oscura de presentaciones tardías y exageradas de la DAI. El ungüento con óxido de zinc brinda una barrera cutánea ideal basada en pruebas y que ya está disponible incluso en los entornos con recursos más restringidos. La aplicación adecuada y su uso tiene suficientes pruebas10 para incorporarlo a las estrategias de protección de la piel para evitar y tratar este problema común de la piel, especialmente en las poblaciones jóvenes o ancianas con problemas de incontinencia.
Conflicto de intereses
Ambos autores han recibido una beca educativa de Calmoseptine para dar un curso de WoundPedia en Manila, Filipinas.
Author(s)
Hiske Smart*
RN, MA (Nur), Hons BSocSc (Nur), PGDip (WHTR – UK), IIWCC (Can)
Nurse Manager and Clinical Nurse Specialist – Wound Care and Hyperbaric Oxygen Therapy Unit, King Hamad University Hospital, Kingdom of Bahrain
Secretary General – World Union of Wound Healing Societies
Email hiskesmart@gmail.com
R Gary Sibbald
BScMd, MEd, DSC (Hon), FRCPC (Med)(Derm), FAAD, MAPWCA, JM
Professor of Medicine and Public Health, University of Toronto
Director of International Interprofessional Wound Care Course (IIWCC) & Masters of Science Community Health (Prevention and Wound Care), Dalla Lana School of Public Health
Co-Editor in Chief Advances in Skin & Wound Care
Project Lead ECHO Ontario, Skin & Wound
Investigator, Institute Better Health, Trillium Health Partners
* Corresponding author
References
- Black JM, Gray M, Bliss DZ, et al. MASD part 2: incontinence-associated dermatitis and intertriginous dermatitis: a consensus. J Wound Ostomy Continence Nurs 2011;38(4):359–70.
- Gray M, Bliss DZ, Doughty DB, Ermer-Seltun J, Kennedy-Evans KL, Palmer MH. Incontinence associated dermatitis: a consensus. J Wound Ostomy Continence Nurs 2007;34(1):45–54.
- Gray M, Black JM, Baharestani MM, et al. Moisture-associated skin damage: overview and pathophysiology. J Wound Ostomy Continence Nurs 2011;38(3):233–41.
- McNichol LL, Ayello EA, Phearman LA, Pezzella PA, Culver EA. Incontinence-associated dermatitis: state of the science and knowledge translation. Adv Skin and Wound Care 2018;31(11):502–513.
- Ayello EA, Sibbald RG, Quiambao PCH, Razor B. Introducing a moisture-associated skin assessment photo guide for brown pigmented skin©. WCET J 2014;34(2):18–25.
- Beeckman D. A decade of research on incontinence-associated dermatitis (IAD): evidence, knowledge gaps and next steps. J Tissue Viabil 2017;26:47–56.
- Bateman SD, Roberts S. Moisture lesions and associated pressure ulcers: getting the dressing regimen right. Wounds UK 2013;9(2):97–102.
- Lachenbruch C, Ribbie D, Emmons K, Van Gilder C. Pressure ulcer risk in the incontinent patient: analysis of incontinence and hospital-acquired pressure ulcers from the International Pressure Ulcer Prevalence Survey. J Wound Ostomy Continence Nurs 2016;43(3):235–41.
- Gray M, Giuliano KK. Incontinence-associated dermatitis, characteristics and relationship to pressure injury: a multisite epidemiologic analysis. JWOCN 2018;45(1):63–67.
- European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel, and Pan Pacific Pressure Injury Alliance. Prevention and treatment of pressure ulcers/injuries: clinical practice guideline. The International Guideline. Emily Haesler (Ed). EPUAP/NPIAP.PPPIA:2019.
- Park KH, Kim KS. Effect of a structured skin care regimen on patients with fecal incontinence: a comparison cohort study. J Wound Ostomy Continence Nurs 2014;41(2):161–167.
- De Farias PT, Azambuja AP, Horimoto AR, et al. A population-based study of the stratum corneum moisture. Clin Cosmet Investig Dermatol 2016;9:79–87. doi:10.2147/CCID.S88485
- Shin HT. Diagnosis and management of diaper dermatitis. Pediatr Clin North Am 2014;61(2):367–382.
- Sopher R, Gefen A. Effects of skin wrinkles, age and wetness on mechanical loads in the stratum corneum as related to skin lesions. Med Biol Eng Comput 2011;49(1):97–105.
- Bou J, Segovia G, Verdu S, Nolasco B, Rueda L, Perejamo M. The effectiveness of a hyper oxygenated fatty acid compound in preventing pressure ulcers. J Wound Care 2005;14(3):117–21.
- Schuren J, Becker A, Sibbald RG. A liquid film-forming acrylate for peri-wound protection: a systematic review and meta-analysis (3MTM CavilonTM no-sting barrier film). Int Wound 2005;2:230–238.
- Beeckman D, Van Damme N, Schoonhoven L, Van Lancker A, Kottner J, Beele H, Gray M, Woodward S, Fader M, Van den Bussche K, Van Hecke A, De Meyer D, Verhaeghe S. Interventions for preventing and treating incontinence-associated dermatitis in adults. Cochrane Database System Rev 2016;11. Art. No: CD011627.
- Lansdown AB, Mirastschijski U, Stubbs N, Scanlon E, Agren MS. Zinc in wound healing: theoretical, experimental, and clinical aspects. Wound Repair Regen 2007;15(1):2–16.



