Volume 41 Number 3
The nursing assessment of pemphigus vulgaris ulcers
Mariana Takahashi Ferreira Costa, Luiza Keiko Matsuka Oyafuso, Mônica Antar Gamba and Kevin Y Woo
Keywords nursing, skin diseases, dermatology, vesiculobullous, acantholysis
For referencing Costa MTF et al. The nursing assessment of pemphigus vulgaris ulcers. WCET® Journal 2021;41(3):27-37
DOI
https://doi.org/10.33235/wcet.41.3.27-37
Submitted 16 March 2021
Accepted Accepted 18 July 2021
Abstract
Introduction Pemphigus vulgaris (PV) is a severe autoimmune bullous dermatosis resulting in the formation of intraepidermal blisters affecting the skin and mucous membranes. Epidemiologic data shows an incidence of 0.1–0.5 per 100,000 inhabitants per year, and mortality at almost 5–10%.
Objective The objective of this integrative literature review was to examine the classification/terminology of PV ulcers according to the description of skin lesions.
Method This is an integrative review of primary studies, series/clinical reviews or validation studies that describe or evaluate PV ulcers. Search strategies included relevant papers that were published between 2011–2019 using terms such as pemphigus, skin ulcer, dermatology, diagnostic, nursing assessment. The studies were selected for analysis after application of eligibility criteria and exclusion by duplicity.
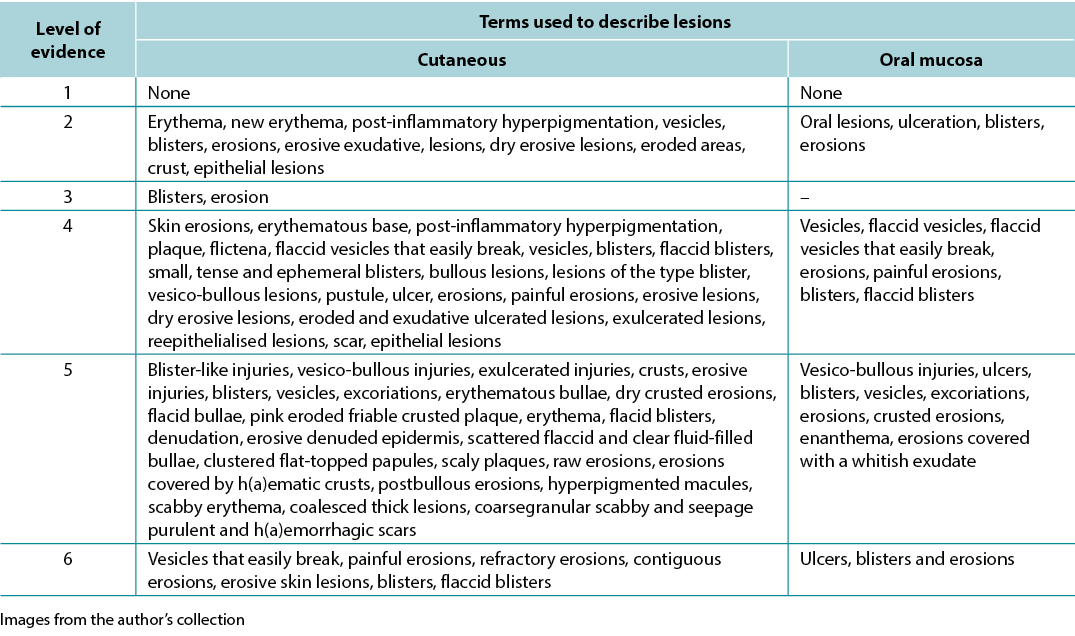
Results The initial search resulted in 2,934 publications; 14 articles were eligible for analysis. The synthesis of the studies was organised as follows – 57.14% series/clinical reviews, 50% written by physicians, 64.29% level of evidence 4. The terminology used to describe PV ulcers included skin/mucosal erythema, new erythema, post-inflammatory hyperpigmentation, oral lesions, epithelialisation scabs, blisters, bullae, erosions, eroded areas, erosive exudative lesions, dry erosive.
Conclusions Studies with better levels of evidence are needed on this issue in order to determine the best way to describe the lesions using the dermatological glossary for nursing assessment.
Introduction
Pemphigus vulgaris (PV) is a severe autoimmune bullous dermatosis in which the antibodies destroy the desmosomes, resulting in the formation of intraepidermal blisters that affect the skin and mucous membranes. PV occurs mainly between the 4th and 6th decades of life, affecting males and females with an incidence of 0.1–0.5 / 100,000 inhabitants / year and with a mortality rate of 5–10%. The disease distribution is universal, but most commonly affects people of Jewish ancestry–3.
In PV, autoantibodies act predominantly on desmoglein 3 (Dsg3) which is expressed predominantly in the deeper layers of the epidermis2,3. Identifying the layer on which acantholysis occurs is a factor that assists in the diagnosis of bullous dermatoses. For example, it is possible to differentiate PV from pemphigus foliaceus by the site where acantholysis occurs, since pemphigus foliaceus affects the granular layer whereas PV affects the spinous layer2,3. These manifestations involve the formation of blisters with consequent ulceration and skin damage which can be devastating, affecting social interaction and even loss of employment4.
The impact of disfigurement associated with PV on patients’ quality of life, self-image, family and social dynamics has been well documented4. In addition to cutaneous involvement, PV may involve mucosal tissue in the mouth, pharynx, larynx, nasal passage and ear canals (Figures 1 & 2). Areas affected by the disease can compromise normal breathing as well as the ability to speak and to eat to maintain adequate nutritional intake2,3.
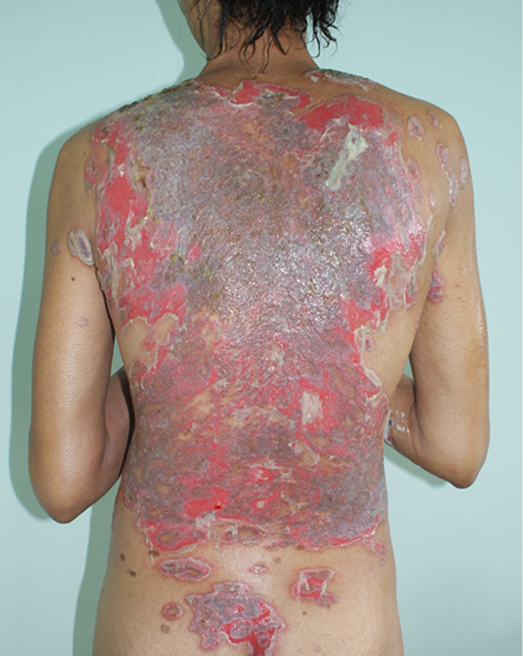
Figure 1. Cutaneous lesions on trunk
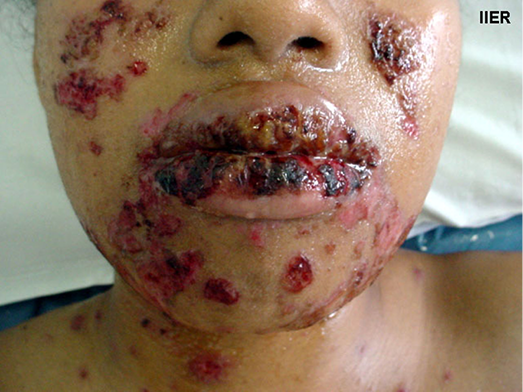
Figure 2. Oral mucosa lesions
The classification of PV has been the object of studies in recent years. The Commitment Index of Skin and Mucous in Pemphigus Vulgaris uses four different parameters to score the disease clinical status: (a) the number of blisters or eroded areas; (b) the size of blisters or eroded areas; (c) evidence of the Nikolsky sign (where sliding the finger firmly with pressure over the skin separates normal-appearing epidermis, producing an erosion); and (d) mucousal involvement and sepsis. The total score may vary from 0–100, and the patients are classified as follows: Class I score 0–30; Class II 35–65; Class III 70–100, meaning that the higher the score, the more critical the status1.
Pemphigus classifications tools, the Pemphigus Disease Area Index (PDAI) and the Japanese Pemphigus Disease Severity Score (JPDSS), were compared by Shimizu et al.5. PDAI measures skin and mucosal involvement by size and number of blisters in each anatomical region, and the score ranges from 0–263. JPDSS uses parameters for scoring: (I) the ratio of affected area of skin to the body’s surface area; (II) the presence or absence of Nikolsky’s sign phenomenon; (III) the number of newly developed blisters per day; (IV) the presence or absence of oral lesions; and (V) the titer of pemphigus antibodies. Each parameter has a score ranging 0–3. In Shimizu et al.’s study5, the results show that PDAI more accurately reflects disease severity. The authors therefore propose the use of indexes to guide a uniform treatment according to grading criteria. Corticotherapy is the treatment of choice, and it can be associated with immunosuppressants if there is no improvement with isolated corticotherapy2,3.
Although considered a relatively rare disease, there is a need for nurses to recognise skin lesions associated with PV and communicate appropriate findings in order to help patients seek early treatment, evaluate disease progression, and monitor responses to treatment6. The purpose of this integrative review was to describe the taxonomy for the description and assessment of skin changes related to PV by nurses.
Method
This integrative review was conducted to identify, analyse and synthesise studies that use qualitative, quantitative and mixed methods in this theme7. We have chosen the method described by Mendes7 to guide the review which consisted of six stages: (1) formulation of the guiding question; (2) establishment of criteria for inclusion and exclusion of studies and data collection (search in the literature); (3) categorisation of studies; (4) evaluation of studies included in the review; (5) analysis and interpretation of data; and (6) synthesis of the knowledge evidenced in the articles analysed (presentation of the results)7.
Formulation of the guiding question
The research question was – How are the lesions that characterise PV described in the literature in its definition and classification?
Establishment of criteria for inclusion and exclusion of studies and data collection
The medical and nursing literature was searched from 2011–2019 in conjunction with a librarian to assist in answering the research question. Searches included Web of Science, LILACS, EMBASE, SCOPUS, PUBMED, BVS, CINAHL and COCHRANE with specific inclusion and exclusion criteria. To identify relevant publications, databases were searched using the following key terms – dermatology, pemphigus, skin ulcer, diagnostic and nursing assessment. The inclusion criteria included articles published in English, Spanish and Portuguese, peer-reviewed literature and consensus documents; the dates of publication were from 1 January 2011 to 31 December 2019. Commentary and editorials were excluded.
Categorisation of studies
Selected studies were then categorised according to the six levels of evidence8:
• Level 1: evidence from meta-analysis of multiple controlled and randomised studies.
• Level 2: evidence from individual studies with experimental design.
• Level 3: evidence from quasi-experimental studies, time series or case-controls.
• Level 4: evidence from descriptive studies (non-experimental or qualitative approach).
• Level 5: evidence of case / experience reports.
• Level 6: evidence based on expert committee opinions, including interpretations of non-research based information, regulatory or legal opinions.
Evaluation of studies included in the review
This step included the evaluation of the studies as well as data extraction. A standardised data collection form was used to extract the following information: authors; professional category of authors; title of the article; journal; year of publication; level of evidence; goals; methodological design; sampling detail; synthesis of information; evaluation/assessment of skin ulcers in pemphigus; methodology used to validate the instrument; description of the instrument; terminology used to characterise ulcers; and results and conclusions.
Analysis and interpretation of data
The data evaluation stage included evaluating the quality of the primary sources using a specific methodological approach to determine the quality of the source. The data were evaluated and coded according to two criteria – the methodological rigour and the relevance to the topic of skin assessment. Studies were analysed and the rigour rated on a score from 0–4. The relevance to the topic was also scored and indicated, with 1 having no relevance to the topic and 2 indicating the article was relevant.
Synthesis / presentation of results
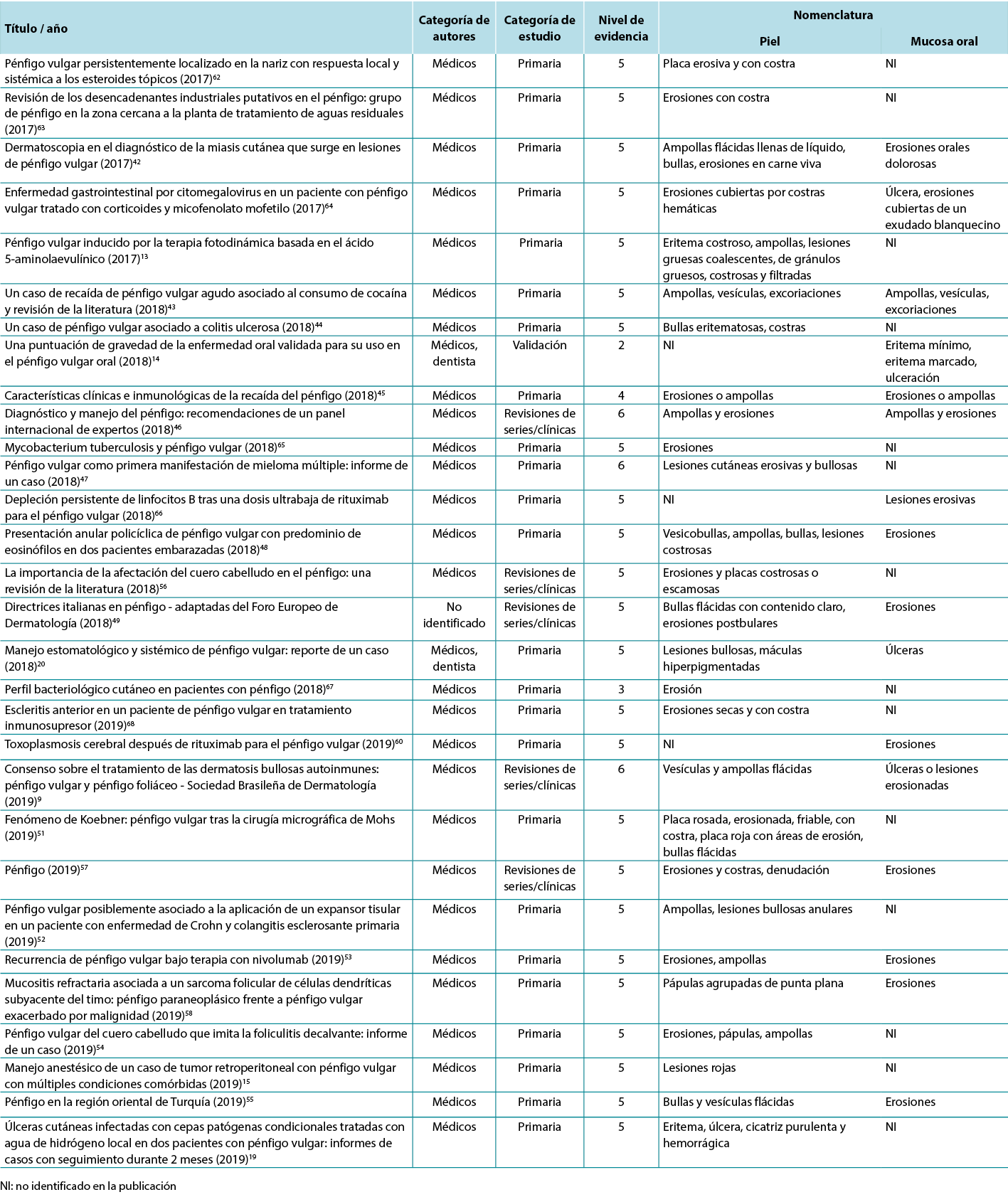
The data analysis for the qualitative studies were reviewed and were systematically categorised, analysed and synthesised, and placed into distinct themes, patterns and relationships using a matrix method. The synthesis of the studies was organised into three axis: (1) characteristics of scientific publications on PV; (2) terminology used to describe cutaneous lesions related to PV (Table 1); and (3) comparison of terminologies used in studies and dermatological description of skin lesions.
Table 1. Terms identified grouped by level of evidence of the studies
Ethical and legal aspects
The research project was submitted and approved by the Research Ethics Committee / UNIFESP: 0450/2015 and followed the ethical and legal precepts of research with human beings according to Resolution 196/96 of the National Health Council.
Results
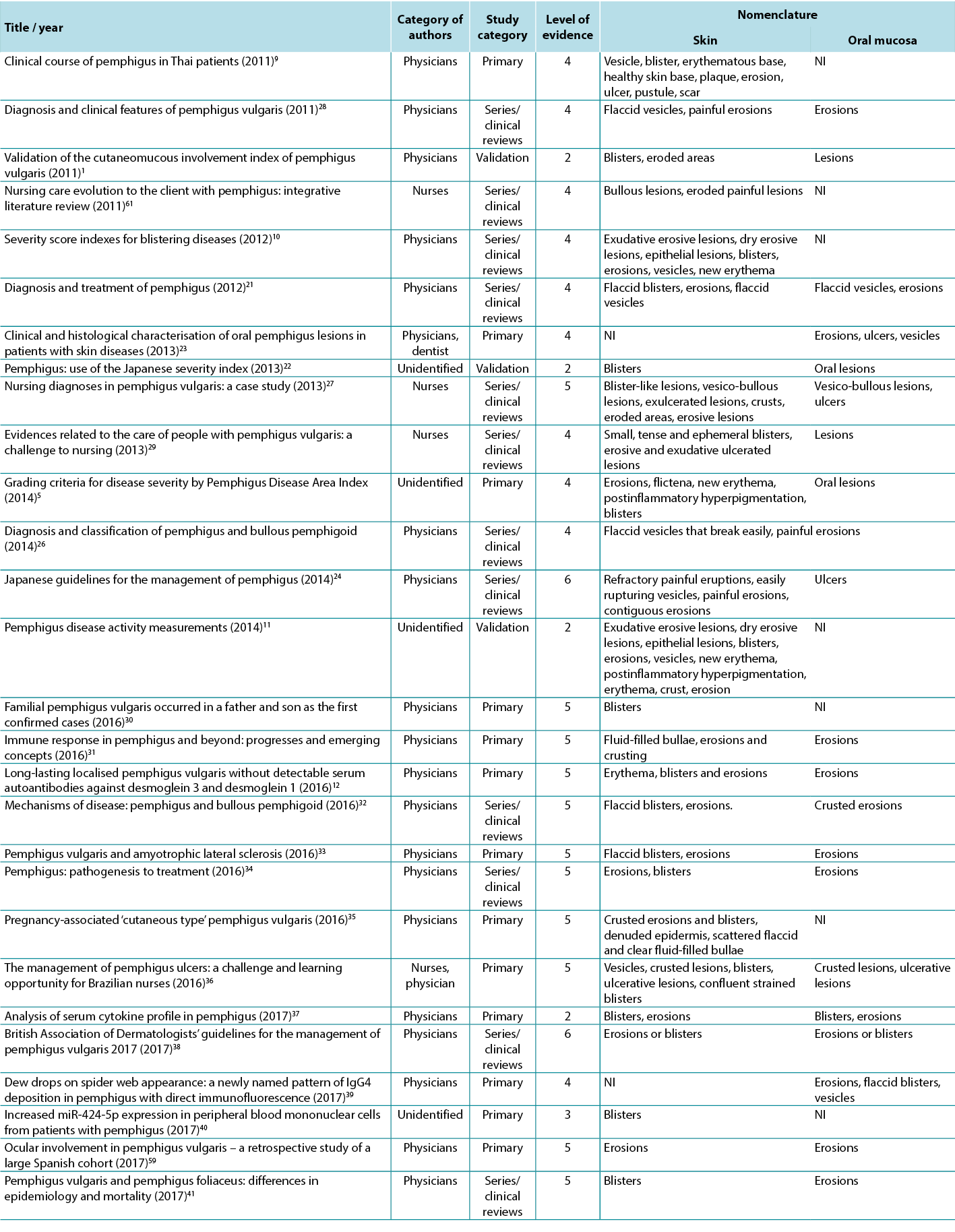
The initial search identified 2934 articles; 356 articles were included from review of the titles. After review of the abstracts, another 258 papers were not suitable for review since they did not meet the inclusion criteria; specifically, the excluded papers did not address PV and lesion assessment. A total of 58 articles were then selected for the study after exclusion of 40 duplicates. Of the 58 articles, 37 (63.79%) were primary studies, 17 (29.31%) were series/clinical reviews and four (6.90%) were validation studies.
A variety of terms were used in the literature to describe PV-related lesions. These are summarised below.
Primary skin lesions
Flat spots or maculae
The first is flat skin lesions, including colour changes and blood-vascular stains. Nomenclature used were new erythema, erythema, minimal erythema, and marked erythema9–15. Erythema is defined as a red colour resulting from vasodilation that disappears by digital pressure or diascopy. Diascopy is a refinement in which a piece of clear glass or plastic is pressed against the skin while the observer looks directly at the lesion under pressure15,16.
Solid formations / oedematous elevations
Solid formations may include bullae and papulae (small superficial solid elevations of the skin) while oedematous elevations could be cutanaeous lesions, scales or pustulae (defined elevation of the skin containing purulent fluid). These clinical features might be associated with a positive Nikolsky sign17.
Pigment spots
Nomenclature used in this section were post-inflammatory hyperpigmentation and hyperpigmented macules5,11,16, 18–20. Hyperchromia is defined as a spot of variable colour, caused by the increase of melanin or deposit of another pigment. The increase in melanin / melanodermic spots has a variable colour from light brown to dark bluish or black16,18.
Liquid content
Nomenclature used here were vesicles, blisters and bullous lesions1,5,9,10,12,13,20–55. Vesicles are defined as of circumscribed elevation, containing clear liquid, up to 1cm in size. The fluid, which is primitively clear (serous), may become cloudy (purulent) or red (haemorrhagic)16,18. A blister is defined as elevation containing clear liquid, greater than 1cm in size. The fluid, which is primitively clear, may become yellowish-red or reddish, forming a purulent or haemorrhagic blister16,18. The term bullous lesions is used to refer to any liquid collections.
Secondary skin lesions
Thickness changes
Nomenclature used here are epithelial lesions, denuded epidermis and scar9–11,13,19,22,35,51,54,56–58. A scar is defined as a flat, salient or depressed lesion, without grooves, pores and hairs, movable, adherent or retractable. It associates atrophy with fibrosis and dyschromia. It results from the repair of destructive process of the skin. It can be: atrophic (thin, pleated, papyraceous); pitted (small holes appear); or hypertrophic (nodular, elevated, vascular, with excessive fibrous proliferation, with a tendency to regress)16,18.
Tissue losses
Nomenclature used are erosions, eroded areas, erosive lesions, crust, ulceration, ulcer, ulcerative lesions, raw erosions and excoriations1,5,9–15,19–21,23–60. Erosion or exulceration is defined as superficial loss that affects only the epidermis. Crust is defined as a concretion of light yellow to greenish or dark red colour which forms in an area of tissue loss. It results from the desiccation of serosity (meliceric), pus (purulent) or blood (haemorrhagic), mixed with epithelial remains16,18.
Therefore, in view of the integrative review, it was possible to identify studies describing the dermatological alterations of PV ulcers according to criteria established by dermatological glossaries. In order to illustrate the correlation of the identified terms and their corresponding study, the third analysis correlates the terms identified with the year, author category, study category and level of evidence, shown in Table 2.
Table 2. Terms identified in selected articles
Discussion
As evidenced by the results, studies in this area are scant and nurses have had little contribution. However, this is needed to highlight the consistency demonstrated between the terms used by authors and the terminology of elementary lesions.
To promote excellence in dermatological care it is necessary for nurses and health professionals to develop skills for the evaluation of cutaneous manifestations, especially skin lesions. The skin, as the largest organ of the human body, has protection as one of its numerous functions. Far beyond essentially dermatological affections, it can translate the person’s general condition, signalling the presence of systemic disorders and sometimes presenting manifestations that are recognised as cutaneous markers of certain pathologies. However, the paucity of studies in PV has led to poor description and evaluation of skin lesions in PV. This may result in delayed diagnosis and suboptimal care and treatment6,20,29,36.
In fact, this subject points to the need for further investigation to compose a framework of knowledge based on scientific evidence in this area, so that dermatology nurses may develop an accurate consideration of the assessment of skin manifestations, especially skin ulcers. These professionals publish little on this subject, which corroborates with the lack of formulation of new evidence for their topical care. This lack of evidence makes nursing assistance to these people less secure, since a theoretical framework is essential for evidence-based care given the specificity and complexity of caring for these patients16,25.
The main researchers in this area, Brandão and Santos4,6,25,29, investigate this issue from the point of view of integral care, with a social-poetic approach and a nursing diagnosis that support the comfort and relief of pain among those affected.
Through clinical observation, the authors of this study concluded that traditional topical care generates high rates of hospital stay, pain and discomfort. This clinical observation was the trigger to build evidence of the best evaluation tools and descriptors and base this on the use of topical therapies that optimise the potential of healing by managing cofactors such as pH, thermoregulation, humidity, microbial load and adherence of the dressing25,36.
It can be observed that when the nursing descriptor was used, the literature search resulted in a much smaller number of articles in comparison to those searches without this descriptor. Although dermatological nursing is a recognised specialty in Brazil, the descriptors ‘nursing in dermatology’ or ‘dermatologist nurse’ or ‘dermatological nursing’ do not exist. Therefore, in search of studies, the descriptors ‘nursing’ and ‘nursing assessment’ were used.
Among the nomenclatures used in the different levels of studies, we can observe that all use the dermatological glossary to describe the lesions, with only a small variation with detailed description of the tissue such as exudative erosions. Despite the scarcity of studies written by nurses, it was possible to observe that the terminology used did not differ between professional categories25,29,36.
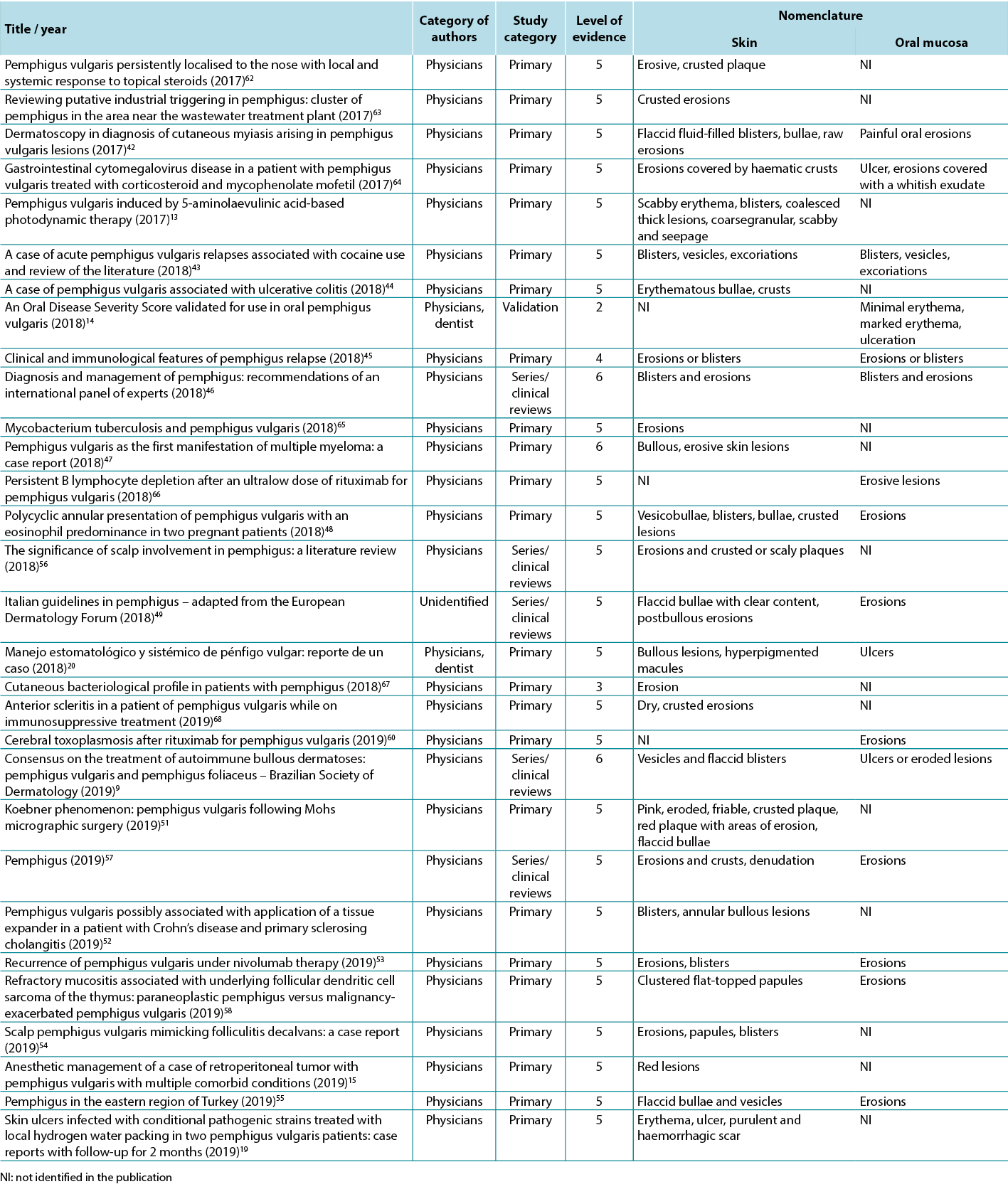
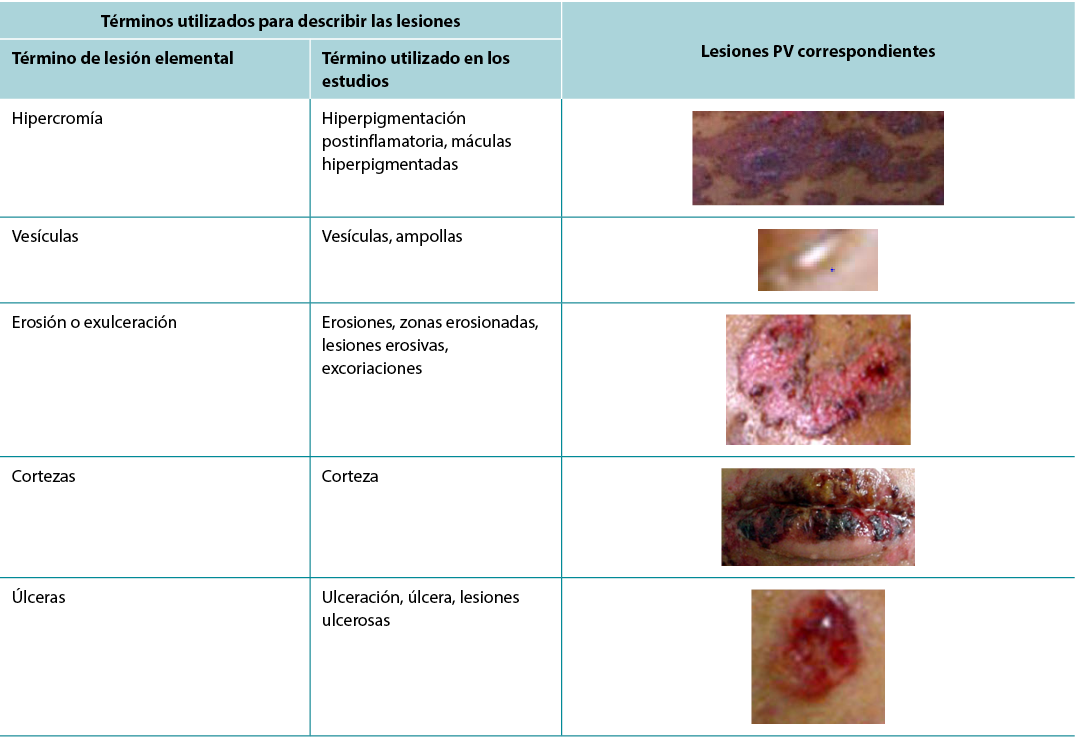
According to Sampaio and Rivitti3, skin lesion classification is like letters of the alphabet; just as letters compose words, through their combination they form morphological signs that allow us to “read” the cutaneous manifestations16,18. As shown in the results, the skin lesions, associated with complementary information, can help in the definition of diagnostic hypotheses, intervention decision and monitoring of healing evolution. The use of clinical descriptors to characterise skin lesions or ulcers standardises this information, making it more understandable for health professionals. In Table 3 examples of PV lesions related to the correspondent elementary skin lesion term are given.
Table 3. Elementary skin lesion terms and corresponding examples of PV lesion
Skin lesions are classified into six groups: colour changes; oedematous elevations; solid formations; liquid formations; thickness changes; and losses and repairs. This classification may be grouped into:
- Primary: flat spots or maculae (colour changes); solid (solid formations); oedematous elevations (rash, oedema); liquid content (liquid formations).
- Secondary: changes in consistency and thickness (changes in thickness); or loss of substance (tissue losses and repairs)16,18.
Diagnoses, interventions and nursing outcomes according to the North American Nursing Diagnosis Association (NANDA), Nursing Interventions Classification (NIC) and Nursing Outcomes Classification (NOC) for patients with PV were proposed by Pena et al.27. The analysis of the nursing diagnosis ‘impaired skin integrity’ and ‘impaired oral mucous membrane’ made it possible to perceive that the nurse assessment to arrive at this diagnosis does not require a specialised evaluation since the defining characteristics for such diagnoses involve only the rupture of the skin or mucosa, not requiring evaluation of thickness, tissue type or other characteristics assessed in a wound. In the proposed NOC outcome ‘healing’, in which one of the indicators used was granulation tissue, the knowledge about the tissue types that a wound can present is necessary. The proposed NIC intervention ‘wound care’ involves the decision about the intervention to be adopted, presupposing specific knowledge, skills and preparation in this area27. Considering the increasing performance of dermatology nursing as a specialty, these nomenclatures are becoming increasingly familiar to nurses.
As the nomenclature used to describe skin lesions becomes standard, whether secondary to PV or not, the interlocution between professionals tends to become more uniform, avoiding misunderstanding and resulting in safer patient care. However, in wound assessment there is still a great diversity in the terminology used to describe the skin damage, for example: slough and fibrin; wet necrosis and liquefaction necrosis; dry necrosis, ‘scar’ and pressure injury; granulation tissue, extra cellular matrix or viable tissue. This richness of terminologies causes doubt, within professionals consulting the records, often generating interpretations that differ from those of the person who registered them. In order to standardise the register of PV ulcers, we suggest the use of the elementary lesions terms – vesicles, blisters, erosions, ulcers and generalised crusts.
The chronic character and the cutaneous manifestation of PV steal from the patient their right to confidentiality. Frequently, the lesions are associated with contagion, impacting on social and familiar relations, and perpetuating stigma and isolation4. For Brandão, nursing actions become productive as they aim to reach the patient’s holistic balance. Thus there is a constant search for alternatives that attend to the needs of people suffering from changes in skin integrity, and the development of technologies and techniques that promote healing in order to improve their quality of life4,27.
Conclusions
This study compared the terminology used to describe cutaneous ulcers in PV studies with the terminology used in describing elementary lesions. It also demonstrated that the publications authored by physicians were the most common ones, followed by those authored by nurses, and lacked uniformity in the description of the lesions.
This study demonstrated that the skin changes in PV can be classified as primary skin lesions (colour changes and liquid collections) or secondary skin lesions (changes in thickness and tissue loss). In view of the extensive dermatological glossary, lesions secondary to PV can be characterised as vesicles, blisters, erosions, ulcers and generalised crusts to support the practice of nursing in dermatology.
Lastly, it is concluded that studies with a higher level of evidence in this area are necessary in order to determine the best way to evaluate the lesions, as well as the nomenclature to be used for improved nursing care.
Conflict of Interest
The authors declare no conflicts of interest.
Funding
The authors received no funding for this study.
La evaluación de enfermería de las úlceras de pénfigo vulgar
Mariana Takahashi Ferreira Costa, Luiza Keiko Matsuka Oyafuso, Mônica Antar Gamba and Kevin Y Woo
DOI: https://doi.org/10.33235/wcet.41.3.27-37
Resumen
Introducción El pénfigo vulgar (PV) es una dermatosis bullosa autoinmune grave que da lugar a la formación de ampollas intraepidérmicas que afectan a la piel y las mucosas. Los datos epidemiológicos muestran una incidencia de 0,1-0,5 por 100.000 habitantes al año, y una mortalidad de casi el 5-10%.
Objetivo El objetivo de esta revisión bibliográfica integradora fue examinar la clasificación/terminología de las úlceras PV según la descripción de las lesiones cutáneas.
Método Esta es una revisión integradora de estudios primarios, series/revisiones clínicas o estudios de validación que describen o evalúan las úlceras PV. Las estrategias de búsqueda incluyeron artículos relevantes que fueron publicados entre 2011-2019 utilizando términos como pénfigo, úlcera cutánea, dermatología, diagnóstico, evaluación de enfermería. Los estudios se seleccionaron para el análisis tras la aplicación de los criterios de elegibilidad y la exclusión por duplicidad.
Resultados La búsqueda inicial dio como resultado 2.934 publicaciones; 14 artículos fueron elegibles para el análisis. La síntesis de los estudios se organizó de la siguiente manera: 57,14% series/revisiones clínicas, 50% escritas por médicos, 64,29% nivel de evidencia 4. La terminología utilizada para describir las úlceras PV incluía eritema cutáneo/mucoso, nuevo eritema, hiperpigmentación postinflamatoria, lesiones orales, costras de epitelización, ampollas, bullas, erosiones, áreas erosionadas, lesiones erosivas exudativas, erosión seca.
Conclusiones Se necesitan estudios con mejores niveles de evidencia sobre este tema para determinar la mejor manera de describir las lesiones utilizando el glosario dermatológico para la evaluación de enfermería.
Introducción
El pénfigo vulgar (PV) es una dermatosis bullosa autoinmune grave en la que los anticuerpos destruyen los desmosomas, lo que da lugar a la formación de ampollas intraepidérmicas que afectan a la piel y las mucosas. El PV se produce principalmente entre la 4ª y 6ª décadas de la vida, afectando a hombres y mujeres con una incidencia de 0,1-0,5 / 100.000 habitantes / año y con una tasa de mortalidad del 5-10%. La distribución de la enfermedad es universal, pero afecta más comúnmente a personas de ascendencia judía-3.
En el PV, los autoanticuerpos actúan predominantemente sobre la desmogleína 3 (Dsg3), que se expresa predominantemente en las capas más profundas de la epidermis2,3. La identificación de la capa en la que se produce la acantólisis es un factor que ayuda al diagnóstico de las dermatosis bullosas. Por ejemplo, es posible diferenciar el PV del pénfigo foliáceo por el lugar donde se produce la acantólisis, ya que el pénfigo foliáceo afecta a la capa granular mientras que el PV afecta a la capa espinosa2,3. Estas manifestaciones implican la formación de ampollas con la consiguiente ulceración y daño cutáneo que puede ser devastador, afectando a la interacción social e incluso a la pérdida de empleo4.
El impacto de la desfiguración asociada al PV en la calidad de vida de los pacientes, la imagen de sí mismos y la dinámica familiar y social está bien documentado4. Además de la afectación cutánea, el PV puede afectar al tejido mucoso de la boca, la faringe, la laringe, las fosas nasales y los conductos auditivos (figuras 1 y 2). Las zonas afectadas por la enfermedad pueden comprometer la respiración normal, así como la capacidad de hablar y de comer para mantener una ingesta nutricional adecuada2,3.

Figura 1. Lesiones cutáneas en el tronco

Figura 2. Lesiones de la mucosa oral
La clasificación del PV ha sido objeto de estudios en los últimos años. El índice de compromiso de la piel y las mucosas en el pénfigo vulgar utiliza cuatro parámetros diferentes para puntuar el estado clínico de la enfermedad: (a) el número de ampollas o zonas erosionadas; (b) el tamaño de las ampollas o zonas erosionadas; (c) la evidencia del signo de Nikolsky (cuando al deslizar el dedo firmemente con presión sobre la piel se separa la epidermis de apariencia normal, produciendo una erosión); y (d) la afectación de las mucosas y la sepsis. La puntuación total puede variar de 0 a 100, y los pacientes se clasifican de la siguiente manera: La puntuación de clase I es de 0 a 30; la de clase II, de 35 a 65; la de clase III, de 70 a 100, lo que significa que cuanto más alta sea la puntuación, más crítico será el estado1.
Las herramientas de clasificación del pénfigo, el Índice de Área de la Enfermedad del Pénfigo (PDAI) y la Puntuación japonesa de la gravedad de la enfermedad del pénfigo (JPDSS) fueron comparadas por Shimizu et al.5. El PDAI mide la afectación de la piel y las mucosas por el tamaño y el número de ampollas en cada región anatómica, y la puntuación oscila entre 0 y 263. La JPDSS utiliza parámetros para la puntuación: (I) la relación entre la superficie de la piel afectada y la superficie del cuerpo; (II) la presencia o ausencia del fenómeno del signo de Nikolsky; (III) el número de ampollas recién desarrolladas por día; (IV) la presencia o ausencia de lesiones orales; y (V) el título de anticuerpos contra el pénfigo. Cada parámetro tiene una puntuación que va de 0 a 3. En el estudio de Shimizu et al5, los resultados muestran que el PDAI refleja con mayor precisión la gravedad de la enfermedad. Por lo tanto, los autores proponen el uso de índices para guiar un tratamiento uniforme según los criterios de clasificación. La corticoterapia es el tratamiento de elección, y puede asociarse a inmunosupresores si no hay mejora con la corticoterapia aislada2,3.
Aunque se considera una enfermedad relativamente rara, es necesario que el personal de enfermería reconozca las lesiones cutáneas asociadas al PV y comunique los hallazgos apropiados para ayudar a los pacientes a buscar un tratamiento temprano, evaluar la progresión de la enfermedad y controlar las respuestas al tratamiento6. El propósito de esta revisión integradora fue describir la taxonomía para la descripción y evaluación de los cambios de la piel relacionados con el PV por parte de las enfermeras.
Método
Esta revisión integradora se realizó para identificar, analizar y sintetizar los estudios que utilizan métodos cualitativos, cuantitativos y mixtos en este tema7. Hemos elegido el método descrito por Mendes7 para guiar la revisión, que constaba de seis etapas: (1) formulación de la pregunta orientadora; (2) establecimiento de los criterios de inclusión y exclusión de los estudios y de recogida de datos (búsqueda en la literatura); (3) categorización de los estudios; (4) evaluación de los estudios incluidos en la revisión; (5) análisis e interpretación de los datos; y (6) síntesis del conocimiento evidenciado en los artículos analizados (presentación de los resultados)7.
Formulación de la pregunta orientadora
La pregunta de investigación fue: ¿Cómo se describen en la literatura las lesiones que caracterizan al PV en su definición y clasificación?
Establecimiento de los criterios de inclusión y exclusión de los estudios y recogida de datos
Se realizó una búsqueda en la literatura médica y de enfermería entre 2011 y 2019 en conjunto con un bibliotecario para ayudar a responder la pregunta de investigación. Las búsquedas incluyeron Web of Science, LILACS, EMBASE, SCOPUS, PUBMED, BVS, CINAHL y COCHRANE con criterios específicos de inclusión y exclusión. Para identificar las publicaciones pertinentes, se realizaron búsquedas en las bases de datos utilizando los siguientes términos clave: dermatología, pénfigo, úlcera cutánea, diagnóstico y evaluación de enfermería. Los criterios de inclusión incluyeron artículos publicados en inglés, español y portugués, literatura revisada por pares y documentos de consenso; las fechas de publicación fueron del 1 de enero de 2011 al 31 de diciembre de 2019. Se excluyeron los comentarios y editoriales.
Clasificación de los estudios
Los estudios seleccionados se clasificaron según los seis niveles de evidencia8:
• Nivel 1: evidencia del meta-análisis de múltiples estudios controlados y aleatorios.
• Nivel 2: evidencia de estudios individuales con diseño experimental.
• Nivel 3: evidencia de estudios cuasi-experimentales, series temporales o casos-control.
• Nivel 4: evidencia de estudios descriptivos (enfoque no experimental o cualitativo).
• Nivel 5: evidencia de informes de casos/experiencia.
• Nivel 6: evidencia basada en opiniones de comités de expertos, incluyendo interpretaciones de información no basada en la investigación, opiniones reguladoras o legales.
Evaluación de los estudios incluidos en la revisión
Este paso incluía la evaluación de los estudios y la extracción de datos. Se utilizó un formulario estandarizado de recogida de datos para extraer la siguiente información: autores; categoría profesional de los autores; título del artículo; revista; año de publicación; nivel de evidencia; objetivos; diseño metodológico; detalle del muestreo; síntesis de la información; evaluación/valoración de las úlceras cutáneas en el pénfigo; metodología utilizada para validar el instrumento; descripción del instrumento; terminología utilizada para caracterizar las úlceras; y resultados y conclusiones.
Análisis e interpretación de los datos
La etapa de evaluación de los datos incluyó la evaluación de la calidad de las fuentes primarias mediante un enfoque metodológico específico para determinar la calidad de la fuente. Los datos se evaluaron y codificaron según dos criterios: el rigor metodológico y la relevancia para el tema de la evaluación de la piel. Se analizaron los estudios y se calificó el rigor con una puntuación de 0 a 4. También se puntuó e indicó la relevancia del tema, siendo 1 que no tenía relevancia para el tema y 2 que indicaba que el artículo era relevante.
Síntesis / presentación de resultados
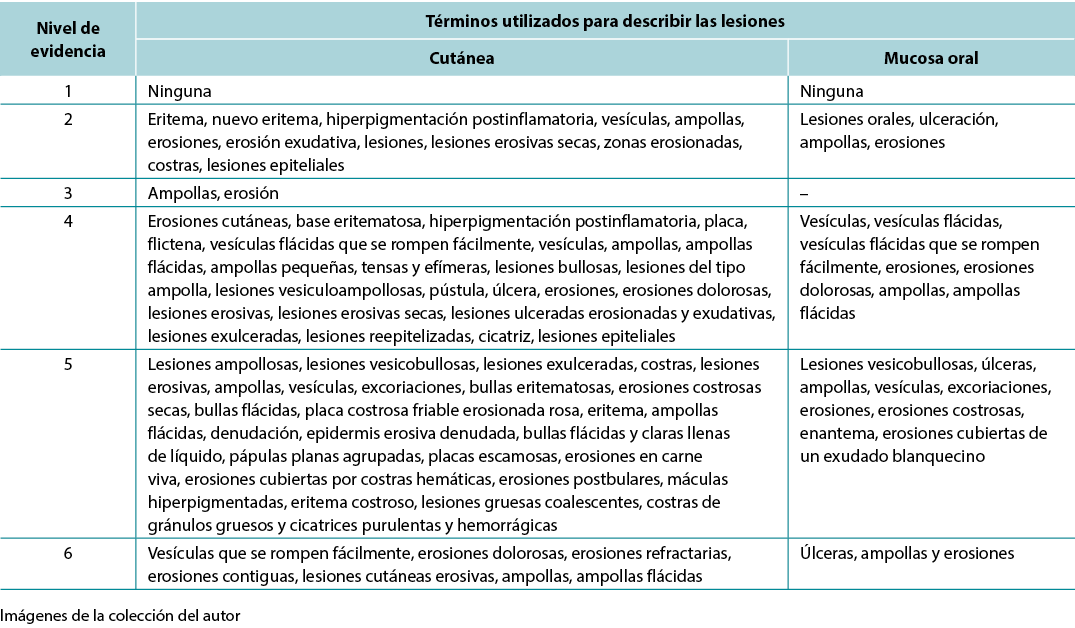
Se revisaron los análisis de datos de los estudios cualitativos y se categorizaron, analizaron y sintetizaron sistemáticamente, y se colocaron en distintos temas, patrones y relaciones mediante un método matricial. La síntesis de los estudios se organizó en tres ejes: (1) características de las publicaciones científicas sobre PV; (2) terminología utilizada para describir las lesiones cutáneas relacionadas con el PV (Tabla 1); y (3) comparación de las terminologías utilizadas en los estudios y descripción dermatológica de las lesiones cutáneas.
Tabla 1. Términos identificados agrupados por el nivel de evidencia de los estudios
Aspectos éticos y jurídicos
El proyecto de investigación fue presentado y aprobado por el Comité de Ética de la Investigación / UNIFESP: 0450/2015 y siguió los preceptos éticos y legales de la investigación con seres humanos según la Resolución 196/96 del Consejo Nacional de Salud.
Resultados
La búsqueda inicial identificó 2.934 artículos; de la revisión de los títulos se incluyeron 356 artículos. Tras la revisión de los resúmenes, otros 258 artículos no eran adecuados para su revisión, ya que no cumplían los criterios de inclusión; concretamente, los artículos excluidos no abordaban la evaluación del PV y las lesiones. Un total de 58 artículos fueron entonces seleccionados para el estudio tras la exclusión de 40 duplicados. De los 58 artículos, 37 (63,79%) eran estudios primarios, 17 (29,31%) eran series/revisiones clínicas y cuatro (6,90%) eran estudios de validación.
En la literatura se han utilizado diversos términos para describir las lesiones relacionadas con el PV. Se resumen a continuación,
Lesiones cutáneas primarias
Manchas planas o máculas
La primera son las lesiones cutáneas planas, que incluyen cambios de color y manchas vasculares. La nomenclatura utilizada fue nuevo eritema, eritema, eritema mínimo y eritema marcado9-15. El eritema se define como un color rojo resultante de la vasodilatación que desaparece con la presión digital o diascopia. La diascopia es un refinamiento en el que se presiona un trozo de vidrio o plástico transparente contra la piel mientras el observador mira directamente la lesión bajo presión15,16.
Formaciones sólidas / elevaciones edematosas
Las formaciones sólidas pueden incluir bullas y pápulas (pequeñas elevaciones sólidas superficiales de la piel), mientras que las elevaciones edematosas pueden ser lesiones cutáneas, escamas o pústulas (elevación definida de la piel que contiene líquido purulento). Estas características clínicas podrían estar asociadas a un signo de Nikolsky positivo17.
Manchas de pigmentación
La nomenclatura utilizada en esta sección fue hiperpigmentación postinflamatoria y máculas hiperpigmentadas5,11,16, 18-20. La hipercromía se define como una mancha de color variable, causada por el aumento de melanina o el depósito de otro pigmento. El aumento de la melanina/manchas melanodérmicas tiene un color variable desde el marrón claro hasta el azulado oscuro o el negro16,18.
Contenido líquido
La nomenclatura utilizada aquí fue vesículas, ampollas y lesiones bullosas1,5,9,10,12,13,20-55. Las vesículas se definen como de elevación circunscrita, que contienen líquido claro, de hasta 1 cm de tamaño. El líquido, que es primitivamente claro (seroso), puede volverse turbio (purulento) o rojo (hemorrágico)16,18. Una ampolla se define como una elevación que contiene un líquido claro, de más de 1 cm de tamaño. El fluido, el cual es primitivamente claro, puede volverse rojo-amarillento o rojizo, formando una ampolla purulenta o hemorrágica16,18. El término lesiones bullosas se utiliza para referirse a cualquier colección de líquido.
Lesiones cutáneas secundarias
Cambios de grosor
La nomenclatura utilizada aquí fue lesiones epiteliales, epidermis denudada y cicatriz9-11,13,19,22,35,51,54,56-58. Una cicatriz se define como una lesión plana, saliente o deprimida, sin surcos, poros ni pelos, móvil, adherente o retráctil. Asocia la atrofia con la fibrosis y la discromía. Es el resultado de la reparación del proceso destructivo de la piel. Puede ser: atrófica (fina, plisada, papirácea); picada (aparecen pequeños agujeros); o hipertrófica (nodular, elevada, vascular, con excesiva proliferación fibrosa, con tendencia a la regresión)16,18.
Pérdidas de tejido
La nomenclatura utilizada fue erosiones, áreas erosionadas, lesiones erosivas, costra, ulceración, úlcera, lesiones ulcerosas, erosiones en carne viva y excoriaciones1,5,9–15,19–21,23–60. La erosión o exulceración se define como una pérdida superficial que afecta sólo a la epidermis. La costra se define como una concreción de color amarillo claro a verdoso o rojo oscuro que se forma en una zona de pérdida de tejido. Resulta de la desecación de la serosidad (melicérica), del pus (purulenta) o de la sangre (hemorrágica), mezclada con restos epiteliales16,18.
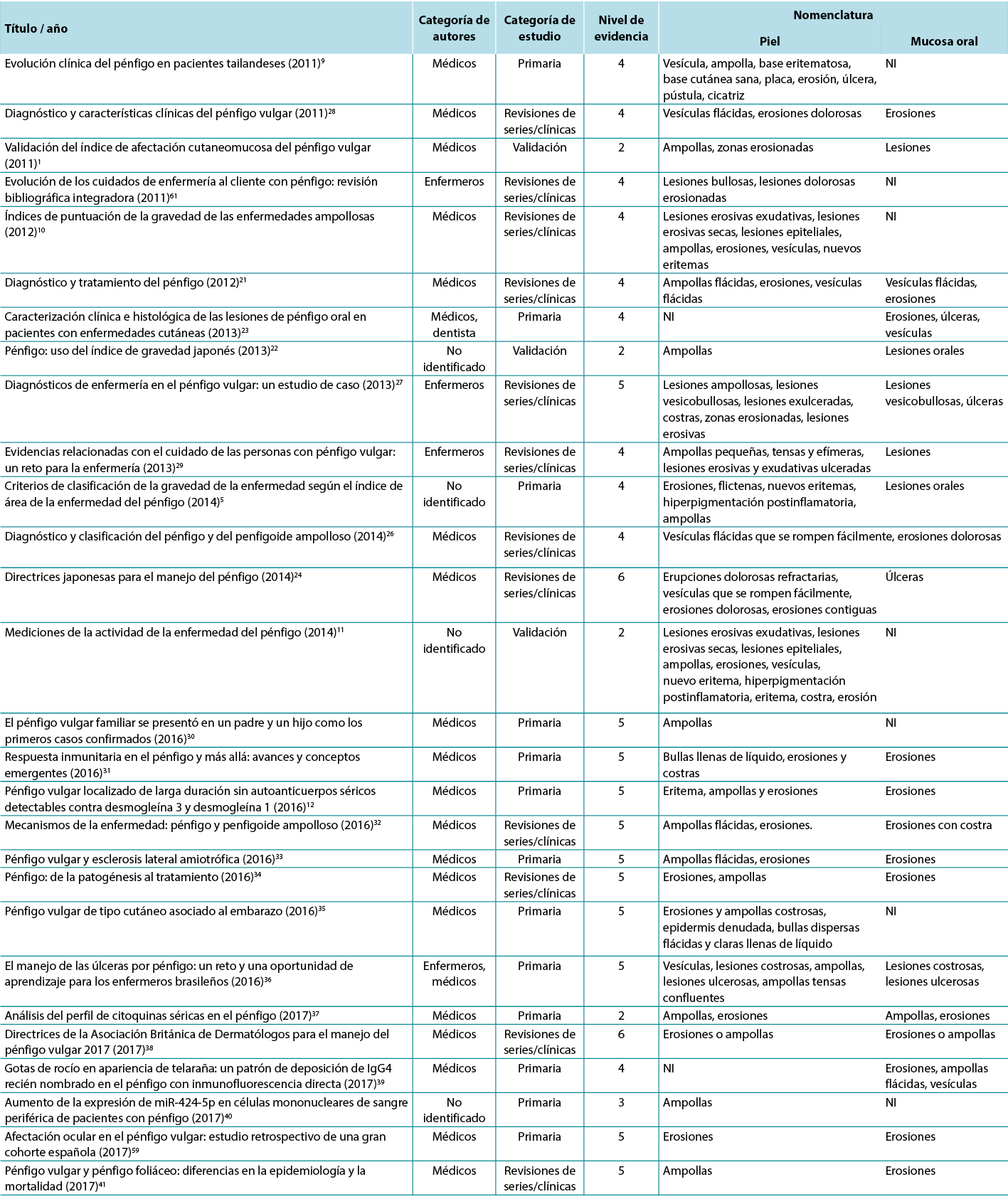
Por lo tanto, en vista de la revisión integradora, fue posible identificar los estudios que describen las alteraciones dermatológicas de las úlceras PV según los criterios establecidos por los glosarios dermatológicos. Para ilustrar la correlación de los términos identificados y su correspondiente estudio, el tercer análisis correlaciona los términos identificados con el año, la categoría del autor, la categoría del estudio y el nivel de evidencia, mostrados en la Tabla 2.
Tabla 2. Términos identificados en los artículos seleccionados
Discusion
Como evidencian los resultados, los estudios en este ámbito son escasos y los enfermeros han contribuido poco. Sin embargo, es necesario destacar la coherencia demostrada entre los términos utilizados por los autores y la terminología de las lesiones elementales.
Para promover la excelencia en la atención dermatológica es necesario que los enfermeros y los profesionales de la salud desarrollen habilidades para la evaluación de las manifestaciones cutáneas, especialmente las lesiones de la piel. La piel, como órgano más grande del cuerpo humano, tiene como una de sus numerosas funciones la protección. Más allá de las afecciones esencialmente dermatológicas, puede traducir el estado general de la persona, señalando la presencia de trastornos sistémicos y presentando a veces manifestaciones que se reconocen como marcadores cutáneos de determinadas patologías. Sin embargo, la escasez de estudios en PV ha conducido a una pobre descripción y evaluación de las lesiones cutáneas en PV. Esto puede dar lugar a un retraso en el diagnóstico y a una atención y tratamiento subóptimos6,20,29,36.
De hecho, este tema apunta a la necesidad de seguir investigando para componer un marco de conocimiento basado en la evidencia científica en esta área, para que los enfermeros de dermatología puedan desarrollar una consideración precisa de la evaluación de las manifestaciones cutáneas, especialmente de las úlceras cutáneas. Estos profesionales publican poco sobre este tema, lo que corrobora con la falta de formulación de nuevas evidencias para su cuidado tópico. Esta falta de evidencia hace que la asistencia de enfermería a estas personas sea menos segura, ya que un marco teórico es esencial para los cuidados basados en la evidencia, dada la especificidad y la complejidad del cuidado de estos pacientes16,25.
Los principales investigadores en esta área, Brandão y Santos4,6,25,29, investigan esta cuestión desde el punto de vista de la atención integral, con un enfoque socio-poético y un diagnóstico de enfermería que apoyan el confort y el alivio del dolor de los afectados.
A través de la observación clínica, los autores de este estudio concluyeron que los cuidados tópicos tradicionales generan altas tasas de estancia hospitalaria, dolor y malestar. Esta observación clínica fue el detonante para construir la evidencia de las mejores herramientas de evaluación y descriptores y basarla en el uso de terapias tópicas que optimicen el potencial de curación mediante el manejo de cofactores como el pH, la termorregulación, la humedad, la carga microbiana y la adherencia del apósito25,36.
Se puede observar que cuando se utilizó el descriptor de enfermería, la búsqueda bibliográfica dio lugar a un número mucho menor de artículos en comparación con las búsquedas sin este descriptor. Aunque la enfermería dermatológica es una especialidad reconocida en Brasil, no existen los descriptores "enfermería en dermatología" o "enfermera dermatóloga" o "enfermería dermatológica". Por lo tanto, en la búsqueda de estudios, se utilizaron los descriptores "enfermería" y "evaluación de enfermería".
Entre las nomenclaturas utilizadas en los diferentes niveles de estudios, podemos observar que todos utilizan el glosario dermatológico para describir las lesiones, con sólo una pequeña variación con la descripción detallada del tejido como las erosiones exudativas. A pesar de la escasez de estudios escritos por enfermeros, se pudo observar que la terminología utilizada no difiere entre las categorías profesionales25,29,36.
Según Sampaio y Rivitti3, la clasificación de las lesiones cutáneas es como las letras del alfabeto; así como las letras componen las palabras, a través de su combinación forman signos morfológicos que nos permiten "leer" las manifestaciones cutáneas16,18. Como muestran los resultados, las lesiones cutáneas, asociadas a información complementaria, pueden ayudar en la definición de hipótesis diagnósticas, la decisión de intervención y el seguimiento de la evolución de la curación. El uso de descriptores clínicos para caracterizar las lesiones o úlceras cutáneas normaliza esta información, haciéndola más comprensible para los profesionales sanitarios. En la Tabla 3 se dan ejemplos de lesiones PV relacionadas con el término de lesión cutánea elemental correspondiente.
Tabla 3. Términos elementales de las lesiones cutáneas y sus correspondientes ejemplos de lesiones PV
Las lesiones cutáneas se clasifican en seis grupos: cambios de color, elevaciones edematosas, formaciones sólidas, formaciones líquidas, cambios de grosor y pérdidas y reparaciones. Esta clasificación puede agruparse en:
- Primaria: manchas planas o máculas (cambios de color); sólida (formaciones sólidas); elevaciones edematosas (erupción, edema); contenido líquido (formaciones líquidas).
- Secundaria: cambios de consistencia y grosor (cambios de espesor); o pérdida de sustancia (pérdidas y reparaciones de tejido)16,18.
Los diagnósticos, las intervenciones y los resultados de enfermería según la North American Nursing Diagnosis Association (NANDA), la Nursing Interventions Classification (NIC) y la Nursing Outcomes Classification (NOC) para los pacientes con PV fueron propuestos por Pena et al.27. El análisis de los diagnósticos de enfermería "alteración de la integridad de la piel" y "alteración de la mucosa oral" permitió percibir que la valoración enfermera para llegar a este diagnóstico no requiere de una evaluación especializada, ya que las características definitorias para dichos diagnósticos implican únicamente la ruptura de la piel o la mucosa, no requiriendo la evaluación del grosor, el tipo de tejido u otras características evaluadas en una herida. En el resultado NOC propuesto "curación", en el que uno de los indicadores utilizados fue el tejido de granulación, es necesario conocer los tipos de tejido que puede presentar una herida. La propuesta de intervención NIC "cuidado de las heridas" implica la decisión sobre la intervención a adoptar, lo que presupone conocimientos, habilidades y preparación específicos en este area27. Teniendo en cuenta el creciente rendimiento de la enfermería dermatológica como especialidad, estas nomenclaturas son cada vez más familiares para los enfermeros.
A medida que se normaliza la nomenclatura utilizada para describir las lesiones cutáneas, sean o no secundarias al PV, la interlocución entre los profesionales tiende a ser más uniforme, lo que evita malentendidos y redunda en una atención más segura del paciente. Sin embargo, en la evaluación de las heridas sigue existiendo una gran diversidad en la terminología utilizada para describir el daño cutáneo, por ejemplo: desprendimiento y fibrina; necrosis húmeda y necrosis por licuefacción; necrosis seca, "cicatriz" y lesión por presión; tejido de granulación, matriz extracelular o tejido viable. Esta riqueza terminológica provoca dudas, dentro de los profesionales que consultan los registros, generando a menudo interpretaciones que difieren de las de la persona que los registró. Para estandarizar el registro de las úlceras PV, sugerimos el uso de los términos de lesiones elementales: vesículas, ampollas, erosiones, úlceras y costras generalizadas.
El carácter crónico y la manifestación cutánea del PV roban al paciente su derecho a la confidencialidad. Con frecuencia, las lesiones se asocian al contagio, repercutiendo en las relaciones sociales y familiares, y perpetuando el estigma y el aislamiento4. Para Brandão, las acciones de enfermería se vuelven productivas en la medida en que buscan alcanzar el equilibrio holístico del paciente. Por ello, existe una búsqueda constante de alternativas que atiendan a las necesidades de las personas que sufren alteraciones en la integridad de la piel, y el desarrollo de tecnologías y técnicas que promuevan la curación para mejorar su calidad de vida4,27.
Conclusiones
Este estudio comparó la terminología utilizada para describir las úlceras cutáneas en los estudios de PV con la terminología utilizada para describir las lesiones elementales. También se demostró que las publicaciones escritas por médicos eran las más comunes, seguidas de las escritas por enfermeros, y que carecían de uniformidad en la descripción de las lesiones.
Este estudio demostró que los cambios en la piel del PV pueden clasificarse como lesiones cutáneas primarias (cambios de color y colecciones de líquido) o lesiones cutáneas secundarias (cambios de grosor y pérdida de tejido). Teniendo en cuenta el amplio glosario dermatológico, las lesiones secundarias al PV pueden caracterizarse como vesículas, ampollas, erosiones, úlceras y costras generalizadas para apoyar la práctica de la enfermería en dermatología.
Por último, se concluye que son necesarios estudios con un mayor nivel de evidencia en esta área para determinar la mejor forma de evaluar las lesiones, así como la nomenclatura a utilizar para mejorar los cuidados de enfermería.
Conflicto de intereses
Los autores declaran no tener conflictos de intereses.
Financiación
Los autores no recibieron financiación para este resumen de evidencia.
Author(s)
Mariana Takahashi Ferreira Costa*
Master’s Degree student, School of Nursing, Federal University of São Paulo, Brazil
Nurse member of Group for Prevention and Treatment of Wounds, de Emílio Ribas Infectology Institute, State Secretary of Health, São Paulo, SP, Brazil
Email marianatakahashicosta@hotmail.com
Luiza Keiko Matsuka Oyafuso
Supervisor of Health Technical Team, Emílio Ribas Infectology Institute, State Secretary of Health, São Paulo, SP, Brazil
Assistant Professor, ABC University Foundation
Mônica Antar Gamba
Associate Professor, School of Nursing, Federal University of São Paulo, São Paulo, SP, Brazil
Coordinator of the Dermatology Nursing Specialization Course, Mentor Professor at the Nursing Postgraduation Program
Kevin Y Woo PhD RN FAPWCA
Assistant Professor, School of Nursing, Faculty of Health Sciences, Queen’s University, Kingston, ON, Canada
Adjunct Research Professor, MClSc program, School of Physical Therapy, Faculty of Health Sciences, Western University
Wound Care Consultant, West Park Healthcare Centre
Clinical Web Editor, Advances in Skin and Wound Care
* Corresponding author
References
- Souza SR, Azulay-Abulafia L, Nascimento LV. Validation of the cutaneomucosal involvement index of pemphigus vulgaris for the clinical evaluation of patients with pemphigus vulgaris. An Bras Dermatol 2011;86(2):284–91.
- Hanauer L, Azulay-Abulafia L, Azulay DR, Azulay RD. Buloses. In: Azulay RD. Dermatology. 7th ed. Rio de Janeiro: Guanabara Koogan; 2017. p. 242–245.
- Sampaio SAP, Rivitti EA. Dermatology. 4th ed. São Paulo: Artes Médicas; 2018. p.300–316.
- Brandão ES, Santos I, Lanzillotti RS. Reduction of pain in clients with autoimmune bullous dermatoses: evaluation by fuzzy logic. Online Braz J Nurs 2016 Dec; 15(4):675–682. Available from: http://www.objnursing.uff.br/index.php/nursing/article/view/546
- Shimizu T, Takebayashi T, Sato Y, Niizeki H, Aoyama Y, et al. Grading criteria for disease severity by Pemphigus Disease Area Index. J Dermatol 2014;41:969–973.
- Brandão ES, Santos I, Lanzillotti RS. Nursing care to comfort people with immunobullous dermatoses: evaluation by fuzzy logic. Rev Enferm UERJ, Rio de Janeiro 2018; 26:e32877.
- Mendes KD, Silveira RC, Galvão CM. Integrative literature review: a research method to incorporate evidence in health care and nursing. Text & Cont Enferm 2008;17(4):758–64.
- Galvão CM, Sawada NO, Mendes IAC. The search for the best evidence. Rev Esc Enferm USP 2003;37:43–50.
- Kulthanan K, Chularojanamontri L, Tuchinda P, AL Sirikudta W, Pinkaew S. Clinical course of pemphigus in Thai patients. Asian Pac J Allergy Immunol 2011;29:161–8.
- Daniel BS, Hertl M, Werth VP, Eming R, Murrell DF. Severity score indexes for blistering diseases. Clin Dermatol 2012;30:108–113.
- Rahbar Z, Daneshpazhooh M, Mirshams-Shahshahani M, Esmaili N, Heidari K, et al. Pemphigus disease activity measurements: pemphigus disease area index, autoimmune bullous skin disorder intensity score and pemphigus vulgaris activity score. JAMA Dermatol 2014;150(3):266–72.
- Yoshifuku A, Fujii K, Kawahira H, Katsue H, Baba A, et al. Long-lasting localized pemphigus vulgaris without detectable serum autoantibodies against desmoglein 3 and desmoglein 1. Indian J Dermatol 2016;61(4):427.
- Zhou Q, Wang P, Zhang L, Wang B, Shi L, et al. Pemphigus vulgaris induced by 5-aminolaevulinic acid-based photodynamic therapy. Photodiagnosis Photodyn Ther 2017;156–158.
- Ormond M, McParland H, Donaldson ANA, Andiappan M, Cook RJ, Escudier M, Shirlaw PJ. An Oral Disease Severity Score validated for use in oral pemphigus vulgaris. Br J Dermatol 2018;179(4):872–881.
- Mishra S, Joshi S. Anesthetic management of a case of retroperitoneal tumor with pemphigus vulgaris with multiple comorbid conditions. Egyptian J Anaesthes 2016;32(1):151–153.
- Rivitti EA. Dermatologia. 4th ed. São Paulo: Artes Médicas; 2018. p. 109–118.
- Kasperkiewicz M, Ellebrecht CT, Takahashi H, Yamagami J, Zillikens D, Payne AS, Amagai M. Pemphigus. Nat Rev Dis Primers 2017 May 11;3:17026. doi:10.1038/nrdp.2017.26. PMID: 28492232; PMCID: PMC5901732.
- Azulay RD. Dermatology. 7th ed. Rio de Janeiro: Guanabara Koogan; 2017. p. 52–64.
- Yang F, Chen Z, Chen SA, Zhu Q, Wang L, et al. Skin ulcers infected with conditional pathogenic strains treated with local hydrogen water packing in two pemphigus vulgaris patients: case reports with follow-up for 2 months. Dermatol Ther 2019 Sep;32(5):e13027. doi:10.1111/dth.13027. Epub 2019 Jul 28. PMID: 31323168.
- Carmona Lorduy M, Porto Puerta I, Berrocal Torres S, Camacho Chaljub F. Manejo estomatológico y sistémico de pénfigo vulgar: reporte de un caso. Rev Cienc Salud 2018;16(2):357–367.
- Tsuruta D, Ishii N, Hashimoto T. Diagnosis and treatment of pemphigus. Immunother 2012;4(7):735.
- Benchikhi H, Nani S, Baybay H, et al. Pemphigus: use of the Japanese severity index in 56 Moroccan patients. Pan Afr Med J 2013;16:96.
- Suliman NM, Åstrøm AN, Ali RW, et al. Clinical and histological characterization of oral pemphigus lesions in patients with skin diseases: a cross sectional study from Sudan. BMC Oral Health 2013;13(1):66.
- Amagai M, Tanikawa A, Shimizu T, et al. Japanese guidelines for the management of pemphigus. J Dermatol 2014;41: 471–486.
- Brandão ES, Santos I, Lanzillotti RS, Ferreira AM, Gamba MA, et al. Nursing diagnoses in patients with immune-bullous dermatosis. Rev Lat Am Enfermagem 2016;24:e2766. doi:10.1590/1518-8345.0424.
- Kershenovich R, Hodak E, Mimouni D. Diagnosis and classification of pemphigus and bullous pemphigoid. Autoimmun Rev 2014;13:477–81.
- Pena SB, Guimarães HC, Bassoli SR, et al. Nursing diagnoses in pemphigus vulgaris: a case study. Int J Nurs Know 2013;24(3):176–179.
- Venugopal SS, Murrell DF. Diagnosis and clinical features of pemphigus vulgaris. Dermatol Clin 2011;29:373–380.
- Brandão ES, Santos I. Evidences related to the care of people with pemphigus vulgaris: a challenge to nursing. Online Braz J Nurs 2013 Sept;12(1):162–77. Available from: http://www.objnursing.uff.br/index.php/nursing/article/view/3674/html.
- Eskiocak AH, Ozkesici B, Uzun S. Familial pemphigus vulgaris occurred in a father and son as the first confirmed cases. Case Rep Dermatol Med 2016;1653507. doi:10.1155/2016/1653507. Epub 2016 Jun 15. PMID: 27403352; PMCID: PMC4925942.
- Di Zenzo G, Amber KT, Sayar BS, Müller EJ, Borradori L. Immune response in pemphigus and beyond: progresses and emerging concepts. Semin Immunopathol 2016 Jan;38(1):57–74.
- Hammers CM, Stanley JR. Mechanisms of disease: pemphigus and bullous pemphigoid. Annu Rev Pathol 2016;11:175–197.
- Mokhtari F, Matin M, Rajati F. Pemphigus vulgaris and amyotrophic lateral sclerosis. J Res Med Sci 2016 Oct18;21:82.
- DiMarco, C. Pemphigus: pathogenesis to treatment. R I Med J 2016;99(12):28–31.
- Rangel, J. Pregnancy-associated ‘cutaneous type’ pemphigus vulgaris. Perm J 2016;20(1):e101-e102. doi:10.7812/TPP/15-059.
- Costa MTF, Oyafuso LKM, Costa IG, Gamba MA, Woo KY. The management of pemphigus ulcers: a challenge and learning opportunity for Brazilian nurses. WCET J 2016;36(2):14–20.
- Lee SH, Hong WJ, Kim SC. Analysis of serum cytokine profile in pemphigus. Ann Dermatol 2017;29(4), 438–445.
- Harman KE, Brown D, Exton LS, Groves RW, Hampton PJ, Mohd Mustapa MF, Buckley DA. British Association of Dermatologists’ guidelines for the management of pemphigus vulgaris 2017. Br J Dermatol 2017;177(5):1170–1201.
- Dmochowski M, Gornowicz-Porowska J, Bowszyc-Dmochowska M. Dew drops on spider web appearance: a newly named pattern of IgG4 deposition in pemphigus with direct immunofluorescence. Postȩpy Dermatol Alergol 2017;34(4):295.
- Wang M, Liang L, Li L, Han K, Li Q, Peng Y, Zeng K. Increased miR-424-5p expression in peripheral blood mononuclear cells from patients with pemphigus. Mol Med Rep 2017;15(6):3479–3484.
- Kridin K, Zelber-Sagi S, Bergman R. Pemphigus vulgaris and pemphigus foliaceus: differences in epidemiology and mortality. Acta Derm Venereol 2017;97(8–9):1095–1099.
- Vinay K, Handa S, Khurana S, Agrawal S, De D. Dermatoscopy in diagnosis of cutaneous myiasis arising in pemphigus vulgaris lesions. Indian J Dermatol 2017;62(4):440.
- Jiménez-Zarazúa O, Guzmán-Ramírez A, Vélez-Ramírez LN, López-García JA, Casimiro-Guzmán L, Mondragón JD. A case of acute pemphigus vulgaris relapses associated with cocaine use and review of the literature. Dermatol Ther 2018;8(4):653–663.
- Seo JW, Park J, Lee J, Kim MY, Choi HJ, Jeong HJ, Kim WK. A case of pemphigus vulgaris associated with ulcerative colitis. Intest Res 2018;16(1):147.
- Ujiie I, Ujiie H, Iwata H, Shimizu H. Clinical and immunological features of pemphigus relapse. Br J Dermatol 2019 Jun;180(6):1498–1505. doi:10.1111/bjd.17591. Epub 2019 Mar 6. PMID: 30585310.
- Murrell D, Peña S, Joly P, Marinovic B, Hashimoto T, et al. Diagnosis and management of pemphigus: recommendations by an international panel of experts. J Am Acad Dermatol 2020 Mar;82(3):575–585.e1. doi:10.1016/j.jaad.2018.02.021. Epub 2018 Feb 10. PMID: 29438767; PMCID: PMC7313440.
- Sendrasoa FA, Ranaivo IM, Rakotoarisaona MF, Raharolahy O, Razanakoto NH, Andrianarison M, Rabenja FR. Pemphigus vulgaris as the first manifestation of multiple myeloma: a case report. J Med Case Rep 2018;12(1):255.
- Küçükoğlu R, Sun GP, Kılıç S. Polycyclic annular presentation of pemphigus vulgaris with an eosinophil predominance in two pregnant patients. Dermatol Online 2018;24(10).
- Feliciani C, Cozzani E, Marzano AV, Caproni M, Di Zenzo G, Calzavara-Pinton P, Lora V. Italian guidelines in pemphigus-adapted from the European Dermatology Forum (EDF) and European Academy of Dermatology and Venerology (EADV). G Ital Dermatol Venereol 2018;153(5):599–608.
- Porro A M, Hans Filho G, Santi CG. Consensus on the treatment of autoimmune bullous dermatoses: pemphigus vulgaris and pemphigus foliaceus: Brazilian Society of Dermatology. An Bras Dermatol 2019;94(2):20–32.
- Hattier G, Beggs S, Sahu J, Trufant J, Jones E. Koebner phenomenon: pemphigus vulgaris following Mohs micrographic surgery. Dermatol Online J 2019;25(1).
- Badavanis G, Pasmatzi E, Kapranos N, Monastirli A, Constantinou P, Psaras G, Tsambaos D. Pemphigus vulgaris possibly associated with application of a tissue expander in a patient with Crohn’s disease and primary sclerosing cholangitis. Acta Dermatovenerol Alp Pannonica Adriat 2019;28(4):173–176.
- Krammer S, Krammer C, Salzer S, Bağcı IS, French LE, Hartmann D. Recurrence of pemphigus vulgaris under nivolumab therapy. Front Med 2019;6:262.
- Bosseila M, Nabarawy EA, Latif MA, Doss S, ElKalioby M, Saleh MA. Scalp pemphigus vulgaris mimicking folliculitis decalvans: a case report. Dermatol Pract Concept 2019;9(3):215–17.
- Yavuz IH, Yavuz GO, Bayram I, Bilgili SG. Pemphigus in the eastern region of Turkey. Postȩpy Dermatol Alergol 2019;36(4):455–60.
- Sar-Pomian M, Rudnicka L, Olszewska M. The significance of scalp involvement in pemphigus: a literature review. Biomed Res Int 2018;2018: 6154397. doi:10,1155/2018/6154397
- Schmidt E, Kasperkiewic M, Joly P. Pemphigus. Lancet 2019;394(10201):882–894.
- Streifel AM, Wessman LL, Schultz BJ, Miller D, Pearson DR. Refractory mucositis associated with underlying follicular dendritic cell sarcoma of the thymus: paraneoplastic pemphigus versus malignancy-exacerbated pemphigus vulgaris. JAAD Case Rep 2019;5(11):933.
- España A, Iranzo P, Herrero‐González J, Mascaro Jr JM, Suárez R. Ocular involvement in pemphigus vulgaris: a retrospective study of a large Spanish cohort. J Dtsch Dermatol Ges 2017;15(4):396–403.
- Lee EB, Ayoubi N, Albayram M, Kariyawasam V, Motaparthi K. Cerebral toxoplasmosis after rituximab for pemphigus vulgaris. JAAD Case Rep 2019;6(1):37–41. doi:10.1016/j.jdcr.2019.10.015. PMID: 31909136; PMCID: PMC6938870.
- Brandão E, Santos I, Carvalho M, Pereira SK. Nursing care evolution to the client with pemphigus: integrative literature review. Revista Enfermagem 2011;19:479–484.
- Zhang C, Goldscheider I, Ruzicka T, Sardy M. Pemphigus vulgaris persistently localized to the nose with local and systemic response to topical steroids. Acta Derm Venereol 2017;97(8–9):1136–1137.
- Pietkiewicz P, Gornowicz-Porowska J, Bartkiewicz P, Bowszyc-Dmochowska M, Dmochowski M. Reviewing putative industrial triggering in pemphigus: cluster of pemphigus in the area near the wastewater treatment plant. Postȩpy Dermatol Alergol 2017;34(3):185.
- Oliveira LB, Maruta CW, Miyamoto D, Salvadori FA, Santi CG, Aoki V, Duarte-Neto AN. Gastrointestinal cytomegalovirus disease in a patient with pemphigus vulgaris treated with corticosteroid and mycophenolate mofetil. Autops Case Reps 2017;7(1):23.
- Osipowicz K, Kowalewski C, Woźniak K. Mycobacterium tuberculosis and pemphigus vulgaris. Postȩpy Dermatol Alergol 2018;35(5):532.
- Lazzarotto A, Ferranti M, Meneguzzo A, Sacco G, Alaibac M. Persistent B lymphocyte depletion after an ultralow dose of rituximab for pemphigus vulgaris. J Investig Allergol Clin Immunol 2018;28(5):347.
- Kiran KC, Madhukara J, Abraham A, Muralidharan S. Cutaneous bacteriological profile in patients with pemphigus. Indian J Dermatol 2018;63(4):301.
- Dube M, Takkar B, Asati D, Jain S. Anterior scleritis in a patient of pemphigus vulgaris while on immunosuppressive treatment. Indian J Dermatol 2019;64(6):499–500.



