Volume 42 Number 2
Fluid handling dynamics and durability of silver-containing gelling fibre dressings tested in a robotic wound system
Aleksei Orlov, Adi Lustig, Angela Grigatti and Amit Gefen
Keywords Wound care, biomechanical model, exudate management, laboratory testing, sorptivity, tissue phantom
For referencing Orlov A et al. Fluid handling dynamics and durability of silver-containing gelling fibre dressings tested in a robotic wound system. WCET® Journal 2022;42(2):15-23
DOI https://doi.org/10.33235/wcet.42.2.15-23
Abstract
Objective To develop a robotic phantom system containing multiple simulated wound replicates to determine the synergy in fluid absorbency and retention (sorptivity) performances and the post-simulated-use mechanical durability of silver-containing gelling fibre primary dressings when used with a secondary dressing, as per clinical practice.
Methods Using a robotic system containing six identical wound simulators, the authors tested the sorptivity performances of the Exufiber Ag+ (Mölnlycke Health Care, Gothenburg, Sweden) primary dressing (ExAg-polyvinyl alcohol [PVA]) against a market-leading comparator product, when used with a secondary foam dressing. The durability of the primary dressings after simulated use was further investigated through tensile mechanical testing.
Results The ExAg-PVA primary dressing delivered greater fluid amounts for absorbency and retention by the secondary foam dressing, approximately 2- and 1.5-fold more than the comparator dressing pair after 10 and 15 hours, respectively. The ExAg-PVA dressing was also substantially less sensitive to the direction of pulling forces and, accordingly, exhibited post-use mechanical strength that was approximately four- and six-times greater than that of the other primary dressing (when the latter dressing was tested out-of-alignment with its visible seams) after 10 and 15 hours, respectively.
Conclusions The dynamics of the sorptivity and fluid sharing between primary and secondary dressings and the effect of directional preference of strength of the primary dressings for adequate durability, resulting in safe post-use removals, have been described. The comparative quantification of these capabilities should help clinical and nonclinical decision-makers select dressings that best meet their patient needs.
Copyright ©2022 the Author(s). This is an open-access article distributed under the terms of the Creative Commons Attribution-Non Commercial-No Derivatives License 4.0 (CCBY-NC-ND), where it is permissible to download and share the work provided it is properly cited. The work cannot be changed in any way or used commercially without permission from the journal.
Introduction
Wounds of all types, including chronic cavity wounds such as pressure injuries, are one of the most impactful, expensive, and common medical problems. Nearly 2.5% of the US population experiences wounds, which is similar, for example, to the prevalence of stroke in the US.1–4 As the population ages and the prevalences of diabetes and obesity increase, there is a sharp growth in demand for advanced and cost-effective wound care to deliver improved patient outcomes. Treatment dressings play a pivotal role in all aspects of wound healing. Designed, in essence, as a temporary artificial substitute for intact skin, treatment dressings protect the wound and manage the exudates that result from periwound inflammatory processes. The presence and composition of exudates typically support the function of tissue-repairing cells and newly generated tissues; thus, in a normal tissue-repair process, the rate of exudate and its constituents will match the healing phase.5–7 However, abnormal prolongation of the inflammatory stage, such as in chronic wounds, may disrupt the physiologic control of exudate production, leading to excessive exudate amounts or altered ratios of protein content which causes the fluid to be thick, highly viscous, or even sticky.5
Effective wound dressings are required to manage exudate fluids secreted at varying rates and viscosities, in the same wound at different times, or for wounds of the same etiology but different patients. A common clinical practice is to insert a primary wound dressing through the wound opening to form the first-line reservoir for fluid absorption and retention on the wound bed. A secondary dressing is then placed above the cavity (and the primary dressing) for mechanical and biological protection, as well as to make a second vessel for the accumulating fluids. Gelling fibre dressings composed of polyvinyl alcohol (PVA) fibres or sodium carboxymethyl cellulose (CMC) are widely used as primary dressings because of their ability to trap fluids by transformation into a gel phase8 (examples of these commercial primary wound dressing products are listed in the woundsource.com resource database9 under the “Gelling Fiber Dressings” wound dressing product category). A variant of these primary gelling fibre dressings are those that contain silver ions to further induce an antimicrobial effect. To deliver effective treatments, a primary dressing and a secondary dressing must work in synergy; that is, neither dressing should approach its maximum fluid absorption capacity within the timeframe indicated for use.3,10–12
The performance of a wound dressing depends primarily on the specific material composition, structure, and manufacturing technology of the dressing. These characteristics, in combination with the relevant clinical protocol, specific wound environment, and the type of paired secondary dressing, impact the safety and efficacy of the primary dressing product. Two fluid-structure interaction properties that are relevant to the function of primary dressings are “sorptivity,” the capacity of a dressing structure to transfer excessive exudate away from the wound bed and onward to the secondary dressing through capillary action,10,13 and “durability,” the ability of a dressing to withstand patient body weight and other mechanical forces applied during changes and remain intact within the wound over the period of use or upon removal.10,13
In the 1970s, it was reported that the presence of gauze dressing particles in wounds “act as foreign bodies and may delay healing. Their removal has been associated with accelerated healing.”14 More recently, Chakravarthy and colleagues15 documented grossly visible disintegration of modern (hydrocolloid) dressings in wounds. Dressing disintegration was associated with inflammatory giant cells—pathologic evidence for a foreign-body reaction—which highlights the importance of durability at both the macroscale and microscale. Specifically, Chakravarthy et al15 evaluated the density of giant cells in histologic tissue sections that were extracted from wounds in a pig model of wound healing and subsequently stained by hematoxylin and eosin. They documented the presence of foreign material (ie, dressing debris) in the vicinity of the giant cells in the histologic slides, which correlated with their observed fragmentation of some of the tested hydrocolloid dressings upon removal during dressing changes.15
Accordingly, poorly performing wound dressings or dressing pairs may cause suboptimal moisture balance, mechanical damage to tissues, foreign-body reactions, or a combination of these adverse events. Such dressing failure modes should be identified through methodological bioengineering laboratory testing so that medical claims can be controlled by regulatory bodies and dressing failure in clinical settings can be avoided. In this context, the authors continue to invest research efforts into the development and improvement of preclinical and laboratory testing methods for objective, quantitative, and standardised evaluation of wound dressing performance.3,10,11,13 Here, the authors present a novel robotic phantom system that contains multiple simulated wound replicates for the simultaneous testing of dressings. The system was developed and used to determine the synergy in fluid absorbency and retention performances of two silver-containing gelling fibre primary dressing products. The methods, equipment, and protocols reported herein form the basis for the next level of clinically relevant performance testing for wound dressings, focused on both safety and efficacy.
Methods
Robotic Exuding Wounds
The researchers developed and used a robotic phantom system comprising six wound replicates. Each wound unit in this system simulated an exuding, 2.5 cm-deep cavity wound (Figure 1). All six wound units included three layers of synthetic soft-tissues simulants (Figure 1). The top layer, representing the peri-wound skin, consisted of 5 mm-thick transparent silicone rubber (RTV615, Momentive Performance Materials Inc, Waterford, New York). An 8-mm-thick layer of paraffin gel (“candle-gel”; Ziv Chemicals Ltd., Holon, Israel) was placed below this “skin” layer, to represent adipose tissue. The inferior layer (with thickness of 12 mm) representing skeletal muscle was again made of silicone rubber (identical to that used as the skin simulant). The elastic modulus of the aforementioned silicone rubber material, measured through uniaxial tensile testing using an electromechanical material-testing machine (Instron model 5944; Instron Co, Norwood, Massachusetts) following ASTM D412-06,16 is 1.5 MPa, which is characteristic of both skin and muscle tissues under large deformations.17–19 The elastic modulus of the paraffin gel used to represent adipose tissue was measured through previously reported indentation tests20 and found to be 5 kPa, which is similar to the reported stiffness of native adipose tissues.21 To simulate continuous secretion of exudate from the above wound constructs, a spiral perforated irrigation tube was laid in each simulated wound bed and tunneled through the phantom structure to connect to a multichannel, programmable syringe pump (NE-1600; New Era Pump Systems Inc, Farmingdale, New York; Figure 1). The effective wet surface formed in the simulated wound beds through this irrigation element was approximately 24 cm2, corresponding to an effective irrigation depth of approximately 2.5 cm. The multichannel syringe pump provided precise control over the flow volume and release rate of an exudate-substitute fluid delivered into the simulated wound beds. The safe and reproducible exudate substitute fluid formula is based on Xanthan gum (C35H49O29); it was previously developed by the authors’ research group for use with the robotic wound phantom systems. This formula facilitates control of the fluid viscosity and pH level to adequately represent the physical characteristics of native exudates.10-13,22 Two exudate solutions were prepared, with high and low viscosities of 0.23 Pa×s and 0.06 Pa×s, respectively; the fluid density was 1.03 g/mL for both. An infrared heating lamp was positioned above the six wound replicas to maintain them at a temperature of 33 ± 2° C;23 the temperatures were monitored via a digital thermometer (Newtron TM-5005-SINGLE I/P; MRC Laboratory Equipment Ltd, Holon, Israel).
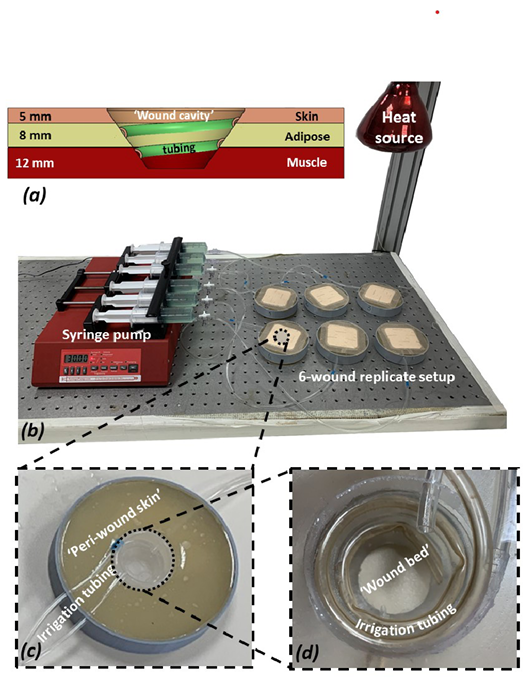
Figure 1. The experimental setup and its components
a) A scheme of a cross-section through a single “wound” simulator unit showing the different tissue simulant layers and their respective thicknesses, the shape and depth of the ‘wound cavity’ and the configuration of the spiral irrigation tubing. (b) A photograph of the robotic phantom system including the six wound replicates and the control unit. (c) A close-up view of a single simulated wound. (d) Zoom on the simulated exuding “wound bed.”
Simulated Treatments
Two types of 10×10 cm primary gelling fibre dressings were investigated: Exufiber Ag+ (Mölnlycke Health Care AB, Gothenburg, Sweden) with PVA fibres (ExAg-PVA) and an equivalent, commercially available, and market-leading silver ion dressing product containing sodium CMC as the gelling material (Ag-CMC). The Ag-CMC dressing is a soft, sterile, nonwoven pad composed of sodium CMC hydrocolloid fibre material that is impregnated with 1.2% ionic silver.24-26 It is indicated for clinical use in various wound types, both acute and chronic, and its physical and antibacterial properties have been described in detail elsewhere.24-26 Of note, although the two types of primary dressings selected for this study—PVA-based and CMC-based—are made of distinct materials and produced through different manufacturing technologies, both are clinically indicated for use as cavity wound fillers, which was the rationale for the current comparison. Mepilex Border Flex (MBF-Foam; Mölnlycke Health Care), a multilayer bordered silicone-foam dressing, was used as the secondary dressing to cover the simulated wounds in all the tests. The MBF-Foam is a five-layer dressing that includes (from the outer dressing surface to its wound-facing aspect): backing film, a retention layer, a spreading layer, an absorptive foam layer (which transports exudate to the spreading layer), and a wound contact layer.
Prior to applying the dressing products onto the simulated wounds, each dressing (primary or secondary) was weighed. The dressings were then applied according to manufacturer instructions. The simulated wounds were positioned facing upward, so that the tested dressings were required to absorb and retain the exudate substitute through capillary action (ie, against gravity). The robotic system was activated with a flow rate of 2 mL/h. To determine the time course of the absorbency performances of the tested dressings and, importantly, the dynamics of the fluid distribution between the primary and secondary dressings, the products were tested for multiple durations of simulated use: 5, 10, and 15 hours.
Dressing Studies
Fluid Retention and Distribution Between the Primary and Secondary Dressings. Following simulated use in the robotic phantom system, the dressings were reweighed to calculate the net mass gain in each dressing due to fluid absorption; any nonretained, residual fluids were carefully collected from the wound cavities and also weighed. After converting the measured fluid masses to volumes (by dividing the absorbed and residual fluid masses by the fluid density), the total exudate volume was calculated separately for each test as the sum of the fluid volumes in the primary and secondary dressings plus the volume of the residual fluid. Next, the distribution of fluid volumes between the primary and secondary dressings was calculated for each test as the percentage of fluid retained in the primary versus the secondary dressing, with respect to the corresponding total exudate volume (the theoretical value of which is also calculable, as the product of the predetermined flow rate and the time of operation of the robotic wound system).10
Fiber Directionality. For gelling fibre dressings, the directionality of the fibres, which typically is related to the manufacturing technology of these primary dressings (ie, PVA vs CMC), likely affects the performances of the dressing product, such as the sorptivity (the fibres become the structural conductors for the capillary action) and the durability (the fibres provide structural support and mechanical tolerance against forces that are aligned with their primary direction). Accordingly, the researchers assessed the directionality of the fibres in the two primary dressing types by digital image processing of microscopy images of the dressing surfaces, which were acquired using a light optical stereo microscope (Axiolab A450909; Carl Zeiss AG, Oberkochen, Germany). The micrographs of the dressing surfaces were acquired in transmitted light mode using a 1.25× magnification objective, a C-mounted digital camera (Swift Cam SC1803; Swift Optical Instruments Inc, Schertz Texas) and the Swift Imaging software (version 3.0, Swift Optical Instruments Inc.). Five fields of view (FOVs) were captured at consistent surface locations from two primary dressing specimens of each type: One FOV was located at the center of the dressing, and the other four FOVs formed a cross around the dressing center, with each such peripheral FOV located at a distance of 2.5 cm from the dressing edges. This resulted in a total of 15 digital micrographs of the FOVs per dressing type, each with dimensions of 4,912 × 3,684 pixels (1 square pixel = 0.919 µm2). For the purpose of the fibre directionality analyses, the acquired FOVs were further divided into three rectangular sub-FOVs, each with dimensions of 1445×3288 pixels. The fibre directionality analyses were conducted using the postacquisition plugin “OrientationJ” of the ImageJ software suite (version 1.X),27,28 which segments the fibres in the digital micrographs and calculates the probability function for their planar orientation in each analyzed sub-FOV. After calibrating this code and visually verifying its performances, the normalised histograms of the fibre orientations in the studied primary dressings were extracted.
Strength of the Primary Dressings After Simulated Use. Immediately after the simulated use sessions, the tensile strength of each primary dressing specimen was tested using an electromechanical testing machine (Instron model 5944; Instron Co) equipped with a 2kN load cell, following a protocol that is based on ASTM D882-02.29 Primary dressing specimens prepared according to the above testing standard were stretched at a deformation rate of 50 mm/min until ultimate failure occurred. Based on the resulting force-deformation data, stress-strain curves of the dressings after simulated use were plotted and the area under the stress-strain curve, which is the strain energy density (SED) to failure, was calculated for each test using a dedicated MATLAB computer code (ver. R2019a; MathWorks, Inc, Natick, Massachusetts). Based on these microscopy analyses of the fibre orientations, the ExAg-PVA dressing was treated as a structure without a specific directional preference (ie, test specimens from this dressing type were prepared and mechanically tested at random directions). However, the Ag-CMC silver-containing primary dressing, which has a specific directional preference of its fibres (as further detailed in the Results), was tested in two different configurations: where its principal fibre direction was fully aligned with the loading axis of the material testing machine, and where the fibres were out of such alignment.
Statistical analyses
All the experiments reported above were conducted in replicates of six and descriptive statistics of means and SDs were calculated for the retained fluid volumes, the distribution of fluid contents between the primary and secondary dressings per each simulated use duration (5, 10, and 15 hours), and the SED to failure of the primary dressings (depending on the directionality of the fibres with respect to the loading axis, as noted previously). Next, analyses of variance (ANOVA), followed by post-hoc Tukey-Kramer multiple pairwise comparisons, were run to identify potential differences between the dressing performances in the previously described fluid management (sorptivity) and material strength tests. Specifically, two-way ANOVAs for the factors of the usage time and the primary dressing type were conducted for the fluid retention and fluid distribution data. In addition, a three-way ANOVA for the factors of the usage time, the primary dressing type, and the directionality of the tensile test with respect to the fibre orientation (in the primary dressing that exhibited directional preference of fibre orientation) was performed for the material strength data. Only the longer exposure times of 10 and 15 hours, for which substantial fluid mass had accrued in the tested primary dressings, were considered for the latter three-way ANOVA. With respect to the directionality factor, based on the microscopy analyses, the last ANOVA considered the ExAg-PVA dressing, which did not show any specific and consistent directional preference of its fibres, as having a single strength (SED-to-failure) property. However, the Ag-CMC had two strength properties, namely, the strength measured (1) when the fibres were fully aligned with the loading axis of the material testing machine and, (2) when they were out of such alignment. P <.05 was considered statistically significant.
Results
When examined in isolation, the absorbency of the ExAg-PVA primary dressing was lower (approximately 11-22%) than that of the Ag-CMC primary silver dressing (Figure 2a). However, this difference was due to a more effective transfer of the exudate-like fluid from the ExAg-PVA dressing to the secondary dressing, as evident when examining the data for the fluid distribution between the primary and secondary dressings (Figure 2b). Specifically, when functioning in a pair with the ExAg-PVA dressing, the secondary dressing contained approximately twice the amount of fluid at the 10-hour time point and 1.5-times the amount of fluid after 15 hours with respect to the comparator pair (Figure 2b). The dynamics of the fluid distribution between the primary and secondary dressings over time (Figure 2b) further revealed that the reservoir of the secondary dressing began to receive fluid no earlier than 5 hours from the time of the dressing application (Figure 2b). After 15 hours, the secondary dressing shared approximately 54.2% of the retained fluid when the primary dressing was ExAg-PVA but only 36.7% when the Ag-CMC primary dressing was used (P < .05; Figure 2b). Importantly, these results represent the performances of the dressing pairs and therefore, better reflect real-world clinical practice, as opposed to assessments of the function of wound dressings in isolation (Figure 2b).
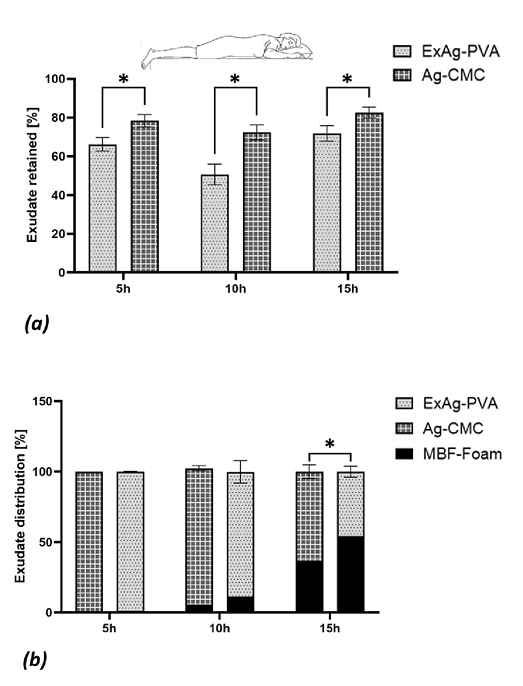
Figure 2. Fluid absorption and retention performances of the tested dressings
(a) The fluid retained in the primary dressings, reflecting the sorptivity of these dressings (reported as percentage of the total fluid volume retained in the primary and secondary dressings plus the residual fluid in the simulated wound bed). (b) The fluid distribution between the primary and secondary dressings after 5, 10, and 15 hours of simulated use in offloaded wounds (as in a prone position). The error bars are the SDs from the mean values of six test repetitions per test configuration and an asterisk indicates a statistically significant difference in the relevant outcome measure (P < .01).
The digital microscopy image analyses of the primary dressings indicated that the ExAg-PVA dressing had no distinguishable directional fibre preference. Specifically, to verify the relative lack of directional preference of the ExAg-PVA dressing with respect to that of the Ag-CMC primary silver-containing dressing, the researchers calculated the integral bounded between the fibre orientation histogram curve and the 0.5 (midpoint) level for the two primary dressings. This integral is defined here as the fibre orientation index (FOI). When a dressing does not exhibit a directional preference of its fibres, the positive and negative areas between the aforementioned histogram curve and the 0.5 level approximately cancel each other out, which results in a relatively low FOI value. The analyses of the FOI data indicated that the ExAg-PVA dressing had a statistically significant, approximately 3.9-fold lower FOI (15.6 ± 11.8) with respect to that of the Ag-CMC primary silver-containing dressing (60.8 ± 48.8; P < .05 for five different microscope FOVs on each dressing type). This FOI property ratio quantitatively demonstrates the strong preference of the fibre alignment in the Ag-CMC primary dressing toward the direction of the visible reinforcing seams in that dressing (the 90° direction marked in Figure 3a). Of note, the fibre orientation histogram of the latter (Ag-CMC) dressing was always above the midpoint level, which again indicates a strong directional preference (Figure 3a). Visual inspection of the microscopy data confirmed that the majority of the fibres in the Ag-CMC primary dressing were aligned and grouped together to connect to the vertical (90°-oriented) visible seams. The micrographs further demonstrated numerous elliptically shaped voids with characteristic maximum length dimensions of approximately 400 to 600 µm in the Ag-CMC primary dressing (Figure 3a). These findings, of a preferred fibre orientation and abundant presence of noncircular voids, justified the selection of the Ag-CMC primary silver-containing dressing as having a specific directional preference (ie, along its visible seams) for the purpose of further mechanical testing, as follows.
For the mechanical testing of the primary dressings post simulated use, the later time points of 10 and 15 hours of fluid exposure were selected because the previous results indicated that at 10 hours and afterward, both primary dressing types had transferred fluid to their paired secondary dressings (Figure 2b). Thus, at the 10- and 15-hour timepoints, both primary dressing types used their fluid reservoirs in a manner indicating that they were indeed tested at their “wet” state. Further, based on the results of the microscopy analyses, the ExAg-PVA dressing was tested as a structure without a specific directional preference (ie, irrespective of the direction by which test specimens were cut from this dressing type), whereas the Ag-CMC dressing was tested in two different configurations: fully aligned with the primary fibre orientation (90° direction), which is the direction of the visible seams, and out of such alignment (ie, randomly selected but different from the 90° direction).
The SED-to-failure data for the two primary dressing types are shown in Figure 3b and demonstrate considerable differences in mechanical behaviors of the post-use dressing types, particularly concerning the ductility of the ExAg-PVA dressing versus the Ag-CMC product. Ductility is the degree to which a material or structure can sustain plastic/irreversible deformations and continue to absorb strain energy under tensile loading before catastrophic failure occurs. Interestingly, the ExAg-PVA dressing appeared to gain ductility as it absorbed more fluid and gelled and accordingly, at 15 hours, it had 1.7-times greater SED-to-failure than it did at 10 hours. In contrast, gelling transformation did not translate into greater ductility for the Ag-CMC primary dressing; its SED-to-failure data were indistinguishable for the 10- and 15-hour time points (Figure 3b). Moreover, the aforementioned strength tests clearly indicated that the main loadbearing structure in the Ag-CMC primary dressing was, indeed, the reinforcing (visible) seams and the (near) 90°-oriented fibres. When tested out of alignment, the strength of the Ag-CMC primary dressing dropped significantly, by more than 8-fold (P < .05). With respect to the mechanical strength of the ExAg-PVA dressing, the Ag-CMC primary dressing had an out-of-alignment strength that was approximately four and six times lower for the 10- and 15-hour time points, respectively (P < .05).
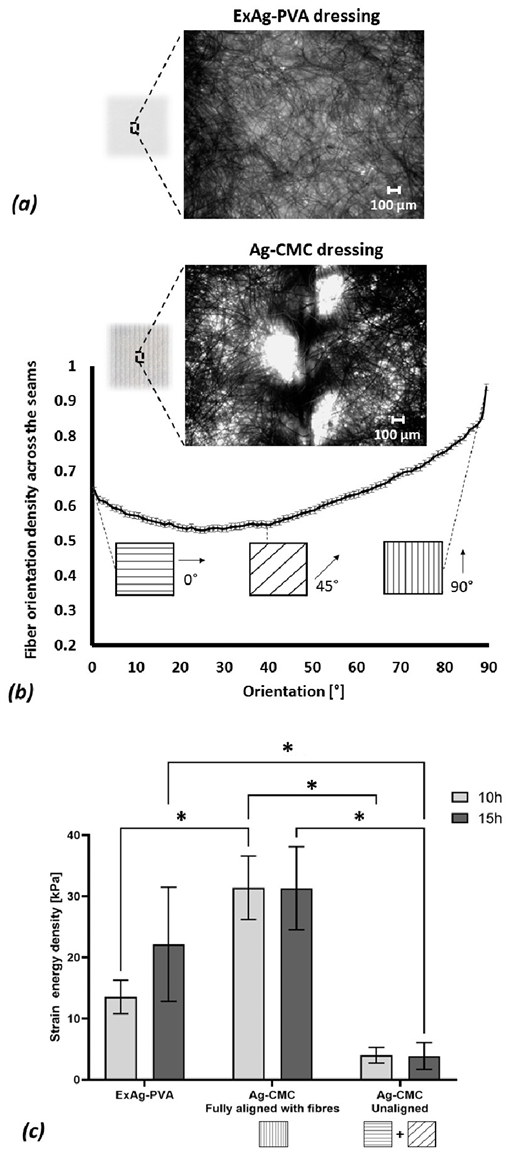
Figure 3. Structure-function analyses of the tested primary wound dressings
(a) An example of a microscopic image of the Exufiber Ag+ (ExAg-PVA) dressing. (b) Representative microscopy image analysis of the fiber orientation in the Ag-sodium carboxymethyl cellulose (CMC) dressing, showing the normalised planar distribution of fiber orientations in this primary dressing type. (c) The strain energy density to failure of the two tested primary dressing types post simulated use of 10 and 15 hours, where the Ag-CMC product has been tested in two configurations, either in full alignment of the principal direction of the fibers of the dressing with the loading axis of the testing machine, or out of such alignment. The error bars are the SDs from the mean values of six test repetitions per test configuration and an asterisk indicates a statistically significant difference in the relevant outcome measure (P < .01).
Discussion
Wound exudates are critical for tissue repair—they facilitate cell mobility and transport of signaling molecules and growth factors across the wound bed. However, excess exudate production may lead to maceration, become a medium for infections, or prolong the inflammation period.30,31 Thus, excess exudate amounts should be absorbed and retained in therapeutic dressings to support the natural wound-healing process. Clinical practice in treating cavity wounds as well as other highly exuding wounds (such as venous leg ulcers and burns) is to use a nonadherent wound filler as the primary dressing to induce a moist wound-healing environment while maximising dressing contact with the wound bed for effective absorbency. A secondary dressing is then applied to close the wound and protect it from potential mechanical traumas and pathogen invasion while also allowing evaporation of the exudate and release of byproduct gases. The secondary dressing also potentially provides an additional reservoir for absorbency and retention of the wound fluids, but it strongly depends on the sorptivity of the primary dressing for effective exudate management. Hence, for effective treatments, the primary and secondary dressings must work in synergy; both dressings should share the retained fluid mass as equally as possible and not approach their maximum fluid absorption capacity until a dressing change is indicated.3,10,11 Of note, for clinical realism, sorptivity should be assessed by testing a wound dressing pair using a relatively viscous, not watery, test fluid, which was the approach of the current study.10,11 New exudate cannot enter a primary dressing if there is no space for it at the wound-contacting aspect of the dressing; however, the existence of such available space depends on adequate transport of existing exudate from the primary to the secondary dressing.10,11 The capillary action that enables this fluid movement is inversely proportional to the square root of the viscosity of the transferred fluid (see Equation 2 in Lustig et al10); that is, the more viscous the fluid, the more difficult it is for it to be transported against gravity upward to the secondary dressing in any offloaded wound.10 Of note, nonoffloaded wounds may occur in real-world clinical practice and include, for example, wounds that are subjected to body weight forces such as plantar diabetic foot ulcers or sacral pressure injuries in patients who are ventilated supine, or wounds that are compressed by a medical device such as compression stockings applied on venous leg ulcers. The current study and configuration of the robotic exuding wounds apply to off-loaded wounds only; the additional biophysical complexity that arises from the action of bodyweight or external (eg, medical device-related) forces on a wound or its vicinity was not taken into account.
Gelling fibre dressings based on PVA or CMC fibres are used as primary dressings on a variety of highly exuding wound types. These dressings are meant to form a soft, cohesive gel when in contact with exudate, which induces the necessary moisture in the wound. However, such dressings must exhibit sufficient capillary action (sorptivity) to effectively transfer any excess exudate fluids away from the wound bed and prevent their pooling at the wound-dressing interfaces or within any undermining or tunneling spaces.3,10,11 In this work, a robotic phantom system of multiple simulated wound replicates was developed and used to evaluate the synergy in fluid absorbency and retention performances (facilitated through sorptivity) of two market-leading silver-containing gelling fibre primary dressing products when used with a secondary foam dressing, as per clinical practice. The ability of these primary dressings to stay intact while being subjected to pulling forces post simulated use sessions (ie, to exhibit clinically relevant durability) was further tested. These pulling forces mimic the mechanical effect of the forces that a clinician would apply with his/her gloved fingers or forceps when removing a used dressing and replacing it with a new one.
The ExAg-PVA was substantially more effective in transferring exudate simulants to the secondary foam dressing compared with the Ag-CMC. The ExAg-PVA dressing contained less fluid at each time point, and its paired secondary dressing accepted that fluid and retained it at increasing amounts over time. The latter results are particularly innovative because they reveal, for the first time in the literature, that the sharing process initiates between 5 and 10 hours after application of the dressings and amplifies thereafter. Specifically, the ExAg-PVA primary dressing delivers greater fluid amounts for absorbency and retention by the secondary dressing, approximately 2- and 1.5-fold the amounts of fluid at the 10- and 15-hour time points, respectively, with reference to the comparator dressing pair. The more fluid that is transferred to the secondary dressing, the greater the available capacity of the primary dressing to manage new inflowing exudates. Thus, laboratory evaluations must assess the function of wound dressings in the relevant clinical context (ie, measuring the function of the primary-secondary dressing pair as opposed to testing dressing products in isolation). Importantly, these experimental results demonstrate that the extent and rate of fluid sharing depend on the dressing materials and composition, indicating that there are more and less optimal choices of primary-secondary dressing combinations.
Nevertheless, sorptivity and the associated absorbency and retention performances are only one aspect to consider when assessing the safety and effectiveness of wound dressings through bioengineering laboratory testing. The mechanical strength of a primary dressing must be sufficient to endure the forces that occur throughout the life cycle of the dressing, including under the extraction forces that a clinician applies when the dressing is removed. Despite being exposed to the aggressive chemical and thermodynamic environment of the wound, a dressing must not disintegrate or leave debris or particles in the wound. Any debris (even microparticles) that originate from the primary dressing and spread onto the wound surface may initiate a foreign-body reaction whereby the immune system attempts to form granuloma (aggregation of macrophages and fibroblasts around each particle to isolate it from the body tissues). Such events consume valuable inflammatory and tissue repair efforts, which detract from the local biologic healing resources (eg, the potential numbers of the immune and fibroblast cells that are available for the tissue repair task).3,10,15,32
The microscopy image analyses did not show a consistent, strong directional preference of the fibres in the ExAg-PVA dressing, indicating low directional strength preference compared with the Ag-CMC, which did demonstrate a strong directional preference associated with its weave structure, specifically toward the visible reinforcing seams of the dressing. The durability testing results were consistent with the aforementioned microscopy findings for the Ag-CMC. Specifically, the Ag-CMC demonstrated poor mechanical strength when the direction of the pulling forces did not fully align with that of the reinforcing seams. Moreover, the current mechanical testing indicated that the strength of the Ag-CMC dressing is dominantly provided by the visible reinforcing seams and the closely aligned fibres; this imposes a real-world requirement (not presented by the manufacturer) that a clinician removing the dressing should be aware of the orientation of the seams and attempt to pull in that specific direction so as to avoid accidental (partial or complete) tearing. Yet, when removing a primary dressing from the wound cavity, the likelihood that a nurse would (blindly) pull the dressing at a specific orientation that exactly matches the primary fibre orientation of the dressing approaches zero. Moreover, removing a dressing in line with its primary fibre orientation is made even harder if the dressing takes on the same color as the exudate while in the wound. Because dressings are typically folded in the wound cavity and most of their structure is invisible, even if a nurse would hypothetically attempt to pull the dressing in a specific direction (to conform with the dressing’s optimal mechanical energy absorption to failure properties), then still, from a cost-effectiveness perspective, a dressing requiring removals at specific orientation and extra attention to that aspect adds to the clinical workload. The above implies that in real-world, clinically relevant scenarios, the Ag-CMC would have a four to six times lower strength (ie, mechanical energy absorption to failure) than that of the ExAg-PVA dressing, and the Ag-CMC dressing is therefore much more likely to leave debris or particles in a wound. The likelihood of such dressing failure events increases further when a wound has undermining, is tunneled, or has sticky or rough surfaces, all of which may be associated with greater pullout forces required to release the used dressing to be changed.
As with any experimental study, there are limitations in the ability to mimic in vivo processes and the large variety of clinical scenarios. Accordingly, in future work, additional experiments focusing on typically nonoffloaded wounds such as venous leg ulcers, are warranted. There is also a need to test additional wound dressing types and technologies from various manufacturers and include the aspect of cost-effectiveness versus the measured performance parameters. Other sensors and post analyses can potentially be added to the apparatus (and to each wound simulant unit) or be integrated in the testing methodology, such as intrawound continuous pH monitoring or mass spectrometry of the residual fluids following dressing usage periods. Further progress can be achieved by introducing exudate substitutes that contain specific microbiomes that may represent different wound etiologies, such as infected pressure injuries or diabetic foot ulcers. All of these future improvements would require additional validation and reliability studies before informing clinical practice.
Conclusions
Using an automated robotic phantom system of multiple open cavity wounds, the authors evaluated the absorbency and retention and therefore the sorptivity performances of silver-containing gelling fibre dressings paired with a secondary foam dressing. The mechanical durability of the primary silver-containing dressings was tested after simulated use. The current experimental system and protocol were designed with emphasis on the clinical relevance of the bioengineering laboratory testing, to reproduce how wound dressings are used in practice and consider the real-world scenarios that may be associated with their failure. Consistent with the previous published work of the authors, sorptivity and durability were again identified as critical factors that should be assessed when evaluating wound dressings in laboratory testing.3,10,11 The present findings further underpin that wound dressings belonging to a certain product category, such as silver-containing gelling fibre dressings, are not all the same, and the specific absorption, retention, and, importantly, the ability to synergistically work with a secondary dressing (which good sorptivity enables) differ across products, depending on the specific materials and composition of the dressing.3,10,32,33 The present experimental data revealed that the ExAg-PVA dressing has better sorptivity and durability than the comparator Ag-CMC product. Moreover, the authors described the dynamics of the fluid sharing between primary and secondary dressings and identified the importance of not having a specific fibre directionality in a primary dressing for durability and safe post-use removals. The comparative quantification of these capabilities should help both clinical and nonclinical decision-makers to assess and select the wound dressings that best meet the needs of their patients. As with any preclinical work, the current laboratory findings need to be validated against randomised controlled trials with appropriate sample sizes of different wound etiologies. The role of the laboratory work reported here is primarily to guide such potential clinical research to focus on the novel aspects of fluid sharing between the primary and secondary wound dressings, and the ability of the primary dressings to remain intact during removals, topics that have been poorly addressed in the literature thus far.
Acknowledgment
This project has received funding from the European Union’s Horizon 2020 research and innovation program under the Marie Skłodowska-Curie Grant was also partially supported by the Israeli Ministry of Science & Technology (Medical Devices Program grant no. 3-17421, awarded to Prof Amit Gefen in 2020) and by Mölnlycke Health Care (Gothenburg, Sweden). The authors thank Ms Orel Belo, the Laboratory Engineer at the Gefen Laboratory, for supporting the experimental work. The authors have disclosed no other financial relationships related to this article. Submitted July 23, 2021; accepted in revised form November 1, 2021; published online ahead of print March 14, 2022. Copyright Advances in Skin & Wound Care and the World Council of Enterostomal Therapists.
Conflict of interest
The authors declare no conflicts of interest.
Funding
The authors received no funding for this study.
Dinámica de manipulación de fluidos y durabilidad de los apósitos de fibra gelificante con plata probados en un sistema robótico para heridas
Aleksei Orlov, Adi Lustig, Angela Grigatti and Amit Gefen
DOI: https://doi.org/10.33235/wcet.42.2.15-23
Resumen
Objetivo Desarrollar un sistema robótico fantasma que contenga múltiples réplicas de heridas simuladas para determinar la sinergia en los rendimientos de absorción y retención de fluidos (sortividad) y la durabilidad mecánica posterior al uso simulado de los apósitos primarios de fibra gelificante que contienen plata cuando se utilizan con un apósito secundario, según la práctica clínica.
Métodos Utilizando un sistema robótico que contenía seis simuladores de heridas idénticos, los autores probaron las prestaciones de sortividad del apósito primario Exufiber Ag+ (Mölnlycke Health Care, Gotemburgo, Suecia) (ExAg-alcohol polivinílico [PVA]) frente a un producto de comparación líder en el mercado, cuando se utiliza con un apósito de espuma secundario. La durabilidad de los apósitos primarios tras el uso simulado se investigó además mediante pruebas mecánicas de tracción.
Resultados El apósito primario ExAg-PVA proporcionó mayores cantidades de líquido para la absorción y la retención del apósito secundario de espuma, aproximadamente 2 y 1,5 veces más que el par de apósitos de comparación después de 10 y 15 horas, respectivamente. El apósito ExAg-PVA también fue sustancialmente menos sensible a la dirección de las fuerzas de tracción y, en consecuencia, mostró una resistencia mecánica posterior al uso que fue aproximadamente cuatro y seis veces mayor que la del otro apósito primario (cuando este último se probó fuera de la alineación de sus costuras visibles) después de 10 y 15 horas, respectivamente.
Conclusiones Se ha descrito la dinámica de la sortividad y el reparto de fluidos entre los apósitos primarios y secundarios, así como el efecto de la preferencia direccional de la resistencia de los apósitos primarios para una durabilidad adecuada, lo que da lugar a retiradas seguras después del uso. La cuantificación comparativa de estas capacidades debería ayudar a los responsables de la toma de decisiones clínicos y no clínicos a seleccionar los apósitos que mejor satisfagan las necesidades de sus pacientes.
Copyright ©2022 el/los autor/es. Este es un artículo de acceso abierto distribuido bajo los términos de la licencia Creative Commons Attribution-Non Commercial-No Derivatives License 4.0 (CCBY-NC-ND), donde se permite descargar y compartir la obra siempre que se cite adecuadamente. El trabajo no puede ser modificado de ninguna manera ni utilizado comercialmente sin el permiso de la revista.
Introduccion
Las heridas de todo tipo, incluidas las heridas crónicas por cavidad, como las lesiones por presión, son uno de los problemas médicos más impactantes, costosos y comunes. Casi el 2,5% de la población estadounidense sufre heridas, lo que es similar, por ejemplo, a la prevalencia de los accidentes cerebrovasculares en Estados Unidos.1–4 A medida que la población envejece y aumenta la prevalencia de la diabetes y la obesidad, se produce un fuerte crecimiento de la demanda de cuidados avanzados y rentables de las heridas para ofrecer mejores resultados a los pacientes. Los apósitos de tratamiento desempeñan un papel fundamental en todos los aspectos de la cicatrización de las heridas. Diseñados, en esencia, como un sustituto artificial temporal de la piel intacta, los apósitos de tratamiento protegen la herida y gestionan los exudados resultantes de los procesos inflamatorios periheridos. La presencia y la composición de los exudados suelen favorecer la función de las células reparadoras de tejidos y de los nuevos tejidos generados; por lo tanto, en un proceso normal de reparación de tejidos, la tasa de exudado y sus componentes coincidirán con la fase de cicatrización.5–7 Sin embargo, la prolongación anormal de la fase inflamatoria, como ocurre en las heridas crónicas, puede alterar el control fisiológico de la producción de exudado, lo que da lugar a cantidades excesivas de exudado o a la alteración de las proporciones del contenido proteico, lo que hace que el líquido sea espeso, muy viscoso o incluso pegajoso.5
Se necesitan apósitos eficaces para gestionar los fluidos exudados que se segregan a diferentes velocidades y viscosidades, en la misma herida en diferentes momentos, o para heridas de la misma etiología, pero de diferentes pacientes. Una práctica clínica habitual es insertar un apósito primario a través de la abertura de la herida para formar el depósito de primera línea para la absorción y retención de líquidos en el lecho de la herida. A continuación, se coloca un apósito secundario por encima de la cavidad (y del apósito primario) para la protección mecánica y biológica, así como para hacer un segundo recipiente para los fluidos acumulados. Los apósitos de fibra gelificante compuestos por fibras de alcohol polivinílico (PVA) o carboximetilcelulosa sódica (CMC) se utilizan ampliamente como apósitos primarios debido a su capacidad para atrapar fluidos mediante su transformación en una fase de gel8 (en la base de datos de recursos de woundsource.com9 se enumeran ejemplos de estos productos comerciales de apósitos primarios en la categoría de productos "Apósitos de fibra gelificante"). Una variante de estos apósitos de fibra gelificante primaria son los que contienen iones de plata para inducir aún más un efecto antimicrobiano. Para que los tratamientos sean eficaces, un apósito primario y un apósito secundario deben trabajar en sinergia; es decir, ninguno de los dos apósitos debe acercarse a su capacidad máxima de absorción de fluidos dentro del plazo indicado para su uso.3,10–12
El rendimiento de un apósito depende principalmente de la composición específica del material, la estructura y la tecnología de fabricación del apósito. Estas características, en combinación con el protocolo clínico pertinente, el entorno específico de la herida y el tipo de apósito secundario emparejado, influyen en la seguridad y la eficacia del producto del apósito primario. Dos propiedades de la interacción fluido-estructura que son relevantes para la función de los apósitos primarios son la "sortividad", la capacidad de una estructura de apósito para transferir el exudado excesivo fuera del lecho de la herida y hacia el apósito secundario a través de la acción capilar,10,13 y la "durabilidad", la capacidad de un apósito para soportar el peso corporal del paciente y otras fuerzas mecánicas aplicadas durante los cambios y permanecer intacto dentro de la herida durante el periodo de uso o al retirarlo.10,13
En la década de los 70, se informó de que la presencia de partículas de gasa en las heridas "actúan como cuerpos extraños y pueden retrasar la cicatrización". Su eliminación se ha asociado a la aceleración de la curación.14
Más recientemente, Chakravarthy y sus colegas15 documentaron la desintegración visible de los apósitos modernos (hidrocoloides) en las heridas. La desintegración del apósito se asoció a células gigantes inflamatorias -evidencia patológica de una reacción a cuerpo extraño-, lo que pone de manifiesto la importancia de la durabilidad tanto a macro como a microescala. En concreto, Chakravarthy et al15 evaluaron la densidad de células gigantes en secciones de tejido histológico extraídas de heridas en un modelo porcino de cicatrización de heridas y posteriormente teñidas con hematoxilina y eosina. Documentaron la presencia de material extraño (es decir, restos de apósitos) en las proximidades de las células gigantes en los portaobjetos histológicos, lo que se correlacionaba con la fragmentación observada de algunos de los apósitos hidrocoloides probados al retirarlos durante los cambios de apósito.15
Por lo tanto, los apósitos o pares de apósitos con un rendimiento deficiente pueden causar un equilibrio de humedad subóptimo, daños mecánicos a los tejidos, reacciones a cuerpos extraños o una combinación de estos eventos adversos. Estos modos de fallo de los apósitos deben identificarse mediante pruebas metodológicas de laboratorio de bioingeniería para que los organismos reguladores puedan controlar las reclamaciones médicas y evitar el fallo de los apósitos en los entornos clínicos. En este contexto, los autores siguen invirtiendo esfuerzos de investigación en el desarrollo y la mejora de métodos de prueba preclínicos y de laboratorio para la evaluación objetiva, cuantitativa y estandarizada del rendimiento de los apósitos.3,10,11,13 Aquí, los autores presentan un novedoso sistema robótico fantasma que contiene múltiples réplicas de heridas simuladas para el ensayo simultáneo de apósitos. El sistema se desarrolló y utilizó para determinar la sinergia en la absorción de fluidos y las prestaciones de retención de dos productos de apósitos primarios de fibra gelificante que contienen plata. Los métodos, el equipo y los protocolos descritos en este documento constituyen la base para el siguiente nivel de pruebas de rendimiento clínicamente relevantes para los apósitos, centradas en la seguridad y la eficacia.
Metodos
Heridas exudativas robóticas
Los investigadores desarrollaron y utilizaron un sistema robótico fantasma compuesto por seis réplicas de heridas. Cada unidad de herida de este sistema simulaba una herida cavitaria exudativa de 2,5 cm de profundidad (Figura 1). Las seis unidades de heridas incluían tres capas de simulantes sintéticos de tejidos blandos (Figura 1). La capa superior, que representaba la piel peri-herida, consistía en un caucho de silicona transparente de 5 mm de espesor (RTV615, Momentive Performance Materials Inc, Waterford, Nueva York). Debajo de esta capa de "piel" se colocó una capa de 8 mm de espesor de gel de parafina ("candle-gel"; Ziv Chemicals Ltd., Holon, Israel) para representar el tejido adiposo. La capa inferior (con un grosor de 12 mm) que representaba el músculo esquelético era de nuevo de caucho de silicona (idéntico al utilizado como simulador de piel). El módulo elástico del mencionado material de caucho de silicona, medido mediante un ensayo de tracción uniaxial utilizando una máquina de ensayos electromecánicos de materiales (Instron modelo 5944; Instron Co, Norwood, Massachusetts) siguiendo la norma ASTM D412-06,16 es de 1,5 MPa, lo cual es característico de los tejidos de la piel y del músculo sometidos a grandes deformaciones.17–19 El módulo elástico del gel de parafina utilizado para representar el tejido adiposo se midió a través de ensayos de indentación previamente reportados20 y se encontró que era de 5 kPa, que es similar a la rigidez reportada de los tejidos adiposos nativos.21 Para simular la secreción continua de exudado de las construcciones de heridas mencionadas, se colocó un tubo de irrigación perforado en espiral en cada lecho de herida simulado y se introdujo en un túnel a través de la estructura fantasma para conectarlo a una bomba de jeringa programable multicanal (NE-1600; New Era Pump Systems Inc, Farmingdale, Nueva York; Figura 1). La superficie húmeda efectiva que se formó en los lechos de la herida simulada a través de este elemento de irrigación fue de aproximadamente 24 cm2, lo que corresponde a una profundidad de irrigación efectiva de aproximadamente 2,5 cm. La bomba de jeringa multicanal proporcionó un control preciso sobre el volumen de flujo y la tasa de liberación de un fluido sustituto del exudado suministrado en los lechos de la herida simulada. La fórmula del fluido sustituto del exudado, segura y reproducible se basa en la goma xantana (C35H49O29); fue desarrollada previamente por el grupo de investigación de los autores para su uso con los sistemas robóticos fantasmas de heridas. Esta fórmula facilita el control de la viscosidad del fluido y el nivel de pH para representar adecuadamente las características físicas de los exudados nativos.10-13,22 Se prepararon dos soluciones de exudado, con viscosidades alta y baja de 0,23 Pa×s y 0,06 Pa×s, respectivamente; la densidad del fluido fue de 1,03 g/mL para ambas. Se colocó una lámpara de calefacción infrarroja por encima de las seis réplicas de heridas para mantenerlas a una temperatura de 33 ± 2° C;23 las temperaturas se controlaron mediante un termómetro digital (Newtron TM-5005-SINGLE I/P; MRC Laboratory Equipment Ltd, Holon, Israel).

Figura 1. El montaje experimental y sus componentes
a) Esquema de un corte transversal a través de una unidad de simulador de "herida" que muestra las diferentes capas de simulante tisular y sus respectivos grosores, la forma y la profundidad de la "cavidad de la herida" y la configuración del tubo de irrigación en espiral. (b) Una fotografía del sistema robótico fantasma que incluye las seis réplicas de la herida y la unidad de control. (c) Un primer plano de una única herida simulada. (d) Zoom sobre el "lecho de la herida" exudado simulado
Tratamientos simulados
Se investigaron dos tipos de apósitos de fibra gelificante primaria de 10×10 cm: Exufiber Ag+ (Mölnlycke Health Care AB, Gotemburgo, Suecia) con fibras de PVA (ExAg-PVA) y un producto de apósito de iones de plata equivalente, disponible comercialmente y líder en el mercado, que contiene CMC sódica como material gelificante (Ag-CMC). El apósito Ag-CMC es una almohadilla suave, estéril y no tejida, compuesta por material de fibra hidrocoloide de CMC sódica impregnada con un 1,2% de plata iónica.24-26 Está indicado para su uso clínico en varios tipos de heridas, tanto agudas como crónicas, y sus propiedades físicas y antibacterianas se han descrito en detalle en otros lugares.24-26 Cabe destacar que, aunque los dos tipos de apósitos primarios seleccionados para este estudio -basados en VA y en CMC- están hechos de materiales distintos y se producen mediante tecnologías de fabricación diferentes, ambos están indicados clínicamente para su uso como rellenos de heridas cavitarias, lo que constituyó la razón de ser de la presente comparación. Se utilizó Mepilex Border Flex (MBF-Foam; Mölnlycke Health Care), un apósito multicapa de espuma de silicona con bordes, como apósito secundario para cubrir las heridas simuladas en todas las pruebas. El MBF-Foam es un apósito de cinco capas que incluye (desde la superficie exterior del apósito hasta su aspecto orientado hacia la herida): película de soporte, una capa de retención, una capa de extensión, una capa de espuma absorbente (que transporta el exudado a la capa de extensión) y una capa de contacto con la herida.
Antes de aplicar los productos de apósito en las heridas simuladas, se pesó cada apósito (primario o secundario). A continuación, se aplicaron los apósitos según las instrucciones del fabricante. Las heridas simuladas se colocaron hacia arriba, de modo que los apósitos probados debían absorber y retener el sustituto del exudado por acción capilar (es decir, en contra de la gravedad). El sistema robótico se activó con un flujo de 2 mL/h. Para determinar el curso temporal de las prestaciones de absorción de los apósitos probados y, sobre todo, la dinámica de la distribución de fluidos entre los apósitos primarios y secundarios, se probaron los productos durante múltiples duraciones de uso simulado: 5, 10 y 15 horas.
Estudios de vestimenta
Retención y distribución de fluidos entre los apósitos primario y secundario. Tras el uso simulado en el sistema robótico fantasma , se volvieron a pesar los apósitos para calcular la ganancia de masa neta en cada apósito debido a la absorción de fluidos; los fluidos residuales no retenidos se recogieron cuidadosamente de las cavidades de la herida y también se pesaron. Tras convertir las masas de fluido medidas en volúmenes (dividiendo las masas de fluido absorbidas y residuales por la densidad del fluido), el volumen total de exudado se calculó por separado para cada prueba como la suma de los volúmenes de fluido en los apósitos primarios y secundarios más el volumen del fluido residual. A continuación, se calculó la distribución de los volúmenes de fluido entre los apósitos primario y secundario para cada prueba como el porcentaje de fluido retenido en el apósito primario frente al secundario, con respecto al correspondiente volumen total de exudado (cuyo valor teórico también es calculable, como el producto del caudal predeterminado y el tiempo de funcionamiento del sistema robótico para heridas).10
Direccionalidad de la fibra. En el caso de los apósitos de fibra gelificante, la direccionalidad de las fibras, que suele estar relacionada con la tecnología de fabricación de estos apósitos primarios (es decir, PVA frente a CMC), probablemente afecta a las prestaciones del producto del apósito, como la sortividad (las fibras se convierten en los conductores estructurales de la acción capilar) y la durabilidad (las fibras proporcionan un soporte estructural y una tolerancia mecánica frente a las fuerzas que están alineadas con su dirección primaria). En consecuencia, los investigadores evaluaron la direccionalidad de las fibras en los dos tipos de apósitos primarios mediante el procesamiento digital de imágenes de microscopía de las superficies de los apósitos, que se adquirieron utilizando un microscopio óptico estereoscópico de luz (Axiolab A450909; Carl Zeiss AG, Oberkochen, Alemania). Las micrografías de las superficies de los apósitos se adquirieron en modo de luz transmitida utilizando un objetivo de 1,25× aumentos, una cámara digital montada en C (Swift Cam SC1803; Swift Optical Instruments Inc, Schertz Texas) y el software Swift Imaging (versión 3.0, Swift Optical Instruments Inc.). Se capturaron cinco campos de visión (FOV) en ubicaciones superficiales consistentes de dos especímenes de apósitos primarios de cada tipo: Un FOV estaba situado en el centro del apósito, y los otros cuatro FOV formaban una cruz alrededor del centro del apósito, y cada uno de estos FOV periféricos estaba situado a una distancia de 2,5 cm de los bordes del apósito. Esto dio lugar a un total de 15 micrografías digitales de los FOV por tipo de apósito, cada una con dimensiones de 4.912 × 3.684 píxeles (1 píxel cuadrado = 0,919µm2). A efectos de los análisis de direccionalidad de las fibras, los FOV adquiridos se dividieron además en tres sub-FOV rectangulares, cada uno de ellos con dimensiones de 1445×3288 píxeles. Los análisis de direccionalidad de las fibras se llevaron a cabo utilizando el plugin "OrientationJ" del conjunto de software ImageJ (versión 1.X),27,28 que segmenta las fibras en las micrografías digitales y calcula la función de probabilidad para su orientación planar en cada sub-FOV analizado. Tras calibrar este código y verificar visualmente sus prestaciones, se extrajeron los histogramas normalizados de las orientaciones de las fibras en los apósitos primarios estudiados.
Resistencia de los apósitos primarios tras un uso simulado. Inmediatamente después de las sesiones de uso simulado, se ensayó la resistencia a la tracción de cada muestra de apósito primario utilizando una máquina de ensayos electromecánicos (Instron modelo 5944; Instron Co) equipada con una célula de carga de 2kN, siguiendo un protocolo que se basa en la norma ASTM D882-02.29 Las muestras de apósito primario preparadas según la norma de ensayo mencionada se estiraron a una velocidad de deformación de 50 mm/min hasta que se produjo el fallo final. A partir de los datos de fuerza-deformación resultantes, se trazaron las curvas de tensión-deformación de los apósitos tras el uso simulado y se calculó para cada prueba el área bajo la curva de tensión-deformación, que es la densidad de energía de deformación (SED) hasta el fallo, utilizando un código informático MATLAB dedicado a (ver. R2019a; MathWorks, Inc, Natick, Massachusetts). Sobre la base de estos análisis microscópicos de las orientaciones de las fibras, el apósito ExAg-PVA se trató como una estructura sin una preferencia direccional específica (es decir, se prepararon muestras de ensayo de este tipo de apósito y se probaron mecánicamente en direcciones aleatorias). Sin embargo, el apósito primario que contiene plata Ag-CMC, que tiene una preferencia direccional específica de sus fibras (como se detalla más adelante en los Resultados), se probó en dos configuraciones diferentes: en las que la dirección principal de sus fibras estaba totalmente alineada con el eje de carga de la máquina de ensayo de materiales, y en las que las fibras estaban fuera de dicha alineación.
Análisis estadísticos
Todos los experimentos descritos anteriormente se llevaron a cabo en réplicas de seis y las estadísticas descriptivas de las medias y las SD fueron calculadas para los volúmenes de fluidos retenidos, la distribución del contenido de fluidos entre los apósitos primarios y secundarios por cada duración de uso simulada (5, 10 y 15 horas) y la SED hasta el fallo de los apósitos primarios (en función de la direccionalidad de las fibras con respecto al eje de carga, como se ha indicado anteriormente). A continuación, se realizaron análisis de varianza (ANOVA), seguidos de comparaciones múltiples post-hoc de Tukey-Kramer por pares, para identificar posibles diferencias entre los rendimientos de los apósitos en las pruebas de gestión de fluidos (sortividad) y de resistencia de los materiales descritas anteriormente. En concreto, se realizaron ANOVAs de dos vías para los factores del tiempo de uso y el tipo de apósito primario para los datos de retención y distribución de fluidos. Además, se realizó un ANOVA de tres vías para los factores del tiempo de uso, el tipo de apósito primario y la direccionalidad del ensayo de tracción con respecto a la orientación de las fibras (en el apósito primario que mostraba preferencia direccional de la orientación de las fibras) para los datos de resistencia del material. En el último ANOVA de tres vías sólo se tuvieron en cuenta los tiempos de exposición más largos, de 10 y 15 horas, para los que se había acumulado una masa de líquido considerable en los apósitos primarios probados. Con respecto al factor de direccionalidad, basado en los análisis de microscopía, el último ANOVA consideró que el apósito ExAg-PVA, que no mostraba ninguna preferencia direccional específica y consistente de sus fibras, tenía una única propiedad de resistencia (SED-a-fallo). Sin embargo, la Ag-CMC tenía dos propiedades de resistencia, a saber, la resistencia medida (1) cuando las fibras estaban totalmente alineadas con el eje de carga de la máquina de ensayo de materiales y, (2) cuando estaban fuera de dicha alineación. P <.05 se consideró estadísticamente significativo.
Resultados
Cuando se examinó de forma aislada, la absorbencia del apósito primario ExAg-PVA fue menor (aproximadamente 11-22%) que la del apósito primario de plata Ag-CMC (Figura 2a). Sin embargo, esta diferencia se debió a una transferencia más eficaz del fluido exudado del apósito ExAg-PVA al apósito secundario, como resulta evidente al examinar los datos de la distribución del fluido entre los apósitos primario y secundario (Figura 2b). En concreto, cuando funcionaba en un par con el apósito ExAg-PVA, el apósito secundario contenía aproximadamente el doble de cantidad de líquido en el punto de tiempo de 10 horas y 1,5 veces la cantidad de líquido después de 15 horas con respecto al par de comparación (Figura 2b). La dinámica de la distribución del líquido entre los apósitos primario y secundario a lo largo del tiempo (Figura 2b) reveló además que el depósito del apósito secundario comenzó a recibir líquido no antes de las 5 horas desde el momento de la aplicación del apósito (Figura 2b). Después de 15 horas, el apósito secundario compartía aproximadamente el 54,2% del líquido retenido cuando el apósito primario era ExAg-PVA, pero sólo el 36,7% cuando se utilizaba el apósito primario de Ag-CMC (P < 0,05; Figura 2b). Es importante destacar que estos resultados representan las prestaciones de los pares de apósitos y, por lo tanto, reflejan mejor la práctica clínica del mundo real, a diferencia de las evaluaciones de la función de los apósitos aislados (Figura 2b).

Figura 2. Rendimiento de absorción y retención de fluidos de los apósitos probados (a) El fluido retenido en los apósitos primarios, que refleja la sortividad de estos apósitos (indicado como porcentaje del volumen total de fluido retenido en los apósitos primarios y secundarios más el fluido residual en el lecho de la herida simulada). (b) La distribución de fluidos entre los apósitos primario y secundario tras 5, 10 y 15 horas de uso simulado en heridas descargadas (como en posición prona). Las barras de error son las SD de los valores medios de seis repeticiones de prueba por configuración de prueba y un asterisco indica una diferencia estadísticamente significativa en la medida de resultado pertinente (P < 0,01).
Los análisis de imágenes de microscopía digital de los apósitos primarios indicaron que el apósito ExAg-PVA no presentaba una preferencia direccional de fibras distinguible. En concreto, para verificar la relativa falta de preferencia direccional del apósito ExAg-PVA con respecto a la del apósito primario con plata Ag-CMC, los investigadores calcularon la integral delimitada entre la curva del histograma de orientación de las fibras y el nivel 0,5 (punto medio) para los dos apósitos primarios. Esta integral se define aquí como el índice de orientación de la fibra (FOI). Cuando un apósito no muestra una preferencia direccional de sus fibras, las áreas positivas y negativas entre la curva del histograma antes mencionada y el nivel 0,5 se anulan aproximadamente, lo que da lugar a un valor FOI relativamente bajo. Los análisis de los datos del FOI indicaron que el apósito ExAg-PVA tenía un FOI estadísticamente significativo, aproximadamente 3,9 veces menor (15,6 ± 11,8) con respecto al del apósito primario con plata Ag-CMC (60,8 ± 48,8; P < 0,05 para cinco FOVs de microscopio diferentes en cada tipo de apósito). Esta relación de propiedades FOI demuestra cuantitativamente la fuerte preferencia de la alineación de las fibras en el apósito primario de Ag-CMC hacia la dirección de las costuras de refuerzo visibles en dicho apósito (la dirección de 90° marcada en la Figura 3a). Cabe destacar que el histograma de la orientación de las fibras de este último apósito (Ag-CMC) estaba siempre por encima del nivel del punto medio, lo que indica de nuevo una fuerte preferencia direccional (Figura 3a). La inspección visual de los datos de microscopía confirmó que la mayoría de las fibras del apósito primario de Ag-CMC estaban alineadas y agrupadas para conectarse a las costuras visibles verticales (orientadas a 90°). Las micrografías demostraron además numerosos huecos de forma elíptica con dimensiones características de longitud máxima de aproximadamente 400 a 600 µm en el apósito primario de Ag-CMC (Figura 3a). Estos hallazgos, de una orientación preferente de las fibras y de la abundante presencia de vacíos no circulares, justificaron la selección del apósito primario con contenido de plata Ag-CMC por tener una preferencia direccional específica (es decir, a lo largo de sus costuras visibles) con el fin de realizar más pruebas mecánicas, como se indica a continuación.
Para las pruebas mecánicas de los apósitos primarios después del uso simulado, se seleccionaron los puntos de tiempo más tardíos de 10 y 15 horas de exposición al líquido porque los resultados anteriores indicaban que a las 10 horas y después, ambos tipos de apósitos primarios habían transferido líquido a sus apósitos secundarios emparejados (Figura 2b). Por lo tanto, en los puntos de tiempo de 10 y 15 horas, ambos tipos de apósitos primarios utilizaron sus depósitos de fluido de una manera que indica que fueron probados en su estado "húmedo". Además, basándose en los resultados de los análisis microscópicos, el apósito ExAg-PVA se ensayó como una estructura sin una preferencia direccional específica (es decir, independientemente de la dirección en la que se cortaron las muestras de ensayo de este tipo de apósito), mientras que el apósito Ag-CMC se ensayó en dos configuraciones diferentes: totalmente alineado con la orientación primaria de las fibras (dirección de 90°), que es la dirección de las costuras visibles, y fuera de dicha alineación (es decir, seleccionada al azar pero diferente de la dirección de 90°).
Los datos de SED a fallo para los dos tipos de apósitos primarios se muestran en la Figura 3b y demuestran diferencias considerables en los comportamientos mecánicos de los tipos de apósitos posteriores al uso, especialmente en lo que respecta a la ductilidad del apósito ExAg-PVA frente al producto Ag-CMC. La ductilidad es el grado en que un material o una estructura puede soportar deformaciones plásticas/irreversibles y seguir absorbiendo energía de deformación bajo carga de tracción antes de que se produzca un fallo catastrófico. Curiosamente, el apósito ExAg-PVA parecía ganar ductilidad a medida que absorbía más líquido y se gelificaba y, en consecuencia, a las 15 horas, tenía una SED hasta el fallo 1,7 veces mayor que a las 10 horas. Por el contrario, la transformación de la gelificación no se tradujo en una mayor ductilidad para el apósito primario de Ag-CMC; sus datos de SED a fallo fueron indistintos para los puntos de tiempo de 10 y 15 horas (Figura 3b). Además, las pruebas de resistencia mencionadas antes indicaron claramente que la principal estructura de carga en el apósito primario de Ag-CMC eran, de hecho, las costuras de refuerzo (visibles) y las fibras (casi) orientadas a 90°. Cuando se probó fuera de la alineación, la resistencia del apósito primario de Ag-CMC disminuyó significativamente, en más de 8 veces (P < 0,05). Con respecto a la resistencia mecánica del apósito ExAg-PVA, el apósito primario de Ag-CMC tenía una resistencia fuera de la alineación que era aproximadamente cuatro y seis veces menor para los puntos de tiempo de 10 y 15 horas, respectivamente (P < 0,05).

Figura 3. Análisis de la estructura-función de los apósitos primarios probados (a) Un ejemplo de imagen microscópica del apósito Exufiber Ag+ (ExAg-PVA). (b) Análisis de imágenes de microscopía representativo de la orientación de las fibras en el apósito de Ag-carboximetilcelulosa sódica (CMC), que muestra la distribución planar normalizada de las orientaciones de las fibras en este tipo de apósito primario. (c) La densidad de energía de deformación hasta el fallo de los dos tipos de apósitos primarios ensayados tras un uso simulado de 10 y 15 horas, donde el producto Ag-CMC se ha ensayado en dos configuraciones, bien en plena alineación de la dirección principal de las fibras del apósito con el eje de carga de la máquina de ensayo, o bien fuera de dicha alineación. Las barras de error son las SD de los valores medios de seis repeticiones de prueba por configuración de prueba y un asterisco indica una diferencia estadísticamente significativa en la medida de resultado pertinente (P < 0,01).
Discusion
Los exudados de las heridas son fundamentales para la reparación de los tejidos, ya que facilitan la movilidad celular y el transporte de moléculas de señalización y factores de crecimiento a través del lecho de la herida. Sin embargo, la producción excesiva de exudado puede provocar maceración, convertirse en un medio para las infecciones o prolongar el periodo de inflamación.30,31 Así pues, el exceso de exudado debe ser absorbido y retenido en los apósitos terapéuticos para favorecer el proceso natural de cicatrización de la herida. La práctica clínica en el tratamiento de las heridas cavitarias, así como de otras heridas con gran exudación (como las úlceras venosas de las piernas y las quemaduras), consiste en utilizar un apósito no adherente como apósito primario para inducir un entorno húmedo de cicatrización de la herida, al tiempo que se maximiza el contacto del apósito con el lecho de la herida para lograr una absorción eficaz. A continuación, se aplica un apósito secundario para cerrar la herida y protegerla de posibles traumas mecánicos y de la invasión de patógenos, al tiempo que se permite la evaporación del exudado y la liberación de los gases derivados. El apósito secundario también proporciona potencialmente un depósito adicional para la absorción y la retención de los fluidos de la herida, pero depende en gran medida de la sortividad del apósito primario para un tratamiento eficaz del exudado. Por lo tanto, para que los tratamientos sean eficaces, los apósitos primarios y secundarios deben trabajar en sinergia; ambos apósitos deben compartir la masa de fluido retenida de la forma más equitativa posible y no acercarse a su capacidad máxima de absorción de fluido hasta que esté indicado un cambio de apósito.3,10,11 Cabe destacar que, para lograr el realismo clínico, la sortividad debe evaluarse probando un par de apósitos con un líquido de prueba relativamente viscoso, no acuoso, que fue el enfoque del presente estudio. 10,11 El nuevo exudado no puede entrar en un apósito primario si no hay espacio para él en la parte del apósito que entra en contacto con la herida; sin embargo, la existencia de dicho espacio disponible depende del transporte adecuado del exudado existente desde el apósito primario al secundario.10,11 La acción capilar que permite este movimiento de fluido es inversamente proporcional a la raíz cuadrada de la viscosidad del fluido transferido (véase la ecuación 2 en Lustig et al10); es decir, cuanto más viscoso sea el fluido, más difícil será su transporte contra la gravedad hacia el apósito secundario en cualquier herida descargada.10 Cabe destacar que las heridas sin carga pueden producirse en la práctica clínica del mundo real e incluyen, por ejemplo, las heridas sometidas a fuerzas del peso corporal, como las úlceras plantares del pie diabético o las lesiones por presión del sacro en pacientes con ventilación supina, o las heridas comprimidas por un dispositivo médico, como las medias de compresión aplicadas en las úlceras venosas de las piernas. El presente estudio y la configuración de las heridas exudativas robóticas se aplican únicamente a las heridas sin carga; no se tuvo en cuenta la complejidad biofísica adicional que surge de la acción del peso corporal o de las fuerzas externas (por ejemplo, relacionadas con los dispositivos médicos) sobre una herida o sus alrededores.
Los apósitos de fibra gelificante basados en fibras de PVA o CMC se utilizan como apósitos primarios en una variedad de tipos de heridas muy exudativas. Estos apósitos están destinados a formar un gel suave y cohesivo cuando entran en contacto con el exudado, lo que induce la humedad necesaria en la herida. Sin embargo, dichos apósitos deben presentar una acción capilar suficiente (sortividad) para transferir eficazmente cualquier exceso de fluidos exudados fuera del lecho de la herida y evitar que se acumulen en las interfaces entre la herida y el apósito o dentro de cualquier espacio de socavación o túnel.3,10,11 En este trabajo, se desarrolló un sistema robótico fantasma de múltiples réplicas de heridas simuladas y se utilizó para evaluar la sinergia en los rendimientos de absorción y retención de fluidos (facilitados por la sortividad) de dos productos de apósitos primarios de fibra gelificante que contienen plata, líderes en el mercado, cuando se utilizan con un apósito de espuma secundario, según la práctica clínica. También se comprobó la capacidad de estos apósitos primarios de permanecer intactos mientras se les somete a fuerzas de tracción después de sesiones de uso simuladas (es decir, de mostrar una durabilidad clínicamente relevante). Estas fuerzas de tracción imitan el efecto mecánico de las fuerzas que un clínico aplicaría con sus dedos enguantados o fórceps al retirar un apósito usado y sustituirlo por uno nuevo.
El ExAg-PVA fue sustancialmente más eficaz en la transferencia de simulantes de exudado al apósito de espuma secundario en comparación con el Ag-CMC. El apósito ExAg-PVA contenía menos líquido en cada punto de tiempo, y su apósito secundario emparejado aceptaba ese líquido y lo retenía en cantidades crecientes con el tiempo. Estos últimos resultados son especialmente innovadores porque revelan, por primera vez en la literatura, que el proceso de reparto se inicia entre 5 y 10 horas después de la aplicación de los apósitos y se amplía a partir de entonces. Específicamente, el apósito primario ExAg-PVA proporciona mayores cantidades de líquido para la absorción y retención por el apósito secundario, aproximadamente 2 y 1,5 veces las cantidades de líquido en los puntos de tiempo de 10 y 15 horas, respectivamente, con referencia al par de apósitos de comparación. Cuanto más líquido se transfiera al apósito secundario, mayor será la capacidad disponible del apósito primario para gestionar los nuevos exudados entrantes. Por lo tanto, las evaluaciones de laboratorio deben valorar la función de los apósitos en el contexto clínico pertinente (es decir, medir la función del par apósito primario-secundario en lugar de probar los productos de apósito de forma aislada). Es importante destacar que estos resultados experimentales demuestran que el grado y la tasa de compartición de fluidos dependen de los materiales y la composición del apósito, lo que indica que hay opciones más y menos óptimas de combinaciones de apósitos primarios y secundarios.
No obstante, la sortividad y los rendimientos de absorción y retención asociados son sólo un aspecto a tener en cuenta a la hora de evaluar la seguridad y la eficacia de los apósitos para heridas mediante pruebas de laboratorio de bioingeniería. La resistencia mecánica de un apósito primario debe ser suficiente para soportar las fuerzas que se producen a lo largo del ciclo de vida del apósito, incluso bajo las fuerzas de extracción que un clínico aplica cuando se retira el apósito. A pesar de estar expuesto al agresivo entorno químico y termodinámico de la herida, un apósito no debe desintegrarse ni dejar restos o partículas en la herida. Cualquier residuo (incluso las micropartículas) que se origine en el apósito primario y se extienda por la superficie de la herida puede iniciar una reacción de cuerpo extraño por la que el sistema inmunitario intenta formar un granuloma (agregación de macrófagos y fibroblastos alrededor de cada partícula para aislarla de los tejidos corporales). Tales acontecimientos consumen valiosos esfuerzos inflamatorios y de reparación tisular, que restan recursos biológicos locales de curación (por ejemplo, el número potencial de células inmunitarias y de fibroblastos que están disponibles para la tarea de reparación tisular).3,10,15,32
Los análisis de imágenes de microscopía no mostraron una preferencia direccional consistente y fuerte de las fibras en el apósito ExAg-PVA, lo que indica una baja preferencia de resistencia direccional en comparación con el Ag-CMC, que sí demostró una fuerte preferencia direccional asociada a su estructura de tejido, específicamente hacia las costuras de refuerzo visibles del apósito. Los resultados de las pruebas de durabilidad fueron consistentes con los hallazgos de la microscopía antes mencionados para la Ag-CMC. En concreto, la Ag-CMC demostró una escasa resistencia mecánica cuando la dirección de las fuerzas de tracción no se alineaba completamente con la de las costuras de refuerzo. Además, las pruebas mecánicas actuales indicaron que la resistencia del apósito de Ag-CMC es proporcionada predominantemente por las costuras de refuerzo visibles y las fibras estrechamente alineadas; esto impone un requisito del mundo real (no presentado por el fabricante) de que un clínico que retire el apósito debe ser consciente de la orientación de las costuras e intentar tirar en esa dirección específica para evitar el desgarro accidental (parcial o completo). Sin embargo, al retirar un apósito primario de la cavidad de la herida, la probabilidad de que un enfermer tire (a ciegas) del apósito en una orientación específica que coincida exactamente con la orientación de la fibra primaria del apósito se aproxima a cero. Además, retirar un apósito en línea con la orientación primaria de sus fibras se hace aún más difícil si el apósito adquiere el mismo color que el exudado mientras está en la herida. Dado que los apósitos suelen estar plegados en la cavidad de la herida y la mayor parte de su estructura es invisible, incluso si un enfermero intentara hipotéticamente tirar del apósito en una dirección específica (para ajustarse a las propiedades óptimas de absorción de energía mecánica hasta el fallo del apósito), entonces, desde una perspectiva de rentabilidad, un apósito que requiere ser retirado en una orientación específica y una atención adicional a ese aspecto se suma a la carga de trabajo clínico. Lo anterior implica que en el mundo real, en escenarios clínicamente relevantes, el Ag-CMC tendría una resistencia de cuatro a seis veces menor (es decir, absorción de energía mecánica hasta el fallo) que la del apósito ExAg-PVA, y el apósito Ag-CMC es, por tanto, mucho más probable que deje restos o partículas en una herida. La probabilidad de que se produzcan estos fallos en el apósito aumenta aún más cuando una herida presenta socavación, está tunelizada o tiene superficies pegajosas o rugosas, todo lo cual puede estar asociado a mayores fuerzas de extracción necesarias para liberar el apósito usado para ser cambiado.
Como en cualquier estudio experimental, existen limitaciones en la capacidad de imitar los procesos in vivo y la gran variedad de escenarios clínicos. En consecuencia, en futuros trabajos, se justifica la realización de experimentos adicionales centrados en heridas típicamente no cargadas, como las úlceras venosas de las piernas. También es necesario probar otros tipos de apósitos y tecnologías de diversos fabricantes e incluir el aspecto de la rentabilidad frente a los parámetros de rendimiento medidos. Otros sensores y análisis posteriores pueden añadirse potencialmente al aparato (y a cada unidad de simulante de herida) o integrarse en la metodología de las pruebas, como la monitorización continua del pH dentro de la herida o la espectrometría de masas de los fluidos residuales tras los períodos de uso del apósito. Se pueden lograr más avances introduciendo sustitutos de exudado que contengan microbiomas específicos que puedan representar diferentes etiologías de heridas, como las lesiones por presión infectadas o las úlceras de pie diabético. Todas estas mejoras futuras requerirían estudios adicionales de validación y fiabilidad antes de informar a la práctica clínica.
Conclusiones
Utilizando un sistema robótico fantasma automático de múltiples heridas de cavidad abierta, los autores evaluaron la absorbencia y la retención y, por tanto, las prestaciones de sortividad de los apósitos de fibra gelificante que contienen plata emparejados con un apósito de espuma secundario. Se comprobó la durabilidad mecánica de los apósitos primarios que contienen plata tras un uso simulado. El sistema y el protocolo experimentales actuales se diseñaron haciendo hincapié en la relevancia clínica de las pruebas de laboratorio de bioingeniería, para reproducir la forma en que se utilizan los apósitos en la práctica y considerar los escenarios del mundo real que pueden estar asociados con su fracaso. En consonancia con el trabajo publicado anteriormente por los autores, se identificaron de nuevo la sortividad y la durabilidad como factores críticos que deben evaluarse al valorar los apósitos para heridas en las pruebas de laboratorio. .3,10,11 Los presentes hallazgos refuerzan aún más que los apósitos para heridas que pertenecen a una determinada categoría de productos, como los apósitos de fibra gelificante que contienen plata, no son todos iguales, y la absorción específica, la retención y, lo que es más importante, la capacidad de trabajar sinérgicamente con un apósito secundario (lo que permite una buena sortividad) difieren entre los productos, dependiendo de los materiales específicos y la composición del apósito.3,10,32,33Los presentes datos experimentales revelaron que el apósito ExAg-PVA tiene mejor sortividad y durabilidad que el producto de comparación Ag-CMC. Además, los autores describieron la dinámica del intercambio de fluidos entre los apósitos primarios y secundarios e identificaron la importancia de no tener una direccionalidad específica de las fibras en un apósito primario para la durabilidad y la seguridad de las retiradas posteriores al uso. La cuantificación comparativa de estas capacidades debería ayudar a los responsables de la toma de decisiones, tanto clínicos como no clínicos, a evaluar y seleccionar los apósitos que mejor se adapten a las necesidades de sus pacientes. Al igual que con cualquier trabajo preclínico, los resultados actuales del laboratorio deben ser validados frente a ensayos controlados aleatorios con tamaños de muestra apropiados de diferentes etiologías de heridas. La función del trabajo de laboratorio que aquí se expone es principalmente la de orientar esa posible investigación clínica para que se centre en los aspectos novedosos del intercambio de fluidos entre los apósitos primarios y secundarios de la herida, así como en la capacidad de los apósitos primarios de permanecer intactos durante su retirada, temas que hasta ahora no se han abordado suficientemente en la literatura.
Agradecimientos
Este proyecto ha recibido financiación del programa de investigación e innovación Horizonte 2020 de la Unión Europea, en el marco de la subvención Marie Skłodowska-Curie, y también ha recibido apoyo parcial del Ministerio de Ciencia y Tecnología de Israel (subvención del Programa de Dispositivos Médicos nº 3-17421, concedida al profesor Amit Gefen en 2020) y de Mölnlycke Health Care (Gotemburgo, Suecia). Los autores agradecen a la Sra. Orel Belo, ingeniera de laboratorio del laboratorio Gefen, el apoyo prestado al trabajo experimental. Los autores no han revelado ninguna otra relación financiera relacionada con este artículo. Presentado el 23 de julio de 2021; aceptado en forma revisada el 1 de noviembre de 2021; publicado en línea antes de su impresión el 14 de marzo de 2022. Copyright Avances en la atención de la piel y heridas y el Consejo Mundial de Terapeutas Enterostomales.
Conflicto de intereses
Los autores declaran no tener conflictos de intereses.
Financiación
Los autores no recibieron financiación por este estudio.
Author(s)
Aleksei Orlov MSc
Graduate Student, Department of Biomedical Engineering, Tel Aviv University, Israel
Adi Lustig MSc
Graduate Student, Department of Biomedical Engineering, Tel Aviv University, Israel
Angela Grigatti MSc
Graduate Student, Department of Biomedical Engineering, Tel Aviv University, Israel
Amit Gefen* PhD
Professor of Biomedical Engineering and the Herbert J Berman Chair in Vascular Bioengineering,
Department of Biomedical Engineering, Tel Aviv University, Israel
At Tel Aviv University, Department of Biomedical Engineering, Tel Aviv, Israel, Aleksei Orlov, MSc; Adi Lustig, MSc; and Angela Grigatti, MSc, are Graduate Students at the research group of Professor Gefen; and Amit Gefen, PhD, is Professor of Biomedical Engineering and the Herbert J. Berman Chair in Vascular Bioengineering.
* Corresponding author
References
- Sen CK. Human wounds and its burden: an updated compendium of estimates. Adv Wound Care 2019;8:39-48.
- Guest JF, Fuller GW, Vowden P. Cohort study evaluating the burden of wounds to the UK’s National Health Service in 2017/2018: update from 2012/2013. BMJ Open 2020;10:e045253.
- Gefen A, Ousey K. Safe and effective wound care during the COVID-19 pandemic. J Wound Care 2020;29:622-3.
- Sen CK. Human wound and its burden: updated 2020 compendium of estimates. Adv Wound Care (New Rochelle) 2021;10:281-92.
- How To Guide: Managing High Exudate Wounds - A Wounds UK Publication. https://www.wounds-uk.com/resources/details/how-to-guide-managing-high-exudate-wounds. Last accessed February 18, 2022.
- Cutting KF. Wound exudate: composition and functions. Br J Community Nurs 2003;8(Supp3):S4-9.
- Schultz GS, Sibbald RG, Falanga V, et al. Wound bed preparation: a systematic approach to wound management. Wound Repair Regen 2003;11(Supp1):S1-28.
- Junker JPE, Kamel RA, Caterson EJ, Eriksson E. Clinical impact upon wound healing and inflammation in moist, wet, and dry environments. Adv Wound Care 2013;2:348-56.
- Woundsource Resource Database. https://www.woundsource.com/product-category/dressings/gelling-fiber-dressings. Last accessed March 11, 2022.
- Lustig A, Alves P, Call E, Santamaria N, Gefen A. The sorptivity and durability of gelling fibre dressings tested in a simulated sacral pressure ulcer system. Int Wound J 2021;18:194-208.
- Gefen A, Santamaria N. Saturation of a dressing applied to an exuding wound: The gap between clinical judgment and laboratory testing. Wounds Int J 2021;12:20-6.
- Lustig A, Gefen A. Fluid management and strength post-simulated use of primary and secondary dressings for treating diabetic foot ulcers: robotic phantom studies. Int Wound J 2022;19:305-15.
- Lustig A, Gefen A. Three-dimensional shape-conformation performances of wound dressings tested in a robotic sacral pressure ulcer phantom. Int Wound J 2021;18:670-80.
- Wood RA. Disintegration of cellulose dressings in open granulating wounds. Br Med J 1976;1:1444-5.
- Chakravarthy D, Rodway N, Schmidt S, Smith D, Evancho M, Sims R. Evaluation of three new hydrocolloid dressings: retention of dressing integrity and biodegradability of absorbent components attenuate inflammation. J Biomed Mater Res 1994;28:1165-73.
- ASTM D412 - 06, Standard Test Methods for Vulcanized Rubber and Thermoplastic Elastomers - Tension, ASTM International, West Conshohocken, PA, 2006, www.astm.org.
- Xu F, Lu TJ. Chapter 3 Skin Biothermomechanics: modeling and experimental characterization. Adv Appl Mech 2009;43:147-248.
- Kuthe CD, Uddanwadiker RV. Investigation of effect of fiber orientation on mechanical behavior of skeletal muscle. J Appl Biomater Funct Mater 2016;14:e154-62.
- Graham HK, McConnell JC, Limbert G, Sherratt MJ. How stiff is skin? Exp Dermatol 2019;28:4-9.
- Friedman R, Haimy A, Epstein Y, Gefen A. Evaluation of helmet and goggle designs by modeling non-penetrating projectile impacts. Comput Methods Biomech Biomed Engin 2019;22:229-42.
- Gefen A, Haberman E. Viscoelastic properties of ovine adipose tissue covering the gluteus muscles. J Biomech Eng 2007;129:924-30.
- Gefen A. Not all superabsorbent wound dressings are born equal: theory and experiments. J Wound Care 2021;30:738-50.
- Dini V, Salvo P, Janowska A, Di Francesco F, Barbini A, Romanelli M. Correlation between wound temperature obtained with an infrared camera and clinical wound bed score in venous leg ulcers. Wounds 2015;27:274-8.
- Barnea Y, Weiss J, Gur E. A review of the applications of the hydrofiber dressing with silver (Aquacel Ag) in wound care. Ther Clin Risk Manag 2010;6:21-7.
- Walker M, Parsons D. Hydrofiber® Technology: its role in exudate management. Wounds UK 2010;6:31-38.
- Hurlow J. AQUACEL® Ag dressing with Hydrofiber® technology. Adv Wound Care (New Rochelle) 2012;1:104-7.
- Rezakhaniha R, Agianniotis A, Schrauwen JT, et al. Experimental investigation of collagen waviness and orientation in the arterial adventitia using confocal laser scanning microscopy. Biomech Model Mechanobiol 2012;11:461-73.
- Schneider CA, Rasband WS, Eliceiri KW. NIH image to ImageJ: 25 years of image analysis. Nat Methods 2012;9:671-5.
- ASTM D882-02, Standard Test Method for Tensile Properties of Thin Plastic Sheeting, ASTM International, West Conshohocken, PA, 2002, www.astm.org.
- Expert working group; Satellite expert working group. Wound exudate and the role of dressings. A consensus document. Int Wound J 2008;5(Suppl 1):iii-12.
- Harding K, Carville K, Chadwick P, et al. World Union of Wound Healing Societies. World Union of Wound Healing Societies (WUWHS) Consensus Document. Wound exudate: effective assessment and management. Wounds Int 2019. https://www.woundsinternational.com/download/resource/7732.
- Grande A, Sivakumaran D. Assessment of the wet strength and log reduction capacity of a silver alginate dressing. 2016 Symp Adv Wound Care (SAWC) April 13-17. 2016:5.
- Gefen A, Santamaria N, Creehan S, Black J. Patient safety may be compromised if study conclusions are generalized to products that make similar claims but have no equivalent research evidence. J Patient Saf Risk Manag 2019;24:37-45.



