Volume 42 Number 4
Risk assessment for pressure injuries
Elizabeth A Ayello and Barbara A Delmore
Keywords pressure injury, risk factors, risk assessment scales
For referencing Ayello EA & Delmore BA. Risk assessment for pressure injuries. WCET® Journal 2022;42(4):31-37
DOI
https://doi.org/10.33235/wcet.42.4.31-37
Submitted 18 November 2022
Accepted 9 December 2022
Abstract
This manuscript highlights commonly used pressure injury (PI) risk assessment instruments (scales) and other considerations that the clinician should contemplate for use in everyday practice to determine if their patient is at risk for a PI.
Introduction
Each year in November, many professional organisations participate in the Stop Pressure Injuries/Ulcers Day. It provides an opportunity to raise awareness about pressure injuries (PIs) to the general public as well as other healthcare professionals. Preventing PIs is an important part of a clinician’s everyday practice. The intent of this article is to provide a succinct summary of some of the commonly used PI risk assessment instruments (scales) as well as other patient characteristics to consider as part of a comprehensive risk assessment process.
Risk Assessment Overview
The purpose of risk assessment is to identify if a person is at risk for a PI and, if so, implement an individualised prevention plan especially considering modifiable and non-modifiable risk factors1. The 2019 International Guideline with implementation recommendations1 provides assistance for clinicians for best practices for individuals at risk for a PI regardless of the care setting. Risk assessment is one of the key components to consider when preventing PIs. It is a systematic process that at minimum includes examination of the person’s skin for any changes, awareness of any devices, including medical and other objects that can cause pressure, assessment of individual patient characteristics that are known to be risk factors, and assessment using a validated/reliable risk assessment instrument (scale) and the clinician’s clinical judgement.
Risk Assessment Instruments
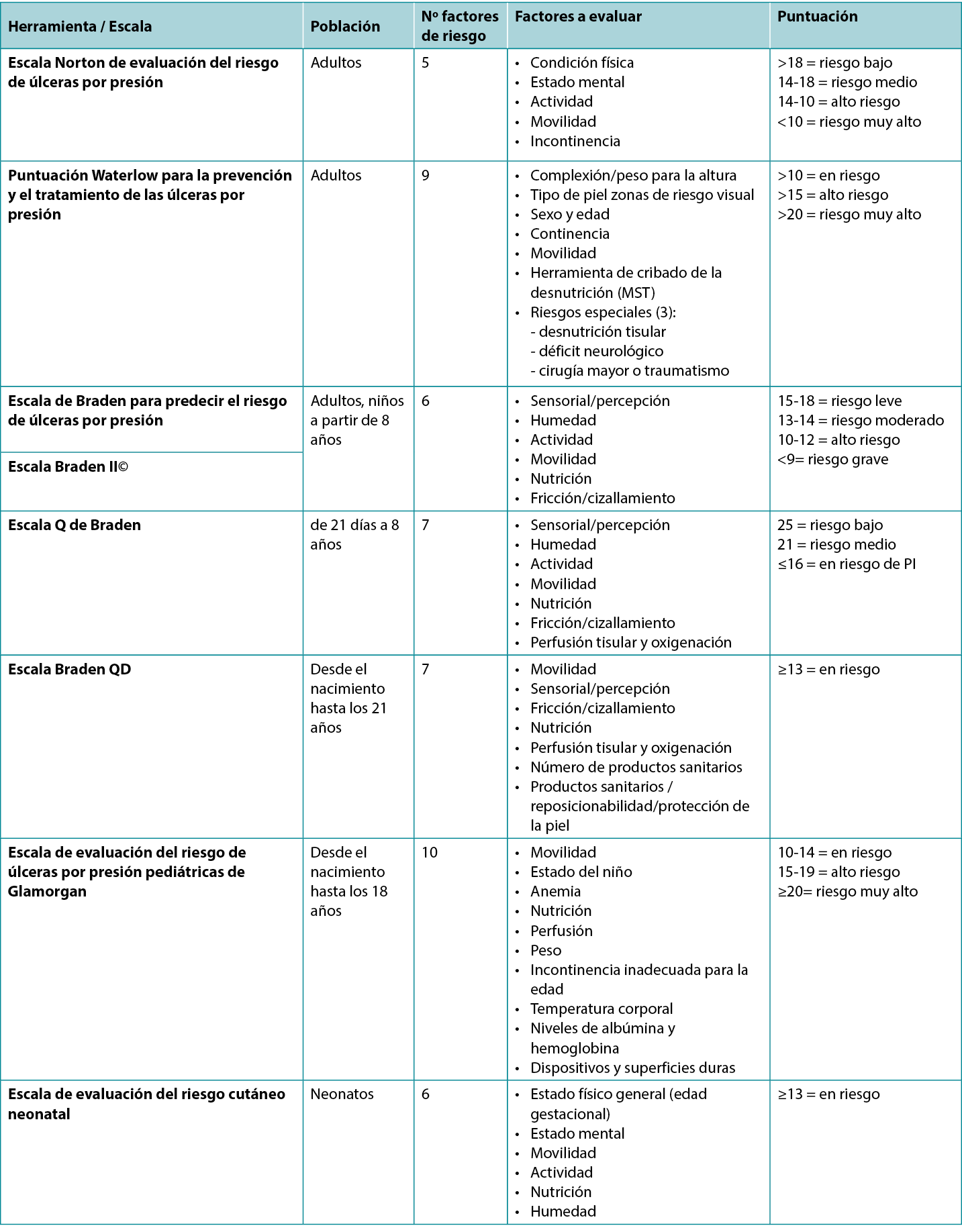
There are several valid and reliable risk assessment instruments (scales) available (Table 1), so it is important to use the one that reflects the age of your population and your practice setting. Some of the risk assessment instruments have a manual of instructions or glossary of terms for their use. The clinician should understand the definition of the terms used in the instrument so that they know how to accurately assess their patient for each of the risk factors outlined in the chosen instrument.
Most practice settings have a specific policy or guidance as to when risk assessments should be performed. The first general practice for performing a risk assessment is upon the person’s admission to a facility, e.g., hospital, long-term care/nursing home, rehabilitation, outpatient setting (e.g., clinics) or homecare assignment. Subsequent risk assessments are based on the clinical setting. For example, in acute care facilities, clinicians perform a risk assessment daily upon transfer to another nursing unit, when the patient’s condition changes, and upon discharge from the facility. In nursing homes or long-term care facilities, clinicians tend to perform risk assessments weekly and upon discharge. In homecare organisations, clinicians tend to perform a risk assessment on every visit, much like outpatient settings. It goes without saying that the clinician should follow the policy of their work setting and accurately evaluate the person according to each risk factor on the instrument. It is important to note that a clinician should also employ their judgment to a person’s PI risk outside of using a risk assessment instrument.
The following section provides a short description of the more commonly used risk assessment instruments.
Adult risk assessment instruments
Norton Pressure Sore Risk-Assessment Scale
Widely acknowledged as the first known scale is the Norton Pressure Sore Risk-Assessment Scale2. It was created in England in 1962 by Doreen Norton. It has five categories (Table 1) to which a number score is assigned based on the descriptor terms. When the numbers are totalled, low risk is determined to be >18, medium risk from 14–18, and lower numbers indicate higher risk, with <10 considered very high risk3.
Waterlow Pressure Ulcer Prevention/Treatment Score
The Waterlow Score was created by Judy Waterlow of the UK in 1985 and was revised in 2005 by Queensland Health4. As seen in Table 1, it has six categories. Additionally, the Malnutrition Screening Tool (MST) is used to assess the person’s nutritional status on this scale. There is also a section entitled ‘Special risks’. The scores are added, with a person being considered at risk when the score is >10, high risk at >15 and very high risk at >20. The back of the scale card has a short summary of prevention strategies as well as the European Pressure Ulcer Advisory Panel (EPUAP) classification definitions; further details can be found at the judy-waterlow.co.uk website5.
Braden Scale for Predicting Pressure Sore Risk
Known by many as the Braden Scale, it was created in the USA by Drs Barbara Braden and Nancy Bergstrom based on a conceptual schema which they published in 19876–8. The Scale has six assessment risk factors – sensory/perception, moisture, activity, mobility, nutrition and friction/shear (Table 1). Several early publications on the validation of the scale were subsequently published8–11. Over the years it has been used around the world and has had much research to validate its use in a variety of skin tones12. Its intended use is for ages 8–100+ years old. A score of 15–18 is considered to be mild risk, 13–14 moderate risk, 10–12 high risk and <9 severe risk.
Braden Scale II©
The Braden Scale for Predicting Pressure Sore Risk was originally published in the late 1980s6–8. Since April 2021, the Braden Scale copyright is now owned by Health Sense Ai and termed the Braden II©13. It has been updated in collaboration with original scale developers, Drs Barbara Braden and Nancy Bergstrom, to the Braden Scale II©. You can apply for copyright permission to use the Braden Scale II© by going to their website (www.bradenscale.com13), completing the licence use forms and paying the fee.
The Braden Scale II© has the same six risk assessment factors as the original Braden Scale – sensory/perception, moisture, activity, mobility, nutrition and friction/shear. Updates to the Braden Scale II© include language to bring the Scale into compliance with currently used taxonomy, like changing pressure sore to pressure injury. In addition, there are updates to the subsection descriptions to facilitate accurate scoring of the instrument among users. There are no changes to the cut scores at which a patient is considered to be at risk, but plan to address in the patient’s plan of care any subscales with higher scores even if the total overall scale score does not indicate the patient is at risk. The Braden Scale II© is available in English, French and Spanish.
To help clinicians score the scale, a glossary of terms has been created and available to use when you obtain copyright use permission. Health Sense AI/HD Nursing also has available several resource materials to help educate clinicians about the Braden Scale II©, including case examples that illustrate how to correctly use the scale13. The Braden Scale II© glossary and training module now make up the Braden Scale II Toolkit© which comes as a package when you licence the Braden Scale II©. This helps ensure staff are trained correctly to use the scale in direct patient care.
Paediatric risk assessment instruments
Braden Q Scale
The Braden Q risk assessment instrument was adapted from the Braden Scale by Curley and colleagues14 and since then has been frequently tested for its reliability and validity15. Its intended use in practice is for paediatric patients aged from 21 days (including corrected to gestational age of 21 days) up to age 8. The instrument includes the same six subscales of the Braden Scale with the addition of a seventh item – tissue perfusion and oxygenation. A score of 25 is considered low risk, 21 is medium risk and 16 or below is considered at risk for a PI (Table 1).
Table 1. Commonly used PI risk assessment instruments (scales) [©Delmore & Ayello 2022]
Braden QD Scale
The Braden QD is one of the newer risk assessment instruments created by Curley and colleagues16 and is based on the Braden Q Scale. Its intended use is for paediatric patients from pre-term ages to 21 years old. It contains five items from the Braden Q (mobility, sensory perception, friction/shear, nutrition, tissue perfusion and oxygenation) plus the addition of number of medical devices and repositionability/skin protection, the latter item specifically addressing medical devices (Table 1). A score of >13 is considered at risk for a PI17.
Glamorgan Paediatric Pressure Ulcer Risk Assessment Scale
This scale was created in the late 2000s as the Glamorgan Paediatric Pressure Ulcer Risk Assessment Scale (Glamorgan Scale) and noted to be the first paediatric risk assessment scale to include devices as one of the risk assessment factors18. Other Scale points address mobility, the child’s condition, anaemia, nutrition, perfusion, weight, incontinence inappropriate for the age, body temperature, albumin and haemoglobin levels, and devices. Any score of 10–14 is considered to be at risk, 15–19 is at high risk, and a score of ≥20 is considered very high risk for a PI.
Neonatal Skin Risk Assessment Scale
This scale was created by Huffines and Logsdon in the late 1990s and was based on the Braden Scale19. It was the first scale tested for reliability and validity for the neonatal population. The neonate is scored based on general physical condition (gestational age), mental state, mobility, activity, nutrition and moisture. A score of ≥13 is considered to be at risk.
Populations at Risk
Older adults
Advanced age (>65 years) is a PI intrinsic risk factor. Much of the risk is from skin changes that occur due to the ageing process such as epidermal thinning and loss of adipose tissue as a protective function. Additionally, disease burden and presence of co-morbidities create PI risk in this population20,21. Assessing risk using a valid and reliable scale is only one component of assessing an older adult’s PI risk. In this case, risk factors should be considered that are not included (e.g., age, disease burden) or reflect the degree of a condition’s severity (e.g., malnutrition)20–22.
Patients with obesity
According to the 2019 International Guideline, patients with obesity are considered a population that requires diligent PI risk assessments23. Obesity is an under recognised complex condition22. The Centers for Disease Control and Prevention (CDC) defines obesity by body mass index (BMI) categories: Class 1, BMI of 30–35kg/m2; Class 2, BMI of 35–40kg/m2; and Class 3, BMI of 40kg/m2 or higher and considered severe24. In this population, PIs occur due to a variety of factors such as malnutrition, diseases and conditions associated with obesity and device-related PIs due to ill-fitting equipment22,23.
Surgical patients
Assessment of the research literature in the 2019 International Guideline supports that the duration of time from when a person is admitted to when they have surgery as well as the length of time they are in surgery may be markers of a patient’s immobility1. Additionally, a person’s American Society of Anesthesiologists (ASA) Physical Status Classification may be a marker of the patient’s clinical status22. All three of these should be considered as risk factors for a person undergoing surgery.
Critical care
Critically ill patients are another special population that should be considered high risk for PI formation and therefore require diligent PI risk assessments23. The reason for this high risk is due to the critical illness of this population, the setting itself, and the abundant presence of medical devices required for treatment25,26. It is paramount to monitor this population closely as the addition of a PI to an already complex situation is considered an additional co-morbidity that can possibly lead to mortality23.
Other Considerations for Risk
Devices and objects
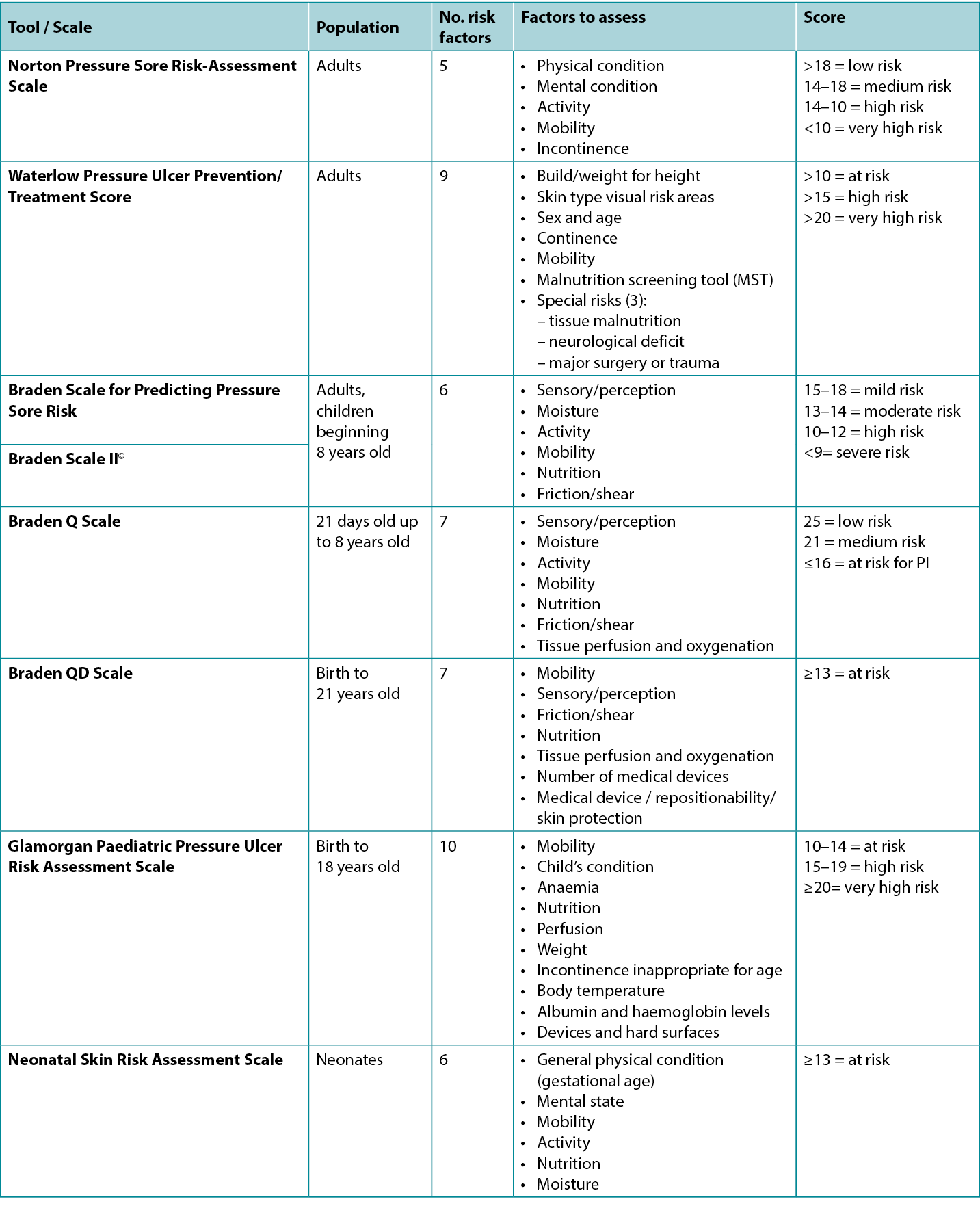
Medical devices and other objects such as eyeglasses and bottle caps can cause PIs27–29. Medical devices are the most frequent aetiology for medical device-related pressure injuries (MDRPI) in neonates and children1,16–18,30 (Figure 1); therefore, consideration for using the Braden QD Scale16 and the Glamorgan Scale18, which both include assessments for medical devices, is warranted.
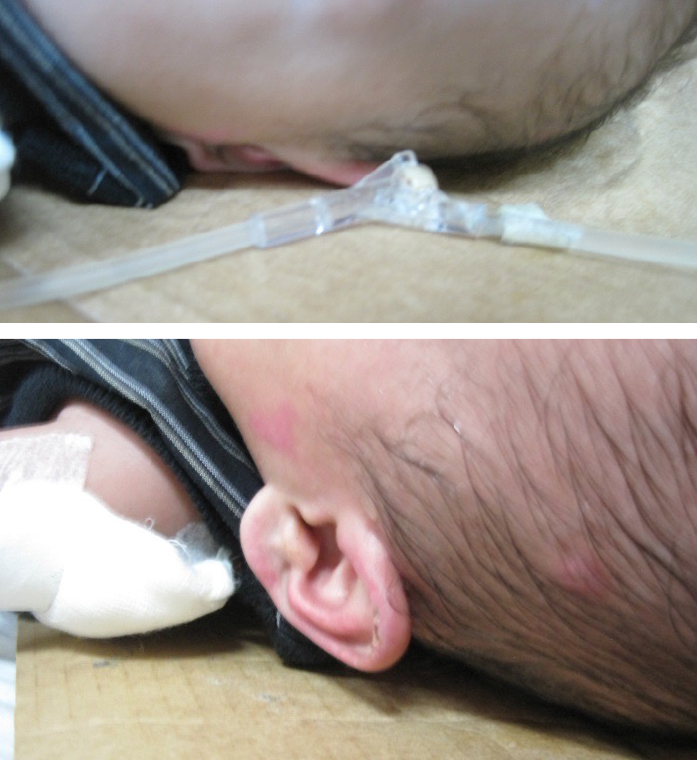
Figure 1. PI that developed from baby lying on IV tubing [©EA Ayello 2015, used with permission]
MDRPI also occur in adults27 (Figure 2). Currently, none of the adult PI risk assessment scales assess for MDRPI even though the 2019 International Guideline does address PI from devices – medical and other sources27. Therefore, raising awareness of devices as an aetiology for device-related PIs in adults is of great importance1,27–29. Consider using the SORE mnemonic to alert staff to medical and other devices that can cause PIs28. Research has supported that MDRPI occur 3 days sooner than other PIs, so staff need to be vigilant in assessing patients who have medical devices29. Remember to keep track of your facility’s MDRPI incidence28. Also, MDRPI on the lip cannot be staged as mucosa, does not keratinise and therefore cannot be staged using the NPIAP staging classification system1,27,28.
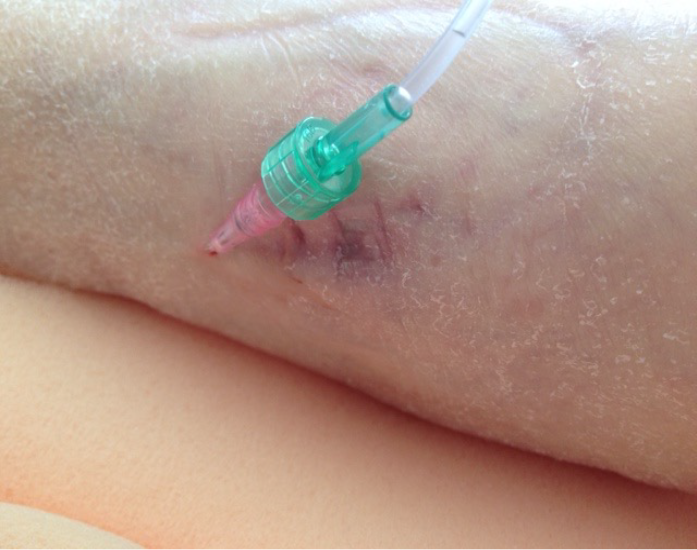
Figure 2. PI as a result of an intravenous (IV) hub that was secured directly to the skin. Notice the imprint on the skin that matches the design of the IV hub [©Delmore 2015, used with permission]
Specific anatomical areas at risk
Heels
Heels are believed to be the second most common anatomical site for PIs31. Due to the anatomy of the heel and limited tissue by the calcaneus, the heel is a particularly vulnerable to risk of a PI31–36 (Figure 3). Two research studies32,33 have provided evidence that patient co-morbidities, specifically diabetes mellitus and vascular disease along with immobility, are risk factors for developing heel PIs and should be considered with assessing a person’s risk for heel PIs along with a validated risk assessment instrument32–34.
Figure 3. Deep tissue pressure injury (DTPI) of the right heel. Unlike Stage 1 PIs that are intact and a lighter red/pink, DTPIs are intact but have a deeper discolouration indicating a deeper level of damage. These full-thickness PIs often evolve to a Stage 3 or 4, or an unstageable PI [©B Delmore & EA Ayello, 2020, used with permission]
In the main analysis (n=337) in one hospital, the predictor variables for heel PIs were diabetes, vascular disease, immobility and Braden Scale <1832. The study was expanded to other hospitals by using data from the New York State Statewide planning and Research Cooperative system (SPARCS)33. The main analysis had 1,697 patients (323 patients who had heel PIs and 1,374 who did not). There were seven significant and independent predictors – diabetes, vascular disease, perfusion issues, impaired nutrition, age >65 years, mechanical ventilation and surgery. Based in part from these two studies, the authors concluded that patient comorbidities, in this instance both diabetes and vascular disease, should be considered as risk factors along with results of formal risk assessment instruments33. Clinicians may find our heels algorithm helpful in their practice34 (Figure 4).
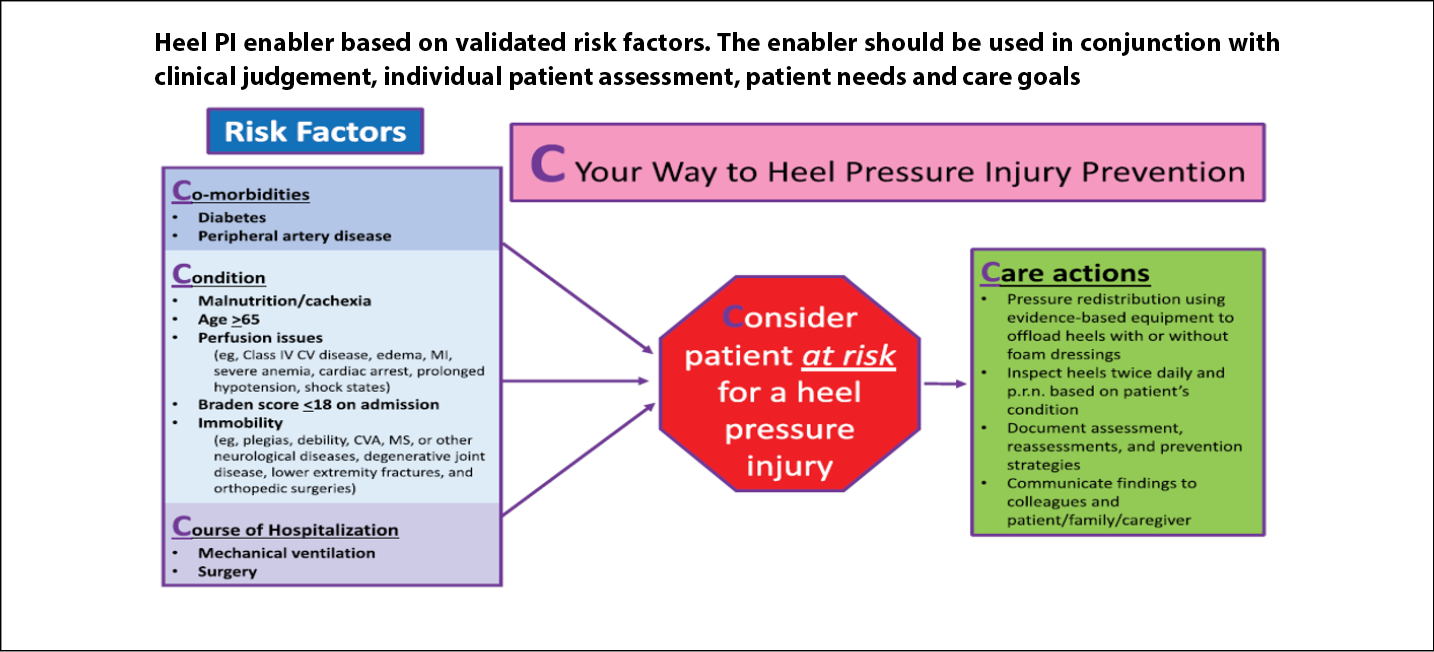
Figure 4. Heel pressure injury algorithm [©Delmore, Ayello & Smart 2020, used with permission]32–34
CV – cardiovascular; CVA – cerebrovascular accident; MI – myocardial infarction; MS – multiple sclerosis
Foot position may also be a risk factor. In another study of 10 healthy male volunteers, there was more strain on the heel tissue when the foot was in external rotation rather than upright (90°)36. Our recent clinical practice point may be helpful to clinicians as to proper foot positioning to help prevent heel PIs34.
Sacrum/coccygeal/ischial tuberosities
The sacrum is the most common anatomical site for PIs. Some research suggests that a patient’s skeletal morphology may be an intrinsic non-modifiable risk for Pl. The work of Gefen37 provides knowledge about changes in persons with spinal cord injury that increase risk for PI. This includes skeletal muscle atrophy, fat infiltration into muscles, bone shape loss leading to flattening of the tips of the ischial tuberosities and thinning of the skin around the ischial tuberositites37.
A recent retrospective case-control study by Delmore and colleagues compared the skeletal sacrococcygeal region of 15 patients with full-thickness PIs to 15 patients without full-thickness PIs using MRIs38. The premise of this study was to determine if the skeletal sacrococcygeal region may act as a possible intrinsic PI risk factor. Findings revealed that patients with full-thickness PIs did have different morphology and morphometry, resembling patients with other conditions. This study also noted that PIs in this region were more located in the coccyx region.
Risk Assessment Instruments and Technology
There is some growing debate in the literature about use of risk assessment scales as they may not capture all important risk factors, so do think about patient comorbidities that may not be captured on a risk assessment scale. There is research to study identification of additional risk factors and/or early indicators for PI including skin temperature39,40 as well as subdermal moisture and imaging41–43. It will be interesting to see how various technologies will reduce cost43. The future of PI risk assessment may include a systematic risk assessment including a valid and reliability scale, patient characteristics such as comorbidities, and technology that will impact on reducing PI incidence.
Conclusion and summary
There are several valid and reliable PI risk assessment scales available for use in practice. Although research continues to provide evidence as to which are the best in terms of predictive ability, identification of patient co-morbidities as well as technology may be additional data to help clinicians identify persons at risk for PIs. It is most important to remember that PI assessment is a process with the care goal of implementing a care plan in a timely manner to prevent avoidable PI44 from occurring.
Conflict of Interest
Dr Ayello was a member of the small working group on medical device-related pressure injuries for the 2019 EPUAP/NPIAP/PPPIA Prevention and treatment of pressure ulcers/injuries1. Dr Delmore is a Board Member of the National Pressure Injury Advisory Panel and is on the Editorial Board for Advances in Skin and Wound Care. She was a member of a small working group on heel pressure injuries for the 2019 EPUAP/NPIAP/PPPIA Prevention and treatment of pressure ulcers/injuries1.
Funding
The authors received no funding for this study.
Evaluación del riesgo de lesiones por presión
Elizabeth A Ayello and Barbara A Delmore
DOI: https://doi.org/10.33235/wcet.42.4.31-37
Resumen
En este manuscrito se destacan los instrumentos (escalas) de evaluación del riesgo de lesiones por presión (PI) utilizados habitualmente y otras consideraciones que el clínico debe contemplar para su uso en la práctic a diaria a fin de determinar si su paciente corre el riesgo de sufrir una PI.
Introducción
Cada año, en noviembre, muchas organizaciones profesionales participan en el Día Stop a las Lesiones por Presión/Ulceras. Ofrece la oportunidad de sensibilizar al público en general y a otros profesionales sanitarios sobre las lesiones por presión (PI). La prevención de las PI es una parte importante de la práctica diaria de los médicos. La intención de este artículo es ofrecer un resumen sucinto de algunos de los instrumentos (escalas) de evaluación del riesgo de PI utilizados habitualmente, así como de otras características de los pacientes que deben tenerse en cuenta como parte de un proceso integral de evaluación del riesgo.
Visión general de la evaluación de riesgos
El objetivo de la evaluación de riesgos es determinar si una persona corre el riesgo de sufrir una PI y, en caso afirmativo, aplicar un plan de prevención individualizado teniendo especialmente en cuenta los factores de riesgo modificables y no modificables1. La Guía Internacional 2019 con recomendaciones de implementación1 proporciona ayuda a los clínicos para las mejores prácticas para individuos en riesgo de una PI independientemente del entorno asistencial. La evaluación de riesgos es uno de los componentes clave que hay que tener en cuenta a la hora de prevenir las PI. Se trata de un proceso sistemático que, como mínimo, incluye el examen de la piel de la persona para detectar cualquier cambio, el conocimiento de cualquier dispositivo, incluidos los objetos médicos y de otro tipo que puedan causar presión, la evaluación de las características individuales del paciente que se sabe que son factores de riesgo y la evaluación mediante un instrumento (escala) de evaluación de riesgos validado/ fiable y el juicio clínico del profesional sanitario.
Instrumentos de evaluación de riesgos
Existen varios instrumentos (escalas) de evaluación del riesgo válidos y fiables (Tabla 1), por lo que es importante utilizar el que refleje la edad de su población y el entorno de su consulta. Algunos de los instrumentos de evaluación de riesgos cuentan con un manual de instrucciones o un glosario de términos para su uso. El clínico debe comprender la definición de los términos utilizados en el instrumento para saber cómo evaluar con precisión a su paciente en relación con cada uno de los factores de riesgo descritos en el instrumento elegido.
La mayoría de los centros tienen una política u orientación específica sobre cuándo deben realizarse las evaluaciones de riesgos. La primera práctica general para realizar una evaluación de riesgos es en el momento del ingreso de la persona en un centro, por ejemplo, un hospital, una residencia de ancianos/cuidados de larga duración, un centro de rehabilitación, un centro ambulatorio (por ejemplo, clínicas) o un centro de atención domiciliaria. Las evaluaciones de riesgo posteriores se basan en el entorno clínico. Por ejemplo, en los centros de cuidados intensivos, los clínicos realizan una evaluación de riesgos diaria al trasladar al paciente a otra unidad de enfermería, cuando cambia su estado y al darle el alta. En las residencias de ancianos o centros de cuidados de larga duración, los médicos suelen realizar evaluaciones de riesgos semanales y de altas. En las organizaciones de atención domiciliaria, los médicos tienden a realizar una evaluación de riesgos en cada visita, de forma muy parecida a los entornos ambulatorios. Huelga decir que el clínico debe seguir la política de su entorno laboral y evaluar con precisión a la persona según cada factor de riesgo del instrumento. Es importante señalar que un clínico también debe emplear su criterio para evaluar el riesgo de PI de una persona al margen de utilizar un instrumento de evaluación de riesgos.
A continuación se describen brevemente los instrumentos de evaluación de riesgos más utilizados.
Instrumentos de evaluación de riesgos para adultos
Escala Norton de evaluación del riesgo de úlceras por presión
Ampliamente reconocida como la primera escala conocida es la Escala de Evaluación del Riesgo de Úlceras por Presión de Norton2. Fue creada en Inglaterra en 1962 por Doreen Norton. Tiene cinco categorías (Tabla 1) a las que se asigna una puntuación numérica basada en los términos descriptores. Cuando se suman los números, se determina que el riesgo bajo es >18, el riesgo medio de 14-18, y los números más bajos indican mayor riesgo, considerándose <10 un riesgo muy alto3.
Puntuación Waterlow para la prevención y el tratamiento de las úlceras por presión
La puntuación de Waterlow fue creada por Judy Waterlow del Reino Unido en 1985 y fue revisada en 2005 por Queensland Health4. Como se ve en el Cuadro 1, tiene seis categorías. Además, se utiliza la Herramienta de Cribado de la Malnutrición (MST) para evaluar el estado nutricional de la persona en esta escala. También hay una sección titulada "Riesgos especiales". Las puntuaciones se suman, y se considera que una persona está en riesgo cuando la puntuación es >10, en alto riesgo cuando es >15 y en muy alto riesgo cuando es >20. En el reverso de la tarjeta de la escala figura un breve resumen de las estrategias de prevención, así como las definiciones de la clasificación del Panel Consultivo Europeo sobre Úlceras por Presión (EPUAP); en el sitio web judy-waterlow.co.uk se pueden encontrar más detalles5.
Escala de Braden para predecir el riesgo de úlceras por presión
Conocida por muchos como la Escala Braden, fue creada en Estados Unidos por las doctoras Barbara Braden y Nancy Bergstrom a partir de un esquema conceptual que publicaron en 19876-8. La Escala tiene seis factores de riesgo de evaluación: sensorial/percepción, humedad, actividad, movilidad, nutrición y fricción/cizallamiento (Tabla 1). Posteriormente se publicaron varias publicaciones sobre la validación de la escala8-11. A lo largo de los años se ha utilizado en todo el mundo y se han realizado numerosas investigaciones para validar su uso en diversos tonos de piel12. Su uso previsto es para edades comprendidas entre los 8 y los 100 años. Una puntuación de 15-18 se considera riesgo leve, 13-14 riesgo moderado, 10-12 riesgo alto y <9 riesgo grave.
Escala Braden II©
La escala Braden para predecir el riesgo de úlceras por presión se publicó originalmente a finales de los años ochenta6-8. Desde abril de 2021, los derechos de autor de la escala Braden pertenecen a Health Sense Ai y se denominan Braden II©13. Se ha actualizado en colaboración con las creadoras originales de la escala, las doctoras Barbara Braden y Nancy Bergstrom, a la Escala Braden II©. Puede solicitar permiso de copyright para utilizar la Escala Braden II© accediendo a su página web(www.bradenscale.com13), rellenando los formularios de licencia de uso y pagando la tasa.
La Escala Braden II© tiene los mismos seis factores de evaluación del riesgo que la Escala Braden original: sensorial/percepción, humedad, actividad, movilidad, nutrición y fricción/corte. Las actualizaciones de la Escala Braden II© incluyen lenguaje para adaptar la escala a la taxonomía utilizada actualmente, como el cambio de úlceras por presión a lesiones por presión. Además, se han actualizado las descripciones de las subsecciones para facilitar la puntuación precisa del instrumento entre los usuarios. No hay cambios en las puntuaciones de corte a partir de las cuales se considera que un paciente está en situación de riesgo, pero aborda en el plan de cuidados del paciente las subescalas con puntuaciones más altas aunque la puntuación total de la escala no indique que el paciente está en situación de riesgo. La Escala Braden II© está disponible en inglés, francés y español.
Para ayudar a los clínicos a puntuar la escala, se ha creado un glosario de términos que podrá utilizar cuando obtenga el permiso de uso de los derechos de autor. Health Sense AI/HD Nursing también dispone de varios materiales de recursos para ayudar a educar a los clínicos sobre la Escala Braden II©, incluyendo ejemplos de casos que ilustran cómo utilizar correctamente la escala13. El glosario y el módulo de formación de la Escala Braden II© forman ahora el Kit de herramientas de la Escala Braden II©, que se entrega como un paquete al obtener la licencia de la Escala Braden II©. Esto ayuda a garantizar que el personal esté correctamente formado para utilizar la escala en la atención directa al paciente.
Instrumentos pediátricos de evaluación de riesgos
Escala Q de Braden
El instrumento de evaluación del riesgo Braden Q fue adaptado de la Escala Braden por Curley y colaboradores14 y desde entonces se ha comprobado con frecuencia su fiabilidad y validez15. Su uso previsto en la práctica es para pacientes pediátricos de edades comprendidas entre los 21 días (incluida la edad gestacional corregida de 21 días) y los 8 años. El instrumento incluye las mismas seis subescalas de la Escala Braden con la adición de un séptimo ítem: perfusión y oxigenación tisular. Una puntuación de 25 se considera de bajo riesgo, 21 de riesgo medio y 16 o menos se considera de riesgo para una PI (Tabla 1).
Tabla 1. Instrumentos (escalas) de evaluación del riesgo de PI utilizados habitualmente [©Delmore & Ayello 2022]
Escala Braden QD
El Braden QD es uno de los instrumentos de evaluación de riesgos más recientes creado por Curley y colegas16 y se basa en la Escala Q de Braden. Su uso previsto es para pacientes pediátricos desde edades prematuras hasta los 21 años. Contiene cinco ítems de la Q de Braden (movilidad, percepción sensorial, fricción/cizallamiento, nutrición, perfusión tisular y oxigenación) más la adición del número de dispositivos médicos y reposicionabilidad/protección de la piel, este último ítem se refiere específicamente a los dispositivos médicos (Tabla 1). Una puntuación >13 se considera de riesgo para un PI17.
Escala de evaluación del riesgo de úlceras por presión pediátricas de Glamorgan
Esta escala se creó a finales de la década de 2000 con el nombre de Escala de Evaluación del Riesgo de Úlceras por Presión Pediátricas de Glamorgan (Escala de Glamorgan) y destaca por ser la primera escala de evaluación del riesgo pediátrico que incluye los dispositivos como uno de los factores de evaluación del riesgo18. Otros puntos de la Escala abordan la movilidad, el estado del niño, la anemia, la nutrición, la perfusión, el peso, la incontinencia inadecuada para la edad, la temperatura corporal, los niveles de albúmina y hemoglobina y los dispositivos. Cualquier puntuación de 10-14 se considera de riesgo, de 15-19 de alto riesgo y una puntuación ≥20 se considera de muy alto riesgo para una PI.
Escala de evaluación del riesgo cutáneo neonatal
Esta escala fue creada por Huffines y Logsdon a finales de la década de 1990 y se basó en la escala Braden19. Fue la primera escala cuya fiabilidad y validez se probó en la población neonatal. Se puntúa al neonato en función de su estado físico general (edad gestacional), estado mental, movilidad, actividad, nutrición y humedad. Una puntuación ≥13 se considera de riesgo.
Poblaciones de riesgo
Adultos mayores
La edad avanzada (>65 años) es un factor de riesgo intrínseco de las PI. Gran parte del riesgo procede de los cambios cutáneos que se producen debido al proceso de envejecimiento, como el adelgazamiento epidérmico y la pérdida de tejido adiposo como función protectora. Además, la carga de enfermedad y la presencia de comorbilidades crean riesgo de PI en esta población20,21. La evaluación del riesgo mediante una escala válida y fiable es sólo uno de los componentes de la evaluación del riesgo de PI de un adulto mayor. En este caso, deben tenerse en cuenta factores de riesgo no incluidos (por ejemplo, la edad, la carga de morbilidad) o que reflejen el grado de gravedad de una afección (por ejemplo, la desnutrición)20-22.
Pacientes con obesidad
Según la Guía Internacional de 2019, los pacientes con obesidad se consideran una población que requiere evaluaciones diligentes del riesgo de PI23. La obesidad es una enfermedad compleja poco reconocida22. Los Centros para el Control y la Prevención de Enfermedades (CDC) definen la obesidad por categorías de índice de masa corporal (IMC): Clase 1, IMC de 30-35kg/m2; Clase 2, IMC de 35-40kg/m2; y Clase 3, IMC de 40kg/m2 o superior y considerado grave24. En esta población, las PI se producen debido a diversos factores, como la malnutrición, las enfermedades y afecciones asociadas a la obesidad y las PI relacionadas con dispositivos debidas a equipos mal ajustados22,23.
Pacientes quirúrgicos
La evaluación de la literatura de investigación en la Guía Internacional de 2019 apoya que la duración del tiempo desde que una persona ingresa hasta que se somete a cirugía, así como el tiempo que permanece en cirugía, pueden ser marcadores de la inmovilidad de un paciente1. Además, la Clasificación del Estado Físico de la Sociedad Americana de Anestesiólogos (ASA) de una persona puede ser un marcador del estado clínico del paciente22. Los tres deben considerarse factores de riesgo para una persona que se somete a una intervención quirúrgica.
Cuidados críticos
Los pacientes en estado crítico son otra población especial que debe considerarse de alto riesgo para la formación de PI y, por lo tanto, requieren evaluaciones diligentes del riesgo de IP23. La razón de este alto riesgo se debe a la enfermedad crítica de esta población, al propio entorno y a la abundante presencia de dispositivos médicos necesarios para el tratamiento25,26. Es primordial vigilar de cerca a esta población, ya que la adición de una PI a una situación ya de por sí compleja se considera una comorbilidad adicional que puede conducir a la mortalidad23.
Otras consideraciones sobre el riesgo
Dispositivos y objetos
Los productos sanitarios y otros objetos como gafas y tapones de botellas pueden causar PI27-29. Los dispositivos médicos son la etiología más frecuente de las lesiones por presión relacionadas con dispositivos médicos (MDRPI) en neonatos y niños1,16-18,30 (Figura 1); por lo tanto, está justificado considerar el uso de la Escala QD de Braden16 y la Escala de Glamorgan18, que incluyen evaluaciones para dispositivos médicos.

Figura 1. PI que se desarrolló a partir de un bebé acostado sobre un tubo intravenoso [©EA Ayello 2015, usado con permiso]
La MDRPI también se da en adultos27 (Figura 2). En la actualidad, ninguna de las escalas de evaluación del riesgo de PI en adultos evalúa la MDRPI, aunque las Directrices Internacionales de 2019 sí abordan la PI procedente de dispositivos médicos y de otras fuentes27. Por lo tanto, la concienciación sobre los dispositivos como etiología de las PI relacionadas con dispositivos en adultos es de gran importancia1,27-29. Considere la posibilidad de utilizar la nemotecnia SORE para alertar al personal sobre los dispositivos médicos y de otro tipo que pueden causar IP28. Las investigaciones han demostrado que la MDRPI se produce 3 días antes que otras PI, por lo que el personal debe estar alerta a la hora de evaluar a los pacientes portadores de dispositivos médicos29. Recuerde llevar un registro de la incidencia MDRPI28 de su instalación. Además, la MDRPI en el labio no puede estadificarse como mucosa, no se queratiniza y, por lo tanto, no puede estadificarse utilizando el sistema de clasificación por estadios NPIAP1,27,28.

Figura 2. PI como resultado de un conector intravenoso (IV) que se fijó directamente a la piel. Observa la huella en la piel que coincide con el diseño del conector intravenoso [©Delmore 2015, usado con permiso]
Zonas anatómicas específicas de riesgo
Talones
Se cree que los talones son el segundo lugar anatómico más común para las PI31. Debido a la anatomía del talón y al tejido limitado por el calcáneo, el talón es una zona especialmente vulnerable al riesgo de una PI31-36 (figura 3). Dos estudios de investigación32,33 han aportado evidencias de que las comorbilidades del paciente, en concreto la diabetes mellitus y la enfermedad vascular junto con la inmovilidad, son factores de riesgo para desarrollar PI del talón y deben tenerse en cuenta al evaluar el riesgo de una persona de sufrir PI del talón junto con un instrumento validado de evaluación del riesgo32-34.

Figura 3. Lesiones por presión tisular profunda (DTPI) del talón derecho. A diferencia de las PI de estadio 1, que están intactas y son de color rojo/rosa más claro, las DTPI están intactas, pero presentan una decoloración más profunda que indica un nivel de daño más profundo. Estas PI de espesor total a menudo evolucionan a un estadio 3 o 4, o a una PI no estadificable [©B Delmore & EA Ayello, 2020, utilizado con permiso]
En el análisis principal (n=337) en un hospital, las variables predictoras de las PI de talón fueron la diabetes, la enfermedad vascular, la inmovilidad y la escala de Braden <1832. El estudio se amplió a otros hospitales utilizando datos del sistema cooperativo de planificación e investigación del Estado de Nueva York (SPARCS)33. El análisis principal contó con 1.697 pacientes (323 pacientes que habían tenido PI de talón y 1.374 que no). Hubo siete predictores significativos e independientes: diabetes, enfermedad vascular, problemas de perfusión, nutrición deficiente, edad >65 años, ventilación mecánica y cirugía. Basándose en parte en estos dos estudios, los autores concluyeron que las comorbilidades del paciente, en este caso tanto la diabetes como la enfermedad vascular, deben considerarse factores de riesgo junto con los resultados de los instrumentos formales de evaluación del riesgo33. Los clínicos pueden encontrar útil nuestro algoritmo de talones en su práctica34 (Figura 4).

Figura 4. Algoritmo de lesiones por presión en el talón [©Delmore, Ayello & Smart 2020, utilizado con autorización]32-34
CV: cardiovascular; CVA: accidente cerebrovascular; MI: infarto de miocardio; MS: esclerosis múltiple
La posición de los pies también puede ser un factor de riesgo. En otro estudio realizado con 10 voluntarios varones sanos, se observó una mayor tensión en el tejido del talón cuando el pie estaba en rotación externa en lugar de en posición vertical (90°)36. Nuestro reciente punto de práctica clínica puede ser útil para los clínicos en cuanto a la posición adecuada del pie para ayudar a prevenir las PI del talón34.
Tuberosidades sacro/coccígeas/isquiáticas
El sacro es el lugar anatómico más frecuente de las PI. Algunas investigaciones sugieren que la morfología esquelética de un paciente puede ser un riesgo intrínseco no modificable de Pl. El trabajo de Gefen37 aporta conocimientos sobre los cambios en las personas con lesión medular que aumentan el riesgo de PI. Esto incluye atrofia del músculo esquelético, infiltración de grasa en los músculos, pérdida de la forma ósea que conduce al aplanamiento de las puntas de las tuberosidades isquiáticas y adelgazamiento de la piel alrededor de las tuberosidades isquiáticas37.
Un reciente estudio retrospectivo de casos y controles realizado por Delmore y sus colegas comparó la región sacrococcígea esquelética de 15 pacientes con PI de espesor total con la de 15 pacientes sin PI de espesor total mediante MRI38. La premisa de este estudio era determinar si la región sacrococcígea esquelética puede actuar como posible factor de riesgo intrínseco de PI. Los resultados revelaron que los pacientes con PI de espesor completo presentaban una morfología y morfometría diferentes, parecidas a las de los pacientes con otras afecciones. En este estudio también se observó que las PI de esta región estaban más localizados en la región del coxis.
Instrumentos y tecnología de evaluación de riesgos
Existe un debate creciente en la literatura sobre el uso de las escalas de evaluación de riesgos, ya que pueden no captar todos los factores de riesgo importantes, por lo que hay que pensar en las comorbilidades del paciente que pueden no estar recogidas en una escala de evaluación de riesgos. Existen investigaciones para estudiar la identificación de factores de riesgo adicionales y/o indicadores precoces de las PI, incluida la temperatura de la piel39,40, así como la humedad subdérmica y la obtención de imágenes41-43. Será interesante ver cómo las distintas tecnologías reducirán los costes43. El futuro de la evaluación del riesgo de PI puede incluir una evaluación sistemática del riesgo que incluya una escala válida y fiable, características de los pacientes como las comorbilidades y tecnología que repercuta en la reducción de la incidencia de PI.
Conclusión y resumen
Existen varias escalas de evaluación del riesgo de PI válidas y fiables que pueden utilizarse en la práctica. Aunque la investigación sigue aportando evidencias sobre cuáles son los mejores en términos de capacidad predictiva, la identificación de las comorbilidades del paciente, así como la tecnología, pueden ser datos adicionales que ayuden a los clínicos a identificar a las personas con riesgo de PI. Lo más importante es recordar que la evaluación de las PI son un proceso cuyo objetivo es aplicar un plan de cuidados a tiempo para evitar que se produzca una PI44 evitable.
Conflicto de intereses
El Dr. Ayello fue miembro del pequeño grupo de trabajo sobre lesiones por presión relacionadas con dispositivos médicos para la EPUAP/NPIAP/PPPIA de 2019 Prevención y tratamiento de úlceras/lesiones por presión1. El Dr. Delmore es miembro de la Junta del Grupo Consultivo Nacional sobre Lesiones por Presión y forma parte del Consejo Editorial de Avances en el cuidado de la piel y las heridas. Fue miembro de un pequeño grupo de trabajo sobre lesiones por presión en el talón para la EPUAP/NPIAP/PPPIA de 2019 Prevención y tratamiento de las úlceras/lesiones por presión1.
Financiación
Los autores no recibieron financiación para este estudio.
Author(s)
Elizabeth A Ayello*
PhD, RN, CWON, MAPWCA, FAAN
Co-Editor in Chief, Advances in Skin and Wound Care
Executive Editor Emeritus, WCET® Journal
New York, NY, USA
Barbara A Delmore
PhD, RN, CWCN, MAPWCA, IIWCC-NYU, FAAN
Senior Nurse Scientist, Center for Innovations in the Advancement of Care (CIAC), NYU Langone Health, New York, NY, USA
Clinical Assistant Professor, Hansjörg Wyss Department of Plastic Surgery, NYU Grossman School of Medicine, New York, NY, USA
* Corresponding author
References
- European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel and Pan Pacific Pressure Injury Alliance (EPUAP/NPIAP/PPPIA). Prevention and treatment of pressure ulcers/injuries: clinical practice guideline. The international guideline. Emily Haesler, editor. Perth, WA: Cambridge Media; 2019.
- Norton D, et al. An investigation of geriatric nursing problems in hospital. London, UK: National Corporation for the Care of Old People; 1962.
- Royal Commission into Aged Care Quality and Safety. The Norton Pressure Sore Risk-Assessment Scale Scoring System; n.d. Available from: https://agedcare.royalcommission.gov.au/system/files/2020-06/RCD.9999.0096.0460.pdf
- Waterlow J. Pressure sores: a risk assessment card. Nurs Times 1985;81(48):49–55.
- judy-waterlow.co.uk. The Waterlow Score; 2007. Available from: http://www.judy-waterlow.co.uk/waterlow_score.htm
- Braden B, Bergstrom N, Laguzza V, Homan A. The Braden Scale for Predicting Pressure Sore Risk. Nurs Res 1987;36(4):205–10.
- Braden B, Bergstrom N. A conceptual schema for the study of the etiology of pressure sores scale. Rehab Nurs 1987;12(1):8–12, 16.
- Bergstrom, N, Demuth PJ, Braden BJ. A clinical trial of the Braden Scale for Predicting Pressure Sore Risk. Nurs Clin North Am 1987;22:417–28.
- Bergstrom N, Braden B, Kemp M, Champagne M, Ruby E. Predicting pressure ulcer risk: a multisite study of the predictive validity of the Braden Scale. Nurs Res 1998;47(5):261–269. doi:10.1097/00006199-199809000-00005
- Braden B, Bergstrom N. Predictive validity of the Braden Scale for pressure sore risk in a nursing home population. Res Nurse Health 1994;17:459–70.
- Bergstrom N, Braden B. A prospective study of pressure sore risk among institutionalized elderly. J Am Geriatr Soc 1992;40:742–58.
- Lyder CH, et al. The Braden Scale for pressure ulcer risk: evaluating the predictive validity in Black and Latino/Hispanic elders. App Nurs Res 1999;12(2):60–8.
- Braden Scale II© Predicting Pressure Injuries. Available from: http://www.bradenscale.com.
- Curley MAQ, et al. Predicting pressure ulcer risk in pediatric patients: the Braden Q Scale. Nurs Res 2003;52(1):22–31.
- Noonan C, Quigley S, Curley MAQ. Using the Braden Q Scale to predict pressure ulcer risk in pediatric patients. J Pediatr Nurs 2011;26:566–75.
- Curley MAQ, Hasbani NR, Quigley SM, et al. Predicting pressure injury risk in pediatric patients: the Braden QD Scale. J Pediatr 2018;192:189–195.
- Chamblee TB, Pasek TA, Caillouette CN, et al. How to predict pediatric pressure injury risk with the Braden QD Scale. Am J Nurs 2018;118(11):34–43.
- Willock J, Baharestani MM, Anthony D. The development of the Glamorgan paediatric pressure ulcer risk assessment scale. J Wound Care 2009;18(1):17–21. Available from: http://www.ncbi.nlm.nih.gov/pubmed/19131913
- Huffines B, Logsdon MC. The Neonatal Skin Risk Assessment Scale for predicting skin breakdown in neonates. Issues Compr Pediatr Nurs 1997;20(2):103–114. doi:10.3109/01460869709026881
- European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel and Pan Pacific Pressure Injury Alliance (EPUAP/NPIAP/PPPIA). Chapter 4: Risk factors and risk assessment. In: Haesler E, editor. Prevention and treatment of pressure ulcers/injuries: clinical practice guideline. The international guideline. Perth, WA: Cambridge Media; 2019. p. 38–72.
- Jaul E, Barron J, Rosenzweig JP, Menczel J. An overview of co-morbidities and the development of pressure ulcers among older adults. BMC Geriatr 2018;18(305):1–11. doi:10.1186/s12877-018-0997-7
- Munoz N, Litchford M, Cox J, Nelson JL, Nie AM, Delmore B. National Pressure Injury Advisory Panel White Paper malnutrition and pressure injury risk in vulnerable populations: application of 2019 International Clinical Practice Guideline. Adv Skin Wound Care 2022;35(March):156–165. doi:10.1097/01.ASW.0000816332.60024.05
- European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel and Pan Pacific Pressure Injury Alliance (EPUAP/NPIAP/PPPIA). Chapter 3: Populations with specific pressure injury related needs. In: Haesler E, editor. Prevention and treatment of pressure ulcers/injuries: clinical practice guideline. The international guideline. Perth, WA: Cambridge Media; 2019. p. 28–37.
- Centers for Disease Control and Prevention. Defining adult overweight and obesity; 2021 [cited 2022 Nov 23]. Available from: https://www.cdc.gov/obesity/adult/defining.html
- Cox J. Pressure injury risk factors in adult critical care patients: a review of the literature. Ostomy Wound Manag 2017;63(11):30–43.
- Alderden J, Rondinelli J, Pepper G, Cummins M, Whitney JA. Risk factors for pressure injuries among critical care patients: a systematic review. Int J Nurs Stud 2017;71:97–114. doi:10.1016/j.ijnurstu.2017.03.012
- European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel and Pan Pacific Pressure Injury Alliance (EPUAP/NPIAP/PPPIA). Chapter 11: Device related pressure injuries. In: Haesler E, editor. Prevention and treatment of pressure ulcers/injuries: clinical practice guideline. The international guideline. Perth, WA: Cambridge Media; 2019. p. 181–193.
- Delmore B, Ayello EA. Pressure injuries caused by medical devices and other objects: a clinical update. Am J Nurs 2017;117(12):36–45.
- Kayser SA, VanGilder CA, Ayello EA, Lachenbruch C. Prevalence and analysis of medical device-related pressure injuries: results from the International Pressure Ulcer Prevalence Survey. Adv Skin Wound Care 2018;31(6):276–285.
- Delmore B, Deppisch M, Sylvia C, Luna-Anderson C, Nie AM. Pressure injuries in the pediatric population: a National Pressure Ulcer Advisory Panel White Paper. Adv Skin Wound Care 2019;32(9):394–408. doi:10.1097/01.ASW.0000577124.58253.66
- European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel and Pan Pacific Pressure Injury Alliance (EPUAP/NPIAP/PPPIA). Chapter 9: Heel pressure injuries. In: Haesler E, editor. Prevention and treatment of pressure ulcers/injuries: clinical practice guideline. The international guideline. Perth, WA: Cambridge Media; 2019. p. 145–154.
- Delmore B, Lebovits S, Suggs B, Rolnitzky L, Ayello EA. Risk factors associated with heel pressure ulcers in hospitalized patients. JWOCN 2015;42(3):242–248.
- Delmore B, Ayello EA, Smith D, Rolnitzky L, Chu AS. Refining heel pressure injury risk factors in the hospitalized patient. Adv Skin Wound Care 2019:32(11):512–519.
- Delmore B, Ayello EA. Practice point: heel pressure injuries. Adv Skin Wound Care 2021;34(5):236-237.
- Gefen A. Why is the heel particularly vulnerable to pressure ulcers. Br J Nurs 2017;8;26(Sup20):S62-S74. doi:10.12968/bjon.2017.26.Sup20.S62.
- Tenenbaum S, Shabshin N, Levy A, Herman A, Gefen AJ. Effects of foot posture and heel padding devices on soft tissue deformations under the heel in supine position in males: MRI studies. J Rehabil Res Dev 2013;50(8):1149–56. doi:10.1682/JRRD/2012.10.0183.
- Gefen A. Tissue changes in patients following spinal cord injury and implications for wheelchair cushions and tissue loading: a literature review. Ostomy Wound Manage 2014;60(2):34–45.
- Delmore B, Sprigle S, Samim M, et al. Does sacrococcygeal skeletal morphology and morphometry influence pressure injury formation in adults. Adv Skin Wound Care 2022;35(11):586–95.
- Sprigle S, et al. Clinical skin temperature measurement to predict incipient pressure ulcers. Adv Skin Wound Care 2001;14(3):133–37.
- Langemo D, Spahn JG. A reliability study using long-wave infrared thermography device to identify relative tissue temperature variations of the body surface and underlying tissue. Adv Skin Wound Care 2017;30(3):109–119.
- Bates-Jensen BM, McCreath HE, Pongquan V. Subdermal moisture is associate with early pressure ulcer damage in nursing home residents with dark skin tones. JWOCN 2009;36(3):277–84.
- Ross G, Gefen A. Assessment of sub-epidermal moisture by direct measurement of tissue biocapacitance. Med Eng Physic 2019;73:92–99.
- Koerner, S, Adams D, Harper SL, Black JM, Langemo DK. Use of thermal imaging to identify deep-tissue pressure injury on admission reduces clinical and financial burdens of hospital-acquired pressure injuries. Adv Skin Wound Care 2019;32(7):312–20.
- Wound, Ostomy and Continence Nurses Society. (2017). WOCN Society position paper: Avoidable versus unavoidable pressure ulcers (injuries). Mt. Laurel, NJ: Author.



