Volume 39 Number 3
Healthcare professionals and interactions with the medical devices industry
Paris Purnell
Keywords compliance, medical devices, nursing profession, ostomy, ethics, industry, healthcare professionals
For referencing Purnell P. Healthcare professionals and interactions with the medical devices industry. WCET® Journal 2019; 39(3):32-36
DOI https://doi.org/10.33235/wcet.39.3.32-36
Abstract
Compliance laws for healthcare professional practices are evolving continuously. It can therefore remain difficult to remain abreast of all laws that apply across all countries. This paper serves as guidance for best practice for healthcare professionals (HCPs) working alongside the medical devices industry.
Introduction
Engaging with product manufacturers and suppliers from within the medical devices industry should, at its best, be a symbiotic relationship where both the healthcare professional (HCP) and the industry representative – henceforth referred to as Industry – derive mutual, yet appropriate, benefits. This relationship should be driven by the ultimate objective of improving patient outcomes. However, this affiliation can be challenging when ensuring objectivity and compliance for both Industry and the HCP. For example, recent global changes of compliance laws designed to govern these affiliations can make it difficult to ensure all parties remain compliant. However, the overall trend is toward transparency by Industry on any such interactions, and these same considerations are increasingly becoming the focus of employers of HCPs as well as the HCP professional bodies.
This paper focuses on global and local laws, codes and market trends in compliance to better inform and protect the HCP. By being more aware of the compliance requirements and legal ramifications when interacting with Industry, the HCP will be in a better position to navigate complex interactions that may place them at risk.
What is Compliance?
Compliance involves a broad series of interactions with HCPs and includes activities such as the promotion of advancements in medical technologies, enhancements in the safe and effective use of medical technologies, research and education activities, and fostering of charitable donations and giving1. For the purposes of this paper, ‘compliance’ is used to describe the ethical code where the first duty of the HCP is to act in the best interests of the patient by working through beneficial relationships with industry in a transparent and ethical manner. Additionally, while the descriptor for a HCP covers most multidisciplinary healthcare workers, this paper refers specifically to the nursing HCPs prescribing medical devices for patients such as ostomy, wound care and continence as this is the audience for this journal. Lastly, medical devices are often highly dependent upon ‘hands on’ HCP interaction from beginning to end, unlike drugs and biologics which act on the human body by pharmacological, immunological or metabolic means2. This often requires Industry to provide HCPs with appropriate instruction, education and training.
As described, compliance laws regarding the interactions of HCPs with Industry are continuously changing. Compounding this challenge, are the variances in the compliance laws by country and sometimes even within that country’s boundaries. Ensuring the HCP is cognisant of the potential pitfalls that may not be apparent when contracting with a manufacturer for either a service or another activity – such as sponsorship – are important considerations. Given the changing face of compliance globally – particularly around some commercial activities that might be considered legal (for now) but not necessarily ethical – it is a timely and worthy discussion to guide the HCP in protecting themselves against potential risk.
International and local Compliance Bodies / Local Trade Associations
There are several international compliance bodies (Figure 1) exerting influences on local Industry and HCP interactions. The larger bodies include AdvaMed (mainly influencing US, Chinese and Latin America activities and companies), MedTech Europe (formerly ‘EucoMed’, covering Europe), APACMed (covering Asia Pacific), and MecoMed (covering the Middle East).

Most countries also have compliance bodies locally which, in turn, often ascribe to at least one of these larger governance bodies. These larger bodies generally set the core principles and ethics that local bodies would engage with as members of the parent body. There are far too many local bodies from a global perspective to create an exhaustive list in this paper. However, from a nursing perspective, there are various registration boards for registered nurses/midwives that operate within each country. These boards each have their own code of ethics and professional standards that influence local practices. For example, Australian nurses ascribe to Australian registration boards such as the Australian Health Practitioners Regulatory Authority and Nursing and Midwifery Board of Australia (NMBA)3, the Wound Ostomy and Continence Nurses Society (WOCN)4 and, of course, the WCET5.
Medical devices are also regulated by local governmental agencies which in turn have their own codes. As one example, the Medical Technology Association of Australia (MTAA) is the governing body regarding compliance for the medical devices industry that includes ostomy products in Australia which has strict codes of conduct and laws regarding interactions between HCPs and Industry. According to the MTAA website6:
In all dealings with Healthcare Professionals, a Company must undertake ethical business practices and socially responsible Industry conduct and must not use any inappropriate inducement or offer any personal benefit or advantage in order to Promote or encourage the use of its products.
This basic definition is a concise summary of what Industry should be following in terms of ethical practices in working with any HCP. One key takeaway message from this simple narrative is the term ‘inducement’. Products must be prescribed on clinical application and suitability. Product usage should not be based upon a ‘quid pro quo’ basis where the HCP and the company are deriving either singular or mutual benefits. This is commonly referred to as ‘corruption’.
As such, while local laws and customs often come into play, an important consideration when the HCP wishes to engage with Industry is to err on the side of caution and follow the rules of the compliance body which are the most stringent. As an example, while some manufacturers in the EU may not necessarily fully ascribe to these bodies, from 2020 MedTech Europe has determined that ALL local trade associations must abide by stricter MedTech Guidelines7. These enforceable ethical standards will be placed on Industry to come into line with all other already compliant manufacturers and service providers.
Corruption and Sponsorship
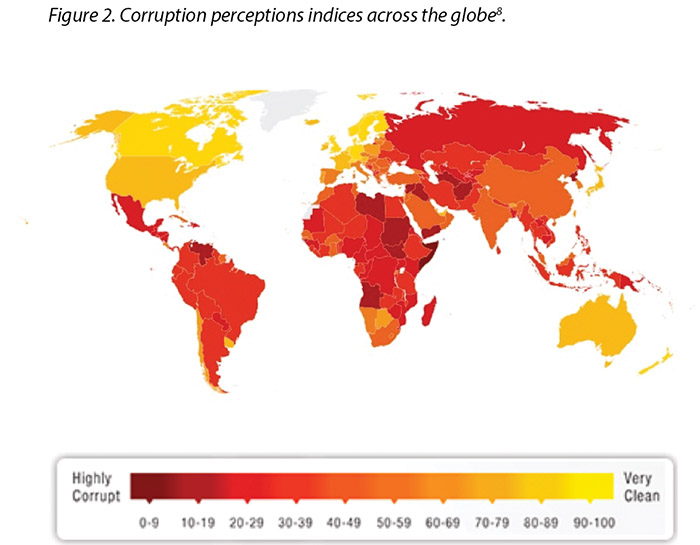
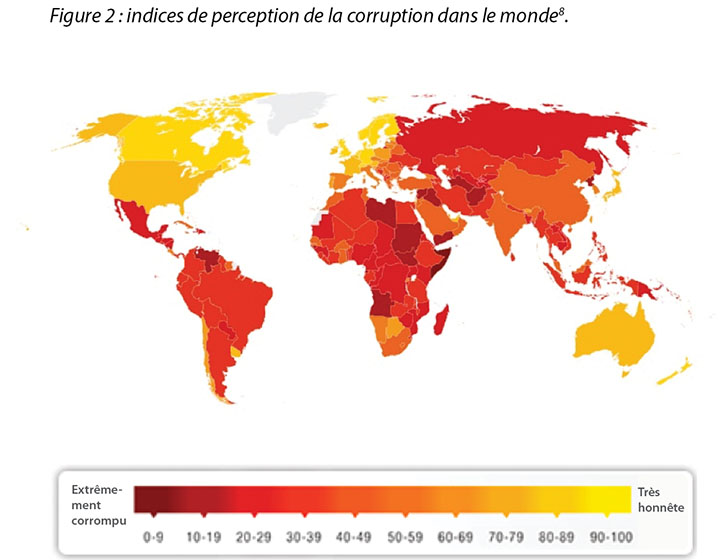
However, laws are constantly changing regarding corruption and sponsorship. Transparency International has developed and mapped the perception of corruption indices across the globe concerning all industries and governments, with darker colours illustrating the perception of higher levels of corruption8; the more yellow (lighter colour), the perception is cleaner and freer from corruption (Figure 2). Yet, while it is good to obtain such a standard, there is an inference that additional scrutiny is required to maintain these standards. This means more oversight into interactions will be assessed. Unfortunately, in recent years, the majority of countries are making little or no progress in ending corruption, while further analysis shows journalists and activists in corrupt countries risk their lives each day in an effort to speak out8.
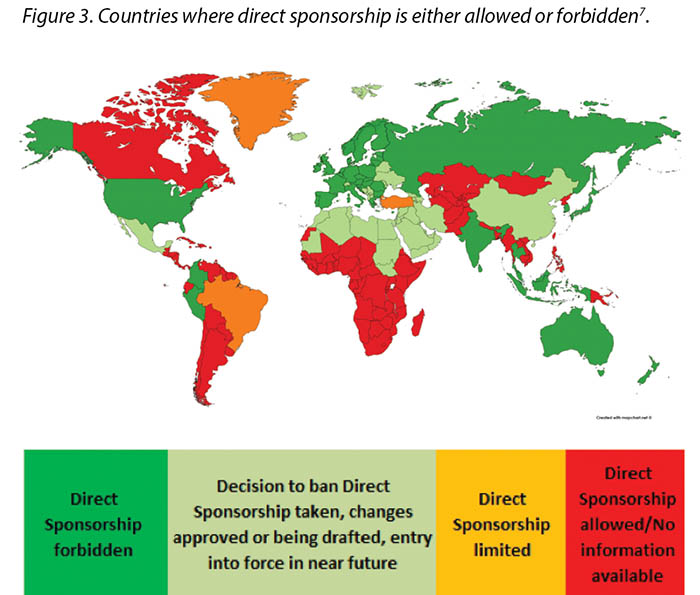
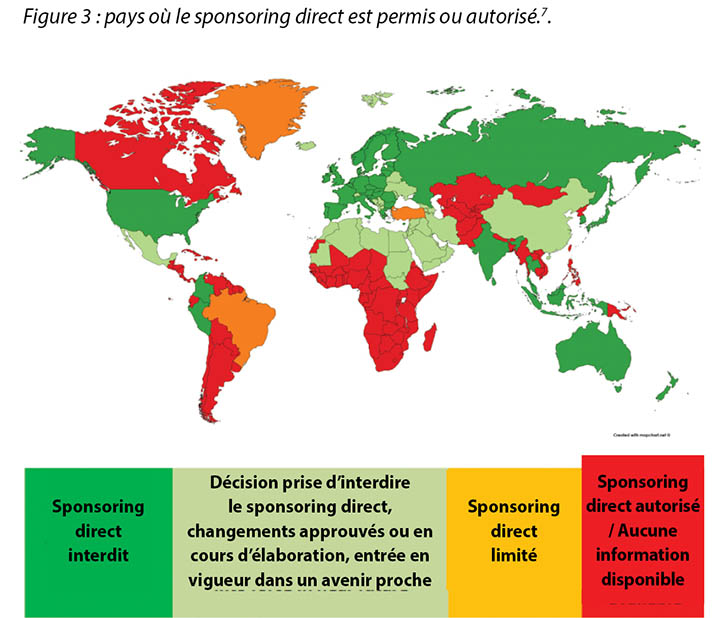
Previously, direct sponsorship usually involved the selection of the HCP by the Industry and direct payment by Industry to the HCP, their institution, or a third-party vendor for the HCP’s travel, lodging, meals, other transportation expenses, conference registration fees or other costs associated with a third-party educational conferences such as those hosted by the European Council of Enterostomal Therapy (ECET), the Society of Urologic Nurses and Associates (SUNA), the Symposium on Advanced Wound Care (SAWC), WOCN or WCET conferences2. This is being, or has already been, phased out in many countries; MedTech Europe illustrates where direct sponsorship is forbidden7 (Figure 3).
Additionally, the concept of direct sponsorship can mean arrangements where Industry selects or influences the selection of a specific HCP through their institution or professional body, or was provided with advance knowledge of the identity of a specific HCP who might benefit directly from Industry funding2. This practice is an ‘indirect’ method of achieving the same objective of direct sponsorship whereby deliberate sponsorship of a specific HCP still occurs. As such, this is also not permissible. As a consequence, the funding must be indirect via an educational grant. MedTech Europe creates another level by enforcing some transparency requirements for all educational grants provided by the industry to healthcare organizations. Access to the transparency report is available on: https://www.ethicalmedtech.eu/transparent-medtech/
General Rules of Engagement for the HCP with Industry
There are several topics for discussion around some rules of engagement for the HCP with Industry, including entertainment, hospitality, event venues and location, travel, contracting, remuneration / compensation, transparency, gifts and samples. Each of the following discussions regarding these outline global compliance standards.
Entertainment
It is prohibited for Industry to organise Industry events – including social, sporting and/or leisure activity or other forms of entertainment – that has no value in terms of education, for example, providing a famous singer at an event, taking nurses to a spa treatment day as an example of managing patients’ skin issues, creating fun artworks/animals using specific medical devices that have no relation to intended use etc. It is also forbidden for Industry to support such entertainment when part of a third-party event, for example live music, sport event, dancing contest. However, there is some tolerance in a third-party event when such entertainment is outside of the scientific / educational programme, is paid for by the HCP, does not dominate / interfere with the educational programme, and is not the main attraction.
Hospitality
Hospitality in this sense relates to meals and/or accommodation. Accommodation should be subordinate in time, with no extensions of stay unless paid for by the HCP. It should only be for the time of the event/meeting that is necessary. Some of these rules are often determined by type of meeting being arranged, for example if the meeting is classified as ‘active’ or ‘passive’. Active events are where the HCP is expected to actively participate and contribute in the meeting, for example a Clinical Advisory Board or Consensus Panel. In these types of events, the HCP is in essence ‘working’ and it is expected that costs incurred for attending the meeting would be reimbursed by Industry. In contrast, passive events are where Industry is presenting to the audience with no reciprocal interaction being required by the HCP. Regarding product promotional events that are organised by Industry – even if they are educational, for example the launch of a new product – no transportation nor hotel fees should be supported. The HCP is expected to cover these costs themselves as this is considered a passive event. However, modest meals at a passive educational event are permitted.
Generally, the meals and accommodation should focus to the purpose of the event and should be seemed as reasonable, for example such as what the HCP would expect to pay by themselves. Recommendations around these values have been determined by trade associations on local laws, and these have been set up in most countries in the world. Maximum amounts for lunches and dinners have been outlined for every country – the rule to apply is generally that of the law governing the hospitality of the country where the HCP is licensed to practise.
Event venues and locations
Industry should respect the following criteria when selecting a venue for an event.
- Perceived image – how it could be seen by the public.
- Centrality – whether it is centrally located for the participants.
- Ease of access – whether it has easy transportation, is close to airport/venue. A recognised scientific or business centre is preferred.
- Time of year – ideally this should not be associated to a tourist season.
- Adapted to the purpose of the meeting – are the rooms appropriate for their intended use.
An event location where the meeting purpose appears secondary to the location is seen as an inducement for the HCP to attend based on the location and not the content or objective of the meeting. As such, event locations should not be lavish such as five-star, golf facilities, spa retreats etc. If the HCP notices the event venue seems inappropriate (for example an amusement park or a retreat), the HCP should reconsider the event.
Travel
When Industry is arranging travel, it must be directly linked to the meeting length and cannot be extended for the purpose of sightseeing / family visits etc. Industry cannot cover a period of stay beyond the official duration of the event.
Travel is linked only to the purpose of the meeting and, like hospitality, should be modest and reasonable – no business / first class air tickets. Related travel expenses for active meetings such as parking, train fares etc. are reimbursable but should be agreed upon prior to the expense.
Contracting
Industry may engage HCPs as consultants and advisors to provide bona fide consulting and other services, including research studies, participation on ostomy/wound advisory boards, presentations at Industry educational events, and new product development. In selecting the HCP, there should be appropriate criteria that includes:
- Legitimate interest – Industry should not contract with a HCP ‘just in case’ or if there is a lack of in-house competencies.
- Appropriate qualifications – the HCP should be technically and scientifically qualified, with the right competencies to achieve the assignment. Industry should collect a CV for documentation and to justify any compensation.
- No financial gain – selection should be detached from sales to avoid any influence.
Contracts with the HCP shall not be contingent in any way on the prospective consultant’s past, present or potential future purchase, lease, recommendation, prescription, use, supply or procurement of the contractor’s products or services. In other words, there is no ‘quid pro quo’ expectation from Industry that the HCP will use/prescribe their products.
Contracts must involve appropriate documentation to justify the compensation – if any – paid to the HCP. MedTech Europe and AdvaMed have specific requirements for written agreements with the HCP1,7. The contracts also protect Industry by ensuring confidentiality on projects is maintained for new products or strategies so they are not shared with competition. Industry also maintains rights to use the material / research / studies developed by the HCP during the assignment. Lastly, contracts must provide transparency. They ensure information of, and to, the HCP’s employer on the existence of the contract, state exactly what the assignment is, and how much compensation (if any) is paid to the HCP.
Remuneration / compensation
When compensating the HCP for their services, reasonable and fair market value (FMV) compensation should be aligned with the market value for that HCP and the type of service. Guidance on FMV should be sought with compliance officers or the local HCP’s Association, for example the NMBA. In addition, documentation of the type and the length of service with associated remuneration is to be captured and signed off by both Industry and the HCP prior to the event occurring.
Transparency
Before engaging with Industry, as a best practice it is strongly suggested that the HPC should gain approval / notification of the HCP’s employer. While not always mandatory, this transparency covers both parties if there arises any questions regarding conflicts of interest. The employer of the HCP should receive full disclosure of the purpose and scope of consultancy agreement. Additionally, all Industry contracts should contain a clause on the obligation of the HCP to notify the existence of the agreement to their hierarchy. It is prudent to check local requirements.
Gifts
In principle, it is prohibited by Industry to provide gifts to the HCP. Local customs may need examining to determine if this is still permissible. For example, in Japan and Thailand there is frequently an expectation of gifts of thanks. These should not be excessive in nature and should not create any expectations of quid pro quo. Local customs and laws may come into play; however, it is recommended to check with a compliance officer prior to engaging in any gifting activities if there is any ambiguity. In some countries, it is now no longer permissible to give birthday or bereavement cards or flowers, and local laws should be evaluated prior to exploring the potential for providing such gifts.
Industry may provide inexpensive educational items and/or gifts in exceptional circumstances, in accordance with local laws, regulations and industry and professional codes of conduct of the country where the HCP is licensed. Excluded ‘educational’ items are DVD players for playing educational movies, or cameras for wound care as these can be used for other purposes. Acceptable educational gifts can be purely educational (medical) book vouchers, registration to third-party events or educational courses, although these are paid to the third-party only – no cash should be paid direct to any HCP. Again, full transparency is required and documentation should be provided to cover both parties.
Samples
Industry may provide products as samples at no charge in order to enable the HCP to evaluate and/or familiarise themselves with the safe, effective and appropriate use and functionality of the product. This will allow HCPs to determine whether, or when, to use, order, purchase, prescribe or recommend the product and/or service in the future. Provision of samples must not improperly reward, induce and/or encourage HCPs to purchase, lease, recommend, prescribe, use, supply nor procure their products or services.
Any offer and/or supply of samples shall always be done in full compliance with applicable national laws, regulations and industry and professional codes of conduct.
Recent US and European laws, as well as MedTech guidelines in the EU7, require the maintenance of appropriate records in relation to the provision of samples to HCPs, for example recording proof of delivery of samples. These are now to be clearly recorded in the books on a no-charge basis, and this and other conditions applicable for the supply of such samples must be clearly disclosed – in writing and at the time of supply – to HCPs.
The concern is the over-supply of samples (dumping) that may be perceived as an inducement to use the certain products. Samples, as described, should be modest. Anecdotally, for the ostomy Industry, there appears to be an oversupply (stocking) of products at many institutions instead of these institutions purchasing. This practice is possibly in need of further scrutiny.
Red Flags – Warnings
The HCP should become familiar before considering interactions with Industry across multiple issues. There are certain common ‘red flags’ that should create alerts in the mind of the HCP that include situations where there is:
- Wording or phrasing with ‘win’, ‘gift’, or ‘prize’.
- No professional educational relationship associated with the benefit.
- Entertainment.
- A submission for ‘competitions’ judged only by Industry manufacturers (no third-party).
- A value which is high in comparison with the effort required.
- Anything which seems ‘too good to be true’.
- Excessive sampling (dumping) of products.
General Rules of Thumb for Protecting the HCP
- Obtain the full rules of engagement from the device manufacturer.
- Review it with your existing employer’s audit committee /managers.
- Check with your professional body, both local and national.
- Review any available guidelines, both local, national or institutional.
- If in doubt, don’t do anything.
- Consider the ‘optics’ – how might the interaction look if it appeared in the news? Is this clean and free from potential misunderstanding?
Conclusion
There are risks for the HCP when engaging with Industry, and rules and laws are constantly changing. It is difficult to remain ahead and informed of these continuous changes; however, this paper aims to raise awareness of this ever-changing landscape. For the HCP, it is a wise idea to check and follow the rules of engagement, observe the red flags and, if there are any doubts, to err on the side of caution and simply not engage. Ultimately, the goal for each party is to improve patient outcomes and create a prosperous dynamic that is compliant. Interactions between Industry and the HCP are inevitable, but if the relationship is open, honest and transparent, with clear rules of engagement and oversight, these relationships can be extremely fruitful for each party.
Disclaimer
Laws from regulatory bodies are frequently updated. At the time of print, this is a fair assumption of current practices. As always, it remains advisable to seek further guidance from the HCP local regulatory body or employer if there is any doubt before any action/s is taken.
Conflict of Interest
The authors declare no conflicts of interest.
Funding
The authors received no funding for this study.
Interactions entre professionnels de santé et secteur des dispositifs médicaux
Paris Purnell
DOI: https://doi.org/10.33235/wcet.39.3.32-36
Résumé
Face à une évolution constante des lois sur la conformité s’appliquant aux professionnels de santé, il est difficile de connaître toute la législation en vigueur dans chaque pays. La présente publication a pour but d’informer les professionnels de santé travaillant en collaboration avec le secteur des dispositifs médicaux sur les meilleures pratiques.
Introduction
Les interactions entre fabricants et fournisseurs de dispositifs médicaux devraient être, au mieux, des relations symbiotiques, mutuellement bénéfiques et justes, aussi bien pour les représentants du secteur (ci-avant désigné par « Secteur ») que pour les professionnels de santé. La relation entre ces parties doit être motivée par un objectif ultime qui est l’amélioration des soins aux patients. Pourtant, cette relation est parfois difficile à gérer, tant pour les professionnels de santé que pour le Secteur, l’objectivité et la conformité étant essentielles. Par exemple, dans le monde, les lois de conformité régissant ces relations ayant récemment changé, il peut s’avérer difficile pour toutes les parties prenantes de les respecter. Pourtant, le Secteur mise de plus en plus sur la transparence lorsqu’il s’agit d’interagir avec les professionnels de santé et les associations professionnelles, et les employeurs des professionnels de santé en font de même.
Le présent article examine les lois et les codes locaux et internationaux, ainsi que les tendances du marché dans le domaine de la conformité, afin de mieux informer et protéger les professionnels de santé. Un professionnel de santé qui connaît les exigences de conformité et les ramifications juridiques sera mieux à même d’interagir avec le Secteur et de s’orienter dans un environnement complexe qui peut présenter des risques pour lui.
Qu’est-ce que la conformité ?
La conformité implique un large éventail d’interactions avec les professionnels de santé et notamment des activités comme la promotion des avancées technologiques médicales, les améliorations de l’utilisation sûre et efficace des technologies médicales, les activités de recherche et de formation, et l’incitation aux dons en faveur d’associations caritatives.1 Pour les besoins de la présente publication, le terme « conformité » est utilisé pour décrire le code de déontologie dans le cadre duquel la toute première fonction du professionnel de santé est d’agir au mieux des intérêts du patient en entretenant des relations bénéfiques avec le Secteur, de manière transparente et éthique. En outre, tandis que l’expression « professionnel de santé » fait référence à des personnes travaillant dans le domaine des soins de santé dans de très nombreuses disciplines, le présent article se réfère spécifiquement aux professionnels de santé prescrivant des dispositifs médicaux pour des patients, comme du matériel de stomies, de soins des plaies et de continence, sachant que nos lecteurs sont, pour la majorité, des professionnels de ce type. Enfin, très souvent, les dispositifs médicaux sont manipulés par des professionnels de santé tout au long de leur utilisation, contrairement aux médicaments et aux produits biologiques qui ont une action pharmacologique, immunologique ou métabolique sur le corps humain.2 Cela exige souvent que le Secteur fournisse aux professionnels de santé des instructions, une formation et un enseignement adaptés.
Comme indiqué ci-avant, les lois de conformité concernant les interactions des professionnels de santé avec le Secteur sont en constante évolution. À cela s’ajoute le fait que les lois de conformité diffèrent d’un pays à un autre, et parfois même au sein d’un même pays. Pour être certain que les professionnels de santé connaissent les éventuels écueils parfois indécelables au moment de signer un contrat avec un fabricant pour la prestation de services ou pour toute autre activité (sponsoring par exemple), certains aspects importants sont à prendre en considération. Les règles de conformité évoluent sans cesse dans le monde, notamment en matière d’activités commerciales pouvant être considérées comme licites (pour le moment), mais pas forcément éthiques. Une discussion opportune et judicieuse s’impose donc afin que le professionnel de santé puisse se protéger face aux éventuels risques.
Organismes de conformité locaux et internationaux / Associations professionnelles locales
Il existe plusieurs organismes de mise en conformité (figure 1) internationaux exerçant une influence sur les interactions entre professionnels de santé et le Secteur au niveau local. Les organismes les plus importants sont entre autres AdvaMed (qui influence surtout les entreprises et les activités aux États-Unis, en Chine et en Amérique latine), MedTech Europe (anciennement EucoMed, actif en Europe), APACMed (actif dans la région Asie-Pacifique) et MecoMed (présent dans tout le Moyen-Orient).

La plupart des pays ont également des organismes de mise en conformité nationaux qui, à leur tour, sont chapeautés par au moins l’un de ces grands organismes. Le plus souvent, ce sont eux qui définissent les principes et la déontologie de base que les organismes locaux s’engagent à respecter en tant que membres de l’organisme parent. Le nombre d’organismes locaux est bien trop grand dans le monde pour fournir une liste exhaustive dans la présente publication. Cependant, d’un point de vue des soins, il existe différents comités où les infirmiers, infirmières et sages-femmes diplômés en activité dans chaque pays peuvent s’inscrire. Ces comités ont leurs propres codes de déontologie et normes professionnelles qui influencent les pratiques locales. Par exemple, les infirmiers et infirmières australiens s’en remettent à l’ordre des infirmiers australien ou à d’autres comités équivalents comme l’Australian Health Practitioners Regulatory Authority et le Nursing and Midwifery Board of Australia (NMBA)3, le Wound Ostomy and Continence Nurses Society (WOCN)4 et bien entendu, le WCET.5
Les dispositifs médicaux sont également régulés par des agences gouvernementales qui ont également leurs propres codes. Par exemple, on peut citer la Medical Technology Association of Australia (MTAA), organe directeur en matière de conformité du secteur des dispositifs médicaux et par ailleurs des accessoires de stomie en Australie. Son code de conduite est strict tout comme le sont les lois relatives aux interactions entre le Secteur et les professionnels de santé. Selon le site Web de la MTAA6 :
Dans le cadre de ses négociations et activités avec des professionnels de santé, une entreprise doit adopter des pratiques commerciales éthiques et une conduite socialement responsable, et elle ne doit pas proposer des incitations inappropriées ou des avantages personnels en nature ou en espèce afin de promouvoir ou d’encourager l’utilisation de ses produits.
Cette définition de base résume de façon succincte ce que le Secteur doit respecter en matière de pratiques déontologiques lorsqu’il travaille avec des professionnels de santé. L’une des principales idées à retenir de ce message est le terme « incitation ». Les produits doivent être prescrits dans le respect de leur application clinique et selon leur pertinence. L’utilisation des produits ne doit pas se baser sur une contrepartie dans le cadre de laquelle le professionnel de santé et l’entreprise obtiennent des avantages mutuels ou particuliers. Le terme généralement utilisé pour décrire ce type de situation est « corruption ».
Si les usages et les lois d’un pays entrent souvent en jeu, tout professionnel de santé souhaitant interagir avec le Secteur se doit de prendre toutes les précautions possibles et de bien respecter les règles les plus strictes de l’organisme de mise en conformité. Par exemple, s’il est vrai que certains fabricants de l’Union européenne ne s’en remettent pas forcément à ces organismes, depuis 2020, MedTech Europe a tout de même décidé que TOUTES les associations professionnelles locales devaient respecter des lignes directrices de MedTech plus strictes.7 Ces règles éthiques en vigueur vont s’imposer aux entreprises du Secteur pour une harmonisation avec tous les autres prestataires de service et fabricants déjà en conformité.
Corruption et sponsoring
Les lois relatives à la corruption et au sponsorship ne cessent de changer. Transparency International a conçu un indice de perception de la corruption et recensé les chiffres de cet indice dans le monde pour tous les secteurs d’activité et les gouvernements. Les pays aux couleurs les plus sombres sont ceux où la perception des niveaux de corruption est la plus élevée8 et les pays aux couleurs plus claires sont ceux où la perception de la corruption est moindre (figure 2). Ces données sont intéressantes et l’on en déduit qu’un contrôle accru est nécessaire pour assurer le respect de ces règles de déontologie. Cela implique un plus grand contrôle des interactions. Malheureusement, au cours des dernières années, très peu de pays ont progressé dans la lutte contre la corruption et des études indiquent que les journalistes et les militants des pays corrompus risquent leur vie chaque jour pour révéler des informations au grand jour.8
Autrefois, le sponsoring direct signifiait généralement la désignation d’un professionnel de santé par le Secteur et un paiement direct du Secteur à ce dernier, à son institut ou à un fournisseur tiers pour ses déplacements, son hébergement, ses repas et autres frais de transport, ses frais d’inscription à des conférences et autres frais déboursés pour se rendre à des conférences comme celles organisées par le Conseil européen de stomathérapie (CES), la Society of Urologic Nurses and Associates (Société des infirmiers en urologie et associés, SUNA), le Symposium on Advanced Wound Care (Colloque sur les soins avancés des plaies, SAWC), les conférences du WOCN ou du WCET.2 Dans de nombreux pays, cette pratique disparaît peu à peu : MedTech Europe recense (figure 3) les pays où le sponsoring direct est désormais interdit.7
De plus, le concept de sponsoring direct peut également signifier que le Secteur s’arrange pour choisir ou désigner un professionnel de santé spécifique par le biais de son institution ou de son organisation professionnelle, ou bien le Secteur dispose à l’avance d’informations sur l’identité d’un professionnel particulier susceptible de bénéficier directement de fonds.2 Cette pratique est une façon « indirecte » d’atteindre le même objectif qu’un sponsorship direct car il s’agit de sponsoring intentionnel d’un professionnel de santé. En tant que tel, cela n’est pas permis non plus. Les fonds doivent donc être versés indirectement par le biais d’une subvention pour l’éducation. MedTech Europe va encore plus loin en imposant des exigences de transparence pour toutes les subventions d’éducation versées par le Secteur aux organisations de santé. Son rapport sur la transparence est disponible à l’adresse suivante : https://www.ethicalmedtech.eu/transparent-medtech/
Règles générales d’interaction entre les professionnels de santé et le secteur
Les règles d’interaction des professionnels de santé avec le Secteur régissent de nombreux domaines comme les divertissements, l’hébergement, les lieux des manifestations, les déplacements, les signatures de contrat, la rémunération / les indemnisations, la transparence, les cadeaux et les échantillons. Chaque domaine est régi par des normes de conformité internationales.
Divertissements
Le Secteur n’est pas autorisé à organiser des manifestations (activités sociales, sportives et / ou de loisir ou toute autre forme de divertissement) n’ayant aucune valeur éducative. Par exemple, il ne peut pas faire venir un chanteur connu lors d’une manifestation, offrir un séjour dans une station thermale à des infirmières pour leur présenter un traitement des problèmes de peau, créer des œuvres d’art / d’animaux avec des dispositifs médicaux alors que cela n’a aucun lien avec leur usage, etc. Le Secteur n’est également pas autorisé à soutenir ce type de divertissement dans le cadre d’une manifestation organisée par un tiers (concert live, évènement sportif ou concours de danse). Cependant, cette pratique est tolérée dans les manifestations de tiers si elle a lieu en dehors d’un programme éducatif ou scientifique, si elle reste à la charge du professionnel de santé et si elle n’est pas le clou du spectacle ou ne perturbe pas le programme éducatif.
Hébergement et repas
Il s’agit ici de tout ce qui a trait à l’hébergement et aux repas. L’hébergement réservé doit correspondre au temps passé sur place, sans aucun prolongement de séjour qui ne soit pas à la charge du professionnel de santé. Il doit uniquement couvrir le temps nécessaire à la présence du professionnel de santé à la manifestation / au colloque. Certaines règles sont souvent définies par le type de réunion organisée. Par exemple, s’il s’agit d'une réunion dite « active » ou « passive ». Les manifestations actives sont celles où le professionnel de santé doit en principe participer de manière active et contribuer aux discussions (par exemple, le Clinical Advisory Board ou le Consensus Panel). Dans le cadre de ce type de manifestation, le professionnel de santé passe la majeure partie de son temps à « travailler » et les coûts qu’implique sa présence sont normalement remboursés par le Secteur. Les manifestations passives sont celles où le Secteur fait des présentations à une audience sans qu’une interaction ne soit exigée du professionnel de santé. Concernant les événements promotionnels organisés par le Secteur (même s’ils sont éducatifs comme le lancement d’un nouveau produit), aucuns frais de déplacement ou d’hébergement ne doivent être pris en charge par le Secteur. Le professionnel de santé doit normalement couvrir ces frais lui-même car cela est considéré comme une manifestation passive. Cependant, les repas légers sont autorisés lors de manifestations éducatives passives.
En général, les repas et l’hébergement doivent répondre aux objectifs de la manifestation et doivent rester dans les limites du raisonnable. Ils ne doivent pas excéder ce qu’un professionnel de santé paierait pour lui-même. Les recommandations en la matière ont été définies par des associations professionnelles sur la base de la législation locale et elles sont en vigueur dans la plupart des pays. Des sommes maximales pour les déjeuners et les dîners ont été définies dans chaque pays et en général, les règles à respecter sont celles du pays où le professionnel de santé est agréé.
Lieux des événements
Le Secteur doit s’en tenir aux critères suivants au moment de choisir le lieu d’une manifestation.
- Réputation du lieu : comment le public perçoit le lieu.
- Centralité : le lieu est-il proche du centre pour que les participants puissent s’y rendre facilement.
- Facilité d’accès : le lieu est-il accessible par les transports, est-il proche d’un aéroport. Un centre d’affaires ou scientifique reconnu est préférable.
- Moment de l’année : l’idéal est de ne pas organiser d’événement pendant la saison touristique.
- Fonctionnalité : le lieu est-il adapté à l’utilisation que l’on souhaite en faire.
Si le lieu d’une manifestation prime sur la manifestation en elle-même, cela est considéré comme une incitation pour les professionnels de santé à s’y rendre car ils viendront pour le lieu et non pour la manifestation. Ainsi, le lieu d’une manifestation ne doit pas être aussi fastueux qu’un hôtel cinq étoiles, un golf ou une station thermale, etc. Un professionnel de santé qui estime que le lieu d’une manifestation est inapproprié (comme un parc d’attractions ou un lieu de retraite) se doit de remettre en cause sa participation.
Déplacements
Lorsque le Secteur organise les déplacements, ceux-ci doivent correspondre à la durée de la manifestation et ne doivent pas être prolongés à des fins touristiques ou familiales, etc. Le Secteur ne peut pas payer pour un séjour supérieur à la durée officielle de la manifestation.
Les déplacements doivent uniquement permettre de se rendre à la manifestation et tout comme l’hébergement et les repas, ils doivent rester modestes et raisonnables. Les billets d’avion en première classe ou en classe affaires ne sont pas autorisés. Les frais de déplacement pour les réunions actives comme le stationnement, les billets de train, etc. sont remboursables, mais doivent être approuvés avant d’être déboursés.
Embauche
Le Secteur peut embaucher des professionnels de santé en tant que consultants et conseillers pour fournir des conseils de bonne foi ou autres services (comme mener des études, siéger à un conseil consultatif sur les plaies et les stomies, intervenir dans le cadre de réunions éducatives organisées par le Secteur ou participer au développement de nouveaux produits). Les critères de sélection des professionnels de santé sont entre autres :
- Intérêt légitime : une entreprise du Secteur ne doit pas embaucher un professionnel de santé « juste au cas où » ou pour combler un manque de compétences en son sein.
- Qualifications : le professionnel de santé doit être qualifié, aussi bien d’un point de vue technique que scientifique, et disposer des compétences lui permettant de remplir correctement son rôle. Le Secteur doit obtenir plusieurs CV pour documenter et justifier toute rémunération.
- Aucun avantage financier : le choix du professionnel de santé doit être indépendant des activités commerciales pour éviter toute influence.
Le contrat signé entre une entreprise et un professionnel de santé ne doit pas dépendre, de quelque manière que ce soit, de l’achat, de la location, de la recommandation, de la prescription, de l’utilisation, de la fourniture, de la prestation ou de l’approvisionnement futurs, passés ou présents de produits ou services de l’entreprise par le professionnel de santé consultant. En d’autres termes, le Secteur ne doit pas s’attendre à ce que le professionnel de santé utilise / prescrive ses produits.
Les contrats doivent inclure les pièces justificatives de la rémunération versée, le cas échéant, au professionnel de santé. MedTech Europe et AdvaMed ont des exigences spécifiques en matière d’accords écrits signés avec tout professionnel de santé.1, 7 Les contrats protègent également le Secteur en garantissant la confidentialité des projets de nouveaux produits et des nouvelles stratégies qui ne sont ainsi pas communiqués à la concurrence. De même, le Secteur peut limiter les droits d’utilisation du matériel / de la recherche / des études développés par le professionnel de santé dans le cadre de ses fonctions. Enfin, les contrats doivent être transparents. Cela garantit que les informations fournies par et à l’employeur du professionnel de santé figurant dans le contrat valide décrivent clairement la mission du professionnel de santé et le montant de sa rémunération (le cas échéant).
Rémunération / Indemnisation
La rémunération ou indemnisation du professionnel de santé pour ses services doit être juste et raisonnable. Elle doit s’aligner sur la valeur du marché selon le professionnel de santé et le type de service fourni. Des informations sur la « juste valeur de marché » sont disponibles auprès des agents de conformité ou des associations professionnelles, par exemple la NMBA. En outre, des documents décrivant le type de service, la durée et la rémunération doivent être rédigés et signés par le Secteur et le professionnel de santé avant la prestation.
Transparence
Avant toute interaction avec le Secteur, il est très fortement recommandé au professionnel de santé d’obtenir l’approbation / l’avis de son employeur. Si elle n’est pas toujours obligatoire, cette mesure de transparence protège les deux parties en cas de conflit d’intérêts. L’employeur du professionnel de santé doit recevoir toutes les informations sur l’objet et le champ d’application de l’accord de prestations de conseils. En outre, tous les contrats du Secteur doivent contenir une clause obligeant les professionnels de santé à informer leur hiérarchie de l’existence du contrat signé. Il vaut mieux vérifier les exigences locales.
Cadeaux
En principe, il est interdit au Secteur d’offrir des cadeaux à un professionnel de santé. Les coutumes locales doivent être examinées pour déterminer si cela est permis ou non. Par exemple, au Japon et en Thaïlande, il est fréquent d’offrir des cadeaux de remerciement. Les cadeaux de ce type doivent rester modestes et ne doivent pas créer des attentes d’une contrepartie. La législation et les coutumes locales peuvent entrer en jeu, mais il est recommandé de vérifier, en cas d’ambiguïté, avec un responsable de la conformité avant d’offrir des cadeaux. Dans certains pays, il n’est plus permis de donner des cartes ou des fleurs à l’occasion d’un anniversaire ou d’un deuil et la législation locale doit être consultée avant d’offrir des cadeaux de ce type.
Le Secteur peut offrir des produits et / ou des cadeaux éducatifs peu coûteux dans des circonstances exceptionnelles, mais toujours dans le respect des lois, des règlements et des codes de conduite de la profession et du secteur du pays où le professionnel de santé est agréé. Ne sont pas considérés comme produits « éducatifs » les lecteurs de DVD pour regarder des films éducatifs sur le soin des plaies ou des caméras car ces appareils peuvent être utilisés à d’autres fins. Voici des exemples de cadeaux éducatifs acceptables : bons d’achat pour des livres éducatifs (médicaux), inscriptions à des manifestations organisées par des tiers ou à des cours. Le paiement pour ces cadeaux doit être versé uniquement à la tierce partie et aucun montant en espèce ne doit être remis à des professionnels de santé. De nouveau, une transparence totale est exigée et les pièces justificatives doivent être fournies pour protéger les deux parties.
Échantillons
Le Secteur peut fournir des échantillons de produits gratuits pour que les professionnels de santé évaluent et / ou se familiarisent avec ces produits et soient en mesure de faire un usage sûr, efficace et correct des produits et de leurs fonctionnalités. Ainsi, les professionnels de santé peuvent déterminer s’ils souhaitent, à l’avenir, utiliser, commander, acheter, prescrire ou recommander les produits et / ou services en question. La fourniture d’échantillons ne doit pas abusivement récompenser, inciter et / ou encourager les professionnels de santé à acheter, louer, recommander, prescrire, utiliser ou fournir les services ou produits du Secteur.
Toute offre et / ou fourniture d’échantillons doit se faire en totale conformité avec la législation et la réglementation en vigueur dans le pays et avec le code de déontologie de la profession et du Secteur.
Des lois récemment promulguées aux États-Unis et dans l’Union européenne, ainsi que des recommandations de MedTech dans l’Union européenne,7 exigent de conserver les pièces justificatives en lien avec la fourniture d’échantillons aux professionnels de santé, par exemple celles de livraison d’échantillons. Elles doivent désormais être clairement enregistrées dans les archives sans aucuns frais, et cette condition ainsi que toute autre condition applicable à la fourniture d’échantillons doit être clairement communiquée, par écrit au moment de la livraison aux professionnels de santé.
Un problème est l’excédent d’échantillons (dumping) pouvant être considéré comme une incitation à utiliser certains produits. Le nombre d’échantillons fournis doit, comme indiqué, rester modeste. Bizarrement, dans le secteur des stomies, il semble que bon nombre d’instituts dispose d’un excédent de produits (stocks) et de se fait n’en achètent pas. Cette pratique devra sans doute faire l’objet d’un contrôle plus minutieux.
Mises en garde et avertissements
Tout professionnel de santé doit se renseigner sur les enjeux et les éventuels problèmes de ses interactions avec le Secteur. Certaines situations doivent en principe déclencher un signal d’alarme dans l’esprit du professionnel de santé. Par exemple :
- L’usage de mots ou d’expressions comme « gagner », « cadeau » ou « prix ».
- Un avantage n’ayant aucun apport éducatif professionnel.
- Des divertissements.
- La participation à un « concours » dont les juges sont uniquement des acteurs du Secteur (aucune tierce partie).
- Une rétribution trop élevée comparée à l’effort requis.
- Un situation où tout semble « trop beau pour être vrai ».
- Une avalanche de produits échantillons (dumping).
Règles d’or de protection des professionnels de santé
• Prendre connaissance de toutes les règles d’interaction avec le fabricant de dispositifs.
• Revoir ces règles avec les responsables / le comité d’audit de l’employeur existant.
• Consulter les organisations professionnelles, locales et nationales.
• Consulter les recommandations locales, nationales ou institutionnelles.
• En cas de doute, ne rien faire.
• Réfléchir en adoptant un point de vue extérieur, c’est-à-dire se demander comment la situation serait-elle commentée dans les médias ? La situation est-elle assez claire et transparente où y a-t-il un risque de malentendu ?
Conclusion
Les risques pour les professionnels de santé qui interagissent avec le Secteur sont réels et la réglementation et la législation sont en constante évolution. Il est parfois difficile d’anticiper ces changements et de rester informé et le présent article souhaite sensibiliser le lecteur à cet environnement très changeant. Si vous êtes professionnel(le) de santé, vérifiez et respectez les règles d’interaction, observez les signes de mise en garde et, en cas de doute, prenez toutes les précautions ou bien ne faites rien. L’objectif pour chaque partie est d’améliorer les soins prodigués aux patients et de créer une dynamique bénéfique pour tous, dans le respect des lois, codes et règlements. Les interactions entre le Secteur et les professionnels de santé sont inévitables, mais si les relations sont ouvertes, honnêtes et transparentes, encadrées par des règles d’interaction et de contrôle claires, alors elles peuvent être très fructueuses pour tout le monde.
Avertissement
Les lois émanant des organismes de réglementation sont fréquemment mises à jour. À la date de publication du présent article, les pratiques décrites ici sont estimées comme actuelles. Comme toujours, il est conseillé aux professionnels de santé d’obtenir des renseignements et recommandations auprès de l’organisme de réglementation local ou de leur employeur en cas de doute.
Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts.
Financement
Les auteurs n’ont reçu aucun fonds pour cette étude.
Author(s)
Paris Purnell
Senior Manager, Clinical Education
Hollister Incorporated, Illinois, USA
Email paris.purnell@hollister.com
References
- Advanced Medical Technology Association. AdvaMed code of ethics on interactions with U.S. health care professionals [Internet]. Washington: Advanced Medical Technology Association 2018 [cited 2019 July 1]. Available from: https://www.advamed.org/sites/default/files/resource/advamed_u.s._code_of_ethics_final_-_eff._jan_1_2020.pdf
- Advanced Medical Technology Association. AdvaMed code of ethics on interactions with Chinese health care professionals [Internet]. Washington: Advanced Medical Technology Association 2018 [cited 2019 July 1]. Available from: https://www.advamed.org/sites/default/files/resource/revised_china_code_language_-_english_final.pdf
- Nursing and Midwifery Board of Australia. Code of conduct for nurses [Internet]. Melbourne: Nursing and Midwifery Board of Australia 2018 [cited 2019 Sept 4]. Available from: https://www.nursingmidwiferyboard.gov.au/Codes-Guidelines-Statements/Professional-standards.aspx
- Wound Ostomy and Continence Nurses Society. WOCN code of conduct and conflict of interest disclosure statement [Internet]. Mount Laurel, NJ: WOCN 2019 [cited 2019 Sept 4]. Available from: https://app.smartsheet.com/b/form/28f0d3b7212348daac48bb8f35def327
- World Council of Enterostomal Therapists. The WCET mission, vision, values statement [Internet]. Washington: WCET 2018 [cited 2019 Sept 4]. Available from: https://www.wcetn.org/mission-values-a-vision
- Medical Technology Association of Australia. Code of practice E10 [Internet]. Sydney: Medical Technology Association of Australia 2018 [cited 2019 July 1]. Available from: https://www.mtaa.org.au/code-of-practice
- MedTech Europe. Code of ethical business practice: open letter to the healthcare community [Internet]. From the Legal and Compliance team of MedTech Europe. MedTech Europe 2017 [cited 2019 July 1]. Available from: http://www.medtechviews.eu/article/code-ethical-business-practice-open-letter-healthcare-community?
- Transparency International. Corruption perceptions index 2017 [Internet]. Berlin: Transparency International 2018 [cited 2019 July 1]. Available from: https://www.transparency.org/news/feature/corruption_perceptions_index_2017
