Volume 40 Number 2
Skin manifestations with COVID-19: the purple skin and toes that you are seeing may not be deep tissue pressure injury
Joyce Black and Joyce Cuddigan
Keywords COVID-19, purple skin, deep tissue pressure injury
For referencing Black J and Cuddigan J. Skin manifestations with COVID-19: the purple skin and toes that you are seeing may not be deep tissue pressure injury. WCET® Journal 2020;40(2):18-21
DOI https://doi.org/10.33235/wcet.40.2.18-21
Abstract
Many reports are occurring concerning areas of purpuric/purple skin and purple toe lesions in patients diagnosed with COVID-19 (SARS-CoV-2) (Figure 1). Wound care providers are being asked if these skin lesions are forms of Deep Tissue Pressure Injury and/or “skin failure”. Early reports of COVID-19 related skin changes included rashes, acral areas of erythema with vesicles or pustules (pseudo-chilblain), other vesicular eruptions, urticarial lesions, maculopapular eruptions, and livedo or necrosis.1-4 The pattern and presentation of skin manifestations with COVID-19 is more than rashes. The purpose of this paper is to guide the wound care clinician in determining if the “purple skin” being seen is a deep tissue pressure injury or a cutaneous manifestation of COVID-19.
Background
The true incidence of COVID-19 related skin injury is unknown at this time; however, NPIAP board members practicing in COVID-19 hotspots and others who are submitting inquiries to the NPIAP Website are reporting purple discoloration of the skin and soft tissue not exposed to pressure. One form is being referred to as a novel phenomenon called “COVID toes” (i.e. deep red or purple appearance of the toes). Clinicians are requesting guidance from NPIAP regarding the differential diagnosis of these injuries from pressure injuries.
Literature Review
Acute respiratory failure and a systemic coagulopathy are critical aspects of the morbidity and mortality seen with severe acute respiratory distress syndrome-associated with coronavirus-2 (SARS-CoV-2).5 Early in the COVID-19 pandemic, it appeared that the primary risk of death from the disease was severe pneumonia followed by a cytokine storm. While much of the pathogenesis of the corona viruses is unknown, there are increasing cases of complications due to hypercoagulation and microvascular occlusion including stroke and pulmonary embolism.6-7 This accelerated clotting process appears to also involve the skin.
COVID-19 enters cells via the angiotensin converting enzyme 2 (ACE2) receptors, which are broadly expressed in vascular endothelium, respiratory epithelium, alveolar monocytes, and macrophages.8 Later in the disease course, COVID-19 replicates in the lower respiratory tract, and generates a secondary viremia, followed by extensive attack against target organs that express ACE2, such as the heart, kidneys, gastrointestinal tract, and vast distal vasculature. This process of viral spreading correlates with the clinical deterioration, mainly taking place around the second week following disease onset.
Magro and colleagues5 reported on five cases with an exceptionally high proportion of aberrant coagulation in severe cases of critically ill adult patients with COVID-19. Their COVID-19 patients exhibited a hypercoagulable state, featuring prolonged prothrombin time, elevated levels of D-dimer and fibrinogen, and near normal activated partial thromboplastin time. Two patients progressed to overt disseminated intravascular coagulation (DIC). DIC has been described before; Tang et al.9 reported that 71.4% of non-survivors and 0.6% of survivors of COVID-19 showed evidence of overt DIC.
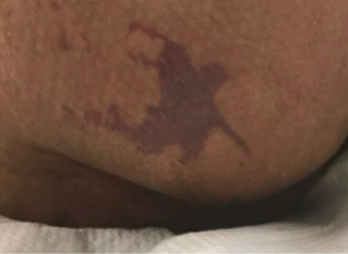
Figure 1 right buttock on day 1
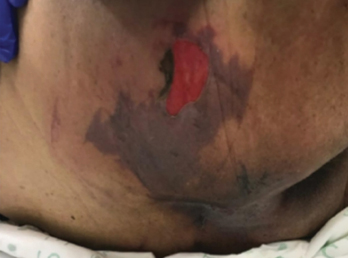
Figure 1 right buttock, sacrum and coccyx on day 3. Photos used with permission of Beaumont Health, Royal Oak MI
Two of the cases with biopsy results from Magro’s5 work are presented here with permission of the author and publisher. They examined skin and lung tissues from five patients with severe COVID-19 characterised by respiratory failure (n=5) and purpuric skin rash (n=3). The purpuric skin lesions showed a pauci-inflammatory thrombogenic vasculopathy, with deposition of Complement 5b-9 and Complement 4d in both grossly involved and normally appearing skin. A pattern of tissue damage consistent with complement-mediated microvascular injury was noted in the lung and/or skin of the five individuals with severe COVID-19. One of the three patients with skin change had a lacey, livedoid rash on the lower extremities; it is not included in this paper.
Cases
Case 1
A 32-year-old male with a medical history of obesity-associated sleep apnea and anabolic steroid use, currently taking testosterone, presented with a 1-week history of fever and cough. He became progressively more dyspneic with fevers to 40°C, ultimately becoming ventilator dependent from acute respiratory failure. Chest x-ray showed bilateral airspace opacities. He had an elevated d-dimer of 1024ng/ml (normal range 0-229) on presentation, which peaked at 2090ng/ml on hospital day 19, and a persistently elevated INR of 1.6-1.9, but a normal PTT and platelet count. Serum complement levels were elevated for CH50 at 177 CAE Units (normal range 60-144), C4 of 42.6 mg/dL (normal range 12-36), and high normal range for C3 at 178 mg/dL (normal range 90-180 mg/dL). Over this patient’s continuing three-plus weeks on ventilator support he completed courses of hydroxychloroquine and azithromycin, followed by the experimental anti-CoV agent remdesivir (5mg/kg IV daily for 10 days).
After only four days on ventilator support, retiform purpura with extensive surrounding inflammation was noted on his buttocks (Fig. 2 A). Skin biopsy showed a striking thrombogenic vasculopathy accompanied by extensive necrosis of the epidermis and adnexal structures, including the eccrine coil (Fig 2b). There was a significant degree of interstitial and perivascular neutrophilia with prominent leukocytoclasia. IHC showed striking and extensive deposition of C5b-9 within the microvasculature (Fig. 2C).
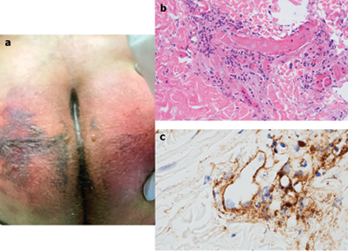
Figure 2
Case 2
A 66-year-old female, with no significant past medical history, was brought to the ED after nine days of fever, cough, diarrhea, and chest pain. She was hypoxemic, with diffuse bilateral patchy airspace opacities, without effusions, on chest x-ray. She was admitted and treated with hydroxychloroquine and prophylactic anticoagulation with enoxaparin. Three days later she became confused, increasingly hypoxemic with rising serum creatinine levels and was intubated. Renal replacement was initiated. On hospital day 10, thrombocytopenia (platelets 128 × 109/L) and a markedly elevated d-dimer of 7030ng/ml, but normal INR and PTT, were noted. The next day dusky purpuric patches appeared on her palms and soles bilaterally (Fig. 3 A). A skin biopsy of one lesion showed superficial vascular ectasia and an occlusive arterial thrombus within the deeper reticular dermis in the absence of inflammation (Fig. 3B). Extensive vascular deposits of C5b-9 (Fig. 3C), C3d, and C4d (Fig. 3D) were observed throughout the dermis, with marked deposition in an occluded artery. A biopsy of normal-appearing deltoid skin also showed conspicuous microvascular deposits of C5b-9 (Fig. 3E). Sedative infusions were discontinued that day, unmasking a comatose state. Computerised tomographic imaging of the head revealed multifocal supra- and infra-tentorial infarctions, with complete infarction of the area supplied by the left middle cerebral artery.
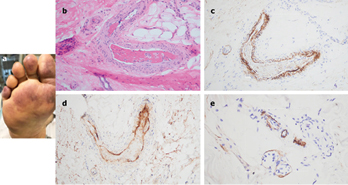
Figure 3
The skin lesions have multiple appearances and patterns associated with microvascular occlusion of vessels in the skin. Some skin lesions can appear with a livedoid or lace-like pattern most commonly on the extremities and others can be more purpuric in nature. Rarely, patients have the appearance of purpura fulminans and frank necrosis or skin infarct. Purpura fulminans is a rare but life-threatening disorder, characterised by hemorrhagic infarction of the skin caused by disseminated intravascular coagulation and dermal vascular thrombosis. This disturbance has traditionally been cited to develop from bacterial endotoxin (typically meningococcus) and mediated by various factors, including the inflammatory cytokines interleukins, interferon and tumor necrosis factor-alpha and consumption of natural anticoagulants. Purpura fulminans has more than 50% mortality from multiple organ dysfunction syndrome.10
From the data available now, at least a subset of sustained, severe COVID-19 may define a type of catastrophic microvascular injury syndrome mediated by activation of complement pathways and an associated procoagulant state.
Clinical guidance for differentiating these injuries from pressure injuries
Purple areas on non-pressure loaded surfaces lack a pressure-shear etiology and should not be classified as pressure injuries. They may resemble purpura fulminans which is consistent with the histopathology noted above and has been reported in other systemic infections. They may also resemble other dermatological conditions associated with microvascular injury and thrombosis such as retiform purpura, livedo reticularis and cutaneous vasculitis.
Purple areas on pressure loaded surfaces (whether prone or supine) require further investigation. Deeper soft tissue may also be damaged because of pressure-shear, particularly in the buttocks, sacrum and coccyx when positioned supine or on the face, knees, and other high-risk body parts when positioned prone. We would recommend that discolored areas on any body surface subjected to pressure loading or shear be palpated to detect differences in tissue consistency and temperature to rule out concomitant deep tissue pressure injury. Theoretically, the same COVID-19 related vascular changes may be occurring in underlying soft tissue (e.g., muscle), rendering those tissues less tolerant of the damaging effects of pressure and shear. The histological specimens presented in the above case studies show clotting. Histological specimens of deep tissue pressure injuries showed frank necrosis of skin, fat, and muscle.11 The histological appearance of Deep Tissue Pressure Injury (DTPI) is not the same as the COVID-19 skin changes.
COVID toes: A deep red appearance may be due to vascular inflammation. A deep purple appearance may be indicative of microthrombi. Patients receiving vasopressors may also develop purple toes; however this is a result of vasoconstriction and ischemia. In the absence of pressure and/or shear, these injuries should not be diagnosed as pressure injuries.
Summary
The purpuric or non-blanchable purple skin lesions seen with COVID-19 are not consistent with DTPI, because they lack pressure induced injury to underlying soft tissue cells and the skin changes likely represent tissue ischemia due to clotting. High risk patients who have been immobile, hypotensive, and hypoxic are at high risk for developing deep tissue pressure injury, however these pressure injuries would be seen on pressure bearing skin and soft tissue. While the term, purpura fulminans, may be correct, other terms have been proposed for this phenomena such as retiform purpura, livedo reticularis and cutaneous vasculitis. Further study is required before the pathophysiologic link of COVID-19 to purpura and other cutaneous manifestations can be fully elucidated. After confirming that the skin change is not due to pressure, wound care providers should not label these skin changes as DTPI, but rather potential skin manifestations from COVID-19.
Research continues to evolve on the entire disease state of COVID-19. Wound care clinicians can aid in the completeness of these investigations by bringing the changes in the skin to the attention of those researchers to understand the pathophysiology. Treatments of these skin-related conditions have also to date not been investigated. In order to enhance our understanding of COVID-19 skin manifestations, consider submitting case reports to the American Academy of Dermatology COVID-19 Dermatology Registry at https://www.aad.org/member/practice/coronavirus/registry.12
This NPIAP White Paper is intended for wide public distribution. Please share with your contacts who may benefit from this information. This content (unless otherwise specified) is copyrighted to the NPIAP
Acknowledgements
The NPIAP gratefully acknowledges the contributions of the following individuals.
Authors: Dr Joyce Black, University of Nebraska Medical Center; Dr. Janet Cuddigan, University of Nebraska Medical Center on behalf of the National Pressure Injury Advisory Panel.
Conflict of Interest
The authors declare no conflicts of interest.
Funding
The authors received no funding for this study.
Reviewers
This White Paper was reviewed by the NPIAP Board of Directors. Feedback on content was provided by Dr Virginia Capasso, Massachusetts General Hospital; Dr Jill Cox, Rutgers University; Dr Barbara Delmore, NYU Langone Health; Dr William Padula, The Leonard D. Schaeffer Center for Health Policy & Economics, University of Southern California; Dr Joyce Pittman, University of Southern Alabama; Dr Lee Ruotsi, Saratoga Hospital Medical Group – Wound Healing; Dr Sharon Sonenblum, Georgia Institute of Technology; and Dr Ann Tescher, Mayo Clinic.
Consultation and guidance
NPIAP appreciates the guidance provided by Dr Ashley Wysong Chairman of the Department of Dermatology at the University of Nebraska Medical Center and Dr Laura Edsberg, Director of the Center for Wound Healing Research at Daemen College in Amherst NY.
Case studies and figures
Figures 2 and 3 used with permission of Dr Jeffrey Laurence of Cornell University. Elsevier, the publisher, grants permission to make all its COVID-19-related research that is available on the COVID-19 resource centre - rights for unrestricted research re-use and analyses in any form or by any means with acknowledgement of the original source.
Photos in Figure 1 were used with permission of Beaumont Health, Royal Oak MI.
Manifestations cutanées avec la COVID-19 : il est possible que la peau et les orteils violacés que vous voyez ne soient pas des lésions de pression des tissus profonds
Joyce Black and Joyce Cuddigan
DOI: https://doi.org/10.33235/wcet.40.2.18-21
Résumé
De nombreux cas de zones de peau purpuriques/violacées et de lésions violacées sur les orteils ont été signalés chez des patients diagnostiqués avec la COVID-19 (SARS-CoV-2) (Figure 1). On demande aux prestataires de soins des plaies si ces lésions cutanées sont des formes de lésions de pression des tissus profonds et/ou d'« insuffisance cutanée ». Les premiers rapports d'altérations cutanées liées à la COVID-19 citaient des éruptions cutanées, des zones acrales d'érythème avec des vésicules ou des pustules (pseudo-engelure), d'autres éruptions vésiculaires, des lésions urticariennes, des éruptions maculopapuleuses et le livedo ou la nécrose.1-4 La forme et la présentation des manifestations cutanées avec la COVID-19 sont bien plus que des éruptions cutanées. Le but de cet article est d'aider le clinicien en soins des plaies à déterminer si la « peau violacée » observée est une lésion de pression des tissus profonds ou une manifestation cutanée de la COVID-19.
Contexte
L'incidence réelle des lésions cutanées liées à la COVID-19 est inconnue pour le moment ; cependant, les membres du conseil d'administration du NPIAP pratiquant dans les hotspots COVID-19 et d'autres qui soumettent des demandes de renseignements sur le site Web du NPIAP signalent une décoloration violacée de la peau et des tissus mous non exposés à une pression. Une des formes constitue un nouveau phénomène appelé « orteils COVID » (c.-à-d. un aspect rouge foncé ou violacé des orteils). Les cliniciens demandent des conseils au NPIAP au sujet du diagnostic différentiel de ces lésions par rapport aux lésions de pression.
Revue de la littérature
L'insuffisance respiratoire aiguë et une coagulopathie systémique sont des aspects critiques de la morbidité et de la mortalité associées au syndrome de détresse respiratoire aiguë sévère lié au coronavirus-2 (SRAS-CoV-2).5 Au début de la pandémie de COVID-19, il semblait que le principal risque de décès résultant de la maladie était une pneumonie sévère suivie d'une tempête de cytokines. Bien que la pathogenèse des virus corona soit largement inconnue, les cas de complications dues à une hypercoagulation et à une occlusion microvasculaire, y compris l'AVC et l'embolie pulmonaire, sont de plus en plus nombreux.6-7 Ce processus de coagulation accéléré semble également impliquer la peau.
La COVID-19 pénètre dans les cellules via les récepteurs de l'enzyme de conversion de l'angiotensine 2 (ACE2), qui sont largement exprimés dans l'endothélium vasculaire, l'épithélium respiratoire, les monocytes alvéolaires et les macrophages.8 Plus tard dans l'évolution de la maladie, la COVID-19 se réplique dans les voies respiratoires inférieures et génère une virémie secondaire, suivie d'une attaque importante contre les organes cibles qui expriment l'ACE2, tels que le cœur, les reins, le tube digestif et la vaste vascularisation distale. Ce processus de propagation virale corrèle avec la détérioration clinique, qui se produit généralement dans la deuxième semaine suivant l'apparition de la maladie.
Magro et ses collègues5 ont signalé cinq cas avec une proportion exceptionnellement élevée de coagulation aberrante dans des cas graves de patients adultes gravement malades atteints de COVID-19 Leurs patients COVID-19 présentaient un état hypercoagulable, avec un temps de prothrombine prolongé, des niveaux élevés de D-dimère et de fibrinogène, et un temps de thromboplastine partiel activé quasi normal. Deux patients ont évolué vers une coagulation intravasculaire disséminée (CID) manifeste. La CID a été décrite précédemment ; Tang et al.9 ont rapporté que 71,4 % des non-survivants et 0,6 % des survivants de la COVID-19 présentaient des signes de CID manifeste.

Figure 1 Fesse droite au jour 1

Figure 1 Fesse droite, sacrum et coccyx au jour 3. Photos utilisées avec la permission de Beaumont Health, Royal Oak MI
Deux des cas ainsi que les résultats de biopsie du travail de5 de Magro sont présentés ici avec la permission de l'auteur et de l'éditeur. Ils ont examiné les tissus cutanés et pulmonaires de cinq patients atteints de COVID-19 sévère caractérisée par une insuffisance respiratoire (n = 5) et une éruption cutanée purpurique (n = 3). Les lésions cutanées purpuriques présentaient une vasculopathie thrombogénique pauci-inflammatoire, avec un dépôt du complément 5b-9 et du complément 4d dans une peau gravement atteinte ainsi que dans une peau d'aspect normal. Un schéma de lésion tissulaire correspondant à une lésion microvasculaire médiée par le complément a été noté dans le poumon et/ou la peau des cinq personnes atteintes de COVID-19 sévère. L'un des trois patients présentant une altération cutanée présentait une éruption livédoïde en dentelle sur les extrémités inférieures ; il n'est pas inclus dans cet article.
Cas
Cas 1
Un homme de 32 ans ayant des antécédents médicaux d'apnée du sommeil liée à l'obésité et d'usage de stéroïdes anabolisants et prenant actuellement de la testostérone, présentait des antécédents de fièvre et de toux depuis 1 semaine. Il est devenu progressivement plus dyspnéique avec jusqu'à 40°C de fièvre, nécessitant pour finir une ventilation assistée en raison d'une insuffisance respiratoire aiguë. Une radiographie du thorax a révélé des opacités des voies aériennes bilatérales. Il présentait un D-dimère élevé de 1024ng/ml (plage normale 0-229), qui a culminé à 2090ng/ml au jour 19 à l'hôpital, et un RIN durablement élevé de 1.6 à 1.9, mais une numération plaquettaire et un TPT normaux. Les taux de complément sérique étaient élevés pour CH50 à 177 unités CAE (plage normale 60-144), C4 à 42,6 mg/dl (plage normale 12-36), et plage normale élevée pour C3 à 178 mg/dl (plage normale 90-180 mg/dl). Pendant les plus de trois semaines que ce patient a passé sous ventilation assistée, il a suivi un traitement à base d'hydroxychloroquine et d'azithromycine, suivis de l'agent expérimental anti-CoV remdésivir (5 mg/kg IV par jour pendant 10 jours).
Après seulement quatre jours sous ventilation assistée, un purpura rétiforme avec une inflammation environnante étendue a été observé sur ses fesses (Fig. 2 A). Une biopsie cutanée a montré une vasculopathie thrombogénique saisissante accompagnée d'une nécrose étendue de l'épiderme et des structures annexielles, y compris la spirale eccrine (Fig.2b). Il y avait un degré significatif de neutrophilie interstitielle et périvasculaire avec une leucocytoclasie proéminente. L'IHC a révélé un dépôt saisissant et étendu de C5b-9 dans la microvasculature (Fig.2C).

Figure 2
Cas 2
Une femme de 66 ans, sans antécédents médicaux significatifs, est arrivée aux urgences après neuf jours de fièvre, de toux, de diarrhée et de douleurs thoraciques. Elle était hypoxémique, avec des opacités diffuses inégales des voies respiratoires bilatérales, sans épanchements, sur la radiographie du thorax. Elle a été admise et traitée par l'hydroxychloroquine et une anticoagulation prophylactique avec l'énoxaparine. Trois jours plus tard, elle est devenue confuse, de plus en plus hypoxémique avec une élévation des taux de créatinine sérique, et a été intubée. Un traitement rénal substitutif a été instauré. Au jour 10 à l'hôpital, une thrombocytopénie (plaquettes 128×109 /l) et un d-dimère significativement élevé de 7030ng/ml, mais un RIN et un TPT normaux, ont été notés. Le lendemain, des taches purpuriques sombres sont apparues bilatéralement sur ses paumes et sur la plante de ses pieds (Fig. 3 A). Une biopsie cutanée d'une lésion a révélé une ectasie vasculaire superficielle et un thrombus artériel occlusif au sein du derme réticulaire plus profond en l'absence d'inflammation (Fig. 3B). Des dépôts vasculaires étendus de C5b-9 (Fig. 3C), C3d et C4d (Fig. 3D) ont été observés à travers le derme, avec un dépôt marqué dans une artère occluse. Une biopsie de peau deltoïde d'aspect normal a également montré des dépôts microvasculaires évidents de C5b-9 (Fig. 3E). Les perfusions sédatives ont été interrompues ce jour-là, révélant un état comateux. Une imagerie tomographique informatisée de la tête a révélé des infarctus sus- et infra-tentoriels multifocaux, avec un infarctus complet de la zone irriguée par l'artère cérébrale moyenne gauche.

Figure 3
Les lésions cutanées ont de multiples aspects et patrons associés à l'occlusion microvasculaire des vaisseaux de la peau. Certaines lésions cutanées peuvent avoir l'aspect d'un patron de type livédoïde ou en dentelle le plus souvent sur les extrémités et d'autres peuvent être de nature plus purpurique. Rarement, ces lésions ont l'aspect d'un purpura fulminans et d'une nécrose franche ou d'un infarctus cutané. Le purpura fulminans est un trouble rare mais potentiellement mortel, caractérisé par un infarctus hémorragique de la peau causé par une coagulation intravasculaire disséminée et une thrombose vasculaire cutanée. Cette perturbation a été traditionnellement considérée comme se développant à partir d'une endotoxine bactérienne (généralement le méningocoque) et médiée par divers facteurs, y compris les cytokines inflammatoires interleukines, l'interféron et le facteur alpha de nécrose tumorale et la consommation d'anticoagulants naturels. Le taux de mortalité du purpura fulminans, due au syndrome de dysfonctionnement d'organes multiples, est de plus de 50 %.10
D'après les données disponibles aujourd'hui, au moins un sous-ensemble de COVID-19 sévère et soutenu peut définir un type de syndrome de lésion microvasculaire catastrophique médié par l'activation des voies du complément et un état procoagulant associé.
Critères cliniques permettant de différencier ces lésions des lésions de pression
Les zones violacées sur les surfaces non soumises à une pression n'ont pas d'étiologie de cisaillement sous pression et ne doivent pas être classées comme des lésions de pression. Elles peuvent ressembler au purpura fulminans, ce qui correspond à l'histopathologie susmentionnée et a été signalé dans d'autres infections systémiques. Elles peuvent également ressembler à d'autres troubles dermatologiques associés à des lésions microvasculaires et à une thrombose tels que le purpura rétiforme, le livédo réticulaire et la vascularite cutanée.
Les zones violacées sur les surfaces sous pression (en position ventrale ou dorsale) nécessitent une exploration plus approfondie. Les tissus mous plus profonds peuvent également être endommagés en raison du cisaillement par pression, en particulier dans les fesses, le sacrum et le coccyx, lorsqu'ils sont en position dorsale ou sur le visage , les genoux et d'autres parties du corps à haut risque lorsqu'ils sont en position ventrale. Nous recommandons que les zones décolorées d'une surface corporelle quelconque soumise à une pression ou à un cisaillement soient palpées afin de détecter les différences de consistance et de température des tissus et exclure les lésions de pression concomitantes des tissus profonds. Théoriquement, les mêmes altérations vasculaires liées à la COVID-19 peuvent se produire dans les tissus mous sous-jacents (p. ex. les muscles), rendant ces tissus moins tolérants des effets nocifs de la pression et du cisaillement. Les échantillons histologiques présentés dans les études de cas ci-dessus montrent une coagulation. Des échantillons histologiques de lésions de pression des tissus profonds ont montré une nécrose franche de la peau, de la graisse et du muscle.11 L'aspect histologique des lésions de pression des tissus profonds (LPTP) n'est pas le même que les altérations cutanées de la COVID-19.
Orteils COVID : Un aspect rouge foncé peut être dû à une inflammation vasculaire. Un aspect violet foncé peut indiquer des microthrombus. Les patients recevant des vasopresseurs peuvent également présenter des orteils violacés ; cela résulte toutefois d'une vasoconstriction et d'une ischémie. En l'absence de pression et/ou de cisaillement, ces lésions ne doivent pas être diagnostiquées comme étant des lésions de pression.
Résumé
Les lésions cutanées violacées purpuriques ou non blanchissables observées avec la COVID-19 ne sont pas compatibles avec une LPTP en raison de l'absence de lésions induites par la pression des cellules des tissus mous sous-jacents et les altérations cutanées représentent probablement une ischémie tissulaire due à la coagulation. Les patients à haut risque qui ont été immobiles, hypotendus et hypoxiques présentent un risque élevé de développer une lésion de pression des tissus profonds, mais ces lésions de pression seraient observées sur la peau et les tissus mous soumis à une pression. Bien que le terme purpura fulminans puisse être correct, d'autres termes ont été proposés pour ce phénomène tels que purpura rétiforme, livédo réticulaire et vascularite cutanée. Une étude plus approfondie est nécessaire avant que le lien physiopathologique de la COVID-19 au purpura et à d'autres manifestations cutanées ne puisse être entièrement élucidé. Après avoir confirmé que l'altération cutanée n'est pas due à la pression, les prestataires de soins des plaies ne doivent pas considérer ces altérations cutanées comme étant des LPTP, mais plutôt des manifestations cutanées potentielles de la COVID-19.
Les recherches continuent d'évoluer sur l'état pathologique complet de la COVID-19. Les cliniciens en soins des plaies peuvent contribuer à l'exhaustivité de ces recherches en portant les altérations de la peau à l'attention de ces chercheurs pour comprendre la physiopathologie. À ce jour, les traitements de ces affections cutanées n'ont pas été étudiés. Afin d'améliorer notre compréhension des manifestations cutanées de la COVID-19, nous vous invitons à soumettre des rapports de cas au COVID-19 Dermatology Registry de l'American Academy of Dermatology à l'adressehttps://www.aad.org/member/practice/coronavirus/registry.12
Ce livre blanc du NPIAP est destiné à être largement diffusé. Merci de le partager avec vos contacts susceptibles de bénéficier de ces informations. Ce contenu (sauf indication contraire) est protégé par le droit d'auteur du NPIAP
Remerciements
Le NPIAP remercie les personnes suivantes de leurs contributions.
Auteurs : Dr Joyce Black, Centre médical de l'Université du Nebraska ; Dr. Janet Cuddigan, Centre médical de l'Université du Nebraska au nom du National Pressure Injury Advisory Panel.
Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts.
Financement
Les auteurs n’ont reçu aucun financement pour cette étude.
Examinateurs
Ce papier blanc a été examiné par le conseil d'administration du NPIAP. Les commentaires sur le contenu ont été fournis par Dr Virginia Capasso, Massachusetts General Hospital ; Dr Jill Cox, Université Rutgers ; Dr Barbara Delmore, NYU Langone Health ; Dr William Padula, The Leonard D. Schaeffer Center for Health Policy & Economics, Université de Californie du Sud ; Dr Joyce Pittman, Université de l'Alabama du Sud ; Dr Lee Ruotsi, Saratoga Hospital Medical Group – Soins des plaies ; Dr Sharon Sonenblum, Georgia Institute of Technology ; et Dr Ann Tescher, Mayo Clinic.
Consultation et recommandations
Le NPIAP apprécie les recommandations du Dr Ashley Wysong, présidente du Département de dermatologie de l'Centre médical de l'Université du Nebraska et du Dr Laura Edsberg, directrice du Center for Wound Healing Research au Daemen College, Amherst NY.
Études de cas et figures
Figures 2 et 3 utilisées avec la permission du Dr Jeffrey Laurence de l'Université Cornell. Elsevier, l'éditeur, accorde la permission de rendre toutes ses recherches liées à la COVID-19 qui sont disponibles sur le centre de ressources COVID-19 - accessibles pour une réutilisation et des analyses de recherche sans restriction sous quelque forme ou par quelque moyen que ce soit en citant la source originale.
Photos de la Figure 1 utilisées avec la permission de Beaumont Health, Royal Oak MI.
Author(s)
Joyce Black
PhD, RN CWCN, FAAN
University of Nebraska Medical Center
Joyce Cuddigan*
PhD, RN, FAAN
University of Nebraska Medical Center on behalf of the National Pressure Injury Advisory Panel
Email jcuddiga@unmc.edu
* Corresponding author
References
- Bouaziz JD et al. Vascular Skin Symptoms in COVID-19: A French Observational Study. J Eur Acad Dermatol Venereol. 2020 Apr 27. https://doi.org/10.1111/jdv.16544. Online ahead of print.
- Guan WJ et al. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med, 2020 Apr 30;382(18):1708-1720. doi: 10.1056/NEJMoa2002032. Epub 2020 Feb 28.
- Recalcati S. Cutaneous Manifestations in COVID-19: A First Perspective. 2020 Mar 26. J Eur Acad Dermatol Venereol. doi: 10.1111/jdv.16387. Online ahead of print.
- Galván Casas C, Català A, Carretero Hernández G, et al. Classification of the cutaneous manifestations of COVID-19: a rapid prospective nationwide consensus study in Spain with 375 cases. Br J Dermatol. 2020.
- Magro C, Mulvey JJ, Berlin D, Nuovo G, Salvatore S, Harp J, Baxter-Stoltzfus A Laurence J. Complement associated microvascular injury and thrombosis in the pathogenesis of severe COVID-19 infection: A report of five cases. Transl Res. 2020 Apr 15. https://doi.org/10.1016/j.trsl.2020.04.007 [Epub ahead of print]
- Oxley, TJ et al. Large-Vessel Stroke as a Presenting Feature of Covid-19 in the Young. New Eng J Med April 28, 2020. doi: 10.1056/NEJMc2009787
- Poissy J. et al. Pulmonary Embolism in COVID-19 Patients: Awareness of an Increased Prevalence. Circulation. 24 Apr 2020. doi: 10.1161/circulationaha.120.047430.
- Cao W and Li T. COVID-19: towards understanding of pathogenesis. Cell Res 30, 367–369 (2020). https://doi.org/10.1038/s41422-020-0327-4.
- Tang N et al. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost. 2020. doi: 10.1111/jth.14768.
- Betrosian AP, Berlet T, Agarwal B. Purpura Fulminans in Sepsis. J Med Sciences 332 (6) 2006, 339-345.
- Edsberg L et al. (2018, March 2) Histology of Deep Tissue Pressure Injury: What can be learned from cadavers. National Pressure Ulcer Advisory Panel Conference, Las Vegas NV.
- American Academy of Dermatology (2020, May 12). COVID-19 Dermatology Registry. https://www.aad.org/member/practice/coronavirus/registry.
