Volume 41 Number 1
Management of nonhealable and maintenance wounds: A systematic integrative review and referral pathway
Geertien C. Boersema, Hiske Smart, Maria G. C. Giaquinto-Cilliers, Magda Mulder, Gregory R. Weir, Febe A. Bruwer, Patricia J. Idensohn, Johanna E. Sander, Anita Stavast, Mariette Swart, Susan Thiart and Zhavandre Van der Merwe
Keywords diabetic foot ulcer, pressure injury, pressure ulcer, venous leg ulcer, atypical wound, interprofessional team, maintenance wound, nonhealable wound, referral
For referencing Boersema GC et al. Management of nonhealable and maintenance wounds: A systematic integrative review and referral pathway. WCET® Journal 2021;41(1):21-32
DOI https://doi.org/10.33235/wcet.41.1.21-32
Abstract
Objective This systematic integrative review aims to identify, appraise, analyze, and synthesize evidence regarding nonhealable and maintenance wound management to guide clinical practice. An interprofessional referral pathway for wound management is proposed.
Data sources An electronic search of Scopus, Web of Science, PubMed, Academic Search Ultimate, Africa-Wide Information, Cumulative Index of Nursing and Allied Health Literature database with Full Text, Health Source: Consumer Edition, Health Source: Nursing/Academic Edition, and MEDLINE was conducted for publications from 2011 to 2019. Search terms included (nonhealable/nonhealing, chronic, stalled, recurring, delayed healing, hard-to-heal) and wound types most associated with nonhealable or maintenance wounds. Published studies were hand searched by the authors.
Study selection Studies were appraised using two quality appraisal tools. Thirteen reviews, six best-practice guidelines, three consensus studies, and six original nonexperimental studies were selected.
Data extraction Data were extracted using a coding framework including treatment of underlying causes, patient-centered concerns, local wound care, alternative outcomes, health dialogue needs, challenges within resource restricted contexts, and prevention.
Data synthesis Data were clustered by five wound types and local wound bed factors; further, commonalities were identified and reported as themes and subthemes.
Conclusions Strong evidence on the clinical management of nonhealable wounds is limited. Few studies describe outcomes specific to maintenance care. Patient-centered care, timely intervention by skilled healthcare providers, and involvement of the interprofessional team emerged as the central themes of effective management of maintenance and nonhealable wounds.
General purpose
To synthesise the evidence regarding nonhealable and maintenance wound management and propose an interprofessional referral pathway for wound management.
Target audience
This continuing education activity is intended for physicians, physician assistants, nurse practitioners, and nurses with an interest in skin and wound care.
Learning objectives/outcomes
After participating in this continuing professional development activity, the participant will apply knowledge gained to:
- Identify the ideas from the authors’ systematic review that could prove useful in understanding nonhealable and maintenance wound management.
- Select evidence-based management strategies for nonhealable and maintenance wound management.
Introduction
Acute wounds follow an organised wound healing sequence and often heal between 3 and 4 weeks. When a wound is still present 4 weeks after wounding, it is defined as a chronic wound1. Many research studies have been conducted on chronic wound management to address the rising demand for effective and affordable care. The healing trajectory of chronic wounds is expected to take 12 weeks2,3. This period may be prolonged if the wound presents with an altered molecular environment, chronic inflammation or fibrosis,4 or uncorrected preexisting systemic factors1.
Patients who present with a wound not responding to conventional treatment are the topic of many best-practice guidelines using the umbrella terms “nonhealing” or “hard-to-heal5,6.” Advanced modalities such as negative-pressure wound therapy (NPWT), ultrasound, laser, platelet-enriched plasma, hyperbaric oxygen (HBO), use of dermal substitutes, and reconstructive surgery are frequently advised as adjunctive intervention. Although appropriate to some wounds, there is a subgroup of patients for whom alternative approaches or endpoints are needed because advanced modalities either failed or are not feasible. This typically is the case when the patient presents with preexisting underlying systemic disease that cannot be controlled, is in need of additional physiologic support (eg, supplementary oxygen, renal dialysis), has difficulty performing activities of daily living without help, experiences financial and/or social difficulties, or lives in a resource-restricted environment without access to advanced care.
The wound bed preparation (WBP) paradigm2,7 guides wound care practitioners to determine wound healing potential as a vital first step of wound assessment. By accounting for both underlying causes and patient-centered concerns, providers can plan for realistic outcomes. The paradigm includes “problem wound” scenarios. Wounds with underlying cause(s) that cannot be corrected are categorised as nonhealable wounds (often attributable to critical ischemia, malignancy, or an untreatable underlying systemic condition)2,7.Wounds with correctable underlying cause(s) in the context of health system challenges (ie, lack of resources, skills, or expertise) or nonoptimal patient factors (ie, smoking, obesity, resistance to change) are categorised as maintenance wounds2,7.
Evidence-based guidance on nonhealable or maintenance wounds is needed. This systematic integrative review aims to identify, appraise, analyse, and synthesise evidence regarding nonhealable and maintenance wound management to guide clinical practice.
Methods
This study was granted ethical exemption (nr. 2019_19.8-5.3) by the University of South Africa Department of Health Studies Research Ethics Committee (no. REC-012714-039) because it did not involve human participants. The research question was: What is known from scientific literature regarding the management of nonhealable and maintenance wounds?
Data Sources
A subject information specialist and two authors of the study conducted a comprehensive literature search using the electronic databases Scopus, Web of Science, PubMed, Academic Search Ultimate, Africa-Wide Information, Cumulative Index of Nursing and Allied Health Literature with Full Text, Health Source: Consumer Edition, Health Source: Nursing/Academic Edition, and MEDLINE. Studies from January 2011 (when the WBP classification of healable, nonhealable, and maintenance wounds2 was established) to September 2019 (the month the search was conducted) were included. The search was not restricted by language or study methodology. Key words included (guideline* or framework* or consensus* or “care pathway*” or paradigm*), (manag* or maint* or treat*), (wound* or ulcer* or injur*) in relation to (nonheal* or chronic or stalled or recur* or “delay* healing” or “hard to heal” or “lower leg*” or “diabetic foot” or pressure or fungating). In addition to the database search, published studies were hand searched by the authors.
Study Selection
Duplicates were removed using the Evidence for Policy and Practice Information Reviewer software (v 4.0; EPPI-Centre, London, England). Titles were screened by one author, followed by independent screening of abstracts by two authors according to selection criteria (Table 1). In addition, a hard-to-heal category was created to facilitate the sorting of studies on stalled nonhealing chronic wounds for wounds that failed to heal but were not yet defined as either a maintenance or nonhealable wound1,4. Two authors independently examined the full-text publications for relevance to the study question and consulted with a third author if they could not reach a consensus.
Publications not meeting the selection criteria (Table 1) were excluded. Investigators also excluded editorials, discussions, corporate education papers, expert opinions not validated by a Delphi process, case studies, case series, and retrospective study designs because of methodology concerns. Non-English articles were excluded if not followed by English translation.
Table 1. Selection criteria
Quality Appraisal
Two-author appraisals were done independently for each study using the Joanna Briggs Institute Critical Appraisal Checklist for Systematic Reviews and Research Syntheses8 and the Crowe Critical Appraisal Tool (v 1.49)for best-practice guidelines, consensus documents, and original studies. A user manual guided the correct use of each quality appraisal tool. The minimum threshold for inclusion for each tool was set at 60% average. A third author was involved if the two scores differed by more than 20%, and the two highest scores were used.
Data Extraction
The final set of included articles was distributed among groups of two or three authors responsible for a wound type and independently co-coding study data. Coding framework topics (Table 2) were collaboratively developed by the research team from the work of authors in the field of study2,7,10-15. Deductive coding focused on extracting relevant content from the results, discussion, and/or conclusion sections of each included article.
Table 2. Coding framework topics

Data Synthesis
Coded sections were clustered into a table to provide a comprehensive overview of evidence by topic and wound type. The teams met in November 2019 to provide a summary of the main findings for each wound type to the whole group. A second analysis was conducted by the three senior authors to identify and describe commonalities (themes) by comparing the extracted information.
Results
The literature search yielded 1,714 records, and the hand search, 36 records. There were 233 relevant titles, with 92 abstracts relevant to the research question. After examining the full-text articles, 61 were excluded. In the remaining 31 studies, three scored less than 60% on the quality appraisal tools. The quality appraisal scores and the strengths and weaknesses of each included study (n = 28) are summarised in Supplemental Table 1 (click here); the flow of the selection process is depicted in Figure 116.
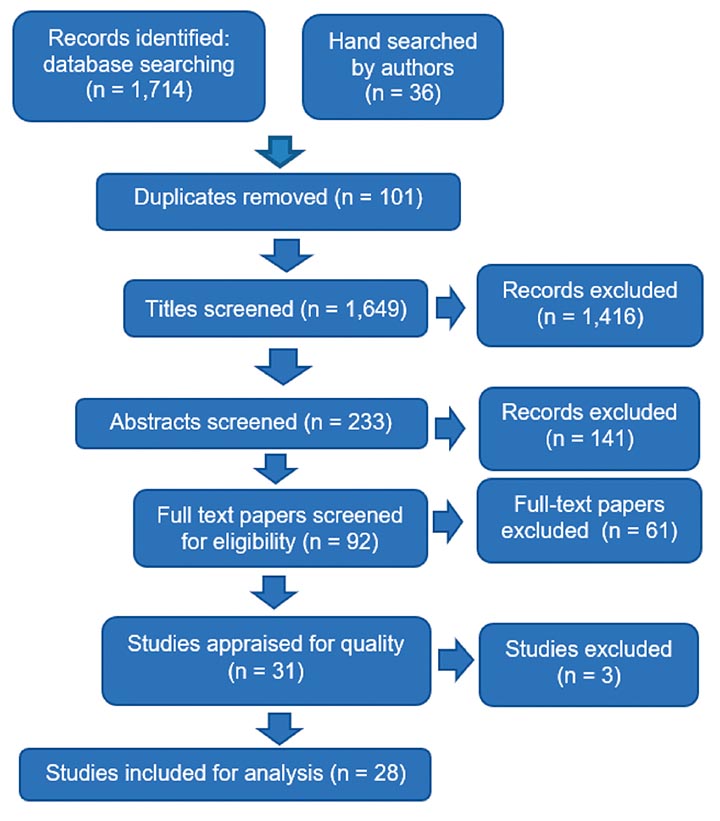
Figure 1. Study selection
Researchers analysed 13 reviews, 6 best-practice guidelines,
3 consensus studies (based on Delphi techniques), and 6 original studies (1 multimethod and 5 nonexperimental, descriptive, and/or correlational quantitative designs). No randomised controlled trials were identified. The characteristics of the included studies are outlined in Supplemental Tables 2 (click here), 3 (click here), and 4 (click here).
Data Synthesis and Theme Identification
This section reports a summary of the extracted data from the included studies for five wound types: malignant fungating wounds (MFWs), lower leg ulcers (LLUs), diabetic foot ulcers (DFUs), pressure injuries (PIs), and atypical wounds. Three articles focused on local wound bed interventions and are summarised separately.
Malignant Fungating Wounds. Two studies on MFWs were included and addressed the effect of topical agents and dressings on quality of life (QoL) for people with MFWs17 and resilience when living with a wound18.
Adderley and Holt17 did not find evidence on the effect of dressings on QoL. Weak evidence suggests the use of 6% miltefosine topical solution or foam dressings with silver on superficial wounds could delay disease progression and reduce malodour17. Evidence supporting the use of honey-coated dressings is not sufficient17.
Ousey and Edwards18 identified pain and fatigue as barriers to maintaining health-related QoL (HRQoL). Practitioners must acknowledge the emotional needs of patients with MFWs who may experience destructive feelings and feelings of avoidance. Loss of bodily function control also impedes the ability to cope with the disease18. Persons living with an MFW want to be informed about physical limitations and psychological consequences (such as sudden hemorrhage), and they appreciate advice on wound management18.
Lower Leg Ulcers. Venous leg ulcers (VLUs) account for up to 80% of all LLUs19, which accounts for the eight articles included on VLUs: two reviews20,21 and one consensus study22 on compression therapy, one review3 and one guideline on the holistic management of VLUs19, one quantitative survey on VLU management24, and one cohort study on sustained behavior change following a client education program25, and one review on cost-effectiveness26. The ninth article, a review by the Canadian Agency for Drugs and Technologies in Health (CADTH), provided evidence on arterial ulcers and mixed etiology ulcers, reporting the lack of current consensus on optimal wound management for mixed arterial-venous ulcers27. All nine studies used the terms nonhealing chronic wounds or wounds with extended time to healing (>12 weeks).
A consensus-based algorithm recommends that ankle-brachial pressure index (ABPI) should be used for its high specificity in detecting peripheral arterial disease (PAD) as an underlying cause in LLUs22 and that significant PAD requires immediate referral to a vascular surgeon19,21,27. However, a survey among nurses identified a significant knowledge-translation gap regarding ABPIs24.
All the evidence supports compression therapy as key to VLU management19-23,27. However, guidelines advise against compression therapy in the presence of significant PAD or pulmonary edema, but do recommend immediate referral to a vascular assessment service19,21,27. The included studies support modified compression carefully monitored by a well-trained clinician for mild PAD (ABPI 0.5-0.8) and standard compression therapy in the absence of PAD19-22.
The included guideline argues that chronic, hard-to-heal VLUs can be transformed into acute wounds by means of debridement once PAD is excluded, malignancy ruled out, and other inflammatory comorbidities accounted for19. All studies supported the WBP paradigm for maintenance wounds7,22,23. When LLUs are not healing as expected, providers should reassess the patient at least every 12 weeks for other potential causes and repeat the ABPI measurement20,22. Further, NPWT is not indicated for healable VLUs over topical modalities; it is effective for securing a skin graft in hard-to-heal wounds, but not as a modality on its own23. There is substantial evidence on the efficacy of electrical stimulation as an adjunctive modality in VLU to achieve healing progress23.
Venous leg ulcers significantly impact social and physical functioning; pain is particularly prominent in the ulcerative phase or with secondary infection19. Only one of the included studies recommends dressings for local pain relief, but concludes that compression therapy remains the key to pain control19.
Effective VLU management requires sustained behavior change19,22,25. Patient education should include leg health, emphasis on regular activity, the role of pharmaceuticals, the importance of compression, optimal positioning of legs during rest, promotion of a healthy diet and adequate hydration, and skin care. Nonadherence to modifying lifestyle factors may lead to extended healing times or nonhealing22,25. Positive behavior change was achieved via e-learning in a prospective single sample cohort study25. Recurrence of VLU is common, and strong evidence supports use of stockings as primary prevention to improve the aching and itching associated with venous insufficiency22.
Carter26 reviewed the cost-effectiveness of new or evidence-based intervention systems versus routine care to guide decision-making. One study in this review (an unblinded randomised controlled trial of moderate evidence strength) concluded that four-layer compression bandages resulted in faster healing versus the control group (standard care) with consequent financial cost savings. However, they also reported compression bandage application skill to be a key factor in achieving positive VLU outcomes26. Another key message from this review was that a multidisciplinary team managing VLUs achieved faster healing by 36.5 days in the intervention group with consequent financial cost savings.
Diabetic Foot Ulcers. These ulcers are classified as hard-to-heal wounds; expected healing trajectories are often missed because of patient factors or healthcare resource limitations28. One systematic review discussing NPWT for DFUs,29 one original study30, and four guidelines31-34 were included in this portion of the review. The guidelines and original study addressed holistic management of DFUs with one discussing HBO33.
Two guidelines recommended that PAD should be assessed to establish healability because DFUs can become nonhealable wounds with inadequate perfusion, rendering those patients unsuitable candidates for revascularisation31,32. Such nonhealable wounds might result in amputation because of increased infection risk30.
Glycemic control of and nutrition support for diabetes to enhance wound healing are supported by strong levels of evidence.31 When addressing the cause of DFUs, plantar pressure redistribution (offloading) is the key to success32. The guidelines further recommended that DFUs should be debrided to reduce biologic load and risk of infection when adequate blood supply is present31,32. In hard-to-heal wounds with inadequate perfusion, debridement should be conservative31. Infection should be treated systemically, especially with a positive probe-to-bone test. When surgery is not an option, systemic antibiotic treatment should be prolonged (6 to 8 weeks)31. There is insufficient evidence for topical antibiotics in these wounds, and their use is associated with increased local and systemic microbial resistance31. Dressing choice should take into consideration the condition of the wound and surrounding skin32.
One guideline suggests strong evidence for HBO as adjunctive therapy for the treatment of Wagner stage 3 DFUs33. Further, a review by the CADTH concluded that DFUs treated with NPWT showed significantly reduced ulcer areas, healing time, and the need for secondary/major amputation when compared with DFUs not treated with NPWT29. These modalities may be indicated in hard-to-heal DFUs but are not recommended for maintenance of nonhealable wounds.
The general review from Ousey and Edwards18 also included three quantitative studies that reported on the psychological effects of living with a DFU. They found a lower HRQoL with a decline in physical and social functioning among a group of 35 patients living with a DFU compared with a group of 15 persons with diabetes without a wound. Further, depression was related to development of the first DFU among a group of 333 participants and was a persistent risk factor for mortality and presented a 33% increased risk of amputations18.
Clinicians attending to patients with DFUs must have the necessary skills and equipment to accurately and holistically assess and treat them31. All of the guidelines included in this study strongly recommend an interprofessional approach to treating DFUs because of their complex nature31-34. These teams should address factors such as patient-centered concerns, access to care, financial limitations, and foot and self-care31,32.
Pressure Injuries. Four studies were included in this portion of the review: one cross-sectional observational design,35 two reviews36,37, and one guideline38. Gelis et al37 stressed that PIs are “not a chronic disease but rather a complication in cases of immobility,” suggesting that PI evolution and prognosis correlate with the contexts in which such injuries and wounds occur; that is, PIs may evolve as maintenance or nonhealing wounds according to the underlying pathology. Guihan and Bombardier35 concluded that the complex underlying comorbidities among persons with slow healing and stage 3 and 4 PIs require an interprofessional approach. Early and aggressive management of acute and chronic PIs may prevent or change the development cycle of hard-to-heal or maintenance wounds over time35.
Fujiwara et al38 included studies focusing on diagnosis and treatment of stage 1-4 PIs. They support pressure and shear forces as underlying causes and strongly recommend pressure relief with position changes every 2 hours and the use of appropriate pressure-relieving mattresses (based on strong evidence). Pain control is an important aspect of patient-centered concerns to improve the HRQoL of patients with PIs. Some evidence in the review suggests pressure-relieving mattresses and specific wound dressings (eg, soft silicone, alginate, and hydrogels). Evidence for the use of nonsteroidal anti-inflammatory and/or psychotropic drugs exists, but is weak.38 Their recommendation to debride devitalised tissue was for healable wounds where the cause could be corrected. For hard-to-heal, maintenance, or nonhealable PIs, no recommendation on debridement could be drawn from the evidence. Surgery may remain as an option once the underlying cause can be corrected and the condition of the patient improved.
In the presence of deep infection, a systemic antibiotic is suggested using a positive bacterial culture from the wound bed to guide treatment38. In addition, signs of persistent inflammation in the periwound area, pyrexia, an increased white blood cell count, or worsening of the inflammatory reaction should be addressed38. A comprehensive assessment of the patient, the wound bed, and periwound area should be conducted to diagnose wound infection. The CADTH did not find evidence to support specific wound dressings and stated: “one dressing will be as good as the other36.”
Gelis et al37 reviewed evidence on patients with chronic neurologic impairment at risk of PI and suggested continuing therapeutic education for older adults, persons with spinal cord injuries, and others at risk37. They also recommend several pedagogic models for use based on the learning style of the specific patient and involving the circle of care in prevention. Providers should support patient self-management of multiple chronic conditions, because several comorbidities often occur simultaneously in persons with slow-healing PIs35.
Atypical Wounds. Four articles were included in this part of the review. These referred to Buruli ulcer, hidradenitis suppurativa, epidermolysis bullosa, and vasculitis- and autoimmune-associated wounds. These wounds present with unusual signs and symptoms and/or locations and do not heal within 4 to 12 weeks, and often the underlying conditions are difficult to manage in clinical practice.
In a Ghanaian Buruli ulcer prospective observational study, the authors found that earlier wound closure (less than 12 weeks) was more likely in primary healthcare settings compared with secondary settings despite a lack of resources, staff incompetency, and high patient loads39. This was attributed to earlier presentation, smaller wounds, better nutrition status, better patient adherence to treatment, and intact social support. Wound closure failure occurred in primary healthcare in the presence of underlying complications, such as osteomyelitis, squamous cell carcinoma, chronic lymphedema, and infection. In the secondary healthcare setting, nutrition deficiency, venous and arterial insufficiency, lymphedema, and malignant deterioration were associated with impaired wound healing. This was mostly attributable to poor hygiene and deficient skills and resources leading to recurrent wound infection. Failure to heal became predictable between weeks 2 and 4.
Alavi et al40 explored hidradenitis suppurativa patient-centered concerns related to sexuality. This observational two-legged cross-sectional study found both men and women with HS experience negative impacts on their QoL. Men experienced sexual performance issues and women experienced sexual distress because of the location of these painful exuding lesions.
The epidermolysis bullosa study reports an expert consensus of recommendations for practice41. The main recommendations included active interventions to control persistent inflammation leading to malignancy; an interprofessional team approach to assessment, identification, and management of underlying factors; delicate management of blisters; optimisation of nutrition status with attention to albumin and hemoglobin levels; use of healing trajectory indicators to predict healing potential; and the importance of a skin edge biopsy in recalcitrant wounds to rule out squamous cell carcinoma.
Shanmugam et al42 review the evaluation and management of hard-to-heal wounds associated with vasculitis and autoimmune etiologies. Wounds not responding to local care and appropriate vascular intervention may have an underlying vasculitis or autoimmune disorder present. An interprofessional team can facilitate the required underlying systemic disease investigation. Skin graft failure should prompt high provider suspicion of vasculitis; an edge biopsy may be helpful to confirm diagnosis42.
Local Wound Bed Factors. Three articles addressed local wound bed issues prevalent in problem wounds regardless of type and addressed malodour, the nonhealing spiral, and maggot debridement therapy (MDT).
Akhmetova et al43 aimed to summarise studies focusing on odour control in chronic wound management. Five control measures with substantial evidence were identified. Metronidazole gel was most extensively studied; five studies reported it reduced odour, exudate, and pain. Topical silver (and silver sulfadiazine use) was included because it is not deemed an antibiotic but rather an antimicrobial agent. Four studies supported its use because of its antimicrobial and anti-inflammatory effect on the wound bed. Charcoal is known to absorb gases, bacteria, and liquids; one study supported its use. Medical-grade honey for odour control was mentioned in three studies, and research on topical cadexomer iodine use in VLUs reported odour reduction as a secondary outcome43.
Schultz et al44 published a guideline for the identification and treatment of chronic nonhealing wounds. “Nonhealing” is not defined in the article in terms of a time frame or underlying cause, but in general as chronic wounds not healing in a timely fashion despite optimal intervention. A key recommendation is the initial use of aggressive debridement in combination with topical antiseptics and systemic antibiotics followed by a step-down approach until healing44. A consensus statement indicates that this recommendation is relevant for aggressive management of wounds that might have some potential for healing44. Further research is required to evaluate the effectiveness, validity, reliability, and reproducibility of the algorithms available to diagnose and treat biofilm. Further exploration into different wound types will be necessary to provide a clear guide on definite signs and symptoms associated with biofilm in the wound bed; for example, ischemic ulcers may not manifest the same signs and symptoms of biofilm because of the lack of blood flow44.
Sherman45 provided a summary of MDT and recommendations on when to initiate it as modality. The author concluded that MDT has three broad actions: debridement, disinfection, and tissue growth stimulation, although the focus was on debridement. The chemical debridement occurs via alimentary secretions and excretions containing digestive enzymes, inhibiting microbial growth and biofilm formation. Further, this action induces maturation of monocytes and neutrophils from proinflammatory cells into their angiogenic phenotype, which could lift the wound out of the inflammatory phase45. Therefore, MDT is of value as an adjunctive modality in addressing local wound bed factors in hard-to-heal wounds to counteract stalled wound growth, but it is contraindicated in dry wounds because maggots need moisture to survive.
Discussion
Despite the proposed definition/classification of wounds into healable, maintenance, and nonhealable by Sibbald et al2, very few authors used those terms in publications, a concern also voiced by Olsson et al46. Common terms were “chronic,” “nonhealing,” “slow healing,” or “atypical,” all with limited reference to wound duration, healing time, or alternative outcomes. This led to authors’ extraction of available data elements into an additional “hard-to-heal” category, allowing for inclusion where healing time or the influence of underlying causes was not described. However, despite the lack of clear definitions, this study identified similarities in management across the different hard-to-heal wound types, and these commonalities encompass the following themes (Table 3).
Table 3. Main themes and subthemes identified
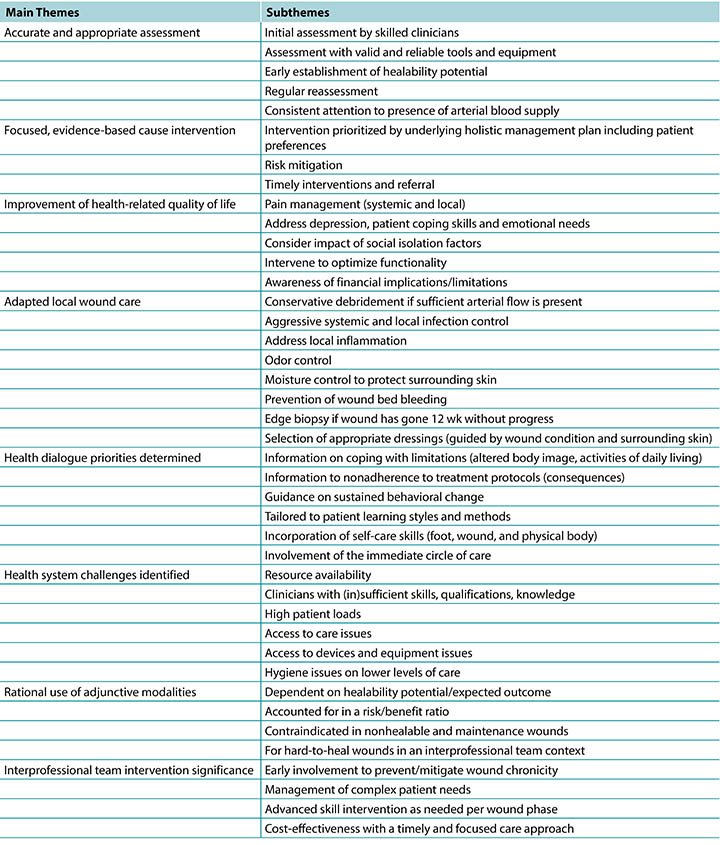
Accurate and Appropriate Assessment. Early identification of underlying conditions and skillful attention to existing patient and system factors are essential to promote healing at an optimal rate (decreasing 30% in size within 4 weeks)10. Providers must determine healability (within the first 12 weeks) and use valid assessment tools. A systematic and comprehensive approach to history taking, physical examination, and laboratory investigations to reach a clear diagnosis improves outcomes39. Lack of adequate blood supply remains a major underlying cause present in most nonhealing or maintenance wounds and should be assessed regularly19,21,24,27. Depression is strongly associated with the onset of DFUs, and if left untreated, increases subsequent amputation and mortality risk18. Providers should actively screen and prioritise intervention and appropriate treatment for depression in patients with long-duration wounds18.
Focused, Evidence-Based Cause Intervention. Adequate cause identification and initiating corrective interventions to mitigate underlying causes early in the wound healing sequence could prevent wound conversion. The substantial list of direct deficits that add to local wound deterioration and chronicity includes osteomyelitis, squamous cell carcinoma, chronic lymphedema, and wound infection39, and these conditions require intervention or aggressive control to recreate and establish wound bed progression or stability. A hard-to-heal, stalled, or atypical wound should prompt an edge biopsy including the reticular dermis and subcutaneous tissue to assess pathology41. Providers should strive for early classification of nonhealable wounds when underlying causes cannot be effectively treated or are deemed uncorrectable47, with an accompanying shift in focus toward palliation and HRQoL.
Improve HRQoL. Chronic wounds lead to personal, financial, social, psychosocial, and sexual adaptations beyond simply coping with the effects of the wound. Critically, depression is associated with increased morbidity and mortality in patients with diabetes18. The benefits of consistent attention to pain management are a key finding in most of the evidence reviewed18, and multiple pain types may require polypharmacy interventions. It is vital to recognise and manage patient-centered concerns with a focus on improving HRQoL by maintaining activities of daily living and addressing ambulation48, self-reliance18, knowledge translation, and self-esteem17,18. Patient-centered concerns should be prioritised as highly as underlying causes because the impact of wound healing on HRQoL may be hidden or dormant, which in turn negatively impacts healing.
Adapted Local Wound Care. Appropriate interventions regarding tissue, infection and inflammation, moisture, and edge management remain a cornerstone of local wound care. Different debridement approaches may range from careful and conservative removal of devitalised tissue31,32, puncturing blisters and not deroofing41, to surgical debridement to remove biofilm or advance edges39,44. These authors recommend careful conservative debridement, which should be performed only by skilled practitioners if adequate arterial blood supply is present to support the wound bed and surrounding tissue.
Aggressive infection control should include actions to treat and prevent recurring superficial and deep wound infection44,45,48, including assessment of the patient’s vital and metabolic status, wound bed, and periwound area. The topical application of any antibiotic preparation such as ointments or creams (eg, gentamicin, fusidic acid, mupirocin) is not recommended by the International Wound Infection Institute because of global concern about antibiotic resistance and the subsequent systemic resistance49. Addressing malodour with appropriate dressings is recommended43 and may be included after a risk analysis on the additional moisture added to a wound bed. Providers and patients should keep nonhealing and maintenance wound beds as dry as possible23 to preserve tissue22; to protect the edges against trauma41, bacterial invasion44, and moisture-related skin breakdown18,26; and prevent further tissue loss or wound expansion. These results provided clear guidance on the edge effect; wound area reductions less than 20% to 40% in 2 to 4 weeks could be a reliable predictor of nonhealing39. That is, providers should not wait 12 weeks without wound edge progress to intervene.
Health Dialogue Priorities. Patients need to understand their situation fully and be guided to self-reliance18. Education should accommodate different learning styles with attention to modifiable risk factors (smoking, poor glycemic control, and resistance to lower limb compression). Health dialogue is strongly associated with financial cost savings26. eLearning platforms (mobile phone, social media) are powerful patient education tools and facilitate health dialogue that incorporates the patient’s care circle in a culturally and patient-appropriate manner. Online learning strategies that include pressure redistribution, nutrition supplementation, skincare, and incontinence care could effectively incorporate the family into the care circle with cost containment as an additional outcome26. The value of targeted patient learning may be further enhanced via the financial benefits of DFU prevention26.
Health System Challenges. This review identified sets of professional skills, or the lack thereof, which impact wound-related outcomes and healing times. These include assessment (ABPI in LLUs22,DFU grading33) and correct clinical management (application of compression bandages20-22, initial foot pressure redistribution32). Lack of provider expertise is an often-overlooked iatrogenic factor in hard-to-heal or stalled wounds24 that leads to loss of valuable time, additional wound complications, and late referral to an interprofessional team for advanced intervention. Recognizing limitations is vital in early referral to a skilled practitioner/interprofessional team.
However, in resource-restricted or rural settings, interprofessional teams may not be feasible, emphasizing the importance of wound care knowledge for all providers. In fact, limited resources leading to delayed healing is a factor often overlooked in the literature. The review by Carter26 supports the cost-effectiveness of guideline-driven versus standard care for chronic wounds. Early identification of maintenance wounds may prevent the prolonged use of resources despite the lack of progress22,26, which could in turn positively impact treatment-associated costs for both the patient and healthcare system.
In the future, the prevention of skin breakdown regardless of wound etiology may be the highest priority of any healthcare professional because of the direct cost saving associated with skin-protective strategies7,22,26. This is evident in PI and DFU prevention, where early intervention and prevention are frequently measured by key performance indicators (incidence and prevalence data50)to save skin from repetitive breakdown and prevent amputations51.
Rational Use of Adjunctive Modalities. In the hands of the interprofessional team, last-resort adjunctive wound therapies (NPWT, HBO, flap/graft surgery, electrostimulation, MDT)23,27,33,45 have the best potential to promote healing when patient issues, wound history, and resource limitations are accounted for in hard-to-heal wounds. However, most advanced modalities are not a viable adjunctive option for maintenance and nonhealable wounds with dry23 or bleeding wound beds18 and may not represent the most optimal use of resources22,26.
Interprofessional Team Approach Significance. The most important finding (present in the majority of the included studies) was that an early interprofessional approach can facilitate correct interventions and wound management
options19,21,26,27,31,32,35,41,42. This timely and accurate intervention may prevent downward spirals into chronicity.18,31-33,35,41,42 Assessment, diagnosis, and appropriate interventions for slow healing or stalled wounds often require advanced wound care skills19-22,27 more readily available in an interprofessional team. Evidence supports this intervention as cost-effective compared with standard routine care over prolonged periods of time26.
Despite this strong recommendation, the interprofessional team is often a last resort and utilised too late to break the cycle of slow healing and chronicity. Patients are vital members of the interprofessional team because they dictate the potential of the team to achieve set outcomes, especially if faced with prolonged healing22. However, clinicians may still struggle to determine when it is appropriate to consult with an interprofessional team. For this reason, the authors developed an interprofessional referral pathway using time- and wound-related markers that may indicate the appropriate time to involve the interprofessional team (Figure 2).
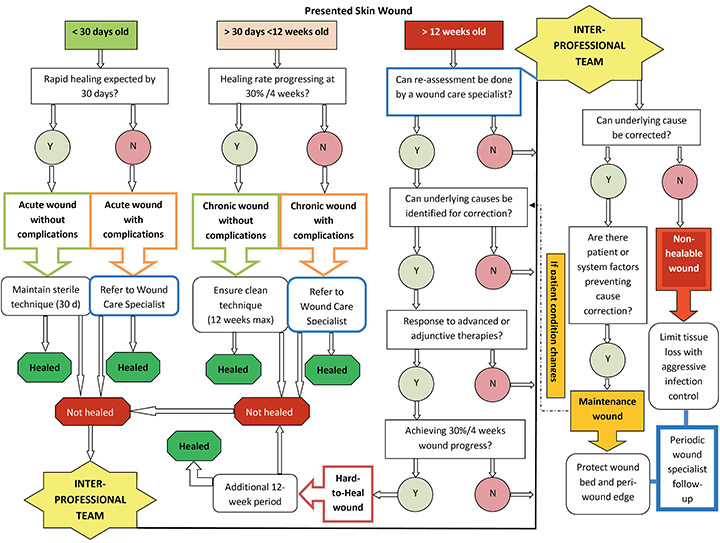
Figure 2. Interprofessional team referral pathway for patients with wounds
The clinician should enter the pathway according to the relevant “time since wounding” in the top horizontal line. Once that box is identified, the decision-making process follows a vertical line downward to an outcome and time frame for that outcome to be achieved. Note that the interprofessional team takes responsibility for diagnosis of maintenance and nonhealable wounds to ensure that no wound lands or remains in those categories unnecessarily.
Definitions: Wound care specialist: a healthcare professional (doctor/nurse/allied health) with additional training and specialization in wound care, part of a functioning interprofessional team. Sterile technique: prevention of bacterial contamination and infection spread by adherence to strict sterile procedural protocol when performing wound-related procedures. Sterile-to-sterile rules apply. Clean technique: also known as nonsterile technique: involves hand washing, a clean environment with a clean field set, clean gloves, and sterile instruments aiming to prevent direct contamination of supplies or material. Acute and chronic wound risk factors: impaired vascular supply, underlying systemic disease, trauma, immune compromise, extensive tissue loss, exposed bone or tendon, patient adherence to treatment issues, patient in need of additional intervention(s), lack of appropriate resources/skills. Advanced/adjunctive therapies: maggot debridement, negative pressure, and hyperbaric oxygen therapies; electrostimulation; ultrasound; laser; platelet-enriched plasma; surgical closure; interventional radiology, etc. Healed outcome—acute wound healed within 30 days; chronic wound healed within 12 weeks (followed 30%/4 weeks’ edge advancement); allowance for additional 12-week period(s) for hard-to-heal wounds as determined by the interprofessional team.
Note: Nonhealable wound could also be a first entry point without any flow through the rest of the pathway, with confirmation from the interprofessional team.
Interprofessional Referral Pathway
In doing this review, the research team realised that hard-to-heal wounds follow a typical sequence of events attributable to provider, patient, payer, policy, or persistent uncorrected underlying factors52,53 rather than being a wound type per se. Essentially, hard-to-heal wounds have specific needs and are an additional category in the process of determining healability:
- healable: where healing occurs predictably according to expected time frames;
- hard-to-heal: where slow, stalled, or nonhealing wounds are in need of additional assessment or care modalities;
- maintenance: where health dialogue for lifestyle modification becomes more important than achieving a wound healing outcome;
- nonhealable: where aggressive attention to local infection prevention and preservation against further tissue loss is needed and no wound healing outcome can be achieved.
It became clear from compiling data elements into themes that prompt identification of wound healing failure is a priority. The complex factors affecting wound healing should be routinely reassessed, and providers should maintain a flexible perspective on the healing trajectory. In current literature, the exact expected time to healing (ie, a defined cutoff point when wounds are classified as maintenance wounds) remains elusive. With this in mind, the research team proposes a referral pathway with specific time frames to help health professionals in decision-making (Figure 2). Timely referral could lead to optimal intervention in the vital early period of wounding and promote available adjunctive interventions when positive outcomes can still be attained.
The pathway proposes that hard-to-heal wounds be granted another 12 weeks of optimal wound care to achieve healing (30% decrease rate within 4 weeks). If the wound does not progress despite advanced team intervention, it can then be classified as a maintenance wound (where patient or system issues prevent cause correction)2. Reassessment and management by wound care specialists fully trained to apply current best evidence and well-positioned on an interprofessional wound care team are critical. The proposed additional 12 weeks of aggressive interprofessional management should be further explored and tested in future research. These studies could consider interventions with or without advanced wound care modalities because such modalities may not be available in resource-restricted contexts.
Limitations
This review was limited to studies from 2011 to 2019 and only considered evidence prior to 2011 if it was included in the selected studies. Guidelines not identified through the search could be of value if the guidelines clearly and transparently report the identification and appraisal of the evidence. Further, key words for specific atypical wounds were not included in the search. This was done to extract studies focused on maintenance and nonhealable wound interventions as well as to limit the yield. However, studies on atypical wounds were hand searched by the research team but had small sample sizes and paucity of evidence.
This study did not include case studies or case series, but the investigators acknowledge that multiple case studies could be the highest level of evidence available in challenging cases or environments. A future review of existing case studies/case series could prove of value to identify current practicalities when dealing with this subgroup of wounds. Studies on the efficacy and cost-effectiveness of local wound bed innovations in resource-restricted contexts would be a valuable contribution and more so if conducted in real-life clinical settings and in collaboration with academics and practitioners.
Conclusions
Active patient involvement in the care process is critical to manage a maintenance or nonhealable wound and achieve acceptable outcomes. Once a nonhealable, maintenance, or hard-to-heal wound is identified, not only should a full reassessment be made by a skilled team of healthcare professionals, but focused clinical interventions such as an edge biopsy or advanced vascular assessment should confirm the wound classification and guide patient and provider decision-making.
Evidence on the exact clinical management of maintenance and nonhealable wounds is insufficient to guide practice. The most common findings were the need for early diagnosis and prompt treatment within the first 12 weeks, comprehensive identification of underlying factors delaying healing, and early involvement of the interprofessional team. An interprofessional referral pathway was developed to incorporate an additional 12-week intervention period in hard-to-heal or late-referral wounds.
If wound assessment reveals a maintenance or nonhealable wound, it is important to realise that this diagnosis will impact the patient on physical, personal, interpersonal, social, and financial levels. The main priority should be to preserve patient integrity in these arenas with a focused patient-centered intervention. Long-term pain management should be prioritised. Further, patient preparation with focused health dialogue is vital to identify and facilitate life adaptations needed and cope with this diagnosis. The incorporation of newly learned or adapted skills into the patient’s own activities of daily living will positively impact QoL. Patients with maintenance, nonhealing, and hard-to-heal wounds should take responsibility for their own self-care where possible and for as long as possible.
Practice pearls
- A wound that does not heal at a rate of 30% per week should be reassessed by an interprofessional team sooner rather than later; do not wait 12 weeks before referral.
- Hard-to-heal wounds, or those that stall over time, may benefit from an interprofessional team’s intervention that may include reassessment and a change of treatment strategy to address the underlying cause of the wound.
- Once diagnosed with a maintenance wound, patients need to be empowered with sufficient knowledge and social/family support to maintain activities of daily living and self-care as long as possible.
- The holistic management of both maintenance and nonhealable wounds involves shifting focus away from achieving wound outcomes and toward addressing patient-centered concerns such as pain management and odour control.
- The clinical focus for nonhealable wounds should include aggressive topical infection control to achieve tissue stability, preservation of existing stable dry tissue, and prevention of wound edge expansion.
Acknowledgments
The authors thank Brinsley Davids, Liezl Naude, Michelle Second, Valana Skinner, and Liz Morris, who participated in the initial phase of the study; Dr Alwiena Blignaut from North West University for her guidance with the methodology and critical review of this article; Dr Annatjie Van der Wath for providing training on principles of qualitative analysis; and Dr Nick Kairinos for critical review of this article. The Wound Healing Association of Southern Africa sponsored the subscription fee for the Evidence for Policy and Practice Information Reviewer software. No other project funding was received. The author, faculty, staff, and planners, including spouses/partners (if any), in any position to control the content of this CME/CNE activity have disclosed that they have no financial relationships with, or financial interests in, any commercial companies relevant to this educational activity.
Supplemental digital content is available for this article. Direct URL citations appear in the printed text and are provided in the HTML and PDF versions of this article on the journal’s website (www.ASWCjournal.com).
To earn CME credit, you must read the CME article and complete the quiz online, answering at least 7 of the 10 questions correctly. This continuing educational activity will expire for physicians on December 31, 2022, and for nurses March 4, 2022. All tests are now online only; take the test at http://cme.lww.com for physicians and www.nursingcenter.com for nurses. Complete CE/CME information is on the last page of this article.
Conflict of Interest
The authors declare no conflicts of interest.
Funding
The authors received no funding for this study.
Prise en charge des plaies non cicatrisables et des plaies chroniques: Un enquête systématique intégrative et un parcours de soins
Geertien C. Boersema, Hiske Smart, Maria G. C. Giaquinto-Cilliers, Magda Mulder, Gregory R. Weir, Febe A. Bruwer, Patricia J. Idensohn, Johanna E. Sander, Anita Stavast, Mariette Swart, Susan Thiart and Zhavandre Van der Merwe
DOI: https://doi.org/10.33235/wcet.41.1.21-32
Résumé
Objectif Cette enquête systématique intégrative a pour but d’identifier, d’évaluer, d’analyser et de synthétiser les données probantes concernant la prise en charge des plaies non cicatrisables et chroniques afin de guider la pratique clinique. Un parcours de soins interprofessionnel pour la prise en charge des plaies est proposé.
Sources des données Une recherche électronique dans Scopus, Web of Science, PubMed, Academic Search Ultimate, Africa-Wide Information, Cumulative Index of Nursing et Allied Health Literature database avec Full Text, Health Source: Consumer Edition, Health Source: Nursing/Academic Edition, et MEDLINE a été consulté pour les publications de 2011 à 2019. Les termes de recherche comprenaient (non cicatrisable/non-cicatrisante, chronique, bloquée, récidivante, cicarisation retardée, difficile à cicatriser) et les types de plaies les plus couramment associés aux plaies non cicatrisables ou chroniques. Les auteurs ont recherché manuellement les études publiées.
Sélection des études Les études ont été évaluées à l’aide de deux outils d’évaluation de la qualité. Treize enquêtes, six guides de bonnes pratiques, trois études de consensus et six études originales non expérimentales ont été sélectionnés.
Extraction des données Les données ont été extraites à l’aide d’un manuel de codage comprenant le traitement des causes sous-jacentes, les difficultés liées au patient, le traitement local des plaies, les résultats alternatifs, les besoins de dialogue en matière de santé, les défis dans des contextes de ressources limitées et la prévention.
Synthèse des données Les données ont été regroupées en fonction de cinq types de plaies et des facteurs locaux du lit des plaies; en outre, les points communs ont été identifiés et présentés sous forme de thèmes et de sous-thèmes.
Conclusions Les données probantes sur la prise en charge clinique des plaies non cicatrisables sont limitées. Peu d’études décrivent des résultats spécifiques aux plaies chroniques. Les soins centrés sur le patient, l’intervention en temps utile de prestataires de soins qualifiés et l’implication de l’équipe interprofessionnelle sont apparus comme les thèmes centraux de la prise en charge efficace des plaies chroniques et non cicatrisables.

Objectif général
Synthétiser les données probantes concernant le traitement des plaies non cicatrisables et chroniques et proposer un parcours de soins interprofessionnel pour la prise en charge des plaies.
Public ciblé
Cette activité de formation continue est destinée aux médecins, aux assistants, aux infirmières et infirmiers praticiens et aux infirmières et infirmiers concernés par les soins de la peau et des plaies.
Objectifs/résultats d’apprentissage
Après avoir participé à cette activité de formation professionnelle continue, le participant appliquera les connaissances acquises pour:
- Identifier les concepts de l’enquête systématique des auteurs qui pourraient s’avérer utiles pour comprendre la prise en charge des plaies non cicatrisables et des plaies chroniques.
- Choisir des stratégies de prise en charge fondées sur des données probantes pour la prise en charge des plaies non cicatrisables et chroniques.
Introduction
Les plaies aiguës suivent une séquence de cicatrisation organisée et cicatrisent souvent ent 3 à 4 semaines. Lorsqu’une plaie est toujours présente 4 semaines après la blessure, elle est définie comme une plaie chronique1. De nombreuses recherches ont été menées sur la prise en charge des plaies chroniques afin de répondre à la demande croissante de soins efficaces et abordables. La trajectoire de guérison des plaies chroniques prend généralement 12 semaines2,3. Cette période peut être prolongée si la plaie présente un environnement moléculaire altéré, une inflammation ou une fibrose chronique,4 ou bien des facteurs systémiques préexistants non corrigés1.
Les patients qui présentent une plaie qui ne répond pas aux traitementx conventionnelx font l’objet de nombreuses guides de bonnes pratiques utilisant les termes généraux de “non-cicatrisation” ou “difficile à cicatriser5,6.“ Les modalités avancées telles que la thérapie des plaies par pression négative (NPWT), les ultrasons, le laser, le plasma enrichi en plaquettes, l’oxygène hyperbare (HBO), l’utilisation de substituts dermiques et la chirurgie reconstructive sont souvent conseillés comme intervention complémentaire. Bien que cela soit approprié pour certaines plaies, il existe un sous-groupe de patients pour lesquels d’autres approches ou critères d’évaluation sont nécessaires lorsque les modalités avancées ont échoué ou ne sont pas réalisables. C’est généralement le cas lorsque le patient présente une maladie systémique sous-jacente préexistante qui ne peut être contrôlée, qu’il a besoin d’un soutien physiologique supplémentaire (par exemple, apport d’oxygène, dialyse rénale), qu’il a des difficultés à accomplir les activités de la vie quotidienne sans aide, qu’il rencontre des difficultés financières et/ou sociales, ou qu’il vit dans un environnement aux ressources limitées sans accès à des soins avancés.
Le paradigme de la préparation du lit de la plaie (WBP)2,7 guide les praticiens du soin des plaies pour déterminer le potentiel de cicatrisation de la plaie, première étape essentielle de l’évaluation de la plaie. En tenant compte à la fois des causes sous-jacentes et des difficultés du patient, les prestataires peuvent planifier l’obtention de résultats réalistes. Le paradigme comprend des scénarios de “blessures à problèmes”. Les plaies dont la ou les causes sous-jacentes ne peuvent être corrigées sont classées dans la catégorie des plaies non cicatrisables (souvent attribuables à une ischémie critique, à une tumeur maligne ou à une affection systémique sous-jacente non traitable)2,7. Les plaies dont la ou les causes sous-jacentes peuvent être corrigées dans le contexte des difficultés du système de santé (c’est-à-dire le manque de ressources, de compétences ou d’expertise) ou des facteurs non optimaux du patient (à savoir le tabagisme, l’obésité, la résistance au changement) sont classées dans la catégorie des plaies chroniques2,7.
Des lignes directrices fondées sur des données probantes concernant les plaies non cicatrisables ou chroniques sont nécessaires. Cette enquête systématique intégrative a pour but d’identifier, d’évaluer, d’analyser et de synthétiser les données concernant la prise en charge des plaies non cicatrisables et chroniques afin de guider la pratique clinique.
présente 4 semaines après la blessure, elle est définie comme une plaie chronique1. De nombreuses recherches ont été menées sur la prise en charge des plaies chroniques afin de répondre à la demande croissante de soins efficaces et abordables. La trajectoire de guérison des plaies chroniques prend généralement 12 semaines2,3. Cette période peut être prolongée si la plaie présente un environnement moléculaire altéré, une inflammation ou une fibrose chronique,4 ou bien des facteurs systémiques préexistants non corrigés1.
Les patients qui présentent une plaie qui ne répond pas aux traitementx conventionnelx font l’objet de nombreuses guides de bonnes pratiques utilisant les termes généraux de “non-cicatrisation” ou “difficile à cicatriser5,6.“ Les modalités avancées telles que la thérapie des plaies par pression négative (npwt), les ultrasons, le laser, le plasma enrichi en plaquettes, l’oxygène hyperbare (hbo), l’utilisation de substituts dermiques et la chirurgie reconstructive sont souvent conseillés comme intervention complémentaire. Bien que cela soit approprié pour certaines plaies, il existe un sous-groupe de patients pour lesquels d’autres approches ou critères d’évaluation sont nécessaires lorsque les modalités avancées ont échoué ou ne sont pas réalisables. C’est généralement le cas lorsque le patient présente une maladie systémique sous-jacente préexistante qui ne peut être contrôlée, qu’il a besoin d’un soutien physiologique supplémentaire (par exemple, apport d’oxygène, dialyse rénale), qu’il a des difficultés à accomplir les activités de la vie quotidienne sans aide, qu’il rencontre des difficultés financières et/ou sociales, ou qu’il vit dans un environnement aux ressources limitées sans accès à des soins avancés.
Le paradigme de la préparation du lit de la plaie (wbp)2,7 guide les praticiens du soin des plaies pour déterminer le potentiel de cicatrisation de la plaie, première étape essentielle de l’évaluation de la plaie. En tenant compte à la fois des causes sous-jacentes et des difficultés du patient, les prestataires peuvent planifier l’obtention de résultats réalistes. Le paradigme comprend des scénarios de “blessures à problèmes”. Les plaies dont la ou les causes sous-jacentes ne peuvent être corrigées sont classées dans la catégorie des plaies non cicatrisables (souvent attribuables à une ischémie critique, à une tumeur maligne ou à une affection systémique sous-jacente non traitable)2,7. Les plaies dont la ou les causes sous-jacentes peuvent être corrigées dans le contexte des difficultés du système de santé (c’est-à-dire le manque de ressources, de compétences ou d’expertise) ou des facteurs non optimaux du patient (à savoir le tabagisme, l’obésité, la résistance au changement) sont classées dans la catégorie des plaies chroniques2,7.
Des lignes directrices fondées sur des données probantes concernant les plaies non cicatrisables ou chroniques sont nécessaires. Cette enquête systématique intégrative a pour but d’identifier, d’évaluer, d’analyser et de synthétiser les données concernant la prise en charge des plaies non cicatrisables et chroniques afin de guider la pratique clinique.
Méthodes
Cette étude a bénéficié d’une exemption éthique (n° 2019_ 19.8-5.3) du comité d’éthique de la recherche du département des études de santé de l’Université d’Afrique du Sud (n° REC-012714-039) car elle n’impliquait pas de participants humains. La question de recherche était la suivante: Que sait-on de la littérature scientifique concernant la prise en charge des plaies non cicatrisables et chroniques?
Sources des données
Un spécialiste de l’information sur le sujet et deux auteurs de l’étude ont effectué une recherche documentaire exhaustive en utilisant les bases de données électroniques Scopus, Web of Science, PubMed, Academic Search Ultimate, Africa-Wide Information, Cumulative Index of Nursing et Allied Health Literature avec Full Text, Health Source: Consumer Edition, Health Source: Nursing/Academic Edition, et MEDLINE. Les études réalisées entre janvier 2011 (date à laquelle la classification WBP des plaies cicatrisables, non cicatrisables et chroniques2 a été établie) et septembre 2019 (mois où la recherche a été menée) ont été incluses. La recherche n’a pas été limitée par la langue ou la méthodologie. Les mots clés comprenaient (guideline* or framework* or consensus* or “care pathway*” or paradigm*), (manag* or maint* or treat*), (wound* or ulcer* or injur*) en relation avec (nonheal* or chronic or stalled or recur* or “delay* healing” or “hard to heal” or “lower leg*” or “diabetic foot” or pressure or fungating). Outre la recherche dans la base de données, les auteurs ont effectué une recherche manuelle des études publiées.
Sélection des études
Les doublons ont été supprimés à l’aide du logiciel Evidence for Policy and Practice Information Reviewer (v 4.0; EPPI-Centre, Londres, Angleterre). Les titres ont été contrôlés par un auteur, suivi d’un examen indépendant des résumés par deux auteurs selon les critères de sélection (tableau 1). En outre, une catégorie “difficile à cicatriser” a été créée pour faciliter le tri des études sur les plaies chroniques non cicatrisables bloquées pour les plaies qui n’ont pas cicatrisé mais qui n’ont pas encore été définies comme plaies chroniques ou non cicatrisables1,4. Deux auteurs ont examiné indépendamment les publications en texte intégral pour vérifier leur pertinence par rapport à la question de l’étude et ont consulté un troisième auteur s’ils ne parvenaient pas à un consensus.
Tableau 1. Critères de sélection
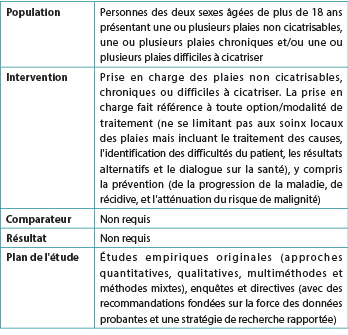
Les publications ne répondant pas aux critères de sélection (tableau 1) ont été exclues. Les chercheurs ont également exclu les éditoriaux, les discussions, les documents de formation d’entreprise, les avis d’experts non validés par un processus Delphi, les études de cas, les séries de cas et les études rétrospectives, pour des raisons de méthodologie. Les articles non anglophones ont été exclus s’ils n’étaient pas suivis d’une traduction en anglais.
Évaluation de la qualité
Deux auteurs ont évalué chaque étude de manière indépendante en utilisant la Joanna Briggs Institute Critical Appraisal Checklist for Systematic Reviews and Research Syntheses8 et le Crowe Critical Appraisal Tool (v 1.49) pour les guides de bonnes pratiques, les documents de consensus et les études originales. Un manuel d’utilisation guidait l’utilisation correcte de chaque outil d’évaluation de la qualité. Le seuil minimal d’inclusion a été fixé à 60% de moyenne pour chaque outil. Un troisième auteur était impliqué si les deux notes différaient de plus de 20%, et les deux notes les plus élevées ont été utilisées.
Extraction de données
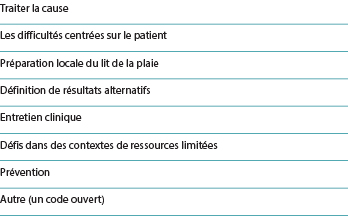
La totalité de l’ensemble d’articles inclus a été réparti entre des groupes de deux ou trois auteurs responsables d’un type de plaie et co-codant indépendamment les données de l’étude. Les thèmes du manuel de codage (tableau 2) ont été élaborés collectivement par l’équipe de recherche à partir des travaux des auteurs du domaine d’étude2,7,10-15. Le codage déductif s’est concentré sur l’extraction du contenu pertinent des sections résultats, discussion et/ou conclusion de chaque article inclus.
Tableau 2. Thèmes du manuel de codage
Synthèse des données
Les sections codées ont été regroupées dans un tableau afin de fournir un aperçu complet des données par thème et par type de plaie. Les équipes se sont réunies en novembre 2019 pour fournir à l’ensemble du groupe un résumé des principaux résultats pour chaque type de plaie. Une deuxième analyse a été menée par les trois auteurs principaux pour identifier et décrire les points communs (thèmes) en comparant les informations extraites.
Résultats
La recherche documentaire a donné lieu à 1 714 enregistrements, et la recherche manuelle, à 36 enregistrements. Il y avait 233 titres pertinents, avec 92 résumés pertinents pour la question de recherche. Après examen des articles en texte intégral, 61 articles ont été exclus. Dans les 31 études restantes, trois ont obtenu un score inférieur à 60% sur les outils d’évaluation de la qualité. Le déroulement du processus de sélection est illustré à la figure 116.
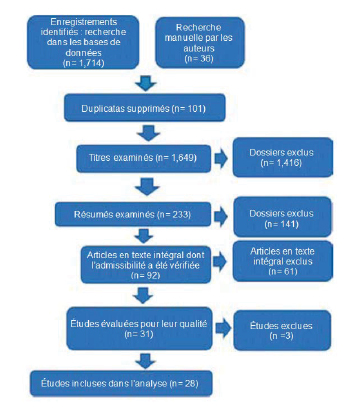
Figure 1. Sélection des études
Les chercheurs ont analysé 13 enquêtes, 6 guides de bonnes pratiques, 3 études de consensus (basées sur des techniques Delphi) et 6 études originales (1 étude multiméthode et 5 études quantitatives non expérimentales, descriptives et/ou corrélationnelles). Aucuns essais contrôlés randomisés n’ont été identifiés.
Synthèse des données et identification des thèmes
Cette section présente un résumé des données extraites des études incluses pour cinq types de plaies: les plaies fongiques malignes (MFW), les ulcères de la jambe inférieure (LLU), les ulcères du pied diabétique (UDP), les lésions dues à la pression (PI) et les plaies atypiques. Trois articles se concentraient sur les interventions locales sur le lit des plaies et sont résumés séparément.
Plaies fongiques malignes. Deux études sur les MFW ont été incluses et ont porté sur l’effet des agents topiques et des pansements sur la qualité de vie (QV) des personnes souffrant de MFW17 et sur la résilience lorsqu’on vit avec une plaie18.
Adderley et Holt17 n’ont pas trouvé de données probantes sur l’effet des pansements sur la qualité de vie. De rares données probantes suggèrent que l’utilisation d’une solution topique de miltefosine à 6% ou de pansements en mousse à l’argent sur les plaies superficielles pourrait retarder la progression de l’affection et réduire la mauvaise odeur17. Les données probantes appuyant l’utilisation de pansements enduits de miel ne sont pas suffisantes17.
Ousey et Edwards18 ont identifié la douleur et la fatigue comme des obstacles au maintien de la qualité de vie liée à la santé (QVLS). Les praticiens doivent reconnaître les besoins émotionnels des patients souffrants de MFW qui peuvent éprouver des pulsions destructrices et un sentiment d’exclusion. La perte de contrôle des fonctions corporelles entrave également la capacité à faire face à la maladie18. Les personnes vivant avec une MFW veulent être informées des limitations physiques et des conséquences psychologiques (comme une hémorragie soudaine), et elles apprécient les conseils sur la prise en charge des plaies18.
Ulcères de la jambe inférieure. Les ulcères de jambe veineux (UJV) représentent jusqu’à 80% de tous les UJV19, ce qui explique les huit articles inclus sur les UJV: deux enquêtes 20,21 et une étude de consensus22 sur la thérapie de compression, une enquête3 et une directive sur la prise en charge holistique des UJV19, une enquête quantitative sur la gestion des UJV24, une étude de cohorte sur le changement accompagné de comportement à la suite d’un programme d’éducation des clients25, et une enquête sur le rapport coût-efficacité26. Le neuvième article, une revue de l’Agence canadienne des médicaments et des technologies de la santé (ACMTS), a fourni des données probantes sur les ulcères artériels et les ulcères d’étiologie mixte, signalant l’absence de consensus actuel sur le traitement optimal des plaies pour les ulcères artériels-veineux mixtes27. Les neuf études ont toutes utilisé les termes de plaies chroniques non cicatrisées ou de plaies dont le délai de cicatrisation est prolongé (> 12 semaines).
Un algorithme consensuel recommande l’utilisation de l’indice de pression brachiale à la cheville (IPCA) en raison de sa haute spécificité pour la détection des maladies artérielles périphériques (MAP) comme cause sous-jacente dans les LLU22 et rappelle qu’une MAP significative nécessite une orientation immédiate vers un chirurgien vasculaire19,21.27. Cependant, une enquête menée auprès des infirmières et infirmiers a mis en évidence un écart important entre les connaissances et leur application concernant les ABPI24.
Tout indique que la thérapie par compression est essentielle à la prise en charge de l’UJV19-23,27. Cependant, les directives déconseillent la thérapie par compression en présence d’une MAP ou d’un œdème pulmonaire significatif, mais recommandent l’orientation immédiate vers un service d’évaluation vasculaire19,21,27. Les études incluses soutiennent la compression modifiée soigneusement surveillée par un clinicien bien formé pour une MAP légère (ABPI 0,5-0,8) et la thérapie de compression standard en l’absence de MAP19-22.
La directive incluse soutient que les UJV chroniques et difficiles à cicatriser peuvent être transformées en plaies aiguës par débridement une fois la MAP exclue, la malignité écartée et les autres comorbidités inflammatoires prises en compte19. Toutes les études ont validé le paradigme du WBP pour les plaies chroniques7,22,23. Lorsque les LLU ne cicatrisent pas comme prévu, les prestataires doivent réévaluer le patient au moins toutes les 12 semaines pour rechercher d’autres causes potentielles et répéter la mesure de l’ABPI20,22. De plus, la TPN n’est pas indiquée pour les UJV cicatrisables par rapport aux modalités topiques; elle est efficace pour fixer une greffe de peau dans les plaies difficiles à cicatriser, mais pas comme modalité à part entière23. Il existe des données probantes substantielles de l’efficacité de la stimulation électrique en tant que modalité d’appoint dans l’UJV pour obtenir des progrès en matière de cicarisation23.
Les ulcères veineux de la jambe ont un impact important sur le fonctionnement social et physique; la douleur est particulièrement importante dans la phase ulcéreuse ou en cas d’infection secondaire19. Une seule des études incluses recommande les pansements pour soulager de la douleur locale, mais conclut que la thérapie par compression reste la clé du contrôle de la douleur19.
Une prise en charge efficace de l’UJV nécessite un changement de comportement durable19,22,25. L’éducation du patient doit inclure la santé des jambes, l’importance d’une activité régulière, le rôle des produits pharmaceutiques, l’importance de la compression, le positionnement optimal des jambes au repos, la promotion d’une alimentation saine et d’une hydratation adéquate, et les soins de la peau. La non-adhésion aux facteurs de modification du mode de vie peut conduire à des délais de cicatrisation prolongés ou à la non-cicatrisation 22,25. Un changement positif de comportement a été obtenu grâce à l’apprentissage en ligne dans une étude de cohorte prospective à échantillon unique25. La récidive de l’UJV est fréquente, et des données probantes solides appuient l’utilisation de bas comme prévention primaire pour améliorer les douleurs et les démangeaisons associées à l’insuffisance veineuse22.
Carter26 a examiné le rapport coût-efficacité des nouveaux systèmes d’intervention ou fondés sur des données probantes par rapport aux soins courants pour guider la prise de décision. L’une des études de cette enquête (des essais contrôlés randomisés non anonymisés dont la force probante est modérée) a conclu que les bandages de compression à quatre couches permettaient une cicatrisation plus rapide par rapport au groupe témoin (soins standard), ce qui a permis des économies financières. Cependant, ils ont également signalé que la compétence en matière d’application des bandages de compression était un facteur clé pour obtenir des résultats positifs en matière d’UJV26. Un autre message clé de cette étude est qu’une équipe multidisciplinaire prenant en charge les UJV a obtenu une cicarisation plus rapide de 36,5 jours dans le groupe d’intervention, avec des économies financières conséquentes.
Ulcères du pied diabétique. Ces ulcères sont classés comme des plaies difficiles à cicatriser; les trajectoires de cicatrisation attendues sont souvent manquées en raison de facteurs liés au patient ou de la limitation des ressources de santé28. Une enquête systématique discutant de la TPN pour les UDP29, une étude originale30 et quatre directives31-34 ont été incluses dans cette partie de l’enquête. Les directives et l’étude originale abordent la prise en charge holistique des UDP, dont l’une traite de l’OHB33.
Deux directives recommandent que les MAP soient évaluées pour établir le potentiel de cicatrisation, car les UDP peuvent devenir des plaies non cicarisables en cas de perfusion inadéquate, ce qui rend ces patients inadaptés à la revascularisation31,32. Ces plaies non cicatrisables peuvent entraîner une amputation en raison du risque accru d’infection30.
Le contrôle de la glycémie et le soutien nutritionnel des diabétiques pour améliorer la cicatrisation des plaies sont validés par des niveaux de données probantes solides.31 Lorsque l’on s’attaque à la cause des UDP, la redistribution de la pression plantaire (décharge) est la clé du succès32. Les directives recommandent également de déterge les UDP pour réduire la charge biologique et le risque d’infection en présence d’une irrigation sanguine adéquate31,32. Dans les plaies difficiles à cicatriser avec une perfusion inadéquate, le débridement doit être conservateur31. L’infection doit être traitée par voie systémique, surtout en cas de test positif de la sonde à l’os. Lorsque la chirurgie n’est pas une option, le traitement antibiotique systémique doit être prolongé (6 à 8 semaines)31. Les directives de l’utilité des antibiotiques topiques dans ces plaies sont insuffisantes, alors que leur utilisation est associée à une augmentation de la résistance microbienne locale et systémique31. Le choix du pansement doit prendre en compte l’état de la plaie et de la peau périlésionnelle32.
Une directive suggère des données probantes solides en faveur de l’OHB comme thérapie d’appoint pour le traitement des UDP de stade 3 de Wagner33. De plus, une étude de l’ACMTS a conclu que les UDP traités par TPN présentaient une réduction significative de l’étendue des ulcères, du temps de cicarisation et de la nécessité d’une amputation secondaire/majeure par rapport aux UDP non traités par TPN29. Ces modalités peuvent être indiquées dans les UDP difficiles à cicatriser mais ne sont pas recommandées pour la prise en charge des plaies non cicatrisables.
L’ général d’Ousey et Edwards18 comprenait également trois études quantitatives portant sur les effets psychologiques de la vie avec un UDP. Ils ont constaté une baisse de la QVLS avec un déclin du fonctionnement physique et social dans un groupe de 35 patients vivant avec un UDP comparé à un groupe de 15 personnes diabétiques sans plaie. En outre, la dépression était liée à l’apparition du premier UDP dans un groupe de 333 participants, constituait un facteur de risque persistant de mortalité et présentait un risque d’amputation accru de 33%18.
Les cliniciens qui s’occupent des patients souffrants d’un UDP doivent avoir les compétences et l’équipement nécessaires pour les évaluer et les traiter de manière précise et holistique31. Toutes les directives incluses dans cette étude recommandent fortement une approche interprofessionnelle du traitement des UDP en raison de leur nature complexe31-34. Ces équipes devraient se pencher sur des facteurs tels que les difficultés propres au patient, l’accès aux soins, les contraintes financières, et les soins personnels et des pieds31,32.
Blessures par pression. Quatre études ont été incluses dans cette partie de l’enquête: un plan d’observation transversal35, deux enquêtes36,37 et une directive38. Gelis et al.37 ont souligné que les blessures par pression (IP) ne sont “pas une maladie chronique mais plutôt une complication de la sédentarité”, suggérant que l’évolution et le pronostic des IP sont en corrélation avec les contextes dans lesquels ces blessures et plaies apparaissent; autrement dit, les IP peuvent évoluer comme des plaies chroniques ou non cicatrisables selon la pathologie sous-jacente. Guihan et Bombardier35 ont conclu que les comorbidités sous-jacentes complexes chez les personnes présentant une cicatrisation lente et des IP de stade 3 et 4 nécessitent une approche interprofessionnelle. Une prise en charge précoce et agressive des IP aiguës et chroniques peut prévenir ou modifier le cycle de développement des plaies difficiles à cicatriser ou chroniques au fil du temps35.
Fujiwara et al.38 ont inclus des études portant sur le diagnostic et le traitement des IP de stade 1 à 4. Ils affirment que la pression et les forces de cisaillement sont des causes sous-jacentes et recommandent fortement de soulager la pression par des changements de position toutes les deux heures et l’utilisation de matelas appropriés pour soulager la pression (sur la base de solides données probantes). Le contrôle de la douleur est un aspect important des difficultés propres au patient pour améliorer la QVLS des patients avec IP. Certains éléments de l’enquête suggèrent des matelas anti-pression et des pansements spécifiques (par exemple, silicone souple, alginate et hydrogels). Des données probantes de l’utilisation d’anti-inflammatoires non stéroïdiens et/ou de médicaments psychotropes existent, mais sont faibles.38 Leur recommandation de déterger les tissus dévitalisés concernait les plaies cicatrisables dont la cause peut être corrigée. Pour les IP difficiles à cicatriser, chroniques ou non cicatrisables, aucune recommandation sur le détersion n’a pu être tirée données. La chirurgie peut rester une option lorsque la cause sous-jacente peut être corrigée et l’état du patient amélioré.
En présence d’une infection profonde, un antibiotique systémique est suggéré en utilisant une culture bactérienne positive du lit de la plaie pour guider le traitement38. En outre, les signes d’inflammation persistante dans la zone péri-lésionnelle, la pyrexie, l’augmentation du nombre de globules blancs ou l’aggravation de la réaction inflammatoire doivent être pris en compte38. Une évaluation complète du patient, du lit de la plaie et de la zone péri-lésionnelle doit être réalisée pour diagnostiquer l’infection de la plaie. L’ACMTS n’a pas trouvé d’éléments probants à l’appui de pansements spécifiques et a établi que:“une pansement sera aussi bon que l’autre36”
Gelis et al.37 ont passé en revue les données probantes sur les patients souffrant d’une déficience neurologique chronique à risque d’IP et ont suggéré une éducation thérapeutique continue pour les personnes âgées, les personnes souffrant de lésions de la moelle épinière et les autres personnes à risque37. Ils recommandent également plusieurs modèles pédagogiques à utiliser en fonction du mode d’apprentissage de chaque patient et en impliquant le cercle de soins dans la prévention. Les prestataires doivent soutenir l’autogestion par le patient de plusieurs affections chroniques, car plusieurs comorbidités sont souvent présentes simultanément chez les personnes atteintes d’IP à cicatrisation retardée35.
Plaies atypiques. Quatre articles ont été inclus dans cette partie de l’enquête. Il s’agissait de l’ulcère de Buruli, de l’hidradenitis suppurativa, de l’épidermolyse bulleuse et des plaies associées à la vasculite et à l’auto-immunité. Ces plaies présentent des signes et des symptômes et/ou des localisations inhabituels et ne cicatrisent pas dans les 4 à 12 semaines, et les conditions sous-jacentes sont souvent difficiles à prendre en charge dans la pratique clinique.
Dans une étude observationnelle prospective sur l’ulcère de Buruli au Ghana, les auteurs ont constaté que la fermeture précoce de la plaie (moins de 12 semaines) était plus probable dans les établissements de soins de santé primaires que dans les établissements secondaires, malgré le manque de ressources, l’incompétence du personnel et le nombre élevé de patients39. Ce résultat a été attribué à une présentation plus précoce, à des plaies plus petites, à un meilleur état nutritionnel, à une meilleure adhésion du patient au traitement et à un soutien social intact. L’échec de la fermeture des plaies s’est produit dans les soins de santé primaires en présence de complications sous-jacentes, telles que l’ostéomyélite, le carcinome spinocellulaire, le lymphœdème chronique et l’infection. Dans le cadre des soins de santé secondaires, une carence nutritionnelle, une insuffisance veineuse et artérielle, un lymphœdème et une détérioration maligne ont été associés à une déficience de la cicatrisation. Cette situation peut être principalement attribuée à une mauvaise hygiène ainsi qu’à des compétences et des ressources insuffisantes, ce qui entraîne une infection récidivante des plaies. L’échec de la guérison est devenu prévisible dans les semaines 2 à 4.
Alavi et al.40 ont exploré les difficultés liées aux patients atteints d’hidradenitis suppurativa en matière de sexualité. Cette étude observationnelle transversale à deux volets a révélé que les hommes et les femmes atteints d’HS subissent des impacts négatifs sur leur qualité de vie. Les hommes ont connu des problèmes de performance sexuelle et les femmes des troubles sexuels en raison de la localisation de ces lésions exsudatives douloureuses.
L’étude sur l’épidermolyse bulleuse rend compte d’un consensus d’experts sur les recommandations pour la pratique41. Les principales recommandations incluent: interventions actives pour contrôler l’inflammation persistante menant à la malignité; approche d’une équipe interprofessionnelle pour l’évaluation, l’identification et la prise en charge des facteurs sous-jacents; prise en charge délicate des ampoules; optimisation de l’état nutritionnel en prêtant attention aux taux d’albumine et d’hémoglobine; utilisation d’indicateurs de trajectoire de cicatrisation pour évaluer le potentiel de cicatrisation; et importance d’une biopsie berges de la peau dans les plaies récalcitrantes pour exclure un carcinome épidermoïde.
Shanmugam et al.42 passent en revue l’évaluation et la prise en chare des plaies difficiles à cicatriser associées à des étiologies vasculaires et auto-immunes. Les plaies qui ne répondent pas aux soins locaux et à une intervention vasculaire appropriée peuvent présenter une vasculite ou un trouble auto-immune sous-jacent. Une équipe interprofessionnelle peut faciliter la recherche requise de la maladie systémique sous-jacente. L’échec de la greffe de peau doit inciter le soignant à soupçonner une vasculite; une biopsie des berges peut être utile pour confirmer le diagnostic42.
Facteurs locaux du lit de la plaie. Trois articles traitent des problèmes locaux du lit de la plaie, qui sont courants dans les plaies à problèmes, quel qu’en soit le type, et abordent la question des mauvaises odeurs, de la spirale de non-cicatrisation et de la thérapie de détersion par asticots (MDT).
Akhmetova et al.43 ont cherché à résumer les études portant sur le contrôle des odeurs dans le traitement des plaies chroniques. Cinq mesures de contrôle avec des preuves substantielles ont été identifiées. Le gel de métronidazole a été le plus étudié; cinq études ont rapporté qu’il réduisait l’odeur, l’exsudat et la douleur. L’argent topique (et l’utilisation de la sulfadiazine d’argent) a été inclus car il n’est pas considéré comme un antibiotique mais plutôt comme un agent antimicrobien. Quatre études ont soutenu son utilisation en raison de son effet antimicrobien et anti-inflammatoire sur le lit de la plaie. Le charbon de bois est connu pour absorber les gaz, les bactéries et les liquides; une étude a confirmé son utilisation. Le miel de qualité médicale pour le contrôle des odeurs a été mentionné dans trois études, et une recherche sur l’utilisation topique de l’iode de cadexomer dans les UJV mantionné la réduction des odeurs comme résultat secondaire43.
Schultz et al.44 ont publié une directive pour l’identification et le traitement des plaies chroniques non cicatrisantes. Le terme “non-cicatrisation” n’est pas défini dans l’article en termes de délai ou de cause sous-jacente, mais de manière générale comme une plaie chronique qui ne cicatrise pas en temps voulu malgré une intervention optimale. Une recommandation clé est l’utilisation initiale d’une détersion agressive en combinaison avec des antiseptiques topiques et des antibiotiques systémiques, suivie d’une approche progressive jusqu’à la cicatrisation44. Une déclaration de consensus indique que cette recommandation est pertinente pour la prise en charge agressive des plaies qui pourraient avoir un certain potentiel de cicatrisation44. Des recherches supplémentaires sont nécessaires pour évaluer l’efficacité, la validité, la fiabilité et la reproductibilité des algorithmes disponibles pour diagnostiquer et traiter le biofilm. Une exploration plus approfondie des différents types de plaies sera nécessaire pour fournir un ligne directrice claire sur les signes et symptômes définitifs associés au biofilm dans le lit de la plaie; par exemple, les ulcères ischémiques peuvent ne pas présenter les mêmes signes et symptômes de biofilm en raison de l’absence de flux sanguin44.
Sherman45 a fourni un résumé de la MDT et des recommandations sur le moment où il faut l’initier comme modalité. L’auteur a conclu que la MDT a trois grandes actions: la détersion, la désinfection et la stimulation de la croissance tissulaire, bien que l’accent ait été mis sur la détersion. La détersion chimique se fait par le biais des sécrétions alimentaires et des excrétions contenant des enzymes digestives, inhibant la croissance microbienne et la formation de biofilms. De plus, cette action induit la maturation des monocytes et des neutrophiles, qui passent de cellules pro-inflammatoires à leur phénotype angiogénique, ce qui pourrait permettre à la plaie de sortir de la phase inflammatoire45. Par conséquent, la MDT est utile en tant que modalité complémentaire pour traiter les facteurs locaux du lit de la plaie dans les plaies difficiles à cicatriser afin de contrecarrer le bloquage de la cicatrisation de la plaie, mais elle est contre-indiquée dans les plaies sèches car les asticots ont besoin d’humidité pour survivre.
Discussion
Malgré la proposition de définition/classification des plaies en plaies cicatrisables, chroniques et non cicatrisables par Sibbald et al.2, très peu d’auteurs ont utilisé ces termes dans leurs publications, un problème également souligné par Olsson et al.46. Les termes courants étaient “chronique“, “non cicatrisable“, “cicatrisation retardée“ ou “atypique“, tous avec une référence limitée à la durée de la plaie, au temps de cicatrisation ou à d’autres résultats. Cela a conduit les auteurs à extraire les éléments de données disponibles dans une catégorie supplémentaire “difficile à guérir”, permettant l’inclusion lorsque le temps de cicatrisation ou l’influence des causes sous-jacentes n’était pas décrit. Cependant, malgré l’absence de définitions claires, cette étude a identifié des similitudes dans la prise en charge des différents types de plaies difficiles à cicatriser, et ces points communs englobent les thèmes suivants (Tableau 3).
Tableau 3. Principaux thèmes et sous-thèmes identifiés
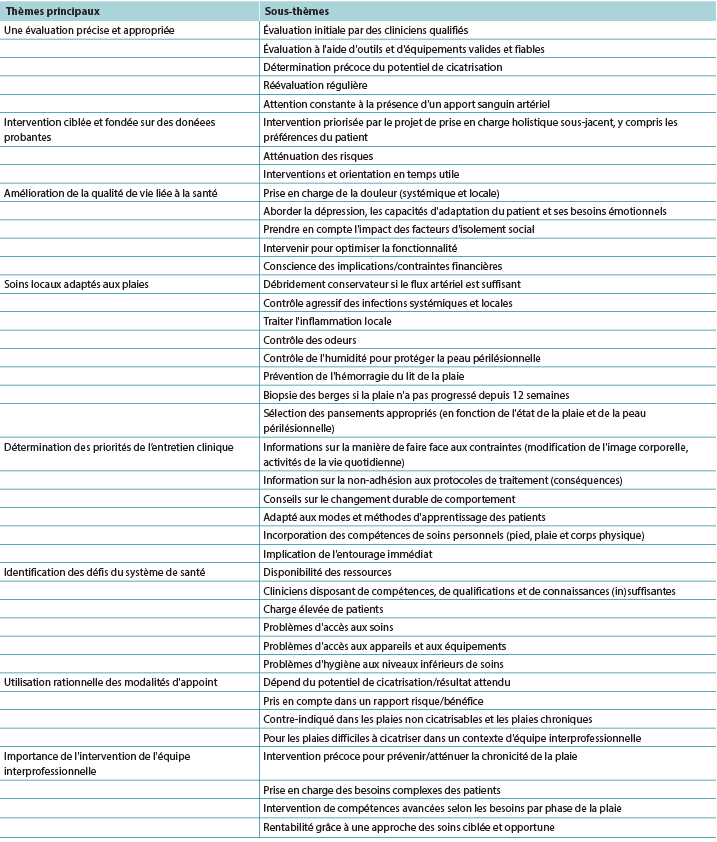
Évaluation précise et appropriée. L’identification précoce des conditions sous-jacentes et une attention habile aux facteurs existants chez le patient et dans le système sont essentielles pour favoriser la cicatrisationn à un rythme optimal (diminution de 30% de l’étendue en 4 semaines)10. Les prestataires doivent déterminer le potentiel de cicatrisation (dans les 12 premières semaines) et utiliser des outils d’évaluation valides. Une approche systématique et complète de l’anamnèse, de l’examen physique et des examens de laboratoire pour parvenir à un diagnostic clair améliore les résultats39. Le manque d’apport sanguin adéquat reste une cause sous-jacente majeure présente pour la plupart des plaies non cicatrisables ou chroniques et doit être évalué régulièrement19,21,24,27. La dépression est fortement associée à l’apparition de UDP et, si elle n’est pas traitée, elle augmente le risque d’amputation et de mortalité ultérieurs18. Les prestataires doivent dépister activement et prioriser l’intervention et le traitement approprié de la dépression chez les patients souffrant de plaies de longue durée18.
Intervention ciblée et fondée sur les données probantes L’identification adéquate des causes et le le démarrage d’interventions correctives pour atténuer les causes sous-jacentes au début de la séquence de cicatrisation pourraient prévenir la conversion des plaies. La liste substantielle des déficits directs qui s’ajoutent à la détérioration et à la chronicité des plaies locales comprend l’ostéomyélite, le carcinome spinocellulaire, le lymphœdème chronique et l’infection de la plaie39, et ces conditions nécessitent une intervention ou un contrôle agressifs pour recréer et établir l’amélioration ou la stabilité du lit de la plaie. Une plaie difficile à cicatriser, bloquée ou atypique doit donner lieu à une biopsie des berges incluant le derme réticulaire et le tissu sous-cutané pour évaluer la pathologie41. Les prestataires doivent s’efforcer de classer rapidement les plaies non cicatrisables lorsque les causes sous-jacentes ne peuvent pas être traitées efficacement ou sont jugées impossibles à corrigers47, et d’accompagner cette démarche d’un changement d’orientation vers les soins palliatifs et la QVLS.
Améliorer la qualité de vie liée à la santé. Les plaies chroniques entraînent des adaptations personnelles, financières, sociales, psychosociales et sexuelles qui vont au-delà de la simple gestion des effets de la plaie. D’un point de vue critique, la dépression est associée à une morbidité et une mortalité accrues chez les patients diabétiques18. Les bénéfices d’une attention constante à la prise en charge de la douleur sont une constatation clé dans la plupart des données examinées18, et plusieurs types de douleur peuvent nécessiter des interventions polypharmaceutiques. Il est essentiel de reconnaître et de prendre en charge les difficultés propres au patient en se concentrant sur l’amélioration de la QVLS en maintenant les activités de la vie quotidienne et en s’occupant de l’ambulation48, de l’autonomie18, de l’application des connaissances et de l’estime de soi17,18. Les difficultés propres au patient doivent être considérées comme tout aussi prioritaires que les causes sous-jacentes, car l’impact de la cicatrisation sur la QVLS peut être caché ou dormant, ce qui à son tour a un impact négatif sur la cicatrisation.
Adapté de Local Wound Care. Les interventions appropriées concernant les tissus, l’infection et l’inflammation, l’humidité et la prise en charge des berges de la plaie restent la pierre angulaire du traitement local des plaies. Les différentes approches de détersion peuvent aller de l’élimination prudente et conservatrice des tissus dévitalisés31,32, de la perforation des ampoules et non de la dérotation41, au débridement chirurgical pour éliminer le biofilm ou rapprocher les berges39,44. Ces auteurs recommandent une détersion prudenet et conservatrice, qui ne doit être effectuée que par des praticiens qualifiés et si l’apport sanguin artériel est suffisant pour irriguer le lit de la plaie et les tissus périlésionnels.
Un contrôle agressif de l’infection doit inclure des actions visant à traiter et à prévenir les infections récidivantes des plaies superficielles et profondes44,45,48, y compris l’évaluation de l’état vital et métabolique du patient, du lit de la plaie et de la zone périlésionnelle. L’application topique de toute préparation antibiotique telle que les pommades ou les crèmes (par exemple, la gentamicine, l’acide fusidique, la mupirocine) n’est pas recommandée par l’International Wound Infection Institute en raison de la préoccupation mondiale concernant la résistance aux antibiotiques et la résistance systémique qui en découle49. Il est recommandé de traiter les mauvaises odeurs avec des pansements appropriés43 et cela peut être inclus après une analyse de risque sur l’ajout d’humidité supplémentaire au lit de la plaie. Les prestataires et les patients doivent maintenir les lits des plaies non cicatrisables et chroniques aussi secs que possible23 afin de préserver les tissus22; de protéger les berges contre les traumatismes41, l’invasion bactérienne44 et la dégradation cutanée liée à l’humidité18,26; et prévenir toute perte supplémentaire de tissus ou toute extension de la plaie. Ces résultats ont fourni des indications claires sur les conséquences des berges; une réduction de l’étendue de la plaie de moins de 20% à 40% en 2 à 4 semaines pourrait être un indice fiable de non-cicatrisation39. En d’autres termes, les prestataires ne devraient pas attendre 12 semaines sans progression des berges de la plaie pour intervenir.
Priorités de l’entretien clinique. Les patients doivent comprendre pleinement leur situation et être accompagnés vers l’autonomie18. L’éducation doit s’adapter aux différents modes d’apprentissage en tenant compte des facteurs de risque modifiables (tabagisme, mauvais contrôle de la glycémie et résistance à la compression des membres inférieurs). L’entretien clinique est fortement associé à des économies de coûts financiers26. Les plateformes d’apprentissage en ligne (téléphone mobile, médias sociaux) sont de puissants outils d’éducation des patients et facilitent l’entretien clinique qui intègre l’entourage du patient d’une manière adaptée au patient et à sa culture. Les stratégies d’apprentissage en ligne qui incluent la redistribution de la pression, les suppléments nutritionnels, les soins de la peau et les soins de l’incontinence pourraient intégrer efficacement la famille dans le cercle des soins, avec la maîtrise des coûts comme résultat supplémentaire26. La valeur de l’apprentissage ciblé des patients peut être renforcée par les avantages financiers de la prévention des UDP26.
Les défis du système de santé. Cette étude a identifié les ensembles de compétences professionnelles, ou leur absence, qui ont un impact sur les résultats liés aux plaies et sur le délai de cicatrisation. Il s’agit notamment de l’évaluation (ABPI dans les LLU22, classement des UDP33) et de la prise en charge clinique correcte (application de bandages de compression20-22, redistribution initiale de la pression du pied32). Le manque d’expertise du prestataire est un facteur iatrogène souvent négligé dans les plaies difficiles à cicatriser ou bloquées24 qui entraîne une perte de temps précieux, des complications supplémentaires de la plaie et une orientation tardive vers une équipe interprofessionnelle pour une intervention avancée. Reconnaître les limites est essentiel pour orienter rapidement le patient vers un praticien ou une équipe interprofessionnelle compétents. Cependant, dans les milieux ruraux ou à ressources limitées, les équipes interprofessionnelles peuvent ne pas être réalisables, ce qui souligne l’importance de la connaissance du traitement des plaies pour tous les prestataires. De fait, les ressources limitées entraînant un retard de la cicatrisation sont un facteur souvent négligé dans la littérature. L’étude de Carter26 défend le rapport coût-efficacité des soins dirigés par rapport aux soins standard pour les plaies chroniques. L’identification précoce des plaies chroniques peut empêcher l’utilisation prolongée de ressources malgré l’absence de progrès22,26, ce qui pourrait à son tour avoir un impact positif sur les coûts associés au traitement, tant pour le patient que pour le système de santé.
À l’avenir, la prévention des dégradations cutanées, quelle que soit l’étiologie de la plaie, pourrait être la priorité absolue de tout professionnel de santé en raison des économies directes associées aux stratégies de protection de la peau7,22,26. Cela est évident dans la prévention de l’IP et de l’UDP, où l’intervention précoce et la prévention sont fréquemment mesurées par des indicateurs de performance clés (données sur l’incidence et la prévalence50) afin de préserver la peau des dégradations répétées et de prévenir les amputations51.
Utilisation rationnelle des Modalités adjuvantes. Entre les mains d’une équipe interprofessionnelle, les thérapies adjuvantes de dernier recours (TPN, OHB, chirurgie des lambeaux/greffes, électrostimulation, MDT)23,27,33,45 disposent du meilleur potentiel pour favoriser la cicatrisation lorsque les problèmes du patient, l’historique de la plaie et les limitations des ressources sont pris en compte dans les plaies difficiles à cicatriser. Cependant, la plupart des modalités avancées ne constituent pas une option complémentaire viable pour les plaies chroniques et les plaies non cicatrisables dont le lit est sec23 ou saigne18 et peuvent ne pas représenter l’utilisation la plus optimale des ressources22,26.
Signification de l’approche d’une équipe interprofessionnelle. Le résultat le plus important (présent dans la majorité des études incluses) est qu’une approche interprofessionnelle précoce peut faciliter les interventions correctes et les options de prise en charge des plaies19,21,26,27,31,32,35,41,42. Cette intervention opportune et précise peut permettre d’éviter la spirale descendante vers la chronicité.18,31-33,35,41,42 L’évaluation, le diagnostic et les interventions appropriées pour les plaies à cicatrisation retardée ou bloquée nécessitent souvent des compétences avancées en matière de soins des plaies19-22,27 plus facilement disponibles au sein d’une équipe interprofessionnelle. Des données probantes indiquent que cette intervention réduit les coûts par rapport aux soins courants standard sur des périodes prolongées26.
Malgré cette forte recommandation, l’équipe interprofessionnelle est souvent utilisée en dernier recours et trop tard pour briser le cycle de la cicatrisation retardée et de la chronicité. Les patients sont des membres essentiels de l’équipe interprofessionnelle car ils poussent le potentiel de l’équipe à atteindre les résultats fixés, surtout s’ils sont confrontés à une cicatrisation retardée22. Cependant, les cliniciens peuvent encore avoir du mal à déterminer quand il est approprié de consulter une équipe interprofessionnelle. C’est pourquoi les auteurs ont développé un parcours de soins interprofessionnel utilisant des marqueurs liés au temps et aux plaies qui peuvent indiquer le moment approprié pour impliquer l’équipe interprofessionnelle (Figure 2).
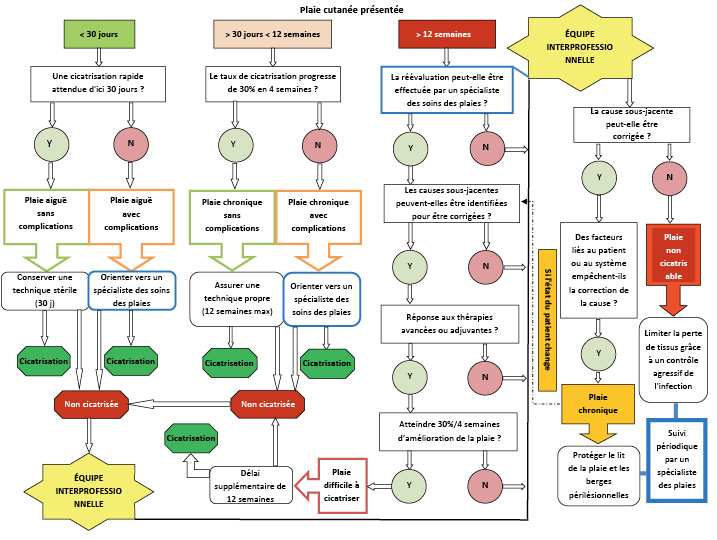
Figure 2. Parcours de soins des équipes interprofessionnelles pour les patients souffrant de plaies
Le clinicien doit saisir le parcours en fonction du “temps écoulé depuis la blessure” dans la ligne horizontale supérieure. Une fois cette case identifiée, le processus décisionnel suit une ligne verticale descendante vers un résultat et un délai pour l’obtention de ce résultat. Notez que l’équipe interprofessionnelle prend la responsabilité du diagnostic des plaies chroniques et des plaies non cicatrisables afin de s’assurer qu’aucune plaie ne se retrouve ou ne reste inutilement dans ces catégories.
Définitions: Spécialiste des soins des plaies: un professionnel de santé (médecin/infirmier/agent paramédical) ayant reçu une formation complémentaire et une spécialisation dans le soin des plaies et faisant partie d’une équipe interprofessionnelle opérationnelle. Technique stérile: prévention de la contamination bactérienne et de la propagation de l’infection par le respect d’un protocole de procédure stérile strict lors de la réalisation de procédures liées aux plaies. Les règles de stérilité s’appliquent. Technique propre: également connue sous le nom de technique non stérile: implique le lavage des mains, un environnement propre avec un équipement propre, des gants propres et des instruments stériles visant à empêcher la contamination directe des fournitures ou du matériel. Facteurs de risque des plaies aiguës et chroniques: apport vasculaire insuffisant, maladie systémique sous-jacente, traumatisme, compromis immunitaire, perte tissulaire étendue, os ou tendon exposé, adhésion du patient aux enjeux du traitement, patient nécessitant une ou plusieurs interventions supplémentaires, manque de ressources/compétences appropriées. Thérapies avancées/adjuvantes: détersion par asticots, pression négative et oxygénothérapie hyperbare; électrostimulation; ultrasons; laser; plasma enrichi en plaquettes; fermeture chirurgicale; radiologie interventionnelle, etc. Résultat de la cicatrisation: plaie aiguë cicatrisée dans les 30 jours; plaie chronique cicatrisée dans les 12 semaines (suivi d’une amélioration de 30% pour 4 semaines de délai); autorisation d’un ou de plusieurs délais supplémentaires de 12 semaines pour les plaies difficiles à cicatriser, selon la décision de l’équipe interprofessionnelle.
Note: Une plaie non cicatrisable peut également être un premier point d’entrée sans qu’il y ait de flux dans le reste du parcours, avec la confirmation de l’équipe interprofessionnelle.
Parcours de soins interprofessionnel
En réalisant cettte enquête, l’équipe de recherche a réalisé que les plaies difficiles à cicatriser suivent une séquence type d’événements attribuables au prestataire, au patient, au payeur, à la réglementation ou à des facteurs sous-jacents persistants non corrigés52,53 plutôt que d’être un type de plaie en soi. Essentiellement, les plaies difficiles à cicatriser ont des besoins spécifiques et constituent une catégorie supplémentaire dans le processus de détermination du potentiel de cicatrisation:
- cicatrisable: où la guérison se produit de manière prévisible selon les délais prévus;
- difficile à cicatriser: lorsque des plaies retardées, bloquées ou non cicatrisantes nécessitent une évaluation ou des modalités de soins supplémentaires;
- chroniques: lorsque l’entretien clinique en vue de modifier le mode de vie devient plus important que l’obtention d’un résultat de cicatrisation de la plaie;
- non cicatrisable: lorsqu’une attention agressive à la prévention de l’infection locale et à la préservation contre une perte supplémentaire de tissu est nécessaire et qu’aucun résultat de cicatrisation ne peut être obtenu.
La compilation des éléments de données par thèmes a clairement montré que l’identification rapide de l’échec de la cicatrisation est une priorité. Les facteurs complexes qui affectent la cicatrisation des plaies doivent être réévalués régulièrement, et les prestataires doivent garder une perspective flexible sur la trajectoire de la cicatrisation. Dans la littérature actuelle, le délai exact de la cicatrisation (c’est-à-dire un point limite défini à partir duquel les plaies sont classées comme plaies chroniques) reste difficile à déterminer. Dans cette optique, l’équipe de recherche propose un parcours de soins avec des délais précis pour aider les professionnels de la santé à prendre des décisions (figure 2). Une orientation opportune pourrait permettre une intervention optimale dans la période précoce essentielle de la blessure et promouvoir les interventions complémentaires disponibles lorsque des résultats positifs peuvent encore être obtenus.
Le parcours propose que les plaies difficiles à cicatriser bénéficient de 12 semaines supplémentaires de soins optimaux pour parvenir à la cicatrisation (taux de réduction de 30% dans les 4 semaines). Si la plaie n’évolue pas malgré l’intervention avancée de l’équipe, elle peut alors être classée comme une plaie chronique (lorsque des problèmes liés au patient ou au système empêchent la correction de la cause)2. La réévaluation et la prise en charge par des spécialistes du traitement des plaies entièrement formés à l’application des meilleures pratiques actuelles et bien intégrés au sein d’une équipe interprofessionnelle de traitement des plaies sont essentielles. La proposition de 12 semaines supplémentaires de prise en charge interprofessionnelle agressive devrait être explorée plus avant et testée dans le cadre de recherches futures. Ces études pourraient envisager des interventions avec ou sans modalités avancées de soins des plaies, car ces modalités peuvent ne pas être disponibles dans des contextes où les ressources sont limitées.
Les limites
Cet examen s’est limité aux études réalisées entre 2011 et 2019 et n’a pris en compte les données antérieures à 2011 que si elles étaient incluses dans les études sélectionnées. Les directives qui n’ont pas été identifiées dans le cadre de la recherche pourraient être utiles si elles rendent compte de manière claire et transparente de l’identification et de l’évaluation des données. En outre, les mots clés relatifs aux plaies atypiques spécifiques n’ont pas été inclus dans la recherche. Ceci dans le but d’extraire les études axées sur les interventions sur les plaies chroniques et non cicatrisables, ainsi que pour limiter la récolte. Cependant, les études sur les plaies atypiques ont fait l’objet d’une recherche manuelle par l’équipe de recherche, mais elles présentaient des cohortes de petite taille et des données insuffisantes. Cette étude ne comprenait pas d’études de cas ou de séries de cas, mais les chercheurs reconnaissent que les études de cas multiples pourraient constituer le plus haut niveau de données disponibles dans des cas ou des environnements difficiles. Un examen futur des études de cas/séries de cas existantes pourrait s’avérer utile pour identifier les pratiques actuelles dans le traitement de ce sous-groupe de plaies. Des études sur l’efficacité et le rapport coût-efficacité d’innovations locales en matière de lits de plaie dans des contextes où les ressources sont limitées constitueraient une contribution précieuse, d’autant plus si elles étaient menées dans des contextes cliniques réels et en collaboration avec des universitaires et des praticiens.
Conclusions
La participation active du patient au processus de soins est essentielle dans la prise encharge d’une plaie chronique ou non cicatrisable et pour obtenir des résultats acceptables. Une fois qu’une plaie non cicatrisable, chronique ou difficile à cicatriser est identifiée, non seulement une réévaluation complète doit être effectuée par une équipe compétente de professionnels de la santé, mais des interventions cliniques ciblées telles qu’une biopsie marginale ou une évaluation vasculaire avancée doivent confirmer la classification de la plaie et guider le processus de décision du patient et du prestataire.
Les données sur la prise en charge clinique exacte des plaies chroniques et des plaies non cicatrisables sont insuffisantes pour guider la pratique. Les conclusions les plus courantes sont la nécessité d’un diagnostic précoce et d’un traitement rapide dans les 12 premières semaines, l’identification complète des facteurs sous-jacents retardant la cicatrisation et l’implication précoce de l’équipe interprofessionnelle. Une parcours de soins interprofessionnel a été mise au point afin d’intégrer un délai d’intervention supplémentaire de 12 semaines pour les plaies difficiles à cicatriser ou celles qui ont été orientées tardivement.
Si l’évaluation de la plaie révèle une plaie chronique ou non cicatrisable, il est important de réaliser que ce diagnostic aura un impact sur le patient aux niveaux physique, personnel, interpersonnel, social et financier. La principale priorité devrait être de préserver l’intégrité du patient dans ces domaines grâce à une intervention centrée sur les difficultés du patient sur le patient. La prise en charge de la douleur à long terme doit être une priorité. En outre, la préparation du patient par un entretien clinique ciblé est essentielle pour identifier et faciliter les adaptations de vie nécessaires et faire face à ce diagnostic. L’incorporation des compétences nouvellement acquises ou adaptées dans les activités de la vie quotidienne du patient aura un impact positif sur la qualité de vie. Les patients souffrant de plaies chroniques, de plaies non cicatrisables et de plaies difficiles à cicatriser doivent assumer la responsabilité de leurs propres soins personnels dans la mesure du possible et aussi longtemps que possible.
Joyaux de la pratique
- Une plaie qui ne cicatrise pas au rythme de 30% par semaine doit être réévaluée par une équipe interprofessionnelle le plus tôt possible; n’attendez pas 12 semaines avant de l’adresser.
- Les plaies difficiles à cicatriser, ou celles qui s’aggravent avec le temps, peuvent bénéficier de l’intervention d’une équipe interprofessionnelle qui peut inclure une réévaluation et un changement de stratégie de traitement pour s’attaquer à la cause sous-jacente de la plaie.
- Une fois qu’une plaie chronique a été diagnostiquée, les patients doivent être dotés de connaissances suffisantes et d’un soutien social/familial pour maintenir les activités de la vie quotidienne et les soins personnels le plus longtemps possible.
- La prise en charge holistique des plaies chroniques et des plaies non cicatrisables implique de ne plus se focaliser sur l’obtention de résultats pour la plaie mais sur les difficultés du patient, telles que la prise en charge de la douleur et le contrôle des odeurs.
- L’objectif clinique pour les plaies non cicatrisables doit inclure un contrôle agressif de l’infection topique pour obtenir la stabilité des tissus, la préservation des tissus secs stables existants et la prévention de l’extension des berges de la plaie.
Remerciements
Les auteurs remercient Brinsley Davids, Liezl Naude, Michelle Second, Valana Skinner et Liz Morris, qui ont participé à la phase initiale de l’étude; le Dr Alwiena Blignaut de la North West University pour ses conseils sur la méthodologie et la révision critique de cet article; le Dr Annatjie Van der Wath pour la formation dispensée sur les principes de l’analyse qualitative; et le Dr Nick Kairinos pour la révision critique de cet article. La Wound Healing Association of Southern Africa a sponsorisé les frais d’abonnement au logiciel Evidence for Policy and Practice Information Reviewer. Aucun autre financement de projet n’a été reçu. L’auteur, le corps professoral, le personnel et les organisateurs, y compris les conjoints/partenaires (le cas échéant), qui sont en position d’exercer un contrôle sur le contenu de cette activité de CME/CNE ont déclaré qu’ils n’ont aucune relation financière avec des sociétés commerciales en rapport avec cette activité de formation, ni aucun intérêt financier dans ces sociétés.
Un contenu numérique supplémentaire est disponible pour cet article. Les citations URL directes apparaissent dans le texte imprimé et sont fournies dans les versions HTML et PDF de cet article sur le site web du journal (www.ASWCjournal.com).
Pour obtenir des crédits de CME, vous devez lire l’article de CME et répondre au quiz en ligne, en répondant correctement à au moins 7 des 10 questions. Cette activité de formation continue expirera le 31 décembre 2022 pour les médecins et le 4 mars 2022 pour les infirmières et infirmiers. Tous les tests sont désormais uniquement en ligne; passez le test sur http://cme.lww.com pour les médecins et sur www.nursingcenter.com pour les infirmières et infirmiers. Les informations complètes sur le CE/CME se trouvent à la dernière page de cet article.
Conflit d’intérêt
Les auteurs ne déclarent aucun conflit d’intérêt.
Financement
Les auteurs n’ont reçu aucun financement pour cette étude.
Author(s)
Geertien C. Boersema
RN, MCur (UP)
Lecturer, University of South Africa, Pretoria, South Africa
Hiske Smart*
RN, MA (Nur), PGDipWHTR (UK), IIWCC,
Manager, Wound Care & Hyperbaric Oxygen Therapy Unit, King Hamad University Hospital, Kingdom of Bahrain
Maria G. C. Giaquinto-Cilliers
MD, IIWCC
Affiliated Lecturer, Department of Plastic and Reconstructive Surgery, University of the Free State, Bloemfontein, South Africa; Head of Plastic and Reconstructive Surgery & Burns Unit, Robert Mangaliso Sobukwe Hospital, Kimberley, South Africa
Magda Mulder
PhD, RN, IIWCC
Head of School of Nursing, University of the Free State, Bloemfontein, South Africa
Gregory R. Weir
MD, M.Med(Chir) (UP), CVS, IIWCC
Specialist Vascular Surgeon, Life Eugene Marais Hospital, Pretoria, South Africa
Febe A. Bruwer
RN, MSocSc(Nur), IIWCC
Clinical Nurse Specialist, Johannesburg, South Africa
Patricia J. Idensohn
MSc (Herts-UK), RN, IIWCC
Clinical Nurse Specialist, Ballito, South Africa; Lecturer, University of Free State, Bloemfontein, South Africa
Johanna E. Sander
RN
Clinical Wound Care Nurse, 2nd Military Hospital, Cape Town,
South Africa
Anita Stavast
MSc (Herts–UK), RN, IIWCC, Clinical Nurse Specialist, Potchefstroom, South Africa
Mariette Swart
RN, IIWCC
Clinical Wound Care Nurse, Strand, Cape Town, South Africa
Susan Thiart
RN, IIWCC, Clinical Wound Care Nurse, Pretoria, South Africa
Zhavandre Van der Merwe
RN, IIWCC
Clinical Wound Care Nurse, Pretoria, South Africa
References
- Demidova-Rice TN, Hamblin MR, Herman IM. Acute and impaired wound healing: pathophysiology and current methods for drug delivery, part 1: normal and chronic wounds: biology, causes, and approaches to care. Adv Skin Wound Care 2012;25(7):304‐14.
- Sibbald RG, Goodman L, Woo KY, et.al. Special considerations in wound bed preparation 2011: an update. Adv Skin Wound Care 2011;24:415-37.
- Korting HC, Schöllmann C, White RJ. Management of minor acute cutaneous wounds: importance of wound healing in a moist environment. J Eur Acad Dermatol Venereol 2011;25:130-7.
- Cañedo-Dorantes L, Cañedo-Ayala M. Skin acute wound healing—a comprehensive review. Int J Inflam 2019;2019:3706315.
- European Wound Management Association. Position document: hard-to-heal wounds: a holistic approach. https://ewma.org/fileadmin/user_upload/EWMA.org/Position_documents_2002-2008/EWMA_08_Eng_final.pdf. October 2008. Last accessed October 8, 2020.
- Leaper DJ, Schultz G, Carville K, Fletcher J, Swanson T, Drake R. Extending the TIME concept: what have we learned in the past 10 years? Int Wound J 2014;9(Suppl 2):1-19.
- Sibbald RG, Elliot JA, Ayello EA, Somayaji R. Optimizing the moisture management tightrope with wound bed preparation 2015. Adv Skin Wound Care 2015;28(10):466-76.
- Jordan Z, Lockwood C, Munn Z, Aromataris E. The updated Joanna Briggs Institute Model of Evidence-Based Healthcare. Int J Evid Based Healthc 2019;17(1):58-71.
- Crowe M, Sheppard L, Campbell A. Comparison of the effects of using the Crowe Critical Appraisal Tool versus informal appraisal in assessing health research: a randomised trial. Int J Evid Based Healthc 2011;9(4):444-9.
- Margolis DJ, Bilker W, Santanna J, Baumgarten M. Venous leg ulcer: incidence and prevalence in the elderly. J Am Acad Dermatol 2002;46(3):381-6.
- Troxler M, Vowden K, Vowden P. Integrating adjunctive therapy into practice: the importance of recognizing ‘hard-to-heal’ wounds. World Wide Wounds. 2006. www.worldwidewounds.com/2006/december/Troxler/Integrating-Adjunctive-Therapy-Into-Practice.html. Last accessed October 8, 2020.
- Weir RG, Smart H, Van Marle J, Cronje FJ. Arterial disease ulcers, part 1: clinical diagnosis and investigation. Adv Skin Wound Care 2014;27(9):421-8.
- Jensen NK, Pals RAS. A dialogue-based approach to patient education. Indian J Endocrinol Metab 2015;19(1):168-70.eS.
- Keliddar I, Mosadeghrad AM, Jafari-Sirizi M. Rationing in health systems: a critical review. Med J Islam Repub Iran 2017;31:47-54.
- Cohen M, Quintner J, Van Rysewyk S. Reconsidering the International Association for the Study of Pain definition of pain. Pain Rep 2018;(2):e634.
- Moher D, Liberati A, Tetzlaff J, Altman DG. Preferred Reporting Items for Systematic Reviews and Meta-analyses: the PRISMA statement. PLoS Med 2009;6(7):e1000097.
- Adderley UJ, Holt IGS. Topical agents and dressings for fungating wounds (reviews). Cochrane Database Syst Rev 2014;5:1-26.
- Ousey K, Edwards K. Exploring resilience when living with a wounds—an integrative literature review. Healthcare (Basel) 2014;2(3):346-55.
- Neumann M, Cornu-Thénard A, Jünger M, et al. Evidence based (S3) guidelines for diagnostics and treatment of venous leg ulcers. J Eur Acad Dermatol Venereol 2016;30(11):1843-75.
- Weller CD, Team V, Ivory JD, Crawford K, Gethin G. ABPI reporting and compression recommendations in global clinical practice guidelines on venous leg ulcer management: a scoping review. Int Wound J 2019;16(2):406-19.
- Andriessen A, Apelqvist J, Mosti G, Partsch H, Gonska C, Abel M. Compression therapy for venous leg ulcers: risk factors for adverse events and complications, contraindications—a review of present guidelines. J Eur Acad Dermatol Venereol 2017;31(9):1562-8.
- Ratliff CR, Yates S, McNichol L, Gray M. Compression for primary prevention, treatment, and prevention of recurrence of venous leg ulcers. J Wound Ostomy Continence Nurs 2016;43(4):347-64.
- Tang JC, Marston WA, Kirsner RS. Wound Healing Society (WHS) venous ulcer treatment guidelines: what’s new in five years? Wound Repair Regen 2012;20:619-37.
- Weller CD, Evan S. Venous leg ulcer management in general practice: practice nurses and evidence-based guidelines. Aust Fam Physician 2012;(4)5:331-7.
- Miller C, Kapp S, Donohue L. Sustaining behaviour changes following a venous leg ulcer client education program. Healthcare 2014;2:324-37.
- Carter M. Economic evaluations of guideline-based or strategic interventions of the prevention or treatment of chronic wounds. Appl Health Econ Health Policy 2014;1(12):373-89.
- Canadian Agency for Drugs and Technologies in Health. Optimal Care of Chronic, Nonhealing, Lower Extremity Wounds: A Review of Clinical Evidence and Guidelines. Ottawa, ON, Canada: CADTH; 2013.
- Harding K, Armstrong D, Chadwick P, et al. Position document: local management of diabetic foot ulcers. World Union of Wound Healing Societies. In: Florence Congress, Position Document. 2016:1-28.
- Canadian Agency for Drugs and Technologies in Health. Negative Pressure Wound Therapy for Managing Diabetic Foot Ulcers: A Review of the Clinical Effectiveness, Cost-Effectiveness, and Guidelines. Ottawa, ON, Canada: CADTH; 2014.
- Taylor SM, Johnson BL, Samies NL, et al. Contemporary management of diabetic neuropathic foot ulceration: a study of 917 consecutively treated limbs. J Am Coll Surg 2011;212(4):532-45.
- Isei T, Abe M, Nakanishi T, et al. The wound/burn guidelines—3: guidelines for the diagnosis and treatment for diabetic ulcer/gangrene. J Dermatol 2016;43(6):591-619.
- Lavery LA, Davis KE, Berriman SJ, et al. WHS guidelines update: diabetic foot ulcer treatment guidelines. Wound Repair Regen 2016; 24:112-26.
- Huang ET, Mansouri J, Murad MH, et al. A clinical practice guideline for the use of hyperbaric oxygen therapy in the treatment of diabetic foot ulcers. Undersea Hyperb Med 2015;42(3):205-47.
- Crawford PE, Fields-Varnado M. Guideline for the management of wounds in patients with lower-extremity neuropathic disease. J Wound Ostomy Continence Nurs 2013;40(1):34-45.
- Guihan M, Bombardier CH. Potentially modifiable risk factors among veterans with spinal cord injury hospitalized for severe pressure ulcers: a descriptive study. J Spinal Cord Med 2012;35(4):240-50.
- Canadian Agency for Drugs and Technologies in Health. Dressing Material for the Treatment of Pressure Ulcers Inpatients in Long-term Care Facilities: A Review of the Comparative Clinical Effectiveness and Guidelines. Ottawa, ON, Canada: CADTH; 2013.
- Gelis A, Pariel S, Colin D, et al. What is the role of TPE in management of patients at risk or with pressure ulcers? Toward development of French guidelines for clinical practice. Ann Phys Rehabil Med 2012;55:517-29.
- Fujiwara H, Isogai Z, Irisawa R, et al. Wound pressure ulcer and burn guidelines—2: guidelines for the diagnosis and treatment of pressure ulcers, second edition. J Dermatol 2018;1-50.
- Addison NO, Pfau S, Koka E et al. Assessing and managing wounds of Buruli ulcer patients at the primary and secondary health care levels in Ghana. PLoS Negl Trop Dis 2017;11(2):e0005331.
- Alavi A, Farzanfar D, Rogalska T, et al. Quality of life and sexual health in patients with hidradenitis suppurativa. Int J Womens Dermatol 2018;4:74-9.
- Pope E, Lara-Corrales I, Mellerio J, et al. A consensus approach to wound care in epidermolysis bullosa. Am Acad Dermatol 2012;67:904-17.
- Shanmugam VK, Angra D, Rahimi H, McNish S. Vasculitic and autoimmune wounds. J Vasc Surg Venous Lymphat Disord 2017;5:280-92.
- Akhmetova A, Saliev T, Allan IU, et al. A comprehensive review of topical odor-controlling treatment options for chronic wounds. J Wound Continence Nurs 2016.46(6):598-609.
- Schultz G, Bjarnsholt T, James GA, et al. Consensus guidelines for the identification and treatment of biofilms in chronic nonhealing wounds. Wound Repair Regen 2017;25:744-57.
- Sherman RA. Mechanisms of maggot-induced wound healing: what do we know and where do we go from here. J Evid Based Complementary Altern Med 2014:1-13.
- Olsson M, Järbrink K, Divakar U, et al. The humanistic and economic burden of chronic wounds: a systematic review. Wound Repair Regen 2019;27(1):114-25.
- Woo KY, Sibbald RG. Local wound care for malignant and palliative wounds. Adv Skin Wound Care 2010;23(9):417-28.
- Driver VR, Gould LJ, Dotson P, et al. Evidence supporting wound care endpoints relevant to clinical practice and patients’ lives. Part 2. Literature survey. Wound Repair Regen 2019;27(1):80-9.
- Swanson T, Angel D, Sussman G, et al. Wound infection in Clinical Practice. International Wound Infection Institute (IWII). Wounds International. 2016. www.woundinfection-institute.com/wp-content/uploads/2017/03/IWII-Wound-infection-in-clinical-practice.pdf. Last accessed October 8, 2020.
- European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel, Pan Pacific Pressure Injury Advisory Panel. Prevention and Treatment of Pressure Ulcers/Injuries: Clinical Practice Guideline. 3rd ed. EPUAP-NPIAP-PPPIA; 2019.
- Lowe J, Sibbald RG, Taha NY, et al. The Guyana diabetes and foot care project: improved diabetic foot evaluation reduces amputation rates by two-thirds in a lower middle-income country. Int J Endocrinol 2015;2015:920124.
- Porter ME. How competitive forces shape strategy. Harvard Bus Rev 1979;57(2):137-45.
- O’Hara NN, Nophale LE, Lyndsay M, et al. Tuberculosis testing for healthcare workers in South Africa: a health service analysis using Porter’s Five Forces Framework. Int J Healthcare Manag 2017;10(1):49-56.
