Volume 41 Number 2
WHAM evidence summary: effectiveness of topical coconut products
Robin Watts, Teresa Solomon and Emily Haesler
Keywords skin conditions, topical coconut, coconut oil, wound management, low- and middle-resource countries
For referencing Watts R et al. WHAM evidence summary: effectiveness of topical coconut products. WCET® Journal 2021;41(2):32-35
DOI https://doi.org/10.33235/wcet.41.2.32-35
Clinical Question
What is the best available evidence on the use of topical coconut products in wound management and the treatment of skin conditions?
Summary
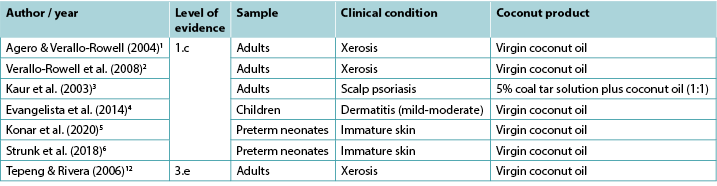
Despite the wide use of topical coconut products for medicinal purposes in tropical geographic regions, only a limited number of clinical studies reporting its effectiveness in treating skin conditions and no studies reporting its use in wound management were identified is this rapid review. Level 1 evidence1,2 demonstrated that topical virgin coconut oil (VCO) is associated with improvements in signs and symptoms of xerosis1,2 and psoriasis3 in adults, and mild-to-moderate dermatitis in children4. There is some evidence that VCO improves scores of skin immaturity in preterm neonates5,6. Currently no evidence is available on the use of topical coconut products for healing human wounds.
Clinical practice recommendations
All recommendations should be applied with consideration to the wound, the person, the health professional and the clinical context.
- Topical VCO could be considered for the treatment of mild-to-moderate xerosis (Grade B).
- Topical VCO could be considered for the treatment of psoriasis in the absence of access to topical corticosteroid therapy (Grade B).
- Topical VCO could be considered for the treatment of mild-to-moderate atopic dermatitis in children (Grade B).
Sources of evidence
This summary was conducted using methods published by the Joanna Briggs Institute (JBI)7–11. The summary is based on a systematic literature search combining search terms related to wounds and skin conditions with terms related to coconut palm. Searches were conducted in Embase, Medline, Global Health, and Allied and Complementary Medicine databases, and in 10 healthcare journals from low- and middle-income countries for evidence published up to May 2021 in English. Studies were assigned a level of evidence (Table 1) based on JBI’s hierarchy7–11. Recommendations are made based on the body of evidence and are graded according to the system reported by JBI7–11.
Table 1. Levels of evidence

Background
Various parts of the coconut tree have been used for a multitude of purposes in traditional medicine for thousands of years, to the extent that the plant is often called the “tree of life”16. Products derived from Cocos nucifera Linn: Arecaacae include coconut water, oil from coconut milk or copra (dried kernel), dried coconut shell and husk fibre17,18. The most used coconut product, virgin coconut oil (VCO), is extracted directly from coconut flesh and contains medium chain fatty acids that have surfactant qualities1,19,20. Another tested product, coconut shell liquid smoke (CS-LS) is produced by burning coconut shells at 400˚C resulting in a solution arising from condensation of vapour of wood smoke14. Coconut shells contain the highest antioxidant properties of any parts of the coconut14.
Laboratory testing and biochemical analysis of these products have identified a number of useful properties – anti-inflammatory, antimicrobial, antifungal, antioxidant, antineoplastic and analgesic17,18,20–24. When applied topically, VCO provides barrier protection for the stratum corneum and reduces transepidermal water loss (TEWL), promoting skin moisturisation19,20,24,25. When used on wounds, VCO and other coconut-derived products are reported to promote collagen synthesis and faster epithelisation15,20,24.
Evidence
Evidence from animal studies
Evidence on the wound healing effect of coconut comes from animal studies. Results from three studies13–15 are provided as examples of the significant amount of laboratory work on this topic. In the first study13, undertaken in India, VCO was applied daily for 10 days to open dermal wounds in rats. There were three groups of six rats each – a control group, a group treated with 0.5ml VCO, and a third treated with 1ml VCO. Time to complete epithelisation and composition of granulation tissue (e.g., collagen and fibroblasts) were among the outcome measures. In terms of both time to complete epithelisation and total collagen content, groups 2 and 3 were statistically significant compared to the control (p<0.05), 1ml being more effective than 0.5ml13 (Level 5).
The second study14 was conducted in Indonesia to evaluate the healing activity of CS-LS for burns. Thirty-six mice were randomised into three groups (n=12/group) – CS-LS, normal saline 0.9% (NaCl), and 10% povidone iodine. The burn wounds were left open, with treatment applied twice daily for 25 days. Wound contraction was measured on days 1, 5, 10 and 25 after burn induction. The CS-LS group showed the fastest wound contraction of the three groups by day 5 (p<0.001). On day 10 there was a statistically significant difference to the povidone iodine group (p<0.001) and on day 25 there was a statistically significant difference to the NaCl group (p<0.05)14 (Level 5).
In the third study15, VCO for treating diabetic ulcers was explored with a rat population. Rats with ulcers were divided into four groups – non-treated, non-diabetic rats (n=18), non-treated diabetic rats (n=18), diabetic rats receiving 1ml VCO applied daily for 14 days (n=18), and diabetic rats receiving silver sulfadiazine cream applied daily for 14 days (n=18). Wound closure rates were measured on days 5, 10 and 14. Diabetic ulcers treated with VCO had statistically significantly faster closure rates (p<0.05) compared with diabetic ulcers receiving no treatment on all days. On days 5 and 14 there was a statistically significant difference between the VCO and the silver sulfadiazine cream groups (p<0.05), favouring VCO15 (Level 5).
Evidence from human studies
Evidence on effectiveness for treating wounds
No evidence on topical coconut products for use in treating human wounds was identified.
Evidence on effectiveness for treating skin conditions
Xerosis in adults
Two blinded RCTs1,2 provided evidence for using VCO to relieve xerosis (dry skin) in adults. The first RCT1 was conducted on 34 individuals with mild-to-moderate xerosis to determine the effectiveness and safety of VCO compared with mineral oil when used as a therapeutic moisturiser. The solutions were applied to the legs twice daily for 14 days. Skin hydration and skin lipids were tested to measure effectiveness while TEWL and skin pH were the quantitative measures for safety. Xerosis was evaluated for dryness, scaling, roughness and pruritus by both an investigator using Wehr’s Grading and by participants using a visual analogue scale. Data were collected at baseline, day 7 and day 14. Participants also evaluated side effects (e.g., erythema, stinging or itching). Both treatments were comparable in terms of outcome measures for effectiveness and safety. By the end of the study 81% (13/16) of the participants in the VCO group showed improvement of at least one level in xerosis grading compared to 72% (13/18) of the mineral oil group1 (Level 1).
The second RCT2 compared VCO to virgin olive oil (VOO) for relieving xerosis and eliminating Staphylococcus aureus from skin in adults with atopic dermatitis (n=52). One group was treated with VCO and the other with VOO, with oils massaged gently into the skin twice daily at two skin sites displaying no clinical signs of infection. Outcome measures were skin cultures, photography and the objective component of the SCORAD severity index (O-SSI). Assessment occurred at baseline and at 4 weeks. At 4 weeks, the VCO group improved more significantly on the O-SSI compared to the VOO group (p=0.004)2. Of the VCO group, 77% (20/26) were positive for S. aureus on entry to the study compared 46% (12/26) in the VOO group. Following treatment, only 5% (1/12) of the VCO group remained positive versus 50% (6/12) of the VOO group. The relative risk for VCO was 0.1 compared to 10.1 for VOO (p=0.00; 95% confidence interval [CI], 0.01–0.73, number needed to treat [NNT]=2.2) (Level 1).
Psoriasis in adults
Two studies provided evidence on the use of coconut oil for treating psoriasis. In an RCT (n=40)3, adults with scalp psoriasis were randomised into three groups to assess the effectiveness of relatively bland emollients: 5% coal tar solution plus coconut oil (1:1); 10% urea, 10% lactic acid, 10% propylene glycol plus 10% liquid paraffin (in a cream base); and VCO alone. All three groups showed comparable significant improvement over time, showing 57%, 64.4% and 58.3% clearing of symptoms respectively (p<0.01) without adverse effects. The authors noted that topical corticosteroids have demonstrated substantially higher response and clearance rates than this study found3 (Level 1).
An observational study (n=31)12 explored the use of VCO applied twice daily for 8 weeks to psoriasis lesions in adults. Erythema, scaling and plaque elevation were evaluated every second week using photography and a clinical assessment of symptom clearance. At the completion of the study 16% of participants (5/31) had complete clearance. Scaling was observed to be most reduced in the 4–6-week period of treatment, while erythema and plaque elevation were most improved in the 6–8-week period. No adverse effects were experienced12 (Level 3).
Dermatitis in children
One RCT4 (n=117) compared the effectiveness of topical VCO to that of topical mineral oil for children (aged between 1–13 years) with mild-to-moderate atopic dermatitis. For both treatment groups, 5ml of oil was applied twice daily. Impact on epidermal function was measured using a clinical assessment tool (SSI) and by measuring TEWL and skin capacitance, all measured at baseline and 2, 4 and 8 weeks. On the SSI measure the VCO was significantly more effective than the mineral oil (mean reduction in symptoms 68.23% versus 38.13%, p<0.001). The VCO also produced significantly effective results in terms of the TEWL over the 8-week period compared to the mineral oil group (decrease in TEWL 70.7% versus 35.36%). In terms of the emollient effect of the two oils, a statistically significant difference between the two became apparent at 8 weeks of treatment (p=0.03). No adverse effects were reported in the VCO group, while five children in the mineral oil group required “rescue” treatment with topical corticosteroids4 (Level 1).
Treatment of immature skin in preterm neonates
Two non-blinded RCTs5,6 investigated application of VCO to preterm neonates to promote skin maturity. In both studies, skin maturity was assessed on days 7, 14 and 21 using the Neonatal Skin Condition Scale (NSCS) that includes evaluation of dryness, erythema and skin breakdown. In both studies, babies with existing skin conditions (e.g., infection or rash) were excluded5,6.
In the largest RCT (n=2,294)5, preterm neonates (<37 weeks) were randomised to a treatment group receiving 5ml VCO applied four times daily or to a control group receiving massage only (no topical treatment). Babies receiving VCO had statistically significantly better NSCS scores than the control group at days 7, 14, 21 and 28 (p<0.01) and were significantly less likely to experience a decrease in skin maturity (p<0.01) or hypothermia (p<0.01), without increase in adverse events including rash or accidental slippage of the baby. However, parents were significantly more likely to rate the intervention as cumbersome (2% versus 0.3%, p<0.001) (Level 1).
In the second RCT6, 72 preterm babies (n<30 weeks) received either no topical emollient (n=36) or 5ml/kg VCO applied twice daily over the body (excluding face, scalp and around medical devices). After 3 weeks of treatment, NSCS score declined for the babies in the control group but remained stable for those receiving VCO (p=0.01). There was no significant difference in adverse events including skin irritation or temperature instability6 (Level 1).
Due to methodological limitations of these studies, more evidence is required to recommend VCO for routine care of immature neonate skin. However, available research suggests that the practice is safe to explore5,6.
Table 2. Summary of clinical evidence for topical coconut products
Considerations for use
- When used as a skin moisturiser, VCO is applied to adults and children by rubbing directly on skin and/or lesions, usually twice daily1,2,4,12,22.
- Topical application of VCO for mild-to-moderate skin conditions is associated with a lower rate of adverse effects than topical corticosteroids4,12.
- To apply VCO to the immature skin of very preterm neonates, stroke the oil onto skin for 2–3 minutes without massage during routine care to avoid excessive handling6.
Conflict of Interest
The authors declare no conflicts of interest in accordance with International Committee of Medical Journal Editors (ICMJE) standards.
The method for development of WHAM (Wound Healing and Management unit at Curtin University, Perth) evidence summaries is consistent with methodology published in Munn Z, Lockwood C, Moola S. The development and use of evidence summaries for point of care information systems: a streamlined rapid review approach. Worldviews Evid Based Nurs 2015;12(3):131–8 and other resources on rapid evidence summaries published by the JBI as cited above. WHAM evidence summaries undergo peer-review by an international multidisciplinary Wound Expert Reference Group. WHAM evidence summaries provide a summary of the best available evidence on specific topics and make suggestions that can be used to inform clinical practice. Evidence contained within this summary should be evaluated by appropriately trained professionals with expertise in wound prevention and management, and the evidence should be considered in the context of the individual, the professional, the geographic and clinical setting and other relevant clinical information.
Funding
The authors received no funding for this evidence summary.
Copyright © 2021 Wound Healing and Management Unit, Curtin University.
![]()
Résumé des données WHAM: efficacité des produits topiques à base de noix de coco
Robin Watts, Teresa Solomon and Emily Haesler
DOI: https://doi.org/10.33235/wcet.41.2.32-35
Question Clinique
Quelles sont les meilleures données disponibles sur l’utilisation de produits topiques à base de noix de coco dans le traitement des plaies et des affections cutanées?
Résumé
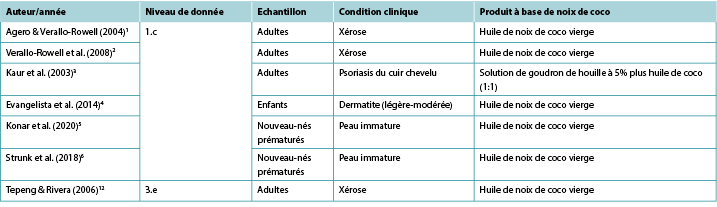
Malgré la large utilisation de produits topiques à base de noix de coco à des fins médicinales dans les régions géographiques tropicales, seul un nombre limité d’études cliniques rapportant son efficacité dans le traitement des affections cutanées et aucune étude rapportant son utilisation dans le traitement des plaies ont été identifiés dans cette rapide vérification. Des données de niveau 11,2 ont démontré que l’huile de coco vierge (HCV) topique est associée à des améliorations des signes et symptômes de la xérose1,2 et du psoriasis3 chez les adultes, et de la dermatite légère à modérée chez les enfants4. Il existe des données prouvant que l’HCV améliore les scores d’immaturité cutanée chez les nouveau-nés prématurés5,6. Actuellement, aucune donnée n’est disponible sur l’utilisation de produits topiques à base de noix coco pour la guérison des blessures humaines.
Recommandations pour la pratique clinique
Toutes les recommandations doivent être appliquées en tenant compte de la plaie, de la personne, du professionnel de santé et du contexte clinique.
- L’HCV topique pourrait être envisagée pour le traitement de la xérose légère à modérée (grade B).
- L’HCV topique pourrait être envisagée pour le traitement du psoriasis en l’absence d’accès à la corticothérapie topique (grade B).
- L’HCV topique pourrait être envisagée pour le traitement de la dermatite atopique légère à modérée chez les enfants (grade B).
Sources des données
Cette synthèse a été réalisée selon les méthodes publiées par le Joanna Briggs Institute (JBI)7-11. La synthèse est basée sur une recherche documentaire systématique combinant des termes de recherche liés aux plaies et aux affections cutanées avec des termes liés au cocotier. Des recherches ont été menées dans les bases de données Embase, Medline, Global Health et Allied and Complementary Medicine, ainsi que dans 10 revues de santé de pays à revenu faible ou intermédiaire, pour trouver des données probantes, publiées en anglais jusqu’en mai 2021. Un niveau de preuve a été attribué aux études (Tableau 1) en fonction de la hiérarchie du JBI7-11. Les recommandations sont formulées sur la base de l’ensemble des données probantes et sont classées selon le système rapporté par le JBI7–11.
Tableau 1. Niveaux de données

Contexte
Différentes parties du cocotier sont utilisées à de multiples fins dans la médecine traditionnelle depuis des milliers d’années, au point que la plante est souvent appelée “arbre de
vie“16. Produits dérivés de Cocos nucifera Linn: Les Arecaacae comprennent l’eau de coco, l’huile de lait de coco ou de coprah (amande séchée), la coque de noix de coco séchée et les fibres de l’enveloppe17,18. Le produit de la noix de coco le plus utilisé, l’huile de coco vierge (HCV), est extrait directement de la chair de la noix de coco et contient des acides gras à chaîne moyenne qui ont des qualités tensioactives1,19,20. Un autre produit testé, la fumée liquide de coque de noix de coco (FL-CC), est produit en brûlant des coques de noix de coco à 400°C, ce qui donne une solution issue de la condensation de la vapeur de la fumée de bois14. Les coques de noix de coco contiennent les propriétés antioxydantes les plus élevées de toutes les parties de la noix de coco14.
Les tests de laboratoire et les analyses biochimiques de ces produits ont permis d’identifier un certain nombre de propriétés utiles - anti-inflammatoires, antimicrobiennes, antifongiques, antioxydantes, antinéoplasiques et analgésiques17,18,20-24. Lorsqu’il est appliqué par voie topique, l’HCV assure une protection de la couche cornée et réduit la perte d’eau transépidermique (PETE), favorisant ainsi l’hydratation de la peau19,20,24,25. Utilisés sur les plaies, l’HCV et d’autres produits dérivés de la noix de coco favoriseraient la synthèse du collagène et une épithélisation plus rapide15,20,24.
Données
Données issues d’études sur les animaux
Les preuves de l’effet cicatrisant de la noix de coco proviennent d’études sur les animaux. Les résultats de trois études13-15 sont fournis à titre d’exemples de la quantité importante de travaux de laboratoire sur ce sujet. Dans la première étude13, entreprise en Inde, l’HCV a été appliquée quotidiennement pendant 10 jours sur des plaies dermiques ouvertes chez le rat. Il y avait trois groupes de six rats chacun - un groupe témoin, un groupe traité avec 0,5ml d’HCV, et un troisième traité avec 1ml d’HCV. Le temps nécessaire à l’épithélisation complète et la composition du tissu de granulation (par exemple, collagène et fibroblastes) faisaient partie des mesures de résultats. En termes de temps d’épithélisation complète et de contenu total en collagène, les groupes 2 et 3 ont été statistiquement significatifs par rapport au contrôle (p<0,05), 1ml étant plus efficace que 0,5ml13 (Niveau 5).
La deuxième étude14 a été menée en Indonésie pour évaluer l’activité curative du FL-CC pour les brûlures. Trente-six souris ont été réparties au hasard en trois groupes (n=12/groupe): FL-CC, solution saline normale à 0,9 % (NaCl) et povidone iodée à 10 %. Les brûlures ont été laissées ouvertes, avec un traitement appliqué deux fois par jour pendant 25 jours. La contraction de la plaie a été mesurée les jours 1, 5, 10 et 25 après l’induction de la brûlure. Le groupe FL-CC a montré la contraction de la plaie la plus rapide des trois groupes au jour 5 (p<0,001). Au jour 10, il y avait une différence statistiquement significative avec le groupe povidone iodée (p<0,001) et au jour 25, il y avait une différence statistiquement significative avec le groupe NaCl (p<0,05)14 (niveau 5).
Dans la troisième étude15, l’HCV pour le traitement des ulcères diabétiques a été explorée avec une population de rats. Les rats présentant des ulcères ont été divisés en quatre groupes: rats non traités, rats non diabétiques (n=18), rats diabétiques non traités (n=18), rats diabétiques recevant 1ml d’HCV appliqué quotidiennement pendant 14 jours (n=18), et rats diabétiques recevant une crème de sulfadiazine d’argent appliquée quotidiennement pendant 14 jours (n=18). Les taux de fermeture des plaies ont été mesurés les jours 5, 10 et 14. Les ulcères diabétiques traités à l’HCV présentaient des taux de fermeture statistiquement plus rapides (p<0,05) par rapport aux ulcères diabétiques ne recevant aucun traitement, et ce, tous les jours. Aux jours 5 et 14, on a constaté une différence statistiquement significative entre le groupe HCV et le groupe de crème à la sulfadiazine d’argent (p<0,05), en faveur du groupe HCV15 (niveau 5).
Données issues d’études sur les êtres humains
Données probantes d’efficacité dans le traitement des plaies
Aucune donnée concernant l’utilisation de produits topiques à base de noix de coco pour le traitement des plaies humaines n’a été identifiée.
Données probantes d’efficacité pour le traitement des affections cutanées
Xérose chez l’adulte
Deux ETR en aveugle1,2 ont fourni des données sur l’utilisation de l’HCV pour soulager la xérose (peau sèche) chez les adultes. Le premier ETR1 a été mené sur 34 personnes souffrant de xérose légère à modérée afin de déterminer l’efficacité et l’innocuité de l’HCV par rapport à l’huile minérale lorsqu’il est utilisé comme hydratant thérapeutique. Les solutions ont été appliquées sur les jambes deux fois par jour pendant 14 jours. L’hydratation de la peau et les lipides cutanés ont été testés pour mesurer l’efficacité tandis que la PETE et le pH de la peau constituaient les mesures quantitatives de l’innocuité. La xérose a été évaluée pour la sécheresse, la desquamation, la rugosité et le prurit à la fois par un investigateur utilisant le Wehr’s Grading et par les participants utilisant une échelle visuelle analogique. Les données ont été recueillies au départ, au jour 7 et au jour 14. Les participants ont également évalué les effets secondaires (par exemple, érythème, picotements ou démangeaisons). Les deux traitements étaient comparables en termes de mesures de d’efficacité et d’innocuité. À la fin de l’étude, 81 % (13/16) des participants du groupe HCV ont montré une amélioration d’au moins un niveau dans le classement de la xérose, contre 72 % (13/18) du groupe huile minérale1 (niveau 1).
Le deuxième ETR2 a comparé l’HCV à l’huile d’olive vierge (HOV) pour soulager la xérose et éliminer le Staphylococcus aureus de la peau chez les adultes atteints de dermatite atopique (n=52). Un groupe a été traité avec de l’HCV et l’autre avec de l’HOV, les huiles étant massées doucement dans la peau deux fois par jour sur deux sites cutanés ne présentant aucun signe clinique d’infection. Les mesures des résultats comprenaient les cultures de peau, la photographie et la composante objective de l’indice de gravité SCORAD (O-IGS). L’évaluation a été faite au début de l’étude et après 4 semaines. Après 4 semaines, le groupe HCV s’est amélioré de manière plus significative sur l’O-IGS par rapport au groupe HOV (p=0,004)2. Dans le groupe HCV, 77 % (20/26) étaient positifs pour S. aureus à l’entrée dans l’étude, contre 46 % (12/26) dans le groupe HOV. Après le traitement, seuls 5% (1/12) du groupe HCV sont restés positifs contre 50% (6/12) du groupe HOV. Le risque relatif pour l’HCV était de 0,1 contre 10,1 pour l’HOV (p=0,00 ; intervalle de confiance [IC] à 95%, 0,01-0,73, nombre de sujets à traiter [NST]=2,2) (niveau 1).
Psoriasis chez l’adulte
Deux études ont fourni des données sur l’utilisation de l’huile de noix de coco pour le traitement du psoriasis. Dans un ETR (n=40)3, des adultes atteints de psoriasis du cuir chevelu ont été répartis au hasard en trois groupes pour évaluer l’efficacité d’émollients relativement anodins: Solution de goudron de houille à 5 % plus huile de coco (1:1) ; 10 % d’urée, 10 % d’acide lactique, 10 % de propylène glycol plus 10 % de paraffine liquide (dans une base de crème) ; et HCV seule. Les trois groupes ont montré une amélioration significative comparable au fil du temps, avec une disparition des symptômes respectivement de 57 %, 64,4 % et
58,3 % (p<0,01) sans effets indésirables. Les auteurs ont noté que les corticostéroïdes topiques ont démontré des taux de réponse et de clairance nettement plus élevés que ceux trouvés par cette étude3 (Niveau 1).
Une étude observationnelle (n=31)12 a exploré l’utilisation de l’HCV appliquée deux fois par jour pendant 8 semaines sur des lésions de psoriasis chez des adultes. L’érythème, la desquamation et l’élévation des plaques ont été évalués toutes les deux semaines à l’aide de photographies et d’une évaluation clinique de la disparition des symptômes. A la fin de l’étude, 16% des participants (5/31) avaient une clairance complète. La réduction de la desquamation a été observée dans la période de 4 à 6 semaines de traitement, tandis que l’érythème et l’élévation de la plaque ont été améliorés dans la période de 6 à 8 semaines. Aucun effet indésirable n’a été constaté12 (niveau 3).
Dermatite chez l’enfant
Un ETR4 (n=117) a comparé l’efficacité de l’HCV topique à celle de l’huile minérale topique chez des enfants (âgés de 1 à 13 ans) atteints de dermatite atopique légère à modérée. Pour les deux groupes de traitement, 5ml d’huile ont été appliqués deux fois par jour. L’impact sur la fonction épidermique a été mesuré à l’aide d’un outil d’évaluation clinique (SSI) et par la mesure du PETE et de la capacitance de la peau, tous mesurés au départ et à 2, 4 et 8 semaines. Sur la mesure de SSI, l’HCV était significativement plus efficace que l’huile minérale (réduction moyenne des symptômes de 68,23% contre 38,13%, p<0,001). Le HCV a également produit des résultats significativement efficaces en termes de PETE sur la période de 8 semaines par rapport au groupe huile minérale (diminution du PETE 70,7% contre 35,36%). En ce qui concerne l’effet émollient des deux huiles, une différence statistiquement significative entre les deux est apparue après 8 semaines de traitement (p=0,03). Aucun effet indésirable n’a été signalé dans le groupe HCV, tandis que cinq enfants du groupe huile minérale ont dû recevoir un traitement de “secours” avec des corticostéroïdes topiques4 (niveau 1).
Traitement de la peau immature chez les nouveau-nés prématurés
Deux ETR non aveugles5,6 ont étudié l’application de l’HCV aux nouveau-nés prématurés pour favoriser la maturité de la peau. Dans les deux études, la maturité de la peau a été évaluée aux jours 7, 14 et 21 à l’aide de la Neonatal Skin Condition Scale (NSCS) qui comprend l’évaluation de la sécheresse, de l’érythème et de la rupture cutanée. Dans les deux études, les bébés présentant des affections cutanées existantes (par exemple, une infection ou une éruption) ont été exclus5,6.
Dans l’ETR le plus important (n=2,294)5, les nouveau-nés prématurés (<37 semaines) ont été répartis au hasard dans un groupe de traitement recevant 5 ml d’HCV appliqués quatre fois par jour ou dans un groupe témoin recevant uniquement des massages (aucun traitement topique). Les bébés recevant l’HCV présentaient des scores NSCS statistiquement significativement meilleurs que ceux du groupe témoin aux jours 7, 14, 21 et 28 (p<0,01) et étaient significativement moins susceptibles de connaître une diminution de la maturité de la peau (p<0,01) ou une hypothermie (p<0,01), sans augmentation des effets indésirables, notamment les éruptions cutanées ou le glissement accidentel du bébé. Cependant, les parents étaient significativement plus susceptibles de qualifier l’intervention de lourde (2% contre 0,3%, p<0,001) (Niveau 1).
Dans le second ETR6, 72 prématurés (n<30 semaines) ont reçu soit aucun émollient topique (n=36), soit 5ml/kg d’HCV appliquéss deux fois par jour sur le corps (à l’exclusion du visage, du cuir chevelu et du pourtour des dispositifs médicaux). Après 3 semaines de traitement, le score NSCS a diminué pour les bébés du groupe témoin mais est resté stable pour ceux recevant l’HCV (p=0,01). Aucune différence significative n’a été constatée en ce qui concerne les effets indésirables, notamment l’irritation cutanée ou l’instabilité de la température6 (niveau 1).
En raison des limites méthodologiques de ces études, des données supplémentaires sont nécessaires pour recommander l’HCV pour les soins de routine de la peau des nouveau-nés immatures. Cependant, les recherches disponibles suggèrent que cette pratique peut être explorée en toute sécurité5,6.
Tableau 2. Synthèse des données cliniques sur les produits topiques à base de noix de coco
Considérations Relatives à l’utilisation
- Lorsqu’elle est utilisée comme hydratant cutané, le HCV est appliquée aux adultes et aux enfants par friction directe sur la peau et/ou les lésions, généralement deux fois par jour1,2,4,12,22.
- L’application topique d’HCV pour les affections cutanées légères à modérées est associée à un taux d’effets indésirables inférieur à celui des corticostéroïdes topiques4,12.
- our appliquer l’HCV sur la peau immature des nouveau-nés très prématurés, appliquer l’huile sur la peau pendant 2 à 3 minutes sans massage pendant les soins de routine afin d’éviter toute manipulation excessive6.
Conflit D’intérêt
Les auteurs ne déclarent aucun conflit d’intérêt conformément aux normes de l’International Committee of Medical Journal Editors (ICMJE).
La méthode de développement des synthèses de données WHAM (Wound Healing and Management unit at Curtin University, Perth) est conforme à la méthodologie publiée dans Munn Z, Lockwood C, Moola S. The development and use of evidence summaries for point of care information systems: a streamlined rapid review approach. Worldviews Evid Based Nurs 2015;12(3):131-8 et d’autres ressources sur les synthèses rapides de données probantes publiées par le JBI comme cité ci-dessus. Les synthèses de données WHAM sont soumises à l’examen de pairs membres d’un groupe de référence international multidisciplinaire d’experts en plaies. Les synthèses de données WHAM fournissent une synthèse des meilleures données probantes disponibles sur des sujets spécifiques et font des suggestions qui peuvent être utilisées pour renseigner la pratique clinique. Les données contenues dans cette synthèse doivent être évaluées par des professionnels dûment formés et spécialisés dans la prévention et la prise en charge des plaies, et les données doivent être considérées dans le contexte de l’individu, du professionnel, du cadre géographique et clinique et de tout autre information clinique pertinente.
Financement
Les auteurs n’ont reçu aucun financement pour cette synthèse de données.
Copyright © 2021 Wound Healing and Management Unit, Université Curtin.
![]()
Author(s)
Robin Watts AM, PhD, MHSc, BA, Dip NEd, FRCNA
Emeritus Professor, School of Nursing, Midwifery and Paramedicine, Wound Healing and Management (WHAM) unit, Curtin University, Perth, WA, Australia
Teresa Solomon BA, Grad Dip Lib Sc ALIA
Curtin University, Perth, WA, Australia
Emily Haesler* PhD, BN, P Grad Dip Adv Nurs, FWA
Adjunct Associate Professor, School of Nursing, Midwifery and Paramedicine, Wound Healing and Management (WHAM) unit, Curtin University, Perth, WA, Australia
Email Emily.haesler@curtin.edu.au
* Corresponding author
References
- Agero AL, Verallo-Rowell VM. A randomized double-blind controlled trial comparing extra virgin coconut oil with mineral oil as a moisturizer for mild to moderate xerosis. Dermatitis 2004;15(3):109–16.
- Verallo-Rowell VM, Dillague KM, Syah-Tjundawan BS. Novel antibacterial and emollient effects of coconut and virgin olive oils in adult atopic dermatitis. Dermatitis 2008;19(6):308–15.
- Kaur I, Saraswat A, Kumar B. A comparison of three therapeutic modalities in scalp psoriasis and a review of literature. Indian J Dermatol 2003;48.
- Evangelista MT, Abad-Casintahan F, Lopez-Villafuerte L. The effect of topical virgin coconut oil on SCORAD index, transepidermal water loss, and skin capacitance in mild to moderate pediatric atopic dermatitis: a randomized, double-blind, clinical trial. Int J Dermatol 2014;53(1):100–8.
- Konar MC, Islam K, Roy A, Ghosh T. Effect of virgin coconut oil application on the skin of preterm newborns: a randomized controlled trial. J Trop Pediatr 2020;66(2):129–35.
- Strunk T, Pupala S, Hibbert J, Doherty D, Patole S. Topical coconut oil in very preterm infants: an open-label randomised controlled trial. Neonatol 2018;113(2):146–51.
- Munn Z, Lockwood C, Moola S. The development and use of evidence summaries for point of care information systems: a streamlined rapid review approach. Worldviews Evid Based Nurs 2015;12(3):131–8. doi:10.1111/wvn.12094. PMID: 25996621.
- Aromataris E, Munn Z, editors. JBI manual for evidence synthesis. Joanna Briggs Institute; 2021. Available from: https://synthesismanual.jbi.global
- Joanna Briggs Institute (JBI) Levels of Evidence and Grades of Recommendation Working Party. New JBI grades of recommendation; 2013. Available from: https://jbi.global/sites/default/files/2019-05/JBI-grades-of-recommendation_2014.pdf
- Joanna Briggs Institute (JBI) Levels of Evidence and Grades of Recommendation Working Party. Supporting document for the Joanna Briggs Institute Levels of Evidence and Grades of Recommendation; 2014. Available from: https://jbi.global/sites/default/files/2019-05/JBI%20Levels%20of%20Evidence%20Supporting%20Documents-v2.pdf
- Joanna Briggs Institute (JBI) Levels of Evidence and Grades of Recommendation Working Party. JBI levels of evidence; 2013. Available from: https://jbi.global/sites/default/files/2019-05/JBI-Levels-of-evidence_2014_0.pdf
- Tepeng K, Rivera F. Virgin coconut oil for psoriasis. J Am Acad Dermatol 2006;54(3):AB210.
- Nevin KG, Rajamohan T. Effect of topical application of virgin coconut oil on skin components and antioxidant status during dermal wound healing in young rats. Skin Pharmacol Physiol 2010;23(6):290–7.
- Tarawan VM, Mantilidewi KI, Dhini IM, Radhiyanti PT, Sutedja E. Coconut shell liquid smoke promotes burn wound healing. J Evid Based Complement Altern Med 2017;22(3):436–40.
- Soliman AM, Lin TS, Ghafar NA, Das S. Virgin coconut oil and diabetic wound healing: histopathological and biochemical analysis. Eur J Anat 2018;22(2):135–44.
- DebMandalm M, Mandalm S. Coconut (Cocos nucifera L.: Arecaceae): in health promotion and disease prevention. Asian Pacific J Trop Med 2011;4(3):241–7.
- Dua K, Sheshala R, Ling T, Ling S, Gorajana A. Anti-inflammatory, antibacterial and analgesic potential of Cocos nucifera Linn.: a review. Med Chem (Los Angeles) 2013;12(2):158–64.
- Vaughn AR, Clark AK, Sivamani RK, Shi VY. Natural oils for skin-barrier repair: ancient compounds now backed by modern science. Am J Clin Dermatol 2018;19(1):103–17.
- Ayanlowo O, -Adeife OC, Ilomuanya M, Ebie C, Adegbulu A, Ezeanyache O, Odiase O, Ikebudu V, Akanbi B. African oils in dermatology. Dermatol Ther 2021 Apr 30:e14968. doi:10.1111/dth.14968. PMID: 33928725.
- Chew YL. The beneficial properties of virgin coconut oil in management of atopic dermatitis. Pharmacog Rev 2019;13(25):24–7.
- Lima E, Sousa C, Meneses L, Ximenes N, Santos Junior G, Vasconcelos G, Lima N, Patroninio M, Macedo D, Vasconcelos S. Cocos nucifera (L.) (Arecaceae): a phytochemical and pharmacological review. Braz J Med Biol Res 2015;48(11):953–64.
- Alves AQ, da Silva VA, Goes AJS, Silva MS, de Oliveira GG, Bastos IVGA, de Castro Neto AG, Alves AJ. The fatty acid composition of vegetable oils and their potential use in wound care. Adv Skin Wound Care 2019;32(8):1–8.
- Kh H, Kuttinath S, Rammohan R. First description of antibacterial and in vitro wound healing properties of Cocos nucifera tomentum. Asian J Pharm Clin Res 2019;12(5):118–22.
- Lin TK, Zhong L, Santiago JL. Anti-inflammatory and skin barrier repair effects of topical application of some plant oils. Int J Mol Sci 2018;19(1).
- Karagounis TK, Gittler JK, Rotemberg V, Morel KD. Use of “natural” oils for moisturization: review of olive, coconut, and sunflower seed oil. Pediatr Dermatol 2019;36(1):9–15.
