Volume 42 Number 1
WHAM evidence summary: Papaya-based products for treating wounds
Terena Solomons and Emily Haesler
Keywords debridement, wounds, Papaya, pawpaw, papain
For referencing Solomons T and Haesler E. WHAM evidence summary: Papaya-based products for treating wounds. WCET® Journal 2022;42(1):34-39
DOI https://doi.org/10.33235/wcet.42.1.34-39
Cliunical question
What is the best available evidence on the effectiveness of papaya-based products for wound healing?
Summary
Despite a long history in low-to-middle resource countries of clinical use of papaya for managing wounds, limited high level research has been conducted on the effectiveness of papaya-based products. Evidence was available for natural papaya pulp wound dressings, commercial papain extract products (withdrawn from market in some countries due to the risk of anaphylaxis) and an experimental papaya filtrate product (not commercially available). Most studies were conducted in hard-to-heal wounds requiring debridement and the studies were generally at a high risk of bias.
Level 1 evidence1 and Level 2 evidence2 for papaya pulp dressings demonstrated an improvement in wound tissue type. Level 3 evidence3-5 suggested papaya pulp dressings were associated with improvement in wound tissue type, reasonable healing rates and reduction in requirement for further surgical interventions. Level 1 evidence6-9 for commercial papain products showed improvements in wound tissue type6, 7 and reduction in wound surface area8, 9. Other Level 1 evidence10 failed to demonstrate effectiveness, and Level 4 evidence was mixed.10-12
Clinical practice recommendations
All recommendations should be applied with consideration to the wound, the person, the health professional and the clinical context.
There is insufficient evidence to make a graded recommendation on the effectiveness of papaya-based products for promoting wound healing.
Evaluate the individual’s risk of allergic reaction (e.g., previous latex allergy) and licensing guidance in the geographic region before using topical papaya-based products. Cease use of natural papaya pulp dressings if the person experiences adverse outcomes (Grade B).
Search for evidence
This summary was developed using methods published by the Joanna Briggs Institute (JBI)13-17. The summary is based on a systematic literature search in English combining search terms that describe wounds and papaya. Searches were conducted in Embase, Medline, PubMed, Global Health, the Cochrane Library, Allied Health and Complementary Medicine and Google Scholar databases for dates up to December 2021. Searches were also conducted in ten healthcare journals from low-and-middle resource countries. Evidence was limited to clinical studies in humans. Studies were assigned a level of evidence (see Table One) based on JBI’s hierarchy13-17. Recommendations are made based on the body of evidence and are graded according to the system reported by JBI13-17.
Table One: Levels of evidence

Background
Papaya (Carica papaya, also called pawpaw) is a tropical plant originating from Southern Mexico and Central America that is now cultivated in tropical and subtropical regions worldwide. Many parts of the tree (e.g., fruit, leaves, seeds and bark) have been used in traditional medicine26. Biochemical analysis of papaya has identified several protease enzymes (e.g., papain and chymopapain) with debriding properties that are purported to remove slough and non-viable tissue and prepare the wound bed for healing. Papaya extract has also been reported to have antimicrobial properties9, 23, 24, 26. Papaya-based treatment is reported to be cost-effective7, 11, and papapaya pulp dressings have been successfully applied and managed by patients/unskilled carers in community settings1, 18.
The literature search identified several methods of applying papaya-based products to a wound:
- Natural papaya pulp dressing: Raw pulp from the fruit is prepared and applied directly to the wound bed.
- Commercial processed preparations: Products containing papain enzyme are available in gel, cream, impregnated dressings and other topically applied formulations. Papain is sometimes combined with other active agents including urea and chlorophyllin-copper complex to enhance its action25. Due to the risk of severe allergic response, papain-based topical agents are banned by the (USA) Food and Drug Administration22.
- Experimental processed formulation: A product prepared as papaya and peach (10-1 by volume), with the fruit flesh treated in a series of processes (titled OPAL001) to form two products – a filtrate and a cream11, 12. The mechanism of activity for the product were hypothesised to be related to either proinflammatory response, antioxidant effect and/or vasorelaxation12. The product is not currently listed with the Therapeutic Goods Administration in Australia where it was developed.
Although no serious adverse reactions were identified in the studies in this evidence summary, papaya has been associated with severe allergic reaction and anaphylaxis, including cross-reactivity in people with latex allergy. This has led to withdrawal of commercial papain-based products from the market in some countries, including the USA22, 26. Anaphylactic reaction is reported to occur at a rate of 1%;27 the response might be associated with the concentration of active ingredients, which is generally higher in processed perparations compared with the natural fruit pulp26.
Evidence
Papaya for improving clinical outcomes in chronic wounds
Studies reporting papaya pulp dressing for wound healing outcomes
One RCT1 compared the efficacy of two methods of debridement – enzymatic debridement using papaya pulp dressings and mechanical debridement using wet-to-dry saline dressings. Following randomisation, 128 participants were enrolled in the study. Of these, 93% had a chronic wound (7% hard wound dehiscence following surgery). There was a significant improvement in granulation tissue formation with papaya dressings compared to wet-to-dry dressings in the third and fourth weeks (p < 0.001) and superior reduction in slough/necrotic tissue for the papaya dressing group compared to the wet-to-dry dressing group at each weekly assessment point (week four, p = 0.0082). However, this did not translate to a significant difference in either reduction in mean wound size at four weeks (p = 0.08) or complete wound healing at three months (papaya 78% versus saline 72%, p = 0.488)1 (Level 1.c).
A quasi-experimental study2 assessed papaya pulp dressing prepared using fresh ripe fruit for healing diabetic foot ulcers. A convenience sample of 60 participants was assigned to either an experimental or control treatment (n = 30 in each group). The papaya dressings were changed daily for 14 days, while the control group received unspecified routine treatment. A significant improvement in healing occurred over time in the group receiving papaya dressing, as measured using the mean healing score on the Bates-Jensen Wound Assessment Tool (BWAT; pre-test 26.37 ± 7.73 versus post- test 51.10 ± 6.81, p < 0.001). A significant difference between the experimental and control group was also reported (p < 0.001)2 (Level 2.c).
A prospective study3 followed 94 patients who underwent a surgical procedure to treat a diabetic foot ulcer: amputation (n = 31) or surgical debridement (n = 63). Thereafter and in conjunction with oral antibiotic therapy, papaya pulp dressings were used for 89% (n = 74) of patients. The grated papaya was prepared, applied daily and covered with sterile gauze. Average healing time, defined as achieving healthy granulation tissue with epithelialised wound edges was 21.56 days (range from 17 to 28 days). Further surgery was required for ten patients3 (Level 3.e).
A second prospective study4 reported outcomes for 135 patients receiving papaya pulp dressings for diabetic foot ulcers (Grade 1-3 on Wagner’s classification system). Prior to commencing the second-daily dressing regimen, 96 patients (71.11%) required surgical debridement. Mean healing time, defined as achieving healthy granulation tissue and epithelialised wound edges, was 19.65 ± 3.47 days (range 14 to 29 days)4 (Level 3.e).
A study5 that included patients who were receiving combined therapy for diabetic foot ulcers (n = 43) tested the effect of papaya pulp dressings on healing. The papaya dressings were changed every two days. Healing time, defined as achieving healthy granulation tissue with epithelialised wound edges, ranged from 18 to 29 days (mean 19.23 days ± 3.624) and 88% of the ulcers required no further surgical intervention after papaya dressings commenced5 (Level 3.e).
A case study reported effective use of papaya pulp dressings to heal a post-radiation sacral ulcer. The wound had received surgical debridement, honey dressings, negative pressure wound therapy and failed flap surgery prior to commencing papaya treatment. Second-daily papaya pulp dressing led to healthy granulation after six weeks, allowing the patient to undergo a follow-up successful flap repair21 (Level 4.d).
Studies reporting processed papaya-based preparations for wound healing outcomes
In the largest RCT6 exploring processed papaya-based products, 100 participants with hard-to-heal, sloughy wounds received either papain-urea or collagenase debriding ointment. Treatment was commenced when the wound was stable (no healing observed over the preceding eight weeks) and continued for four weeks, with weekly assessment. The papain-urea group showed statistically significantly superior reduction in slough/necrotic tissue over time (89.22% ± 15.16% versus 82.51% ± 17.45%, p = 0.043). Between-group difference was not statistically significant in the first three weeks, and the small difference observed in week four may not be clinically significant. Percent of granulation tissue was statistically significantly greater for the papain-urea group at every weekly assessment, including baseline (week four: papain-urea 6.82% ± 8.15% versus collagenase 3.58% ± 3.09%, p = 0.01)6 (Level 1.c).
Sixty participants with diabetic foot ulcers were randomly assigned to received either papain-urea or an unidentified conventional wound dressing to explore the effectiveness of a commercially available papaya-based debriding agent.7 Both treatments were applied second-daily. The papain group achieved statistically significantly greater reduction of necrotic tissue (72.27% ± 4.68% versus 24.63% ± 3.74%, p = 0.03) and faster granulation (8.73 ± 2.37 days versus 16.03 ± 4.68 days, p = 0.001). The superior outcome led to faster hospital discharge7 (Level 1.c).
In a small, double-blind RCT18, 8% papain gel was compared to both fibrin gel a non-active gel control for the healing of chronic venous ulcers (n = 55 people with n = 63 ulcers). Individual ulcers were randomised to one of the three groups and assessed at baseline then every 15 days. Neither fibrin gel nor papain gel improved ulcer healing compared to the control. This conclusion was based on the following: complete wound healing rates were similar in all groups (fibrin gel 14.3%, papain gel 21.1% and control 30.4%, p = 0.43) and no statistically significant difference between groups in reduction in wound area (p = 0.62). All groups achieved improvements in exudate levels, signs of local wound infection and edge epithelisation by day 60 (all p > 0.05). Two participants (one in each of the active treatment groups) reported mild pain18 (Level 1.c).
In a small, non-blinded RCT, Rodrigues et. al. (2015)8 reported on the effectiveness of 2% papain gel compared to 2% carboxymethyl cellulose gel for healing venous leg ulcers. Twenty-one participants were randomised, of which 18 participants (n = 28 ulcers) completed the 12-week study. The results showed a statistically significant reduction in wound area for ulcers treated with papain, particularly between the fifth and 12th week of treatment (p = 0.032) and this was statistically significant compared to the control group (p = 0.006). However, the rate of complete healing was low (two ulcers treated with papaya and no control group ulcers completely healed in 12 weeks) and the amount of exudate and devitalised tissue were similar in both groups (p > 0.05 for both)8 (Level 1.c).
Another non-blinded small RCT19 (n = 29 randomised, n = 26 analysed) compared papain-urea to collagenase in non-infected pressure injuries. Participants were treated with moist-to-moist saline dressings in a screening period for up to two weeks prior to commencing the trial. After four weeks of treatment, papain-urea ointment was deemed to be statistically significantly (p < 0.05) superior for reducing wound size, with no pain or discomfort experienced by participants19 (Level 1.c).
Several case studies10-12 reporting use of OPAL001 papaya-based products have been published. In the first report, 11 quadriplegic patients with Category/Stage 2 and 4 pressure injuries received OPAL001 products in conjunction with contemporary wound dressings. Complete healing was achieved for nine of the pressure injuries after 6 days to 14 weeks of treatment11. In the second case report, removal of non-viable tissue and healing was achieved for two diabetic foot ulcers, one venous leg ulcer and an ulcerated skin graft in individuals with impaired vascular function10. The third case report12 detailed reduction in hyperkeratosis and the size of a sacral pressure injury after four weeks of treatment with OPALA filtrate and cream. Ongoing self-treatment with OPALA cream achieved resolution of hyperkeratosis, but the pressure injury deteriorated12 (all Level 4.d).
Table Two: Summary of the evidence for papaya-based treatments
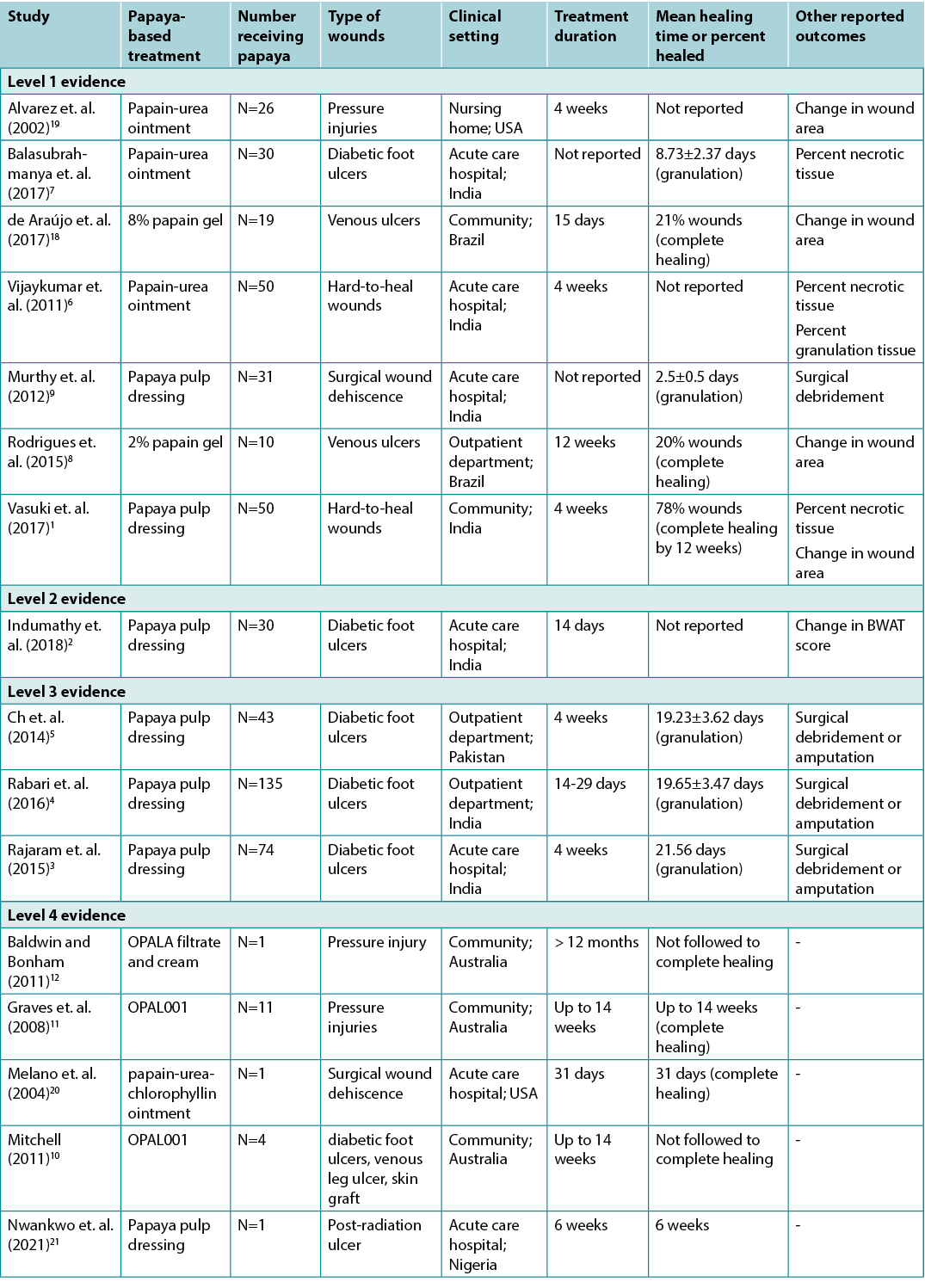
Papaya for treating surgical wound dehiscence
An RCT9 compared the safety and efficacy of papaya pulp dressings with hydrogen peroxide solution in patients with wound dehiscence post-caesarean section (n = 63). Participants received concurrent antibiotics selected following culture and sensitivity. Time required to develop healthy granulation tissue in the hydrogen peroxide group was 6.2 ± 1.6 days compared to the papaya group at 2.5 ± 0.5 days (p < 0.05). Only 3.2% of the papaya dressing group required additional surgical debridement compared with 56% of the hydrogen peroxide group (p < 0.05). Minor adverse events (e.g., local irritation) were reported but not significantly different to those associated with hydrogen peroxide9 (n.b., hydrogen peroxide is not recommended for irrigating wounds) (Level 1.c).
A case study20 reported that the use of a papain-urea-chlorophyllin product applied to post-surgical sternal wound dehiscence was associated with complete healing after 31 days of second-daily treatment. The patient received concurrent negative pressure wound therapy20 (Level 4.d).
Considerations for use
- Papaya-based products facilitate breakdown of necrotic and nonviable tissues that contain protein and the debriding action is from the top downward in the wound. Debridement should be ceased when the wound bed is cleared of slough and necrotic tissue25.
- There is no standardised method of preparing papaya pulp dressing. Studies variably use ripe, semi-ripe or unripe fruit pulp9. Enzymatic content of the pulp is reported to potential decrease as the fruit ripens, suggesting raw or semi-ripe fruit is more effective1, 4, 9. Antimicrobial properties are reported to remain consistent as fruit ripens1, 4, 9.
- The following preparation method for papaya pulp dressings is reported:
- Remove the skin and seeds from papaya fruit2, 5.
- Either grate the fruit pulp9, 21, or mash it to a paste.
- Apply the papaya pulp to wound bed after cleansing the wound.9, 21
- Covered with sterile gauze9.
- Change the papaya pulp dressing daily2, 5 or second daily9, 21.
- Unused papaya paste should be placed in cold storage5.
Conflicts of interest
The author declares no conflicts of interest in accordance with International Committee of Medical Journal Editors (ICMJE) standards.
About WHAM evidence summaries
Wound Healing and management Collaborative (WHAM) evidence summaries are consistent with methodology published in:
Munn Z, Lockwood C, Moola S. The development and use of evidence summaries for point of care information systems: A streamlined rapid review approach, Worldviews Evid Based Nurs. 2015;12(3):131-8.
Methods are outlined in detail in resources published by the Joanna Briggs Institute as cited in this evidence summary, and on the WHAM website: http://WHAMwounds.com. WHAM evidence summaries undergo peer-review by an international multidisciplinary Expert Reference Group.
WHAM evidence summaries provide a summary of the best available evidence on specific topics and make suggestions that can be used to inform clinical practice. Evidence contained within this summary should be evaluated by appropriately trained professionals with expertise in wound prevention and management, and the evidence should be considered in the context of the individual, the professional, the clinical setting and other relevant clinical information.
Copyright © 2021 Wound Healing and Management (WHAM) Collaborative, Curtin University.

Synthèse des données WHAM: Produits à base de papaye pour le traitement des plaies
Terena Solomons and Emily Haesler
DOI: https://doi.org/10.33235/wcet.42.1.34-39
Question clinique
Quelles sont les meilleures données probantes disponibles de l'efficacité des produits à base de papaye pour la cicatrisation des plaies ?
Synthèse
Malgré une longue histoire d'utilisation clinique de la papaye pour le traitement des plaies dans les pays à ressources faibles ou moyennes, peu de recherches de haut niveau ont été menées sur l'efficacité des produits à base de papaye. Des données probantes étaient disponibles pour les pansements naturels à base de pulpe de papaye, les produits commerciaux à base d'extrait de papaïne (retirés du marché dans certains pays en raison du risque d'anaphylaxie) et un produit expérimental à base de filtrat de papaye (non disponible dans le commerce). La plupart des études ont été menées sur des plaies difficiles à cicatriser nécessitant un débridement et les études présentaient généralement un risque élevé de biais.
Les données de niveau 11 et de niveau 22 concernant les pansements de pulpe de papaye ont démontré une amélioration du type de tissu de la plaie. Les données de niveau 33-5 ont suggéré que les pansements de pulpe de papaye étaient associés à une amélioration du type de tissu de la plaie, à des taux de cicatrisation raisonnables et à une réduction de la nécessité d'autres interventions chirurgicales. Les données de niveau 16-9 concernant les produits commerciaux à base de papaïne ont montré une amélioration du type de tissu de la plaie6, 7 et une réduction de la surface de la plaie8, 9. D'autres données de niveau 110 n'ont pas réussi à démontrer une efficacité, et les données de niveau 4 étaient mitigées.10-12
Recommandations pour la pratique clinique
Toutes les recommandations doivent être appliquées en tenant compte de la plaie, de la personne, du professionnel de santé et du contexte clinique.
Les données probantes sont insuffisantes pour formuler une recommandation graduée sur l'efficacité des produits à base de papaye pour favoriser la cicatrisation des plaies.
Avant d'utiliser des produits topiques à base de papaye, évaluez le risque de réaction allergique de la personne (par exemple, allergie antérieure au latex) et les directives d'homologation dans la région géographique. Cesser l'utilisation des pansements naturels de pulpe de papaye si la personne présente des résultats indésirables (grade B).
Recherche de preuves
Cette synthèse a été réalisée selon les méthodes publiées par le Joanna Briggs Institute (JBI)13-17. Le résumé est basé sur une recherche systématique de la littérature en anglais combinant les termes de recherche qui décrivent les plaies et la papaye. Des recherches ont été menées dans les bases de données Embase, Medline, PubMed, Global Health, la Cochrane Library, Allied Health and Complementary Medicine et Google Scholar pour des publications allant jusqu'à décembre 2021. Des recherches ont également été effectuées dans dix revues de santé de pays à ressources faibles et moyennes. Les données sont limitées aux études cliniques chez l'homme. Un niveau de données a été attribué aux études (voir Tableau 1) en fonction de la hiérarchie du JBI13-17. Les recommandations sont formulées sur la base de l'ensemble des données probantes et sont classées selon le système rapporté par le JBI13-17.
Tableau 1: Niveaux de données

Contexte
La papaye (Carica papaya, également appelée pawpaw) est une plante tropicale originaire du sud du Mexique et de l'Amérique centrale qui est maintenant cultivée dans les régions tropicales et subtropicales du monde entier. De nombreuses parties de l'arbre (par exemple, les fruits, les feuilles, les graines et l'écorce) étaient utilisées en médecine traditionnelle26. L'analyse biochimique de la papaye a permis d'identifier plusieurs enzymes protéases (par exemple, la papaïne et la chymopapaïne) ayant des propriétés débridantes qui sont censées éliminer la boue et les tissus non viables et préparer le lit de la plaie à la cicatrisation. L'extrait de papaye a également été présenté comme ayant des propriétés antimicrobiennes9, 23, 24, 26. Le traitement à base de papaye serait rentable économiquement7, 11, et les pansements de pulpe de papaye ont été appliqués et gérés avec succès par des patients/soignants non qualifiés dans des contextes de la société1, 18.
La recherche documentaire a permis d'identifier plusieurs méthodes d'application de produits à base de papaye sur une plaie :
- Pansement naturel de pulpe de papaye : La pulpe crue du fruit est préparée et appliquée directement sur le lit de la plaie.
- Préparations commerciales transformées : Les produits contenant l'enzyme papaïne sont disponibles sous forme de gel, de crème, de pansements imprégnés et d'autres formulations pour application topique. La papaïne est parfois associée à d'autres agents actifs, notamment l'urée et le complexe chlorophylline-cuivre, pour renforcer son action25. En raison du risque de réaction allergique grave, les agents topiques à base de papaïne sont interdits par la Food and Drug Administration (États-Unis)22.
- Formulation expérimentale traitée : Produit préparé à partir de papaye et de pêche (10-1 en volume), la chair du fruit étant traitée dans une série de procédés (intitulés OPAL001) pour former deux produits - un filtrat et une crème11, 12. On a supposé que le mécanisme d'activité du produit était lié à une réponse pro-inflammatoire, à un effet antioxydant et/ou à une vasorelaxation12. Le produit n'est actuellement pas inscrit sur la liste de l’Administration des produits thérapeuthiques en Australie où il a été développé.
Bien qu'aucun effet indésirable grave n'ait été identifié dans les études figurant dans cette synthèse de données, la papaye a été associée à une réaction allergique grave et à l'anaphylaxie, incluant une réaction croisée chez les personnes allergiques au latex. Cela a conduit au retrait du marché des produits commerciaux à base de papaïne dans certains pays, dont les États-Unis22, 26. Une réaction anaphylactique est rapportée à un taux de 1%;27 la réaction pourrait être associée à la concentration des ingrédients actifs, qui est généralement plus élevée dans les préparations transformées par rapport à la pulpe de fruit naturelle26.
Données
La papaye pour améliorer les résultats cliniques des plaies chroniques
Études faisant état de pansements de pulpe de papaye pour la cicatrisation des plaies
Un ECR1 a comparé l'efficacité de deux méthodes de
débridement : le débridement enzymatique à l'aide de pansements de pulpe de papaye et le débridement mécanique à l'aide de pansements salins humides à secs. Après randomisation, 128 participants ont été inscrits à l'étude. Parmi eux, 93% présentaient une plaie chronique (7% de déhiscence importante de la plaie après la chirurgie). On a constaté une amélioration significative de la formation du tissu de granulation avec les pansements de papaye par rapport aux pansements humides à secs au cours des troisième et quatrième semaines (p < 0,001) et une réduction supérieure de la boue/du tissu nécrotique pour le groupe des pansements de papaye par rapport au groupe des pansements humides à secs à chaque point d'évaluation hebdomadaire (quatrième semaine, p = 0,0082). Cependant, cela ne s'est pas traduit par une différence significative dans la réduction de la taille moyenne de la plaie à quatre semaines
(p = 0,08) ni dans la cicatrisation complète de la plaie à trois mois (papaye 78 % contre solution saline 72 %, p = 0,488)1 (Niveau 1.c).
Une étude quasi-expérimentale2 a évalué le pansement de pulpe de papaye préparé à partir de fruits frais mûrs pour la cicatrisation des ulcères du pied diabétique. Un échantillon de commodité de 60 participants a été affecté soit à un traitement expérimental soit à un traitement de contrôle (n = 30 dans chaque groupe). Les pansements de papaye ont été changés quotidiennement pendant 14 jours, tandis que le groupe témoin a reçu un traitement standard non spécifié. Une amélioration significative de la cicatrisation s'est produite au fil du temps dans le groupe recevant le pansement de papaye, comme le montre le score moyen de cicatrisation mesuré sur l'outil d'évaluation des plaies de Bates-Jensen (BWAT ; pré-test 26,37 ± 7,73 contre post-test
51,10 ± 6,81, p < 0,001). Une différence significative entre le groupe expérimental et le groupe témoin a également été rapportée (p < 0,001)2 (niveau 2.c).
Une étude prospective3 a suivi 94 patients ayant subi une intervention chirurgicale pour traiter un ulcère du pied
diabétique : amputation (n = 31) ou débridement chirurgical (n = 63). Par la suite et en conjonction avec un traitement antibiotique oral, les pansements de pulpe de papaye ont été utilisés pour 89% (n = 74) des patients. La papaye râpée a été préparée et appliquée quotidiennement, et recouverte d'une gaze stérile. Le temps moyen de cicatrisation, défini comme l'obtention d'un tissu de granulation sain avec des bords de plaie épithélialisés, était de 21,56 jours (de 17 à 28 jours). Une intervention chirurgicale supplémentaire a été nécessaire pour dix patients3(Niveau 3.e).
Une deuxième étude prospective4 a décrit les résultats de 135 patients ayant reçu des pansements de pulpe de papaye pour des ulcères du pied diabétique (grade 1-3 selon le système de classification de Wagner). Avant de commencer le deuxième régime de pansement quotidien, 96 patients (71,11 %) ont dû subir un débridement chirurgical. Le temps moyen de cicatrisation, défini comme l'obtention d'un tissu de granulation sain et des bords de plaie épithélialisés, était de 19,65 ± 3,47 jours (intervalle de 14 à 29 jours)4 (Niveau 3.e).
Une étude5 portant sur des patients recevant une thérapie combinée pour des ulcères du pied diabétique (n = 43) a testé l'effet des pansements de pulpe de papaye sur la cicatrisation. Les pansements de papaye étaient changés tous les deux jours. Le temps de cicatrisation, défini comme l'obtention d'un tissu de granulation sain avec des bords de plaie épithélialisés, allait de 18 à 29 jours (moyenne de 19,23 jours ± 3,624) et 88 % des ulcères n'ont nécessité aucune autre intervention chirurgicale après le début des pansements de papaye5(Niveau 3.e).
Une étude de cas a rendu compte l'utilisation efficace de pansements de pulpe de papaye pour guérir un ulcère sacral post-radiation. Avant de commencer le traitement à la papaye, la plaie avait fait l'objet d'un débridement chirurgical, de pansements au miel, d'une thérapie par pression négative et d'une chirurgie par lambeau qui avait échoué. Un pansement de pulpe de papaye changé deux fois par jour a conduit à une granulation saine après six semaines, ce qui a permis à la patiente de bénéficier d’un suivi de réparation de lambeau réussie21 (niveau 4.d).
Études rapportant des préparations à base de papaye transformée pour la cicatrisation des plaies
Dans le plus grand ECR6 explorant les produits transformés à base de papaye, 100 participants souffrant de plaies difficiles à cicatriser et spongieuses ont reçu soit de la papaïne-urée, soit une pommade débridante à base de collagénase. Le traitement a été commencé lorsque la plaie était stable (aucune cicatrisation observée au cours des huit semaines précédentes) et a été poursuivi pendant quatre semaines, avec une évaluation hebdomadaire. Le groupe papaïne-urée a montré une réduction statistiquement supérieure du tissu nécrotique dans le temps (89,22 % ± 15,16 % contre 82,51 % ± 17,45 %, p = 0,043). La différence entre les groupes n'était pas statistiquement significative au cours des trois premières semaines, et la petite différence observée à la quatrième semaine pourrait ne pas être cliniquement significative. Le pourcentage de tissu de granulation était statistiquement supérieur dans le groupe papaïne-urée à chaque évaluation hebdomadaire, y compris au départ (semaine
4 : papaïne-urée 6,82 % ± 8,15 % contre collagénase 3,58 % ±
3,09 %, p = 0,01)6 (Niveau 1.c).
Soixante participants souffrant d'ulcères du pied diabétique ont été répartis au hasard pour recevoir soit de la papaïne-urée soit un pansement conventionnel non identifié afin d'explorer l'efficacité d'un agent débridant à base de papaye disponible dans le commerce.7 Les deux traitements étaient appliqués deux fois par jour. Le groupe papaïne a obtenu une réduction statistiquement significative du tissu nécrotique (72,27 % ± 4,68 % contre
24,63 % ± 3,74 %, p = 0,03) et une granulation plus rapide
(8,73 ± 2,37 jours contre 16,03 ± 4,68 jours, p = 0,001). Le résultat supérieur a permis une sortie d'hôpital plus rapide7(Niveau 1.c).
Dans un petit ECR en double aveugle18, un gel de papaïne à 8 % a été comparé à un gel de fibrine ainsi qu’à un gel témoin non actif pour la guérison d'ulcères veineux chroniques (n = 55 personnes avec n = 63 ulcères). Les ulcères individuels ont été répartis au hasard dans l'un des trois groupes et évalués au départ puis tous les 15 jours. Ni le gel de fibrine ni le gel de papaïne n'ont amélioré la cicatrisation des ulcères par rapport au témoin Cette conclusion était basée sur les éléments suivants : les taux de cicatrisation complète étaient similaires dans tous les groupes (gel de fibrine 14,3 %, gel de papaïne 21,1 % et contrôle 30,4 %, p = 0,43) et il n’y avait aucune différence statistiquement significative entre les groupes en ce qui concerne la réduction de la surface de la plaie (p = 0,62). Tous les groupes ont obtenu une amélioration des niveaux d'exsudat, des signes d'infection locale de la plaie et de l'épithélisation des bords au jour 60 (tous les groupes p > 0,05). Deux participants (un dans chacun des groupes de traitement actif) ont signalé une douleur légère18(Niveau 1.c).
Dans un petit ECR sans insu (non aveugle), Rodrigues et al. (2015)8 ont décrit l'efficacité du gel de papaïne à 2% par rapport au gel de carboxyméthylcellulose à 2% pour la cicatrisation des ulcères de jambe veineux. Vingt et un participants ont été randomisés, dont 18 (n = 28 ulcères) ont terminé l'étude de 12 semaines. Les résultats ont montré une réduction statistiquement significative de la surface de la plaie pour les ulcères traités à la papaïne, en particulier entre la cinquième et la douzième semaine de traitement (p = 0,032), et ces résultats étaient statistiquement signifiant par rapport au groupe témoin (p = 0,006). Cependant, le taux de cicatrisation complète était faible (deux ulcères traités à la papaye et aucun ulcère du groupe témoin n'a complètement cicatrisé en 12 semaines) et la quantité d'exsudat et de tissu dévitalisé était similaire dans les deux groupes (p > 0,05 pour les deux)8 (Niveau 1.c).
Un autre petit ECR non aveugle19 (n = 29 randomisés, n = 26 analysés) a comparé la papaïne-urée à la collagénase dans les lésions de pression non infectées. Les participants ont été traités avec des pansements salins humides à humides pendant une période de d’observation allant jusqu'à deux semaines avant de commencer l'essai. Après quatre semaines de traitement, la pommade papaïne-urée a été jugée supérieure, de manière statistiquement significative (p < 0,05), pour la réduction de la taille de la plaie, sans que les participants aient ressenti de douleur ou d'inconfort19(niveau 1.c).
Plusieurs études de cas10-12 faisant état de l'utilisation de produits OPAL001 à base de papaye ont été publiées. Dans le premier rapport, 11 patients tétraplégiques présentant des lésions de pression de catégorie/stade 2 et 4 ont reçu des produits OPAL001 conjointement avec des pansements appliqués dans le même temps. Une guérison complète a été obtenue pour neuf des lésions de pression après 6 jours à 14 semaines de traitement11. Dans le deuxième rapport de cas, l'élimination des tissus non viables et la cicatrisation ont été obtenues pour deux ulcères de pied diabétique, un ulcère de jambe veineux et une greffe de peau ulcérée chez des personnes ayant une fonction vasculaire altérée10. Le troisième rapport de cas12 détaille la réduction de l'hyperkératose et de la taille d'une blessure par pression sacrale après quatre semaines de traitement avec le filtrat et la crème OPALA. Un auto-traitement continu avec la crème OPALA a permis de résoudre l'hyperkératose, mais la lésion de pression s'est détériorée12 (Tous les niveaux 4.d).
La papaye pour traiter la déhiscence des plaies chirurgicales
Un ECR9 a comparé la sécurité et l'efficacité des pansements de pulpe de papaye avec une solution de peroxyde d'hydrogène chez des patientes présentant une déhiscence de plaie après une césarienne (n = 63). Les participantes ont reçu des antibiotiques simultanés sélectionnés après culture et sensibilité. Le temps nécessaire pour développer un tissu de granulation sain dans le groupe peroxyde d'hydrogène était de 6,2 ± 1,6 jours, contre 2,5 ± 0,5 jours dans le groupe papaye (p < 0,05). Seuls 3,2 % des patientes du groupe pansement de papaye ont dû subir un débridement chirurgical supplémentaire, contre 56 % des patientes du groupe peroxyde d'hydrogène (p < 0,05). Des effets indésirables mineurs (p. ex., irritation locale) ont été signalés, mais ils n'étaient pas significativement différents de ceux associés au peroxyde d'hydrogène9 (NB : le peroxyde d'hydrogène n'est pas recommandé pour irriguer les plaies)(Niveau 1.c).
Une étude de cas20 a rapporté que l'utilisation d'un produit à base de papaïne-urée-chlorophylline appliqué sur une déhiscence de plaie sternale post-chirurgicale était associée à une cicatrisation complète après 31 jours de traitement biquotidien. Le patient a reçu un traitement simultané de la plaie par pression négative20(niveau 4.d).
Tableau 2 : Synthèse de données sur les traitements à base de papaye
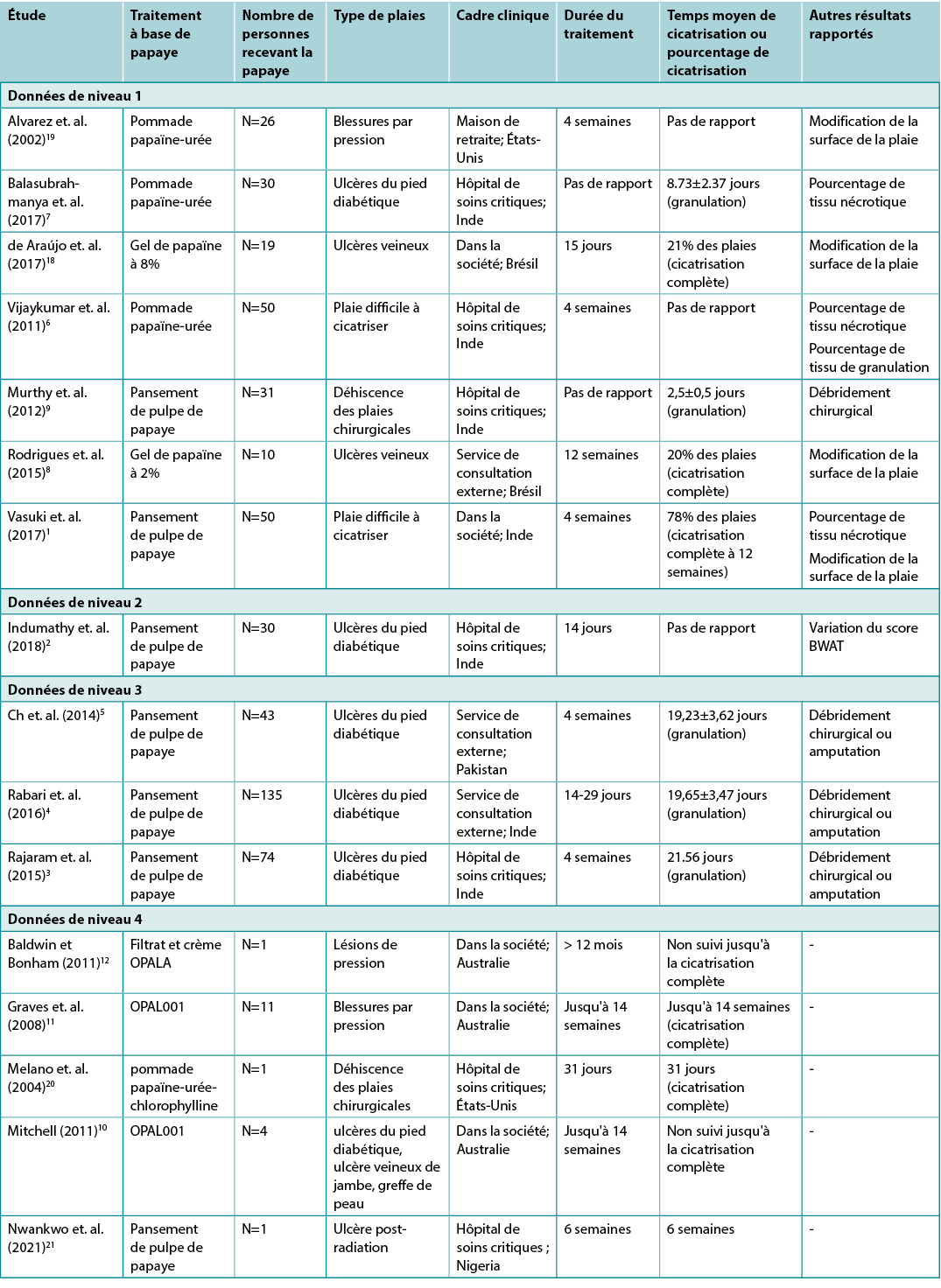
Considérations relatives à l'utilisation
- Les produits à base de papaye facilitent la dégradation des tissus nécrotiques et non viables qui contiennent des protéines et l'action de débridement se fait du haut vers le bas de la plaie. Le débridement doit être interrompu lorsque le lit de la plaie est débarrassé de la boue et des tissus nécrotiques25.
- Il n'existe pas de méthode standardisée pour préparer les pansements de pulpe de papaye. Les études utilisent de manière variable la pulpe de fruits mûrs, peu mûrs ou non mûrs9. Le contenu enzymatique de la pulpe est décrit comme pouvant potentiellement diminuer à mesure que le fruit mûrit, ce qui suggère que le fruit cru ou peu mûr est plus efficace1, 4, 9. Les propriétés antimicrobiennes sont décrites comme restant constantes au fur et à mesure que le fruit mûrit1, 4, 9.
- La méthode de préparation suivante pour les pansements de pulpe de papaye est ainsi décrite :
- Retirer la peau et les graines des papayes2, 5.
- Soit râper la pulpe du fruit9, 21, soit l'écraser pour en faire une pâte.
- Appliquer la pulpe de papaye sur le lit de la plaie après avoir nettoyé la plaie.9, 21
- Recouvrir de gaze stérile9.
- Changer le pansement de pulpe de papaye tous les jours2, 5 ou deux fois par jour9, 21.
- La pâte de papaye non utilisée doit être placée en chambre froide5.
Conflit d'intérêt
Les auteurs ne déclarent aucun conflit d'intérêt conformément aux normes de l'International Committee of Medical Journal Editors (ICMJE).
À propos des synthèses de données wham
Les synthèses de données du Wound Healing and Management Collaborative, (WHAM) sont conformes à la méthodologie publiée dans:
Munn Z, Lockwood C, Moola S. Le développement et l'utilisation de synthèses de données pour les systèmes d'information concernant les soins : Une approche simplifiée d'examen rapide, Worldviews Evid Based Nurs. 2015;12(3):131-8.
Les méthodes citées dans cette synthèse de données, sont décrites en détail dans les ressources publiées par l’institut Joanna Briggs,et sur le site Internet de WHAM : http://WHAMwounds.com. Les synthèses de données WHAM sont soumises à l’examen de pairs membres d’un groupe de référence international multidisciplinaire d'experts en plaies.
Les synthèses de données WHAM fournissent une synthèse des meilleures données probantes disponibles sur des sujets spécifiques et font des suggestions qui peuvent être utilisées pour renseigner la pratique clinique. Les données contenues dans cette synthèse doivent être évaluées par des professionnels dûment formés et spécialisés dans la prévention et la prise en charge des plaies, et les données doivent être considérées dans le contexte de l'individu, du professionnel, du cadre clinique et de tout autre information clinique pertinente.
Copyright © 2021 Wound Healing and Management Collaborative (WHAM), Université Curtin.

Author(s)
Terena Solomons
BA Grad Dip Lib Sc AALIA (CP) Health
Western Australian Group for Evidence Informed Healthcare Practice, Curtin University
Emily Haesler*
PhD Post Grad Sip Adv Nurs (Gerontics) BNurs Fellow Wounds Australia
Wound Healing and Management Collaborative, Curtin Health Innovation Research Institute, Curtin University
* Corresponding author
References
- Vasuki V, Thanmaran N, Vimalakaran B, Madan K. Comparative study of papaya dressing versus normal saline dressing in healing of ulcers. 2017, 2017;4(4):8.
- Indumathy S, Thenmozhi PA, Gowri PM. Effectiveness of papaya pulp dressing on diabetic foot ulcer International Journal of Research in Ayurveda and Pharmacy, 2018;9(5):75-8.
- Rajaram B, Venkanna M, Kumaraswamy BV, Kumar D, Maripeddi K, Puligilla S, Reddy S. The role of papaya dressings in the management of diabetic foot ulcers: A propsective study. Journal of Evidence Based Medicine and Healthcare, 2015;2(42):7365-71.
- Rabari Y, Singh R, Prasad D, Abraham A. The role of papaya (Carica papaya) dressings in the management of chronic ulcers. National Journal of Medical and Dental Research, 2016;4(4):329-32.
- Ch I, Shaikh S, ur Rashid H. The role of papaya dressings in the management of diabetic foot ulcers: A prospective study. Journal of Evidence Based Medicine and Healthcare, 2015;18(1):87-9.
- Vijaykumar H, Pai SA, Pandey V, Kamble P. Comparative study of collagenase and papain-urea based preparations in the management of chronic nonhealing limb ulcers. Indian J Sci Technol, 2011;4:1096-100.
- Balasubrahmanya KS, Praveen MP, Srinidhi M, Shruthi S, Jinumon KV, Rahul DK. A prospective study on effectiveness of use of papain urea based preparation in dressings compared with regular conventional dressings in diabetic foot ulcers Int Surg J, 2017;4(6):1984-87.
- Rodrigues AL, de Oliveira BG, Futuro DO, Secoli SR. Effectiveness of papain gel in venous ulcer treatment: Randomized clinical trial. Revista Latino-americana de Enfermagem, 2015;23(3):458‐65.
- Murthy MB, Murthy BK, Bhave S. Comparison of safety and efficacy of papaya dressing with hydrogen peroxide solution on wound bed preparation in patients with wound gape. Indian J Pharmacol, 2012;44(6):784-87.
- Mitchell GK. Clinical observations supporting a vasodilatory effect of the modified papaya extract OPAL001. Wound Practice & Research, 2011;19(4):190-5.
- Graves N, Ashby A. The use of OPAL001 filtrate and cream in the treatment of chronic pressure ulcers. Wound Practice & Research, 2008;16(2):22-9.
- Baldwin C, Bonham S. Treatment of a sacral pressure ulcer and extensive hyperkeratosis with OPAL A filtrate and cream: A case study. Wound Practice & Research, 2011;19:196.
- Munn Z, Lockwood C, S. M. The development and use of evidence summaries for point of care information systems: A streamlined rapid review approach. Worldviews Evid Based Nurs, 2015;12(3):131-8.
- Aromataris E, Munn Z, editors. JBI Manual for Evidence Synthesis. 2021. https://synthesismanual.jbi.global: Joanna Briggs Institute.
- Joanna Briggs Institute (JBI) Levels of Evidence and Grades of Recommendation Working Party. New JBI Grades of Recommendation. 2013. https://jbi.global/sites/default/files/2019-05/JBI-grades-of-recommendation_2014.pdf: JBI.
- Joanna Briggs Institute (JBI) Levels of Evidence and Grades of Recommendation Working Party. Supporting Document for the Joanna Briggs Institute Levels of Evidence and Grades of Recommendation. 2014. https://jbi.global/sites/default/files/2019-05/JBI%20Levels%20of%20Evidence%20Supporting%20Documents-v2.pdf: JBI.
- Joanna Briggs Institute (JBI) Levels of Evidence and Grades of Recommendation Working Party. JBI Levels of Evidence. 2013. https://jbi.global/sites/default/files/2019-05/JBI-Levels-of-evidence_2014_0.pdf: JBI.
- de Araújo IC, Defune E, Abbade LP, Miot HA, Bertanha M, de Carvalho LR, Ferreira RR, Yoshida WB. Fibrin gel versus papain gel in the healing of chronic venous ulcers: A double-blind randomized controlled trial. Phlebology, 2017;32(7):488-95.
- Alvarez OM, Fernandez-Obregon A, Rogers RS, Bergman L, Black M. A prospective, randomized comparative study of collagenase and papain-urea for pressure ulcer debridement. Wounds, 2002;14(8):293-301.
- Melano E, Rodriguez HL, Carrillo R, Dillon L. The effects of Panafil when using topical negative pressure to heal an infected sternal wound. J Wound Care, 2004;13(10):425-6.
- Nwankwo EU, Maduba CC, Modekwe VI, Nnadozie UU. The use of unripe pawpaw for wound bed preparation following radiation-induced sacral ulcer: A case report and review of literature. Niger J Med 2021;30(339-41).
- US Food Drug Administration (FDA). 2015. Questions and Answers about FDA’s Enforcement Action Regarding Unapproved Topical Drug Products Containing Papain. Available from: http://www.fda.gov/Drugs/GuidanceComplianceRegulatoryInformation/EnforcementActivitiesbyFDA/SelectedEnforcementActionsonUnapprovedDrugs/ucm119646.htm. [Accessed January 2021].
- Hakim R, Fakhrurrazi, Dinni. Effect of Carica papaya extract toward incised wound healing process in mice (Mus musculus) clinically and histologically. Evidence-Based Complementary and Alternative Medicine, 2019;2019:8306519.
- Tumpa SI, Hossain MI, Ishika T. Antimicrobial activities of Psidium guajava, Carica papaya and Mangifera indica against some gram positive and gram negative bacteria. J Pharmacogn Phytochem, 2015;3(6):125-9.
- Kravitz S, McGuire J, Zinszer K. Management of skin ulcers: Understanding the mechanismand selection of enzymatic debriding agents. Adv Skin Wound Care, 2008;21(2):72-4.
- Haesler E, Watts RR, J., Carville K. Local resource botanicals used in wound care. Wound Practice & Research, 2016;24(2):85-90.
- Pieper B, Caliri MH. Nontraditional wound care: A review of the evidence for the use of sugar, papaya/papain, and fatty acids. J Wound Ostomy Continence Nur, 2003;30(4):175–83.
