Volume 42 Number 1
Nursing care of severe hand foot syndrome caused by the oral anti-tumour drug Xeloda: a case study
Shuangshuang Zhang, Wenxing Zhao and Mengmeng Zhang
Keywords nursing, hand foot syndrome, Xeloda, biocellulose dressing
For referencing Zhang S, Zhao W and Zhang M. Nursing care of severe hand foot syndrome caused by the oral anti-tumour drug Xeloda: a case study. WCET® Journal 2022;42(1):29-33
DOI
https://doi.org/10.33235/wcet.42.1.29-33
Submitted 14 October 2021
Accepted 9 March 2021
Abstract
This case study summarises the nursing experience of a patient with grade III hand foot syndrome (HFS) caused by the oral anti-tumour drug Xeloda. The key points of nursing were a multi-disciplinary team consultation to make a clear diagnosis of grade III HFS, effectively control infection, apply a biocellulose dressing, and promote granulation growth and epidermal cell regeneration on the premise that the anti-tumour drug Xeloda cannot be reduced or stopped. After 98 days of comprehensive nursing intervention the wound healed completely; 6 months later, the ulcer did not reoccur.
Introduction
This case study will summarise the nursing experience of caring for a patient with grade III hand foot syndrome (HFS) caused by the oral anti-tumour drug Xeloda (Capecitabine). The key points of nursing care are the importance of a multi-disciplinary team (MDT) consultation process to provide a definitive diagnosis of a grade III HFS, effectively control infection and apply a biocellulose dressing to the wound to promote the growth of granulation tissue and epidermal cell regeneration on the premise that the anti-tumour drug Xeloda could not be reduced or stopped. After 98 days of comprehensive nursing interventions, the wound had healed completely; 6 months later, the ulcer had not re-occurred.
HFS is also known as palmar-plantar erythrodysesthesia, syndrome, acral erythema and Burgdorf’s syndrome. It is an adverse dermatologic skin reaction that may occur in patients with malignant tumours during treatments with systemic chemotherapy or molecular targeted therapy1–3. Localised tissue injury occurs as a result of a toxic reaction caused by drug accumulation from damage to the eccrine gland system. Further, the drugs used are excreted in sweat in the terminal limb capillaries of the palms of the hand and soles of the feet, making these areas more susceptible to HFS. The vascularity of and increased pressures and skin temperature of the hands and feet may exacerbate this effect2,4. While HFS is not life-threatening, it may severely impact a person’s quality of life, especially older people3. The clinical manifestations of HFS are palmoplantar numbness, insensitivity, a tingling sensation, rapid skin swelling or erythema, desquamation, skin cracking or blisters (usually advanced stage) or severe pain3,5. The palms of the hands are usually affected first. There may be progressive aggravations of any skin lesions.
It is important the HFS is not mistaken for hand-foot skin reaction (HFSR) arising from the use of multikinase or BRAF inhibitors. Skin reactions from the use of these groups of drugs manifest as yellowish, painful hyperkeratotic plaques on the heels, fingertips, within interdigital web spaces and over joints3.
According to National Cancer Institute (NCI)6, HFS is divided into three grades: grade I is dermatitis with skin changes (such as fingerprint disappearance, pigmentation, erythema, skin numbness, insensitivity, paresthesia, desquamation, etc.) with or without pain; grade II is skin change or dermatitis, with pain but without dysfunction; grade III is skin change or dermatitis (such as skin wet desquamation, ulcer, blister), severe pain and dysfunction. Grade III severe ulcers are rare. The pathological manifestations of grade III ulcers are vacuolar degeneration (liquefaction) of basal keratinocytes, infiltration of lymphocytes around skin vessels, apoptosis of keratinocytes and skin oedema7. The Xeloda antithetical couplet named capecitabine tablets, the new generation of oral fluorouracil broad spectrum anti-tumour drugs8, is used for the treatment of advanced breast cancer patients after chemotherapy; tumour cells can be intentionally killed if Xeloda is used independently. Xeloda can also be used in conjunction with other chemotherapy agents9. Further, Xeloda is usually taken orally BD after food and in cases of metastatic breast cancer Xeloda is used for maintenance therapy as long as it remains effective. Adverse reactions to Xeloda mainly include HFS, nausea, diarrhoea and neutropenia. The incidence of HFS is the highest among the adverse reactions to Xeloda, reaching 45–68%8. Furthermore, 20–50% of the patients who used Xeloda were forced to reduce the dosage or even discontinue treatment due to HFS10,11.
On 26 May 2020, a patient with severe grade III HFS caused by oral Xeloda was admitted to our hospital’s specialist nursing clinic of wound ostomy incontinence. Without stopping the drug, the wound was completely healed in 98 days after comprehensive nursing and medical intervention. The nursing methods are reported as follows.
Case Presentation
Background
A 65-year-old female patient, Ms Li, presented with a history of desquamation and skin peeling of the palms of both hands and the soles of both feet, inflamed dermatitis and occasional blisters for 3 years, and an ulcer on the right heel for 2 months. Her skin conditions and wounds were not healed by moist wound healing methods in two grade III, class A hospitals in the province.
Her past medical history included being diagnosed 13 years ago with breast cancer. Further, axillary lymph node metastasis and bilateral lung metastasis occurred 4 years ago. After six courses of chemotherapy, Xeloda 1.5g BID was taken orally as targeted therapy, and the disease did not progress. After oral administration of Xeloda for 2 weeks, grade I and II HFS appeared, such as dry hands and feet and desquamation.
Systemic evaluation
A systemic evaluation of Ms Li included the following reviews:
- Laboratory examinations undertaken within the last 6 months showed:
- CEA (carcinoembryonic antigen) marker was 5.53–12ng/ml (normal: 0-5).
- Ca (Cancer antigen)-153: 20.04–28.45u/ml (normal: 0–25).
- Pain assessment. Numeric Rating Scale (NRS) score: 8 points (0 represents no pain and 10 represents the worst pain imaginable).
- Mobility: unable to walk affecting normal life, e.g. family members were required to use a wheelchair to push Ms Li to the clinic for dressing changes.
- Nutritional status: average; BMI 19.9kg/m2.
- Psychological status: anxiety and fear were exhibited.
- Local lower limb:
- The dorsalis pedis artery and posterior tibial artery had good pulsation after hand felt without formal assessment with equipment.
- No prior history of lower extremity arteriovenous disease.
- Wound assessment:
- Wound location: the right heel.
- Wound measurement: the size of the wound bed was 5x5cm.
- Wound bed: the wound bed was covered with 100% yellow sloughy non-viable tissue.
- Wound exudate: there was a medium amount of exudate that was purulent and had a slight odour.
- Wound edge: a black hard scab was evident and circumferential around the wound bed.
- The peri-wound skin was dry and a large portion of dry epidermis was peeled away during wound cleansing (Figure 1).
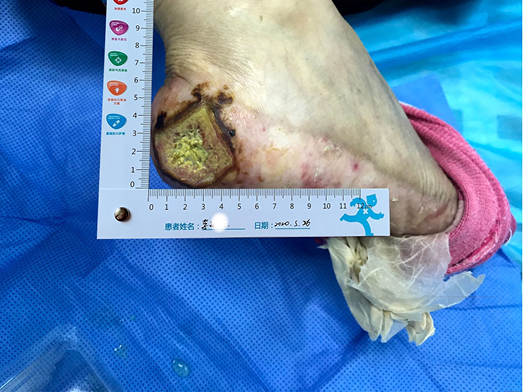
Figure 1. The wound on presentation
Multidiscipinary team and nursing care plan
From a nursing perspective there were a number of difficulties encountered and challenges to be overcome. These included:
- Assessing and managing a chronic non-healing wound. The wound was not healed after 2 months of moist healing treatment in two other grade III, class A hospitals in the province.
- Identifying the cause and type of wound. Was this a cancerous wound, pyoderma gangrenosum or HFS with an accompanying severe ulcer? There was no clear pathology or definitive diagnosis.
- Oral Xeloda therapy can affect wound healing. This raised the question of whether oral Xeloda could be reduced or stopped.
Due to the above nursing assessment and nursing difficulties, a multidisciplinary team (MDT) consultation, including the general surgeon, oncologist and wound care nurse, was quickly convened. Representatives from the relevant departments of the hospital were invited to formulate a diagnosis and treatment plan. The general surgery department suggested that pathology and bacterial culture should be undertaken. The results showed there were dense perivascular and interstitial neutrophilic infiltration of the tissue. However, there were no signs of vasculitis or malignant tumour. The bacteria cultured were identified as Proteus. The diagnosis of grade III HFS with rare severe ulcer was confirmed. Post oncology consultation, the oncologist’s opinion was that, considering the recurrence of breast cancer after 4 years, double lung metastasis as well as multiple unstable tumour markers, oral Xeloda could not be reduced or stopped.
Wound management: initial strategies
The initial goals of wound management were to control infection, promote autolysis of and debride non-viable tissue when required, and to relieve pain. The principles of TIME (Tissue, Infection, Moisture, Exudate) were used to guide local wound management and manage the characteristics of the wound described above. Normal saline and gauze was used to clean and mechanically debride the wound bed. Considering the moderate amount of wound exudate, and dry skin at the edge and around the wound, a sulfadiazine silver lipid hydrocolloid dressing was selected as the primary contact layer to control infection and keep the wound moist. The function of this dressing is to reduce the bacterial burden within the wound and control infection, assist with autolysis and debridement, and reduce pain during dressing changes12. The skin around the wound was dry and partly desquamated. In order to prevent avulsion, a soft silicone foam dressing was used as the secondary or external dressing, which also absorbed the exudate vertically and protected the fragile peri-wound skin.
Evaluation
Initial wound management strategies
After using the sulfadiazine silver lipid hydrocolloid dressing from 26 May to 4 June, the localised infection was controlled. Autolysis of non-viable tissue via the dressing product in conjunction with mechanical debridement had occurred, leaving the wound bed with 100% granulation tissue. The wound edge retained a little dip and within the peri-wound skin part of the epidermis was still exfoliated (Figure 2). The amount of wound exudate remained moderate but the odour had disappeared. Dressing pain was reduced. The size of the wound bed was reduced from 5x5cm to 4.5x4.5cm (Figures 3 & 4). The NRS score was reduced to 6 points, and the patient could be helped by her family to come to the clinic for dressing changes.
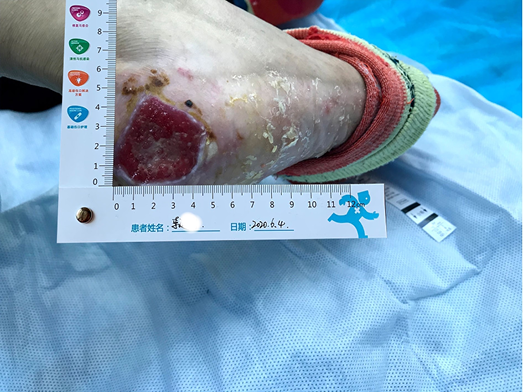
Figure 2. Autolysis of non-viable tissue revealing granulation tissue
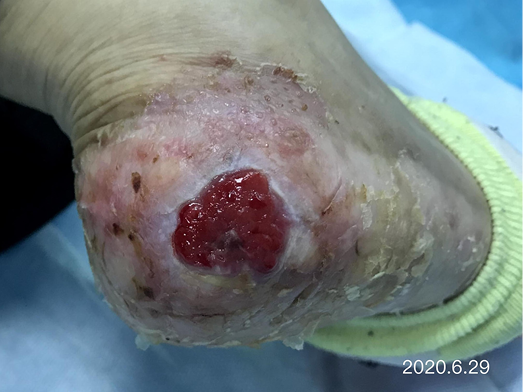
Figure 3. Continued wound healing
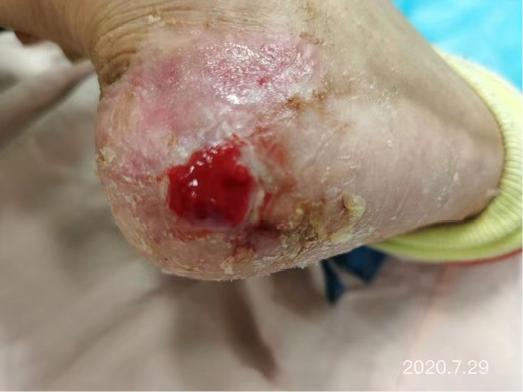
Figure 4. Continued wound healing
Secondary wound management strategies
After the wound infection was controlled and non-viable tissue was removed from the wound bed, the sulfadiazine silver lipid hydrocolloid was stopped and the treatment plan was changed. After considering the delays in wound healing that had occurred over a 2-month period within other hospitals plus our hospital, consideration was given as to what other auxiliary wound management products could be used to promote granulation tissue and epidermal cell regeneration to facilitate wound closure of this chronic wound. Therefore, to guide selection of another primary dressing, the MDT considered the factors under ‘S’ in the acronym MOIST. MOIST was developed as an adjunct to TIME to cater for the development of new wound technologies. MOIST refers to ‘M’ Moisture balance; ‘O’ Oxygen balance; ‘I’ Infection control; ‘S’ Support and ‘T’ Tissue management13. The S refers to modification of the wound environment e.g. inflammatory mediators, pH levels and growth factors. Consequently, a biocellulose wound dressing (Nanoderm® from China Shandong Nameide Biotechnology) was selected. This is a natural biomaterial which is safe and non-stimulating for tumour growth within cancer patients and can effectively promote granulation tissue and epidermal cell regeneration. A soft silicone foam dressing was chosen for the secondary/external dressing.
After dressing changes every 3–4 days, the granulation tissue increased and the size of the wound gradually reduced. By 11 August, the wound had narrowed to 1.5x1.5cm and entered the epithelialisation stage (Figure 5). The primary biocellulose wound dressing was discontinued. The skin around the wound was fragile and so the soft silicone foam dressing was still used. At this time, the NRS score was 2, and the patient could come to the hospital for dressing changes. After almost 3 months’ treatment, the wound had healed completely on 31 August (Figure 6). At follow-up 6 months later, the patient’s ulcer had not re-ocurred. In order to express her gratitude, the patient specifically came to the clinic and said that she had recovered her state of health to that of 4 years ago and had returned to a normal life that included square dancing.
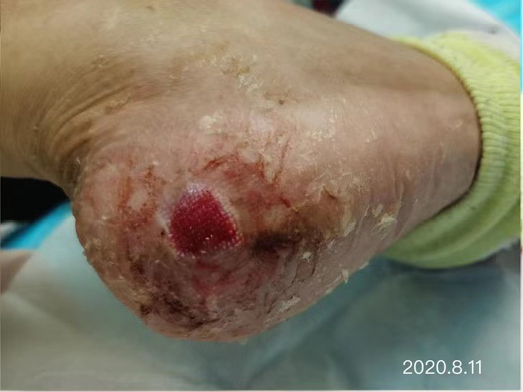
Figure 5. The epithelialisation stage
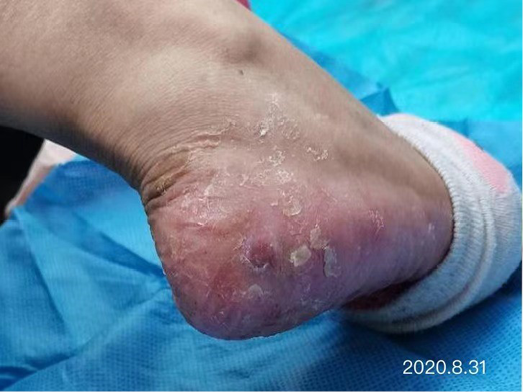
Figure 6. Final stages of healing
Discussion
Many articles were searched for the best evidence to assist with the management of this case. In terms of systemic therapy, Xeloda-targeted therapy combined with high-dose vitamin B6 (300mg/d) and Vit E cream for both hands and feet can reduce the severity of HFS14. Nearly half of the patients treated thought that HFS is the most serious side effect of chemotherapy received, which has a serious impact on the confidence and compliance of treatment. It is important to provide patients who will receive Xeloda therapy relevant knowledge of the benefits and side effects of the treatment and health guidance to manage any adverse effects. Having sufficient psychological preparation may assist patients to overcome the underlying disease and any treatment related side effects. The effective management of chronic wounds is enhanced through a MTD approach to determine the cause of the wound and factors that may complicate wound healing, and to determine evidence-based wound management strategies to facilitate wound healing and improve patients’ quality of life15.
Summary
HFS with severe skin ulcers is very rare. When Xeloda is unable to be reduced or stopped, the wound is difficult to heal. This presents great challenges to wound specialist nurses in determining wound management strategies. In this case, through MDT consultation and wound specialist nurse evaluation of the patient, the wound and systemic treatments, the wound infection was controlled using a sulfadiazine silver lipid hydrocolloid dressing, and a biocellulose dressing was applied to effectively promote granulation tissue and epidermal cell regeneration. In this case the treatment of primary disease was not affected, the patient’s pain was minimised, and wound healing realised.
Soins infirmiers du syndrome main-pied sévère causé par le médicament anti-tumoral oral Xeloda : une étude de cas
Shuangshuang Zhang, Wenxing Zhao and Mengmeng Zhang
DOI: https://doi.org/10.33235/wcet.42.1.29-33
Résumé
Cette étude de cas résume l'expériencede soins infirmiers d'un patient souffrant d'un syndrome main-pied (SMP) de grade III causé par le médicament anti-tumoral oral Xeloda. Les points clés des soins infirmiers ont été la consultation d'une équipe multidisciplinaire pour établir un diagnostic clair d’un SMP de grade III, le contrôle efficace de l'infection, appliquer un pansement de biocellulose et promouvoir la croissance de la granulation et la régénération des cellules épidermiques, en partant du principe que le médicament anti-tumoral Xeloda ne peut être réduit ou arrêté. Après 98 jours d'intervention infirmière complète, la plaie a complètement guéri ; 6 mois plus tard, l'ulcère n'a pas réapparu.
Introduction
Cette étude de cas résume l'expérience infirmière dans la prise en charge d'un patient souffrant d'un syndrome mains-pieds (SMP) de grade III causé par le médicament anti-tumoral oral Xeloda (capécitabine). Les points clés des soins infirmiers sont l'importance du processus de consultation de l'équipe multidisciplinaire (EMD) pour fournir un diagnostic définitif d'un SMP de grade III, contrôler efficacement l'infection et appliquer un pansement de biocellulose sur la plaie pour favoriser la croissance du tissu de granulation et la régénération des cellules épidermiques, en partant du principe que le médicament anti-tumoral Xeloda ne pouvait pas être réduit ou arrêté. Après 98 jours d'interventions infirmières complètes, la plaie a complètement cicatrisé ; 6 mois plus tard, l'ulcère n'était pas réapparu.
Le SMP est également connu sous le nom de syndrome érythrodysesthésie palmo-plantaire, d'érythème acral et de syndrome de Burgdorf. Il s'agit d'une réaction cutanée dermatologique indésirable qui peut survenir chez les patients atteints de tumeurs malignes lors de traitements par chimiothérapie systémique ou par thérapie moléculaire ciblée1–3. Des lésions tissulaires localisées se produisent à la suite d'une réaction toxique provoquée par l'accumulation de médicaments à partir de lésions du système des glandes eccrines. De plus, les médicaments utilisés sont excrétés dans la sueur des capillaires des membres terminaux de la paume des mains et de la plante des pieds, ce qui rend ces zones plus sensibles au SMP. La vascularisation et l'augmentation des pressions et de la température cutanée des mains et des pieds peuvent exacerber cet effet2,4. Bien que le SMP ne mette pas la vie en danger, il peut avoir un impact important sur la qualité de vie d'une personne, en particulier des personnes âgées3. Les manifestations cliniques du SMP sont un engourdissement palmo-plantaire, une insensibilité, une sensation de picotement, un gonflement rapide de la peau ou un érythème, une desquamation, des craquelures ou des cloques (généralement à un stade avancé) ou une douleur intense3,5. Les paumes des mains sont généralement touchées en premier. Il peut y avoir des aggravations progressives de toute lésion cutanée.
Il est important que le SMP ne soit pas confondu avec la réaction cutanée main-pied (RCMP) résultant de l'utilisation d'inhibiteurs multikinases ou BRAF. Les réactions cutanées liées à l'utilisation de ces groupes de médicaments se manifestent par des plaques hyperkératosiques jaunâtres et douloureuses sur les talons, le bout des doigts, dans les espaces interdigitaux et sur les articulations3.
Selon l’institut national du cancer, (INC)6, le SMP est divisé en trois grades : le grade I est une dermatite avec des changements cutanés (tels que la disparition des empreintes digitales, la pigmentation, l'érythème, l'engourdissement de la peau, l'insensibilité, la paresthésie, la desquamation, etc.) avec ou sans douleur ; le grade II est un changement cutané ou une dermatite, avec douleur mais sans dysfonctionnement ; le grade III est un changement cutané ou une dermatite (telle qu'une desquamation humide de la peau, un ulcère, une cloque), une douleur sévère et un dysfonctionnement. Les ulcères sévères de grade III sont rares. Les manifestations pathologiques des ulcères de grade III sont une dégénérescence vacuolaire (liquéfaction) des kératinocytes basaux, une infiltration de lymphocytes autour des vaisseaux cutanés, une apoptose des kératinocytes et un œdème cutané7. Le couple antithétique Xeloda, appelé comprimés de capécitabine, nouvelle génération de médicaments anti-tumoraux oraux à large spectre à base de fluorouracile8, est utilisé pour le traitement des patientes atteintes d'un cancer du sein avancé après une chimiothérapie; les cellules tumorales peuvent être intentionnellement tuées si Xeloda est utilisé indépendamment. Xeloda peut également être utilisé en conjonction avec d'autres agents de chimiothérapie9. En outre, Xeloda est généralement pris par voie orale, sous forme de BD après les repas, et en cas de cancer du sein métastatique, Xeloda est utilisé comme traitement d'entretien tant qu'il reste efficace. Les effets indésirables de Xeloda comprennent principalement le SMP, les nausées, la diarrhée et la neutropénie. L'incidence du SMP est la plus élevée parmi les effets indésirables de Xeloda, atteignant 45-68%8. En outre, 20 à 50 % des patients ayant utilisé Xeloda ont été contraints de réduire la dose ou même d'interrompre le traitement en raison d’un SMP10,11.
Le 26 mai 2020, un patient souffrant d’un SMP sévère de grade III causé par le Xeloda oral a été admis dans le départment de soins infirmiers spécialisés dans les plaies, les stomies et l’ incontinence de notre hôpital. Sans arrêt du médicament, la plaie a été complètement guérie en 98 jours après des soins infirmiers et une intervention médicale globaux. Les méthodes de soins infirmiers sont rapportées comme suit.
Présentation de cas
Contexte
Une patiente de 65 ans, Mme Li, s'est présentée avec des antécédents de desquamation et de décollement de la peau de la paume des deux mains et de la plante des deux pieds, de dermatite inflammatoire et de cloques occasionnelles depuis 3 ans, et d'un ulcère au talon droit depuis 2 mois. Ses affections cutanées et ses plaies n'ont pas été guéries par les méthodes de cicatrisation humide dans deux hôpitaux de catégorie III, classe A, de la province.
Ses antécédents médicaux présentaient un cancer du sein diagnostiqué 13 ans auparavant. De plus, une métastase des ganglions lymphatiques axillaires et une métastase pulmonaire bilatérale sont apparues 4 ans auparavant. Après six cures de chimiothérapie, Xeloda 1,5g BID a été pris par voie orale comme thérapie ciblée, et la maladie n'a pas progressé. Après l'administration orale de Xeloda pendant 2 semaines, des SMP de grade I et II sont apparus, tels que des mains et des pieds secs et une desquamation.
Évaluation systémique
L'évaluation systémique de Mme Li comprenait les examens suivants :
- Les examens de laboratoire effectués au cours des 6 derniers mois ont montré :
- Le marqueur CEA (antigène carcinoembryonnaire) était de 5,53-12ng/ml (normal: 0-5).
- Ca (antigène du cancer)-153: 20.04-28.45u/ml (normal: 0–25).
- Évaluation de la douleur. Score sur l'échelle d'évaluation numérique (END) : 8 points (0 représente l'absence de douleur et 10 représente la pire douleur imaginable).
- Mobilité : incapacité de marcher affectant la vie normale, par exemple, les membres de la famille ont dû utiliser un fauteuil roulant pour pousser Mme Li à la clinique pour changer ses pansements.
- État nutritionnel : moyen; IMC 19,9 kg/m2.
- État psychologique : anxiété et peur étaient présentes.
- Membre inférieur local :
- L'artère pédieuse dorsale et l'artère tibiale postérieure présentaient une bonne pulsation après un palpage manuel sans évaluation formelle à l'aide d'un équipement.
- Pas d'antécédents de maladie artério-veineuse des membres inférieurs.
- Évaluation de la plaie :
- Localisation de la plaie : le talon droit.
- Mesure de la plaie : la taille du lit de la plaie était de 5x5cm.
- Lit de la plaie : le lit de la plaie était recouvert à 100 % de tissu non viable jaune et spongieux.
- Exsudat de la plaie : il y avait une quantité moyenne d'exsudat purulent et légèrement odorant.
- Bord de la plaie : une croûte noire et dure était évidente et circonférentielle autour du lit de la plaie.
- La peau péri-lésionnelle était sèche et une grande partie de l'épiderme sec a été éliminée lors du nettoyage de la plaie (Figure 1).

Figure 1. Présentation de la plaie
Équipe multidisciplinaire et protocole de soins infirmiers
Du point de vue des soins infirmiers, un certain nombre de difficultés et de défis à relever se sont présentés. Il s'agit notamment de :
- Évaluer et prendre en charge d'une plaie chronique non cicatrisante. La plaie n'était pas guérie après 2 mois de traitement de cicatrisation humide dans deux autres hôpitaux de grade III, classe A, de la province.
- Identifier la cause et le type de la plaie. S'agissait-il d'une plaie cancéreuse, d'un pyoderma gangrenosum ou d'un SMP accompagné d'un ulcère grave ? Il n'y avait pas de pathologie claire ou de diagnostic définitif.
- Le traitement oral au Xeloda peut affecter la cicatrisation des plaies. Cela a soulevé la question de savoir si le Xeloda oral pouvait être réduit ou arrêté.
En raison de l'évaluation et des difficultés infirmières mentionnées ci-dessus, une consultation de l'équipe multidisciplinaire (EMD), comprenant le chirurgien général, l'oncologue et l'infirmière spécialisée dans les plaies, a été rapidement convoquée. Les représentants des services concernés de l'hôpital ont été invités à formuler un diagnostic et un protocole de soins. Le service de chirurgie générale a suggéré de déterminer la pathologie et de procéder à une culture bactérienne. Les résultats ont montré qu'il y avait une infiltration neutrophile dense périvasculaire et interstitielle du tissu. Cependant, il n'y avait aucun signe de vasculite ou de tumeur maligne. Les bactéries cultivées ont été identifiées comme étant des Proteus. Le diagnostic de SMP de grade III avec un ulcère grave rare a été confirmé. Après la consultation oncologique, l'avis de l'oncologue était que, compte tenu de la récidive du cancer du sein après 4 ans, de la double métastase pulmonaire ainsi que des multiples marqueurs tumoraux instables, le Xeloda oral ne pouvait pas être réduit ou arrêté.
Traitement des plaies : stratégies initiales
Les objectifs initiaux du traitement des plaies étaient de contrôler l'infection, de favoriser l'autolyse des tissus non viables et de les débrider si nécessaire, et de soulager la douleur. Les principes TIME (Tissu, Infection, humidité (Moisture), Exudat) ont été utilisés pour guider le traitement local de la plaie et traiter les caractéristiques de la plaie décrite ci-dessus. Une solution saline normale et une gaze ont été utilisées pour nettoyer et débrider mécaniquement le lit de la plaie. Compte-tenu de la quantité modérée d'exsudat de la plaie et de la sécheresse de la peau au bord et autour de la plaie, un pansement hydrocolloïde sulfadiazine-argent a été choisi comme couche de contact primaire pour contrôler l'infection et maintenir la plaie hydratée. La fonction de ce pansement est de réduire la charge bactérienne dans la plaie et de contrôler l'infection, d'aider à l'autolyse et au débridement, et de réduire la douleur pendant les changements de pansement12. La peau autour de la plaie était sèche et partiellement desquamée. Afin d'éviter l'avulsion, un pansement en mousse de silicone souple a été utilisé comme pansement secondaire ou externe, qui a également absorbé l'exsudat verticalement et protégé la peau péri-lésionnelle fragile.
Évaluation
Stratégies initiales de traitement des plaies
Après l’utilisation du pansement hydrocolloïde sulfadiazine-lipide d'argent du 26 mai au 4 juin, l'infection localisée a été contrôlée. Le produit du pansement en conjonction avec le débridement mécanique a permis l’autolyse des tissus non viables, laissant le lit de la plaie avec 100% de tissu de granulation. Le bord de la plaie a conservé une légère inclinaison et, dans la peau péri-lésionnelle, une partie de l'épiderme était encore exfoliée (Figure 2). La quantité d'exsudat de la plaie est restée modérée mais l'odeur a disparu. La douleur liée aux changements de pansement a été réduite. La taille du lit de la plaie a été réduite de 5x5cm à 4,5x4,5cm (Figures 3 & 4). Le score END a été réduit à 6 points, et la patiente a pu être aidée par sa famille pour venir à la clinique pour les changements de pansement.

Figure 2. Autolyse des tissus non viables révélant un tissu de granulation

Figure 3. Poursuite de la cicatrisation de la plaie

Figure 4. Poursuite de la cicatrisation de la plaie
Stratégies de traitement secondaire des plaies
Une fois l'infection de la plaie contrôlée et les tissus non viables retirés du lit de la plaie, l'hydrocolloïde sulfadiazine-lipide d'argent a été arrêté et le protocole de soins a été modifié. Après avoir pris en compte les retards dans la cicatrisation des plaies qui se sont accumulés sur une période de 2 mois dans d'autres hôpitaux ainsi que dans notre hôpital, on s'est demandé quels autres produits auxiliaires de traitement des plaies pouvaient être utilisés pour favoriser la régénération du tissu de granulation et des cellules épidermiques afin de faciliter la fermeture de cette plaie chronique. Par conséquent, pour guider la sélection d'un autre pansement primaire, l’EMD a pris en compte les facteurs " S " de l'acronyme MOIST. MOIST a été développé en complément de TIME pour répondre au développement de nouvelles technologies de traitement des plaies. MOIST fait référence à l'équilibre de l'humidité (Moisture), à l'équilibre de l'oxygène (O), au contrôle de l'infection (I), au soutien (S) et à la gestion des tissus (T)13. Le S fait référence à la modification de l'environnement de la plaie, par exemple les médiateurs inflammatoires, les niveaux de pH et les facteurs de croissance. Par conséquent, un pansement de biocellulose (Nanoderm® de China Shandong Nameide Biotechnology) a été sélectionné. Il s'agit d'un biomatériau naturel qui est sûr et non stimulant pour la croissance des tumeurs chez les patients cancéreux et qui peut favoriser efficacement la régénération du tissu de granulation et des cellules épidermiques. Un pansement en mousse de silicone souple a été choisi pour le pansement secondaire/externe.
Après avoir changé le pansement tous les 3-4 jours, le tissu de granulation a augmenté et la taille de la plaie a progressivement diminué. Le 11 août, la plaie s'était rétrécie à 1,5x1,5 cm et était entrée dans la phase d'épithélialisation (figure 5). Le pansement primaire de biocellulose a été abandonné. La peau autour de la plaie étant fragile, le pansement en mousse de silicone souple a été utilisé. À ce moment-là, le score END était de 2, et la patiente pouvait venir à l'hôpital pour changer son pansement. Après presque 3 mois de traitement, la plaie était complètement cicatrisée le 31 août (Figure 6). Lors du suivi à 6 mois plus tard, l'ulcère de la patiente n'avait pas réapparu. Afin d'exprimer sa gratitude, la patiente est venue expressément à la clinique et a déclaré qu'elle avait retrouvé son état de santé d'il y a 4 ans et qu'elle avait repris une vie normale incluant la danse en quadrille.

Figure 5. La phase d'épithélialisation

Figure 6. Derniers stades de la cicatrisation
Discussion
De nombreux articles ont été recherchés afin de trouver les meilleures données probantes pour aider à la prise en charge de ce cas. En termes de traitement systémique, le traitement ciblé par Xeloda associé à de la vitamine B6 à haute dose (300mg/j) et à une crème à la vitamine E pour les mains et les pieds peut réduire la sévérité du SMP14. Près de la moitié des patients traités pensent que le SMP est l'effet secondaire le plus grave de la chimiothérapie reçue, ce qui a un impact sérieux sur la confiance et l'observance du traitement. Il est important de fournir aux patients qui vont suivre un traitement par Xeloda des connaissances pertinentes sur les avantages et les effets secondaires du traitement et des conseils de santé pour gérer les éventuels effets indésirables. Une préparation psychologique suffisante peut aider les patients à surmonter la maladie sous-jacente et les effets secondaires liés au traitement. La prise en charge efficace des plaies chroniques est renforcée par une approche EPD visant à déterminer la cause de la plaie et les facteurs susceptibles de compliquer la cicatrisation, ainsi qu’ à définir des stratégies de prise en charge des plaies fondées sur des données probantes pour faciliter la cicatrisation et améliorer la qualité de vie des patients15.
Synthèse
Le SMP avec des ulcères cutanés sévères est très rare. Lorsque le Xeloda ne peut pas être réduit ou arrêté, la plaie est difficile à cicatriser. Cela pose de grands défis aux infirmiers et infirmières spécialisés dans les plaies pour déterminer les stratégies de traitement des plaies. Dans ce cas, grâce à la consultation de la EPD et à l'évaluation du patient, de la plaie et des traitements systémiques par une infirmière spécialisée dans les plaies, l'infection de la plaie a été contrôlée à l'aide d'un pansement hydrocolloïde sulfadiazine-argent, et un pansement de biocellulose a été appliqué pour favoriser efficacement la régénération du tissu de granulation et des cellules épidermiques. Dans ce cas, le traitement de la maladie primaire n'a pas été affecté, la douleur du patient a été minimisée et la cicatrisation de la plaie a été réalisée.
Author(s)
Shuangshuang Zhang MSN, ET
The First Affiliated Hospital of Shandong First Medical University, Shandong Province Qianfoshan Hospital, Jinan, Shandong, China
Wenxing Zhao* MSN, ET
Central Hospital Affiliated to Shandong First Medical University, Jinan Central Hospital Affiliated to Shandong University, Jinan, Shandong, China
Mengmeng Zhang MSN, ET
Central Hospital Affiliated to Shandong First Medical University, Jinan Central Hospital Affiliated to Shandong University, Jinan, Shandong, China
* Corresponding author
References
- Zhang YH, Shao CHY. Nursing experience of 26 cases of hand foot syndrome caused by anti-tumor treatment. Jilin Medical Science 2014;35(7):1568.
- Inokuchi M, Ishikawa I, Furukawa H et al. Treatment of capecetibane-induced hand-foot syndrome using a topical retinoid: a case report. Oncology Letters 2014;7(2):444–448.
- Kwakman JJM, Elshot YS, Punt CJA, Koopman M. Management of cytotoxic chemotherapy-induced hand-foot syndrome. Oncology Reviews 2020;14(1):57–63.
- Xu L, Xue M, Wang J, Zhang W. Analysis of risk factors of hand foot syndrome induced by apatinib mesylate and nursing countermeasures. Nursing Research 2019;33(23):4049–4054.
- Nikolaou V, Syrigos K, Saif MW. Incidence and implications of chemotherapy related hand-foot syndrome. Journal of Expert Opinions of Drug Safety 2016;15(12):1625–1633.
- Dong Y, Lu Z, Yang Y. Nursing research progress of hand foot syndrome caused by capecitabine. Nursing Research 2016;30(1):275–278.
- Janusch M,Fischer M, Marsch WC, et al. The hand-foot syndrome a frequent secondary manifestation in antineoplastic chemotherapy. European Journal of Dermatology 2006;16(5):494–499.
- Li X, Liu D, Wu D, Fan X, Zhang J. Research progress on the relationship between capecitabine related gene polymorphism and hand foot syndrome. Journal of Practical Oncology 2018;32(2):149–153.
- Liu SL, Yu ZY, Liu HF. Xeloda maintenance therapy in the treatment of advanced breast cancer. Chinese and Foreign Women Health 2020;7(13):68,91.
- Guo QH, Ma JL, Zhang J, et al. Clinical observation of hand foot syndrome caused by capecitabine and 5-fluorouracil. Journal of Chinese Medical Guide 2013;11(31):36–37.
- Gao J, He Q, Hua D, et al. Polymorphism of TS 3’ - UTR predicts survival of Chinese advanced gastric cancer patients receiving first-line capecitabine plus paclitaxel. Clinical and Translational Oncology 2013;15(8):619–625.
- Sood A, Granick MS, Tomaselli NL. Wound dressings and comparative effectiveness data. Advances in Wound Care 2014;(3):511–529.
- Dissemond J, Assenheimer B, Engels B et al. Clinical letter, MOIST. Journal of the German Society of Dermatology 2017;(4):443–445.
- Chen Z, Zhou S, Xu S, Ding P, Zhang H. Clinical observation of hand foot soaking formula in the prevention and treatment of capecitabine related hand foot syndrome. China Science and Technology of Traditional Chinese Medicine 2016;23(3):329–330.
- Lei J, Sun L, Li P, Zhu C, Lin Z, et al. The wound dressings and their applications in wound healing and management. Health Science Journal 2019;13(4):662–668.
