Volume 42 Number 1
Wound bed preparation
R Gary Sibbald, James A Elliott, Reneeka Persaud-Jaimangal, Laurie Goodman, David G Armstrong, Catherine Harley, Sunita Coelho, Nancy Xi, Robyn Evans, Dieter O Mayer, Xiu Zhao, Jolene Heil, Bharat Kotru, Barbara Delmore, Kimberly LeBlanc, Elizabeth A Ayello, Hiske Smart, Gulnaz Tariq, Afsaneh Alavi and Ranjani Somayaji
Keywords debridement, Exudate, wound bed preparation, wound healing, Infection, Inflammation, Pain, healability, moisture management, paradigm, patient-centred care
For referencing Sibbald GR et al. Wound bed preparation. WCET® Journal 2022;42(1):16-28
DOI
https://doi.org/10.33235/wcet.42.1.16-28
Submitted November 2020
Accepted February 2021
Abstract
The wound bed preparation (WBP) model is a paradigm to optimise chronic wound treatment. This holistic approach examines the treatment of the cause and patient-centred concerns to determine if a wound is healable, a maintenance wound, or non-healable (palliative). For healable wounds (with adequate blood supply and a cause that can be corrected), moisture balance is indicated along with active debridement and control of local infection or abnormal inflammation. In maintenance and non-healable wounds, the emphasis changes to patient comfort, relieving pain, controlling odour, preventing infection by decreasing bacteria on the wound surface, conservative debridement of slough, and moisture management including exudate control.
In this fourth revision, the authors have re-formulated the WBP model into 10 statements. This article will focus on the literature in the last 5 years or new interpretations of older literature. This process is designed to facilitate knowledge translation in the clinical setting and improve patient outcomes at a lower cost to the healthcare system.
© R Gary Sibbald. Previously published in Advances in Skin & Wound Care April 2021 and published here with the kind permission of Gary Sibbald (see Editorial)
Introduction
Wound bed preparation (WBP) is a structured approach to wound healing. Now entering its third decade of widespread use, the WBP paradigm was first published in 2000, with periodic updates in 2003, 2006, 2011, 2015 and now 2021. This article lists 10 statements formulated from previous versions of the WBP model, reports the results of a survey of current wound care practitioners conducted to achieve consensus on those principles, and summarises related evidence supporting each statement. This latest iteration features the following key changes:
- The use of an audible handheld Doppler (AHHD) of dorsalis pedis or posterior tibial artery as an alternative to the traditional ankle-brachial pressure index (ABPI) for the clinical assessment of adequate arterial supply to heal and ability to apply compression therapy safely.
- Updated approaches to topical and systemic pain management for persons with wounds.
- An update on the management of maintenance and non-healable wounds.
- New enablers to facilitate knowledge dissemination for the other eight components of WBP.
Sackett and colleagues1 define evidence-based medicine as “integrating individual clinical expertise and the best external evidence”. Specifically, the three pillars of evidence-based medicine include scientific evidence, expert knowledge and patient preference; these are incorporated into the 10 statements included in the WBP 2021 paradigm (Figure 1).
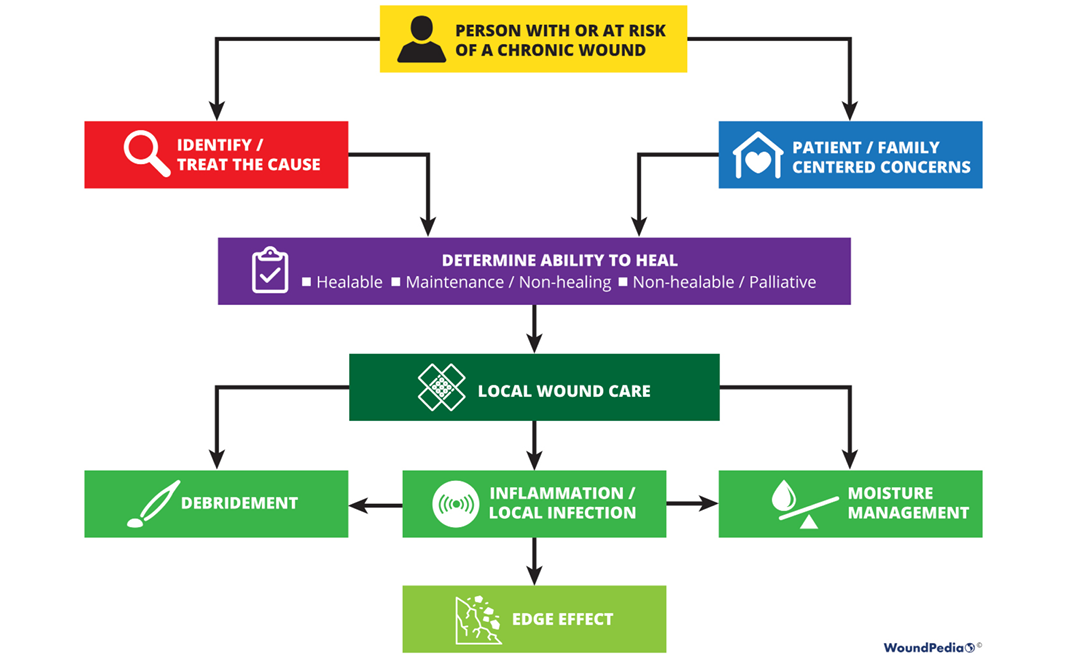
Figure 1. WBP paradigm 2021 (©WoundPedia 2021)
Engagement of stakeholders in the evaluation process has been suggested as a strategy to bridge the “translation gap”2. Wound healing experts and active wound care practitioners were involved in the evaluation process of the 10 statements to enhance dissemination3,4. Further, the authors conducted a comprehensive search of recent literature, findings from which are included throughout this document. Finally, WBP 2021 includes a set of enablers for translation of knowledge into practice. These enablers are tools intended for use at the point of care to enhance implementation of the WBP statements.
Methods
Ten statements were initially developed by the authors based on previous versions of the WBP paradigm and informed by a review of recent literature. These initial statements were used to create an online survey and a set of visual ‘enablers’ that added further detail to each statement. Some of the 10 statements were further subdivided into lettered substatements (1A, 1B, 1C etc). The survey was iteratively reviewed and assessed for face and content validity by a total of twenty developers and external wound care stakeholders over a 6-month period and finalised for send-out.
The survey (Supplementary Table 1, https://wcetn.org/page/ReadJournal) was sent to a purposive sample of wound healing key opinion leaders (KOLs). The authors chose at least one KOL from each continent and from each key wound healing profession – physicians, nurses and allied health practitioners. For each statement, respondents stated whether they strongly agreed, somewhat agreed, somewhat disagreed or strongly disagreed. The desired consensus level for statement acceptance was 80% of respondents somewhat agreeing or strongly agreeing with each statement. The survey was also sent to graduating classes of the International Interprofessional Wound Care Courses (IIWCC) in Abu Dhabi and Canada. The respondents were completing a year-long KOL training with a certificate of completion. Most (but not all) class members voluntarily participated.
Results
Surveys were requested from KOLs (n=21) and students of the IIWCC 2020 class of Abu Dhabi (n=66) and Canada (n=65). The 21 KOLs’ consensus for each statement was between 86–100% (Supplementary Table 2). The 2020 IIWCC class in Abu Dhabi demonstrated 98–100% consensus (Supplementary Table 3) and the class in Canada reached an 85–100% consensus (Supplementary Table 4, all tables at https://wcetn.org/page/ReadJournal). The most notable result, beyond the generally high level of consensus, was the comparatively low KOL agreement with Statement 5 (still 86%; discussed later) and the high agreement with all statements among the Abu Dhabi students. This could be because the students in Abu Dhabi (from several West Asian countries and a small number of students from Africa) had less wound care experience than the other groups.
The final 10 statements are listed in Table 1. Each statement will now be expanded upon in more detail in a narrative summary and with accompanying visuals for translation to practice.
Table 1. WBP 2021 10 final statements
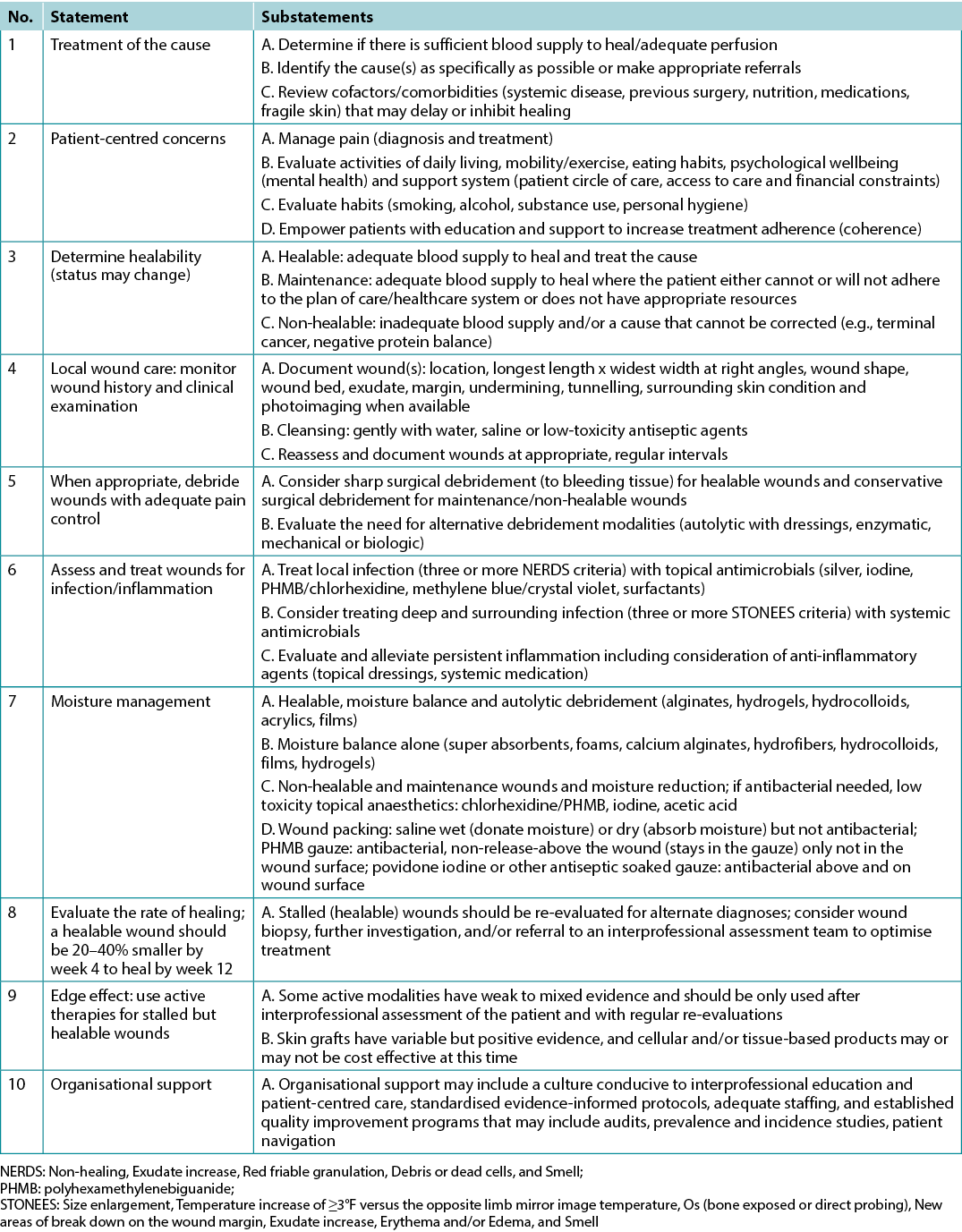
Statement 1 – Treatment of the cause
Optimal, timely diagnosis and treatment of the wound cause are the most important aspects of chronic wound care.
Substatement 1A – Determine if there is sufficient blood supply to heal/adequate perfusion
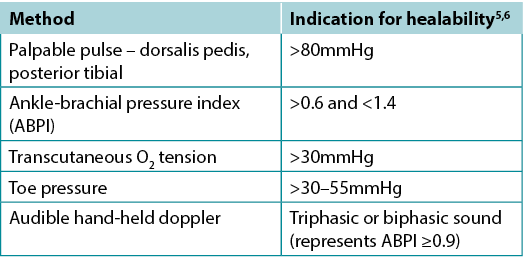
Clinicians should assess vascular supply for leg and foot ulcers to identify if there is adequate blood supply to heal. A palpable dorsalis pedis pulse usually indicates there is at least 80mmHg pressure in the foot (Table 2).
The ABPI is a ratio of the ankle systolic BP over the brachial systolic BP obtained using an 8-MHz portable Doppler. Approximately 8% of individuals may have an aberrant dorsalis pedis pulse, and the posterior tibial or peroneal pulse should be palpated as an alternative. The ABPI has been the standard for assessment of blood supply in the foot. A normal value is usually equal to or greater than 0.9 and less than 1.45,6; under 0.9 there may be some arterial disease, and over 1.4 the foot vessels are calcified and the value is inaccurate.
Ideally, the ABPI should be obtained after the patient has been recumbent for 20 minutes. A BP cuff is placed over the gaiter area of the lower leg. The clinician locates an audible arterial signal on the foot, and the cuff is inflated until the sound disappears. The cuff is deflated and, when the sound reappears, the systolic BP is recorded. The same procedure is repeated over the brachial artery.
Often oedema and inflammation (including congestive heart failure, acute or subacute lipodermatosclerosis or thrombophlebitis), along with infection, may result in pain. Acute pain may make occlusion of the lower leg artery impossible. In addition, up to 80% of persons with diabetes or 20% of older adults will have calcified vessels, providing an artificially high ABPI, rendering the test inaccurate. An alternative test is the AHHD evaluation. This test can be performed with the patient sitting or recumbent, and the BP cuff is not necessary around the gaiter area. An adequate amount of gel is placed over the dorsum of the foot and the audible waveform elicited (Table 2). A monophasic or absent audible signal indicates the need for a full vascular assessment. The presence of an audible multiphasic (biphasic/triphasic) wave indicates there is no significant peripheral vascular disease in the lower extremity, and compression therapy can be instituted. The foot should be checked for normal temperature and the absence of dependent rubor (dusky red colour) that blanches with elevation. This physical examination can be used to rule out an angiosomal defect (local or segmental artery occlusion). The dorsalis pedis or posterior tibial pulse should also be palpable.
Table 2. Vascular assessment methods (©WoundPedia 2021)
A 2015 study documented the results of AHHD readings performed on 379 legs in 200 patients which were compared with sequential lower-leg Doppler readings in a certified vascular laboratory7. The test is specific for excluding arterial disease (posterior tibial, 98.6%; dorsalis pedis, 97.8%) but is not sensitive for a diagnosis of arterial disease (posterior tibial, 37.5%; dorsalis pedis, 30.2%). This test is a reliable, simple, rapid, inexpensive bedside exclusion test for peripheral vascular disease among patients with or without diabetes. The results are independent of vascular calcification.
Again, a monophasic Doppler result or absent pulses should trigger segmental lower leg duplex Doppler studies of the arterial blood supply. In some cases, venous studies may be warranted, especially if there is a possibility of surgical or other venous intervention. This test can avoid delays in applying compression therapy when traditional ABPI studies are not possible (lack of access to a Doppler, pain, non-compressible vessels or time constraints).
For ulcers elsewhere on the body, there is a need for adequate perfusion; check the temperature of the surrounding skin. Examine the regional skin for dependent rubor of the arm or leg distally. On the central body, check the area for oedema or necrosis along with circulation time (a white area from a depressed finger on the skin should return in 3 seconds or less; otherwise, there may be compromise). Compromised circulation may indicate a maintenance or non-healable wound until the underlying defect is corrected.
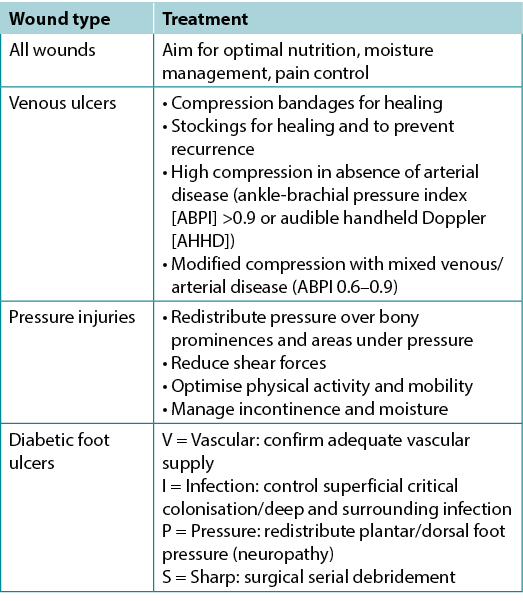
Substatement 1B – Identify the cause(s) as specifically as possible or make appropriate referrals
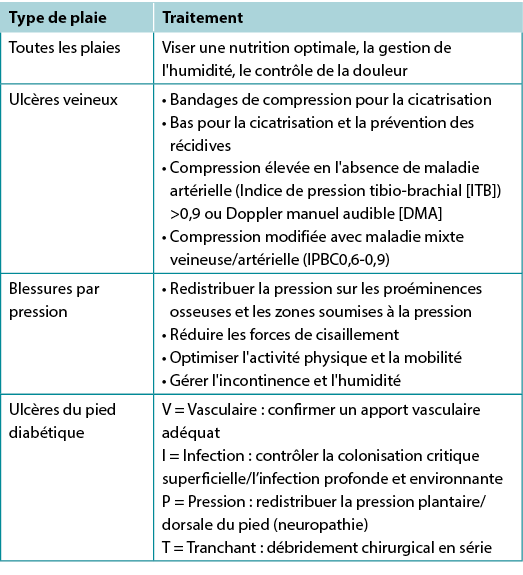
Often the cause of a non-healing wound is an “inadequate diagnosis”4. Practitioners must identify the wound cause as precisely as possible, considering vascular leg ulcers (venous, mixed, arterial, lymphatic or combinations), diabetic foot ulcers (neuropathic, ischaemic or mixed) and pressure injuries (which must be distinguished from moisture-associated skin damage); each has specific management considerations (Table 3). Other diagnoses include inflammatory ulcers (pyoderma gangrenosum, vasculitis), malignant ulcers (primary skin, other secondary malignancies), trauma/previous surgeries, medications, and congenital or acquired coexisting diseases. Some coexisting conditions put skin at risk. As skin ages, it becomes thinner. Photo damage and hereditary (e.g., epidermolysis bullosa, Ehlers-Danlos syndrome) or acquired (e.g., bullous pemphigoid, toxic epidermal necrolysis) dermatologic disease increase susceptibility to trauma, including skin tears. Further, areas of moisture-associated skin damage may be more susceptible to pressure injuries or infection.
Table 3. Treatment of wound cause by type (©WoundPedia 2021)
Substatement 1C – Review cofactors/comorbidities (systemic disease, previous surgery, nutrition, medications, fragile skin) that may delay or inhibit healing
Addressing modifiable cofactors is important for all persons with chronic wounds (Figure 2). Appropriate referrals for optimal management can often facilitate wound healing.
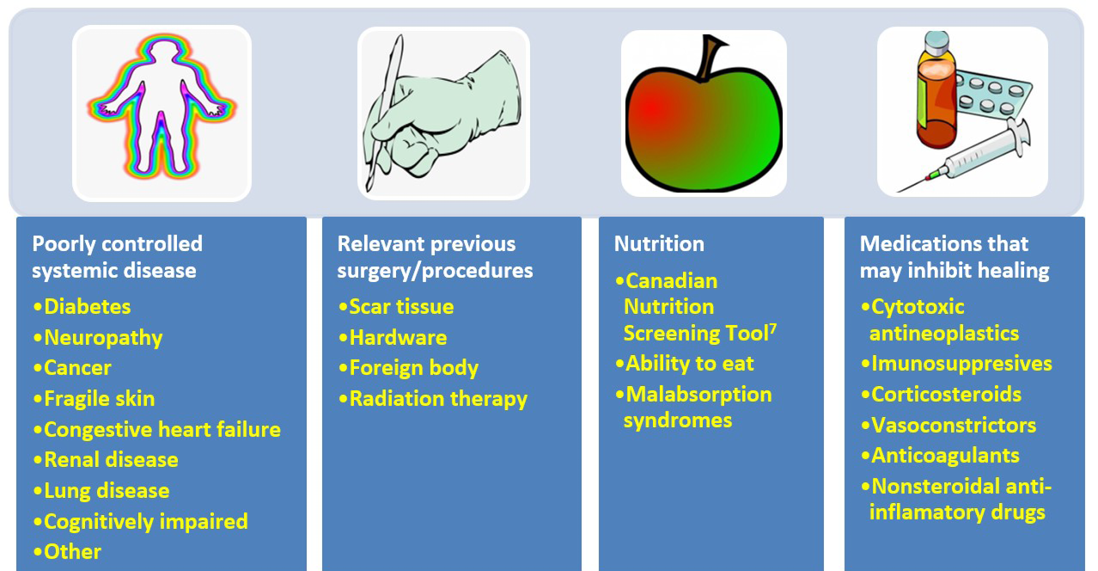
Figure 2. Cofactors and comorbidities to review for wound healing (©WoundPedia 2021)
Nutrition assessment can be facilitated with the validated two-question Canadian Nutritional Screening Tool8:
- Have you lost weight in the past 6 months without trying to lose this weight? (If the patient reports a weight loss but gained it back, consider it as no weight loss).
- Have you been eating less than usual for more than a week?
This tool has many advantages; no blood tests or diagnostic procedures are required, it is simple and rapid to administer and it is reliable9. Any healthcare professional can quickly identify a potential nutrition deficiency and the need for referral to a dietitian.
Statement 2 – Patient-centred concerns
Substatement 2A – Manage pain (diagnosis and treatment)
Pain is often the foremost concern of patients, whereas it is rarely the top concern of healthcare providers. Pain must also be quantified. The numeric rating scale (0–10) is typically used (Table 4). Reported pain levels of 5 or greater require intervention.
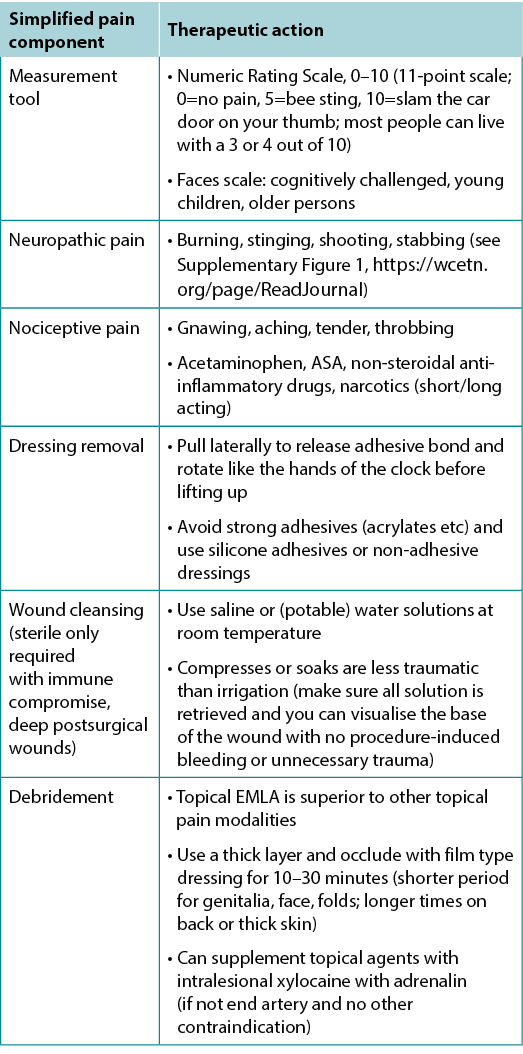
Table 4. Management of wound-related pain (©WoundPedia 2021)
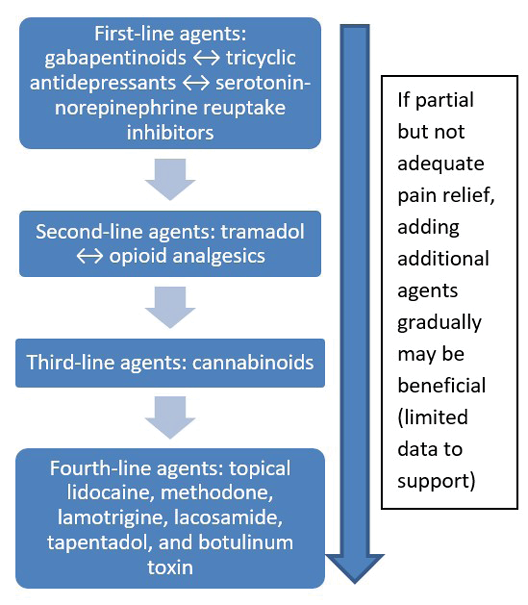
There are two major types of pain – nociceptive and neuropathic (Supplementary Figure 1, https://wcetn.org/page/ReadJournal). Nociceptive pain is related to injury, is stimulus dependent and is typically associated with aching, gnawing, tender or throbbing sensations. Neuropathic pain is often spontaneous and described as burning, shooting, stinging or stabbing. Each type has a different physiologic basis, necessitating different pharmacologic treatment.
A recent systematic review on topical analgesics associated with pain in chronic leg ulcers demonstrated a topical cream (eutectic mixture of local anaesthetics) was superior to other formulations for people living with chronic leg ulcers10. There are other topical modalities that may be associated with pain relief and strategies, including the use of silicone adhesives to replace other, more traumatic, acrylic adhesives at dressing removal.
Inadequate pain control can occur during many components of local wound care11. For painful dressing changes, oral medication must be administered at an appropriate time prior to the change. Between dressing changes, pain is often linked to the cause of the wound or its complications; consider non-pharmacologic measures (music therapy, meditation, acupuncture, transcutaneous electrical nerve stimulation, homeopathy, naturopathy and spiritual healing).
In summary, a patient’s rights in terms of pain involve the six Cs – every patient deserves to be Checked, the Cause determined, the Consequences of treatment explained (with adverse effects), adequate Control, the ability to Call timeouts during procedures and Comfort. Finally, providers must remember that pain management not documented is equivalent to no pain management.
Substatement 2B – Evaluate activities of daily living, mobility/exercise, eating habits, psychological wellbeing (mental health) and support system (patient circle of care, access to care and financial constraints)
Patient-centred concerns often involve inadequate support structures. They can also involve a lack of healthcare system agency impairing access to appropriate healthcare. Personal mental health may impair the patient’s ability to cope with the management of a chronic wound, and he or she may require help. There is a need for social workers, discharge coordinators and clinical psychologists to support systems in the community.
Substatement 2C – Evaluate habits (smoking, alcohol, substance use, personal hygiene)
Every cigarette will decrease local oxygenation 30% for an hour12. Cigarettes and other tobacco products can be a major factor preventing healing of chronic wounds or act as a proinflammatory stimulus for persons with hidradenitis suppurativa. Opiate use alone (especially >10mg/d) was associated with an increase in wound size and reduced likelihood of healing in a 2017 study of 450 patients13.
Substatement 2D – Empower patients with education and support to increase treatment adherence (coherence)
Aujoulat et al14 examined patient empowerment in relation to chronic disease education. They determined that: “the goals and outcomes… should neither be predefined by the healthcare professions, nor restricted to some disease and treatment related outcomes but should be discussed and negotiated with every patient according to his/her own particular situation and life priorities”14.
Moore et al.15 outlined four steps to increase patient involvement in their care:
1. Seek patient views/understanding of their condition.
2. Identify fears/concerns.
3. Establish what is important for the patient.
4. Assess willingness for involvement in their care.
Statement 3 – Determine healability
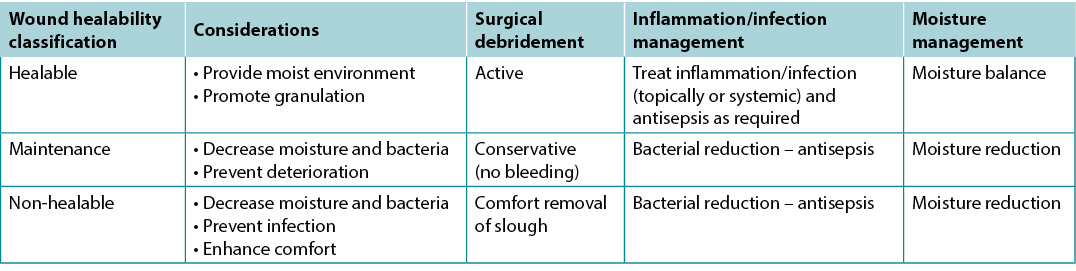
One of the first steps providers must take after diagnosis is to determine healability, with the knowledge that the wound status may change. Generally, chronic wounds fall into one of three categories – healable, maintenance and non-healable. Local wound care strategies will vary by classification (Table 5).
Table 5. Summary of local wound care strategies; adapted from Sibbald et al16 (©WoundPedia 2021)
Substatement 3A – Healable: adequate blood supply to heal and treat the cause
A healable wound has enough blood supply to heal and the cause has been corrected. As a rule, approximately two-thirds of wounds in the community are healable.
Substatement 3B – Maintenance: adequate blood supply to heal where the patient either cannot or will not adhere to the plan of care/healthcare system or does not have appropriate resources
A quarter of wounds are maintenance wounds, either because of patient issues (e.g., refusal to wear compression bandages) and/or health system factors that prevent healing (e.g., cannot afford plantar pressure redistribution devices and the system will not supply the footwear).
Substatement 3C – Non-healable: inadequate blood supply and/or a cause that cannot be corrected (e.g., terminal cancer, negative protein balance)
Approximately 5–10% of wounds are non-healable, often because of inadequate blood supply that cannot be treated or corrected, advanced chronic disease, or the dying process. For patients with non-healable wounds, the paramount points of care to address are pain, infectious complications, exudate and odour control as well as activities of daily living.
Thirteen KOLs from the Wound Healing Society of South Africa conducted a recent systematic integrative review of non-healable and maintenance wounds17. This 13-member panel sourced 13 reviews, six best practice guidelines, three consensus studies and six original non-experimental studies. The three main conclusions were the need for patient-centred care, timely intervention by skilled healthcare providers, and an interprofessional referral pathway17.
Statement 4 – Local wound care: monitor wound history and clinical examination
Substatement 4A – Document wound(s): location, longest length x widest width at right angles, wound shape, wound bed, exudate, margin, undermining, tunnelling, surrounding skin condition and photoimaging when available
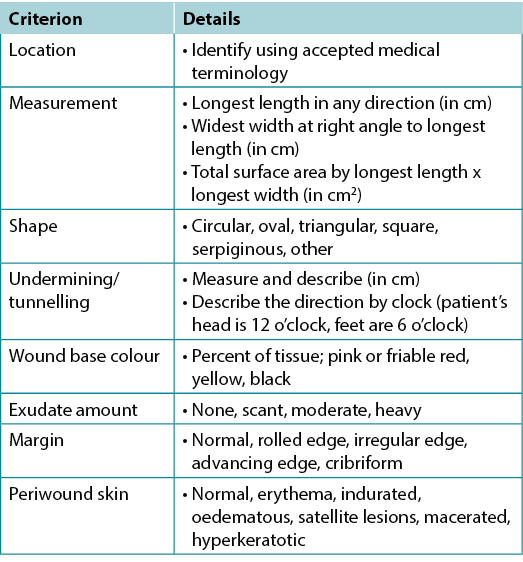
Wound documentation is important (Table 6). Document the wound’s location and size; these authors recommend using the longest length and widest width perpendicular to one another, although head-to-toe alignment is also common. Pick the method of measurement that aligns with institutional policy; consistency is most important. Note and monitor undermining, tunnelling, tissue type in the wound bed, wound margins and periwound skin characteristics.
Table 6. Wound documentation (©WoundPedia 2021)
Substatement 4B – Cleansing: gently with water, saline or low-toxicity antiseptic agents
For healable wounds, local wound care may include sharp surgical debridement, treatment of infection (local infections, deep and surrounding infection) and moisture management. For non-healable wounds, optimal care may be aimed at conservative debridement of slough, bacterial reduction and moisture reduction. In these cases, antiseptic agents that may have some tissue toxicity may be preferable to allowing bacterial proliferation to cause further tissue damage leading to infection.
There is extraordinarily little high quality evidence on the topic of wound cleansing (Table 7); accordingly, it is hard to draw any conclusions so the topic of wound cleansing is one that requires further research19. When irrigating, note the amount of solution that was used going into and out of the wound bed. Caution should be used when the entire wound bed is not clearly visualised or intact. Be careful not to harm the wound bed through excess trauma.
Table 7. Methods of wound cleansing; adapted from Nicks et al18 (©WoundPedia 2021)
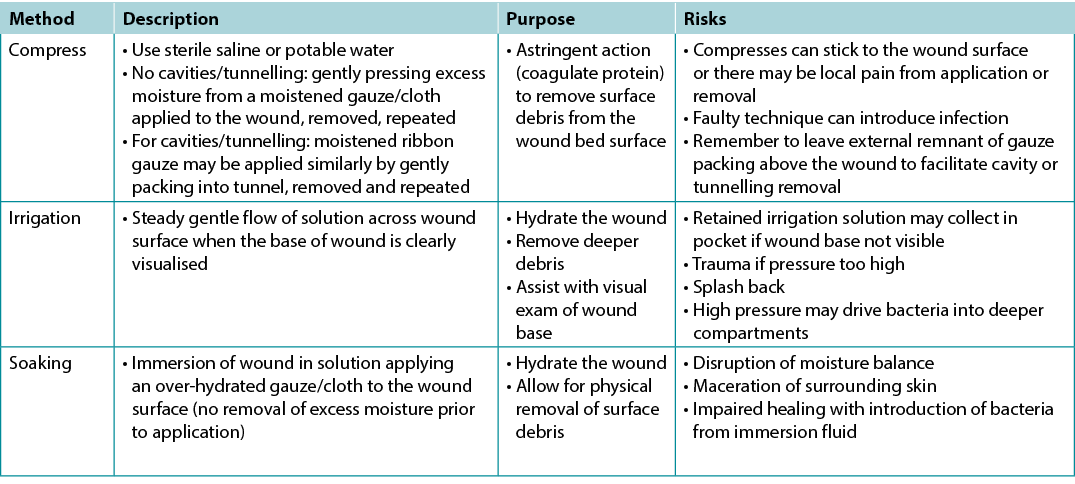
Substatement 4C – Reassess and document wounds at appropriate, regular intervals
Statement 5 – When appropriate, debride wounds with adequate pain control
Debridement is a way to remove slough, debris or foreign substances that may facilitate infection or act as a proinflammatory stimulus, prolonging the inflammatory stage of wound healing and delaying the proliferative reparative process. Sharp surgical debridement requires assessment of the blood supply to be sure it is adequate for healing. Before starting, providers who are considering even conservative debridement methods must ensure they have appropriate competency, scope of practice, the required equipment, and support in the event of bleeding, as well as alignment with their facility’s policies and procedures.
Although it did achieve consensus, the relatively lower agreement levels among KOLs for this statement were likely attributable to facility-related limitations on sharp debridement. This procedure requires clinical experience, appropriate scope of practice, and availability of equipment to perform the procedure and stop bleeding if required.
Substatement 5A – Consider sharp surgical debridement (to bleeding tissue) for healable wounds and conservative surgical debridement for maintenance/non-healable wounds
For healable wounds, this means sharp surgical debridement, autolytic debridement with dressings or enzymatic, biologic (medical maggots), or mechanical debridement. For non-healable and maintenance wounds, this means conservative surgical or other methods of non-viable slough removal.
Patient empowerment can be modelled on the 4-Step Clinical Decision Making Debridement Guide20 for a mutual agreement between patients and clinicians. First, ask whether the wound is capable of healing. If the answer is yes, select the appropriate method based on patient concerns and wound characteristics. Next, investigate which wound characteristics influence debridement choice, such as secondary infection, pain, wound size and exudate. Ascertain how selective a debridement method is needed; determine if there is any risk to healthy tissue when necrotic tissue is being debrided. Finally, consider the care setting. Some clinicians and/or types of resources may not be available in all care settings. Government regulation and facility policy may also be factors20.
Substatement 5B – Evaluate the need for alternative debridement modalities (autolytic with dressings, enzymatic, mechanical or biologic)
Autolytic debridement can be accomplished via calcium alginate, hydrogel and hydrocolloid dressings. This type of debridement is often relatively painless, but it may be slower than surgical methods. Enzymatic debridement (collagenase) is often used where surgical debridement or autolytic dressings are not available. It is a relatively slow method, and the treatment requires a prescription.
Mechanical debridement may be accomplished using advanced technologies such as ultrasound that require clean or sterile conditions with protection from bacterial contamination and airborne bacterial pathogens or particulate matter. Whirlpool systems may contaminate areas of emersed skin and may cause cross-contamination between patients. Saline wet-to-dry gauze is nursing time intensive, painful on dressing removal, and can remove healthy viable tissue from the wound surface.
Moya-López et al.21 recently published a review of maggot debridement therapy for chronic wounds. Maggot therapy can be faster than some other non-surgical debridement methods, and it is selective for devitalised tissue. The authors concluded that more data were needed by wound type, frequency of application and the efficacy of treatment. Maggots are not indicated for ischaemic wounds and when deep and surrounding infection has not been treated systemically.
Statement 6 – Assess and treat wounds for infection/inflammation
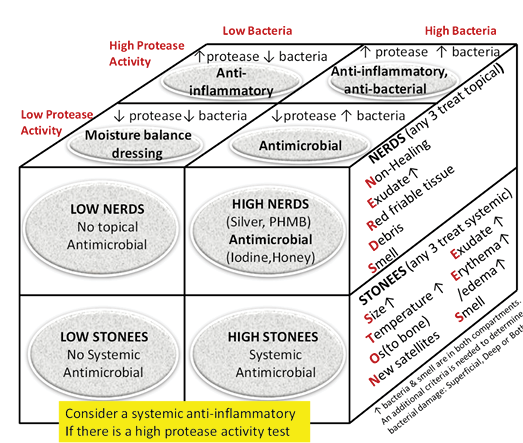
Wound infections have two compartments – one superficial and the other deep10,12. Wounds can be thought of as a bowl of soup; the thin layer on the surface of a wound is analogous to the superficial compartment, and the sides and bottom of the soup bowl are equivalent to the surrounding and deep components of a chronic wound.
Substatement 6A – Treat local infection (three or more NERDS criteria) with topical antimicrobials (silver, iodine, polyhexamethylenebiguanide [PHMB]/chlorhexidine, methylene blue/crystal violet, surfactants)
The superficial compartment of a chronic wound is a thin layer of cells that can be treated topically. Any three or more NERDS (Nonhealing, Exudate increase, Red friable granulation, Debris or dead cells, and Smell) criteria are signs of local infection, for which topical antimicrobials may be indicated. If the wound is healable and the cause treated, it should take 4 weeks or less to improve. Clinicians should know that treating the superficial wound compartment requires dressings to release antimicrobial agents onto the surface of the wound. Non-release dressings will work above the wound surface but cannot penetrate the superficial compartment. This may prevent bacterial growth above the wound, but another agent may be needed to target the surface wound compartment. For example, antiseptic sprays such as chlorhexidine mouthwashes often have less available alcohol with decreased local burning and stinging compared with some presurgical antiseptics designed for intact skin. Some topical agents release silver or iodine in various concentrations to penetrate the surface compartment and treat local infection.
Substatement 6B – Consider treating deep and surrounding infection (three or more STONEES criteria) with systemic antimicrobials
Topical antimicrobial agents penetrate only a few millimetres; deep and surrounding infections may require systemic antimicrobials (Supplementary Table 5, https://wcetn.org/page/ReadJournal). Four of the seven STONEES criteria represent the wounds’ surrounding features (the sides of the soup bowl) – increased Size, elevated Temperature of 3°F over a mirror image of the surrounding wound skin, New or satellite areas of involvement and a surrounding cellulitis (Erythema or Edema). Cellulitis is not always present when chronic wounds are associated with deep and surrounding infection, and erythema is not easily recognised in skin of colour or the presence of oedema. The three remaining STONEES signs in the wound bed include probing to bone (Os [Latin for bone]), increased Exudate and Smell.
Substatement 6C – Evaluate and alleviate persistent inflammation including consideration of anti-inflammatory agents (topical dressings, systemic medication)
Factors other than infectious organisms can play a role in a persistent inflammatory response. These factors include invading cells (neutrophils, macrophages, lymphocytes), immune complexes (vasculitis), granulomatous inflammation (sarcoidosis, etc) and others; consider these factors when picking a topical or systemic therapy. There are some topical antimicrobials that are proinflammatory, such as iodine. There are other agents that may be anti-inflammatory, including silver, and some that are neutral, such as PHMB gauze/foam and gentian violet/methylene blue foam.
Inflammation can also lead to delayed wound healing in both compartments. Protease tests are not always available in the clinical setting and may only measure surface rather than deep changes. Some of the signs of infection may also be part of the clinical presentation for persistent inflammation. The Sibbald Cube (Supplementary Figure 2 (https://wcetn.org/page/ReadJournal) outlines where high proteases in wounds with and without infection may prevent healing in both the superficial and deep compartments. Recently published data indicate biomarkers may predict the healing trajectory of venous leg ulcers22. The right therapy at the right time could more effectively control proteases, bacterial contamination, debridement and moisture control with optimal timing of growth factors, matrix constructs and cellular components.
In regard to topical therapies, silver- and honey-based products have reported anti-inflammatory effects. These agents should only be used with local infection and inflammation for short periods of time. Systemically, several antibacterial agents have anti-inflammatory action. Commonly recommended antimicrobials (some with anti-inflammatory effects) for wounds and related skin infections are listed in Supplementary Table 5 (https://wcetn.org/page/ReadJournal).
Statement 7 – Moisture management
Providers must select an appropriate dressing to match the wound characteristics and individual patient needs (Figure 3). Ideal moisture management depends on a wound’s healability.
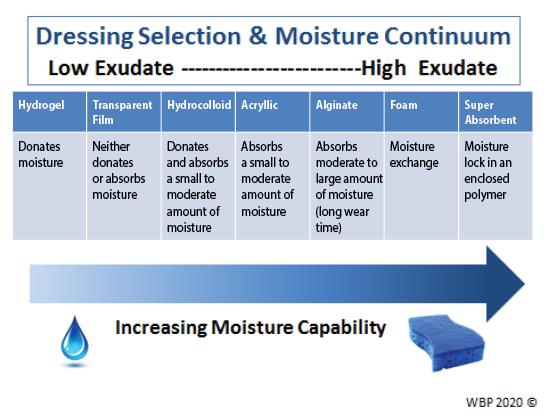
Figure 3. Optimising moisture management; adapted from Sibbald et al16 (©WoundPedia 2021)
Substatement 7A – Healable, moisture balance and autolytic debridement (alginates, hydrogels, hydrocolloids, acrylics, films)
In healable wounds, moisture balance can be achieved by choosing the appropriate dressing from the moisture continuum in the enabler (Supplementary Table 6, https://wcetn.org/page/ReadJournal) that lists dressings for low to highly exudative wounds.
Substatement 7B – Moisture balance alone (super absorbents, foams, calcium alginates, hydrofibers, hydrocolloids, films, hydrogels)
Substatement 7C – Non-healable and maintenance wounds and moisture reduction; if antibacterial needed, low toxicity topical anaesthetics: chlorhexidine/PHMB, iodine, acetic acid
For individuals with maintenance or non-healable wounds, target moisture and bacteria reduction. Wounds need to be constantly reassessed for healing or deterioration and dressing choices may need to be altered based on presentation.
For these wounds, providers need to balance patient preference and comfort to avoid pain, as well as prevent overdrying of wounds. Tulle dressings are often most appropriate; they are a combination of gauze or fabric with a petrolatum or paraffin coating. They may also contain an antiseptic (e.g., chlorhexidine, iodine).
However, several dressings can optimise moisture management16. Chlorhexidine (0.5% in white paraffin impregnated into a tulle sheet) is active against Gram-positive and negative bacteria; PHMB is a non-release foam, gauze/packing ribbon formulation. Iodine dressings (either in cadexomer molecule or as povidone iodine) have a broad spectrum of activity, albeit decreased effectiveness in the presence of pus or exudate. Note that these dressings may be toxic with prolonged use over large areas (as povidone iodine). Finally, acetic acid (0.5–1%, e.g., diluted white vinegar) should be placed using gauze on the wound bed usually for about 5–10 minutes, often as a rotating compress. These dressings have a low pH and are effective against Pseudomonas species; however, they may select out other organisms16.
Substatement 7D – Wound packing: saline wet (donate moisture) or dry (absorb moisture) but not antibacterial; PHMB gauze: antibacterial, non-release-above the wound (stays in the gauze) only not in the wound surface; povidone iodine or other antiseptic soaked gauze: antibacterial above and on wound surface
Saline packing may be used in healable wounds without critical colonisation. It is not the purpose of these dressings to stick to the wound bed so that there will be trauma with dressing removal. If a dry saline gauze sticks to the wound bed, the gauze should be moistened before application and, if it sticks, moistened again prior to removal. Alternate dressings should then be chosen to maintain moist, interactive healing.
Statement 8 – Evaluate the rate of healing
If a wound is not at least 20–40% smaller by week 4, it is unlikely to heal by week 12 (Figure 4).

Figure 4. How to calculate wound surface area
Substatement 8A – Stalled (healable) wounds should be re-evaluated for alternate diagnoses; consider wound biopsy, further investigation, and/or referral to an inter-professional assessment team to optimise treatment
Healing trajectory can be assessed in the first 4–8 weeks to predict if a wound is likely to heal by week 12, provided there are no new complicating factors9. Stalled but healable wounds often need a comprehensive interprofessional assessment to optimise treatment and improve the healing trajectory. This may necessitate the reclassification of a wound to the maintenance or non-healable category.
Statement 9 – Edge effect
Use active therapies for stalled but healable wounds. See Supplementary Table 7 (https://wcetn.org/page/ReadJournal) for evidence on adjunctive therapies – negative-pressure wound therapy, electrical stimulation, cellular and/or tissue-based products, skin grafts, ultrasound and hyperbaric oxygen therapy (Table 8).
Table 8. Adjunctive therapies
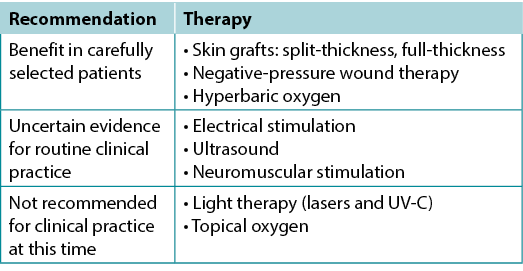
Substatement 9A – Some active modalities have weak to mixed evidence and should be used only after inter-professional assessment of the patient and with regular re-evaluations
Substatement 9B – Skin grafts have variable but positive evidence, and cellular and/or tissue-based products may or may not be cost-effective at this time
Many active therapies have appeared and disappeared in the wound healing toolbox. Not only do these therapies need to stimulate healing, but also they must be cost-effective within the context of the local health system. Some of these therapies have better evidence for acute wounds than with chronic, non-healing wounds (e.g., negative-pressure wound therapy after diabetic foot surgery, split-thickness skin grafts), particularly where the cause is not or cannot be corrected. If an active therapy is selected, it is imperative that a consistent and accurate wound assessment be conducted so that wound progression in either direction may be determined and the therapy discontinued in a timely manner if the wound is not on a healing trajectory. More high-quality randomised controlled trials on these therapies are needed before definitive recommendations on their use can be made.
Statement 10 – Organisational support
Substatement 10A – Organisational support may include a culture conducive to interprofessional education and patient-centred care, standardised evidence-informed protocols, adequate staffing, and established quality improvement programs that may include audits, prevalence and incidence studies and patient navigation
Elements of an effective organisational plan for guideline implementation are as follows23:
- Assess organisational readiness and barriers to implementation, considering local circumstances.
- Involve all members (whether in a direct or indirect supportive function) in the implementation process.
- Provide ongoing educational opportunities to reinforce best practice.
- One or more qualified individual(s) should provide the support needed for the education and implementation process.
- Provide opportunities for reflection on personal and organisational experience in implementing guidelines.
Often the barriers to successful wound healing are related to the health system and not a lack of provider knowledge. Better coordination of care is needed across the continuum, from acute to chronic care, as well as standardisation of formularies and best practices. This could be accomplished through situational learning, changing healthcare systems to facilitate interprofessional assessment of complex patient problems, and breaking down barriers within and across healthcare organisations. This requires organisations to invest in resources for interprofessional education on wound care practices, as well as collection and regular review of wound care data outcomes in the form of an ongoing quality initiative.
Patients with chronic wounds often have limited resources and come from lower socioeconomic backgrounds. Using patient navigation models to facilitate referrals and link homecare providers with care coordinators to access system resources is one way forward24,25. However, this is only successful when team members are linked together as part of a coordinated interprofessional model. These health system changes can increase value.
The Porter model of healthcare links the voice of the patient with the provider, payer, policy maker and even the politician to provide value for the healthcare dollar26. For systems to change, policymakers and politicians must be aware of inconsistencies and inequities facing wound care patients and providers as the first step toward improving patient-centred wound care.
Conclusions
These 10 evidence-informed statements have received consensus from KOLs in repeated surveys. The provision of enablers is intended to assist with dissemination of the WBP paradigm into practice. A concerted effort has been made to emphasise the importance of early, proactive assessment of the wound healing trajectory. By intervening before wounds become chronic, there are benefits for the patient, providers, payors and policy makers. This is more important now than ever in the face of mounting healthcare costs and ageing populations.
Conflict of Interest
Dr LeBlanc has disclosed that she is a speaker for Hollister, Coloplast, 3M and Mölnlycke. Dr Ayello has disclosed that she has received educational/research grants from Sage/Stryker and Calmoseptine. Dr Sibbald has received grants from Mölnlycke, Calmoseptine and the Government of Ontario for Project ECHO Skin and Wound.
Funding
The authors received no funding for this study.
Supplementary data
Supplementary Figure 1
Supplementary Figure 2
Supplementary Table 1. Wound bed preparation 2021 expert survey

Supplementary Table 2. key opinion leader wound bed preparation 2021 survey results (n = 21)
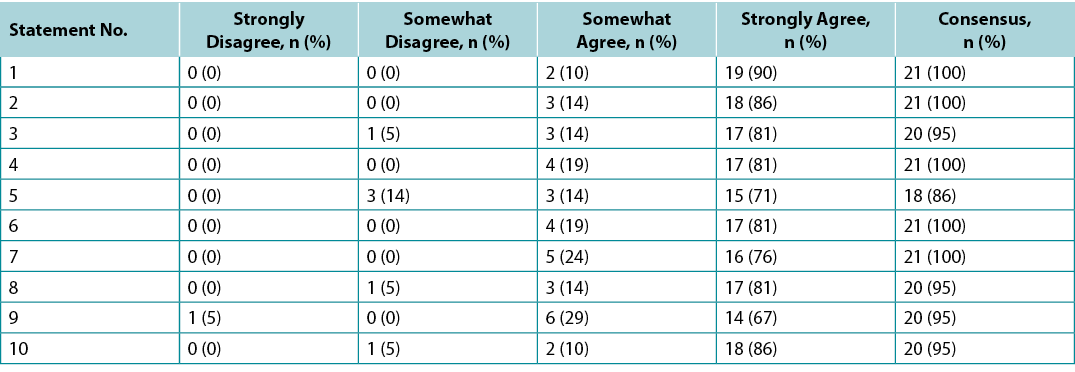
Supplementary Table 3. ABU Dhabi international interprofessional wound care course wound bed preparation 2021 survey results (n = 66)
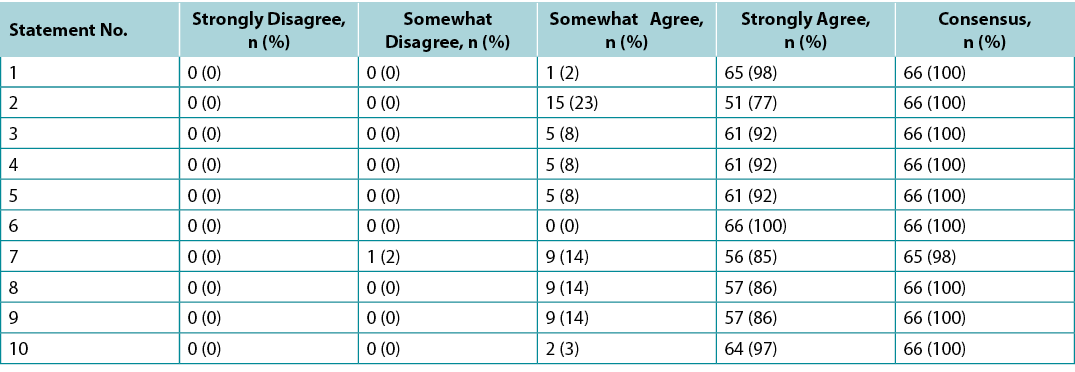
Supplementary Table 4. Canada international interprofessional wound care course wound bed preparation 2021 survey results (n = 65)
Supplementary Table 5. Systemic antimicrobial therapy for deep and surrounding infection
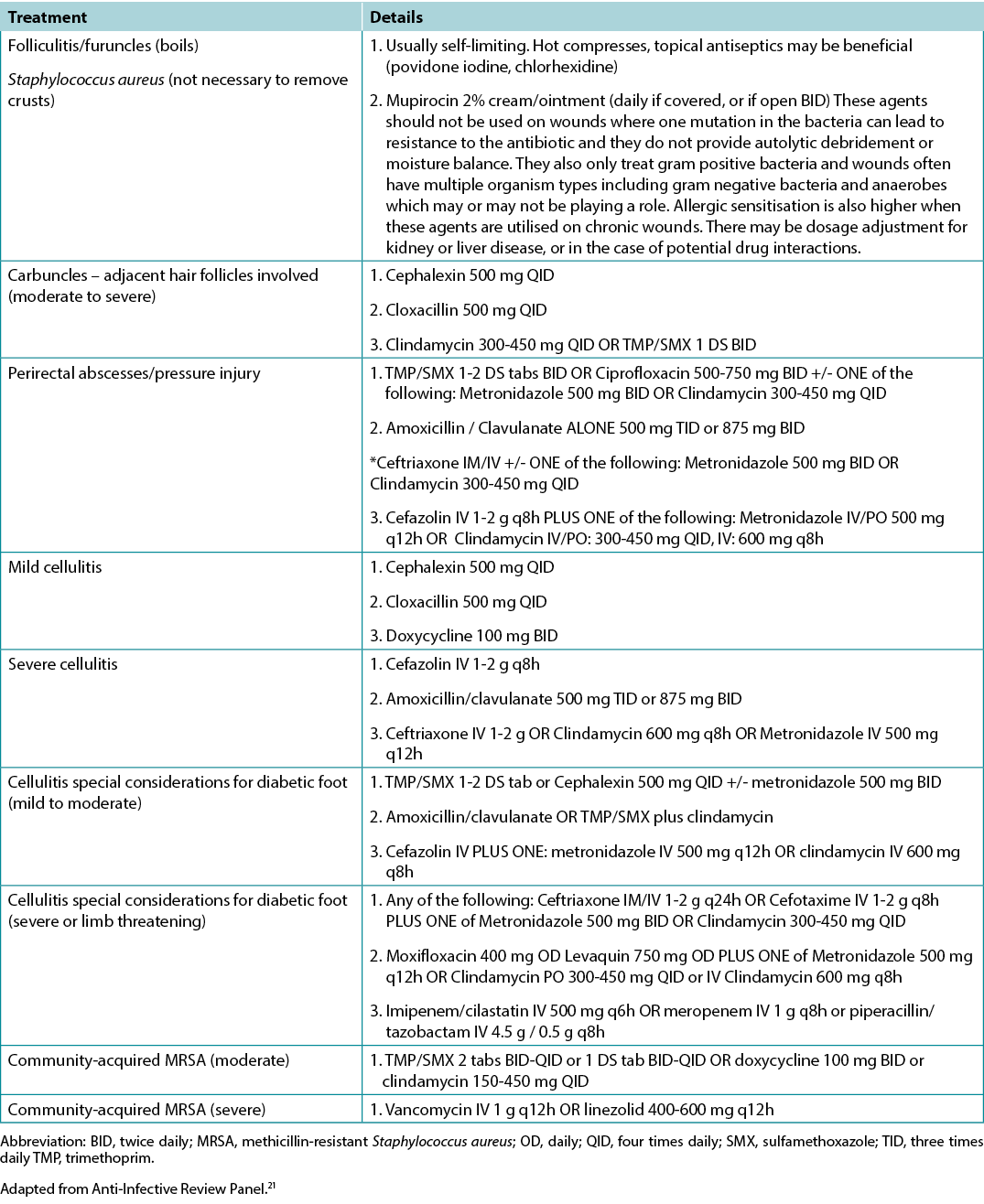
Supplementary Table 6. Summary of Modern Dressing Categories for Moisture Balance by Increasing Absorbency
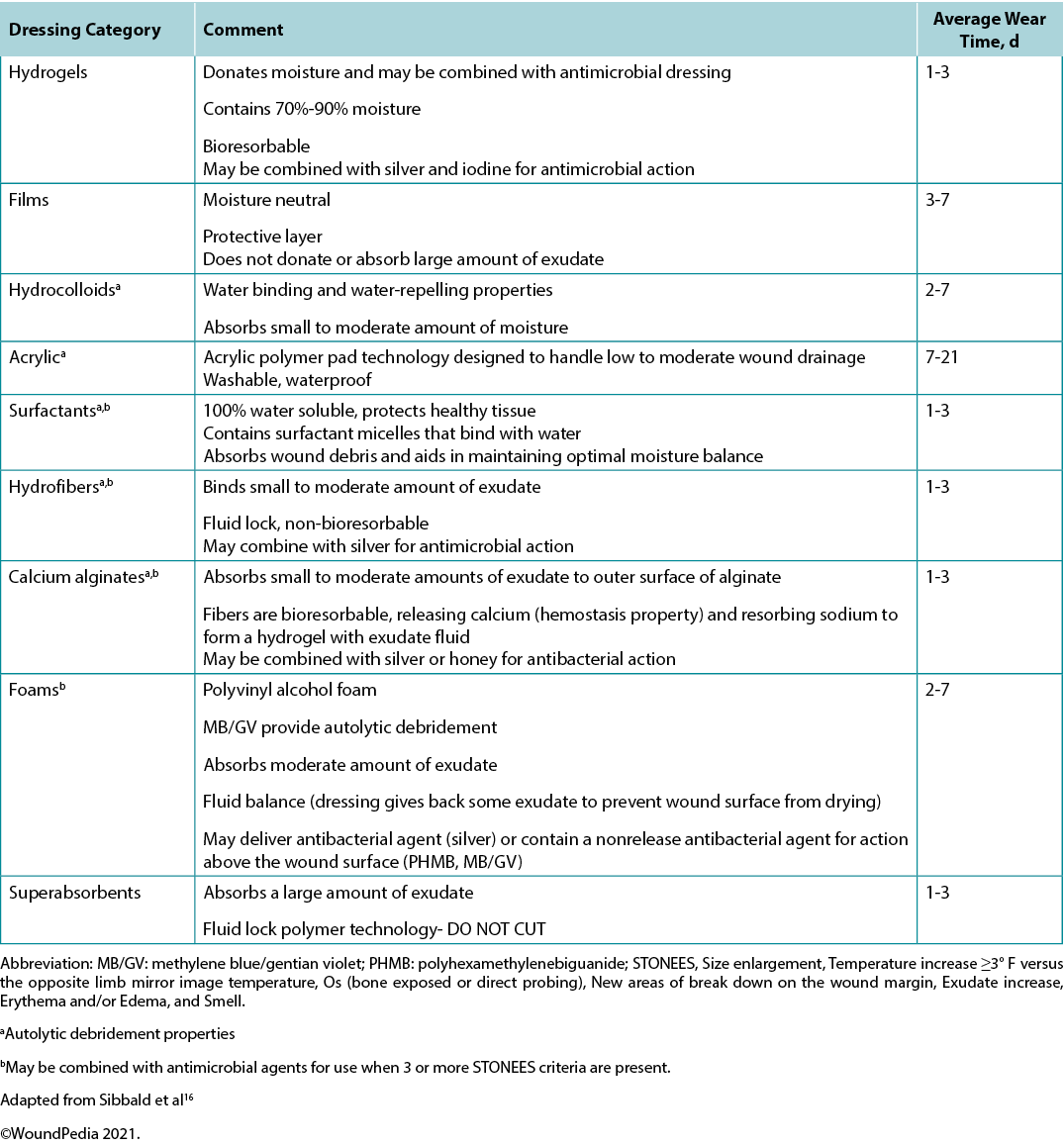
Supplementary Table 7. Evidence on adjunctive therapies
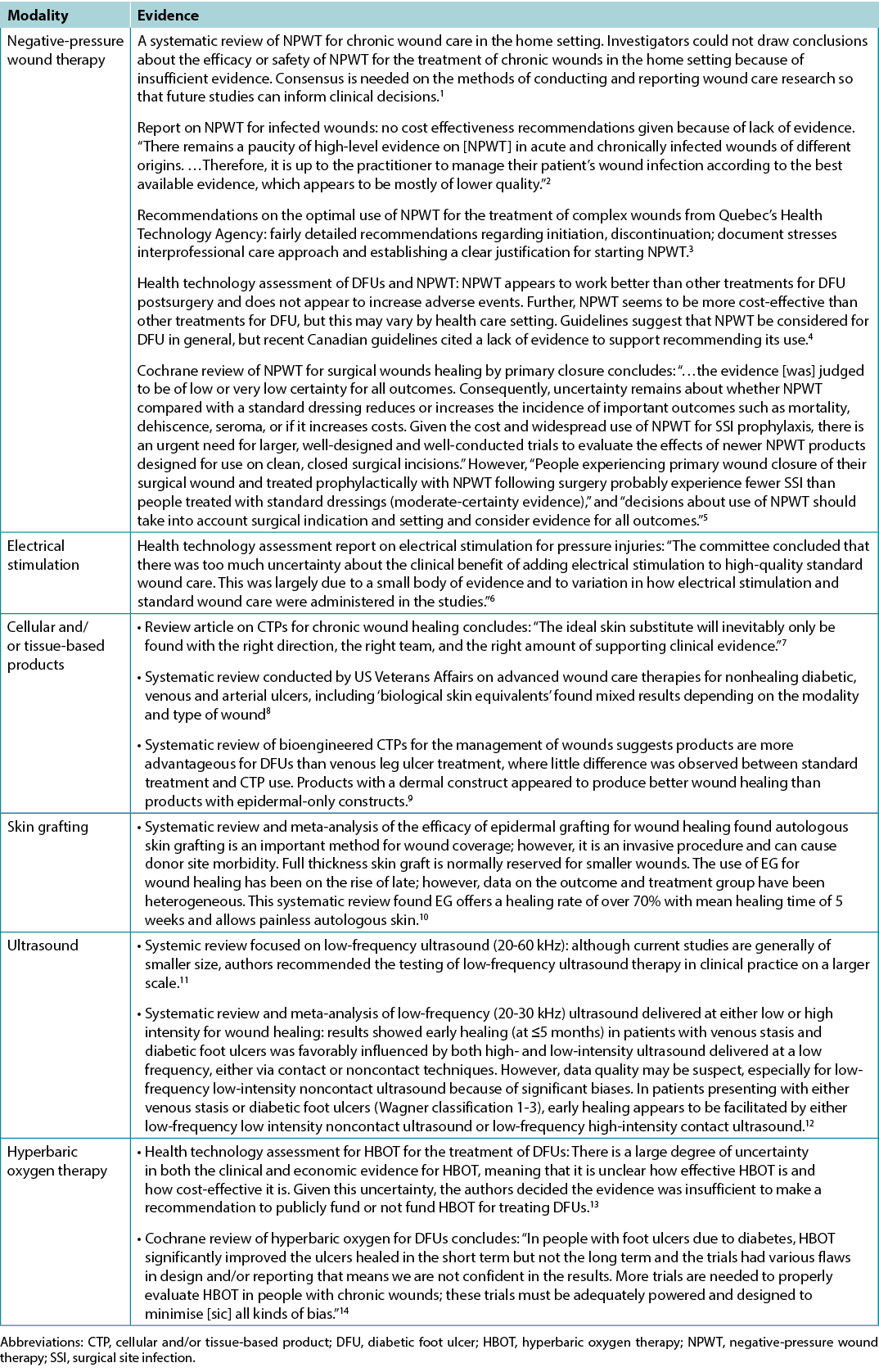
Préparation du lit de la plaie
R Gary Sibbald, James A Elliott, Reneeka Persaud-Jaimangal, Laurie Goodman, David G Armstrong, Catherine Harley, Sunita Coelho, Nancy Xi, Robyn Evans, Dieter O Mayer, Xiu Zhao, Jolene Heil, Bharat Kotru, Barbara Delmore, Kimberly LeBlanc, Elizabeth A Ayello, Hiske Smart, Gulnaz Tariq, Afsaneh Alavi and Ranjani Somayaji
DOI: https://doi.org/10.33235/wcet.42.1.16-28
Résumé
Le modèle de préparation du lit de la plaie (PLP) est un paradigme pour optimiser le traitement des plaies chroniques. Cette approche holistique examine le traitement de la cause et les préoccupations centrées sur le patient pour déterminer si une plaie est cicatrisable, une plaie d'entretien ou non cicatrisable (palliative). Pour les plaies cicatrisables (avec un apport sanguin adéquat et une cause qui peut être corrigée), l'équilibre hydrique est indiqué en même temps que le débridement actif et le contrôle de l'infection locale ou de l'inflammation anormale. Dans le cas des plaies d'entretien et des plaies non cicatrisables, l'accent est mis sur le confort du patient, le soulagement de la douleur, le contrôle des odeurs, la prévention des infections par la diminution des bactéries à la surface de la plaie, le débridement conservateur de la boue et la gestion de l'humidité, y compris le contrôle des exsudats.
Dans cette quatrième révision, les auteurs ont reformulé le modèle PLP en 10 énoncés. Cet article se concentrera sur la littérature des 5 dernières années ou sur les nouvelles interprétations de la littérature plus ancienne. Ce processus est conçu pour faciliter l'application des connaissances dans le cadre clinique et améliorer les résultats des patients à moindre coût pour le système de santé.
Introduction
La préparation du lit de la plaie (PLP) est une approche structurée de la cicatrisation des plaies. Entrant maintenant dans sa troisième décennie d'utilisation généralisée, le paradigme PLP a été publié pour la première fois en 2000, avec des mises à jour périodiques en 2003, 2006, 2011, 2015 et maintenant 2021. Cet article énumère 10 énoncés formulés à partir de versions précédentes du modèle PLP, rapporte les résultats d'une enquête menée auprès de praticiens actuels du traitement des plaies afin d'obtenir un consensus sur ces principes, et résume les données connexes soutenant chaque énoncé. Cette dernière itération présente les principaux changements suivants :
- Utilisation d'un Doppler manuel audible (DMA) de l'artère dorsale pédieuse ou de l'artère tibiale postérieure comme alternative au traditionnel indice de pression tibio-brachial (ITB) pour l'évaluation clinique de l'apport artériel adéquat pour la guérison et la capacité d'appliquer une thérapie de compression en toute sécurité.
- Approches actualisées de la gestion de la douleur topique et systémique chez les personnes souffrant de plaies.
- Mise à jour sur la prise en charge des plaies d'entretien et des plaies non cicatrisables.
- Nouveaux outils pour faciliter la diffusion des connaissances pour les huit autres composantes du PLP.
Sackett et ses collègues1 définissent la médecine fondée sur les données probantes comme "l'intégration de l'expertise clinique individuelle et des meilleures données probantes externes". Plus précisément, les trois piliers de la médecine fondée sur les données probantes sont les preuves scientifiques, les connaissances des experts et les préférences des patients ; ils sont intégrés dans les 10 énoncés inclus dans le paradigme PLP 2021 (figure 1).

Figure 1. Paradigm PLP 2021 (©WoundPedia 2021)
L'implication des parties prenantes dans le processus d'évaluation a été suggérée comme une stratégie permettant de combler le "déficit de traduction "2. Des experts en cicatrisation et des praticiens actifs dans le domaine des soins des plaies ont été impliqués dans le processus d'évaluation des 10 énoncés afin d'en améliorer la diffusion3,4. En outre, les auteurs ont effectué une recherche exhaustive dans la littérature récente, dont les conclusions sont reprises dans le présent document. Enfin, le programme PLP 2021 comprend un ensemble d'outils permettant de traduire les connaissances dans la pratique. Ces outils sont destinés à être utilisés sur le lieu de soins pour améliorer la mise en œuvre des principes du PLP.
Méthodes
Dix énoncés ont été initialement élaborés par les auteurs sur la base des versions précédentes du paradigme PLP et éclairés par une revue de la littérature récente. Ces énoncés initiaux ont été utilisées pour créer une enquête en ligne et un ensemble de "outils" visuels qui ajoutent des précisions à chaque énoncé. Certains des 10 énoncés ont été subdivisés en sous-énoncés lettrés (1A, 1B, 1C, etc.). L'enquête a été révisée de manière itérative et évaluée pour la validité de son contenu et de sa forme par un total de vingt développeurs et intervenants externes dans le domaine des soins des plaies sur une période de 6 mois, puis finalisée pour être envoyée.
L'enquête (tableau annexe 1, https://wcetn.org/page/ReadJournal) a été envoyée à un échantillon raisonné de leaders d'opinion clés (LOC) dans le domaine de la cicatrisation. Les auteurs ont choisi au moins un LOC de référence de chaque continent et de chaque profession clé de la cicatrisation des plaies - médecins, infirmières et infirmiers, et praticiens paramédicaux. Pour chaque énoncé, les répondants ont indiqué s'ils étaient tout à fait d'accord, plutôt d'accord, plutôt en désaccord ou tout à fait en désaccord. Le niveau de consensus souhaité pour l'acceptation des énoncés était de 80 % des répondants plutôt d'accord ou tout à fait d'accord avec chaque énoncé. L'enquête a également été envoyée aux promotions de diplômés du Cours international interprofessionnel de traitement des plaies (IIWCC) à Abu Dhabi et au Canada. Les personnes interrogées terminaient une formation de LOC d'un an validée par un certificat. La plupart (mais pas tous) des membres du groupe ont participé volontairement.
Résultats
Des sondages ont été adressés aux LOC (n=21) et aux étudiants de la promotion 2020 de l'IIWCC d'Abu Dhabi (n=66) et du Canada (n=65). Le consensus des 21 LOC pour chaque énoncé était compris entre 86 et 100 % (tableau annexe 2). La promotion IIWCC 2020 à Abu Dhabi a fait montre d'un consensus de 98 à 100 % (tableau annexe 3) et la promotion du Canada a atteint un consensus de 85 à 100 % (tableau annexe 4, tous les tableaux sur https://wcetn.org/page/ReadJournal). Le résultat le plus remarquable, au-delà du niveau généralement élevé de consensus, était l'accord comparativement faible des LOC avec l'énoncé 5 (tout de même 86% ; discuté plus loin) et l'accord élevé avec tous les énoncés parmi les étudiants d'Abu Dhabi. Cela pourrait s'expliquer par le fait que les étudiants d'Abu Dhabi (originaires de plusieurs pays d'Asie occidentale et un petit nombre d'étudiants africains) avaient moins d'expérience en soins des plaies que les autres groupes.
Les 10 énoncés finaux sont énumérées dans le tableau 1. Chaque déclaration sera désormais développée de manière plus détaillée dans un résumé narratif et accompagnée de visuels pour faciliter la traduction dans la pratique.
Tableau 1. PLP 2021 10 énoncés finaux
Énoncé 1 - Traitement de la cause
Un diagnostic et un traitement optimaux et rapides de la cause de la plaie sont les aspects les plus importants du traitement des plaies chroniques.
Sous-énoncé 1A - Déterminer si l'apport sanguin est suffisant pour la cicatrisation/perfusion adéquate
Les cliniciens doivent évaluer l'apport vasculaire des ulcères de la jambe et du pied pour déterminer si l'apport sanguin est suffisant pour la cicatrisation. Un pouls dorsal pédieux palpable indique généralement une pression d'au moins 80 mmHg dans le pied (tableau 2).
Tableau 2. Méthodes d'évaluation vasculaire (©WoundPedia 2021)
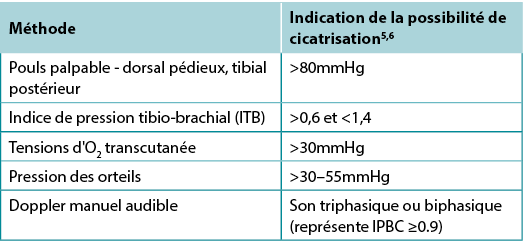
L'IPBC est le rapport entre la tension systolique de la cheville et la tension systolique brachiale, obtenu à l'aide d'un Doppler portable de 8 MHz. Environ 8 % des individus peuvent avoir un pouls dorsal pédieux aberrant, et le pouls tibial postérieur ou péronier doit être palpé comme alternative. L'IPBC constituait la norme pour l'évaluation de l'apport sanguin dans le pied. Une valeur normale est généralement égale ou supérieure à 0,9 et inférieure à 1,45,6; en dessous de 0,9, il peut y avoir une maladie artérielle, et au-dessus de 1,4, les vaisseaux du pied sont calcifiés et la valeur est imprécise.
Idéalement, l’IPBC doit être obtenu après que le patient est resté allongé pendant 20 minutes. Un brassard de TA est placé sur la longueur de la jambe inférieure. Le clinicien localise un signal artériel audible sur le pied, et le brassard est gonflé jusqu'à ce que le son disparaisse. Le brassard est dégonflé et, lorsque le son réapparaît, la tension systolique est enregistrée. La même procédure est répétée sur l'artère brachiale.
Souvent, l'œdème et l'inflammation (notamment l'insuffisance cardiaque congestive, la lipodermatosclérose aiguë ou subaiguë ou la thrombophlébite), ainsi que l'infection, peuvent entraîner des douleurs. Une douleur aiguë peut rendre impossible l'occlusion de l'artère de la jambe inférieure. En outre, jusqu'à 80 % des personnes diabétiques ou 20 % des personnes âgées ont des vaisseaux calcifiés, ce qui donne un IPBC artificiellement élevé et rend le test inexact. Un test alternatif est l'évaluation de l'AHHD. Ce test peut être réalisé avec le patient assis ou allongé, et il n'est pas nécessaire de placer le brassard de TA autour de la longueur de jambe. Une quantité adéquate de gel est placée sur le dos du pied et la forme d'onde audible est déclenchée (tableau 2). Un signal sonore monophasique ou absent indique la nécessité d'une évaluation vasculaire complète. La présence d'une onde audible multiphasique (biphasique/triphasique) indique qu'il n'y a pas de maladie vasculaire périphérique significative dans le membre inférieur et qu'un traitement par compression peut être instauré. Il faut vérifier la température normale du pied et l'absence de rubor dépendant (couleur rouge sombre) qui blanchit avec l'élévation. Cet examen physique permet d'exclure un défaut angiosomal (occlusion locale ou segmentaire d'une artère). Le pouls dorsal pédieux ou tibial postérieur doit également être palpable.
Une étude de 2015 a documenté les résultats de lecture AHHD effectuées sur 379 jambes chez 200 patients, qui ont été comparées à des lectures Doppler séquentielles de la partie inférieure de la jambe dans un laboratoire vasculaire certifié7. Le test est spécifique pour exclure une maladie artérielle (tibial postérieur, 98,6 % ; dorsal pédieux, 97,8 %) mais n'est pas sensible pour un diagnostic de maladie artérielle (tibial postérieur, 37,5 % ; dorsal pédieux, 30,2 %). Ce test est un test d'exclusion fiable, simple, rapide et peu coûteux de la maladie vasculaire périphérique chez les patients diabétiques ou non. Les résultats sont indépendants de la calcification vasculaire.
Là encore, un résultat Doppler monophasique ou l'absence de pouls doit déclencher des études Doppler duplex segmentaires de la jambe inférieure pour vérifier l'apport sanguin artériel. Dans certains cas, des études veineuses peuvent être justifiées, notamment s'il existe une possibilité d'intervention chirurgicale ou autre intervention veineuse. Ce test peut éviter les retards dans l'application de la thérapie de compression lorsque les études traditionnelles IPBC ne sont pas possibles (manque d'accès à un Doppler, douleur, vaisseaux non compressibles ou contraintes de temps).
Pour les ulcères situés ailleurs sur le corps, une perfusion adéquate est nécessaire ; vérifier la température de la peau environnante. Examiner la peau régionale à la recherche d'un rubor dépendant du bras ou de la jambe en position distale. Sur le corps central, vérifier l'absence d'œdème ou de nécrose ainsi que le temps de circulation (une zone blanche provenant d'un doigt enfoncé sur la peau doit revenir en 3 secondes ou moins ; dans le cas contraire, il peut y avoir compromission). Une circulation compromise peut indiquer une plaie d'entretien ou non cicatrisable jusqu'à ce que le défaut sous-jacent soit corrigé.
Sous-énoncé 1B - Identifier la ou les causes aussi précisément que possible ou orienter les patients vers les services appropriés
Souvent, la cause d'une plaie qui ne cicatrise pas est un "diagnostic inadéquat "4. Les praticiens doivent identifier la cause de la plaie aussi précisément que possible, en prenant en compte les ulcères de jambe vasculaires (veineux, mixtes, artériels, lymphatiques ou combinés), les ulcères du pied diabétique (neuropathiques, ischémiques ou mixtes) et les lésions de pression (qui doivent être distinguées des lésions cutanées associées à l'humidité) ; chacun d'entre eux requière des considérations de prise en charge spécifiques (tableau 3). Les autres diagnostics comprennent les ulcères inflammatoires (pyoderma gangrenosum, vasculite), les ulcères malins (peau primaire, autres tumeurs malignes secondaires), les traumatismes/chirurgies antérieures, les médicaments et les maladies coexistantes congénitales ou acquises. Certaines affections coexistantes mettent la peau en danger. En vieillissant, la peau s'amincit. Les lésions photosensibles et les maladies dermatologiques héréditaires (p. ex. épidermolyse bulleuse, syndrome d'Ehlers-Danlos) ou acquises (p. ex. pemphigoïde bulleuse, nécrolyse épidermique toxique) augmentent la susceptibilité aux traumatismes, y compris les déchirures cutanées. En outre, les zones de lésions cutanées associées à l'humidité peuvent être plus sensibles aux lésions de pression ou aux infections.
Tableau 3. Traitement de la cause de la plaie par type (©WoundPedia 2021)
Sous-énoncé 1C - Examiner les cofacteurs/comorbidités (maladie systémique, chirurgie antérieure, nutrition, médicaments, peau fragile) qui peuvent retarder ou inhiber la cicatrisation.
La prise en compte des cofacteurs modifiables est importante pour toutes les personnes atteintes de plaies chroniques (figure 2). Une orientation appropriée vers une prise en charge optimale peut souvent faciliter la cicatrisation des plaies.
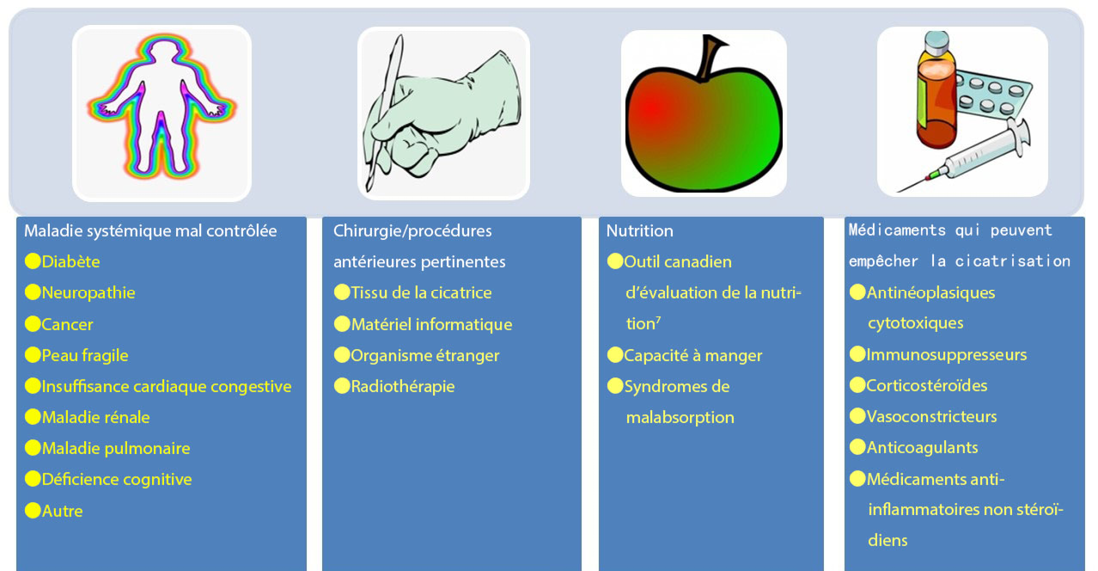
Figure 2. Cofacteurs et comorbidités à examiner pour la cicatrisation des plaies (©WoundPedia 2021)
L'évaluation de la nutrition peut être facilitée par l'outil canadien de dépistage nutritionnel validé en deux questions8 :
- Avez-vous perdu du poids au cours des 6 derniers mois sans avoir essayé de perdre ce poids ? (Si le patient déclare avoir perdu du poids mais l'a repris, considérer qu'il n'y a pas eu de perte de poids).
- Est-ce que vous mangez moins que d'habitude depuis plus d'une semaine ?
Cet outil présente de nombreux avantages : il ne nécessite pas de tests sanguins ni de procédures de diagnostic, il est simple et rapide à utiliser et il est fiable9. Tout professionnel de la santé peut rapidement identifier une éventuelle carence nutritionnelle et la nécessité de consulter un diététicien.
Énoncé 2 - préoccupations centrées sur le patient
Sous-énoncé 2A – Prendre en charge la douleur (diagnostic et traitement)
La douleur est souvent la première préoccupation des patients, alors qu'elle est rarement la première préoccupation des prestataires de soins. La douleur doit également être quantifiée. L'échelle d'évaluation numérique (0-10) est généralement utilisée (tableau 4). Les niveaux de douleur déclarés de 5 ou plus nécessitent une intervention.
Tableau 4. Prise en charge de la douleur liée aux plaies (©WoundPedia 2021)
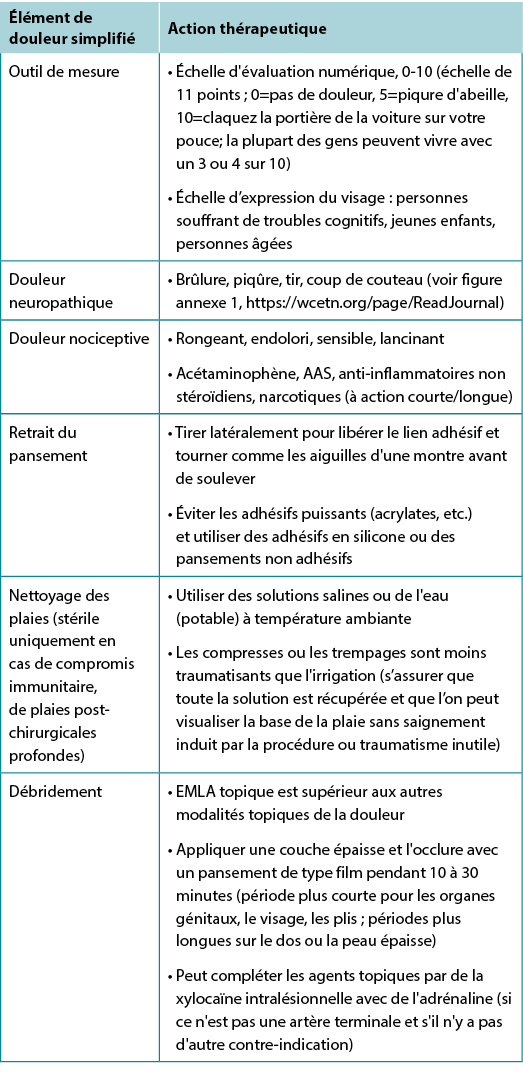
Il existe deux grands types de douleur : nociceptive et neuropathique (figure annexe 1, https://wcetn.org/page/ReadJournal). La douleur nociceptive est liée à une blessure, dépend du stimulus et est généralement associée à des sensations d’endolorissement, de rongement, de sensibilité ou d'élancement. La douleur neuropathique est souvent spontanée et décrite comme une sensation de brûlure, de tir, de piqûre ou de coup de poignard. Chaque type a une base physiologique différente, nécessitant un traitement pharmacologique différent.
Une récente étude systématique sur les analgésiques topiques associés à la douleur dans les ulcères de jambe chroniques a démontré qu'une crème topique (mélange eutectique d'anesthésiques locaux) était supérieure aux autres formulations pour les personnes vivant avec des ulcères de jambe chroniques10. Il existe d'autres modalités topiques qui peuvent être associées au soulagement de la douleur et aux stratégies, notamment l'utilisation d'adhésifs en silicone pour remplacer d'autres adhésifs acryliques, plus traumatisants, lors du retrait du pansement.
Un contrôle inadéquat de la douleur peut survenir au cours de nombreuses étapes du soin local des plaies11. Pour les changements de pansement douloureux, un médicament oral doit être administré à un moment approprié avant le changement. Entre les changements de pansement, la douleur est souvent liée à la cause de la plaie ou à ses complications ; envisager des mesures non pharmacologiques (musicothérapie, méditation, acupuncture, stimulation électrique transcutanée des nerfs, homéopathie, naturopathie et apaisement spirituel).
En résumé, les droits d'un patient en matière de douleur impliquent les six « C » - chaque patient mérite : un examen (Check), une Cause déterminée, des Conséquences du traitement expliquées (avec les effets indésirables), un Contrôle adéquat, la possibilité de demander (Call) des temps d'arrêt pendant les procédures et le Confort. Enfin, les prestataires doivent se rappeler que la prise en charge de la douleur non documentée équivaut à l'absence de prise en charge de la douleur.
Sous-énoncé 2B - Évaluer les activités de la vie quotidienne, la mobilité/l'exercice, les habitudes alimentaires, le bien-être psychologique (santé mentale) et le système de soutien (cercle de soins du patient, accès aux soins et contraintes financières)
Les préoccupations centrées sur le patient concernent souvent l'insuffisance des structures de soutien. Ils peuvent également impliquer un manque d'institutions du système de santé empêchant l'accès à des soins appropriés. La santé mentale personnelle peut altérer la capacité du patient à faire face à la prise en charge d'une plaie chronique, et il peut avoir besoin d'aide. Il y a un besoin de travailleurs sociaux, de coordinateurs de sortie et de psychologues cliniques pour relayer le système de santé dans la société.
Sous-énoncé 2C - Évaluer les habitudes (tabagisme, alcool, usage de substances, hygiène personnelle)
Chaque cigarette diminue l'oxygénation locale de 30 % pendant une heure12. Les cigarettes et autres produits du tabac peuvent être un facteur majeur empêchant la cicatrisation des plaies chroniques ou agir comme un stimulus pro-inflammatoire pour les personnes atteintes d'hidradénite suppurée. La consommation d'opiacés seuls (en particulier >10mg/j) a été associée à une augmentation de la taille de la plaie et à une réduction de la probabilité de cicatrisation dans une étude de 2017 portant sur 450 patients13.
Sous-énoncé 2D – Renforcer l’autonomie des patients par l’information et le soutien afin d'accroître l'adhésion au traitement (cohérence).
Aujoulat et al.14 ont examiné l'autonomisation des patients en relation avec l'information sur les maladies chroniques. Ils ont déterminé que : "les objectifs et les résultats... ne devraient pas être prédéfinis par les professions de santé, ni limités à certains résultats liés à la maladie et au traitement, mais devraient être discutés et négociés avec chaque patient en fonction de sa situation particulière et de ses priorités de vie "14.
Moore et al.15 ont défini quatre étapes pour accroître l’implication des patients dans leurs propres soins :
1. Chercher à connaître le point de vue du patient et sa compréhension de son état.
2. Identifier les craintes/préoccupations.
3. Déterminer ce qui est important pour le patient.
4. Évaluer la volonté de s'impliquer dans leurs soins.
Énoncé 3 - Déterminer possibilité de cicatrisation
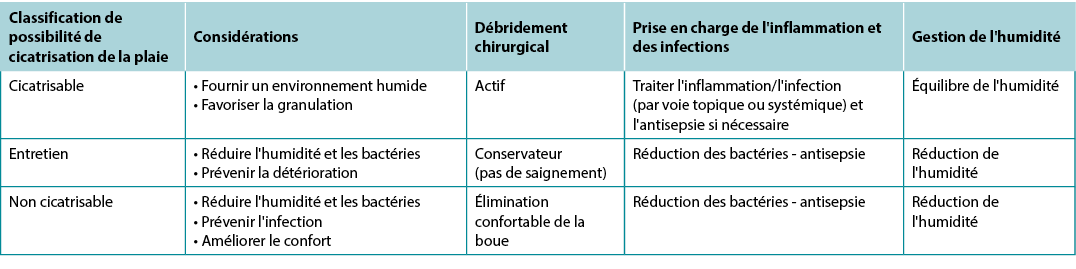
L'une des premières mesures que les prestataires doivent prendre après le diagnostic est de déterminer la possibilité de cicatrisation, sachant que l'état de la plaie peut changer. En général, les plaies chroniques entrent dans l'une des trois catégories suivantes : cicatrisables, d'entretien et non cicatrisables. Les stratégies locales de soins des plaies varient selon la classification (tableau 5).
Tableau 5. Synthèse des stratégies locales de traitement des plaies ; d’après Sibbald et al.16 (©WoundPedia 2021)
Sous-énoncé 3A - Cicatrisable : apport sanguin adéquat pour cicatriser et traiter la cause
Une plaie cicatrisable a un apport sanguin suffisant pour cicatriser et la cause a été corrigée. En règle générale, environ deux tiers des plaies dans la société sont guérissables.
Sous-énoncé 3B - Maintien : apport sanguin adéquat pour cicatriser lorsque le patient ne peut ou ne veut pas adhérer au protocole de soins/système de santé ou ne dispose pas des ressources appropriées
Un quart des plaies sont des plaies d'entretien, soit en raison de problèmes liés au patient (par exemple, le refus de porter des bandages de compression) et/ou de facteurs liés au système de santé qui empêchent la cicatrisation (par exemple, le patient ne peut pas se permettre d'acheter des dispositifs de redistribution de la pression plantaire et le système ne fournit pas les chaussures).
Sous-énoncé 3C - Non cicatrisable : apport sanguin inadéquat et/ou une cause qui ne peut être corrigée (par exemple, cancer en phase terminale, équilibre protéique négatif)
Environ 5 à 10 % des plaies ne sont pas cicatrisables, souvent en raison d'un apport sanguin inadéquat qui ne peut être traité ou corrigé, d'une maladie chronique avancée ou du processus de décès. Pour les patients présentant des plaies non cicatrisables, les points de soins primordiaux à traiter sont la douleur, les complications infectieuses, le contrôle des exsudats et des odeurs ainsi que les activités de la vie quotidienne.
Treize LOC de la Société de traitement des plaies d'Afrique du Sud ont mené une récente revue systématique intégrative des plaies non cicatrisables et des plaies d'entretien17. Ce panel de 13 membres a sélectionné 13 analyses critiques, six directives de bonnes pratiques, trois études de consensus et six études non expérimentales originales. Les trois principales conclusions étaient la nécessité de soins centrés sur le patient, d'une intervention en temps utile par des prestataires de soins qualifiés et d'une filière d'orientation interprofessionnelle17.
Énoncé 4 - Soins locaux des plaies : surveiller l'historique de la plaie et l'examen clinique
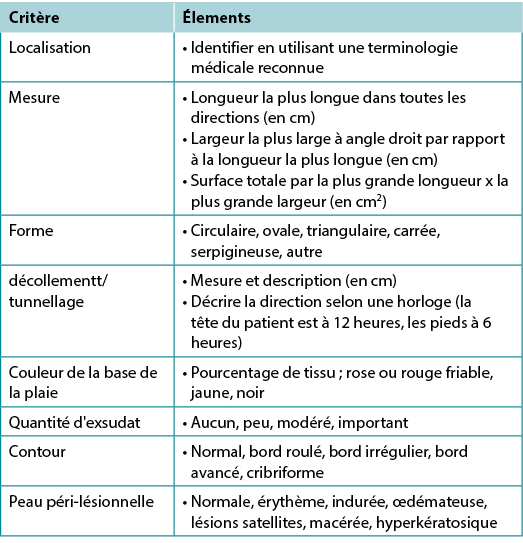
Sous-énoncé 4A - Documenter la ou les plaies : emplacement, longueur la plus longue x largeur la plus grande à angle droit, forme de la plaie, lit de la plaie, exsudat, bord, décollement, le creusement de tunnels, état de la peau péri-lésionnelle et photoimagerie si disponible
La documentation de la plaie est importante (tableau 6). Documenter l'emplacement et la taille de la plaie ; ces auteurs recommandent d'utiliser la longueur la plus longue et la largeur la plus large perpendiculaires l'une à l'autre, bien que l'alignement de la tête aux pieds soit également courant. Choisir la méthode de mesure qui s'aligne sur la politique institutionnelle ; la cohérence est la plus importante. Noter et surveiller le décollement, le creusement de tunnels, le type de tissu dans le lit de la plaie, les bords de la plaie et les caractéristiques de la peau péri-lésionnelle.
Tableau 6. Documentation sur les plaies (©WoundPedia 2021)
Sous-énoncé 4B - Nettoyage : en douceur avec de l'eau, du sérum physiologique ou des agents antiseptiques à faible toxicité
Pour les plaies cicatrisables, le soin local de la plaie peut inclure un débridement chirurgical net, le traitement de l'infection (infections locales, infection profonde et péri-lésionnelles) et la gestion de l'humidité. Pour les plaies non cicatrisables, les soins optimaux peuvent viser le débridement conservateur de la boue, la réduction des bactéries et la réduction de l'humidité. Dans ces cas, il peut être préférable d'utiliser des agents antiseptiques qui peuvent avoir une certaine toxicité tissulaire plutôt que de laisser la prolifération bactérienne provoquer des lésions tissulaires supplémentaires conduisant à une infection.
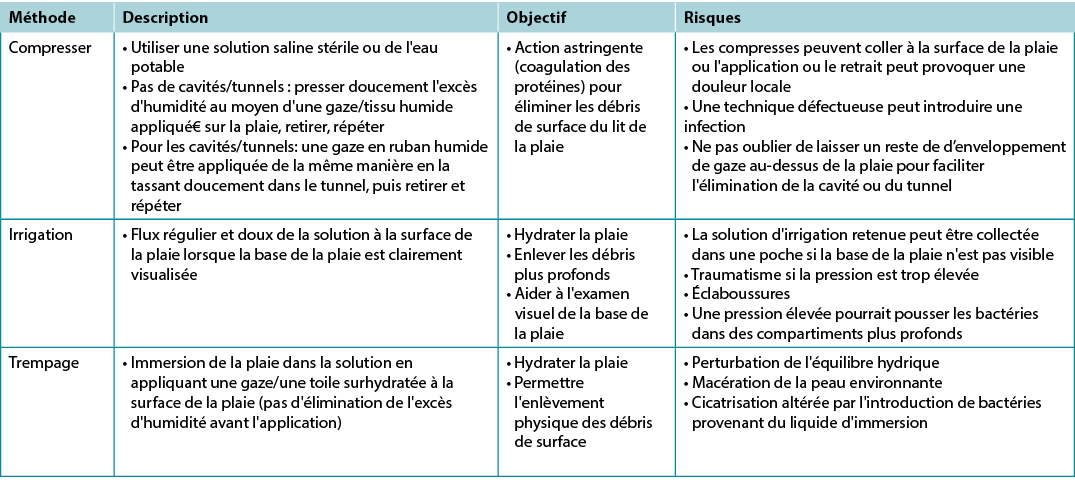
Il y a extraordinairement peu de données de haute qualité sur le sujet du nettoyage des plaies (Tableau 7) ; par conséquent, il est difficile de tirer des conclusions et le sujet du nettoyage des plaies nécessite des recherches supplémentaires19. Lors de l'irrigation, noter la quantité de solution utilisée à l'entrée et à la sortie du lit de la plaie. Il convient d'être prudent lorsque l'ensemble du lit de la plaie n'est pas clairement visualisé ou intact. Veiller à ne pas endommager le lit de la plaie par un traumatisme excessif.
Tableau 7. Méthodes de nettoyage des plaies ; d’après Nicks et al.18 (©WoundPedia 2021)
Sous-énoncé 4C - Réévaluer et documenter les plaies à intervalles réguliers et appropriés.
Énoncé 5 - Lorsque cela est approprié, débrider les plaies avec un contrôle adéquat de la douleur.
Le débridement permet d'éliminer la boue, les débris ou les substances étrangères qui peuvent faciliter l'infection ou agir comme un stimulus pro-inflammatoire, prolongeant la phase inflammatoire de la cicatrisation et retardant le processus de réparation prolifératif. Un débridement chirurgical net nécessite une évaluation de l’apport sanguin pour s'assurer qu'il est adéquat pour la cicatrisation. Avant de commencer, les prestataires qui envisagent des méthodes de débridement, même conservatrices, doivent s'assurer qu'ils disposent des compétences appropriées, du champ d'application, de l'équipement nécessaire et d'un soutien en cas d'hémorragie, ainsi que de la conformité aux politiques et procédures de leur établissement.
Bien qu'il ait fait l'objet d'un consensus, les niveaux d'accord relativement plus faibles entre les LOC pour cet énoncé pouvaient probablement être attribués aux limitations liées aux établissements en ce qui concerne le débridement tranchant. Cette procédure nécessite une expérience clinique, un champ d'application approprié et la disponibilité d'un équipement permettant de réaliser la procédure et d'arrêter l'hémorragie si nécessaire.
Sous-énoncé 5A - Envisager un débridement chirurgical tranchant (jusqu'au tissu qui saigne) pour les plaies cicatrisables et un débridement chirurgical conservateur pour les plaies d'entretien/non cicatrisables.
Pour les plaies cicatrisables, cela signifie un débridement chirurgical tranchant, un débridement autolytique avec des pansements ou un débridement enzymatique, biologique (asticots médicaux) ou mécanique. Pour les plaies non cicatrisables et les plaies d'entretien, il s'agit de méthodes chirurgicales conservatrices ou d'autres méthodes d'élimination de la boue non viable.
La responsabilisation du patient peut s'inspirer du guide de débridement en 4 étapes pour la prise de décision clinique20 pour un accord mutuel entre patients et cliniciens. Tout d'abord, se demander si la plaie est apte à cicatriser. Si la réponse est oui, choisir la méthode appropriée en fonction des préoccupations du patient et des caractéristiques de la plaie. Ensuite, étudier les caractéristiques de la plaie qui influencent le choix du débridement, comme l'infection secondaire, la douleur, la taille de la plaie et l'exsudat. Déterminer dans quelle mesure une méthode de débridement sélective est nécessaire; déterminer s'il y a un risque pour les tissus sains lorsque les tissus nécrosés sont débridés. Enfin, considérer le cadre de soins. Certains cliniciens et/ou types de ressources peuvent ne pas être disponibles dans tous les établissements de soins. La réglementation gouvernementale et la politique de l'établissement peuvent également constituer des facteurs20.
Sous-énoncé 5B - Évaluer la nécessité de recourir à d'autres modalités de débridement (autolytique avec pansements, enzymatique, mécanique ou biologique)
Le débridement autolytique peut être réalisé à l'aide de pansements d'alginate de calcium, d'hydrogel et d'hydrocolloïde. Ce type de débridement est souvent relativement indolore, mais il peut être plus lent que les méthodes chirurgicales. Le débridement enzymatique (collagénase) est souvent utilisé lorsque le débridement chirurgical ou les pansements autolytiques ne sont pas disponibles. C'est une méthode relativement lente, et le traitement nécessite une prescription.
Le débridement mécanique peut être réalisé à l'aide de technologies avancées telles que les ultrasons qui nécessitent des conditions propres ou stériles avec une protection contre la contamination bactérienne et les pathogènes bactériens ou les particules en suspension dans l'air. Les systèmes d'hydromassage peuvent contaminer les zones de peau émergée et provoquer une contamination croisée entre les patients. La gaze saline humide à sèche demande beaucoup de temps de soins infirmiers, est douloureuse lors du retrait du pansement et peut éliminer des tissus sains viables de la surface de la plaie.
Moya-López et al.21 ont récemment publié une revue de la thérapie de débridement par les asticots pour les plaies chroniques. La thérapie par les asticots peut être plus rapide que certaines autres méthodes de débridement non chirurgicales, et elle est sélective pour les tissus dévitalisés. Les auteurs ont conclu que davantage de données étaient nécessaires par type de plaie, fréquence d'application et efficacité du traitement. Les asticots ne sont pas indiqués pour les plaies ischémiques et lorsque l'infection profonde et environnante n'a pas été traitée par voie systémique.
Énoncé 6 - Évaluer et traiter les plaies pour détecter les infections/inflammations
Les infections des plaies ont deux compartiments - l'un superficiel et l'autre profond10,12. Les plaies peuvent être considérées comme un bol de soupe ; la fine couche à la surface d'une plaie est analogue au compartiment superficiel, et les côtés et le fond du bol de soupe sont équivalents aux composants environnants et profonds d'une plaie chronique.
Sous-énoncé 6A - Traiter l'infection locale (trois critères NERDS au moins) avec des antimicrobiens topiques (argent, iode, polyhexaméthylènebiguanide [PHMB]/chlorhexidine, bleu de méthylène/violet de cristal, surfactants)
Le compartiment superficiel d'une plaie chronique est une fine couche de cellules qui peut être traitée par voie topique. Trois critères NERDS au moins (Non-cicatrisation, augmentation de l'Exsudat, granulation Rouge friable, Débris ou cellules mortes et odeur (Smell)) sont le signe d'une infection locale, pour lesquels des antimicrobiens topiques peuvent être indiqués. Si la plaie est cicatrisable et la cause traitée, l'amélioration devrait prendre 4 semaines ou moins. Les cliniciens doivent savoir que le traitement du compartiment superficiel de la plaie nécessite que les pansements libèrent des agents antimicrobiens à la surface de la plaie. Les pansements non libérateurs fonctionnent au-dessus de la surface de la plaie mais ne peuvent pas pénétrer dans le compartiment superficiel. Cela peut empêcher la croissance bactérienne au-dessus de la plaie, mais un autre agent peut être nécessaire pour cibler le compartiment superficiel de la plaie. Par exemple, les sprays antiseptiques tels que les bains de bouche à la chlorhexidine contiennent souvent moins d'alcool que certains antiseptiques préchirurgicaux conçus pour la peau intacte, ce qui réduit les sensations de brûlure et de picotement. Certains agents topiques libèrent de l'argent ou de l'iode à différentes concentrations pour pénétrer dans le compartiment superficiel et traiter l'infection locale.
Sous-énoncé 6B - Envisager de traiter l'infection profonde et environnante (trois critères STONEES ou plus) avec des antimicrobiens systémiques
Les agents antimicrobiens topiques ne pénètrent que de quelques millimètres ; les infections profondes et environnantes peuvent nécessiter des antimicrobiens systémiques (tableau annexe 5, https://wcetn.org/page/ReadJournal). Quatre des sept critères STONEES représentent les caractéristiques des contours de la plaie (les parois du bol de soupe) - Surface accrue, Température augmentée de 3°F par rapport à une image miroir de la peau péri-lésionnelle, Nouvelles zones ou zones satellites d'implication et cellulite environnante (Erythème ou œdème). La cellulite n'est pas toujours présente lorsque les plaies chroniques sont associées à une infection profonde et périphérique, et l'érythème n'est pas facilement reconnaissable à la couleur de la peau ou à la présence d'un œdème. Les trois autres signes de STONEES dans le lit de la plaie sont le palpage de l’Os, l'augmentation de l'Exsudat et l'odeur (Smell).
Sous-énoncé 6C - Évaluer et soulager l'inflammation persistante, notamment en envisageant des agents anti-inflammatoires (pansements topiques, médicaments systémiques)
Des facteurs autres que les organismes infectieux peuvent jouer un rôle dans une réponse inflammatoire persistante. Ces facteurs comprennent les cellules envahissantes (neutrophiles, macrophages, lymphocytes), les complexes immuns (vascularite), l'inflammation granulomateuse (sarcoïdose, etc.) et autres ; tenir compte de ces facteurs lors du choix d’un traitement topique ou systémique. Il existe certains antimicrobiens topiques qui sont pro-inflammatoires, comme l'iode. Il existe d'autres agents qui peuvent être anti-inflammatoires, notamment l'argent, et certains qui sont neutres, comme la gaze/mousse de PHMB et la mousse de violet de gentiane/bleu de méthylène.
L'inflammation peut également entraîner un retard de cicatrisation dans les deux compartiments. Les tests de protéase ne sont pas toujours disponibles en milieu clinique et peuvent ne mesurer que les changements superficiels plutôt que profonds. Certains des signes d'infection peuvent également faire partie de la présentation clinique d'une inflammation persistante. Le cube de Sibbald (figure annexe 2 (https://wcetn.org/page/ReadJournal)) décrit les endroits où des protéases élevées dans les plaies avec et sans infection peuvent empêcher la cicatrisation dans les compartiments superficiel et profond. Des données publiées récemment indiquent que les biomarqueurs peuvent prédire la trajectoire de cicatrisation des ulcères de jambe veineux22. La bonne thérapie au bon moment pourrait permettre de contrôler plus efficacement les protéases, la contamination bactérienne, le débridement et le contrôle de l'humidité grâce à un planning optimal des facteurs de croissance, des constructions matricielles et des composants cellulaires.
En ce qui concerne les thérapies topiques, les produits à base d'argent et de miel ont montré des effets anti-inflammatoires. Ces agents ne doivent être utilisés qu'en cas d'infection et d'inflammation locales, pendant de courtes périodes. Par voie systémique, plusieurs agents antibactériens ont une action anti-inflammatoire. Les antimicrobiens couramment recommandés (certains ayant des effets anti-inflammatoires) pour les plaies et les infections cutanées associées sont énumérés dans le tableau annexe 5 (https://wcetn.org/page/ReadJournal).
Énoncé 7 - Gestion de l'humidité
Les soignants doivent choisir un pansement approprié en fonction des caractéristiques de la plaie et des besoins individuels du patient (Figure 3). La gestion idéale de l'humidité dépend de la possibilité de cicatrisation d'une plaie.
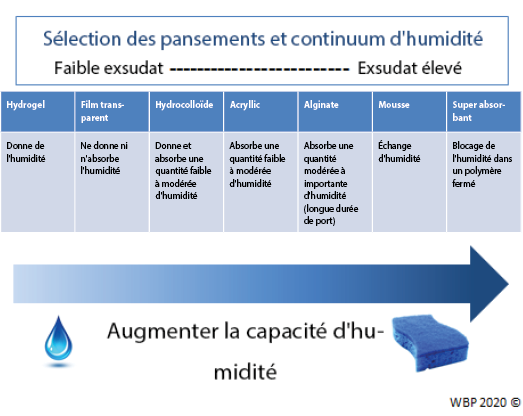
Figure 3. Optimisation de la gestion de l'humidité ; d’après Sibbald et al.16 (©WoundPedia 2021)
Sous-énoncé 7A - Débridement cicatrisant, équilibré en humidité et autolytique (alginates, hydrogels, hydrocolloïdes, acryliques, films)
Dans les plaies cicatrisables, l'équilibre de l'humidité peut être obtenu en choisissant le pansement approprié dans le continuum d'humidité de l'outil (tableau annexe 6, https://wcetn.org/page/ReadJournal) qui répertorie les pansements pour les plaies faiblement à fortement exsudatives.
Énoncé 7B - Équilibre hydrique seul (super absorbants, mousses, alginates de calcium, hydrofibres, hydrocolloïdes, films, hydrogels)
Sous-énoncé 7C - Plaies non cicatrisables et d'entretien et réduction de l'humidité ; si un antibactérien est nécessaire, anesthésiques topiques de faible toxicité : chlorhexidine/PHMB, iode, acide acétique
Pour les personnes présentant des plaies d'entretien ou non cicatrisables, cibler l'humidité et la réduction des bactéries. Les plaies doivent être constamment réévaluées pour vérifier la cicatriation ou la détérioration et les choix de pansements doivent être modifiés en fonction de la présentation.
Pour ces plaies, les soignants doivent trouver un équilibre entre les préférences et le confort du patient afin d'éviter la douleur et d'empêcher le dessèchement des plaies. Les pansements en tulle sont souvent les plus appropriés ; ils sont constitués d'une combinaison de gaze ou de tissu avec un revêtement de pétrolatum ou de paraffine. Ils peuvent également contenir un antiseptique (par exemple, de la chlorhexidine, de l'iode).
Cependant, plusieurs pansements peuvent optimiser la gestion de l'humidité16. La chlorhexidine (0,5 % dans de la paraffine blanche imprégnée dans une feuille de tulle) est active contre les bactéries à Gram positif et négatif ; le PHMB est une formulation de mousse nonlibératrice, de gaze/enveloppement en ruban. Les pansements iodés (sous forme de molécule de cadexomer ou de povidone iodée) ont un large spectre d'activité, bien que leur efficacité diminue en présence de pus ou d'exsudat. Noter que ces pansements peuvent être toxiques en cas d'utilisation prolongée sur de grandes surfaces (comme la povidone iodée). Enfin, de l'acide acétique (0,5-1%, par exemple du vinaigre blanc dilué) doit être placé à l'aide d'une gaze sur le lit de la plaie pendant environ 5-10 minutes, souvent sous forme de compresse rotative. Ces pansements ont un pH faible et sont efficaces contre les espèces de Pseudomonas ; cependant, ils peuvent sélectionner d'autres organismes16.
Sous-énoncé 7D - Conditionnement de la plaie : sérum physiologique humide (donne de l'humidité) ou sec (absorbe l'humidité) mais pas antibactérien; gaze PHMB : antibactérienne, non libérée au-dessus de la plaie (reste dans la gaze) mais pas à la surface de la
plaie ; gaze imbibée de povidone iodée ou d'un autre antiseptique : antibactérienne au-dessus et sur la surface de la plaie
Un enveloppement salin peut être utilisé pour les plaies cicatrisables sans colonisation critique. Le but de ces pansements n'est pas de coller au lit de la plaie, cela provoquerait un traumatisme lors du retrait du pansement. Si une gaze saline sèche colle au lit de la plaie, il faut humidifier la gaze avant de l'appliquer et, si elle colle, l'humidifier à nouveau avant de la retirer. Il faut alors choisir des pansements alternatifs pour maintenir une cicatrisation humide et interactive.
Énoncé 8 - Évaluer le taux de cicatrisation
Si une plaie n'est pas réduite d'au moins 20 à 40 % en semaine 4, il est peu probable qu'elle cicatrise en semaine 12 (figure 4).

Figure 4. Comment calculer la surface de la plaie
Sous-énoncé 8A - Les plaies stagnantes (cicatrisables) doivent être réévaluées pour trouver d'autres diagnostics ; envisager une biopsie de la plaie, des examens complémentaires et/ou l'orientation vers une équipe d'évaluation interprofessionnelle pour optimiser le traitement
La trajectoire de cicatrisation peut être évaluée au cours des 4 à 8 premières semaines afin d’estimer si une plaie est susceptible de cicatriser en semaine 12, à condition qu'il n'y ait pas de nouveaux facteurs de complication9. Les plaies stagnantes mais cicatrisables nécessitent souvent une évaluation interprofessionnelle complète afin d'optimiser le traitement et d'améliorer la trajectoire de cicatrisation. Cela peut nécessiter le reclassement d'une plaie dans la catégorie "entretien" ou "non cicatrisable".
Énoncé 9 - Effet de bord
Utiliser des thérapies actives pour les plaies bloquées mais cicatrisables. Voir le tableau annexe 7 (https://wcetn.org/page/ReadJournal) pour les données probantes sur les thérapies d'appoint - thérapie par pression négative, stimulation électrique, produits cellulaires et/ou tissulaires, greffes de peau, ultrasons et oxygénothérapie hyperbare (tableau 8).
Tableau 8. Traitements adjuvants
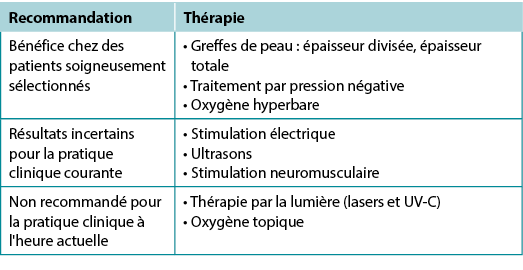
Sous-énoncé 9A - Certaines modalités actives présentent des données faibles ou mitigées et ne doivent être utilisées qu'après une évaluation interprofessionnelle du patient et des réévaluations régulières
Sous-énoncé 9B - Les greffes de peau présentent des données variables mais positives, et les produits cellulaires et/ou à base de tissus peuvent ou non être économiques à l'heure actuelle
De nombreuses thérapies actives sont apparues et ont disparu dans la boîte à outils de la cicatrisation des plaies. Non seulement ces thérapies doivent stimuler la cicatrisation, mais elles doivent également être rentables économiquement dans le contexte du système de santé local. Certaines de ces thérapies ont de meilleures données probantes pour les plaies aiguës que pour les plaies chroniques non cicatrisables (par exemple, la thérapie par pression négative après une chirurgie du pied diabétique, les greffes de peau d'épaisseur variable), en particulier lorsque la cause n'est pas ou ne peut pas être corrigée. Si un traitement actif est choisi, il est impératif de procéder à une évaluation cohérente et précise de la plaie afin de pouvoir déterminer la progression de la plaie dans un sens ou dans l'autre et d'interrompre le traitement en temps utile si la plaie n'est pas sur une trajectoire de cicatrisation. D'autres essais contrôlés randomisés de haute qualité sur ces thérapies sont nécessaires avant que des recommandations définitives sur leur utilisation puissent être faites.
Énoncé 10 - Soutien organisationnel
Sous-énoncé 10A - Le soutien organisationnel peut inclure une culture propice à la formation interprofessionnelle et aux soins centrés sur le patient, des protocoles standardisés fondés sur des données probantes, une dotation en personnel adéquate et des programmes établis d'amélioration de la qualité pouvant inclure des audits, des études de prévalence et d'incidence ainsi que la navigation des patients
Les éléments d'un plan organisationnel efficace pour la mise en œuvre des directives sont les suivants23 :
- Évaluer l'état de préparation organisationnelle et les obstacles à la mise en œuvre, en tenant compte des circonstances locales.
- Impliquer tous les membres (qu'ils occupent une fonction de soutien direct ou indirect) dans le processus de mise en œuvre.
- Fournir des opportunités de formation continue pour renforcer les meilleures pratiques.
- Une ou plusieurs personnes qualifiées doivent fournir le soutien nécessaire au processus de formation et de mise en œuvre.
- Fournir des occasions de réflexion sur l'expérience personnelle et organisationnelle dans la mise en œuvre des directives.
Souvent, les obstacles à une cicatrisation réussie sont liés au système de santé et non à un manque de connaissances des soignants. Une meilleure coordination des soins est nécessaire dans tout le continuum, des soins aigus aux soins chroniques, ainsi que la standardisation des formulaires et des meilleures pratiques. Cela pourrait se faire par le biais de l'apprentissage situationnel, de la modification des systèmes de soins afin de faciliter l'évaluation interprofessionnelle des problèmes complexes des patients, et de la suppression des barrières au sein des organisations de soins de santé et entre elles. Cela nécessite que les organisations investissent dans des ressources pour la formation interprofessionnelle sur les pratiques de soins des plaies, ainsi que la collecte et l'examen régulier des résultats des données sur les soins des plaies sous la forme d'une initiative de qualité continue.
Les patients souffrant de plaies chroniques ont souvent des ressources limitées et sont issus de milieux socio-économiques défavorisés. L'utilisation de modèles de navigation des patients pour faciliter l’orientation et mettre en relation les prestataires de soins à domicile avec les coordonnateurs de soins pour accéder aux ressources du système est une façon de progresser24,25. Toutefois, cette démarche ne peut réussir que si les membres de l'équipe sont reliés entre eux dans le cadre d'un modèle interprofessionnel coordonné. Ces changements du système de santé peuvent augmenter la valeur économique.
Le modèle Porter de soins de santé associe la voix du patient à celle du soignant, du payeur, du décideur et même du politique afin de valoriser le coût des soins de santé26. Pour que les systèmes changent, les décideurs et les politiques doivent être conscients des incohérences et des inégalités auxquelles sont confrontés les patients et les prestataires de soins en matière de traitement des plaies : c’est la première étape vers l'amélioration des soins des plaies centrés sur le patient.
Conclusions
Ces 10 énoncés fondés sur des données probantes ont fait l'objet d'un consensus de la part des LOC dans des enquêtes répétées. La fourniture d'outils est destinée à faciliter la diffusion du paradigme PLP dans la pratique. Un effort concerté a été fait pour souligner l'importance d'une évaluation précoce et proactive de la trajectoire de cicatrisation. Intervenir avant que les plaies ne deviennent chroniques produit des bénéfices pour le patient, les prestataires, les payeurs et les décideurs. Cela est plus important que jamais face à l'augmentation des coûts des soins de santé et au vieillissement de la population.
Conflit d'intérêt
Le Dr LeBlanc a déclaré qu'elle est conférencière pour Hollister, Coloplast, 3M et Mölnlycke. Le Dr Ayello a déclaré avoir reçu des subventions à la formation/ recherche de Sage/Stryker et Calmoseptine. Le Dr Sibbald a reçu des subventions de Mölnlycke, Calmoseptine et du gouvernement de l'Ontario pour le projet ECHO Skin and Wound.
Financement
Les auteurs n'ont reçu aucun financement pour cette étude.
Données supplémentaires

Figure annexe 1

Figure annexe 2
Tableau annexe 1. Préparation du lit de la plaie 2021 enquête d’experts

Tableau annexe 2. Résultats de l’enquête 2021 auprès des leaders d’opinion clés sur la préparation du lit de la plaie (n = 21)
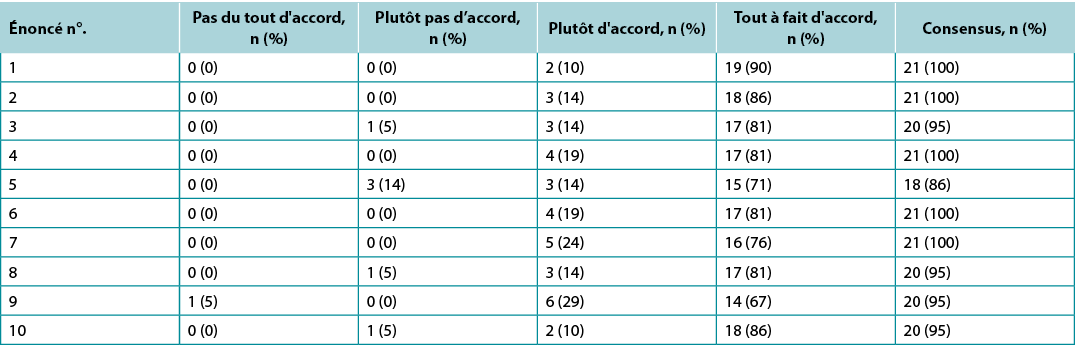
Tableau annexe 3. Résultats de l’enquête Préparation du lit de la plaie 2021 auprès du Cours international interprofessionnel de traitements des plaies d’Abu Dhabi n = 66)
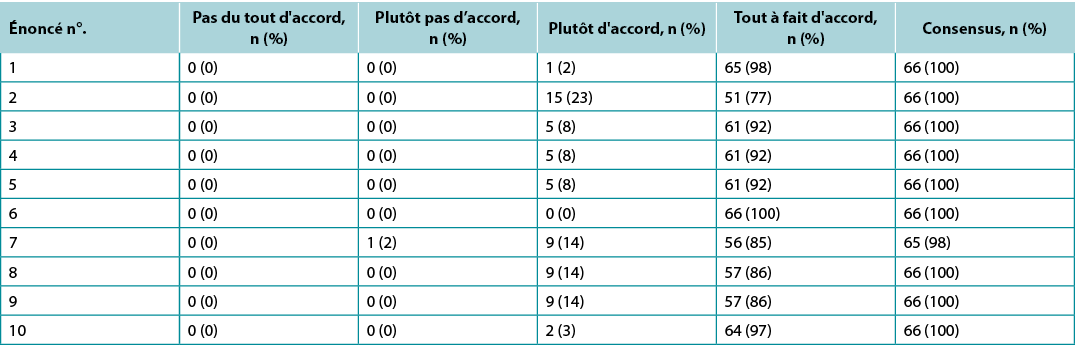
Tableau annexe 4. Résultats de l’enquête Préparation du lit de la plaie 2021 auprès du Cours international interprofessionnel de traitements des plaies du Canada (n = 65)
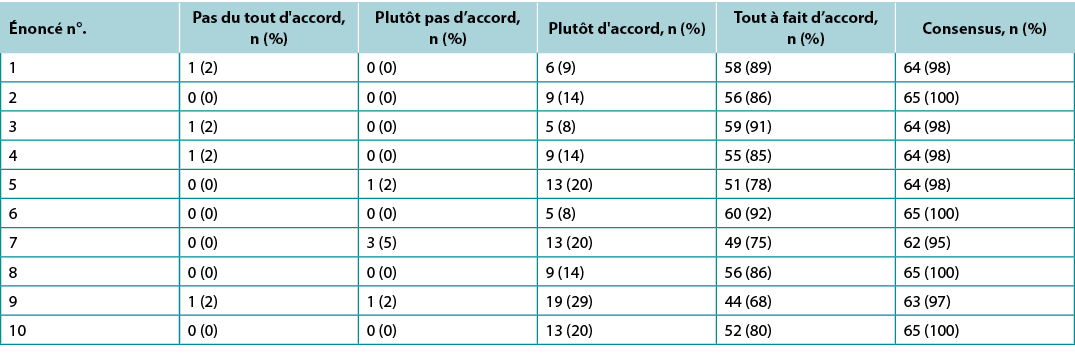
Tableau annexe 5. Thérapie antimicrobienne systémique pour l’infection profonde et environnante
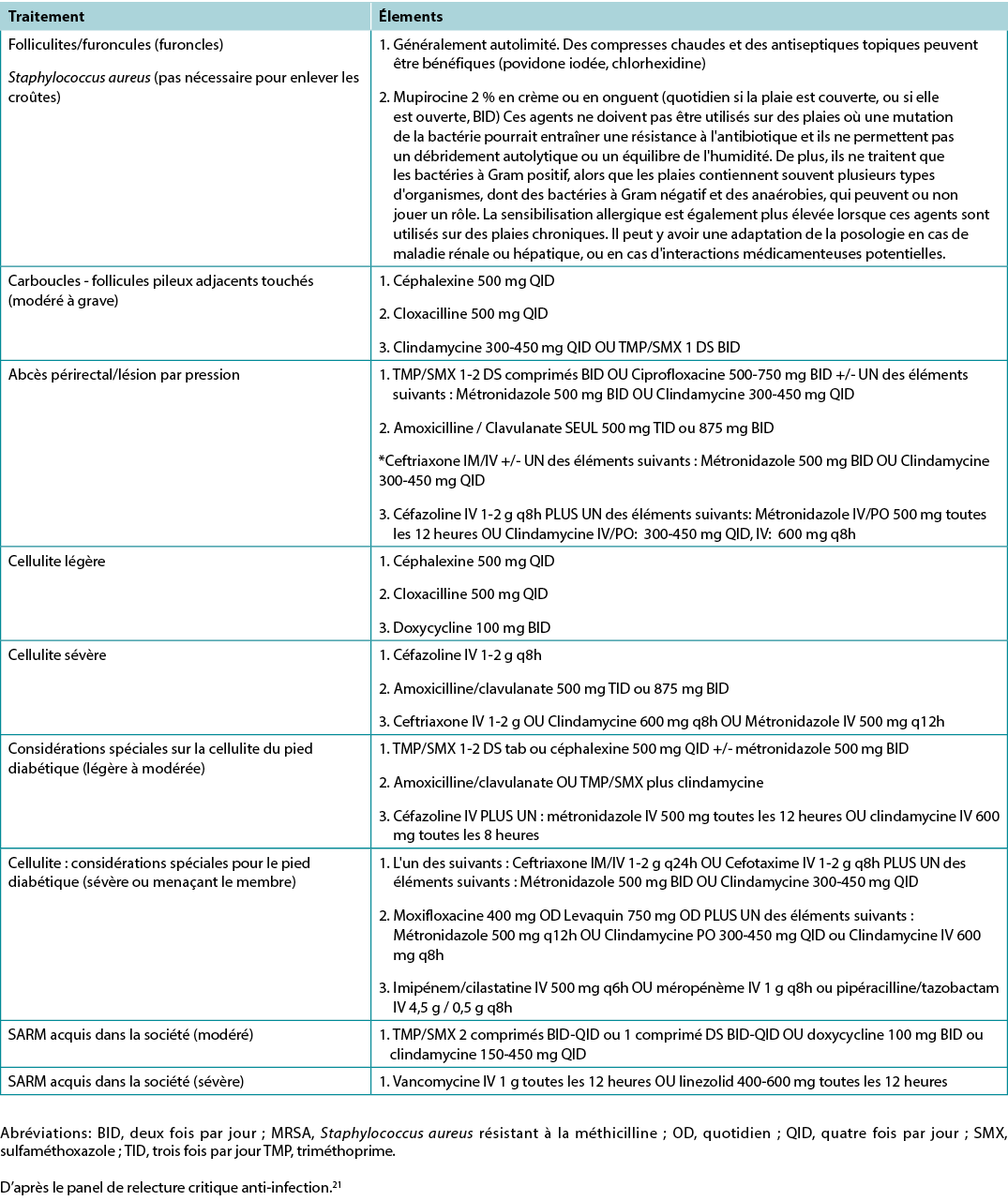
Tableau annexe 6. Résumé des catégories de pansements modernes permettant d’équilibrer l’humidité en augmentant le pouvoir d’absorption
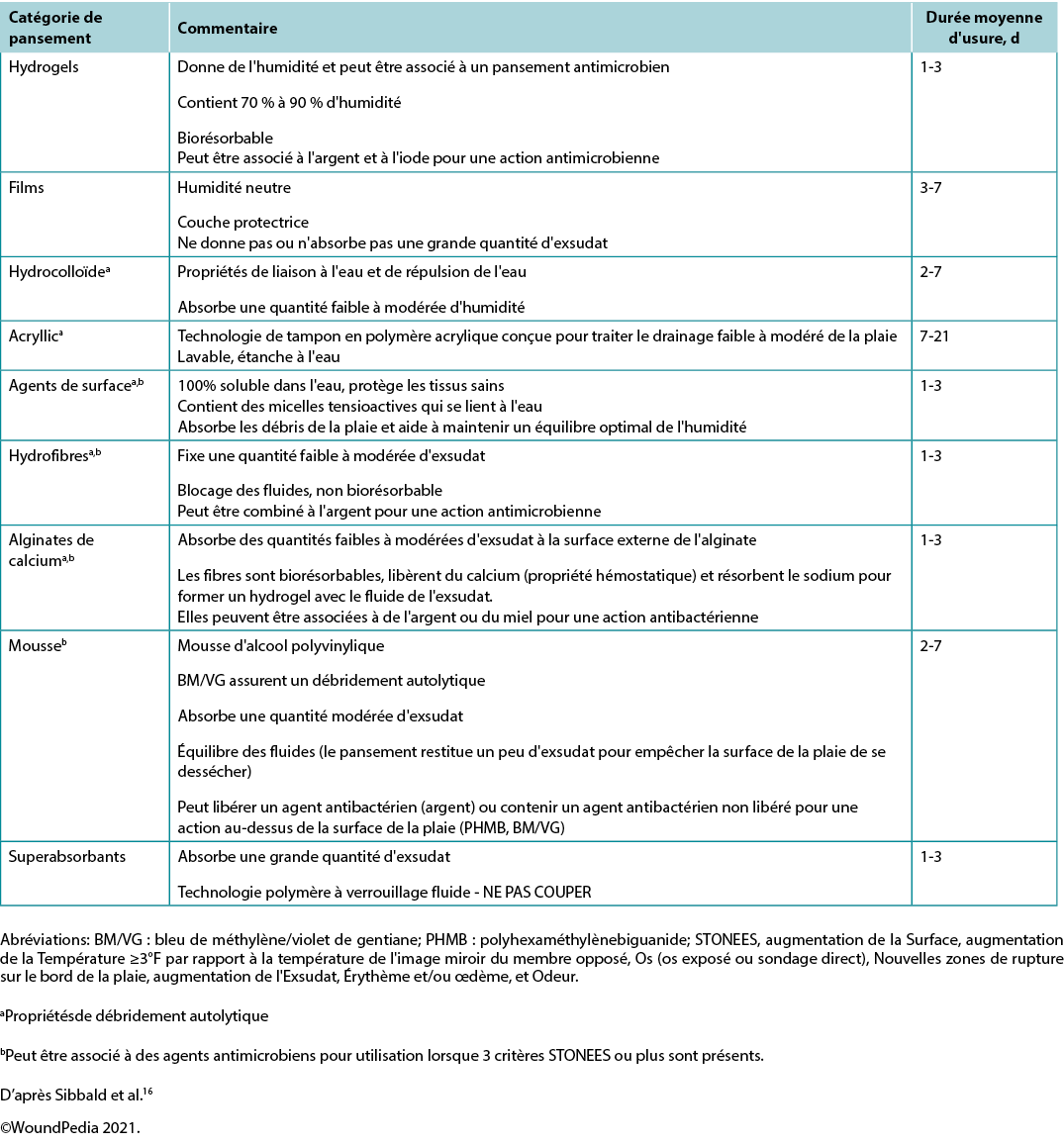
Tableau annexe 7. Données probantes sur les thérapies d’appoint
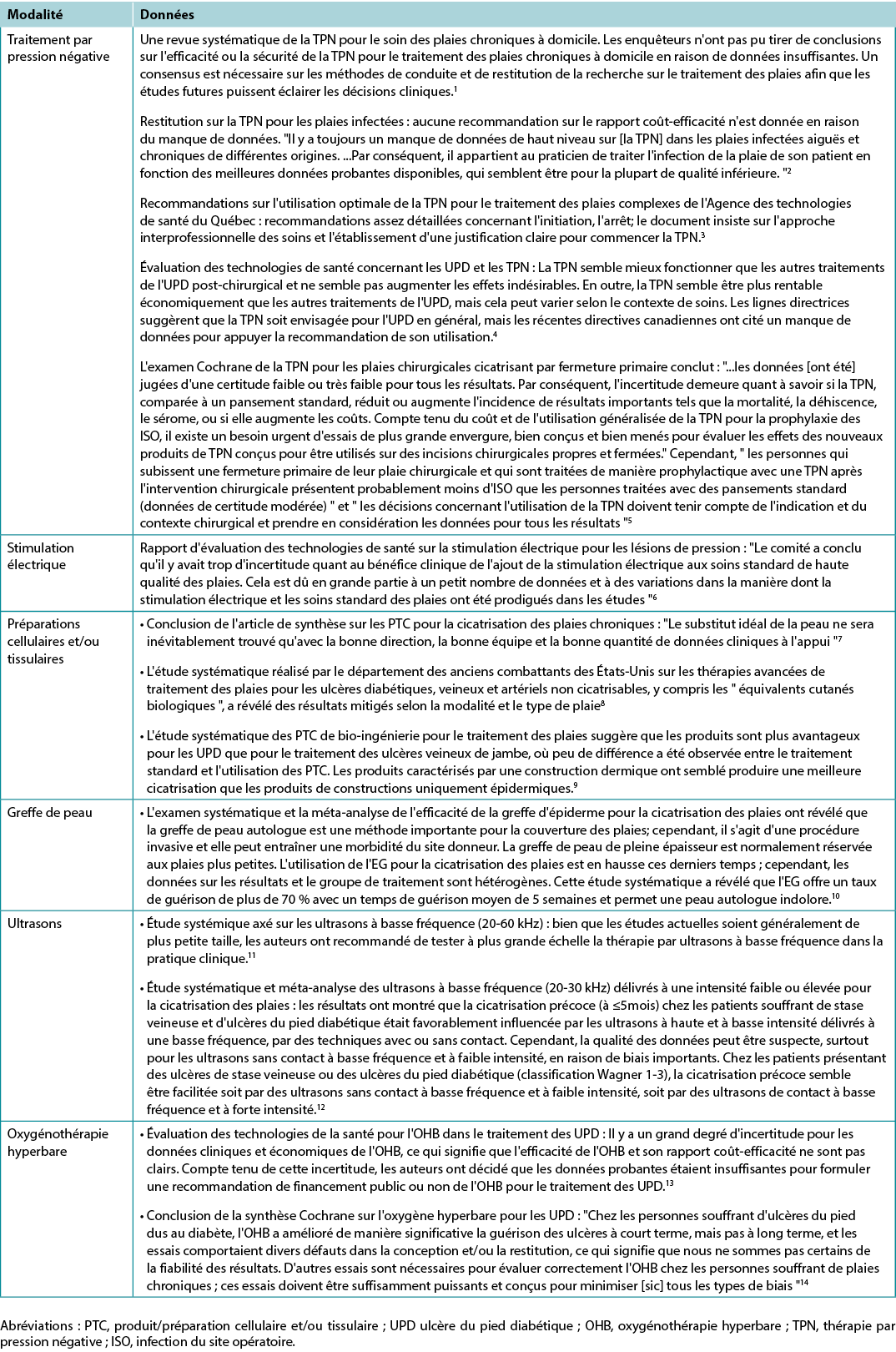
Author(s)
R Gary Sibbald*
MD, DSc (Hons), MEd, BSc, FRCPC (Med Derm), FAAD, MAPWCA, JM, Professor of Medicine and Public Health, Director, International Interprofessional Wound Care Course and Masters of Science in Community Health, Dalla Lana School of Public Health, University of Toronto, Ontario, Canada
James A Elliott
MMSc, Project Manager, ECHO Ontario Skin and Wound Care, Toronto Regional Wound Healing Clinic, Mississauga, Ontario, Canada
Reneeka Persaud-Jaimangal
MD, MScCH, IIWCC, Clinical Coordinator, ECHO Ontario Skin and Wound Care, Toronto Regional Wound Healing Clinic, Mississauga, Ontario, Canada
Laurie Goodman
MHScN, RN, IIWCC, Course Coordinator and Co-Director, WoundPedia, Mississauga, Ontario, Canada
David G Armstrong
DPM, MD, PhD, Professor of Surgery and Director, Southwestern Academic Limb Salvage Alliance, Keck School of Medicine, University of Southern California, Los Angeles, USA
Catherine Harley
RN, EMBA, Chief Executive Officer, Nurses Specialised in Wound, Ostomy & Continence Canada, Ottawa, Ontario, Canada
Sunita Coelho
BScN, RN, IIWCC, Toronto Regional Wound Healing Clinic, Mississauga, Ontario, Canada
Nancy Xi
MD, CCFP, Family Physician, Trillium Health Partners, Mississauga, Ontario, Canada
Robyn Evans
MD, MSc, Director, Wound Healing Clinic, Women’s College Hospital, Toronto, Ontario, Canada
Dieter O Mayer
MD, FEBVS, FAPWCA, Department of Surgery, Cantonal Hospital of Fribourg, Switzerland
Xiu Zhao
MD, CCFP, Family Physician, Trillium Health Partners, Mississauga, Ontario, Canada
Jolene Heil
BScN, CNS, IIWCC, MClSc, Advanced Practice Nurse, Providence Care, Kingston, Ontario, Canada
Bharat Kotru
PhD, IIWCC, Podiatrist, Max Super Speciality Hospital, Bathinda, Punjab, India
Barbara Delmore
PhD, RN, CWCN, MAPWCA, IIWCC, FAAN, Senior Nurse Scientist, Center for Innovations in the Advancement of Care, NYU Langone Health, New York, NY, USA
Kimberly LeBlanc
PhD, RN,NSWOC, WOCC(C), FCAN, Chair, Wound Ostomy Continence Institute, Nurses Specialised in Wound Ostomy Continence Care Canada, Ottawa, Ontario, Canada
Elizabeth A Ayello
PhD, MS, BSN, RN, CWON, ETN, MAWPCA, FAAN, Professor Emeritus, Excelsior College of Nursing, Albany, New York, NY, USA; Senior Advisor, The John A. Hartford Institute for Geriatric Nursing, New York, NY, USA; President, Ayello, Harris, & Associates, New York, NY, USA
Hiske Smart
MA, RN, PG Dip (UK), IIWCC, Manager, Wound Care & Hyperbaric Oxygen Therapy Unit, King Hamad University Hospital, Muharraq, Kingdom of Bahrain
Gulnaz Tariq
MSc, RN, PG Dip (PAK), BSc, IIWCC, MSc (UK), Manager, Wound Care/Surgical Units, Sheikh Khalifa Medical City, Abu Dhabi, United Arab Emirates
Afsaneh Alavi
MD, Senior Consultant, Department of Dermatology, Mayo Clinic, Rochester, MN, USA
Ranjani Somayaji
BScPT, MD, MPH, FRCPC, Assistant Professor, Departments of Medicine; Microbiology, Immunology and Infectious Disease; and Community Health Sciences; Cumming School of Medicine, University of Calgary, Alberta, Canada
References
- Sackett D, Rosenberg W, Gray J, Haynes R, WS R. Evidence based medicine: what it is and what it isn’t. BMJ 1996;312(7023):71–2.
- Brownson RC, Eyler AA, Harris JK, Moore JB, Tabak RG. Getting the word out: new approaches for disseminating public health science. J Public Health Manage Pract 2018;24(2):102–11.
- Keown K, Van Eerd D, Irvin E. Stakeholder engagement opportunities in systematic reviews: knowledge transfer for policy and practice. J Continuing Educ Health Prof 2008;28(2):67–72.
- Minkler M, Salvatore A. Participatory approaches for study design and analysis in dissemination and implementation research. In: Brownson RC, Colditz GA, Proctor EK, editors. Dissemination and implementation research in health: translating science to practice. New York, NY: Oxford University Press; 2012. p. 192–212.
- Gerhard-Herman MD, Gornik HL, Barrett C, et al. 2016 AHA/ACC guideline on the management of patients with lower extremity peripheral artery disease: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation 2017;135(12):e726–79.
- Beaumier M, Murray BA, Despatis MA, et al. Best practice recommendations for the prevention and management of peripheral arterial ulcers. Toronto, ON: Wounds Canada; 2020. p. 1–75.
- Alavi A, Sibbald RG, Nabavizadeh R, Valaei F, Coutts P, Mayer D. Audible handheld Doppler ultrasound determines reliable and inexpensive exclusion of significant peripheral arterial disease. Vascular 2015;23(6):622–9.
- Canadian Nutrition Society, Canadian Malnutrition Task Force. Canadian Nutritional Screening Tool (CNST); 2014 [cited 2021 Jan 14]. Available from: http://nutritioncareincanada.ca/sites/default/uploads/files/CNST.pdf
- Laporte M, Keller HH, Payette H, et al. Validity and reliability of the new Canadian Nutrition Screening Tool in the ‘real-world’ hospital setting. Eur J Clin Nutr 2015;69(5):558–64.
- Purcell A, Buckley T, King J, Moyle W, Marshall A. Topical analgesic and local anesthetic agents for pain associated with chronic leg ulcers: a systematic review. Adv Skin Wound Care 2020;33(5): 240–51.
- Woo KY, Coutts PM, Price P, Harding K, Sibbald RG. A randomized crossover investigation of pain at dressing change comparing 2 foam dressings. Adv Skin Wound Care 2009;22(7):304–10.
- Jensen J, Goodson W, Hopf H, Hunt T. Cigarette smoking decreases tissue oxygen. Arch Surg 1991;126(9):1131–4.
- Shanmugam VK, Couch KS, McNish S, Amdur RL. Relationship between opioid treatment and rate of healing in chronic wounds: opioids in chronic wounds. Wound Repair Regen 2017;25(1):120–30.
- Aujoulat I, d’Hoore W, Deccache A. Patient empowerment in theory and practice: polysemy or cacophony? Patient Educ Couns 2007;66(1):13–20.
- Moore Z, Butcher G, Corbett LQ, et al. Exploring the concept of a team approach to wound care: managing wounds as a team. J Wound Care 2014;23 Suppl 5b:S1–S38.
- Sibbald RG, Elliott JA, Ayello EA, Somayaji R. Optimizing the moisture management tightrope with Wound Bed Preparation 2015. Adv Skin Wound Care 2015;28(10):466–76.
- Boersema GC, Smart H, Giaquinto-Cilliers MGC, et al. Management of nonhealable and maintenance wounds: a systematic integrative review and referral pathway. Adv Skin Wound Care 2021;34(1):11–22.
- Nicks BA, Ayello EA, Woo K, Nitzki-George D, Sibbald RG. Acute wound management: revisiting the approach to assessment, irrigation, and closure considerations. Int J Emerg Med 2010;3(4):399–407.
- Moulin D, Boulanger A, Clark A, et al. Pharmacological management of chronic neuropathic pain: revised consensus statement from the Canadian Pain Society. Pain Res Manage 2014;19(6):328–35.
- Sibbald R, Niezgoda J, Ayello E. Debridement. In: Baranoski S, Ayello EA, editors. Wound care essentials: practice principles. 5th ed. Philadelphia, PA: Wolters Kluwer; 2020.
- Moya-López J, Costela-Ruiz V, García-Recio E, Sherman RA, De Luna-Bertos E. Advantages of maggot debridement therapy for chronic wounds: a bibliographic review. Adv Skin Wound Care 2020;33(10):515–25.
- Stacey MC. Biomarker directed chronic wound therapy – a new treatment paradigm. J Tissue Viability 2020;29(3):180–3.
- Registered Nurses Association of Ontario. Assessment and management of foot ulcers for people with diabetes. 2nd ed. Toronto, ON: Registered Nurses’ Association of Ontario; 2013.
- Freeman HP. The origin, evolution, and principles of patient navigation. Cancer Epidemiol Biomarkers Prev 2012;21(10):1614–7.
- Freund KM. Implementation of evidence-based patient navigation programs. Acta Oncol 2017;56(2):123–7.
- Porter ME, Lee TH. The strategy that will fix health care. Harvard Business Review. 2013 [cited 2021 Jan 14]. Available from: https://hbr.org/2013/10/the-strategy-that-will-fix-health-care
