Volume 42 Number 3
Pressure injury management in critically ill patients with COVID-19 in a makeshift hospital in Indonesia: A report of two cases
Kezia Eveline, Hemma W Indirayani, Rachmaniar Pramanasari, Firas F Alkaff
Keywords pressure injury, COVID-19, Case report, ICU, Indonesia
For referencing Eveline K et al. Pressure injury management in critically ill patients with COVID-19 in a makeshift hospital in Indonesia: A report of two cases. WCET® Journal 2022;42(3):23-29
DOI
https://doi.org/10.33235/wcet.42.3.23-29
Submitted 9 January 2022
Accepted 15 March 2022
Abstract
Patients who are critically ill with COVID-19 need ventilation support in the ICU. However, ICU patients are at higher risk of developing a pressure injury (PI). Unfortunately, PI prevention is not optimally implemented in Indonesia, especially in the makeshift hospitals created during the COVID-19 pandemic.
Here, the authors report two cases of critically ill COVID-19 patients who developed large sacral PIs during hospitalisation in a makeshift hospital in Indonesia. The first patient developed a grade III, 7 cm × 7 cm sacral PI on the 14th day of hospitalisation. The second patient developed a grade IV, 12 cm × 8 cm sacral PI on the 16th day of hospitalisation. Both patients had elevated D-dimer levels and used a noninvasive ventilator for one week.
The wounds were treated with surgical debridement, silver hydrogel dressing, and hydrocolloid dressing, and complemented with static air mattress overlay.
The authors recommend that in situations where there is a shortage of healthcare workers, the government should provide pressure-redistribution devices and silicone foam dressings for all critically ill patients to prevent PI development and lighten the workload of healthcare workers.
Copyright Advances in Skin & Wound Care and the World Council of Enterostomal Therapists®.
Introduction
COVID-19 has a wide clinical spectrum.1 Although the majority of those infected with COVID-19 are asymptomatic or have only mild symptoms, older adults and those with comorbidities are more likely to become critically ill.2 Among patients who are critically ill with COVID-19, the majority develop acute respiratory distress syndrome (ARDS), a life-threatening form of respiratory failure with a high mortality rate.3,4 Patients who develop ARDS require ventilation support in the ICU. However, patients in the ICU are also at higher risk of pressure injury (PI) development due to prolonged immobilisation.5
Unfortunately, PI prevention measures are not optimally implemented in Indonesia,8 especially in the makeshift hospitals created during the COVID-19 pandemic. Here, the authors report two cases of critically ill COVID-19 patients who developed large PIs during hospitalisation in a makeshift hospital in one of the largest cities in Indonesia. Written informed consent was provided by the legal guardian (for case 1) and by the subject of the case (for case 2) to publish the case details and associated images. The authors highlight challenges in PI management during the COVID-19 pandemic and propose several suggestions to aid PI prevention.
Case report
Case 1
A 40-year-old man with a medical history of schizophrenia and intellectual disability presented to the ER with the chief complaints of irritability, fever, dry cough, and shortness of breath. Three days before admission, the patient developed a fever of 38° C at home. On physical examination at the ER, the patient’s temperature was 37.8° C, BP was 120/80 mmHg, heart rate was 102 beats per minute, respiratory rate was 24 breaths per minute, and oxygen saturation was 85% without any oxygen support. Lung auscultation revealed rales in the left lung and chest X-ray revealed pulmonary infiltrates in the left lung (Figure 1). Laboratory evaluation showed elevated D-dimers (>20.000 ng/mL FEU) and hypoalbuminemia (2.2 mg/dl). Based on the initial evaluation, COVID-19 infection was suspected. A nasopharynx specimen was taken for COVID-19 reverse transcriptase-polymerase chain reaction evaluation to confirm the COVID-19 diagnosis.
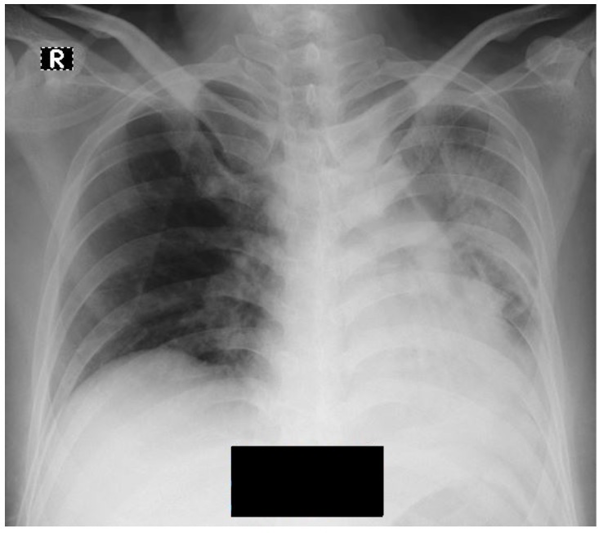
Figure 1. Chest x-ray in case 1,X-ray showing infiltrate in left lung.
While waiting for the test result, the patient was given 15 liters per minute oxygen via nonrebreathing mask and treated with intravenous moxifloxacin 400 mg daily, intravenous acetylcysteine 500 mg daily, intravenous albumin 50 grams daily, and 40 mg subcutaneous enoxaparin twice daily. To treat the symptoms of schizophrenia, the patient was given oral clozapine 50 mg twice daily, oral quetiapine 200 mg twice daily, and oral trihexyphenidyl 2mg twice daily. Because the patient was uncooperative, the patient was restrained on the bed after his legal guardian provided written consent. A foley catheter was then inserted and a diaper was used. The following day, the patient’s COVID-19 test result came back positive. The patient was then given additional treatment of intravenous oseltamivir 75 mg twice daily.
During hospitalisation, the patient’s oxygen saturation was not improving. On day 10, blood gas analysis showed uncompensated respiratory acidosis (pH 7.28, PO2 122 mmHg, PCO2 51.8 mmHg, and HCO3 24.9 mEq/L) with Jackson Reese circuit oxygen support. The patient also developed ARDS (PaO2/FiO2 ratio 122). Because this makeshift hospital lacked mechanical ventilators, a noninvasive ventilator was used. The patient had mean arterial pressure of 60 mmHg and Glasgow Coma Scale of 8, indicating ongoing septic shock. Thus, intravenous norepinephrine (0.1 mcg/kg/min) was administered continuously using syringe pump. Because the patient was immobilised, 30 minutes right-oblique and 30 minutes left-oblique passive mobilisation was undertaken every 8 hours. The restraints were released prior to mobilisation and retied after mobilisation to the new position. To maintain nutrition intake, a nasogastric feeding tube was inserted. The required nutrition was calculated by the dietitian and given as milk feeding.
Due to the limited number of healthcare workers (HCWs) available every shift and their high workloads, PI risk assessment was not performed. However, the patient’s skin was inspected every 8 hours during diaper changes. On day 14, a 7 cm × 7 cm bilateral sacral wound was noted with epithelial surface and superficial wound bed (Figure 2a). The wound was cleansed using normal saline and wound irrigation solution and a silver hydrogel dressing was applied to the wound bed. A hydrocolloid foam dressing was placed on top of the silver hydrogel dressing and extended 2 cm around the wound to protect the peri-wound skin from maceration. To prevent urine or fecal contamination, nonsterile gauze was placed above the hydrocolloid foam dressing and fixed with retention tape. In addition, a static air mattress overlay was placed on the bed as a pressure-redistribution device (PRD). The wound dressing was changed every 3 days, or earlier if contaminated with urine or feces.
On day 18, the sacral wound enlarged to 15 cm × 10 cm with slough and suspicion of “deeper ulceration” (Figure 2b). Surgical debridement was then performed by the nurses at the bedside. After surgical debridement, fascia was seen as the wound bed (Figure 2c). According to the 2016 National Pressure Ulcer Advisory Panel (NPUAP) staging system,10 the wound was classified as grade III. Because of the deep cavity wound, sterile gauze was placed in the cavity to fill the space after applying a silver hydrogel dressing onto the wound bed. The wound dressing was changed every 2 days instead of every 3 days, or earlier if contaminated with urine or feces. When needed, surgical debridement was performed again. On day 26, granulation began to appear from the wound (Figure 2d). The patient was discharged on day 39. Nurses followed up with weekly home visits until the wound was completely closed to evaluate the wound-healing process, perform surgical debridement if needed, change the wound dressing, and teach family members how to change the wound dressing in between home visits.
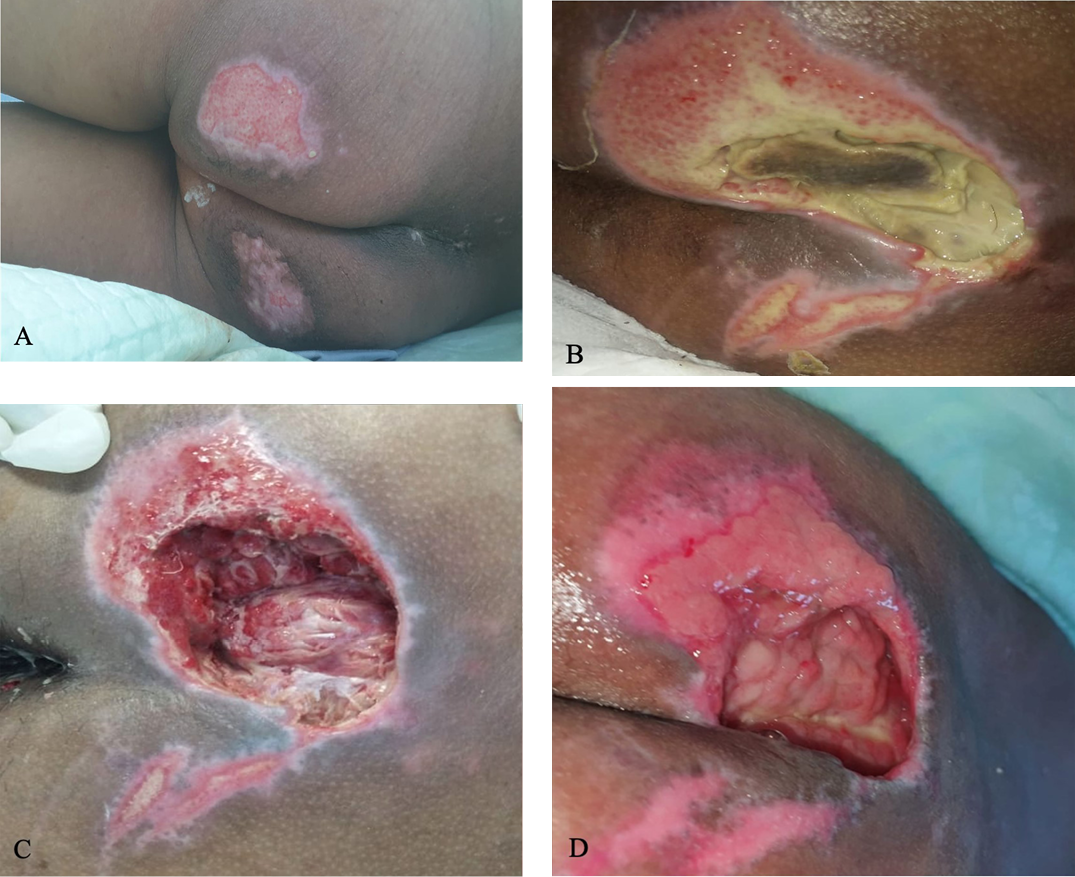
Figure 2. Sacral ulcer in case 1
A) Sacral ulcer with epithelial wound bed measuring 7 cm × 7 cm on day 14. B) Covered by slough and suspicion of “deeper ulcer,” measuring 15 cm × 10 cm on day 18. C) Minimal slough and fascia in the wound bed after surgical debridement and wound dressing, 15 cm x 10 cm with depth of 6 cm on day 22. D) Granulation tissue on day 26, measuring 10 cm × 6 cm.
Case 2
A 59-year-old man with a medical history of type 2 diabetes mellitus, hypertension, and cerebrovascular accident (CVA) presented to the ER with the chief complaints of fever, cough, and shortness of breath. Five days earlier, the patient had developed a cough and fever of 38.5° C at home. The patient tested positive for COVID-19 3 days before presenting to the ER. On physical examination at the ER, the temperature was 37.5° C, BP was 140/90 mmHg, heart rate was 110 beats per minute, respiratory rate was 24 breaths per minute, and oxygen saturation was 75% without any oxygen support. The patient had left-side hemiplegia due to the CVA. Lung auscultation revealed rales in both lungs. Chest X-ray revealed bilateral pulmonary opacities and cardiomegaly (Figure 3). Laboratory evaluation showed elevated D-dimers (2.100 ng/mL FEU), elevated interleukin-6 level (120 pg/mL), and hypoalbuminemia (2.8 mg/dl). Based on the initial evaluation, the patient was diagnosed with COVID-19 and recent CVA.
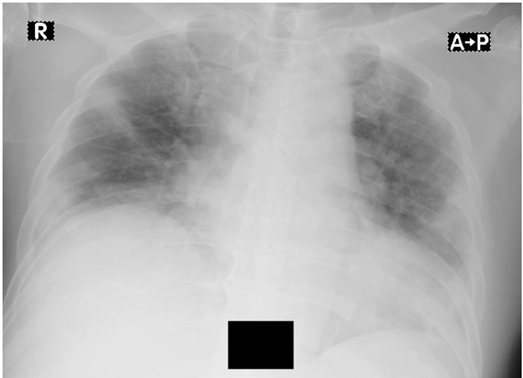
Figure 3. Chest x-ray in case 2
X-ray showing infiltrate in both lungs and cardiomegaly with cardio-thoracic ratio of 60%.
The patient was given 15 liters per minute oxygen via Jackson Rees circuit and treated with intravenous moxifloxacin 400 mg daily, intravenous acetylcysteine 500 mg daily, intravenous albumin 50 grams daily, subcutaneous heparin 5000 International Unit (IU), intravenous dexamethasone 6 mg daily, 400 mg intravenous Tocilizumab single dose, and oral oseltamivir 75 mg twice daily. To treat the hypertension, the patient was given oral amlodipine 10 mg once daily and oral candesartan 16 mg once daily. The patient also received subcutaneous long actin insulin 20 IU once daily and rapid acting insulin 16 IU thrice daily to treat the diabetes mellitus.
During hospitalisation, the patient’s oxygen saturation was not improving. On day 7, blood gas analysis showed uncompensated respiratory acidosis (pH 7.3, PO2 150 mmHg, PCO2 50.2 mmHg, and HCO3 23.5 mEq/L) with Jackson Reese circuit oxygen support. The patient developed ARDS (PaO2/FiO2 ratio 150) and was given a noninvasive ventilator due to the lack of mechanical ventilators. Because the patient was immobilised, 30 minutes right-oblique and 30 minutes left-oblique passive mobilisation was undertaken every 8 hours. To maintain nutritional intake, a nasogastric feeding tube was inserted; milk feeding was calculated by a dietician.
Due to the limited number of HCWs every shift and their high workloads, PI risk assessment was not performed. However, the patient’s skin was inspected every 8 hours during diaper changes. On day 16, a 12 cm × 8 cm sacral wound with suspicion of “deeper ulceration” was found on both sides of the sacrum (Figure 4a). On day 18, central necrotic tissue was present (Figure 4b). Nurses performed surgical debridement at the bedside (Figure 4c) and the wound was cleansed using normal saline and wound irrigation solution. A silver hydrogel dressing was applied on the wound bed and a hydrocolloid foam dressing was placed on top of the silver hydrogel dressing and extended 2 cm around the wound to protect the peri-wound skin from maceration. To prevent urine or fecal contamination, nonsterile gauze was placed above the hydrocolloid foam dressing and fixed with retention tape. Further, a static air mattress overlay was placed on the bed as a PRD. The wound dressing was changed every 3 days, or earlier if contaminated with urine or feces. When needed, surgical debridement was performed again.
Two days after treatment, the wound bed was more profound than the initial wound with bone and tendon exposure (Figure 4d). According to the 2016 NPUAP staging system,10 the wound was grade IV. Because of the deep cavity wound, the cavity was filled with sterile gauze after applying a silver hydrogel dressing onto the wound bed. The wound dressing was changed every 2 days instead of every 3 days, or earlier if contaminated with urine or feces. On day 25, granulation tissue presented on the ulcer (Figure 4e) and by day 30, the ulcer had narrowed (Figure 4f). The patient was discharged on day 35. Nurses followed up with weekly home visits until the wound was completely closed to evaluate the wound-healing process, perform surgical debridement if needed, change the wound dressing, and teach family members how to change the wound dressing in between the scheduled home visits.
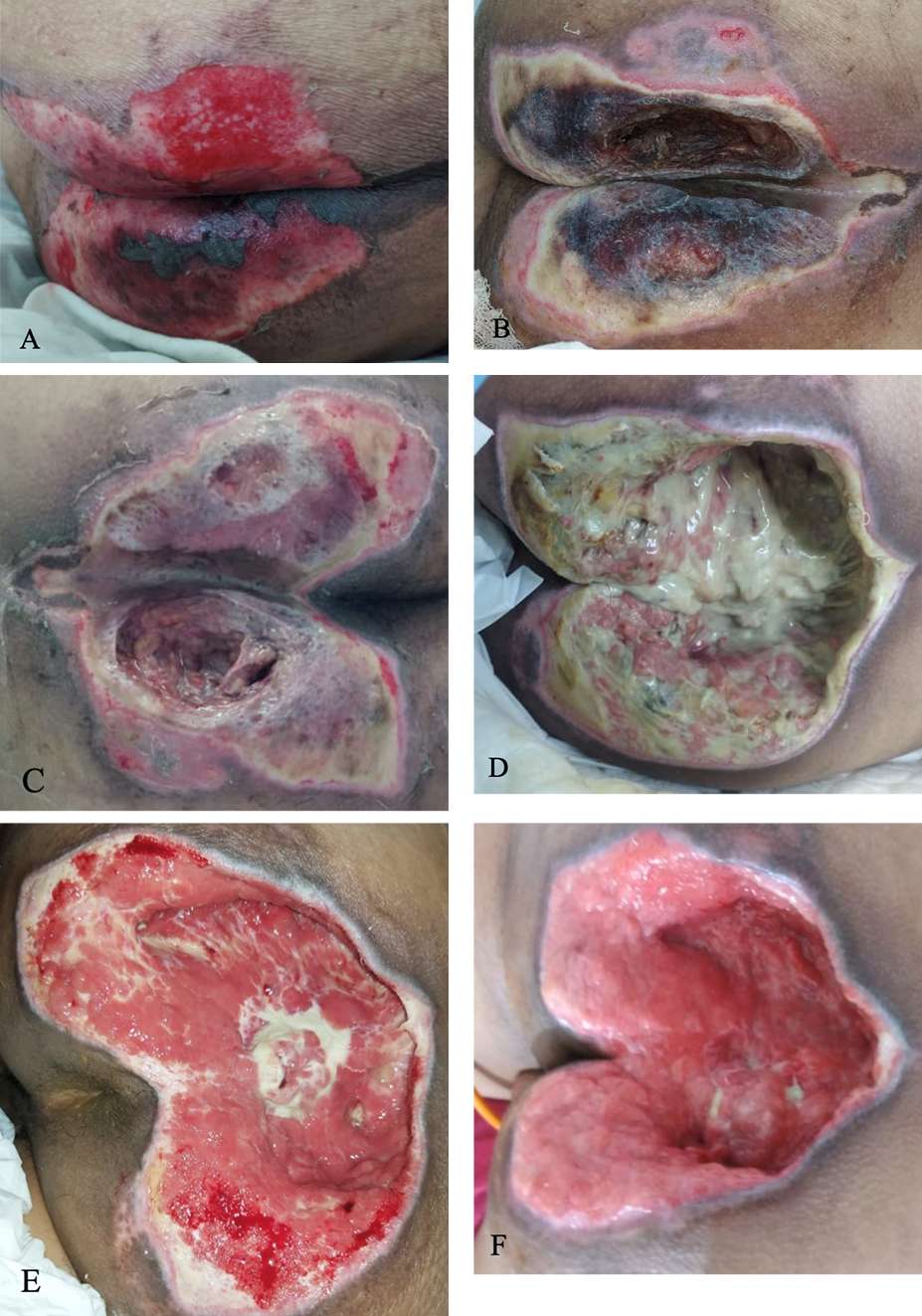
Figure 4. Sacral ulcer in case 2
A) Sacral ulcer on both side of buttocks with epithelial wound bed and necrotic tissue on central side, measuring 12 cm x 8 cm on day 16. B) Covered with both slough and necrotic tissue, measuring 12 cm x 10 cm on day 18. C) After surgical debridement on day 18. D) Covered with massive slough, depth of 7 cm on day 20. E) Granulation tissue and minimal slough on day 25. F) Granulation tissue on day 30.
Discussion
As reflected in the latest NPUAP definition of PI, the main factors influencing PI development are pressure, shear, and soft tissue tolerance.10 Pressure refers to sustained pressure on a local point, whereas shearing force occurs when two opposing surfaces slide in opposite directions. When pressure and shear disrupt blood flow and local tissue hypoxia lasts for a critical period of time, tissue damage results. However, at what intensity and duration of force tissue damage occurs depends on the tissue tolerance.12 Pressure injuries usually occur in bony areas such as the sacrum.13
Researchers have identified a number of PI risk factors, including immobility, being confined to bed, malnutrition, dehydration, infection, urinary and bowel incontinence, diabetes, vascular disease, and vasopressor use.14-16 Sedated patients are particularly prone to PI because they do not perceive painful stimuli from intense and prolonged pressure and are not able to actively change their position in bed.7,17,18 Recently, it has been reported that patients who are critically ill with COVID-19 are also at higher risk of PI.19 These patients have reduced perfusion and are more likely to develop systemic coagulopathy, which leads to decreased tissue tolerance.19 In the first case, the patient was critically ill with COVID-19 and required a vasopressor. This patient had impaired mental health as a comorbidity. People with severe mental health impairment such as schizophrenia tend to have poor diet and may neglect their personal hygiene, causing similar conditions to having urinary and bowel incontinence.13 In the second case, the patient was also critically ill with COVID-19 and had CVA and diabetes mellitus as comorbidities.
Pressure injury is associated with prolonged hospitalisation.20-22 The length of stay was 39 days for the first case report patient and 35 days for the second patient. The first patient could have been discharged 9 days earlier if there were no PI present; the second patient could have been discharged 5 days earlier. In a previous case series of three severely ill patients with COVID-19, PIs were first noted between 7 and 19 days after hospitalisation.19 For the patients described herein, PI was noted on day 14 of hospitalisation for the first patient, and on day 16 for the second patient.
According to the latest guidelines, comprehensive PI risk assessment, preventive skin care, and early mobilisation and repositioning are some of the PI management strategies that should be considered.23 In terms of patients who are critically ill with COVID-19, Tang et al24 found that PIs can be managed by improving the underlying contributing factors, providing PRD with proper positioning, improving mobility, minimising excessive moisture, correcting malnutrition, and performing close daily monitoring of the PI including the dressing, surrounding skin, and any possible complications.
However, proper PI management translates to an extra workload for nurses. Unfortunately, due to significant staffing shortages, HCWs’ workload during the COVID-19 pandemic in Indonesia is already high.9 In this makeshift hospital, there are only one doctor and three nurses on every shift, resulting in a HCW-to-patient ratio of 1:5. In addition, most of the patients with COVID-19 were critically ill. With a very unbalanced HCW-to-patient ratio and resultant high workload for the HCWs, it is not possible to follow the guidelines for proper PI management. As a result, PI risk assessment was not performed when patients arrived at the makeshift hospital; mobilisation and skin assessment were performed every 8 hours (once per HCW’s working shift) instead of being individualised according to risk assessment.
With regard to PRDs, a recent study found that PRD use was associated with an 88% reduced risk of PI development in high risk ICU patients.25 Similarly, a previous systematic review also concluded that PRD should be provided to patients who are at high risk of PI development.26 Pressure-redistribution devices help prevent PIs by decreasing the magnitude and duration of pressure as well as reducing the shear and friction between the patient and the bed surface.10,25 Thus, providing PRDs for all critically ill patients with COVID-19 would be a beneficial strategy for PI prevention. However, in the makeshift hospital, only two PRDs are available, and thus are allocated for PI treatment and not for PI prevention.
Based on the difficulties experienced during the COVID-19 pandemic, the authors recommend several PI prevention strategies for hospitals with HCW shortages:23,28
Re-educate HCWs about PI management
Conduct skin assessments as often as possible
Ensure patients have adequate nutrition and hydration
Use PRDs for all patients who are critically ill with COVID-19
Apply silicone foam dressings over the bony prominences that serve as the main pressure points in all critically ill patients with COVID-19.
Conclusions
Patients who are critically ill with COVID-19 are also at greater risk of PI development during hospitalisation. In a situation where there is a shortage of HCWs, governments should compensate by providing additional PRDs and silicone foam dressings for all critically ill patients to prevent PI development and lighten the workload of HCWs.
Conflict of Interest
The authors declare no conflicts of interest.
Funding
The authors received no funding for this study.
Prise en charge des lésions de pression chez des patients atteints d’une forme grave de COVID-19 dans un hôpital de campagne en Indonésie : Compte-rendu de deux cas
Kezia Eveline, Hemma W Indirayani, Rachmaniar Pramanasari, Firas F Alkaff
DOI: https://doi.org/10.33235/wcet.42.3.23-29
Résumé
Les patients atteints d’une forme grave de COVID-19 ont besoin d'une respiration assistée en unité de soins intensifs (USI). Cependant, les patients en unité de soins intensifs présentent un risque plus élevé de développer une lésion de pression (LP). Malheureusement, la prévention des LP n'est pas mise en œuvre de manière optimale en Indonésie, notamment dans les hôpitaux de campagne créés pendant la pandémie de COVID-19.
Les auteurs décrivent ici deux cas de patients COVID-19 atteints d’une forme grave qui ont développé d’importantes LP sacrales pendant leur hospitalisation dans un hôpital de campagne en Indonésie. Le premier patient a développé une LP sacrale de stade III, de 7 cm × 7 cm, le 14e jour d'hospitalisation. Le deuxième patient a développé une LP sacrale de stade IV, de 12 cm × 8 cm, le 16e jour d'hospitalisation. Les deux patients présentaient des taux élevés de D-dimères et ont utilisé un respirateur non invasif pendant une semaine.
Les plaies ont été traitées par débridement chirurgical, des pansements hydrogels à l'argent et pansements hydrocolloïdes, et par un surmatelas à air statique en complément.
Les auteurs recommandent que, dans les situations où il y a pénurie de personnel de santé, le gouvernement fournisse des dispositifs de redistribution de la pression et des pansements en mousse de silicone à tous les patients gravement atteints afin de prévenir le développement de LP et d'alléger la charge de travail du professionnel de santé.
©Advances in Skin & Wound Care et World Council of Enterostomal Therapists®.
Introduction
Le COVID-19 présente un large spectre clinique.1 Bien que la majorité des personnes infectées par le COVID-19 soient asymptomatiques ou ne présentent que des symptômes légers, les adultes plus âgés et ceux présentant des comorbidités sont plus susceptibles de faire une forme grave.2 Parmi les patients atteints de COVID-19, la majorité développe un syndrome de détresse respiratoire aiguë (SDRA), une forme d'insuffisance respiratoire menaçant le pronostic vital avec un taux de mortalité élevé.3,4 Les patients qui développent un SDRA ont besoin d'une respiration assistée en USI. Cependant, les patients en soins intensifs sont également exposés à un risque plus élevé de développement de lésions de pression (LP) en raison d'une immobilisation prolongée.5
Malheureusement, les mesures de prévention des LP ne sont pas mises en œuvre de manière optimale en Indonésie8, notamment dans les hôpitaux de campagne créés pendant la pandémie de COVID-19. Les auteurs présentent ici deux cas de patients COVID-19 atteints d’une forme grave qui ont développé d’importantes LP pendant leur hospitalisation dans un hôpital de campagne de l'une des plus grandes villes d'Indonésie. Un consentement éclairé écrit a été fourni par le tuteur légal (pour le cas 1) et par le sujet du cas (pour le cas 2) pour publier les caractéristiques du cas et les images associées. Les auteurs mettent en évidence les défis de la prise en charge des LP pendant la pandémie de COVID-19 et proposent plusieurs suggestions pour aider à la prévention des LP.
Compte-rendu de cas
Cas 1
Un homme de 40 ans ayant des antécédents médicaux de schizophrénie et de déficience intellectuelle s'est présenté aux urgences en se plaignant principalement d‘irritabilité, de fièvre, d’une toux sèche et d’un essoufflement. Trois jours avant son admission, le patient a développé une fièvre de 38 °C à son domicile. Lors de l'examen clinique aux urgences, la température du patient était de 37,8 °C, la tension artérielle de 120/80 mmHg, la fréquence cardiaque de 102 battements par minute, la fréquence respiratoire de 24 respirations par minute et la saturation en oxygène de 85 % sans aucune assistance en oxygène. L'auscultation pulmonaire a révélé des râles dans le poumon gauche et la radiographie pulmonaire a révélé des infiltrats pulmonaires dans le poumon gauche (figure 1). L'évaluation de laboratoire a montré des D-dimères élevés (>20,000 ng/mL FEU) et une hypoalbuminémie (2,2 mg/dl). D'après l'évaluation initiale, une infection au COVID-19 a été suspectée. Un échantillon nasopharyngé a été prélevé pour une évaluation de la réaction en chaîne de la transcriptase inverse-polymérase du COVID-19 afin de confirmer le diagnostic de COVID-19.

Figure 1. Radiographie du thorax du cas 1, la radiographie montre un infiltrat dans le poumon gauche.
En attendant le résultat du test, le patient a reçu 15 litres d'oxygène par minute par l'intermédiaire d'un masque sans réinspiration et a été traité avec 400 mg de moxifloxacine par jour par voie intraveineuse, 500 mg d'acétylcystéine par jour par voie intraveineuse, 50 grammes d'albumine par jour par voie intraveineuse et 40 mg d'énoxaparine par voie sous-cutanée deux fois par jour. Pour traiter les symptômes de la schizophrénie, le patient a reçu 50 mg de clozapine par voie orale deux fois par jour, 200 mg de quétiapine par voie orale deux fois par jour et 2 mg de trihexyphénidyl par voie orale deux fois par jour. Comme le patient n'était pas coopératif, il a été attaché sur son lit après que son tuteur légal eut fourni un consentement écrit. Une sonde de Foley a ensuite été insérée et des couches ont été utilisées. Le jour suivant, le résultat du test COVID-19 du patient est revenu positif. Le patient a ensuite reçu un traitement supplémentaire de 75 mg d'oséltamivir intraveineux deux fois par jour.
Pendant l'hospitalisation, la saturation en oxygène du patient ne s'est pas améliorée. Le 10e jour, l'analyse des gaz du sang a révélé une acidose respiratoire non compensée (pH 7,28, PO2 122 mmHg, PCO2 51,8 mmHg et HCO3 24,9 mEq/L) avec une assistance en oxygène par circuit Jackson Reese. Le patient a également développé un SDRA (ratio PaO2/FiO2 de 122). Comme cet hôpital de campagne ne disposait pas de respirateurs mécaniques, un respirateur non invasif a été utilisé. Le patient avait une pression artérielle moyenne de 60 mmHg et un score de 8 sur l’échelle de coma de Glasgow, indiquant un choc septique en cours. Ainsi, de la norépinéphrine intraveineuse (0,1 mcg/kg/min) a été administrée en continu à l'aide d'un pousse-seringue. Le patient étant immobilisé, une mobilisation passive de 30 minutes en oblique droite et 30 minutes en oblique gauche a été entreprise toutes les 8 heures. Les contentions ont été libérées avant la mobilisation et retirées après la mobilisation dans la nouvelle position. Pour maintenir l'apport nutritionnel, une sonde d'alimentation nasogastrique a été insérée. L'alimentation nécessaire a été calculée par un diététicien et donnée sous forme de lait.
En raison du nombre limité de professionnels de santé (PDS) disponibles dans chaque équipe et de leur charge de travail élevée, l'évaluation du risque de LP n'a pas été réalisée. Cependant, la peau du patient a été inspectée toutes les 8 heures lors du changement des couches. Le 14e jour, une plaie sacrale bilatérale de 7 cm × 7 cm a été notée avec une surface épithéliale et un lit de plaie superficiel (figure 2a). La plaie a été nettoyée à l'aide d'une solution saline standard et d'une solution d'irrigation de la plaie, et un pansement hydrogel à l’argent a été appliqué sur le lit de la plaie. Un pansement en mousse hydrocolloïde a été placé par-dessus le pansement hydrogel à l’argent et étendu sur 2 cm autour de la plaie pour protéger la peau péri-lésionnelle de la macération. Pour éviter toute contamination urinaire ou fécale, une gaze non stérile a été placée au-dessus du pansement en mousse hydrocolloïde et fixée avec du ruban de rétention. En outre, un surmatelas à air statique a été placé sur le lit comme dispositif de redistribution de la pression (DRP). Le pansement était changé tous les 3 jours, ou plus tôt s'il était contaminé par de l'urine ou des matières fécales.
Le 18e jour, la plaie sacrale s'est élargie à 15 cm × 10 cm avec de la boue et une suspicion d'"ulcération plus profonde" (figure 2b). Le débridement chirurgical a ensuite été effectué par les infirmières et les infirmiers au lit du patient. Après le débridement chirurgical, le fascia apparaissait comme lit de la plaie (Figure 2c). Selon le système de stadification 2016 du Comité consultatif national sur les lésions de pression (NPUAP),10 la plaie a été classée de stade III. En raison de la profondeur de la plaie, une gaze stérile a été placée dans la cavité pour remplir l'espace après avoir appliqué un pansement hydrogel à l’argent sur le lit de la plaie. Le pansement était changé tous les 2 jours au lieu de tous les 3 jours, ou plus tôt s'il était contaminé par de l'urine ou des matières fécales. Si nécessaire, un débridement chirurgical était de nouveau effectué. Le 26e jour, une granulation a commencé à apparaître sur la plaie (Figure 2d). Le patient est sorti de l'hôpital le 39e jour. Les infirmières et infirmiers ont effectué des visites hebdomadaires à domicile jusqu'à la fermeture complète de la plaie afin d'évaluer le processus de cicatrisation, de procéder à un débridement chirurgical si nécessaire, de changer le pansement de la plaie et d'apprendre aux membres de la famille comment changer le pansement entre les visites à domicile.

Figure 2. Ulcère sacral du cas 1
A) Ulcère sacral avec lit de la plaie épithéliale mesurant 7 cm × 7 cm au 14e jour. B) Recouvert de boue et suspicion d'un "ulcère plus profond", mesurant 15 cm × 10 cm au 18e jour. C) Boue minimale et fascia dans le lit de la plaie après débridement chirurgical et pansement de la plaie, 15 cm x 10 cm avec une profondeur de 6 cm au 22e jour. D) Tissu de granulation au 26e jour, mesurant 10 cm × 6 cm.
Cas 2
Un homme de 59 ans ayant des antécédents médicaux de diabète sucré de type 2, d'hypertension et d'accident vasculaire cérébral (AVC) s'est présenté aux urgences en se plaignant principalement de fièvre, de toux et d’essoufflement. Cinq jours auparavant, le patient avait développé une toux et une fièvre de 38,5 °C à son domicile. Le patient a été testé positif au COVID-19 3 jours avant de se présenter aux urgences. Lors de l'examen physique aux urgences, la température était de 37,5 °C, la tension artérielle de 140/90 mmHg, la fréquence cardiaque de 110 battements par minute, la fréquence respiratoire de 24 respirations par minute et la saturation en oxygène de 75 % sans aucune assistance en oxygène. Le patient avait une hémiplégie du côté gauche due à l'AVC. L'auscultation pulmonaire a révélé des râles dans les deux poumons. La radiographie du thorax a révélé des opacités pulmonaires bilatérales et une cardiomégalie (figure 3). L'évaluation de laboratoire a révélé un taux élevé de D-dimères (2,100 ng/mL FEU), un taux élevé d'interleukine-6 (120 pg/mL) et une hypoalbuminémie (2,8 mg/dl). D'après l'évaluation initiale, le patient a été diagnostiqué avec un COVID-19 et un AVC récent.

Figure 3. Radiographie du thorax du cas 2
La radiographie montre un infiltrat dans les deux poumons et une cardiomégalie avec un rapport cardio-thoracique de 60 %.
Le patient a reçu 15 litres d'oxygène par minute via un circuit Jackson Rees et a été traité avec 400 mg de moxifloxacine par voie intraveineuse par jour, 500 mg d'acétylcystéine par voie intraveineuse par jour, 50 grammes d'albumine par voie intraveineuse par jour, 5 000 unités internationales (UI) d'héparine sous-cutanée, 6 mg de dexaméthasone par voie intraveineuse par jour, 400 mg de Tocilizumab par voie intraveineuse en dose unique et 75 mg d'oséltamivir par voie orale deux fois par jour. Pour traiter l'hypertension, le patient a reçu de 10 mg d'amlodipine par voie orale une fois par jour et 16 mg de candésartan par voie orale une fois par jour. Le patient a également reçu 20 UI d'insuline longue durée sous-cutanée une fois par jour et 16 UI d'insuline rapide trois fois par jour pour traiter son diabète sucré.
Pendant l'hospitalisation, la saturation en oxygène du patient ne s'est pas améliorée. Le 7e jour , l'analyse des gaz du sang a révélé une acidose respiratoire non compensée (pH 7,3, PO2 150 mmHg, PCO2 50,2 mmHg et HCO3 23,5 mEq/L) avec une assistance en oxygène par circuit Jackson Reese. Le patient a développé un SDRA (ratio PaO2/FiO2 de 150) et a été doté d’un respirateur non invasif en raison de l'absence de respirateurs mécaniques. Le patient étant immobilisé, une mobilisation passive de 30 minutes en oblique droite et 30 minutes en oblique gauche a été entreprise toutes les 8 heures. Pour maintenir l'apport nutritionnel, une sonde d'alimentation nasogastrique a été insérée; l'alimentation lactée a été calculée par un diététicien.
En raison du nombre limité de PDS par équipe et de leur charge de travail élevée, l'évaluation du risque de LP n'a pas été réalisée. Cependant, la peau du patient a été inspectée toutes les 8 heures lors du changement des couches. Le 16e jour, une plaie sacrale de 12 cm × 8 cm avec suspicion d'"ulcération plus profonde" a été découverte des deux côtés du sacrum (figure 4a). Au 18e jour, un tissu nécrotique central était présent (figure 4b). Les infirmières et infirmiers ont procédé au débridement chirurgical au lit du patient (Figure 4c) et la plaie a été nettoyée à l'aide d'une solution saline standard et d'une solution d'irrigation de la plaie. Un pansement hydrogel à l’argent a été appliqué sur le lit de la plaie et un pansement en mousse hydrocolloïde a été placé par-dessus le pansement à hydrogel à l’argent et étendu sur 2 cm autour de la plaie pour protéger la peau péri-lésionnelle de la macération. Pour éviter toute contamination urinaire ou fécale, une gaze non stérile a été placée au-dessus du pansement en mousse hydrocolloïde et fixée avec du ruban de rétention. En outre, un surmatelas à air statique a été placé sur le lit comme DRP. Le pansement était changé tous les 3 jours, ou plus tôt s'il était contaminé par de l'urine ou des matières fécales. Si nécessaire, un débridement chirurgical était de nouveau effectué.
Deux jours après le traitement, le lit de la plaie était plus profond que la plaie initiale avec une exposition des os et des tendons (Figure 4d). Selon le système de stadification NPUAP 2016,10 la plaie était de stade IV. En raison de la profondeur de la plaie, la cavité a été remplie de gaze stérile après avoir appliqué un pansement hydrogel à l’argent sur le lit de la plaie. Le pansement était changé tous les 2 jours au lieu de tous les 3 jours, ou plus tôt s'il était contaminé par de l'urine ou des matières fécales. Au 25e jour, un tissu de granulation est apparu sur l'ulcère (figure 4e) et au 30e jour, l'ulcère s'était rétréci (figure 4f). Le patient est sorti de l'hôpital le 35e jour. Les infirmières et les infirmiers ont effectué des visites hebdomadaires à domicile jusqu'à la fermeture complète de la plaie afin d'évaluer le processus de cicatrisation, de procéder à un débridement chirurgical si nécessaire, de changer le pansement de la plaie et d'apprendre aux membres de la famille à changer le pansement entre les visites à domicile programmées.

Figure 4. Ulcère sacral du cas 2
A) Ulcère sacral sur les deux côtés du fessier avec lit de la plaie épithéliale et tissu nécrotique sur le côté central, mesurant 12 cm x 8 cm au 16e jour. B) Couvert à la fois de boue et de tissu nécrotique, mesurant 12 cm x 10 cm au 18e jour. C) Après débridement chirurgical au 18e jour. D) Couvert d'une boue massive, d'une profondeur de 7 cm au 20e jour. E) Tissu de granulation et boue minimale au 25e jour. F) Tissu de granulation au 30ème jour.
Discussion
Comme le reflète la dernière définition des LP du NPUAP, les principaux facteurs influençant le développement des LP sont la pression, le cisaillement et la tolérance des tissus mous.10 La pression fait référence à une pression soutenue sur un point localisé, tandis que la force de cisaillement se produit lorsque deux surfaces opposées glissent dans des directions opposées. Lorsque la pression et le cisaillement perturbent la circulation sanguine et que l'hypoxie locale des tissus perdure sur une période critique, il en résulte des lésions tissulaires. Cependant, l'intensité et la durée de la force à laquelle les lésions tissulaires se produisent dépendent de la tolérance des tissus.12 Les lésions de pression se produisent généralement dans les zones osseuses telles que le sacrum.13
Les chercheurs ont identifié un certain nombre de facteurs de risque de LP, notamment l'immobilité, le confinement au lit, la malnutrition, la déshydratation, l'infection, l'incontinence urinaire et intestinale, le diabète, les maladies vasculaires et l'utilisation de vasopresseurs.14-16 Les patients sous sédatifs sont particulièrement exposés aux LP car ils ne perçoivent pas les stimuli douloureux d'une pression intense et prolongée et ne sont pas en mesure de changer activement leur position dans le lit.7,17,18 Récemment, il a été signalé que les patients atteints d’une forme grave de COVID-19 présentent également un risque plus élevé de LP.19 Ces patients ont une perfusion réduite et sont plus susceptibles de développer une coagulopathie systémique, ce qui entraîne une diminution de la tolérance tissulaire.19 Dans le premier cas, le patient était gravement atteint de COVID-19 et avait besoin d'un vasopresseur. Ce patient présentait une comorbidité de santé mentale déficiente. Les personnes souffrant de troubles mentaux graves, comme la schizophrénie, ont tendance à avoir une mauvaise alimentation et peuvent négliger leur hygiène personnelle, ce qui entraîne des conditions similaires à celles de l'incontinence urinaire et intestinale.13 Dans le second cas, le patient était également gravement atteint de COVID-19 et présentait des comorbidités d’AVC et de diabète sucré.
Les lésions de pression sont associées à une hospitalisation prolongée.20-22 La durée de séjour était de 39 jours pour le premier patient du compte-rendu de cas et de 35 jours pour le deuxième patient. Le premier patient aurait pu sortir 9 jours plus tôt s'il n'y avait pas eu de LP; le deuxième patient aurait pu sortir 5 jours plus tôt. Dans une précédente série de cas de trois patients atteints d’une forme grave de COVID-19, des LP ont été notées pour la première fois entre 7 et 19 jours après l'hospitalisation.19 Pour les patients décrits ici, une LP a été constatée le 14e jour d'hospitalisation pour le premier patient, et le 16e jour pour le second.
Selon les dernières directives, l'évaluation complète du risque de LP, les soins cutanés préventifs, ainsi que la mobilisation et le repositionnement précoces sont quelques-unes des stratégies de prise en charge des LP à envisager.23 En ce qui concerne les patients atteints d’une forme grave de COVID-19, Tang et al.24 ont constaté que les LP peuvent être gérées en améliorant les facteurs contributifs sous-jacents, en fournissant un DRP avec un positionnement correct, en améliorant la mobilité, en réduisant l'humidité excessive, en corrigeant la malnutrition et en effectuant une surveillance quotidienne étroite de la LP, y compris le pansement, la peau environnante et toute complication éventuelle.
Cependant, une bonne prise en charge des LP se traduit par une charge de travail supplémentaire pour les infirmières et infirmiers. Malheureusement, en raison d'une importante pénurie de personnel, la charge de travail des PDS pendant la pandémie de COVID-19 en Indonésie est déjà élevée.9 Dans cet hôpital de campagne, il n'y a qu'un médecin et trois infirmières ou infirmiers par équipe, ce qui donne un ratio PDS/patients de 1/5. En outre, la plupart des patients COVID-19 étaient atteints d’une forme grave. Avec un ratio PDS/patients très déséquilibré et la charge de travail élevée qui en résulte pour les PDS, il n'est pas possible de suivre les directives pour une prise en charge correcte des LP. Par conséquent, l'évaluation du risque de LP n'était pas effectuée à l'arrivée des patients à l'hôpital de campagne; la mobilisation et l'évaluation cutanée étaient effectuées toutes les 8 heures (une fois par changement d’équipe de PDS) au lieu d'être individualisées en fonction de l'évaluation du risque.
En ce qui concerne les DRP, une étude récente a montré que l'utilisation de DRP était associée à une réduction de 88 % du risque de développement de LP chez les patients à haut risque des USI.25 De même, une revue systématique précédente a également conclu que des DRP devraient être fournis aux patients qui présentent un risque élevé de développement de LP.26 Les dispositifs de redistribution de la pression aident à prévenir les LP en diminuant l'ampleur et la durée de la pression ainsi qu'en réduisant le cisaillement et la friction entre le patient et la surface du lit.10,25 Ainsi, la fourniture de DRP à tous les patients atteints d’une forme grave de COVID-19 serait une stratégie bénéfique pour la prévention des LP. Cependant, dans cet hôpital de campagne, seuls deux DRP sont disponibles, et sont donc affectés au traitement des LP et non à la prévention des LP.
Sur la base des difficultés rencontrées lors de la pandémie de COVID-19, les auteurs recommandent plusieurs stratégies de prévention des LP pour les hôpitaux qui manquent de professionnels de santé :23,28
Reformer les PDS sur la prise en charge des LP
Effectuer des évaluations cutanées aussi souvent que possible
S'assurer que les patients ont une alimentation et une hydratation adéquates
Utiliser des DRP pour tous les patients atteints d’une forme grave de COVID-19
Appliquez des pansements en mousse de silicone sur les proéminences osseuses qui servent de points de pression principaux chez tous les patients atteints d’une forme grave de COVID-19.
Conclusions
Les patients atteints d’une forme grave de COVID-19 présentent également un risque accru de développement de LP pendant leur hospitalisation. Dans une situation de pénurie de personnel soignant, les gouvernements devraient compenser en fournissant des DPR supplémentaires et des pansements en mousse de silicone pour tous les patients gravement atteints afin de prévenir le développement de LP et d'alléger la charge de travail des PDS.
Conflit d'intérêt
Les auteurs ne déclarent aucun conflit d'intérêt.
Financement
Les auteurs n'ont reçu aucun financement pour cette étude.
Author(s)
Kezia Eveline MD
Plastic Reconstructive and Aesthetic Surgery Resident, Faculty of Medicine Universitas Airlangga, Dr Soetomo General Academic Hospital, Surabaya, Indonesia
Hemma W Indirayani MD
Internist, Menur Mental Hospital, Surabaya, Indonesia
Rachmaniar Pramanasari MD
Plastic Reconstructive and Aesthetic Surgeon, Airlangga University Hospital, Surabaya, Indonesia
Firas F Alkaff* MD
Lecturer, Division of Pharmacology and Therapy, Department of Anatomy, Histology and Pharmacology, Faculty of Medicine Universitas Airlangga
PhD Researcher, Division of Nephrology, Department of Internal Medicine, University Medical Centre, Groningen, The Netherlands
* Corresponding author
Kezia Eveline, MD is Plastic Reconstructive and Aesthetic Surgery Resident at Faculty of Medicine Universitas Airlangga, Dr. Soetomo General Academic Hospital, Surabaya, Indonesia. Hemma W. Indriyani, MD is Internist at Menur Mental Hospital, Surabaya. Rachmaniar Pramanasari, MD, is Plastic Reconstructive and Aesthetic Surgeon at Airlangga University Hospital, Surabaya. Firas F. Alkaff, MD is Lecturer at Division of Pharmacology and Therapy, Department of Anatomy, Histology, and Pharmacology, Faculty of Medicine Universitas Airlangga and PhD Researcher at Division of Nephrology, Department of Internal Medicine, University Medical Center Groningen, Groningen, The Netherlands
Kezia Eveline, MD, est interne en chirurgie plastique, reconstructive et esthétique à la Faculté de médecine Universitas Airlangga, Hôpital académique général Dr. Soetomo, Surabaya, Indonésie. Hemma W. Indriyani, MD est interne à l'hôpital psychiatrique Menur, à Surabaya. Rachmaniar Pramanasari, MD, est chirurgien plastique reconstructeur et esthétique à l'hôpital universitaire Airlangga, à Surabaya. Firas F. Alkaff, MD est maître de conférences à la Division de pharmacologie et thérapie, Département d'anatomie, d'histologie et de pharmacologie, Faculté de médecine Universitas Airlangga et chercheur PhD à la Division de la néphrologie, Département de médecine interne, Centre médical universitaire de Groningue, Groningue, Pays-Bas
References
- Ramos-Casals M, Brito-Zeron P, Mariette X. Systemic and organ-specific immune-related manifestations of COVID-19. Nat Rev Rheumatol 2021;17:315-32.
- Gao YD, Ding M, Dong X, et al. Risk factors for severe and critically ill COVID-19 patients: a review. Allergy 2021;76:428-55.
- Xu W, Sun NN, Gao HN, et al. Risk factors analysis of COVID-19 patients with ARDS and prediction based on machine learning. Sci Rep 2021;11:2933.
- Yang X, Yu Y, Xu J, et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study. Lancet Respir Med 2020;8:475-81.
- Challoner T, Vesel T, Dosanjh A, Kok K. The risk of pressure ulcers in a proned COVID population. Surgeon 2021;S1479-666X(21)00121-9.
- He M, Tang A, Ge X, Zheng J. Pressure ulcers in the intensive care unit: an analysis of skin barrier risk factors. Adv Skin Wound Care 2016;29:493-8.
- Keller BP, Wille J, van Ramshorst B, van der Werken C. Pressure ulcers in intensive care patients: a review of risks and prevention. Intensive Care Med 2002;28:1379-88.
- Amir Y, Lohrmann C, Halfens RJ, Schols JM. Pressure ulcers in four Indonesian hospitals: prevalence, patient characteristics, ulcer characteristics, prevention and treatment. Int Wound J 2017;14:184-93.
- Mahendradhata Y, Andayani N, Hasri ET, et al. The capacity of the Indonesian healthcare system to respond to COVID-19. Front Public Health 2021;9:649819.
- Edsberg LE, Black JM, Goldberg M, McNichol L, Moore L, Sieggreen M. Revised National Pressure Ulcer Advisory Panel pressure injury staging system: revised pressure injury staging system. J Wound Ostomy Continence Nurs 2016;43:585-97.
- Defloor T. The risk of pressure sores: a conceptual scheme. J Clin Nurs 1999;8:206-16.
- Mervis JS, Phillips TJ. Pressure ulcers: Pathophysiology, epidemiology, risk factors, and presentation. J Am Acad Dermatol 2019;81:881-90.
- Bhattacharya S, Mishra RK. Pressure ulcers: current understanding and newer modalities of treatment. Indian J Plast Surg 2015;48(1):4-16.
- Cox J, Roche S. Vasopressors and development of pressure ulcers in adult critical care patients. Am J Crit Care 2015;24:501-10.
- Ahn H, Cowan L, Garvan C, Lyon D, Stechmiller J. Risk factors for pressure ulcers including suspected deep tissue injury in nursing home facility residents: analysis of national minimum data set 3.0. Adv Skin Wound Care 2016;29:178-90; quiz E1.
- Mawhirt SL, Frankel D, Diaz AM. Cutaneous manifestations in adult patients with COVID-19 and dermatologic conditions related to the COVID-19 pandemic in health care workers. Curr Allergy Asthma Rep 2020;20(12):75.
- Nedergaard HK, Haberlandt T, Toft P, Jensen HI. Pressure ulcers in critically ill patients - preventable by non-sedation? A substudy of the NONSEDA-trial. Intensive Crit Care Nurs 2018;44:31-5.
- Sasabe Y, Niitani M, Teramoto C, et al. Deep sedation predicts pressure injury in patients admitted to intensive care units. Nurs Crit Care 2022;DOI: 10.1111/nicc.12753.
- Young S, Narang J, Kumar S, et al. Large sacral/buttocks ulcerations in the setting of coagulopathy: a case series establishing the skin as a target organ of significant damage and potential morbidity in patients with severe COVID-19. Int Wound J 2020;17:2033-7.
- Triantafyllou C, Chorianopoulou E, Kourkouni E, Zaoutis TE, Kourlaba G. Prevalence, incidence, length of stay and cost of healthcare-acquired pressure ulcers in pediatric populations: a systematic review and meta-analysis. Int J Nurs Stud 2021;115:103843.
- Gupta P, Shiju S, Chacko G, et al. A quality improvement programme to reduce hospital-acquired pressure injuries. BMJ Open Qual 2020;9(3):e000905.
- Allman RM, Goode PS, Burst N, Bartolucci AA, Thomas DR. Pressure ulcers, hospital complications, and disease severity: impact on hospital costs and length of stay. Adv Wound Care 1999;12:22-30.
- European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel, Pan Pacific Pressure Injury Alliance. Prevention and Treatment of Pressure Ulcers/Injuries: Clinical Practice Guideline. The International Guideline. EPUAP/NPIAP/PPPIA; 2019.
- Tang J, Li B, Gong J, Li W, Yang J. Challenges in the management of critical ill COVID-19 patients with pressure ulcer. Int Wound J 2020;17:1523-4.
- Bai DL, Liu TW, Chou HL, Hsu YL. Relationship between a pressure redistributing foam mattress and pressure injuries: an observational prospective cohort study. PLoS One 2020;15(11):e0241276.
- McInnes E, Jammali-Blasi A, Bell-Syer SE, Dumville JC, Middleton V, Cullum N. Support surfaces for pressure ulcer prevention. Cochrane Database Syst Rev 2015;9:CD001735.
- Shi C, Dumville JC, Cullum N. Support surfaces for pressure ulcer prevention: a network meta-analysis. PLoS One 2018;13(2):e0192707.
- Team V, Team L, Jones A, Teede H and Weller CD (2021) Pressure Injury Prevention in COVID-19 Patients With Acute Respiratory Distress Syndrome. Front. Med. 7:558696. doi: 10.3389/fmed.2020.558696
