Volume 43 Number 2
Delving into skin and soft tissue infections (SSTI). Part III: focus on cellulitis
Caley Shukalek, Vidhi Desai, Brandon Christensen, Christopher Lata, Ranjani Somayaji
Keywords soft tissue infection, case-based review, cellulitis
For referencing Shukalek C et al. Delving into skin and soft tissue infections (SSTI). Part III: focus on cellulitis. WCET® Journal 2023;43(2):24-28
DOI
https://doi.org/10.33235/wcet.43.2.24-28
Submitted 27 July 2022
Accepted 6 June 2023
Abstract
In this third part of a series of articles (Part I WCET® Journal Volume 36 Number 2 – April/June 2016: PP29-34; Part II WCET® Journal Volume 37 Number 3 – July/September 2017: PP20-24) on skin and soft tissue infections (SSTI), cellulitis syndromes are explored. A case-based approach to the diagnosis and management of cellulitis for clinicians is discussed.
Introduction
Skin and soft tissue infections (SSTI) represent a spectrum of diseases, from mild superficial infection such as erysipelas and cellulitis to deep fascial infections as seen in necrotising fasciitis. The presentations vary but are common both within primary and acute care settings. The burden of SSTI is vast, with rates rising through the late 1990s–2000s, attributed to increasing age and comorbidities such as obesity1. However, there are no significant differences between men and women2. A US-based study in 2010 showed SSTI to be two-times more common than UTI and 10 times more common than pneumonia, with rates as high as 48.5 cases per 1000 person years3. Similarly, a study examining rates of cellulitis in the US between 1998–2013 demonstrated the rates of acute hospitalisation were nearly double, with costs totalling nearly US$3.74 billion4. At the same time, a challenging aspect of cellulitis and other SSTI is diagnosis, with a reliance on clinical history and physical examination. The absence of objective microbiological or laboratory testing allows for non-infectious aetiologies to be mistakenly diagnosed as SSTI. This too is costly to the system, with one study showing up to 30% of patients admitted with lower limb cellulitis were misdiagnosed, with an estimated cost of between US$195–515 million5.
Endeavours to develop aids in the diagnosis of cellulitis have been undertaken; however, challenges remain around developing ‘gold standard’ diagnostics and appropriate comparators, given the heterogeneity of alternative diagnoses. A 2019 systematic review found several tools to aid in diagnosis; however, none were adequately validated for lower limb cellulitis6.
As previously discussed, SSTI often result from minor superficial trauma to the skin barrier7,8. Trauma can come in the form of external damage to the skin, chronic venous insufficiency, or inflammation4,9,10.
Cellulitis Overview
Clinical manifestations
Cellulitis is a rapidly progressive SSTI involving the dermis and subcutaneous tissues11. Symptoms typically include acute onset redness, warmth, oedema and pain, but can occasionally include systemic symptoms such as fevers and rigours. Most commonly, cellulitis is found on the lower extremities, with rates as high as 39.9% of all cellulitis12. As mentioned previously, damage to the skin surface through trauma, inflammation or oedema typically precedes infection. Less commonly, cellulitis can occur due to spread of an infection from the bloodstream or a contiguous source (i.e. abscess in the fat tissue expanding outward)2.
Numerous risk factors exist for the primary/first episode of cellulitis, including homelessness, advanced age, obesity, skin breakdown (ulcers, inflammation, trauma), oedema/lymphoedema, toe web infections (fungal, bacterial) venous insufficiency and previous venectomy among others13. At the same time, risk factors for recurrent cellulitis include obesity, tinea pedis, oedema/lymphoedema and venous insufficiency, but also smoking, malignancy and previous cellulitis1. Recurrence rates of cellulitis following a primary episode are high but ranges vary depending on the study, with some reporting ~8–20%12 while others show between 22–49% when risk factors are present1.
Non-necrotising and non-purulent infections rarely cause mortality1. However, the estimated overall mortality rate for cellulitis is reported to be 1.1%, although infection itself may only be the culprit in up to one third of cases1,14. The vast majority of infections are caused by Staphylococcus aureus and streptococci and, in one study, where microbiologic diagnoses were confirmed, these two pathogenic groups were cultured 97% of the time13.
Several scoring systems have been developed, including the ERON15 and the modified Dundee classification, which have been included in the UK CREST guidelines16. However, these criteria have not been widely adopted and have been criticised for being overly simplified or not clinically robust in distinguishing severity11,17.
Interestingly, recent studies have shown the incidence of cellulitis can vary by season. One such study out of Denver showed a trend toward higher rates of admissions for primary cellulitis in warmer months, with July having 66.63% higher odds of infection compared to the colder winter months18. At the same time, a study out of southwestern Taiwan showed rates of lower extremity cellulitis increased in the days immediately following a typhoon, suggesting climates prone to floods and excessive precipitation may place occupants at risk of cellulitis with enteric, gram-negative and water-borne organisms due to exposure to contaminated water19. One explanation may be soaking of the extremities for prolonged periods, thus impairing natural host defence systems and facilitating a portal of entry through the skin surface19. Furthermore, during climate disasters, bites from animals and insects may also contribute to increased rates of infection18.
Pathogenesis
Once superficial damage occurs to the skin surface, bacterial contamination with the patient’s own skin flora can occur. This explains why staphylococcal and streptococcal species are the most prevalent organisms in cellulitis. Successful infection occurs in three steps – the bacteria must first adhere to the host’s cells, then invade the tissue while evading the host’s defences, and finally utilise its toxigenic factors19. A cytokine and neutrophil response are triggered after bacteria penetrate the skin. This epidermal response results in antimicrobial peptide production and keratinocyte proliferation, both of which induce the characteristic examination findings of cellulitis2. The portal of entry is not always evident, particularly as cellulitis can occur with seemingly intact skin in the context of other risk factors. In these instances, microscopic cracks occur in skin; these become irritated or inflamed, thus facilitating bacterial migration inward20.
Clinical approach / microbiology
Cellulitis can be classified into non-purulent and purulent forms based on the clinical presentation. Non-purulent cellulitis, classically caused by streptococci, presents as a unilateral, poorly demarcated, warm and red area lacking purulent discharge or abscess. Conversely, purulent cellulitis, classically caused by staphylococci, generally develops around wounds, collections or carbuncles. In both, there is surrounding oedema and tenderness to palpation which can expand rapidly as the infection progresses. Other local features can include local necrosis and abscess formation (subsequent to cellulitis process) based on the bacterial species and infection severity.
S. aureus is more frequently associated with purulent cellulitis, although both bacterial species are capable of severe infectious features based on the virulence factors of the infecting strain. Other streptococci that are also implicated in cellulitis include Group B, C and G streptococcus – these are more common in persons with diabetes or vascular disease. As a wound becomes chronic, there is a transition of skin flora to one that is polymicrobial with colonisation by enteric gram-negatives, anaerobes or environmental pathogens. Following a similar pathogenesis, these organisms can cause infection, often in those with untreated wounds, poor circulation, or diabetic foot ulcers21.
More atypical organisms can be involved in cellulitis, including those seen in animal bite, fresh/salt water, or aquarium exposures. These are often identified with careful history and require broader spectrum therapies which are beyond the scope of this review.
Differential diagnosis
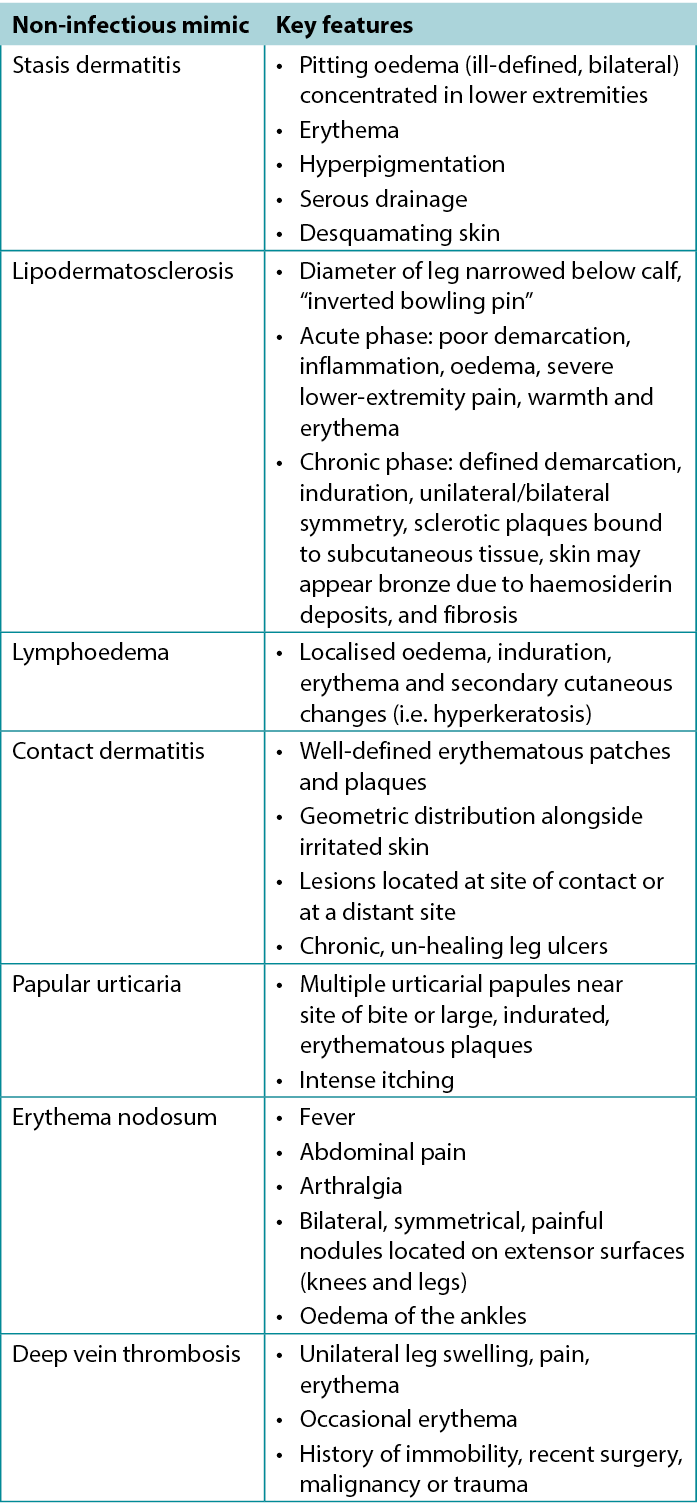
Given the wide spectrum of dermatologic conditions, the largely subjective nature of history and physical examination, and the non-specific symptoms (i.e. tenderness, erythema, oedema) seen in the skin, cellulitis is frequently misdiagnosed22. Syndromes that mimic cellulitis include statis dermatitis, lipodermatosclerosis and lymphoedema; these are summarised in Table 122. Stasis dermatitis is the most common mimic of cellulitis, although it tends to be slower onset and more often bilateral. However, stasis dermatitis and other mimics are risk factors for SSTI and, as such, infection should remain on the differential. Lymphoedema refers to oedema resulting from abnormal lymphatic flow of any cause and presents most commonly as a unilateral non-pitting oedema. There can be associated erythema due to inflammation, but pain and warmth may not be present. Other conditions that can mimic infections include contact dermatitis and papular urticaria, both relating to a dermal sensitivity reaction to an allergen or insect bite22. Generally, addressing other factors such as systemic signs, laboratory tests and occasionally biopsy can assist in making a diagnosis in more challenging cases23.
Table 1. Characteristics of non-infectious mimics of cellulitis
The differentiation between erysipelas and cellulitis is often challenging, but often not clinically relevant. Erysipelas, by definition, involves the superficial epidermis, whereas cellulitis involves the dermis and subcutaneous tissues24. Cellulitis and erysipelas both have similar clinical presentations; however, cellulitis usually presents as a flat, erythematous patch. Erysipelas, however, may be raised and tends to be more well demarcated than cellulitis, with clear margins between infected and uninfected skin25. Additionally, erysipelas is more classically described in the face25. In light skinned individuals, lesions also differ in colour, with cellulitis being more pink and erysipelas being described classically as ‘salmon-red’. Clinically, both erysipelas and cellulitis are treated with similar agents and for similar duration24.
A final important differential consideration are necrotising SSTI, including necrotising fasciitis. While erythematous skin changes are common to both, necrotising fasciitis tends to be exquisitely painful, beyond what the clinician would expect of the skin changes present. In contrast to cellulitis, there are often systemic symptoms, including fever, hypotension, tachycardia or altered level of consciousness, but these findings may be late in the disease process26. Additionally, there may be blisters, bullae, skin discolouration, crepitus (presence of gas under the skin), pain, and rapid extension of erythema within hours26.
Therapy
The degree of clinical severity determines the type of treatment that is needed for cellulitis; a guideline detailing treatment approaches can be found elsewhere24. Cases of cellulitis that lack systemic signs of infection (i.e. fever, tachycardia) can be treated with an oral antimicrobial agent that is active against streptococci alone (mild cases). Moderate–severe cases may require intravenous antimicrobials initially, with a subsequent step down to oral antibiotics after a period of improvement. For severe infections, empiric coverage against methicillin-resistant S. aureus (MRSA) may be considered based on the location of infection, risk factors, and local MRSA prevalence. In purulent cellulitis, incision and drainage may be indicated alongside antimicrobial therapies.
Although classical descriptions exist to differentiate streptococcal and staphylococcal cellulitis, the distinctions are not generally clear and, as such, agents with activity against both are often used. For treatment, penicillins with staphylococcal activity or cephalosporins are frequently used, with the latter also used in cases of penicillin allergy – for severe reactions other classes will be considered. Clinical improvements often lag antimicrobial therapy by 24–48 hours and at times erythema can extend27. In these cases, it is often appropriate to continue with therapy and reassess at 72 hours, when the body’s inflammatory response begins to subside. In the absence of improvement at 72 hours, the diagnosis or choice of therapy may need to be reassessed.
Prevention
As described above, recurrence is a common and costly in cellulitis, with each additional episode causing more inflammatory damage to the lymphatic system, thus perpetuating the problem28. Non-pharmacological prevention options include regular moisturisation, prevention of toe-space infections (tinea pedis), weight loss, regular exercise, and lower leg compression therapy (e.g. compression stockings29). While there is no evidence for topical solutions to prevent cellulitis, topical antibiotic ointments have been shown to reduce infection in acute lacerations and wounds28,30. After initiating the non-pharmacological options above, if recurrent cellulitis remains an issue, low dose suppressive penicillin has been shown to be effective in preventing recurrent cellulitis27.
Case studies
Case 1
Ms Lee is a 35-year-old otherwise healthy woman who presents with a 2-day history of fever, redness, pain and swelling around her left ear. There was no recent trauma or injury. There is no previous history of dermatologic ailments in the head or neck, including eczema. Physical examination reveals a fever of 38.5˚C, heart rate of 90 beats per minute, and blood pressure of 95/60 (normal). Examination of the left ear itself reveals a normal tympanic membrane with no drainage or lesions. There is marked erythema and induration around the left ear with tender pre-auricular nodes. Note is made of an ‘ear pit’ or preauricular sinus proximal to the tragus of the left ear (Figure 1).
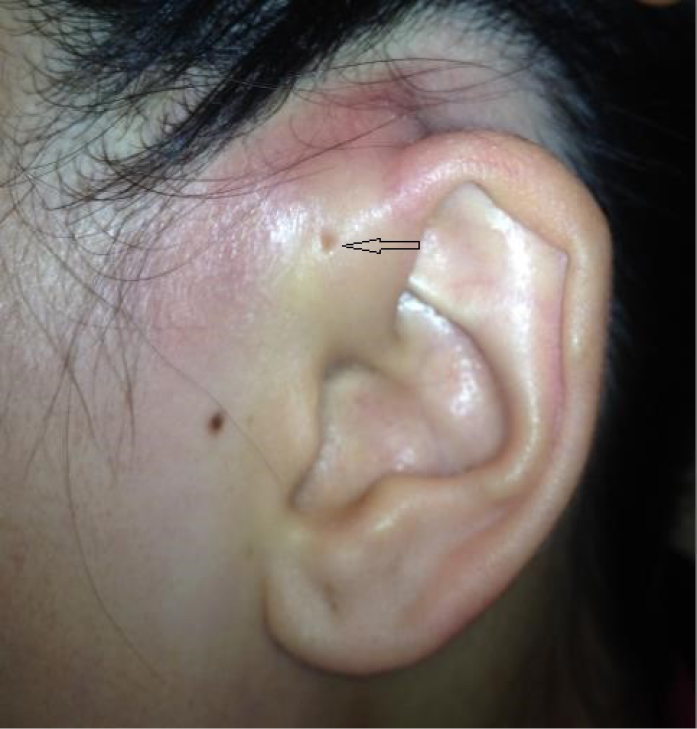
Figure 1. Case study 1.
On further questioning, Ms Lee reveals that her mother had a similar sinus which became infected in her 30s and required surgical removal. Ms Lee is initiated on cefazolin 2g IV every 8 hours for 72 hours via home parenteral pump after which she has a 40% improvement. She is stepped down to cephalexin 500mg PO four times daily for 4 days to complete a total 7-day course. She is also referred to the otolaryngology service for consideration of surgical removal of the sinus once her symptoms are resolved.
In case 1, we see an atypical presentation of cellulitis of the outer ear, with the likely risk factor being the anatomical variant described. Therapy targeting staphylococci and streptococci yield clinical improvement. To prevent recurrence, surgical consultation and intervention may be required.
Case 2
Mr Brown is a 56-year-old businessman with no past medical history and no obesity. He presents to the emergency department with a 48-hour history of swollen, erythematous and painful left lower leg after a month-long trip to Turkey. He has just returned home after an >8-hour flight. Pain began prior to the flight but has worsened in recent days. In the emergency department he is mildly tachycardic (HR105), normotensive and afebrile. Other haemodynamic markers are within normal limits. His blood work demonstrates a white blood cell count of 16,000 with elevated CRP. Other laboratorial parameters are within normal limits. A doppler ultrasound of the left leg rules out deep vein thrombosis.
There is no preceding trauma or injury, and no apparent risk factors for cellulitis. The ED physician makes a diagnosis of cellulitis based on the patients presenting clinical history of a swollen, painful erythematous lower leg and exclusion of DVT. He is started on cefazolin 2g IV every 8 hours and discharged home via home parenteral pump. He is followed up in clinic and after 5 days of parenteral therapy has not improved. Treatment is broadened with anti-MRSA therapy in the form of Doxycycline and 3 days later improvement is minimal. Additional history obtained elucidates frequent swimming in pools and fresh/saltwater lakes while abroad. The decision is made to discontinue parenteral therapy at the patient’s request. He is started on highly bioavailable oral ciprofloxacin for empiric gram-negative coverage in addition to the gram-positive/MRSA coverage provided by doxycycline. Five days later, the redness, erythema and swelling have reduced 80%. He completes a 7-day course of this combined therapy.
Case 2, on the other hand, introduces two unique considerations. The first is the need to rule out possible differentials, in this case deep vein thrombosis, given the history of long-haul flight. The second consideration are organisms beyond staphylococci and streptococci. As discussed, improvement with typical therapies should be seen within 72 hours. When this has not occurred, re-examining the history and differential is often important. Here, a history of multiple water exposures has been uncovered, leading the clinician to consider therapies targeting gram-negative and environmental pathogens. The ultimate improvement once on anti-gram-negative therapy confirms the diagnosis.
Conclusion
Cellulitis and SSTI are an increasing burden to the healthcare system world-wide, owing to the rise in age and comorbidities. Diagnosis and management present major challenges given the absence of gold standard, inter-clinician variability, and the large number of mimics. However, emerging evidence around prevention provides an unique opportunity to prevent morbidity and avoid additional healthcare costs.
Conflict of Interest
The authors declare no conflicts of interest.
Funding
The authors received no funding for this study.
Approfondissement des infections de la peau et des tissus mous (IPTM). Partie III : focus sur la cellulite
Caley Shukalek, Vidhi Desai, Brandon Christensen, Christopher Lata, Ranjani Somayaji
DOI: https://doi.org/10.33235/wcet.43.2.24-28
Résumé
Dans cette troisième partie d'une série d'articles (Partie I : WCET® Journal - Volume 36 Numéro 2 - Avril/Juin 2016, p. 29-34 ; Partie II : WCET® Journal - Volume 37 Numéro 3 - Juillet/Septembre 2017, p. 20-24) sur les infections de la peau et des tissus mous (IPTM), les syndromes de cellulite sont explorés. Une approche du diagnostic et de la prise en charge de la cellulite basée sur des compte-rendu de cas pour les praticiens de la clinique est discutée.
Introduction
Les infections de la peau et des tissus mous (IPTM) représentent un éventail de maladies, allant des infections superficielles légères telles que l'érysipèle et la cellulite aux infections fasciales profondes telles que la fasciite nécrosante. Les présentations varient mais sont courantes dans les établissements de soins primaires et aigus. La charge des IPTM est considérable, avec des taux en hausse jusqu'à la fin des années 1990-2000, attribués à l'augmentation de l'âge et des comorbidités telles que l'obésité1. Cependant, il n'y a pas de différences significatives entre les hommes et les femmes2. Une étude américaine réalisée en 2010 a montré que les IPTM sont deux fois plus fréquentes que les infections urinaires et dix fois plus fréquentes que la pneumonie, avec des taux atteignant 48,5 cas pour 1 000 personnes-année3. De même, une étude portant sur les taux de cellulite aux États-Unis entre 1998 et 2013 a montré que les taux d'hospitalisation aiguë étaient presque deux fois plus élevés, avec des coûts totalisant près de 3,74 milliards de dollars américains4. En même temps, l’ un des aspects difficiles de la cellulite et des autres IPTM est le diagnostic, car il repose sur l'historique clinique et l'examen physique. L'absence de tests microbiologiques ou de laboratoire objectifs conduit à diagnostiquer à tort des étiologies non infectieuses comme étant des IPTM. Une étude a montré que jusqu'à 30 % des patients admis pour une cellulite des membres inférieurs ont été mal diagnostiqués, ce qui représente un coût estimé entre 195 et 515 millions de dollars américains5.
Des efforts ont été entrepris pour mettre au point des aides au diagnostic de la cellulite ; toutefois, des difficultés subsistent en ce qui concerne la mise au point de diagnostics de référence et de comparateurs appropriés, compte tenu de l'hétérogénéité des diagnostics alternatifs. Une revue systématique réalisée en 2019 a mis en évidence plusieurs outils d'aide au diagnostic, mais aucun n'a été validé de manière adéquate pour la cellulite des membres inférieurs6.
Comme indiqué précédemment, les IPTM résultent souvent d'un traumatisme superficiel mineur de la barrière cutanée7,8. Le traumatisme peut prendre la forme d'une lésion externe de la peau, d'une insuffisance veineuse chronique ou d'une inflammation4,9,10.
La cellulite en bref
Manifestations cliniques
La cellulite est une IPTM à évolution rapide qui touche le derme et les tissus sous-cutanés11. Les symptômes comprennent généralement une apparition aigüe de rougeur, chaleur, œdème et douleur, mais peuvent occasionnellement inclure des symptômes systémiques tels que fièvres et états sévères. La cellulite touche le plus souvent les membres inférieurs, avec des taux atteignant 39,9 % de l'ensemble des cellulites12. Comme indiqué précédemment, les lésions de la surface de la peau dues à un traumatisme, à une inflammation ou à un œdème précèdent généralement l'infection. Plus rarement, la cellulite peut être due à la propagation d'une infection à partir de la circulation sanguine ou d'une source contiguë (par exemple, un abcès dans le tissu adipeux qui s'étend vers l'extérieur)2.
Il existe de nombreux facteurs de risque pour le premier épisode de cellulite, notamment l'absence de domicile, l'âge avancé, l'obésité, les lésions cutanées (ulcères, inflammations, traumatismes), l'œdème/lymphœdème, les infections des orteils (fongiques, bactériennes), l'insuffisance veineuse et les veinectomies antérieures, entre autres13. Parallèlement, les facteurs de risque de cellulite récurrente sont l'obésité, le tinea pedis, l'œdème/lymphœdème et l'insuffisance veineuse, mais aussi le tabagisme, les tumeurs malignes et les cellulites antérieures1. Les taux de récidive de la cellulite après un épisode primaire sont élevés, mais les fourchettes varient selon les études, certaines faisant état d'environ 8 à 20 %12, d'autres de 22 à 49 % en présence de facteurs de risque1.
Les infections non nécrosantes et non purulentes sont rarement mortelles1. Cependant, le taux de mortalité global estimé pour la cellulite est de 1,1 %, bien que l'infection elle-même ne soit responsable que dans un tiers des cas1,14. La grande majorité des infections sont causées par le Staphylococcus aureus et les streptocoques et, dans une étude où les diagnostics microbiologiques ont été confirmés, ces deux groupes pathogènes ont été cultivés dans 97 % des cas13.
Plusieurs systèmes d'évaluation ont été mis au point, notamment l'ERON15 et la classification modifiée de Dundee, qui ont été inclus dans les directives britanniques du CREST16. Toutefois, ces critères n'ont pas été largement adoptés et ont été critiqués parce qu'ils sont trop simplifiés ou qu'ils ne sont pas cliniquement robustes pour différencier les pathologies sévères11,17.
Il est intéressant de noter que des études récentes ont montré que l'incidence de la cellulite peut varier en fonction de la saison. L'une de ces études, réalisée à Denver, a montré une tendance à l'augmentation des taux d'admission pour cellulite primaire au cours des mois les plus chauds, le mois de juillet présentant un risque d'infection supérieur de 66,63 % par rapport aux mois d'hiver les plus froids18. Parallèlement, une étude menée dans le sud-ouest de Taïwan a montré que les taux de cellulite des membres inférieurs augmentaient dans les jours suivant immédiatement un typhon, ce qui suggère que les climats sujets aux inondations et aux précipitations excessives peuvent exposer les occupants à un risque de cellulite due à des organismes entériques, gram-négatifs et d'origine hydrique en raison de l'exposition à de l'eau contaminée19. L'une des explications pourrait être le trempage des extrémités pendant une période prolongée, ce qui altère les systèmes de défense naturels de l'hôte et facilite une porte d'entrée à travers la surface de la peau19. En outre, lors de catastrophes climatiques, les morsures d'animaux et d'insectes peuvent également contribuer à l'augmentation des taux d'infection18.
Pathogénie
Une fois que la surface de la peau est endommagée, une contamination bactérienne par la propre flore cutanée du patient peut se produire. Cela explique pourquoi les espèces staphylococciques et streptococciques sont les organismes les plus répandus dans la cellulite. Une infection qui réussit se développe en trois étapes : la bactérie doit d'abord adhérer aux cellules de l'hôte, puis envahir les tissus tout en échappant aux défenses de l'hôte, et enfin utiliser ses facteurs toxigènes19. La pénétration des bactéries dans la peau déclenche une réaction des cytokines et des neutrophiles. Cette réponse épidermique entraîne la production de peptides antimicrobiens et la prolifération des kératinocytes, deux phénomènes qui induisent les résultats d'examen caractéristiques de la cellulite2. La porte d'entrée n'est pas toujours évidente, d'autant plus que la cellulite peut survenir sur une peau apparemment intacte dans le contexte d'autres facteurs de risque. Dans ces cas, des fissures microscopiques se produisent dans la peau ; celles-ci deviennent irritées ou enflammées, facilitant ainsi la migration des bactéries vers l'intérieur20.
Approche clinique / microbiologie
La cellulite peut être classée en formes non purulentes et purulentes en fonction de la présentation clinique. La cellulite non purulente, classiquement causée par des streptocoques, se présente comme une zone unilatérale, mal délimitée, chaude et rouge, sans écoulement purulent ni abcès. A l'inverse, la cellulite purulente, classiquement causée par des staphylocoques, se développe généralement autour des plaies, des colonies ou des furoncles Dans les deux cas, on observe un œdème environnant et une sensibilité à la palpation qui peut s'étendre rapidement au fur et à mesure que l'infection progresse. D'autres caractéristiques locales peuvent inclure la nécrose locale et la formation d'abcès (après le processus de cellulite) en fonction de l'espèce bactérienne et de la sévérité de l'infection.
Le S. aureus est plus fréquemment associé à la cellulite purulente, bien que les deux espèces bactériennes puissent présenter des caractéristiques infectieuses sévères en fonction des facteurs de virulence de la souche infectante. D'autres streptocoques sont également impliqués dans la cellulite, notamment les streptocoques des groupes B, C et G. Ces streptocoques sont plus fréquents chez les personnes souffrant de diabète ou de maladies vasculaires. Lorsqu'une plaie devient chronique, la flore cutanée évolue vers une flore polymicrobienne avec une colonisation par des Gram négatifs entériques, des anaérobies ou des agents pathogènes de l'environnement. Suivant une pathogénie similaire, ces organismes peuvent provoquer une infection, souvent chez les personnes présentant des plaies non traitées, une mauvaise circulation ou des ulcères du pied diabétique21.
Des organismes plus atypiques peuvent être impliqués dans la cellulite, notamment ceux observés lors de morsures d'animaux, d'expositions à l'eau douce ou à l'eau salée ou à des aquariums. Ceux-ci sont souvent identifiés grâce à une anamnèse minutieuse et nécessitent des thérapies à spectre plus large qui dépassent le cadre de cette étude.
Diagnostic différentiel
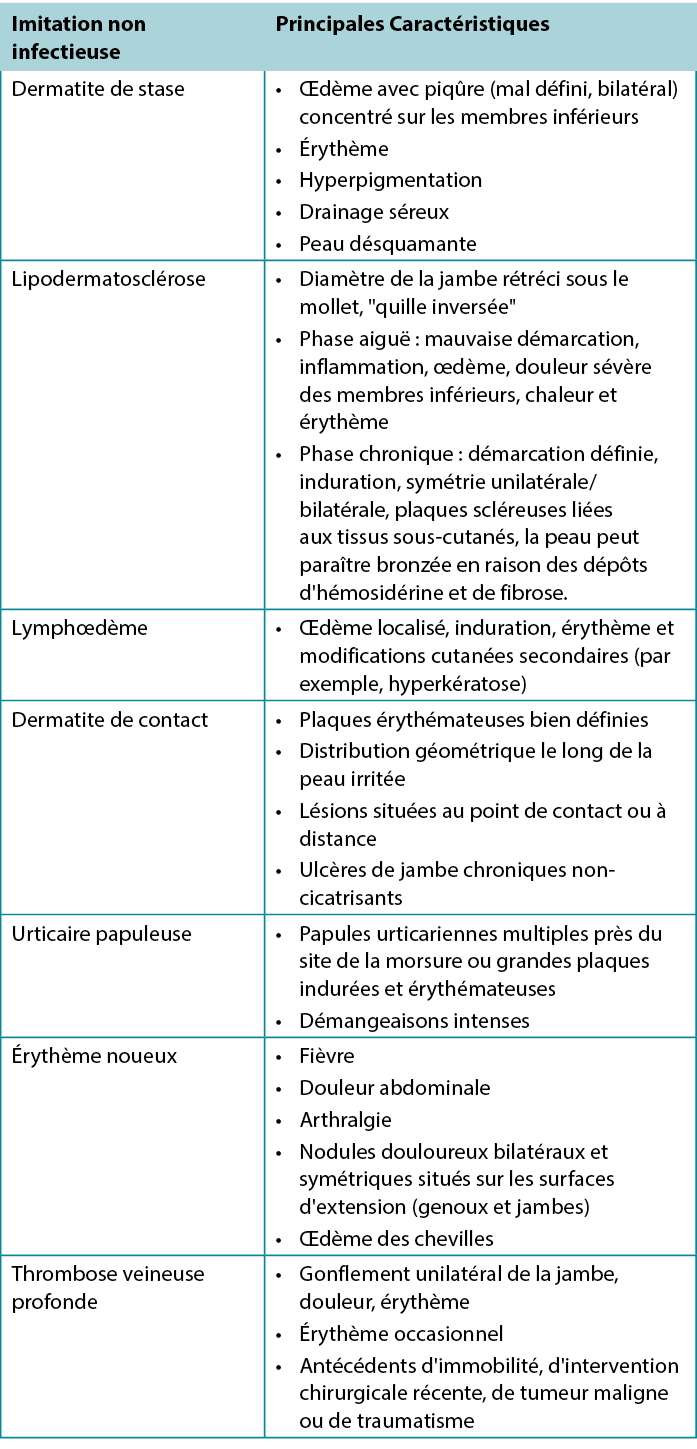
Compte tenu du large spectre des affections dermatologiques, de la nature largement subjective de l'anamnèse et de l'examen physique, et des symptômes non spécifiques (sensibilité, érythème, œdème) observés au niveau de la peau, la cellulite est souvent mal diagnostiquée22. Les syndromes qui imitent la cellulite comprennent la dermatite statique, la lipodermatosclérose et le lymphœdème ; ils sont résumés dans le tableau 122. La dermatite de stase est l'imitation la plus courante de la cellulite, bien qu'elle ait tendance à se manifester plus lentement et soit plus souvent bilatérale. Cependant, la dermatite de stase et d'autres imitations sont des facteurs de risque d'IPTM et, à ce titre, l'infection doit rester un facteur différentiel. Le lymphœdème est un œdème résultant d'un flux lymphatique anormal, quelle qu'en soit la cause, et se présente le plus souvent sous la forme d'un œdème unilatéral sans piqûre. Il peut y avoir un érythème associé dû à l'inflammation, mais la douleur et la chaleur peuvent être absentes. Parmi les autres affections susceptibles d'imiter les infections figurent la dermatite de contact et l'urticaire papuleuse, toutes deux liées à une réaction de sensibilité cutanée à un allergène ou à une piqûre d'insecte22. En général, la prise en compte d'autres facteurs tels que les signes systémiques, les tests de laboratoire et parfois une biopsie peuvent aider à poser un diagnostic dans les cas les plus difficiles23.
Tableau 1. Caractéristiques des imitations non infectieuses de la cellulite
La différenciation entre l'érysipèle et la cellulite est souvent difficile, mais n'est pas toujours cliniquement pertinente. L'érysipèle, par définition, touche l'épiderme superficiel, alors que la cellulite touche le derme et les tissus sous-cutanés24. La cellulite et l'érysipèle ont des présentations cliniques similaires, mais la cellulite se présente généralement sous la forme d'une tache érythémateuse plate. L'érysipèle, cependant, peut être surélevé et tend à être mieux délimité que la cellulite, avec des marges claires entre la peau infectée et la peau non infectée25. En outre, l'érysipèle est plus classiquement décrit au niveau du visage25. Chez les personnes à la peau claire, les lésions diffèrent également en couleur, la cellulite étant plus rose et l'érysipèle étant décrite classiquement comme "rouge saumon". Sur le plan clinique, l'érysipèle et la cellulite sont traités avec des agents similaires et pour une durée similaire24.
Une dernière considération différentielle importante concerne les IPTM nécrosantes, y compris la fasciite nécrosante. Si les modifications cutanées érythémateuses sont communes aux deux, la fasciite nécrosante a tendance à être extrêmement douloureuse, au-delà de ce que le clinicien attendrait des modifications cutanées présentes. Contrairement à la cellulite, des symptômes systémiques apparaissent souvent, notamment de la fièvre, de l'hypotension, de la tachycardie ou une altération de l'état de conscience, mais ces signes peuvent apparaître tardivement dans l'évolution de la maladie26. En outre, il peut y avoir des cloques, des bulles, une décoloration de la peau, une crépitation (présence de gaz sous la peau), une douleur et une extension rapide de l'érythème dans les heures qui suivent26.
Thérapie
Le degré de sévérité clinique détermine le type de traitement nécessaire pour la cellulite ; un guide détaillant les approches thérapeutiques est disponible ailleurs24. Les cas de cellulite qui ne présentent pas de signes systémiques d'infection (fièvre, tachycardie) peuvent être traités avec un agent antimicrobien oral actif contre les streptocoques uniquement (cas bénins). Les cas modérément sévères peuvent nécessiter l'administration d'antimicrobiens par voie intraveineuse dans un premier temps, puis d'antibiotiques par voie orale après une période d'amélioration. Pour les infections graves, une couverture empirique contre le S. aureus résistant à la méthicilline (SARM) peut être envisagée en fonction du lieu de l'infection, des facteurs de risque et de la prévalence locale du SARM. En cas de cellulite purulente, l'incision et le drainage peuvent être indiqués en plus des thérapies antimicrobiennes.
Bien qu'il existe des descriptions classiques pour différencier la cellulite streptococcique de la cellulite staphylococcique, les distinctions ne sont généralement pas claires et, par conséquent, des agents ayant une activité contre les deux types de cellulite sont souvent utilisés. Pour le traitement, les pénicillines à activité staphylococcique ou les céphalosporines sont fréquemment utilisées, ces dernières étant également utilisées en cas d'allergie à la pénicilline - en cas de réactions sévères, d'autres classes seront envisagées. Les améliorations cliniques accusent souvent un retard de 24 à 48 heures par rapport au traitement antimicrobien et l'érythème peut parfois se prolonger27. Dans ce cas, il convient souvent de poursuivre le traitement et de le réévaluer au bout de 72 heures, lorsque la réponse inflammatoire de l'organisme commence à s'atténuer. En l'absence d'amélioration au bout de 72 heures, il peut être nécessaire de réévaluer le diagnostic ou le choix du traitement.
Prévention
Comme décrit ci-dessus, la récidive est fréquente et coûteuse dans le cas de la cellulite, chaque épisode supplémentaire causant davantage de dommages inflammatoires au système lymphatique, perpétuant ainsi le problème28. Les options de prévention non pharmacologiques comprennent l'hydratation régulière, la prévention des infections de l'espace des orteils (tinea pedis), la perte de poids, l'exercice régulier et la thérapie de compression de la jambe inférieure (par exemple, les bas de compression29). Bien qu'il n'y ait aucune preuve que les solutions topiques préviennent la cellulite, il a été démontré que les pommades antibiotiques topiques réduisent l'infection dans les lacérations et les plaies aiguës28,30. Après avoir mis en œuvre les options non pharmacologiques ci-dessus, si la cellulite récurrente reste un problème, la pénicilline suppressive à faible dose s'est avérée efficace pour prévenir la cellulite récurrente27.
Études de cas
Cas 1
Mme Lee est une femme de 35 ans, par ailleurs en bonne santé, qui présente depuis deux jours de la fièvre, des rougeurs, des douleurs et un gonflement autour de l'oreille gauche. Il n'y a pas eu de traumatisme ou de blessure récente. Il n'y a pas d'antécédents d'affections dermatologiques de la tête ou du cou, y compris d'eczéma. L'examen physique révèle une fièvre de 38,5˚C, une fréquence cardiaque de 90 battements par minute et une tension artérielle de 95/60 (normale). L'examen de l'oreille gauche révèle une membrane tympanique normale, sans drainage ni lésion. La patiente présente un érythème et une induration marqués autour de l'oreille gauche et les ganglions pré-auriculaires sont sensibles. On note la présence d'un "creux d'oreille" ou sinus préauriculaire à proximité du tragus de l'oreille gauche (figure 1).
Interrogée plus avant, Mme Lee révèle que sa mère avait un sinus similaire qui s'était infecté à la trentaine et avait dû être enlevé chirurgicalement. Mme Lee est mise sous céfazoline 2g IV toutes les 8 heures pendant 72 heures via une pompe parentérale à domicile, après quoi son état s'améliore de 40 %. Elle passe à 500 mg de céphalexine PO quatre fois par jour pendant quatre jours pour un traitement total de sept jours. Elle est également orientée vers le service d'oto-rhino-laryngologie pour envisager l'ablation chirurgicale du sinus une fois les symptômes disparus.
Dans le cas 1, nous observons une présentation atypique de la cellulite de l'oreille externe, le facteur de risque probable étant la variante anatomique décrite. La thérapie ciblant les staphylocoques et les streptocoques apporte une amélioration clinique. Pour éviter une récidive, une consultation et une intervention chirurgicale peuvent être nécessaires.

Figure 1. Étude de cas 1.
Cas 2
M. Brown est un homme d'affaires de 56 ans qui n'a pas d'antécédents médicaux et ne souffre pas d'obésité. Il se présente au service des urgences avec un historique de 48 heures de jambe inférieure gauche enflée, érythémateuse et douloureuse après un voyage d'un mois en Turquie. Il vient de rentrer chez lui après un vol de plus de 8 heures. La douleur est apparue avant le vol mais s'est aggravée ces derniers jours. Au service des urgences, il est légèrement tachycarde (HR105), normotendu et afébrile. Les autres marqueurs hémodynamiques sont dans les limites de la normale. Ses analyses sanguines révèlent une numération des globules blancs de 16 000 et une CRP élevée. Les autres paramètres de laboratoire sont dans les limites de la normale. Une échographie Doppler de la jambe gauche permet d'exclure une thrombose veineuse profonde.
Il n'y a pas de traumatisme ou de blessure préalable, ni de facteurs de risque apparents de cellulite. L'urgentiste pose un diagnostic de cellulite sur la base de l'historique clinique du patient, qui présente une jambe érythémateuse gonflée et douloureuse, et de l'exclusion d'une TVP. Il est mis sous céfazoline 2g IV toutes les 8 heures et renvoyé chez lui avec une pompe parentérale domestique. Il est suivi en clinique et, après 5 jours de thérapie parentérale, son état ne s'est pas amélioré. Le traitement est élargi avec une thérapie anti-SARM sous forme de doxycycline et 3 jours plus tard, l'amélioration est minime. Les antécédents complémentaires obtenus élucident des baignades fréquentes dans des piscines et des lacs d'eau douce ou salée lors de séjours à l'étranger. La décision d'interrompre la thérapie parentérale est prise à la demande du patient. Il est mis sous ciprofloxacine orale hautement biodisponible pour une couverture empirique des infections à Gram négatif, en plus de la couverture des infections à Gram positif/SARM fournie par la doxycycline. Cinq jours plus tard, la rougeur, l'érythème et le gonflement ont diminué de 80 %. Il suit une cure de 7 jours de cette thérapie combinée.
Le cas 2, quant à lui, introduit deux considérations uniques. La première est la nécessité d'exclure d'éventuelles causes différentielles, en l'occurrence une thrombose veineuse profonde, compte tenu des antécédents de vols long-courriers. La deuxième considération concerne les organismes autres que les staphylocoques et les streptocoques. Comme nous l'avons vu, les thérapies habituelles devraient permettre d'obtenir une amélioration dans les 72 heures. Si ce n'est pas le cas, il est souvent important de réexaminer les antécédents et la situation différentielle. Dans le cas présent, des antécédents d'expositions multiples à l'eau ont été découverts, ce qui amène le clinicien à envisager des thérapies ciblant les pathogènes gram-négatifs et environnementaux. L'amélioration finale sous traitement anti-gram négatif confirme le diagnostic.
Conclusion
La cellulite et les infections nosocomiales représentent une charge de plus en plus lourde pour le système de santé dans le monde entier, en raison de l'augmentation de l'âge et des comorbidités. Le diagnostic et la prise en charge posent des défis majeurs en raison de l'absence d'étalon-or, de la variabilité inter-clinique et du grand nombre d’imitations. Cependant, les nouvelles données sur la prévention offrent une occasion unique de prévenir la morbidité et d'éviter des coûts de santé supplémentaires.
Conflit d'intérêt
Les auteurs ne déclarent aucun conflit d'intérêt.
Financement
Les auteurs n'ont reçu aucun financement pour cette étude.
Author(s)
Caley Shukalek†
MD, MSc
Department of Medicine, University of Calgary, Calgary, AB, Canada
Vidhi Desai†
BSc student
University of Calgary, Calgary, AB, Canada
Brandon Christensen
MD
Department of Medicine, University of Calgary, Calgary, AB, Canada
Christopher Lata
MD, MSc
Department of Medicine, University of Calgary, Calgary, AB, Canada
Ranjani Somayaji*
MD, MPH
Assistant Professor, Departments of Medicine and Microbiology, Immunology & Infectious Disease, Cumming School of Medicine, University of Calgary, 3330 Hospital Drive NW,
Calgary, AB T2N 4N1, Canada
Email rsomayaj@ucalgary.ca
* Corresponding author †Co-first authors
References
- Raff AB, Kroshinsky D. Cellulitis: a review. JAMA 2016;316:325–37.
- Brown BD, Hood Watson KL. Cellulitis. Treasure Island (FL): StatPearls Publishing; 2022 [cited 2022 May 31]. Available from: https://www.ncbi.nlm.nih.gov/books/NBK549770/
- Miller LG, Eisenberg DF, Liu H, Chang CL, Wang Y, Luthra R, et al. Incidence of skin and soft tissue infections in ambulatory and inpatient settings, 2005–2010. BMC Infect Dis 2015 Aug 21;15(1).
- Peterson RA, Polgreen LA, Cavanaugh JE, Polgreen PM. Increasing incidence, cost, and seasonality in patients hospitalized for cellulitis. Open Forum Infect Dis 2017 Jan 1;4(1).
- Weng QY, Raff AB, Cohen JM, Gunasekera N, Okhovat JP, Vedak P, et al. Costs and consequences associated with misdiagnosed lower extremity cellulitis. JAMA Dermatol 2017 Feb 1;153(2):141–6.
- Patel M, Lee SI, Akyea RK, Grindlay D, Francis N, Levell NJ, et al. A systematic review showing the lack of diagnostic criteria and tools developed for lower-limb cellulitis. Br J Dermatol 2019;181:1156–65.
- Somayaji R. Approach to skin and soft tissue infections. WCET J 2016;36(2):20–4.
- Shukalek C, Parsons L, Somayaji R. Delving into skin and soft tissue infections (SSTI). Part II: Focus on superficial infections. WCET J 2017 Jul;37(3):20–4.
- Dupuy A, Benchikhi H, Roujeau JC, Bernard P, Vaillant L, Chosidow O, et al. Risk factors for erysipelas of the leg (cellulitis): case-control study. BMJ 1999 Jun 12;318:1591–4.
- Björndóttir S, Gottfredsson M, Thórisdóttir AS, Gunnarsson GB, Ríkardsdóttir H, Kristjánsson M, et al. Risk factors for acute cellulitis of the lower limb: a prospective case-control study. Clin Infect Dis 2005 Nov 15 [cited 2022 Oct 1];41(10):1416–22. Available from: https://pubmed.ncbi.nlm.nih.gov/16231251/
- Sullivan T, de Barra E. Diagnosis and management of cellulitis. Clin Med 2018 Apr 1 [cited 2022 Oct 1];18(2):160. Available from: /pmc/articles/PMC6303460/
- Ellis Simonsen SM, van Orman ER, Hatch BE, Jones SS, Gren LH, Hegmann KT, et al. Cellulitis incidence in a defined population. Epidemiol Infect 2006 Apr;134(2):293–9.
- Jenkins TC, Sabel AL, Sarcone EE, Price CS, Mehler PS, Burman WJ. Skin and soft-tissue infections requiring hospitalization at an academic medical center: opportunities for antimicrobial stewardship. Clin Infect Dis 2010 Oct 15 [cited 2022 Oct 1];51(8):895–903. Available from: https://pubmed.ncbi.nlm.nih.gov/20839951/
- Gunderson CG, Cherry BM, Fisher A. Do patients with cellulitis need to be hospitalized? A systematic review and meta-analysis of mortality rates of inpatients with cellulitis. J Gen Intern Med 2018;33:1553–60.
- Eron LJ, Lipsky BA, Low DE, Nathwani D, Tice AD, Volturo GA. Managing skin and soft tissue infections: expert panel recommendations on key decision points. J Antimicrob Chemother 2003 Nov [cited 2022 Oct 1];52 Suppl 1. Available from: https://pubmed.ncbi.nlm.nih.gov/14662806/
- Fulton R, Doherty L, Gill D. Guidelines on the management of cellulitis in adults. Northern Ireland: CREST; 2005.
- Ki V, Rotstein C. Bacterial skin and soft tissue infections in adults: a review of their epidemiology, pathogenesis, diagnosis, treatment and site of care. Can J Infect Dis Med Microbiol 2008 [cited 2022 Oct 1];19(2):173–84. Available from: https://pubmed.ncbi.nlm.nih.gov/19352449/
- Peterson RA, Polgreen LA, Sewell DK, Polgreen PM. Warmer weather as a risk factor for cellulitis: a population-based investigation. Clin Infect Dis 2017 Oct 1;65(7):1167–73.
- Lin PC, Lin HJ, Guo HR, Chen KT. Epidemiological characteristics of lower extremity cellulitis after a typhoon flood. PLoS One 2013 Jun 13;8(6).
- Habif TP. Cellulitis and erysipelas section of bacterial infections: In: Habif TP. Clinical dermatology: a color guide to diagnosis and therapy. 5th ed. Philadelphia, PA: Mosby; 2010. p. 342–350.
- Pitocco D, Spanu T, di Leo M, Vitiello R, Rizzi A, Tartaglione L, et al. Diabetic foot infections: a comprehensive overview. Eur Rev Med Pharmacol Sci 2019;23(2):26–37.
- Keller EC, Tomecki KJ, Alraies MC. Distinguishing cellulitis from its mimics. Cleve Clin J Med 2012;79:547–52.
- Bailey E, Kroshinsky D. Cellulitis: diagnosis and management. Dermatol Ther 2011;24:229–39.
- Stevens DL, Bisno AL, Chambers HF, Dellinger EP, Goldstein EJC, Gorbach SL, et al. Executive summary: practice guidelines for the diagnosis and management of skin and soft tissue infections: 2014 update by the Infectious Diseases Society of America. Clin Infect Dis 2014 Jul 15;59(2):147–59.
- Stevens DL, Bryant AE. Streptococcus pyogenes: basic biology to clinical manifestations: impetigo, erysipelas and cellulitis. University of Oklahoma Health Sciences Center; 2016 [cited 2022 May 31]. Available from: https://www.ncbi.nlm.nih.gov/books/NBK333408
- Bystritsky R, Chambers H. Cellulitis and soft tissue infections. Ann Intern Med 2018 Feb 6;168(3):ITC17–31.
- Thomas KS, Crook AM, Nunn AJ, Foster KA, Mason JM, Chalmers JR, et al. Penicillin to prevent recurrent leg cellulitis. N Engl J Med 2013 May 2 [cited 2022 Oct 1];368(18):1695–703. Available from: https://pubmed.ncbi.nlm.nih.gov/23635049/
- Dire DJ, Coppola M, Dwyer DA, Lorette JJ, Karr JL. Prospective evaluation of topical antibiotics for preventing infections in uncomplicated soft-tissue wounds repaired in the ED. Acad Emerg Med 1995 Jan 1 [cited 2022 Oct 1];2(1):4–10. Available from: https://onlinelibrary.wiley.com/doi/full/10.1111/j.1553-2712.1995.tb03070.x
- Webb E, Neeman T, Bowden FJ, Gaida J, Mumford V, Bissett B. Compression therapy to prevent recurrent cellulitis of the leg. New Eng J Med 2020 Aug 13;383(7):630–9.
- Singer AJ, Dagum AB. Current management of acute cutaneous wounds. N Engl J Med 2008 Sep 4 [cited 2022 Oct 1];359(10):1037–46. Available from: https://pubmed.ncbi.nlm.nih.gov/18768947/
