Volume 43 Number 2
WHAM evidence summary: sugar dressing for wound healing and treating wound infection in resource limited settings
Emily Haesler
Keywords Traditional wound management, sugar dressing, sugar paste
For referencing Haesler E. WHAM evidence summary: sugar dressing for wound healing and treating wound infection in resource limited settings . WCET® Journal 2023;43(2):35-40
DOI https://doi.org/10.33235/wcet.43.2.35-40
Clinical question
What is the best available evidence for sugar dressing improving wound healing and for reducing signs and symptoms of wound infection?
Summary
Granular/crystalized white sugar is readily accessible at low cost in most geographic regions. It has been used as a wound treatment for hundreds of years because it is sterile, non-toxic, absorbs fluid and has some antimicrobial properties1. Sugar is most often used in its granular form, packed into a wound cavity and secured with a wound dressing. Alternatively, it is ground into a powder, combined with glycerine or petroleum jelly and applied as a paste1, 2. There was no evidence comparing the effectiveness of sugar to modern dressings that promote moist wound healing. Level 1 evidence3, 4 at high risk of bias showed sugar dressing was associated with acceptable wound healing rates3, 4 and reduction in wound infection4, but might not be as effective as Edinburgh University Solution of Lime (EUSOL)3 or honey4, which are both commonly used in settings with limited resources. Level 35-7 and 48-15 evidence at moderate or high risk of bias provided evidence that sugar dressing might promote healing5, 6, 8, 9, 11-15, improve the wound bed tissue5, 9, 13-15, and reduce bacterial infection6, 12-15, wound pain5, and wound malodour7, 10.
Clinical practice recommendations
All recommendations should be applied with consideration to the wound, the person, the health professional and the clinical context.
|
Sugar dressing could be considered for use as a natural wound dressing to reduce signs and symptoms of infection and to promote healing when there is limited access to modern wound dressings (Grade B). |
Sources of evidence: search and appraisal
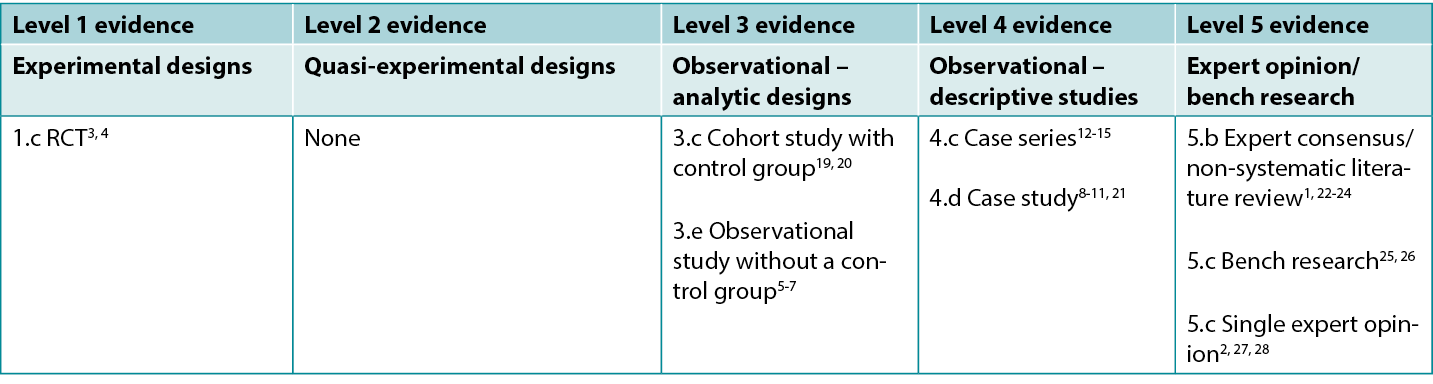
This summary was conducted using methods published by the Joanna Briggs Institute16-18. The summary is based on a systematic literature search combining search terms related to sugar dressing and wound healing. Searches were conducted for evidence reporting use of granulated sugar in human wounds published up to December 2022 in English in the following databases: Cumulative Index to Nursing and Allied Health Literature (CINAHL), Medline (Ovid), Google Scholar, Embase (Ovid), AMED and Health Internetwork Access to Research Initiative (Hinari, access via Research4Life) and Cochrane Library. Studies on other sugar sources (e.g., honey) or sugar combined with povidone-iodine (Knutson’s formula) were not eligible for inclusion (excepting when reported as a comparator). Levels of evidence for intervention studies are reported in Table 1.
Table 1: Levels of evidence for clinical studies
Background
Sugar has been used since the late 1600s as a wound cleanser and the early 1700s as a treatment to promote wound healing1, 22. It is readily accessible at a very low cost in most geographic regions. In its granular/crystalized form, sugar consists of glucose and fructose, bound together to form sucrose (a disaccharide)13, 26. Sugar is present as a monosaccharide in other natural treatments, including honey, saps and fruit22. In its crystalized form, sugar’s mechanism for wound healing is different than that of honey and fruits. Crystalized sugar is sometimes used in combination with povidone-iodine to treat wounds29-33, and is commercially marketed as a sugar-povidone-iodine paste in some countries. The evidence for sugar in other natural forms (e.g., honey) and in combination with povidone iodine is not reported in this evidence summary, excepting as a comparator to sugar dressing.
There are several mechanisms through which granular white sugar is presumed to promote wound healing. First, sugar is hygroscopic; that is, it absorbs moisture from the environment around it, contributing to reduction in wound exudate22, 28. This also leads to mechanical debridement through slough adherence to the sugar dressing for removal without damage to healthy tissue1, 3, 22. In addition, sugar’s hygroscopic property contributes to autolytic debridement13, and reduction of edema in the wound bed and surrounding tissues1, 13.
Sugar increases osmolality of the wound environment, which influences water level activity. This mechanism attracts lymphocytes and macrophages to the wound bed1, and can inhibit the growth of bacteria5, 7, 25, 26. Sugar also releases hydrogen peroxide at low, non-toxic levels, which further inhibits bacteria activity7, 13, 27. Invitro studies have demonstrated sugar’s activity against a range of bacteria, including S. aureus, P aeruginosa, S. faecalis, E. coli, K. pneumoniae, and C. albicans5, 8, 25; and this was supported in an in-vivo study reported below4. In comparison to many other antiseptics, sugar has low toxicity and lowers the wound bed pH to around 5.0, which is more conducive to healing than an alkaline pH1, 7.
Clinical evidence on sugar dressing
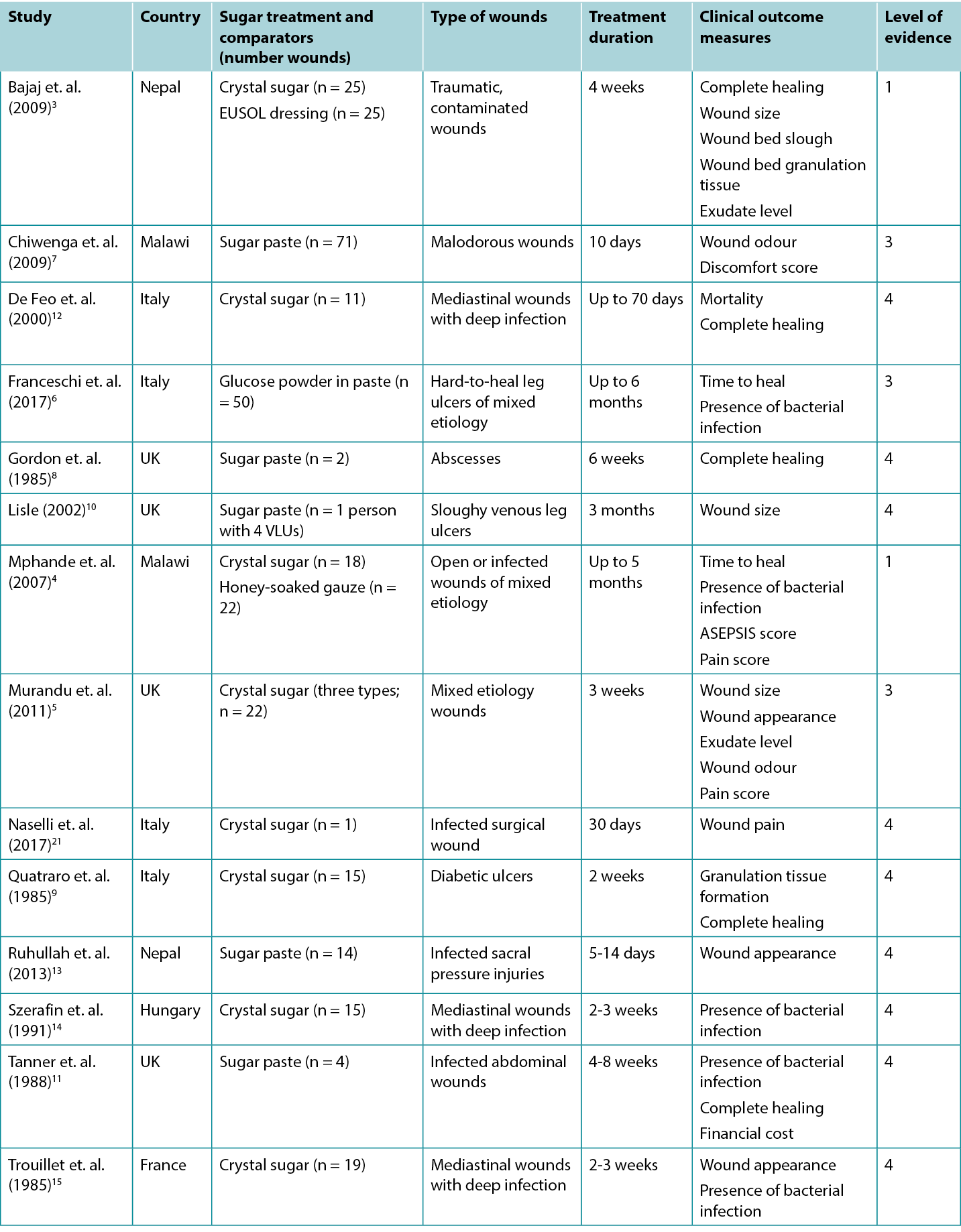
Studies reporting clinical outcomes for treatment with sugar dressings are summarised in Table 2.
Table 2: Summary of the evidence for traditional sugar dressing/paste
Sugar dressing for promoting wound healing
An RCT3 (n = 50 wounds) that was at high risk of bias compared sugar dressing to EUSOL dressing for treating traumatic, contaminated wounds associated with bone injuries. EUSOL is a traditional hypolochlorite made from chlorinated lime and boric acid34. In both groups the wounds were lavaged with normal saline. The sugar group received granulated white sugar plus a gauze dressing. The EUSOL group received a 30-minute EUSOL soak followed by packing with EUSOL gauze. Both groups received concurrent systemic antibiotics based on culture and sensitivity of organisms in the wounds. After four weeks both groups had good healing rates, but the EUSOL group showed superiority (77% healed versus 66% healed, p < 0.05). The EUSOL group had a 1.23 times higher likelihood of achieving healing within four weeks. The EUSOL group also had superior outcomes on other measures including wound size and wound bed tissue type3 (Level 1).
A second RCT4 (n = 40) that was at high risk of bias compared sugar dressing to a honey dressing in open or infected wounds in children and adults. Debris was removed using saline and gauze, then wounds were either packed with granulated sugar or with honey-soaked gauze. Dressings were initially performed daily, increasing to weekly based on wound condition. After two weeks of treatment, the median healing rate was higher in the honey group (3.8 cm2/week versus 2.2 cm2/week, p = not reported). Median time to complete healing was shorter in the honey group (31.5 days [range 14 – 98] versus 56 days [range 21 – 133]). Both treatments were considered effective. Honey was reported as superior; however, no statistical analysis was reported to support this conclusion4 (Level 1).
In a proof-of-concept study at high risk of bias5, 22 wounds of mixed etiology were treated with a sugar dressing for three weeks. At baseline, the wounds had sloughy/necrotic tissue and moderate to heavy exudate levels. Wounds were cleansed, packed with granulated sugar and an absorbent pad applied, either daily or twice daily. There was progressive improvement in wound bed appearance for all the wounds over the short study period, and a reduction in mean wound area (baseline mean: 34.7 cm2 [range 6–144]; 3-week mean: 28.9 cm2 (range 4.63 – 142.4])5 (Level 3).
Several case studies8-11 at high risk of bias reported successful healing of hard-to-heal wounds with various sugar preparations. In one8, two people with complex abscesses that had previously failed to heal with surgical debridement and EUSOL gauze packing achieved complete healing within six weeks of commencing treatment with sugar paste (powdered sugar combined with polyethylene glycol and hydrogen peroxide)8. Quatraro et. al. (1985)9 reported that packing diabetic ulcers (n = 15) with sugar replaced every 3 to 4 hours was associated with rapid wound bed granulation (5 to 6 days) and complete healing within 12 days9. Another case report10 described the use of sugar paste replaced daily to reduce wound malodour and heal multiple, sloughy, partial thickness leg ulcers in one person. Finally, Tanner et. al. (1988)11 reported four cases in which sugar paste was applied to infected abdominal wounds to achieve healing within 4 to 8 weeks. In this report, thicker sugar paste was applied directly to open wound beds, and a thinner sugar paste (with increased volume of polyethylene glycol and hydrogen peroxide) was installed into abscess cavities with a syringe and catheter11 (Level 4).
Sugar dressing for signs and symptoms of wound infection
In an observational study6 (n = 50) at high risk of bias, hard-to-heal leg ulcers were selected for trial of a 60% sugar powder and 40% petroleum jelly paste preparation. At baseline, wound swabs were taken, with results showing bacterial presence in 100% of ulcers. Treatment was wound cleansing with tap water (no debridement performed), weekly application of the sugar paste, bandaging and etiological-based management (e.g., compression therapy or conservative hemodynamic correction of venous insufficiency [CHIVA]). A second wound swab was performed at 30 to 40 days; 100% of ulcers were bacteria-free. Complete healing rate was 96%, with a mean healing time of 109 days6 (Level 3).
Another observational study7 (n = 71) at high risk of bias explored sugar paste to manage wound odour and pain. Malodorous wounds selected for treatment had a mean baseline odour score of 5.45 that reduced to 2.94 at ten days of treatment (score rated from 1 to 10, where 10 was worst odour). Patient-rated discomfort reduced from a mean of 6.73 to 3.87 (score from 1 to 10, where 10 was worst pain)7 (Level 3).
A case series12 (n = 11) at high risk of bias reported outcomes for mediastinal wound infection following cardiac surgery when treated with sugar dressing. On detection of wound infection, surgical exploration, debridement and povidone iodine irrigation were performed, and the wound was surgically closed. However, wound infection did not resolve for any participants. The sternal wound was re-opened, and sugar dressing was performed up to four times daily until complete healing or flap reconstruction. Mean time to resolution of infection (based on microbiological assessment) after sugar dressing commenced was 11.22 ± 1.6 days. Mean duration of sugar dressing was 44 ± 27.8 days12 (Level 4). In a later report19, 20 at moderate risk of bias, the researchers compared this cohort to two other cohorts with mediastinal wound infection following cardiac surgery that received different treatments based on a range of standardized protocols at the time of their admission. Mortality rates were significantly better for sugar dressing versus conservative treatment/closed irrigation (30.6% versus 2.4%, p < 0.05), but mortality was higher for people treated with sugar dressing versus negative pressure wound therapy (1.8% versus 2.4%, p < 0.05)19. However, all the people in this study were critically ill and it was not evident that the type of dressing influenced mortality outcomes (Level 3). Other small case series at high risk of bias13-15 achieved similar clinical outcomes in both surgical wounds14, 15 and chronic wounds13 using sugar dressing14, 15 or paste13 to resolve local wound infection, debride the wound bed and promote granulation in preparation for surgical repair (Level 4).
The RCT4 comparing sugar to honey dressings evaluated signs and symptoms of infection with microbiological assessment, ASEPSIS score and pain assessment (categorically described as no pain, moderate pain or severe pain). Both groups showed similar reduction in signs and symptoms of wound infection. After one week of treatment, the percent of wounds treated with sugar that returned positive cultures reduced from baseline (52% to 39%). The median ASEPSIS score for sugar-treated wounds showed a reduction in the first three weeks (8.3 points/week) and the percent of people describing severe pain during dressing changes or with movement also reduced4 (Level 1).
In the short proof-of-concept study described above, Murandu et. al. (2011)5 reported resolution of signs and symptoms of infection (i.e., exudate, malodour and wound pain). Malodour completely resolved by seven days of treatment in all 11 wounds that were assessed as malodorous at baseline. All 22 wounds had moderate-to-heavy exudate levels at baseline; exudate decreased in the first week and was absent or minimal for all wounds by trial end. Pain requiring opiates was reported by five people at baseline, and this resolved within three days of treatment5 (Level 3).
Considerations for use
Preparation and use of sugar dressing
The studies included in this evidence summary used various methods to apply sugar to the wound. Some researchers5, 9, 15 packed granular white sugar directly into the wound cavity and retained it with gauze, absorbent pad, dry gauze or adhesive dressing (see Table 3 for an example of a recommended application method24). Muranda et. al. (2011)5 described using yellow paraffin to build a ‘ridge’ around wounds in awkward anatomical locations (e.g., heels) to further assist in retaining sugar in the wound. In these studies, packing sugar directly into the wound required replacement of the sugar dressing at least twice daily to maintain a well-packed wound cavity5, 9, 15, because sugar combines with wound exudate and drains from the wound7. Other researchers describe the addition of glycerin or petroleum jelly to make a sugar paste that could more easily be retained in the wound6-8, 13 and had a consistency that eased application7.
Table 3: One method for applying sugar to a wound

Adverse effects
- Some people reported a burning pain on application of sugar dressing that resolved quickly5, 7. Sugar has also been reported to cause itching of the peri-wound skin.24 These effects are thought to occur due to the drying effect sugar has on the wound bed and might be reduced by using a sugar paste in preference to granular sugar28.
- Evidence on the effect of topically applied sugar on blood sugar levels in people with diabetes is mixed. Sugar is a disaccharide (i.e., glucose and fructose combine to form sucrose) that is absorbed through the intestines, so theoretically it should not influence blood sugar levels when applied to a wound bed1, 23, 35. Some studies explored and confirmed that applying sugar to a wound does not influence blood sugar levels5, 15; however, there was one case report in which raised blood sugar level was observed1, 22, and in another study people with diabetes were given higher insulin doses20.
- There is one report of acute kidney failure associated with sugar paste23. In some of the reports12, 14, 15, people who had a wound treated with sugar dressing died; however, these people had serious disease and death was likely not related to the sugar dressing.
Other considerations
- White granulated sugar is considered sterile. Care should be taken to guarantee the product used is not contaminated and that sterility is maintained (e.g., if powdering the sugar).
- The evidence in this summary came from settings with limited access to wound care resources. Consider the medico-legal implications of using a sugar dressing in resource-rich settings.
- Optimal frequency of sugar dressing replacements is twice daily7, 13, 21, 26 to maintain sufficient osmolality and hydrogen peroxide production to sustain inhibition of bacteria22, 27. However, this is rarely possible in resource-limited settings7. Numerous studies reported wound dressing frequencies of up to 5 to 7 days4, 6, 7, 13, particularly after wound exudate reduces.
- Patient and health practitioner satisfaction levels were reported to be high in one study, and in this study feasibility of people performing their own sugar dressing in the community was demonstrated5.
- Sugar is reported to have a lower attraction to flies than honey, which may be a consideration when selecting a wound dressing in resource-limited settings28.
- Sugar paste was prepared by a hospital pharmacy from by using powdered, additive-free sugar combined with polyethylene glycol and hydrogen peroxide11, with ratio of ingredients varying based on the viscosity required for ease of application. Hydrogen peroxide is not recommended for use in cavity wounds and sterility might not be maintained when powdering the sugar.
- A cost comparison that considered cost of dressing materials and community nursing time for a four-month treatment regime in the 1980s in the UK reported a sugar paste dressing to be a cheaper option than gauze or paraffin gauze11.
Conflicts of interest
The author declares no conflicts of interest in accordance with International Committee of Medical Journal Editors (ICMJE) standards.
About WHAM evidence summaries
WHAM evidence summaries are consistent with methodology published in Munn Z, Lockwood C, Moola S. The development and use of evidence summaries for point of care information systems: A streamlined rapid review approach, Worldviews Evid Based Nurs. 2015;12(3):131-8.
Methods are outlined in resources published by the Joanna Briggs Institute16-18 and on the WHAM Collaborative website: http://WHAMwounds.com. WHAM evidence summaries undergo peer-review by an international, multidisciplinary Expert Reference Group. WHAM evidence summaries provide a summary of the best available evidence on specific topics and make suggestions that can be used to inform clinical practice. Evidence contained within this summary should be evaluated by appropriately trained professionals with expertise in wound prevention and management, and the evidence should be considered in the context of the individual, the professional, the clinical setting and other relevant clinical information.
Copyright © 2023 Wound Healing and Management Collaboration, Curtin Health Innovations Research Institute, Curtin University
Synthèse de données WHAM : Pansements au sucre pour la cicatrisation des plaies et le traitement de l'infection des plaies dans des environnements aux ressources limitées
Emily Haesler
DOI: https://doi.org/10.33235/wcet.43.2.35-40
Question clinique
Quelles sont les meilleures données probantes disponibles concernant l'amélioration de la cicatrisation des plaies et la réduction des signes et symptômes d'infection des plaies grâce aux pansements au sucre ?
Synthèse
Le sucre blanc granulé/cristallisé est facilement accessible à bas prix dans la plupart des régions géographiques. Il est utilisé comme traitement des plaies depuis des centaines d'années car il est stérile, non toxique, absorbe les liquides et possède certaines propriétés antimicrobiennes1. Le sucre est le plus souvent utilisé sous forme cristallisée, tassé dans la cavité d'une plaie et maintenu avec un pansement. Il peut également être réduit en poudre, mélangé à de la glycérine ou de la vaseline et appliqué sous forme de pâte1, 2. Il n'existe pas de données comparant l'efficacité du sucre à celle des pansements modernes qui favorisent la cicatrisation des plaies humides. Des données de niveau 13, 4 avec un risque élevé de biais ont montré que le pansement au sucre était associé à des taux acceptables de cicatrisation des plaies3, 4 et à une réduction des infections cutanées4, mais qu'il pourrait ne pas être aussi efficace que la solution de chaux de l'université d'Édimbourg (EUSOL)3 ou que le miel4, qui sont tous deux couramment utilisés dans des contextes où les ressources sont limitées. Des données de niveau 35-7 et 48-15 avec un risque de biais modéré ou élevé ont fourni des preuves que le pansement au sucre pouvait favoriser la cicatrisation5, 6, 8, 9, 11-15, améliorer le tissu du lit de la plaie5, 9, 13-15, et réduire l'infection bactérienne6, 12-15, la douleur cutanée5, ainsi que la mauvaise odeur de la plaie7, 10.
Recommandations pour la pratique clinique
Toutes les recommandations doivent être appliquées en tenant compte de la plaie, de la personne, du professionnel de santé et du contexte clinique.
| Le pansement au sucre pourrait être envisagé comme pansement naturel pour réduire les signes et symptômes d'infection et favoriser la cicatrisation lorsque l'accès aux pansements modernes est limité (grade B). |
Sources des données : recherche et évaluation
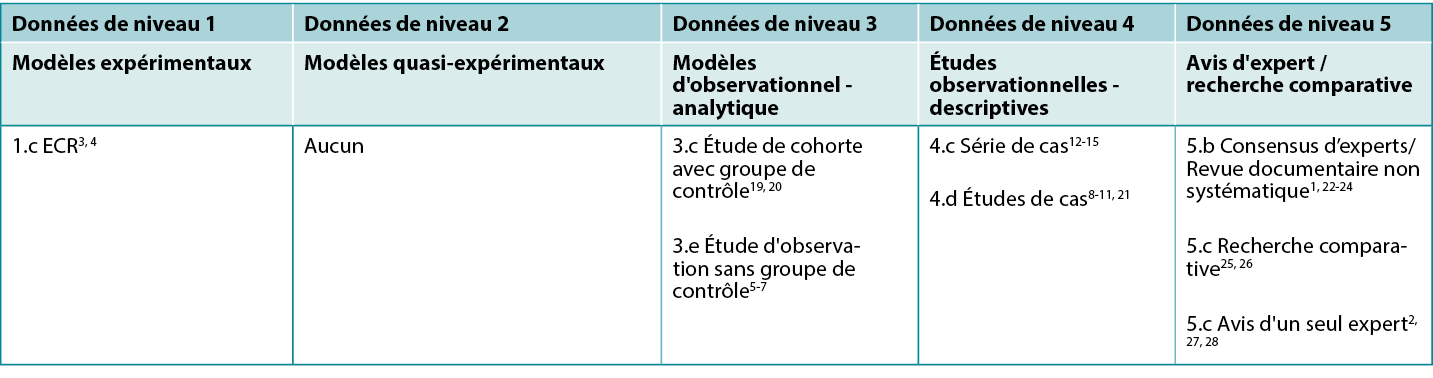
Cette synthèse a été réalisée selon les méthodes publiées par le Joanna Briggs Institute16-18. La synthèse est basée sur une recherche documentaire systématique combinant les termes de recherche associés aux pansements au sucre et à la cicatrisation des plaies. Des recherches ont été effectuées pour trouver des données probantes sur l'utilisation du sucre cristallisé dans les plaies humaines, publiées jusqu'en décembre 2022 en anglais dans les bases de données suivantes : Cumulative Index to Nursing and Allied Health Literature (CINAHL), Medline (Ovid), Google Scholar, Embase (Ovid), AMED et Health Internetwork Access to Research Initiative (Hinari, accès via Research4Life) et la bibliothèque Cochrane. Les études portant sur d'autres sources de sucre (par exemple, le miel) ou sur le sucre combiné à la povidone iodée (formule de Knutson) n'ont pas été retenues (sauf lorsqu'elles ont été rapportées en tant que comparateur). Les niveaux de données des études d'intervention sont indiqués dans le tableau 1.
Tableau 1: Niveaux de données des études cliniques
Contexte
Le sucre est utilisé depuis la fin des années 1600 comme nettoyant des plaies et depuis le début des années 1700 comme traitement pour favoriser la cicatrisation des plaies1, 22. Il est facilement accessible à un coût très faible dans la plupart des régions géographiques. Sous sa forme granulée/cristallisée, le sucre se compose de glucose et de fructose, liés ensemble pour former le saccharose (un disaccharide)13, 26. Le sucre est présent sous forme de monosaccharide dans d'autres traitements naturels, notamment le miel, les sèves et les fruits22. Sous sa forme cristallisée, le mécanisme de cicatrisation du sucre est différent de celui du miel et des fruits. Le sucre cristallisé est parfois utilisé en combinaison avec la povidone iodée pour traiter les plaies29-33, et est commercialisé dans certains pays sous la forme d'une pâte de sucre-povidone iodée. Les données concernant le sucre sous d'autres formes naturelles (par exemple, le miel) et en combinaison avec l'iode de povidone ne sont pas rapportées dans cette synthèse de données, sauf en tant que comparateur du pansement au sucre.
Il existe plusieurs mécanismes par lesquels le sucre blanc cristallisé est supposé favoriser la cicatrisation des plaies. Tout d'abord, le sucre est hygroscopique, c'est-à-dire qu'il absorbe l'humidité de l'environnement qui l'entoure, ce qui contribue à réduire l'exsudat de la plaie22, 28. Cela permet également un débridement mécanique grâce à l'adhérence des mucosités au pansement au sucre qui peut être retiré sans endommager les tissus sains1, 3, 22. En outre, la propriété hygroscopique du sucre contribue au débridement autolytique13 et à la réduction de l'œdème dans le lit de la plaie et les tissus environnants1, 13.
Le sucre augmente l'osmolalité de l'environnement de la plaie, ce qui influence l'activité du niveau d'eau. Ce mécanisme attire les lymphocytes et les macrophages vers le lit de la plaie1 et peut inhiber la croissance des bactéries5, 7, 25, 26. Le sucre libère également du peroxyde d'hydrogène à des niveaux faibles et non toxiques, ce qui inhibe davantage l'activité des bactéries7, 13, 27. Des études in vitro ont démontré l'activité du sucre contre une série de bactéries, notamment S. aureus, P. aeruginosa, S. faecalis, E. coli, K. pneumoniae et C. albicans5, 8, 25, ce qui a été confirmé par une étude in vivo décrite ci-dessous4. Par rapport à de nombreux autres antiseptiques, le sucre présente une faible toxicité et abaisse le pH du lit de la plaie à environ 5,0, ce qui est plus propice à la cicatrisation qu'un pH alcalin1, 7.
Données cliniques sur le pansement au sucre
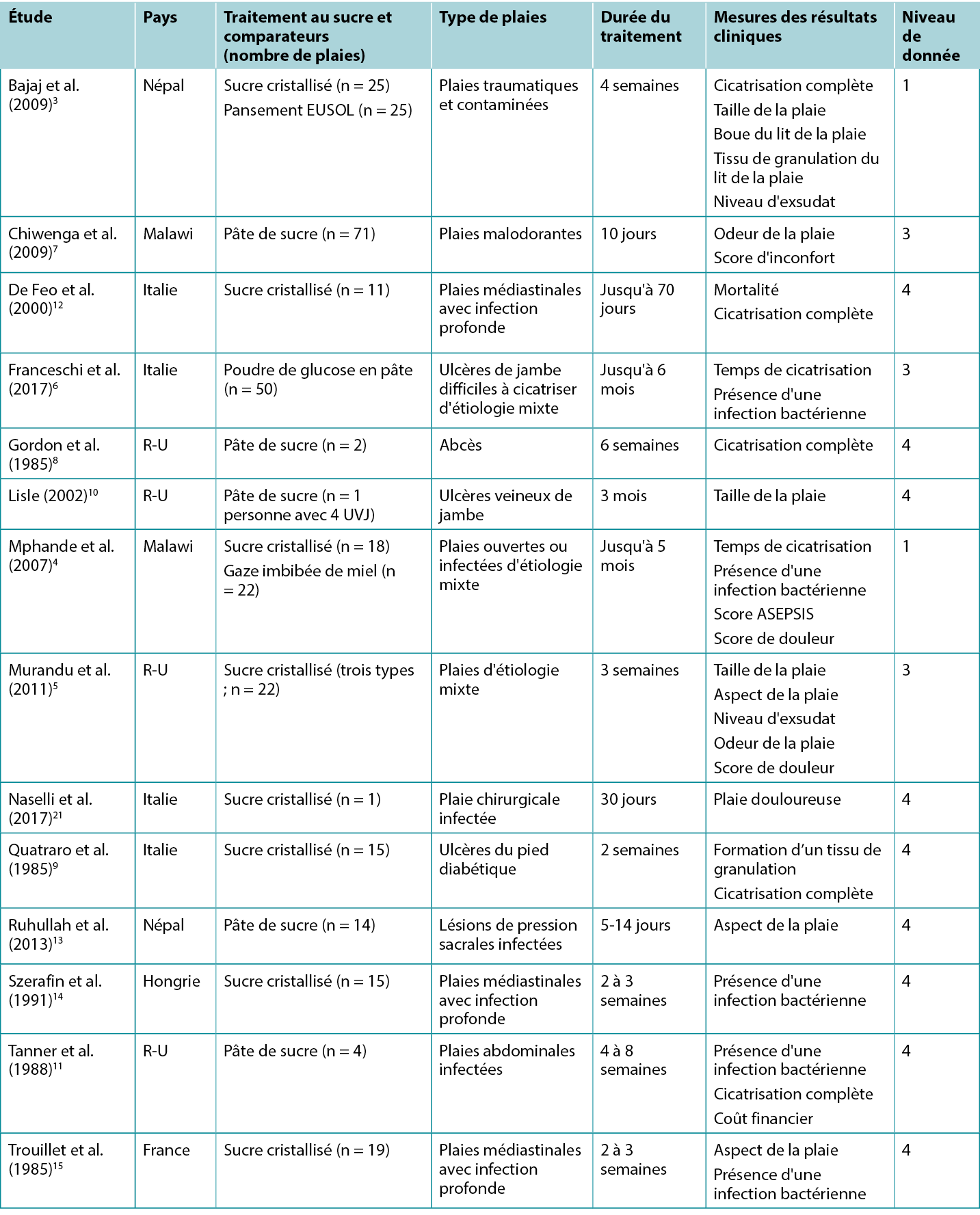
Les études rapportant les résultats cliniques du traitement avec des pansements au sucre sont résumées dans le tableau 2.
Tableau 2 : Synthèse des données probantes pour les pansements/pâtes traditionnels au sucre
Pansement au sucre pour favoriser la cicatrisation des plaies
Un ECR3 (n = 50 plaies) présentant un risque élevé de biais a comparé le pansement au sucre au pansement EUSOL pour le traitement des plaies traumatiques contaminées associées à des lésions osseuses. EUSOL est un hypolochlorite traditionnel fabriqué à partir de chaux chlorée et d'acide borique34. Dans les deux groupes, les plaies ont été lavées avec du sérum physiologique. Le groupe "sucre" a reçu du sucre blanc cristallisé et un pansement de gaze. Le groupe EUSOL a bénéficié d'un trempage de 30 minutes suivi d'un comblement avec la gaze EUSOL. Les deux groupes ont reçu des antibiotiques systémiques concomitants sur la base de la culture et de la sensibilité des organismes présents dans les plaies. Après quatre semaines, les deux groupes présentaient de bons taux de cicatrisation, mais le groupe EUSOL a montré une supériorité (77 % de cicatrisation contre 66 % de cicatrisation, p < 0,05). Le groupe EUSOL avait 1,23 fois plus de chances d'obtenir une cicatrisation dans les quatre semaines. Le groupe EUSOL a également obtenu des résultats supérieurs sur d'autres mesures, notamment la taille de la plaie et le type de tissus du lit de la plaie3 (niveau 1).
Un deuxième ECR4 (n = 40) présentant un risque de biais élevé a comparé un pansement au sucre à un pansement au miel pour des plaies ouvertes ou infectées chez des enfants et des adultes. Les débris ont été éliminés à l'aide de sérum physiologique et de gaze, puis les plaies ont été comblées soit avec du sucre cristallisé, soit avec de la gaze imbibée de miel. Les pansements étaient d'abord quotidiens, puis hebdomadaires en fonction de l'état de la plaie. Après deux semaines de traitement, le taux de cicatrisation médian était plus élevé dans le groupe miel (3,8 cm2/semaine contre 2,2 cm2/semaine, p = non rapporté). La durée médiane de la cicatrisation complète était plus courte dans le groupe miel (31,5 jours [intervalle 14 - 98] contre 56 jours [intervalle 21 - 133]). Les deux traitements ont été jugés efficaces. Le miel a été déclaré supérieur, mais aucune analyse statistique n'a été rapportée pour étayer cette conclusion4 (niveau 1).
Dans une étude de validation de concept présentant un risque élevé de biais5, 22 plaies d'étiologie mixte ont été traitées avec un pansement au sucre pendant trois semaines. Au départ, les plaies présentaient des tissus nécrotiques et des niveaux d'exsudat modérés à importants. Les plaies ont été nettoyées, comblées avec du sucre cristallisé et un tampon absorbant a été appliqué, soit quotidiennement, soit deux fois par jour. L'aspect du lit de la plaie s'est progressivement amélioré pour toutes les plaies au cours de la courte période de l'étude, et la surface moyenne de la plaie a été réduite (moyenne de départ : 34,7 cm2 [intervalle 6-144] ; moyenne sur 3 semaines : 28,9 cm2 (intervalle 4,63 - 142,4])5 (niveau 3).
Plusieurs études de cas8-11 présentant un risque élevé de biais ont fait état d'une cicatrisation réussie de plaies difficiles à cicatriser avec diverses préparations à base de sucre. Dans l'une d'entre elles8, deux personnes souffrant d'abcès complexes qui n'avaient pas cicatrisé après un débridement chirurgical et l'application de gaze EUSOL ont obtenu une guérison complète dans les six semaines suivant le début du traitement à la pâte de sucre (sucre en poudre combiné à du polyéthylène glycol et à du peroxyde d'hydrogène)8. Quatraro et al. (1985)9 ont rapporté que comblement des ulcères diabétiques (n = 15) avec du sucre remplacé toutes les 3 à 4 heures était associé à une granulation rapide du lit de la plaie (5 à 6 jours) et à une cicatrisation complète en 12 jours9. Un autre compte rendu de cas10 décrit l'utilisation d'une pâte de sucre remplacée quotidiennement pour réduire la mauvaise odeur de la plaie et guérir de multiples ulcères de jambe d'épaisseur partielle et visqueux chez une personne. Enfin, Tanner et al. (1988)11 ont décrit quatre cas dans lesquels de la pâte de sucre a été appliquée sur des plaies abdominales infectées et a permis une cicatrisation en 4 à 8 semaines. Dans ce compte-rendu, une pâte de sucre plus épaisse a été appliquée directement sur le lit des plaies ouvertes, et une pâte de sucre plus fine (avec un volume accru de polyéthylène glycol et de peroxyde d'hydrogène) a été insérée dans les cavités des abcès à l'aide d'une seringue et d'un cathéter11 (niveau 4).
Pansement au sucre pour réduire les signes et symptômes d'infection des plaies
Dans une étude d'observation6 (n = 50) présentant un risque élevé de biais, des ulcères de jambe difficiles à cicatriser ont été sélectionnés pour un essai sur une préparation de pâte composée de 60 % de sucre en poudre et de 40 % de gelée de pétrole. Au départ, des écouvillons ont été prélevés sur les plaies et les résultats ont montré la présence de bactéries dans 100 % des ulcères. Le traitement consistait en un nettoyage de la plaie à l'eau du robinet (sans débridement), une application hebdomadaire de la pâte de sucre, un bandage et une prise en charge étiologique (par exemple, thérapie par compression ou correction hémodynamique conservatrice de l'insuffisance veineuse [CHIVA]). Un deuxième écouvillonnage de la plaie a été effectué après 30 à 40 jours ; 100 % des ulcères étaient exempts de bactéries. Le taux de cicatrisation complète était de 96 %, avec une durée moyenne de cicatrisation de 109 jours6 (niveau 3).
Une autre étude d'observation7 (n = 71) présentant un risque élevé de biais a exploré la pâte de sucre pour la prise en charge de l'odeur et la douleur de la plaie. Les plaies malodorantes sélectionnées pour le traitement avaient un score d'odeur moyen de base de 5,45 qui a diminué à 2,94 après dix jours de traitement (score évalué de 1 à 10, 10 étant la pire odeur). La gêne évaluée par les patients est passée d'une moyenne de 6,73 à 3,87 (score de 1 à 10, 10 étant la pire douleur)7 (niveau 3).
Une série de cas12 (n = 11) présentant un risque élevé de biais a décrit les résultats de l'infection de la plaie médiastinale à la suite d'une chirurgie cardiaque lorsqu'elle était traitée avec un pansement au sucre. Lorsque l'infection de la plaie a été détectée, une exploration chirurgicale, un débridement et une irrigation à l'iode de povidone ont été effectués, et la plaie a été refermée chirurgicalement. Cependant, l'infection de la plaie n'a été résolue pour aucun des participants. La plaie sternale a été rouverte et un pansement au sucre a été réalisé jusqu'à quatre fois par jour jusqu'à la cicatrisation complète ou la reconstruction du lambeau. Le temps moyen de résolution de l'infection (sur la base de l'évaluation microbiologique) après le début de l'application du pansement au sucre était de 11,22 ± 1,6 jours. La durée moyenne des pansements au sucre était de 44 ± 27,8 jours12 (niveau 4). Dans un compte-rendu ultérieur19, 20 présentant un risque de biais modéré, les chercheurs ont comparé cette cohorte à deux autres cohortes présentant une infection de la plaie médiastinale à la suite d'une chirurgie cardiaque et ayant reçu différents traitements basés sur une série de protocoles standardisés au moment de leur admission. Les taux de mortalité étaient significativement meilleurs pour les pansements au sucre que pour le traitement conservateur/irrigation fermée (30,6 % contre 2,4 %, p < 0,05), mais la mortalité était plus élevée pour les personnes traitées avec des pansements au sucre que pour le traitement des plaies par pression négative (1,8 % contre 2,4 %, p < 0,05)19. Cependant, tous les sujets de cette étude étaient dans un état critique et il n'était pas évident que le type de pansement influence les résultats en matière de mortalité (niveau 3). D'autres petites séries de cas présentant un risque élevé de biais13-15 ont obtenu des résultats cliniques similaires pour les plaies chirurgicales14, 15 ainsi que pour les plaies chroniques13 en utilisant un pansement au sucre14, 15 ou une pâte13 pour résoudre l'infection locale de la plaie, débrider le lit de la plaie et favoriser la granulation en vue d'une réparation chirurgicale (niveau 4).
L’ECR4 comparant les pansements au sucre et au miel a évalué les signes et les symptômes d'infection à l'aide d'une évaluation microbiologique, du score ASEPSIS et de l'évaluation de la douleur (décrite catégoriquement comme absence de douleur, douleur modérée ou douleur sévère). Les deux groupes ont montré une réduction similaire des signes et symptômes d'infection de la plaie. Après une semaine de traitement, le pourcentage de plaies traitées au sucre dont les cultures se sont révélées positives a diminué par rapport à la situation de départ (52 % à 39 %). Le score médian ASEPSIS pour les plaies traitées au sucre a montré une réduction au cours des trois premières semaines (8,3 points/semaine) et le pourcentage de personnes décrivant une douleur sévère lors des changements de pansements ou des mouvements a également diminué4 (niveau 1).
Dans la courte étude de validation de concept décrite ci-dessus, Murandu et al. (2011)5 ont fait état de la disparition des signes et symptômes d'infection (exsudat, mauvaise odeur et douleur). La mauvaise odeur a complètement disparu au bout de sept jours de traitement pour les 11 plaies jugées malodorantes au départ. Les 22 plaies présentaient des niveaux d'exsudat modérés à élevés au départ ; l'exsudat a diminué au cours de la première semaine et était absent ou minime pour toutes les plaies à la fin de l'essai. Une douleur nécessitant des opiacés a été signalée par cinq personnes au départ, et elle s'est résorbée dans les trois jours suivant le traitement5 (niveau 3).
Considérations relatives à l'utilisation
Préparation et utilisation du pansement au sucre
Les études incluses dans cette synthèse de données probantes ont utilisé diverses méthodes pour appliquer le sucre sur la plaie. Certains chercheurs5, 9, 15 ont tassé le sucre blanc cristallisé directement dans la cavité de la plaie et l'ont maintenu avec de la gaze, un tampon absorbant, de la gaze sèche ou un pansement adhésif (voir le tableau 3 pour un exemple de méthode d'application recommandée24). Muranda et al. (2011)5 ont décrit l'utilisation de paraffine jaune pour construire une "crête" autour des plaies situées dans des zones anatomiques délicates (par exemple, les talons) afin de favoriser le maintient le sucre dans la plaie. Dans ces études, le conditionnement du sucre directement dans la plaie a nécessité le remplacement du pansement au sucre au moins deux fois par jour pour maintenir une cavité de la plaie bien conditionnée5, 9, 15, car le sucre se combine à l'exsudat de la plaie et s'écoule de la plaie7. D'autres chercheurs décrivent l'ajout de glycérine ou de gelée de pétrole pour obtenir une pâte de sucre qui peut être plus facilement maintenue dans la plaie6-8, 13 et dont la consistance facilite l'application7.
Tableau 3 : Une méthode pour appliquer du sucre sur une plaie

Effets indésirables
- Certaines personnes ont signalé une douleur brûlante lors de l'application du pansement au sucre, qui s'est rapidement résorbée5, 7. Il a également été signalé que le sucre provoquait des démangeaisons de la peau périlésionnelle.24 Ces effets sont considérés comme dus à l'assèchement du lit de la plaie provoqué par le sucre et qu'ils peuvent être réduits en utilisant une pâte de sucre plutôt que du sucre cristallisé28.
- Les donnée sur l'effet du sucre appliqué par voie topique sur la glycémie des personnes atteintes de diabète sont mitigées. Le sucre est un disaccharide (c'est-à-dire que le glucose et le fructose se combinent pour former le saccharose) qui est absorbé par les intestins. En théorie, il ne devrait donc pas influencer la glycémie lorsqu'il est appliqué sur le lit d'une plaie1, 23, 35. Certaines études ont exploré et confirmé que l'application de sucre sur une plaie n'influençait pas la glycémie5, 15. Toutefois, un compte-rendu de cas a fait état d'une augmentation de la glycémie1, 22, et dans une autre étude, des personnes atteintes de diabète ont reçu des doses d'insuline plus élevées20.
- Un cas d'insuffisance rénale aiguë associée à la pâte de sucre a été signalé23. Dans certains compte-rendu12, 14, 15, des personnes dont la plaie avait été traitée avec un pansement au sucre sont décédées ; toutefois, ces personnes souffraient d'une maladie grave et leur décès n'était probablement pas lié au pansement au sucre.
Autres considérations
- Le sucre blanc cristallisé est considéré comme stérile. Il faut veiller à ce que le produit utilisé ne soit pas contaminé et à ce que la stérilité soit maintenue (par exemple, si le sucre est saupoudré).
- Les données présentées dans cette synthèse proviennent de contextes où l'accès aux ressources de traitement des plaies est limité. Il conviendrait d’examiner les implications médico-légales de l'utilisation d'un pansement au sucre dans les contextes riches en ressources.
- La fréquence optimale de remplacement des pansements au sucre est de deux fois par jour7, 13, 21, 26 afin de maintenir une osmolalité et une production de peroxyde d'hydrogène suffisantes pour maintenir l'inhibition des bactéries22, 27. Toutefois, cela est rarement possible dans des contextes où les ressources sont limitées7. De nombreuses études ont rapporté des fréquences de changement de pansement allant jusqu'à 5 à 7 jours4, 6, 7, 13, en particulier après la réduction de l'exsudat de la plaie.
- Les niveaux de satisfaction des patients et des professionnels de santé se sont avéré élevés dans une étude, et cette étude a démontré la faisabilité pour les personnes de réaliser leur propre pansement au sucre dans la vie quotidienne5.
- Le sucre attirerait moins les mouches que le miel, ce qui peut être un élément à prendre en compte lors de la sélection d'un pansement dans des contextes où les ressources sont limitées28.
- La pâte de sucre a été préparée par une pharmacie d'hôpital à partir de sucre en poudre, sans additif, associé à du polyéthylène glycol et du peroxyde d'hydrogène11, le rapport des ingrédients variant en fonction de la viscosité requise pour faciliter l'application. Le peroxyde d'hydrogène n'est pas recommandé pour les plaies cavitaires et la stérilité peut ne pas être maintenue lorsque le sucre est réduit en poudre.
- Une comparaison des coûts prenant en compte le coût du matériel de pansement et le temps de travail infirmier ambulatoire pour un traitement de quatre mois dans les années 1980 au Royaume-Uni a montré qu'un pansement à base de pâte de sucre était une option moins chère que la gaze ou la gaze paraffinée11.
Conflits d'intérêt
Les auteurs ne déclarent aucun conflit d'intérêt conformément aux normes de Comité international des éditeurs de presse médicale (ICMJE).
À propos des synthèses de données WHAM
Munn Z., Lockwood C., Moola S. Le développement et l'utilisation de synthèses de données pour les systèmes d'information sur les soins : Une approche simplifiée d'examen rapide, Worldviews Evid Based Nurs. 2015;12(3):131-8.
Les méthodes sont décrites dans les ressources publiées par l'Institut Joanna Briggs16-18 et sur le site internet de la collaboration WHAM : http://WHAMwounds.com. Les synthèses de données WHAM sont soumises à l’examen de pairs membres d’un groupe de référence international multidisciplinaire d'experts en plaies. Les synthèses de données WHAM fournissent une synthèse des meilleures données probantes disponibles sur des sujets spécifiques et font des suggestions qui peuvent être utilisées pour renseigner la pratique clinique. Les données contenues dans cette synthèse doivent être évaluées par des professionnels dûment formés et spécialisés dans la prévention et la prise en charge des plaies, et les données doivent être considérées dans le contexte de l'individu, du professionnel, du cadre clinique et de tout autre information clinique pertinente.
Copyright © 2023 Collaboratif sur la cicatrisation et la gestion des plaies, Institut de recherche sur l’innovation en santé de Curtin, Université Curtin
Author(s)
Emily Haesler
PhD P Grad Dip Adv Nurs (Gerontics), BN, FWA
Adjunct Professor, Curtin University, Curtin Health Innovation Research Institute, Wound Healing and Management (WHAM) Collaborative
References
- Biswas A, Bharara M, Hurst C, Gruessner R, Armstrong D, Rilo H. Use of sugar on the healing of diabetic ulcers: A review. J Diabetes Sci Technol, 2010; 4: 1139 - 45.
- Bitter CC, Erickson TB. Management of burn injuries in the wilderness: Lessons from low-resource settings. Wilderness Environ Med, 2016; 27(4): 519-25.
- Bajaj G, Karn NK, Shrestha BP, Kumar P, Singh MP. A randomised controlled trial comparing EUSOL and sugar as dressing agents in the treatment of traumatic wounds. Tropical Doctor, 2009; 39(1): 1-3.
- Mphande AN, Killowe C, Phalira S, Jones HW, Harrison WJ. Effects of honey and sugar dressings on wound healing. J Wound Care, 2007; 16(7): 317-9.
- Murandu M, Webber M, Simms M, Dealey C. Use of granulated sugar therapy in the management of sloughy or necrotic wounds: A pilot study. J Wound Care, 2011; 20(5): 206-16.
- Franceschi C, Bricchi M, Delfrate R. Anti-infective effects of sugar-vaseline mixture on leg ulcers. Veins and Lymphatics, 2017; 6(2).
- Chiwenga S, Dowlen H, Mannion S. Audit of the use of sugar dressings for the control of wound odour at Lilongwe Central Hospital, Malawi. Tropical Doctor, 2009; 39(1): 20-2.
- Gordon H, Middleton K, Seal D, Sullens K. Sugar and wound healing. Lancet, 1985; 2(8456): 663-5.
- Quatraro A, Minei A, Donzella C, Caretta F, Consoli G, Giugliano D. Sugar and wound healing. Lancet, 1985; 2(8456): 665.
- Lisle J. Use of sugar in the treatment of infected leg ulcers. Br J Community Nurs, 2002; 7(6 Suppl): 40, 2, 4, 6.
- Tanner A, Owen E, Seal D. Successful treatment of chronically infected wounds with sugar paste. Eur J Clin Microbiol Infect Dis, 1988; 7(4): 524-5.
- De Feo M, Gregorio R, Renzulli A, Ismeno G, Romano GP, Cotrufo M. Treatment of recurrent postoperative mediastinitis with granulated sugar. J Cardiovasc Surg, 2000; 41(5): 715-9.
- Ruhullah M, Sanjay S, Singh H, Sinha K, Irshad M, Abhishek B, Kaushal S, Shambhu S. Experience with the use of sugar paste dressing followed by reconstruction of sacral pressure sore with V-Y flap: A reliable solution for a major problem. Medical Practice and Reviews 2013; 4(4): 23-6.
- Szerafin T, Vaszily M, Péterffy A. Granulated sugar treatment of severe mediastinitis after open-heart surgery. Scand J Thorac Cardiovasc Surg, 1991; 25(1): 77-80.
- Trouillet JL, Chastre J, Fagon JY, Pierre J, Domart Y, Gibert C. Use of granulated sugar in treatment of open mediastinitis after cardiac surgery. Lancet, 1985; 2(8448): 180-4.
- Aromataris E, Munn Z (editors). Joanna Briggs Institute Reviewer’s Manual. https://reviewersmanual.joannabriggs.org/ The Joanna Briggs Institute, 2017.
- Joanna Briggs Institute Levels of Evidence and Grades of Recommendation Working Party. New JBI Grades of Recommendation. Adelaide: Joanna Briggs Institute, 2013.
- The Joanna Briggs Institute Levels of Evidence and Grades of Recommendation Working Party. Supporting Document for the Joanna Briggs Institute Levels of Evidence and Grades of Recommendation. www.joannabriggs.org: The Joanna Briggs Institute, 2014.
- De Feo M, Vicchio M, Santè P, Cerasuolo F, Nappi G. Evolution in the treatment of mediastinitis: single-center experience. Asian Cardiovasc Thorac Ann, 2011; 19(1): 39-43.
- De Feo M, Gregorio R, Della Corte A, Marra C, Amarelli C, Renzulli A, Utili R, Cotrufo M. Deep sternal wound infection: the role of early debridement surgery. Eur J Cardiothorac Surg, 2001; 19(6): 811-6.
- Naselli A, Accame L, P. B, Loy A, Bandettini R, Garaventa A, Alberighi O, Castagnola E. Granulated sugar for adjuvant treatment of surgical wound infection due to multi-drug-resistant pathogens in a child with sarcoma: a case report and literature review. Le Infezioni in Medicina, 2017; 4(35): 358-61.
- Pieper B, Caliri M. Nontraditional wound care: A review of the evidence for the use of sugar, papaya/papain, and fatty Aacids. J Wound Ostomy Cont Nurs, 2003; 30: 175–83.
- Valls L, Altisen M, Poblador R, Alvarez A, Biosca R. Sugar paste for treatment of decubital ulcers. J Pharm Technol, 1996; 12: 289 - 90.
- International Committee of the Red Cross (ICRC). ICRC Nursing Guideline 3: Sugar Dressing. IN: ICRC Nursing Guidelines. Geneva, Switzerland: ICRC; 2021.
- Chirife J, Herszage L, Joseph A, Kohn ES. In vitro study of bacterial growth inhibition in concentrated sugar solutions: microbiological basis for the use of sugar in treating infected wounds. Antimicrob Agents Chemother, 1983; 23(5): 766-73.
- Middleton KR, Seal DV. Development of a semi-synthetic sugar paste for promoting healing of Iinfected wounds. In: Wadström T, Eliasson I, Holder I, Ljungh Å, editors. Pathogenesis of Wound and Biomaterial-Associated Infections. London: Springer London; 1990. p. 159-62.
- Molan P, Cooper R. Honey and sugar as a dressing for wounds and ulcers Tropical Doctor, 2000; 30(4): 249-50.
- Tovey F. Honey and sugar as a dressing for wounds and ulcers. Tropical Doctor, 2000; 30: 1.
- Di Stadio A, Gambacorta V, Cristi MC, Ralli M, Pindozzi S, Tassi L, Greco A, Lomurno G, Giampietro R. The use of povidone-iodine and sugar solution in surgical wound dehiscence in the head and neck following radio-chemotherapy. Int Wound J, 2019; 16(4): 909-15.
- Knutson RA, Merbitz LA, Creekmore MA, Snipes HG. Use of sugar and povidone-iodine to enhance wound healing: five year’s experience. South Med J, 1981; 74(11): 1329-35.
- Nakao H, Yamazaki M, Tsuboi R, Ogawa H. Mixture of sugar and povidone - Iodine stimulates wound healing by activating keratinocytes and fibroblast functions. Arch Dermatol Res, 2006; 298(4): 175-82.
- Shimamoto Y, Shimamoto H, Fujihata H. Topical application of sugar and povidone-iodine in the management of decubitus ulcers in aged patients. Hiroshima Journal of Medical Sciences, 1986; 35(2): 167-9.
- Topham J. Sugar paste and povidone-iodine in the treatment of wounds. J Wound Care, 1996; 5(8): 364-5.
- Haesler E, Carville K. WHAM evidence summary: traditional hypochlorite solutions. WCET® Journal, 2023; 43(1): 35-40.
- Bogdanov S, Jurendic T, Sieber R, Gallmann P. Honey for nutrition and health: a review. J Am Coll Nutr, 2008; 27(6): 677-89.

