Volume 44 Number 1
WHAM evidence summary: fish skin for treating burns
Emily Haesler
Keywords burns, Traditional wound management, fish skin, tilapia fish, evidence summary
For referencing Haesler E. WHAM evidence summary: fish skin for treating burns. WCET® Journal 2024;44(1):44-48.
DOI 10.33235/wcet.44.1.44-48
Clinical question
What is the best available evidence for fish skin for treating burns?
Summary
In low and middle resource settings, fish skin has been used as a low cost, traditional biological dressing for treatment of burns and other wounds. The high collagen concentration and tensile strength1-4 of fish skin has led to its use as a xenograft. There is insufficient clinical evidence on healing outcomes to make a recommendation on using fish skin for treating burns. Level 1 evidence5-7 at high risk of bias suggests that complete healing might be faster with a fish skin dressing compared to the local standard care (most frequently, silver sulfadiazine cream replaced every two days), but the time to healing difference was negligible in most studies and may not be clinically significant. Level 1 evidence5-7 on effectiveness in achieving better control of pain intensity showed mixed results. However, no studies reported that fish skin dressings were inferior to local standard care, adverse events were not reported to be an issue and some low level evidence indicated people receiving fish skin dressings were satisfied with the outcomes.
Clinical practice reccommendations
All recommendations should be applied with consideration to the wound, the person, the health professional and the clinical context.
|
There is insufficient evidence to make a recommendation on the use of fish skin dressings to promote healing in burns. |
Sources of evidence: search and appraisal
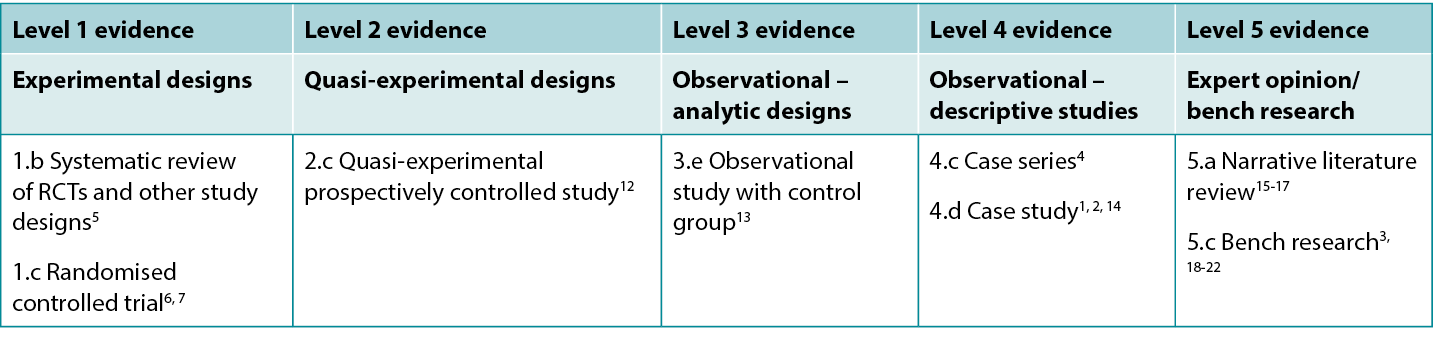
This summary was conducted using methods published by the Joanna Briggs Institute.8-11 The summary is based on a systematic literature search combining search terms related to fish skin, burns and healing. Searches were conducted for evidence reporting use of fish skin in human burns published up to 31 January 2024 in English in the following databases: Cumulative Index to Nursing and Allied Health Literature (CINAHL), Medline (Ovid), Google Scholar, Embase (Ovid), AMED, Global Health, Health Internetwork Access to Research Initiative (Hinari, access via Research4Life) and Cochrane Library. Levels of evidence for intervention studies are reported in Table 1.
Table 1. Levels of evidence for clinical studies
Background
Some types of fish skin have been used as a wound dressings in low resource communities due to their similarities to human skin. Fish skin has high collagen concentration, high resistance, and high tensile strength.1-4 Fish skin also has anti-viral, anti-bacterial and anti-oxidative properties, and is rich is unsaturated fatty acids, which might contribute to efficacy as a burn treatment.4, 16
The clinical research in this evidence summary is focused on the use of natural fish skin that is applied directly to burns (usually after a sterilisation process). The fish skin adheres to the wound bed as a xenograft, protecting the wound bed during healing and reducing the number of dressing changes that are required. This has potential to reduce healthcare resources and to reduce wound-related pain.1, 2, 4, 5, 12, 15
Bench research has also described the extraction and use of collagen from fish skin in commercial wound dressing products, including sponges, hydrogels and topical powders3,17-22 but no clinical research on the use of these products for human burns was identified in the literature search.
Clinical evidence on fish skin for wound healing
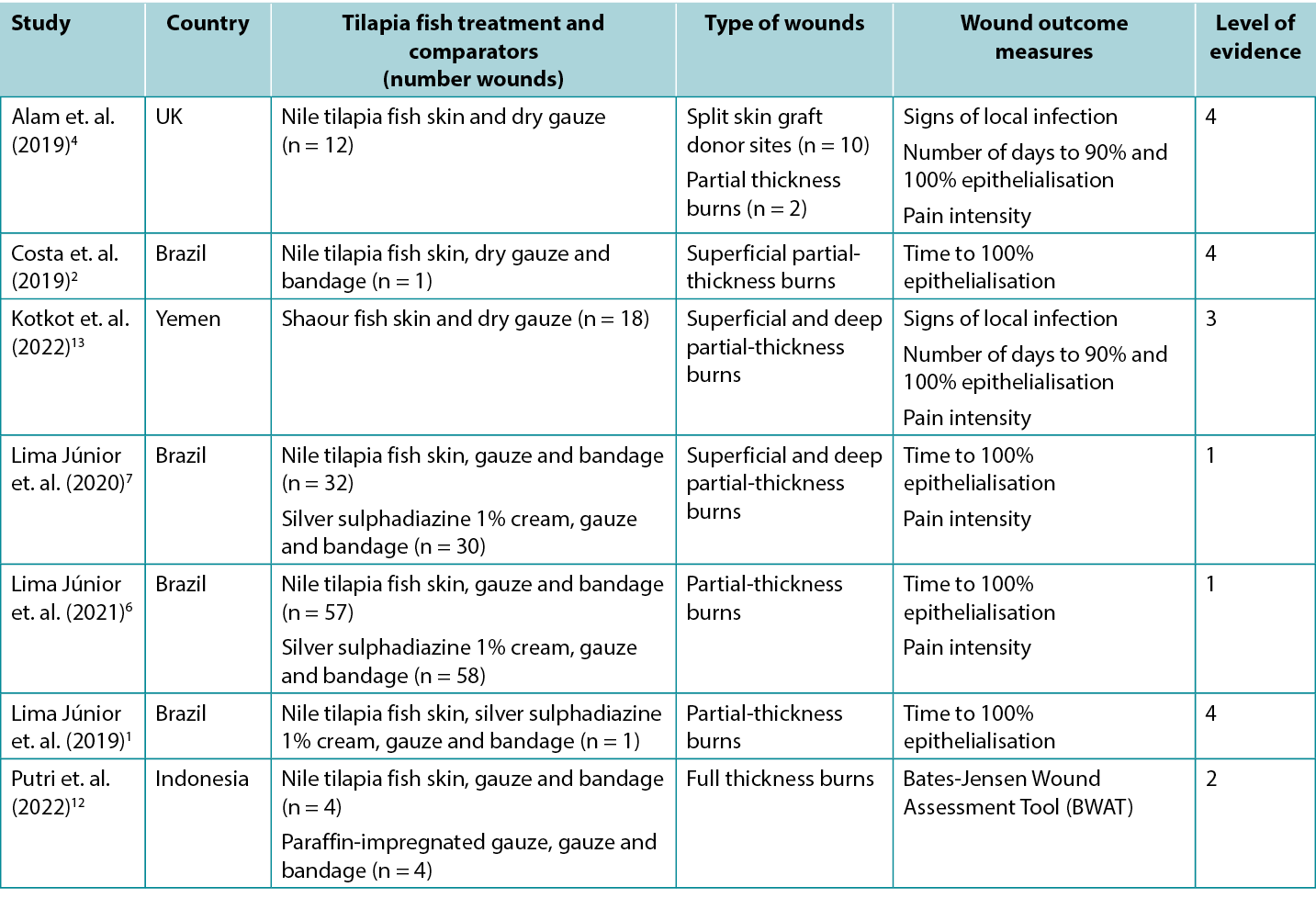
Studies reporting clinical outcomes for human burns treated with tilapia fish skin dressing and shaour fish skin dressing are summarized in Table 2. Half of the published evidence1, 2, 6, 7 was produced by one team in Brazil.
Table 2. Summary of the primary evidence for tilapia fish skin dressing for wound management
Fish skin for promoting healing in burns
The highest level of evidence comes from a meta-analysis5 at high risk of bias that included three studies1, 6, 7 (reported below). Pooled results showed tilapia fish skin dressing was associated with shorter time for partial-thickness burns to reach complete epithelialisation (standard mean difference [SMD] –0.903, 95% confidence interval [CI] −1.45 to −0.355, p<0.001) (Level 1). The primary studies all showed positive outcomes for healing with fish skin dressings:
- One RCT7 at moderate risk of bias, compared tilapia fish skin dressing with silver sulphadiazine 1% cream for treating partial thickness burns. The study had three arms based on the depth and extent of the participants burns (arm A: superficial second-degree burns to less than 10% of the body [n = 23]; arm B: superficial second-degree burns to 10–20% of the body [n = 19] and arm C: deep second-degree burns to 5–15% of the body [n = 20]). After light debridement and cleansing with a topical antimicrobial, the treatment group in each arm received a tilapia fish skin dressing, gauze and a bandage. Every 48 hours the secondary dressing was removed to check the fish skin dressing was correctly adhered. The control group in each arm received the local standard care regimen (silver sulphadiazine 1% cream, gauze and a bandage, changed every 48 hours). In all three study arms, complete epithelialisation was achieved significantly faster in burns treated with the tilapia fish dressing (mean difference between treatment arm and control arm ranged from 1.43 to 3.20 days, p < 0.05 in all arms)7 (Level 1).
- In an RCT6 at high risk of bias the same research team extended their research in individuals with partial thickness burns. Individuals with burns to up to 10% of the body that occurred no more than 72 hours prior and had not yet received treatment were eligible for the trial if they had no product sensitivity or significant co-morbidities. The treatment and control dressing regimens were the same as in the RCT reported above. The treatment group experienced faster healing (mean days: 10.2 ± 0.9 versus 9.7 ± 0.6; p = 0.001) Although the outcomes were statistically significant, the difference between the two regimens could not be considered clinically significant6 (Level 1).
- In a comparative study12 at high risk of bias, tilapia fish skin was applied to acute, non-infected full thickness limb burns (n = 4) following surgical sharp debridement. The fish skin dressings were changed every five days. The outcomes were compared to those for burns on the contralateral limbs that received the local standard care (paraffin-impregnated gauze changed every three days). The mean Bates-Jensen Wound Assessment Tool (BWAT) scores on day 10 were not different (fish skin: 18.75 ± 1.25 versus control: 30.5 18.75 ± 0.9) (Level 2).
- An observational study (n = 18)13 at high risk of bias, reported the effectiveness of shaour fish skin for treating partial-thickness burns. After preparation, the fish skin was applied to the burn area and secured with dry gauze. The fish skin dressing was replaced at day seven and day 15. The mean time to 90% epithelialisation was 11.05 ± 2.57 days (range 7–15) and the mean time to 100% epithelialisation was 17.27 ± 2.05 days (range 13–21). No cases experienced signs of local infection or allergic reaction13 (Level 3).
- A case series4 at high risk of bias reported the use of tilapia fish skin in split-skin graft donor sites for people (n =10) who had experienced burns. The fish skin was soaked in saline and applied directly to the donor sites, held in place with gauze. Dressings were changed on day 7 and then every three days. The average time to complete epithelialisation was 11.5 days (range 10–16) and the mean pain score on a VRS (0–10) at day 7 was 2.3 (range 1–4). In this study, an additional two participants received tilapia skin dressing applied to partial thickness burns, with complete epithelialisation observed at two weeks. No cases experienced signs of local infection (Level 4).
- Several case reports at high risk of bias describe the successful use of fish skin to treat partial thickness burns,1,2 including burns in babies and young children.2 In these case reports, healing occurred without complication in 10 to 17 days1, 2 (Level 4).
Wound-related pain outcomes with fish skin dressing
Findings on the impact of tilapia fish skin dressing on wound-related pain are inconclusive. First, pain was only reported on unidimensional scales measuring pain intensity, and in many studies it was not clear when the pain assessment was conducted. When the results from three studies1, 6, 7 were pooled in a meta-analysis,5 tilapia fish dressing was associated with lower pain intensity but the result was not significant (standard mean difference on a 10cm visual analogue scale (VAS) –0.608, 95% CI −0.885 to −0.331, p = 0.54) (Level 1). The following results were reported in the primary research:
- Participants in the three-armed RCT7 reported pain intensity using a 10cm VAS. There was no significant difference between pain intensity for tilapia fish skin dressing and silver sulphadiazine 1% cream in the arm in which participants had superficial second-degree burns to less than 10% of the body (p > 0.05). In the arms in which participants had superficial second-degree burns to 10–20% of the body or deep second-degree burns to 5–15% of the body, those receiving tilapia fish skin dressing reported lower pain intensity immediately after dressing change than those receiving silver sulphadiazine 1% cream (p < 0.005 for all wound dressing changes in both arms)7 (Level 1).
- Participants in the second RCT6 reported more rapid reduction in burn-related pain intensity (p < 0.001) with a tilapia fish skin dressing compared to a control group receiving silver sulphadiazine 1% cream (Level 1).
- In the observational study (n = 18),13 the mean pain rating on a Verbal Rating Scale (VRS, 0–10) was 6.94 ± 0.72 (range 6–8) at day 7, and this decreased statistically significantly (p < 0.001) to 5.22 ± 0.64 (range 4–6) at day 15 (Level 3).
- Individuals treated with fish skin dressing in other studies reported the dressing was comfortable.4, 12
Considerations for use
Consider local policies, procedures, and licensing before implementing traditional wound treatments.
Preparation
In the clinical studies,1, 2, 6 the fish skin was sterilised using a chemical process followed by gamma irradiation and stored in sterile packaging under refrigeration prior to use. After preparation, the product can be stored in refrigerated sterile packaging for up to two years.2
Clinical use
- In clinical use,1,6,13 burns were lightly debrided (if indicated) and then cleansed in sterile saline or a topical antimicrobial solution before fish skin was applied. The fish skin covered the entire wound or burn, including approximately 1cm of healthy peri-wound skin. The fish skin was covered with dry gauze with or without additional bandaging. In one study2 the fish skin was washed in sterile 0.9% saline for 5 minutes three times immediately before its application to the burn.
- In most clinical reports, the fish skin dressing was checked every few days to ensure the fish skin adhered to the burn, but the fish skin was not replaced.1,6,7 As the fish skin dries, it sloughs from the wound bed. At this stage, moistening the area (e.g., in the shower or using a cleansing solution) can assist in lifting the fish skin, revealing new epithelisation.1 In other reports, the fish skin dressing was replaced after 5 to 7 days.4,12,13
- Fish skin dressing may be inappropriate for some anatomical regions, including the face, neck and groin, due to difficulty achieving adequate adherence on skin folds.2,7,15
Cost effectiveness
- Several sources1,7,12 suggested that fish skin dressing is cost effective because the dressing does not need frequent replacement. In most reports in this evidence summary the fish skin was not replaced; in one study the fish skin dressing change was changed weekly13 In the pooled results5 from three studies1,6,7, tilapia skin dressing was associated with fewer dressings (SMD −4.195, 95% CI −5.615 to −2.774, p = 0.074) but the result was not significant (Level 1).
- In an RCT6, there were significantly lower costs associated with using tilapia fish skin dressings compared with silver sulphadiazine cream ($11 ± $1 versus Brazilian $19± $1; dollars in 2020), related to lower costs for dressing materials and analgesia (Level 1).
Adverse effects
Most of the research1,2,5-7 included in this evidence summary reported no adverse events associated with fish skin dressings. In one small study12, two of the participants died due to septic shock deemed not related to either the fish skin dressing or the comparison paraffin-impregnated gauze dressing they were receiving.
Conflicts of interest
The author declares no conflicts of interest in accordance with International Committee of Medical Journal Editors (ICMJE) standards.
About WHAM evidence summaries
WHAM evidence summaries provide a summary of the best available evidence on specific topics and make suggestions that can be used to inform clinical practice. Evidence contained within this summary should be evaluated by appropriately trained professionals with expertise in wound prevention and management, and the evidence should be considered in the context of the individual, the professional, the clinical setting and other relevant clinical information.
WHAM evidence summaries are developed using methodology consistent with that published by Joanna Briggs Institute8-11. Evidence underpinning a WHAM recommendation is identified via a PICO search strategy, assigned a level of evidence and evaluated for risk of bias. All WHAM evidence summaries are peer-reviewed by an international Expert Reference Group. For more information on the methods and the WHAM Expert Reference Group, visit the website: www.WHAMwounds.com.
Copyright © Wound Healing and Management Collaborative, Curtin University, and the authors.
Synthèse de données probantes WHAM: la peau de poisson pour le traitement des brûlures
Emily Haesler
DOI: 10.33235/wcet.44.1.44-48
Question clinique
Quelles sont les meilleures données probantes disponibles concernant l'utilisation de la peau de poisson dans le traitement des brûlures ?
Synthèse
Dans les pays à faibles et moyennes ressources, la peau de poisson a été utilisée comme un pansement biologique traditionnel peu coûteux pour le traitement des brûlures et d'autres plaies. La forte concentration de collagène et la résistance à la traction1-4 de la peau de poisson ont conduit à son utilisation comme xénogreffe. Les données cliniques sur les résultats de la cicatrisation sont insuffisantes pour formuler une recommandation sur l'utilisation de la peau de poisson dans le traitement des brûlures. Des données de niveau 15-7 avec un risque élevé de biais suggèrent que la cicatrisation complète pourrait être plus rapide avec un pansement en peau de poisson qu'avec les soins locaux standard (le plus souvent, une crème à base de sulfadiazine d'argent appliquée tous les deux jours), mais la différence de temps de cicatrisation était négligeable dans la plupart des études et n'est peut-être pas cliniquement significative. Les données probantes de niveau 15-7 sur l'efficacité d'un meilleur contrôle de l'intensité de la douleur ont donné des résultats mitigés. Cependant, aucune étude n'a indiqué que les pansements à base de peau de poisson étaient inférieurs aux soins locaux standard, les événements indésirables n'ont pas été signalés comme étant un problème et certaines données de faible niveau ont indiqué que les personnes recevant des pansements à base de peau de poisson étaient satisfaites des résultats.
Recommandations pour la pratique clinique
Toutes les recommandations doivent être appliquées en tenant compte de la plaie, de la personne, du professionnel de santé et du contexte clinique.
| Les données probantes sont insuffisantes pour formuler une recommandation sur l'utilisation de pansements à base de peau de poisson pour favoriser la cicatrisation des brûlures. |
Sources des données : recherche et évaluation
Cette synthèse a été réalisée à l'aide des méthodes publiées par le Joanna Briggs Institute.8-11 La synthèse est basée sur une recherche documentaire systématique combinant des termes de recherche liés à la peau de poisson, aux brûlures et à la cicatrisation. Des recherches ont été effectuées pour trouver des données probantes de l'utilisation de la peau de poisson pour les brûlures humaines, publiées jusqu'au 31 janvier 2024 en anglais dans les bases de données suivantes : Cumulative Index to Nursing and Allied Health Literature (CINAHL), Medline (Ovid), Google Scholar, Embase (Ovid), AMED, Global Health, Health Internetwork Access to Research Initiative (Hinari, access via Research4Life) and bibliothèque Cochrane. Les niveaux de données des études d'intervention sont indiqués dans le Tableau 1.
Tableau 1. Niveaux de données des études cliniques

Contexte
Certains types de peau de poisson ont été utilisés comme pansements dans les communautés à faibles ressources en raison de leur similitude avec la peau humaine. La peau de poisson a une forte concentration de collagène, une résistance élevée et une grande force de traction.1-4 La peau de poisson a également des propriétés antivirales, antibactériennes et antioxydantes et est riche en acides gras insaturés, ce qui pourrait contribuer à son efficacité dans le traitement des brûlures.4, 16
La recherche clinique présentée dans cette synthèse de données probantes se concentre sur l'utilisation de peau de poisson naturelle appliquée directement sur les brûlures (généralement après un processus de stérilisation). La peau de poisson adhère au lit de la plaie comme une xénogreffe, protégeant le lit de la plaie pendant la cicatrisation et réduisant le nombre de changements de pansement nécessaires. Cela peut permettre de limiter les ressources en soins de santé et de diminuer la douleur liée à la plaie.1, 2, 4, 5, 12, 15
La recherche comparative a également décrit l'extraction et l'utilisation du collagène de la peau de poisson dans les produits commerciaux de pansement, y compris les éponges, les hydrogels et les poudres topiques3,17-22 mais aucune recherche clinique sur l'utilisation de ces produits pour les brûlures humaines n'a été identifiée dans la recherche documentaire.
Données probantes cliniques sur la peau de poisson pour la cicatrisation des plaies
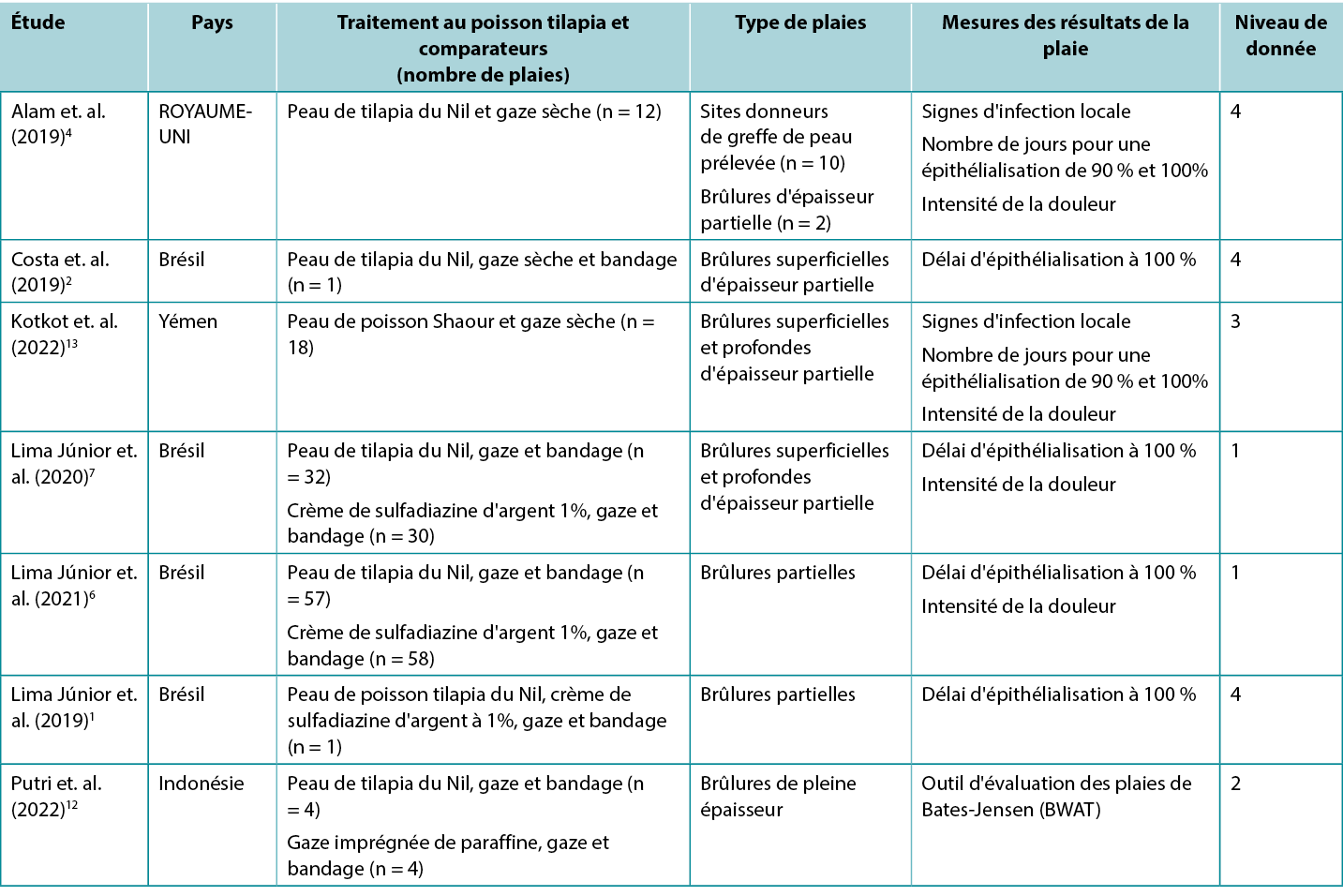
Les études rapportant les résultats cliniques des brûlures humaines traitées avec un pansement de peau de poisson tilapia et un pansement de peau de poisson shaour sont synthétisées dans le Tableau 2. La moitié des données publiées1, 2, 6, 7 ont été produites par une équipe brésilienne.
Tableau 2. Synthèse des données probantes primaires sur le pansement de peau de poisson tilapia pour le traitement des plaies
La peau de poisson pour favoriser la cicatrisation des brûlures
Le niveau de données le plus élevé provient d'une méta-analyse5 présentant un risque élevé de biais et incluant trois études1, 6, 7 (voir ci-dessous). Les résultats regroupés ont montré que le pansement à base de peau de poisson tilapia était associé à un temps plus court pour que les brûlures d'épaisseur partielle atteignent une épithélialisation complète (différence moyenne standard [DMS] -0,903, intervalle de confiance à 95 % [IC] -1,45 à -0,355, p<0,001) (Niveau 1). Les études primaires ont toutes montré des résultats positifs pour la cicatrisation avec des pansements à base de peau de poisson :
- Un ECR7 présentant un risque de biais modéré a comparé le pansement à base de peau de poisson tilapia à la crème à base de sulfadiazine d'argent à 1 % pour le traitement des brûlures d'épaisseur partielle. L'étude comportait trois groupes en fonction de la profondeur et de l'étendue des brûlures des participants (groupe A : brûlures superficielles du second degré sur moins de 10 % du corps [n = 23] ; groupe B : brûlures superficielles du second degré sur 10 à 20 % du corps [n = 19] et groupe C : brûlures profondes du second degré sur 5 à 15 % du corps [n = 20]). Après un débridement léger et un nettoyage avec un antimicrobien topique, un groupe de traitement pour chacun des trois groupes d’étude a reçu un pansement de peau de poisson tilapia, de la gaze et un bandage. Toutes les 48 heures, le pansement secondaire a été retiré pour vérifier que le pansement en peau de poisson adhérait correctement. Le groupe témoin de chacun des trois groupes d’étude a reçu le traitement standard local (crème à base de sulfadiazine d'argent à 1%, gaze et bandage, changés toutes les 48 heures). Dans les trois groupes d'étude, l'épithélialisation complète a été obtenue significativement plus rapidement dans les brûlures traitées avec le pansement à base de poisson tilapia (la différence moyenne entre le groupe de traitement et le groupe de contrôle allait de 1,43 à 3,20 jours, p<0,05 dans tous les groupes)7 (Niveau 1).
- Dans un ECR6 présentant un risque élevé de biais, la même équipe de chercheurs a étendu ses recherches à des personnes présentant des brûlures d'épaisseur partielle. Les personnes ayant subi des brûlures sur 10 % du corps au maximum, survenues au maximum 72 heures auparavant et n'ayant pas encore reçu de traitement, étaient éligibles à l'essai si elles ne présentaient pas de sensibilité au produit ou de comorbidités importantes. Les régimes de traitement et de contrôle des pansements étaient les mêmes que dans l’ECR mentionné ci-dessus. Le groupe traité a connu une cicatrisation plus rapide (moyenne du nombre de jours : 10,2 ± 0,9 versus 9,7 ± 0,6 ; p = 0,001) Bien que les résultats soient statistiquement significatifs, la différence entre les deux régimes ne peut être considérée comme cliniquement significative6 (Niveau 1).
- Dans une étude comparative12 présentant un risque élevé de biais, la peau de poisson tilapia a été appliquée sur des brûlures aux membres aiguës non infectées de pleine épaisseur (n = 4) après un débridement chirurgical tranchant. Les pansements de peau de poisson ont été changés tous les cinq jours. Les résultats ont été comparés à ceux des brûlures des membres controlatéraux qui ont reçu les soins standard locaux (gaze imprégnée de paraffine changée tous les trois jours). Les scores moyens de l'Outil d'évaluation des plaies de Bates-Jensen (BWAT) au 10e jour n'étaient pas différents (peau de poisson : 18,75 ± 1,25 par rapport au contrôle : 30,5 18,75 ± 0,9) (Niveau 2).
- Une étude observationnelle (n = 18)13 présentant un risque élevé de biais rendu-compte de l'efficacité de la peau de poisson shour pour le traitement des brûlures d'épaisseur partielle. Après préparation, la peau de poisson a été appliquée sur la zone brûlée et fixée à l'aide d'une gaze sèche. Le pansement de peau de poisson a été remplacé au septième et au quinzième jour. Le délai moyen d'épithélialisation à 90 % était de 11,05 ± 2,57 jours (intervalle 7-15) et le délai moyen d'épithélialisation à 100% était de 17,27 ± 2,05 jours (intervalle 13-21). Aucun cas n'a présenté de signes d'infection locale ou de réaction allergique13 (Niveau 3).
- Une série de cas4 présentant un risque élevé de biais a décrit l'utilisation de peau de poisson tilapia sur les sites donneurs de greffe de peau prélévée pour des personnes (n =10) ayant subi des brûlures. La peau de poisson a été imbibée de sérum physiologique et appliquée directement sur les sites donneurs, maintenue en place par de la gaze. Les pansements ont été changés le 7e jour, puis tous les trois jours. La durée moyenne de l'épithélialisation complète a été de 11,5 jours (intervalle 10-16) et le score moyen de la douleur sur un EEV (0-10) au 7ème jour a été de 2,3 (intervalle 1-4). Dans cette étude, deux autres participants ont reçu un pansement à base de peau de tilapia appliqué sur des brûlures d'épaisseur partielle, avec une épithélialisation complète observée au bout de deux semaines. Aucun cas n'a présenté de signes d'infection locale (Niveau 4).
- Plusieurs comptes-rendus de cas présentant un risque élevé de biais décrivent l'utilisation réussie de la peau de poisson pour traiter des brûlures d'épaisseur partielle,1,2 y compris des brûlures chez les bébés et les jeunes enfants.2 Dans ces rapports de cas, la cicatrisation s'est produite sans complication en 10 à 17 jours1, 2 (Niveau 4).
Résultats de la douleur liée à la plaie avec le pansement de peau de poisson
Les résultats concernant l'impact du pansement de peau de poisson tilapia sur la douleur liée à la plaie ne sont pas concluants. Tout d'abord, la douleur n'a été rapportée que sur des échelles unidimensionnelles mesurant l'intensité de la douleur et, dans de nombreuses études, le moment où l'évaluation de la douleur a été effectuée n'était pas clair. Lorsque les résultats de trois études1, 6, 7 ont été regroupés dans une méta-analyse,5 le pansement de poisson tilapia a été associé à une intensité de douleur plus faible, mais le résultat n'était pas significatif (différence moyenne standard sur une échelle visuelle analogique (EVA) de 10 cm -0,608, IC à 95 % de -0,885 à -0,331, p = 0,54) (Niveau 1). Les résultats suivants ont été obtenus dans le cadre de la recherche primaire :
- Les participants à l’ECR à trois groupes d’études7 ont signalé l'intensité de la douleur à l'aide d'une EVA de 10 cm. Il n'y a pas eu de différence significative entre l'intensité de la douleur pour le pansement de peau de poisson tilapia et la crème à base de sulfadiazine d'argent à 1 % dans le bras où les participants avaient des brûlures superficielles du second degré sur moins de 10 % du corps (p > 0,05). Dans les groupes où les participants présentaient des brûlures superficielles du second degré sur 10 à 20 % du corps ou des brûlures profondes du second degré sur 5 à 15 % du corps, ceux qui ont reçu le pansement de peau de poisson tilapia ont fait état d’une intensité de douleur plus faible immédiatement après le changement de pansement que ceux qui ont reçu la crème de sulfadiazine argentique à 1 % (p < 0,005 pour tous les changements de pansement dans les deux groupes)7 (Niveau 1).
- Les participants au deuxième ECR6 ont fait état d'une réduction plus rapide de l'intensité de la douleur liée aux brûlures (p < 0,001) avec un pansement à base de peau de poisson tilapia, par rapport à un groupe témoin recevant une crème à base de sulfadiazine argentique à 1 % (Niveau 1).
- Dans l'étude observationnelle (n = 18),13 l'évaluation moyenne de la douleur sur une échelle d'évaluation verbale (EEV, 0-10) était de 6,94 ± 0,72 (intervalle 6-8) au 7e jour, et elle a diminué de manière statistiquement significative (p < 0,001) à 5,22 ± 0,64 (intervalle 4-6) au 15e jour (Niveau 3).
- Les personnes traitées avec un pansement de peau de poisson dans d'autres études ont indiqué que le pansement était confortable.4, 12
Considérations relatives à l'utilisation
Tenir compte des règlementations, procédures et autorisations locales avant de mettre en œuvre des traitements traditionnels des plaies.
Préparation
Dans les études cliniques,1, 2, 6 la peau de poisson a été stérilisée par un procédé chimique suivi d'une irradiation gamma et conservée dans un emballage stérile sous réfrigération avant d'être utilisée. Après préparation, le produit peut être conservé dans un emballage stérile réfrigéré jusqu'à deux ans.2
Usage clinique
- En clinique,1,6,13 les brûlures ont été légèrement débridées (si nécessaire) puis nettoyées avec du sérum physiologique stérile ou une solution antimicrobienne topique avant l'application de la peau de poisson. La peau de poisson couvrait la totalité de la plaie ou de la brûlure, y compris environ 1 cm de peau péri-lésionnelle saine. La peau de poisson a été recouverte d'une gaze sèche, avec ou sans pansement supplémentaire. Dans une étude2 , la peau de poisson a été lavée trois fois pendant 5 minutes dans une solution saline stérile à 0,9 % immédiatement avant d'être appliquée sur la brûlure.
- Dans la plupart des comptes-rendus cliniques, le pansement de peau de poisson a été vérifié tous les quelques jours pour s'assurer que la peau de poisson adhérait à la brûlure, mais la peau de poisson n'a pas été remplacée.1,6,7 Lorsque la peau de poisson sèche, elle se détache du lit de la plaie. À ce stade, l'humidification de la zone (par exemple, sous la douche ou à l'aide d'une solution nettoyante) peut aider à soulever la peau de poisson, révélant une nouvelle épithélisation.1 Dans d'autres comptes-rendus, le pansement en peau de poisson a été remplacé après 5 à 7 jours.4,12,13
- Le pansement en peau de poisson peut être inapproprié pour certaines régions anatomiques, notamment le visage, le cou et l'aine, en raison de la difficulté à obtenir une adhérence adéquate sur les plis cutanés.2,7,15
Rapport coût-efficacité
- Plusieurs sources1,7,12 suggéraient que le pansement de peau de poisson est rentable car il n'a pas besoin d'être remplacé fréquemment. Dans la plupart des comptes-rendus de cette synthèse de données probantes, la peau de poisson n'a pas été remplacée. Dans une étude, le pansement de la peau du poisson était changé toutes les semaines.13 Dans les résultats regroupés5 de trois études1,6,7, le pansement de peau de tilapia était associé à moins de pansements (DMS -4,195, IC 95% de -5,615 à -2,774, p = 0,074), mais le résultat n'était pas significatif (Niveau 1).
- Dans un ECR6, les coûts associés à l'utilisation de pansements de peau de poisson tilapia étaient significativement inférieurs à ceux de la crème à base de sulfadiazine d'argent (11 $ ± 1 $ contre 19 $± 1 $ au Brésil ; dollars en 2020), en raison de la réduction des coûts liés aux matériels de pansement et à l'analgésie (Niveau 1).
Effets indésirables
La plupart des études1,2,5-7 incluses dans cette synthèse de données probantes ne fait état d'aucun effet indésirable associé aux pansements de peau de poisson. Dans une petite étude12, deux des participants sont décédés à la suite d'un choc septique jugé sans rapport avec le pansement de peau de poisson ou le pansement comparatif à base de gaze imprégnée de paraffine qu'ils recevaient.
Conflits d'intérêt
Les auteurs ne déclarent aucun conflit d'intérêt conformément aux normes de Comité international des éditeurs de presse médicale (ICMJE).
À propos des synthèses de données WHAM
Les synthèses de données WHAM fournissent une synthèse des meilleures données probantes disponibles sur des sujets spécifiques et font des suggestions qui peuvent être utilisées pour renseigner la pratique clinique. Les données contenues dans cette synthèse doivent être évaluées par des professionnels dûment formés et spécialisés dans la prévention et la prise en charge des plaies, et les données doivent être considérées dans le contexte de l'individu, du professionnel, du cadre clinique et de tout autre information clinique pertinente.
Les synthèses de données probantes WHAM sont élaborés selon une méthodologie conforme à celle publiée par l'Institut Joanna Briggs8-11. Les données étayant une recommandation WHAM sont identifiées au moyen d'une stratégie de recherche PICO. Un niveau de donnée leur est attribué et elles sont évaluées en fonction du risque de biais. Toutes les synthèses de données probantes WHAM sont revues par les pairs grâce à un Groupe de référence international d'experts. Pour plus d'informations sur les méthodes et le Groupe de référence d’experts du WHAM, voir le site internet : www.WHAMwounds.com.
Copyright © Wound Healing and Management Collaborative, Curtin University, et les auteurs.
Author(s)
Emily Haesler
PhD P Grad Dip Adv Nurs (Gerontics) BN FWA
Adjunct Professor, Curtin University, Curtin Health Innovation Research Institute, Wound Healing and Management (WHAM) Collaborative
References
- Lima-Júnior EM, de Moraes Filho MO, Costa BA, Fechine FV, de Moraes MEA, Silva-Junior FR, Soares MFAdN, Rocha MBS, Leontsinis CMP. Innovative treatment using tilapia skin as a xenograft for partial thickness burns after a gunpowder explosion. J Surg Case Rep, 2019; 6: rjz181.
- Costa BA, Lima Júnior EM, de Moraes Filho MO, Fechine FV, de Moraes MEA, Silva Júnior FR, do Nascimento Soares MFA, Rocha MBS. Use of tilapia skin as a xenograft for pediatric burn treatment: A case report. J Burn Care Res, 2019; 40(5): 714-7.
- Ge B, Wang H, Li J, Liu H, Yin Y, Zhang N, Qin S. Comprehensive assessment of Nile tilapia skin (Oreochromis niloticus) collagen hydrogels for wound dressings. Marine Drugs. 2020; 18(4).
- Alam K, Jeffery SLA. Acellular Fish skin grafts for management of split thickness donor sites and partial thickness burns: A case series. Mil Med, 2019; 184(Suppl 1): 16-20.
- Cadri S, Elrosasy A, Al Mawla AM, Albakri K, Abdelwahab OA, Soliman A, Jaradat B, Cadri N, Alabdallat YJ, Negida A. The efficacy of Nile tilapia skin xenograft for treating superficial partial-thickness burn versus the standard of care: a meta-analysis of published trials. Arch Dermatol Res, 2023; 316(1): 33.
- Lima Júnior EM, de Moraes Filho MO, Costa BA, Fechine FV, Vale ML, Diógenes AKL, Neves KRT, Uchôa A, Soares M, de Moraes MEA. Nile tilapia fish skin-based wound dressing improves pain and treatment-related costs of superficial partial-thickness burns: A phase III randomized controlled trial. Plast Reconstr Surg, 2021; 147(5): 1189-98.
- Lima Júnior EM, De Moraes Filho MO, Costa BA, Rohleder AVP, Sales Rocha MB, Fechine FV, Forte AJ, Alves A, Silva Júnior FR, Martins CB, Mathor MB, Moraes MEA. Innovative burn treatment using tilapia skin as a xenograft: A phase II randomized controlled trial. J Burn Care Res, 2020; 41(3): 585-92.
- Aromataris E, Munn Z, editors. JBI Manual for Evidence Synthesis. https://synthesismanual.jbi.global: Joanna Briggs Institute, 2020.
- Joanna Briggs Institute Levels of Evidence and Grades of Recommendation Working Party. New JBI Grades of Recommendation. Adelaide, Australia: Joanna Briggs Institute, 2013.
- Joanna Briggs Institute Levels of Evidence and Grades of Recommendation Working Party. Supporting Document for the Joanna Briggs Institute Levels of Evidence and Grades of Recommendation. Adelaide, Australia: Joanna Briggs Institute, 2014.
- Munn Z, Lockwood C, Moola S. The development and use of evidence summaries for point of care information systems: A streamlined rapid review approach. Worldviews Evid Based Nurs, 2015;12(3):131-8.
- Putri N, Kreshanti P, Syarif A, Duhita G, Johanna N, Wardhana A. Efficacy of tilapia skin xenograft compared to paraffin-impregnated gauze as a full-thickness burn dressing after excisional debridement: A case series. Int J Surg Case Rep, 2022; 95(107240): 107240.
- Kotkot A, Ghabisha S, Ahmed F, Al-wageeh S, Al-shami E, Al-hajri A, Aljbri W, Mohammed F. Fish skin as a biological dressing for burn injuries. Journal of Emergency Medicine, Trauma and Acute Care, 2022; 2022(4).
- Riaz Z. Treatment of human skin burns through using tilapia skin. Bull. Biol. All. Sci. Res., 2021;6:24.
- Luze H, Nischwitz SP, Smolle C, Zrim R, Kamolz LP. The use of acellular fish skin grafts in burn wound management. A systematic review. Medicina (Kaunas), 2022; 58(7).
- Esmaeili A, Biazar E, Ebrahimi M, Heidari Keshel S, Kheilnezhad B, Saeedi Landi F. Acellular fish skin for wound healing. Int Wound J, 2023; 20(7): 2924-41.
- Afifah A, Suparno O, Haditjaroko L, Tarman K. Utilisation of fish skin waste as a collagen wound dressing on burn injuries: a mini review. IOP Conference Series: Earth and Environmental Science, 2019; 335(1): 012031.
- Lima-Verde MEQ, Parthiban SP, Júnior AECF, De Barros Silva PG, Junior EML, De Moraes MO, De Paulo Aragão Sabóia V, Bertassoni LE, Alves APNN. Nile tilapia fish skin, scales, and spine as naturally derived biomaterials for tissue regeneration. Current Oral Health Reports, 2020;7(4):335-43.
- Li D, Sun WQ, Wang T, Gao Y, Wu J, Xie Z, Zhao J, He C, Zhu M, Zhang S, Wang P, Mo X. Evaluation of a novel tilapia-skin acellular dermis matrix rationally processed for enhanced wound healing. Materials Science and Engineering: C, 2021; 127: 112202.
- Wang T, Yang L, Wang G, Han L, Chen K, Liu P, Xu S, Li D, Xie Z, Mo X, Wang L, Liang H, Liu X, Zhang S, Gao Y. Biocompatibility, hemostatic properties, and wound healing evaluation of tilapia skin collagen sponges. Journal of Bioactive and Compatible Polymers, 2020; 36(1): 44-58.
- Yang L, Chen K, Liu P, Kang Y, Shen S, Qu C, Gong S, Liu Y, Gao Y. Preparation of Nile tilapia skin collagen powder by low-temperature and comprehensive evaluation of hemostasis and wound healing. Int J Artif Organs, 2023; 46(2): 99-112.
- Zhou T, Wang N, Xue Y, Ding T, Liu X, Mo X, Sun J. Electrospun tilapia collagen nanofibers accelerating wound healing via inducing keratinocytes proliferation and differentiation. Colloids and Surfaces B: Biointerfaces, 2016; 143: 415-22.

