Volume 42 Number 1
Nursing care of severe hand foot syndrome caused by the oral anti-tumour drug Xeloda: a case study
Shuangshuang Zhang, Wenxing Zhao and Mengmeng Zhang
Keywords nursing, hand foot syndrome, Xeloda, biocellulose dressing
For referencing Zhang S, Zhao W and Zhang M. Nursing care of severe hand foot syndrome caused by the oral anti-tumour drug Xeloda: a case study. WCET® Journal 2022;42(1):29-33
DOI
https://doi.org/10.33235/wcet.42.1.29-33
Submitted 14 October 2021
Accepted 9 March 2021
Abstract
This case study summarises the nursing experience of a patient with grade III hand foot syndrome (HFS) caused by the oral anti-tumour drug Xeloda. The key points of nursing were a multi-disciplinary team consultation to make a clear diagnosis of grade III HFS, effectively control infection, apply a biocellulose dressing, and promote granulation growth and epidermal cell regeneration on the premise that the anti-tumour drug Xeloda cannot be reduced or stopped. After 98 days of comprehensive nursing intervention the wound healed completely; 6 months later, the ulcer did not reoccur.
Introduction
This case study will summarise the nursing experience of caring for a patient with grade III hand foot syndrome (HFS) caused by the oral anti-tumour drug Xeloda (Capecitabine). The key points of nursing care are the importance of a multi-disciplinary team (MDT) consultation process to provide a definitive diagnosis of a grade III HFS, effectively control infection and apply a biocellulose dressing to the wound to promote the growth of granulation tissue and epidermal cell regeneration on the premise that the anti-tumour drug Xeloda could not be reduced or stopped. After 98 days of comprehensive nursing interventions, the wound had healed completely; 6 months later, the ulcer had not re-occurred.
HFS is also known as palmar-plantar erythrodysesthesia, syndrome, acral erythema and Burgdorf’s syndrome. It is an adverse dermatologic skin reaction that may occur in patients with malignant tumours during treatments with systemic chemotherapy or molecular targeted therapy1–3. Localised tissue injury occurs as a result of a toxic reaction caused by drug accumulation from damage to the eccrine gland system. Further, the drugs used are excreted in sweat in the terminal limb capillaries of the palms of the hand and soles of the feet, making these areas more susceptible to HFS. The vascularity of and increased pressures and skin temperature of the hands and feet may exacerbate this effect2,4. While HFS is not life-threatening, it may severely impact a person’s quality of life, especially older people3. The clinical manifestations of HFS are palmoplantar numbness, insensitivity, a tingling sensation, rapid skin swelling or erythema, desquamation, skin cracking or blisters (usually advanced stage) or severe pain3,5. The palms of the hands are usually affected first. There may be progressive aggravations of any skin lesions.
It is important the HFS is not mistaken for hand-foot skin reaction (HFSR) arising from the use of multikinase or BRAF inhibitors. Skin reactions from the use of these groups of drugs manifest as yellowish, painful hyperkeratotic plaques on the heels, fingertips, within interdigital web spaces and over joints3.
According to National Cancer Institute (NCI)6, HFS is divided into three grades: grade I is dermatitis with skin changes (such as fingerprint disappearance, pigmentation, erythema, skin numbness, insensitivity, paresthesia, desquamation, etc.) with or without pain; grade II is skin change or dermatitis, with pain but without dysfunction; grade III is skin change or dermatitis (such as skin wet desquamation, ulcer, blister), severe pain and dysfunction. Grade III severe ulcers are rare. The pathological manifestations of grade III ulcers are vacuolar degeneration (liquefaction) of basal keratinocytes, infiltration of lymphocytes around skin vessels, apoptosis of keratinocytes and skin oedema7. The Xeloda antithetical couplet named capecitabine tablets, the new generation of oral fluorouracil broad spectrum anti-tumour drugs8, is used for the treatment of advanced breast cancer patients after chemotherapy; tumour cells can be intentionally killed if Xeloda is used independently. Xeloda can also be used in conjunction with other chemotherapy agents9. Further, Xeloda is usually taken orally BD after food and in cases of metastatic breast cancer Xeloda is used for maintenance therapy as long as it remains effective. Adverse reactions to Xeloda mainly include HFS, nausea, diarrhoea and neutropenia. The incidence of HFS is the highest among the adverse reactions to Xeloda, reaching 45–68%8. Furthermore, 20–50% of the patients who used Xeloda were forced to reduce the dosage or even discontinue treatment due to HFS10,11.
On 26 May 2020, a patient with severe grade III HFS caused by oral Xeloda was admitted to our hospital’s specialist nursing clinic of wound ostomy incontinence. Without stopping the drug, the wound was completely healed in 98 days after comprehensive nursing and medical intervention. The nursing methods are reported as follows.
Case Presentation
Background
A 65-year-old female patient, Ms Li, presented with a history of desquamation and skin peeling of the palms of both hands and the soles of both feet, inflamed dermatitis and occasional blisters for 3 years, and an ulcer on the right heel for 2 months. Her skin conditions and wounds were not healed by moist wound healing methods in two grade III, class A hospitals in the province.
Her past medical history included being diagnosed 13 years ago with breast cancer. Further, axillary lymph node metastasis and bilateral lung metastasis occurred 4 years ago. After six courses of chemotherapy, Xeloda 1.5g BID was taken orally as targeted therapy, and the disease did not progress. After oral administration of Xeloda for 2 weeks, grade I and II HFS appeared, such as dry hands and feet and desquamation.
Systemic evaluation
A systemic evaluation of Ms Li included the following reviews:
- Laboratory examinations undertaken within the last 6 months showed:
- CEA (carcinoembryonic antigen) marker was 5.53–12ng/ml (normal: 0-5).
- Ca (Cancer antigen)-153: 20.04–28.45u/ml (normal: 0–25).
- Pain assessment. Numeric Rating Scale (NRS) score: 8 points (0 represents no pain and 10 represents the worst pain imaginable).
- Mobility: unable to walk affecting normal life, e.g. family members were required to use a wheelchair to push Ms Li to the clinic for dressing changes.
- Nutritional status: average; BMI 19.9kg/m2.
- Psychological status: anxiety and fear were exhibited.
- Local lower limb:
- The dorsalis pedis artery and posterior tibial artery had good pulsation after hand felt without formal assessment with equipment.
- No prior history of lower extremity arteriovenous disease.
- Wound assessment:
- Wound location: the right heel.
- Wound measurement: the size of the wound bed was 5x5cm.
- Wound bed: the wound bed was covered with 100% yellow sloughy non-viable tissue.
- Wound exudate: there was a medium amount of exudate that was purulent and had a slight odour.
- Wound edge: a black hard scab was evident and circumferential around the wound bed.
- The peri-wound skin was dry and a large portion of dry epidermis was peeled away during wound cleansing (Figure 1).
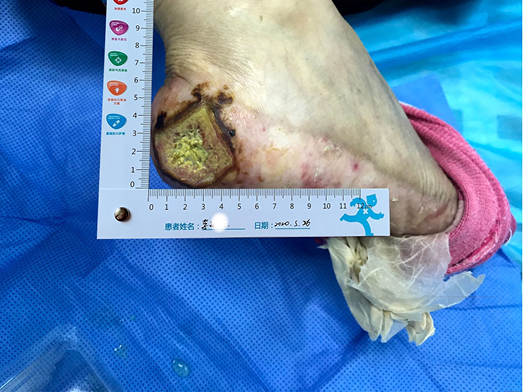
Figure 1. The wound on presentation
Multidiscipinary team and nursing care plan
From a nursing perspective there were a number of difficulties encountered and challenges to be overcome. These included:
- Assessing and managing a chronic non-healing wound. The wound was not healed after 2 months of moist healing treatment in two other grade III, class A hospitals in the province.
- Identifying the cause and type of wound. Was this a cancerous wound, pyoderma gangrenosum or HFS with an accompanying severe ulcer? There was no clear pathology or definitive diagnosis.
- Oral Xeloda therapy can affect wound healing. This raised the question of whether oral Xeloda could be reduced or stopped.
Due to the above nursing assessment and nursing difficulties, a multidisciplinary team (MDT) consultation, including the general surgeon, oncologist and wound care nurse, was quickly convened. Representatives from the relevant departments of the hospital were invited to formulate a diagnosis and treatment plan. The general surgery department suggested that pathology and bacterial culture should be undertaken. The results showed there were dense perivascular and interstitial neutrophilic infiltration of the tissue. However, there were no signs of vasculitis or malignant tumour. The bacteria cultured were identified as Proteus. The diagnosis of grade III HFS with rare severe ulcer was confirmed. Post oncology consultation, the oncologist’s opinion was that, considering the recurrence of breast cancer after 4 years, double lung metastasis as well as multiple unstable tumour markers, oral Xeloda could not be reduced or stopped.
Wound management: initial strategies
The initial goals of wound management were to control infection, promote autolysis of and debride non-viable tissue when required, and to relieve pain. The principles of TIME (Tissue, Infection, Moisture, Exudate) were used to guide local wound management and manage the characteristics of the wound described above. Normal saline and gauze was used to clean and mechanically debride the wound bed. Considering the moderate amount of wound exudate, and dry skin at the edge and around the wound, a sulfadiazine silver lipid hydrocolloid dressing was selected as the primary contact layer to control infection and keep the wound moist. The function of this dressing is to reduce the bacterial burden within the wound and control infection, assist with autolysis and debridement, and reduce pain during dressing changes12. The skin around the wound was dry and partly desquamated. In order to prevent avulsion, a soft silicone foam dressing was used as the secondary or external dressing, which also absorbed the exudate vertically and protected the fragile peri-wound skin.
Evaluation
Initial wound management strategies
After using the sulfadiazine silver lipid hydrocolloid dressing from 26 May to 4 June, the localised infection was controlled. Autolysis of non-viable tissue via the dressing product in conjunction with mechanical debridement had occurred, leaving the wound bed with 100% granulation tissue. The wound edge retained a little dip and within the peri-wound skin part of the epidermis was still exfoliated (Figure 2). The amount of wound exudate remained moderate but the odour had disappeared. Dressing pain was reduced. The size of the wound bed was reduced from 5x5cm to 4.5x4.5cm (Figures 3 & 4). The NRS score was reduced to 6 points, and the patient could be helped by her family to come to the clinic for dressing changes.
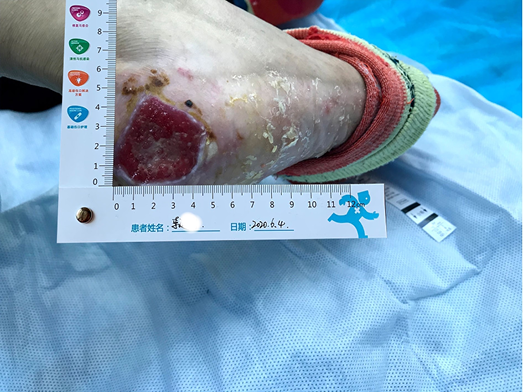
Figure 2. Autolysis of non-viable tissue revealing granulation tissue
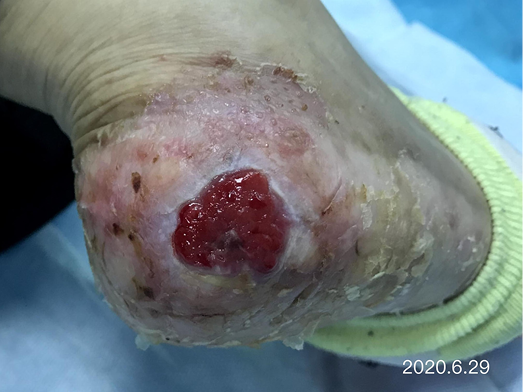
Figure 3. Continued wound healing
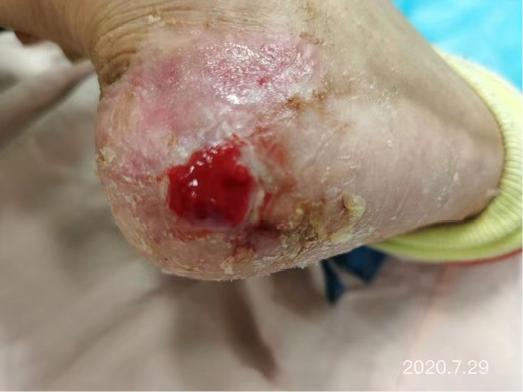
Figure 4. Continued wound healing
Secondary wound management strategies
After the wound infection was controlled and non-viable tissue was removed from the wound bed, the sulfadiazine silver lipid hydrocolloid was stopped and the treatment plan was changed. After considering the delays in wound healing that had occurred over a 2-month period within other hospitals plus our hospital, consideration was given as to what other auxiliary wound management products could be used to promote granulation tissue and epidermal cell regeneration to facilitate wound closure of this chronic wound. Therefore, to guide selection of another primary dressing, the MDT considered the factors under ‘S’ in the acronym MOIST. MOIST was developed as an adjunct to TIME to cater for the development of new wound technologies. MOIST refers to ‘M’ Moisture balance; ‘O’ Oxygen balance; ‘I’ Infection control; ‘S’ Support and ‘T’ Tissue management13. The S refers to modification of the wound environment e.g. inflammatory mediators, pH levels and growth factors. Consequently, a biocellulose wound dressing (Nanoderm® from China Shandong Nameide Biotechnology) was selected. This is a natural biomaterial which is safe and non-stimulating for tumour growth within cancer patients and can effectively promote granulation tissue and epidermal cell regeneration. A soft silicone foam dressing was chosen for the secondary/external dressing.
After dressing changes every 3–4 days, the granulation tissue increased and the size of the wound gradually reduced. By 11 August, the wound had narrowed to 1.5x1.5cm and entered the epithelialisation stage (Figure 5). The primary biocellulose wound dressing was discontinued. The skin around the wound was fragile and so the soft silicone foam dressing was still used. At this time, the NRS score was 2, and the patient could come to the hospital for dressing changes. After almost 3 months’ treatment, the wound had healed completely on 31 August (Figure 6). At follow-up 6 months later, the patient’s ulcer had not re-ocurred. In order to express her gratitude, the patient specifically came to the clinic and said that she had recovered her state of health to that of 4 years ago and had returned to a normal life that included square dancing.
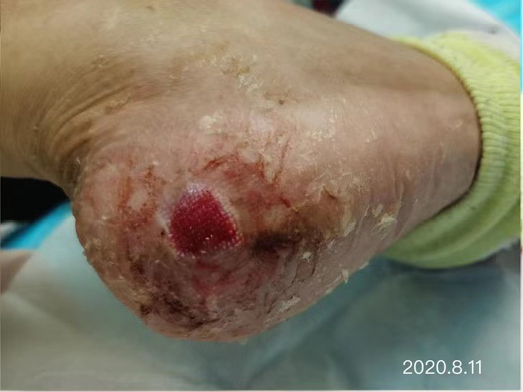
Figure 5. The epithelialisation stage
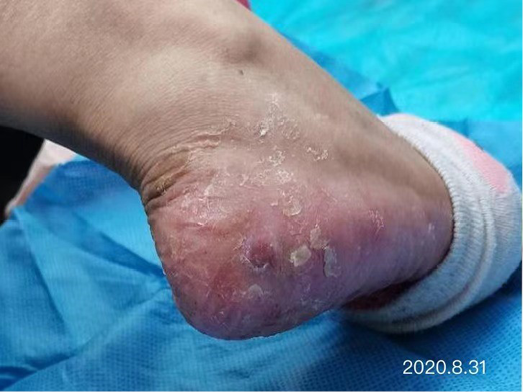
Figure 6. Final stages of healing
Discussion
Many articles were searched for the best evidence to assist with the management of this case. In terms of systemic therapy, Xeloda-targeted therapy combined with high-dose vitamin B6 (300mg/d) and Vit E cream for both hands and feet can reduce the severity of HFS14. Nearly half of the patients treated thought that HFS is the most serious side effect of chemotherapy received, which has a serious impact on the confidence and compliance of treatment. It is important to provide patients who will receive Xeloda therapy relevant knowledge of the benefits and side effects of the treatment and health guidance to manage any adverse effects. Having sufficient psychological preparation may assist patients to overcome the underlying disease and any treatment related side effects. The effective management of chronic wounds is enhanced through a MTD approach to determine the cause of the wound and factors that may complicate wound healing, and to determine evidence-based wound management strategies to facilitate wound healing and improve patients’ quality of life15.
Summary
HFS with severe skin ulcers is very rare. When Xeloda is unable to be reduced or stopped, the wound is difficult to heal. This presents great challenges to wound specialist nurses in determining wound management strategies. In this case, through MDT consultation and wound specialist nurse evaluation of the patient, the wound and systemic treatments, the wound infection was controlled using a sulfadiazine silver lipid hydrocolloid dressing, and a biocellulose dressing was applied to effectively promote granulation tissue and epidermal cell regeneration. In this case the treatment of primary disease was not affected, the patient’s pain was minimised, and wound healing realised.
Cuidados de enfermagem da síndrome mão-pé grave causada pelo medicamento oral anti-tumor Xeloda: um estudo de caso
Shuangshuang Zhang, Wenxing Zhao and Mengmeng Zhang
DOI: https://doi.org/10.33235/wcet.42.1.29-33
Sumário
Este estudo de caso resume a experiência de enfermagem de um paciente com síndrome mão-pé de grau III (HFS) causado pelo medicamento oral anti-tumor Xeloda. Os pontos-chave da enfermagem foram uma consulta de equipa multidisciplinar para realizar um diagnóstico claro da HFS de grau III, controlar eficazmente a infecção, aplicar um penso biocelulósico e promover o crescimento da granulação e a regeneração das células epidérmicas, com base na premissa de que o medicamento anti-tumor Xeloda não pode ser reduzido ou parado. Após 98 dias de intervenção de enfermagem abrangente, a ferida cicatrizou completamente; após 6 meses, a úlcera não voltou a ocorrer.
Introdução
Este estudo de caso resumirá a experiência de enfermagem no cuidado de um paciente com síndrome mão-pé de grau III (HFS) causado pelo medicamento oral antitumoral Xeloda (Capecitabina). Os pontos-chave dos cuidados de enfermagem residem na importância de um processo de consulta de uma equipa multidisciplinar (MDT) para fornecer um diagnóstico definitivo de uma HFS de grau III, controlar eficazmente a infecção e aplicar um penso biocelulósico à ferida para promover o crescimento do tecido de granulação e a regeneração das células epidérmicas, com base na premissa de que o medicamento anti-tumor Xeloda não poderia ser reduzido ou interrompido. Após 98 dias de intervenções de enfermagem abrangentes, a ferida tinha sarado completamente; após 6 meses, a úlcera não tinha voltado a ocorrer.
A HFS é também conhecida como eritrodisestesia palmar-plantar, síndrome, eritema acral e síndrome de Burgdorf. É uma reacção cutânea dermatológica adversa que pode ocorrer em pacientes com tumores malignos durante tratamentos com quimioterapia sistémica ou com terapia molecular orientada1–3. A lesão localizada nos tecidos ocorre como resultado de uma reacção tóxica causada pela acumulação de fármacos devido a danos no sistema da glândula écrina. Além disso, as drogas utilizadas são excretadas sob a forma de suor nos capilares dos membros terminais das palmas das mãos e das plantas dos pés, tornando estas áreas mais susceptíveis ao HFS. A vascularidade e o aumento das pressões e da temperatura da pele das mãos e da dos pés podem exacerbar este efeito2,4. Embora o HFS não ponha a vida em risco, pode afectar gravemente a qualidade de vida de uma pessoa, especialmente no caso das pessoas mais idosas3. As manifestações clínicas da HFS são a dormência palmo-plantar, a insensibilidade, a sensação de formigueiro, o inchaço rápido da pele ou eritema, a descamação, a rachadura da pele ou bolhas (geralmente fase avançada) ou ainda dor intensa3,5. As palmas das mãos normalmente são afectadas em primeiro lugar. Podem existir agravamentos progressivos de quaisquer lesões cutâneas.
É importante que o HFSR não seja confundido com a reacção cutânea de mão-pé (HFSR) resultante da utilização de multikinase ou de inibidores BRAF. As reacções da pele resultantes do uso destes grupos de drogas manifestam-se atarvés do surgimento de placas hiperqueratóticas amareladas e dolorosas nos calcanhares, nas pontas dos dedos, dentro dos espaços interdigitais da teia e sobre as articulações3.
Segundo o National Cancer Institute (NCI)6, a HFS está dividida em três graus: grau I apresenta dermatite com alterações cutâneas (tais como desaparecimento de impressões digitais, pigmentação, eritema, dormência cutânea, insensibilidade, parestesia, descamação, etc.) com ou sem dor; grau II origina mudança de pele ou dermatite, com dor mas sem disfunção; grau III provoca mudança de pele ou dermatite (tais como descamação húmida da pele, úlcera, bolha), dor e disfunção graves. São raras as úlceras graves de Grau III. As manifestações patológicas das úlceras de grau III consistem em degeneração vacuolar (liquefacção) de queratinócitos basais, infiltração de linfócitos em torno de vasos cutâneos, apoptose de queratinócitos e edema cutâneo7. A marca antitética Xeloda denominada comprimidos de capecitabine, a nova geração de medicamentos orais fluorouracil de largo espectro antitumoral8, são utilizados para o tratamento de pacientes avançados com cancro da mama após quimioterapia; as células tumorais podem ser intencionalmente mortas se o Xeloda for utilizado independentemente. A Xeloda também pode ser utilizada conjuntamente com outros agentes de quimioterapia9. Além disso, a Xeloda é normalmente tomada oralmente BD a seguir à toma dos alimentos e nos casos de cancro da mama metastásico, a Xeloda é utilizada para a terapia de manutenção, enquanto permanecer eficaz. As reacções adversas à Xeloda incluem principalmente HFS, náuseas, diarreia e neutropenia. A incidência de HFS é a mais elevada de entre as reacções adversas à Xeloda, atingindo 45-68%8. Além disso, entre 20 a 50% dos pacientes que utilizaram Xeloda foram forçados a reduzir a dose ou mesmo interromper o tratamento devido à HFS10,11.
A 26 de Maio de 2020, um paciente com HFS grave de grau III causado por Xeloda oral foi admitido na clínica especializada do nosso hospital em incontinência de ostomia de ferida. Sem parar o medicamento, a ferida foi completamente cicatrizada em 98 dias no seguimento de uma intervenção médica e de enfermagem abrangente. Os métodos de enfermagem são relatados da seguinte forma.
Apresentação do caso
Antecedentes
Uma paciente de 65 anos de idade, a Sra. Li, apresentou um historial de descamação e de perda da pele das palmas das mãos e das plantas dos dois pés, dermatite inflamada e bolhas ocasionais durante 3 anos e uma úlcera no calcanhar direito durante 2 meses. As suas condições de pele e de feridas não foram cicatrizadas por métodos de cicatrização de feridas húmidas em dois hospitais de grau III, classe A da sua província.
A sua história médica anterior incluiu ter sido diagnosticada há 13 anos com cancro da mama. Para além disso, a metástase dos gânglios linfáticos axilares e a metástase pulmonar bilateral ocorreram há 4 anos. Após seis sequências de tratamentos por quimioterapia, a Xeloda 1,5g BID foi tomada oralmente como terapia orientada e a doença não progrediu. Após a administração oral de Xeloda durante 2 semanas, surgiram HFS de grau I e II, apresentando mãos e pés secos e descamação.
Avaliação sistémica
Uma avaliação sistémica da Sra. Li incluiu as seguintes revisões:
- Os exames de laboratório realizados nos últimos 6 meses mostraram que:
- O marcador CEA (antígeno carcinoembriónico) era de 5,53-12ng/ml (normal: 0-5).
- Ca (antigénio cancerígeno)-153: 20.04-28,45u/ml (normal: 0–25).
- Avaliação da dor. Escala numérica de classificação (NRS): 8 pontos (0 representa sem dor e 10 representa a pior dor imaginável).
- Mobilidade: incapaz de andar afectando a vida normal, por exemplo, os membros da família eram obrigados a usar uma cadeira de rodas para empurrar a Sra. Li para a clínica para proceder à troca de pensos.
- Estado de nutrição: média; IMC 19,9kg/m2.
- Estado psicológico: a ansiedade e o medo foram evidenciados.
- Membro inferior local:
- A artéria dorsal do pé e a artéria tibial posterior tiveram uma boa pulsação, depois de terem sido sentidaa à mão sem avaliação formal com equipamento.
- Não existia historial anterior de doença arteriovenosa das extremidades inferiores.
- Avaliação de feridas:
- Localização da ferida: no calcanhar direito.
- Medida da ferida: o tamanho do leito da ferida era de 5x5cm.
- leito da ferida: o leito da ferida estava coberto com tecido não viável viscoso amarelo a 100%.
- Exsudado de ferida: havia uma quantidade média de exsudado que era purulento e que tinha um ligeiro odor.
- Bordo da ferida: uma sarna negra dura circunferencial era evidente ao redor do leito da ferida.
- A pele peri-ferida estava seca e uma grande porção de epiderme seca foi descascada durante a limpeza da ferida (Figura 1).

Figura 1. A ferida apresentada
Equipa multidisciplinar e plano de cuidados de enfermagem
Do ponto de vista da enfermagem, existiram uma série de dificuldades encontradas e desafios a serem ultrapassados. Estes incluíam:
- Avaliar e gerir uma ferida crónica não cicatrizante. A ferida não foi cicatrizada após 2 meses de tratamento de cicatrização húmida em dois outros hospitais de grau III, classe A da sua província.
- Identificar a causa e o tipo de ferida. Era uma ferida cancerosa, com pioderma gangrenoso ou HFS acompanhada por uma úlcera grave? Não se identificou uma patologia clara nem um diagnóstico definitivo.
- A terapêutica oral com Xeloda pode afectar a cicatrização de feridas. Esta situação levantou a questão de saber se o Xeloda oral poderia ser reduzido ou interrompido.
Devido à avaliação e às dificuldades de enfermagem acima referidas, foi rapidamente convocada uma consulta multidisciplinar (MDT), incluindo o cirurgião geral, o oncologista e o enfermeiro de cuidados a feridas. Representantes dos departamentos relevantes do hospital foram convidados a formular um diagnóstico e também um plano de tratamento. O departamento de cirurgia geral sugeriu a realização de uma patologia e de uma cultura bacteriana. Os resultados mostraram que existiu no tecido uma infiltração densa perivascular e intersticial neutrofílica. No entanto, não foram detectados sinais de vasculite ou de tumor maligno. As bactérias cultivadas foram identificadas como sendo Proteus. Foi confirmado o diagnóstico de HFS grau III com úlcera grave rara. Após a realização de consulta de oncologia, a opinião do oncologista foi de que, considerando a recorrência do cancro da mama após 4 anos, a dupla metástase pulmonar, bem como múltiplos marcadores tumorais instáveis, a Xeloda oral não podia ser reduzida ou interrompida.
Gestão de feridas: estratégias iniciais
Os objectivos iniciais da gestão de feridas passavam por controlar a infecção, promover a autólise e o desbridamento de tecido não viável quando necessário e aliviar a dor. Os princípios de TIME (Tecido, Infecção, Humidade, Exsudado) foram utilizados para orientar a gestão da ferida local e para gerir as características da ferida acima descritas. O soro fisiológico normal e a gaze foram utilizados para limpar e destruir mecanicamente o leito da ferida. Considerando a quantidade moderada de exsudado da ferida e a pele seca no bordo e à volta da mesma, foi seleccionado um penso de sulfadiazina hidrocolóide lipídico de prata como camada de contacto primária para controlar a infecção e manter a ferida húmida. A função deste penso é o de reduzir a carga bacteriana dentro da ferida e também controlar a infecção, ajudar na autólise e no desbridamento e reduzir a dor durante as trocas de penso12. A pele à volta da ferida estava seca e parcialmente descamada. A fim de evitar avulsão, foi utilizado um penso macio de espuma de silicone como penso secundário ou penso externo, que também absorvia o exsudado verticalmente e protegia a pele peri-ferida frágil.
Avaliação
Estratégias iniciais de gestão de feridas
Após a utilização de um penso de sulfadiazina hidrocolóide lipídico de prata de 26 de Maio a 4 de Junho, a infecção localizada foi controlada. Tinha ocorrido a autólise do tecido não viável através do produto de penso e em conjunto com o desbridamento mecânico, deixando o leito da ferida com 100% de tecido de granulação. O bordo da ferida reteve uma pequena depressão e dentro da parte da pele peri-ferida da epiderme ainda estava esfoliada (Figura 2). A quantidade de exsudado da ferida permaneceu moderada, mas o odor tinha desaparecido. As dores associadas ao penso foram reduzidas. O tamanho do leito da ferida foi reduzido de 5x5cm para 4,5x4,5cm (Figuras 3 & 4). A pontuação do NRS foi reduzida para 6 pontos e a paciente passou a poder ser ajudada pela sua família para vir à clínica para trocar de pensos.

Figura 2. Autólise de tecido não viável revelando tecido de granulação

Figura 3. Cicatrização continuada de feridas

Figura 4. Cicatrização continuada de feridas
Estratégias de gestão de feridas secundárias
Após a infecção da ferida ter sido controlada e o tecido não viável ter sido removido do leito da ferida, a sulfadiazina hidrocolóide lipídico de prata foi interrompida e o plano de tratamento foi alterado. Tendo em consideração os atrasos na cicatrização de feridas que tinham ocorrido durante um período de 2 meses em outros hospitais e ainda no nosso hospital, considerou-se que outros produtos auxiliares de gestão de feridas poderiam ser utilizados para promover a granulação de tecido e a regeneração de células epidérmicas, de forma a facilitar o encerramento desta ferida crónica. Por este motivo, para orientar a selecção de outro penso primário, o MDT considerou os factores incluídos em 'S' na sigla MOIST. O MOIST foi desenvolvido como coadjuvante do TIME para providenciar o desenvolvimento de novas tecnologias de feridas. MOIST refere-se ao 'M' equlíbrio da Humidade; 'O' ao equlíbrio do Oxigénio; “I” ao controlo de infecções; “S” ao suporte e “T” àgestão de tecidos13. O S refere-se à modificação do ambiente da ferida, por exemplo, mediadores inflamatórios, níveis de pH e factores de crescimento. Consequentemente, foi seleccionado um penso biocelulósico (Nanoderm® da China Shandong Nameide Biotechnology). Trata-se de um biomaterial natural seguro e que não é estimulante para o crescimento de tumores em pacientes com cancro e que pode promover eficazmente a granulação de tecido e a regeneração de células epidérmicas. Foi escolhido um penso macio de espuma de silicone para penso secundário/externo.
Depois de mudar o penso a cada 3-4 dias, o tecido de granulação aumentou e o tamanho da ferida diminuiu gradualmente. A 11 de Agosto, a ferida tinha diminuído para 1,5x1,5cm e tinha entrado na fase de epitelização (Figura 5). O penso primário da ferida biocelulósica foi interrompido. A pele à volta da ferida era frágil e por isso o penso macio de espuma de silicone era ainda utilizado. Nesta altura, a pontuação do NRS era 2 e o paciente podia vir ao hospital para trocar de penso. Após quase 3 meses de tratamento, a 31 de Agosto, a ferida tinha cicatrizado completamente (Figura 6). No seguimento efectuado 6 meses mais tarde, a úlcera do paciente não tinha voltado a ocorrer. Para expressar a sua gratidão, a paciente deslocou-se especificamente à clínica e transmitiu que tinha recuperado o seu estado de saúde de há 4 anos atrás e que tinha regressado a uma vida normal, o que incluía a dança do quadrado.

Figura 5. A fase de epitelização

Figura 6. Etapas finais da cicatrização
Discussão
Muitos artigos foram pesquisados na procura das melhores provas para ajudar na gestão deste caso. Em termos de terapia sistémica, a terapia orientada para Xeloda- combinada com doses elevadas de vitamina B6 (300mg/d) e o creme Vit E para as mãos e pés pode reduzir a gravidade do HFS14. Quase metade dos pacientes tratados pensavam que a HFS é o efeito secundário mais grave da quimioterapia recebida, o que tem um sério impacto na confiança e na aplicação em conformidade do tratamento. É importante fornecer aos pacientes que irão receber a terapia com Xeloda conhecimentos relevantes sobre os benefícios e sobre os efeitos secundários do tratamento, bem como orientação sanitária para gerir quaisquer efeitos adversos. Ter a preparação psicológica suficiente pode ajudar os pacientes a superar a doença subjacente e quaisquer efeitos secundários relacionados com o tratamento. A gestão eficaz de feridas crónicas é melhorada através de uma abordagem MTD para determinar a causa da ferida e os factores que podem complicar a cicatrização da ferida e também para determinar estratégias de gestão de feridas baseadas em provas, de modo a facilitar a cicatrização da ferida e melhorar a qualidade de vida dos pacientes15.
Resumo
O HFS com úlceras de pele graves é muito raro. Quando não é possível reduzir ou parar a utilização de Xeloda, a ferida é difícil de cicatrizar. Isto representa grandes desafios para os enfermeiros especializados em feridas na determinação de estratégias de gestão de feridas. Neste caso, através da consulta MDT e da avaliação do paciente por enfermeiro de feridas especialista, da ferida e dos tratamentos sistémicos, a infecção da ferida foi controlada utilizando um penso sulfadiazina hidrocolóide lipídico de prata e foi aplicado um penso biocelulósico para promover eficazmente a granulação do tecido e a regeneração das células epidérmicas. Neste caso, o tratamento da doença primária não foi afectado, a dor do paciente foi minimizada e a cicatrização das feridas realizada.
Author(s)
Shuangshuang Zhang MSN, ET
The First Affiliated Hospital of Shandong First Medical University, Shandong Province Qianfoshan Hospital, Jinan, Shandong, China
Wenxing Zhao* MSN, ET
Central Hospital Affiliated to Shandong First Medical University, Jinan Central Hospital Affiliated to Shandong University, Jinan, Shandong, China
Mengmeng Zhang MSN, ET
Central Hospital Affiliated to Shandong First Medical University, Jinan Central Hospital Affiliated to Shandong University, Jinan, Shandong, China
* Corresponding author
References
- Zhang YH, Shao CHY. Nursing experience of 26 cases of hand foot syndrome caused by anti-tumor treatment. Jilin Medical Science 2014;35(7):1568.
- Inokuchi M, Ishikawa I, Furukawa H et al. Treatment of capecetibane-induced hand-foot syndrome using a topical retinoid: a case report. Oncology Letters 2014;7(2):444–448.
- Kwakman JJM, Elshot YS, Punt CJA, Koopman M. Management of cytotoxic chemotherapy-induced hand-foot syndrome. Oncology Reviews 2020;14(1):57–63.
- Xu L, Xue M, Wang J, Zhang W. Analysis of risk factors of hand foot syndrome induced by apatinib mesylate and nursing countermeasures. Nursing Research 2019;33(23):4049–4054.
- Nikolaou V, Syrigos K, Saif MW. Incidence and implications of chemotherapy related hand-foot syndrome. Journal of Expert Opinions of Drug Safety 2016;15(12):1625–1633.
- Dong Y, Lu Z, Yang Y. Nursing research progress of hand foot syndrome caused by capecitabine. Nursing Research 2016;30(1):275–278.
- Janusch M,Fischer M, Marsch WC, et al. The hand-foot syndrome a frequent secondary manifestation in antineoplastic chemotherapy. European Journal of Dermatology 2006;16(5):494–499.
- Li X, Liu D, Wu D, Fan X, Zhang J. Research progress on the relationship between capecitabine related gene polymorphism and hand foot syndrome. Journal of Practical Oncology 2018;32(2):149–153.
- Liu SL, Yu ZY, Liu HF. Xeloda maintenance therapy in the treatment of advanced breast cancer. Chinese and Foreign Women Health 2020;7(13):68,91.
- Guo QH, Ma JL, Zhang J, et al. Clinical observation of hand foot syndrome caused by capecitabine and 5-fluorouracil. Journal of Chinese Medical Guide 2013;11(31):36–37.
- Gao J, He Q, Hua D, et al. Polymorphism of TS 3’ - UTR predicts survival of Chinese advanced gastric cancer patients receiving first-line capecitabine plus paclitaxel. Clinical and Translational Oncology 2013;15(8):619–625.
- Sood A, Granick MS, Tomaselli NL. Wound dressings and comparative effectiveness data. Advances in Wound Care 2014;(3):511–529.
- Dissemond J, Assenheimer B, Engels B et al. Clinical letter, MOIST. Journal of the German Society of Dermatology 2017;(4):443–445.
- Chen Z, Zhou S, Xu S, Ding P, Zhang H. Clinical observation of hand foot soaking formula in the prevention and treatment of capecitabine related hand foot syndrome. China Science and Technology of Traditional Chinese Medicine 2016;23(3):329–330.
- Lei J, Sun L, Li P, Zhu C, Lin Z, et al. The wound dressings and their applications in wound healing and management. Health Science Journal 2019;13(4):662–668.



