Volume 42 Number 4
Risk assessment for pressure injuries
Elizabeth A Ayello and Barbara A Delmore
Keywords pressure injury, risk factors, risk assessment scales
For referencing Ayello EA & Delmore BA. Risk assessment for pressure injuries. WCET® Journal 2022;42(4):31-37
DOI
https://doi.org/10.33235/wcet.42.4.31-37
Submitted 18 November 2022
Accepted 9 December 2022
Abstract
This manuscript highlights commonly used pressure injury (PI) risk assessment instruments (scales) and other considerations that the clinician should contemplate for use in everyday practice to determine if their patient is at risk for a PI.
Introduction
Each year in November, many professional organisations participate in the Stop Pressure Injuries/Ulcers Day. It provides an opportunity to raise awareness about pressure injuries (PIs) to the general public as well as other healthcare professionals. Preventing PIs is an important part of a clinician’s everyday practice. The intent of this article is to provide a succinct summary of some of the commonly used PI risk assessment instruments (scales) as well as other patient characteristics to consider as part of a comprehensive risk assessment process.
Risk Assessment Overview
The purpose of risk assessment is to identify if a person is at risk for a PI and, if so, implement an individualised prevention plan especially considering modifiable and non-modifiable risk factors1. The 2019 International Guideline with implementation recommendations1 provides assistance for clinicians for best practices for individuals at risk for a PI regardless of the care setting. Risk assessment is one of the key components to consider when preventing PIs. It is a systematic process that at minimum includes examination of the person’s skin for any changes, awareness of any devices, including medical and other objects that can cause pressure, assessment of individual patient characteristics that are known to be risk factors, and assessment using a validated/reliable risk assessment instrument (scale) and the clinician’s clinical judgement.
Risk Assessment Instruments
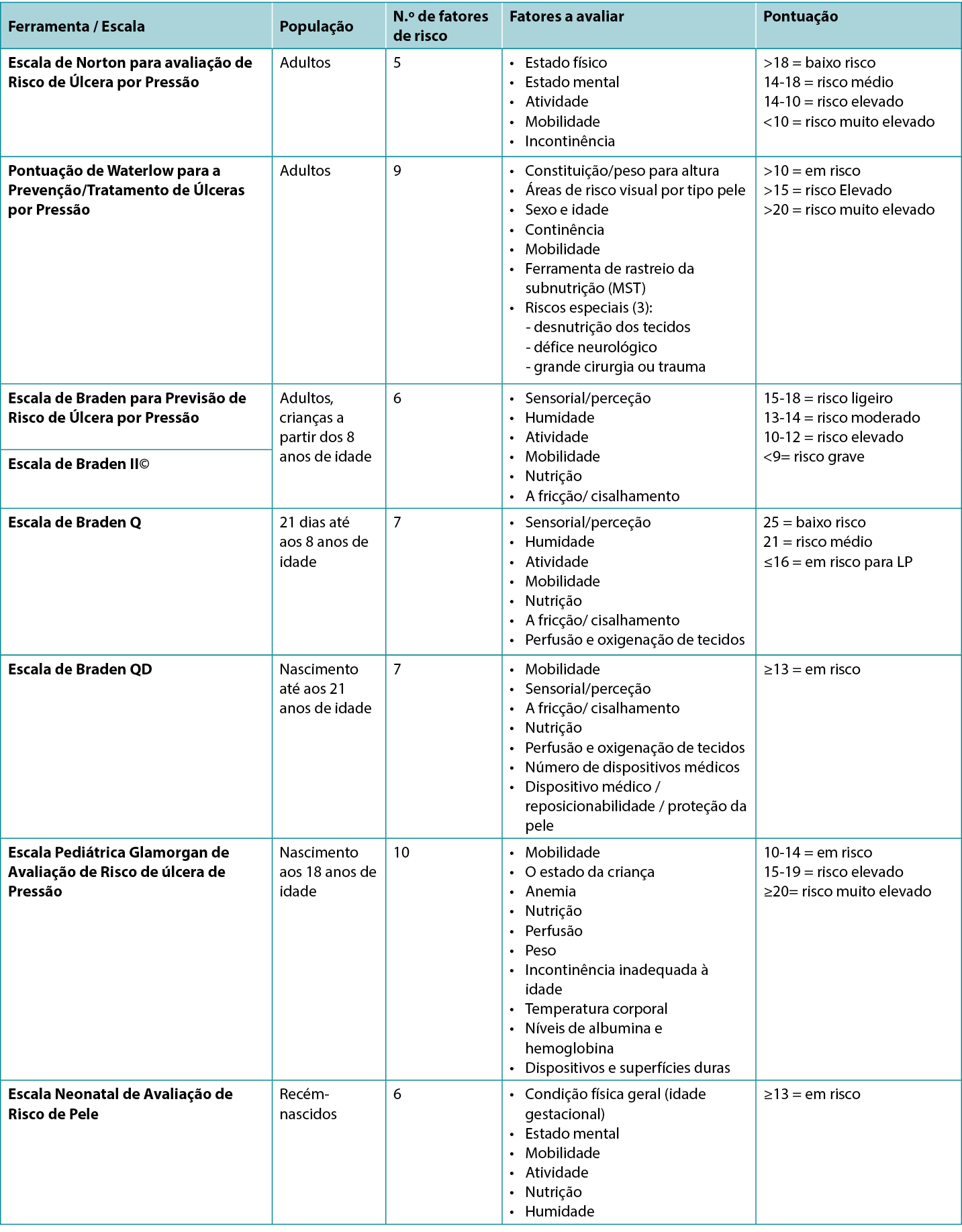
There are several valid and reliable risk assessment instruments (scales) available (Table 1), so it is important to use the one that reflects the age of your population and your practice setting. Some of the risk assessment instruments have a manual of instructions or glossary of terms for their use. The clinician should understand the definition of the terms used in the instrument so that they know how to accurately assess their patient for each of the risk factors outlined in the chosen instrument.
Most practice settings have a specific policy or guidance as to when risk assessments should be performed. The first general practice for performing a risk assessment is upon the person’s admission to a facility, e.g., hospital, long-term care/nursing home, rehabilitation, outpatient setting (e.g., clinics) or homecare assignment. Subsequent risk assessments are based on the clinical setting. For example, in acute care facilities, clinicians perform a risk assessment daily upon transfer to another nursing unit, when the patient’s condition changes, and upon discharge from the facility. In nursing homes or long-term care facilities, clinicians tend to perform risk assessments weekly and upon discharge. In homecare organisations, clinicians tend to perform a risk assessment on every visit, much like outpatient settings. It goes without saying that the clinician should follow the policy of their work setting and accurately evaluate the person according to each risk factor on the instrument. It is important to note that a clinician should also employ their judgment to a person’s PI risk outside of using a risk assessment instrument.
The following section provides a short description of the more commonly used risk assessment instruments.
Adult risk assessment instruments
Norton Pressure Sore Risk-Assessment Scale
Widely acknowledged as the first known scale is the Norton Pressure Sore Risk-Assessment Scale2. It was created in England in 1962 by Doreen Norton. It has five categories (Table 1) to which a number score is assigned based on the descriptor terms. When the numbers are totalled, low risk is determined to be >18, medium risk from 14–18, and lower numbers indicate higher risk, with <10 considered very high risk3.
Waterlow Pressure Ulcer Prevention/Treatment Score
The Waterlow Score was created by Judy Waterlow of the UK in 1985 and was revised in 2005 by Queensland Health4. As seen in Table 1, it has six categories. Additionally, the Malnutrition Screening Tool (MST) is used to assess the person’s nutritional status on this scale. There is also a section entitled ‘Special risks’. The scores are added, with a person being considered at risk when the score is >10, high risk at >15 and very high risk at >20. The back of the scale card has a short summary of prevention strategies as well as the European Pressure Ulcer Advisory Panel (EPUAP) classification definitions; further details can be found at the judy-waterlow.co.uk website5.
Braden Scale for Predicting Pressure Sore Risk
Known by many as the Braden Scale, it was created in the USA by Drs Barbara Braden and Nancy Bergstrom based on a conceptual schema which they published in 19876–8. The Scale has six assessment risk factors – sensory/perception, moisture, activity, mobility, nutrition and friction/shear (Table 1). Several early publications on the validation of the scale were subsequently published8–11. Over the years it has been used around the world and has had much research to validate its use in a variety of skin tones12. Its intended use is for ages 8–100+ years old. A score of 15–18 is considered to be mild risk, 13–14 moderate risk, 10–12 high risk and <9 severe risk.
Braden Scale II©
The Braden Scale for Predicting Pressure Sore Risk was originally published in the late 1980s6–8. Since April 2021, the Braden Scale copyright is now owned by Health Sense Ai and termed the Braden II©13. It has been updated in collaboration with original scale developers, Drs Barbara Braden and Nancy Bergstrom, to the Braden Scale II©. You can apply for copyright permission to use the Braden Scale II© by going to their website (www.bradenscale.com13), completing the licence use forms and paying the fee.
The Braden Scale II© has the same six risk assessment factors as the original Braden Scale – sensory/perception, moisture, activity, mobility, nutrition and friction/shear. Updates to the Braden Scale II© include language to bring the Scale into compliance with currently used taxonomy, like changing pressure sore to pressure injury. In addition, there are updates to the subsection descriptions to facilitate accurate scoring of the instrument among users. There are no changes to the cut scores at which a patient is considered to be at risk, but plan to address in the patient’s plan of care any subscales with higher scores even if the total overall scale score does not indicate the patient is at risk. The Braden Scale II© is available in English, French and Spanish.
To help clinicians score the scale, a glossary of terms has been created and available to use when you obtain copyright use permission. Health Sense AI/HD Nursing also has available several resource materials to help educate clinicians about the Braden Scale II©, including case examples that illustrate how to correctly use the scale13. The Braden Scale II© glossary and training module now make up the Braden Scale II Toolkit© which comes as a package when you licence the Braden Scale II©. This helps ensure staff are trained correctly to use the scale in direct patient care.
Paediatric risk assessment instruments
Braden Q Scale
The Braden Q risk assessment instrument was adapted from the Braden Scale by Curley and colleagues14 and since then has been frequently tested for its reliability and validity15. Its intended use in practice is for paediatric patients aged from 21 days (including corrected to gestational age of 21 days) up to age 8. The instrument includes the same six subscales of the Braden Scale with the addition of a seventh item – tissue perfusion and oxygenation. A score of 25 is considered low risk, 21 is medium risk and 16 or below is considered at risk for a PI (Table 1).
Table 1. Commonly used PI risk assessment instruments (scales) [©Delmore & Ayello 2022]
Braden QD Scale
The Braden QD is one of the newer risk assessment instruments created by Curley and colleagues16 and is based on the Braden Q Scale. Its intended use is for paediatric patients from pre-term ages to 21 years old. It contains five items from the Braden Q (mobility, sensory perception, friction/shear, nutrition, tissue perfusion and oxygenation) plus the addition of number of medical devices and repositionability/skin protection, the latter item specifically addressing medical devices (Table 1). A score of >13 is considered at risk for a PI17.
Glamorgan Paediatric Pressure Ulcer Risk Assessment Scale
This scale was created in the late 2000s as the Glamorgan Paediatric Pressure Ulcer Risk Assessment Scale (Glamorgan Scale) and noted to be the first paediatric risk assessment scale to include devices as one of the risk assessment factors18. Other Scale points address mobility, the child’s condition, anaemia, nutrition, perfusion, weight, incontinence inappropriate for the age, body temperature, albumin and haemoglobin levels, and devices. Any score of 10–14 is considered to be at risk, 15–19 is at high risk, and a score of ≥20 is considered very high risk for a PI.
Neonatal Skin Risk Assessment Scale
This scale was created by Huffines and Logsdon in the late 1990s and was based on the Braden Scale19. It was the first scale tested for reliability and validity for the neonatal population. The neonate is scored based on general physical condition (gestational age), mental state, mobility, activity, nutrition and moisture. A score of ≥13 is considered to be at risk.
Populations at Risk
Older adults
Advanced age (>65 years) is a PI intrinsic risk factor. Much of the risk is from skin changes that occur due to the ageing process such as epidermal thinning and loss of adipose tissue as a protective function. Additionally, disease burden and presence of co-morbidities create PI risk in this population20,21. Assessing risk using a valid and reliable scale is only one component of assessing an older adult’s PI risk. In this case, risk factors should be considered that are not included (e.g., age, disease burden) or reflect the degree of a condition’s severity (e.g., malnutrition)20–22.
Patients with obesity
According to the 2019 International Guideline, patients with obesity are considered a population that requires diligent PI risk assessments23. Obesity is an under recognised complex condition22. The Centers for Disease Control and Prevention (CDC) defines obesity by body mass index (BMI) categories: Class 1, BMI of 30–35kg/m2; Class 2, BMI of 35–40kg/m2; and Class 3, BMI of 40kg/m2 or higher and considered severe24. In this population, PIs occur due to a variety of factors such as malnutrition, diseases and conditions associated with obesity and device-related PIs due to ill-fitting equipment22,23.
Surgical patients
Assessment of the research literature in the 2019 International Guideline supports that the duration of time from when a person is admitted to when they have surgery as well as the length of time they are in surgery may be markers of a patient’s immobility1. Additionally, a person’s American Society of Anesthesiologists (ASA) Physical Status Classification may be a marker of the patient’s clinical status22. All three of these should be considered as risk factors for a person undergoing surgery.
Critical care
Critically ill patients are another special population that should be considered high risk for PI formation and therefore require diligent PI risk assessments23. The reason for this high risk is due to the critical illness of this population, the setting itself, and the abundant presence of medical devices required for treatment25,26. It is paramount to monitor this population closely as the addition of a PI to an already complex situation is considered an additional co-morbidity that can possibly lead to mortality23.
Other Considerations for Risk
Devices and objects
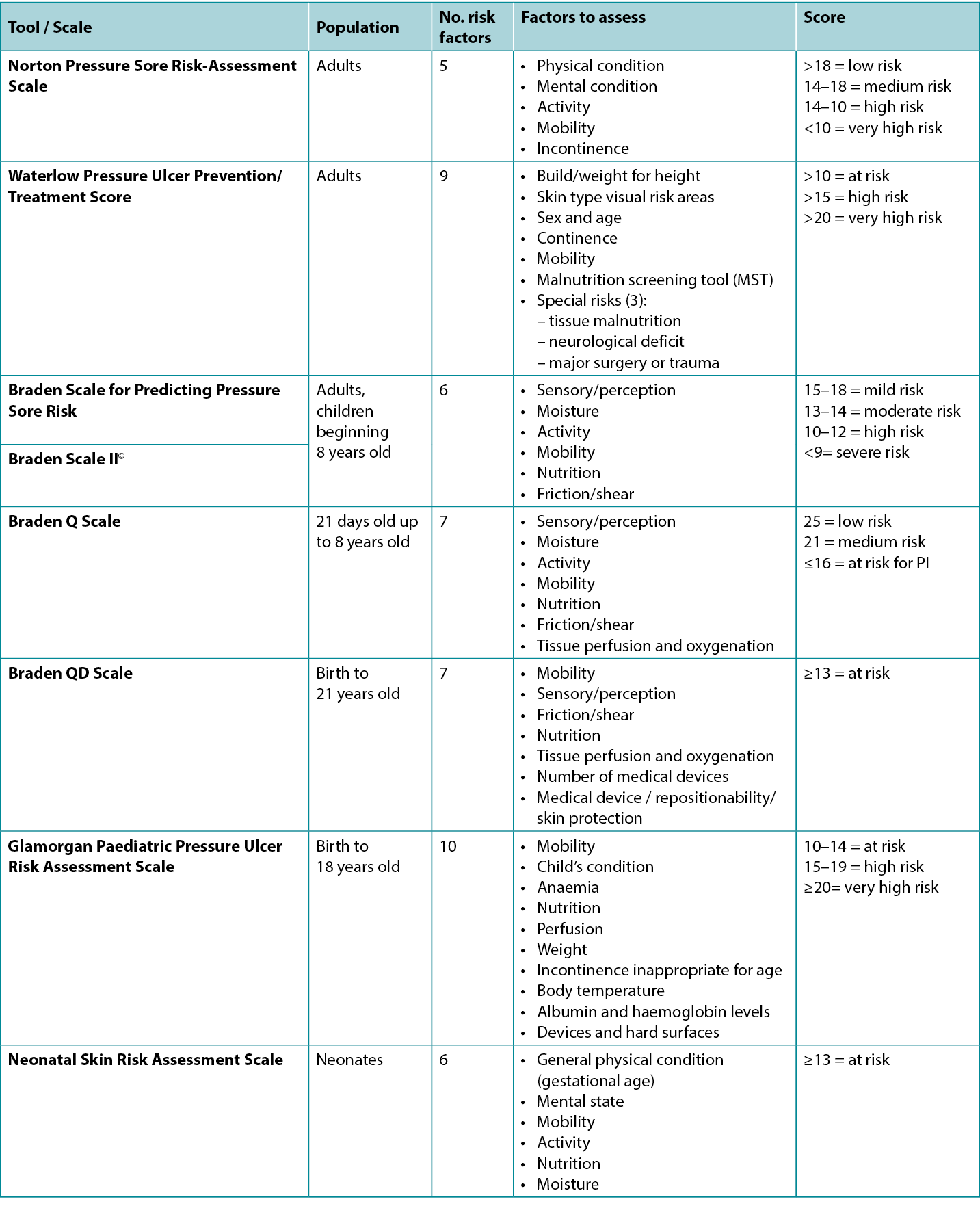
Medical devices and other objects such as eyeglasses and bottle caps can cause PIs27–29. Medical devices are the most frequent aetiology for medical device-related pressure injuries (MDRPI) in neonates and children1,16–18,30 (Figure 1); therefore, consideration for using the Braden QD Scale16 and the Glamorgan Scale18, which both include assessments for medical devices, is warranted.
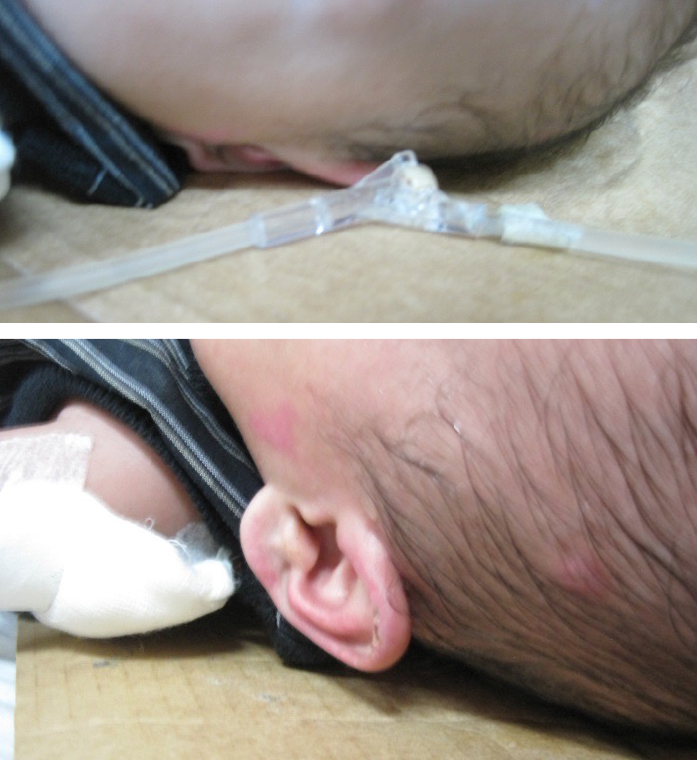
Figure 1. PI that developed from baby lying on IV tubing [©EA Ayello 2015, used with permission]
MDRPI also occur in adults27 (Figure 2). Currently, none of the adult PI risk assessment scales assess for MDRPI even though the 2019 International Guideline does address PI from devices – medical and other sources27. Therefore, raising awareness of devices as an aetiology for device-related PIs in adults is of great importance1,27–29. Consider using the SORE mnemonic to alert staff to medical and other devices that can cause PIs28. Research has supported that MDRPI occur 3 days sooner than other PIs, so staff need to be vigilant in assessing patients who have medical devices29. Remember to keep track of your facility’s MDRPI incidence28. Also, MDRPI on the lip cannot be staged as mucosa, does not keratinise and therefore cannot be staged using the NPIAP staging classification system1,27,28.
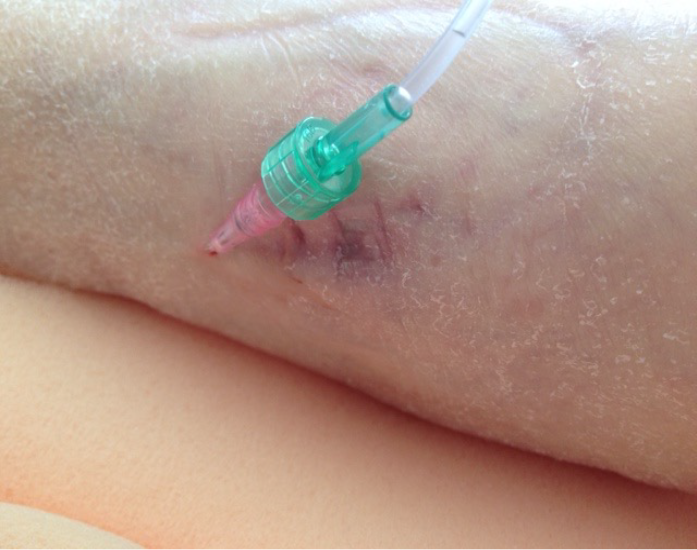
Figure 2. PI as a result of an intravenous (IV) hub that was secured directly to the skin. Notice the imprint on the skin that matches the design of the IV hub [©Delmore 2015, used with permission]
Specific anatomical areas at risk
Heels
Heels are believed to be the second most common anatomical site for PIs31. Due to the anatomy of the heel and limited tissue by the calcaneus, the heel is a particularly vulnerable to risk of a PI31–36 (Figure 3). Two research studies32,33 have provided evidence that patient co-morbidities, specifically diabetes mellitus and vascular disease along with immobility, are risk factors for developing heel PIs and should be considered with assessing a person’s risk for heel PIs along with a validated risk assessment instrument32–34.
Figure 3. Deep tissue pressure injury (DTPI) of the right heel. Unlike Stage 1 PIs that are intact and a lighter red/pink, DTPIs are intact but have a deeper discolouration indicating a deeper level of damage. These full-thickness PIs often evolve to a Stage 3 or 4, or an unstageable PI [©B Delmore & EA Ayello, 2020, used with permission]
In the main analysis (n=337) in one hospital, the predictor variables for heel PIs were diabetes, vascular disease, immobility and Braden Scale <1832. The study was expanded to other hospitals by using data from the New York State Statewide planning and Research Cooperative system (SPARCS)33. The main analysis had 1,697 patients (323 patients who had heel PIs and 1,374 who did not). There were seven significant and independent predictors – diabetes, vascular disease, perfusion issues, impaired nutrition, age >65 years, mechanical ventilation and surgery. Based in part from these two studies, the authors concluded that patient comorbidities, in this instance both diabetes and vascular disease, should be considered as risk factors along with results of formal risk assessment instruments33. Clinicians may find our heels algorithm helpful in their practice34 (Figure 4).
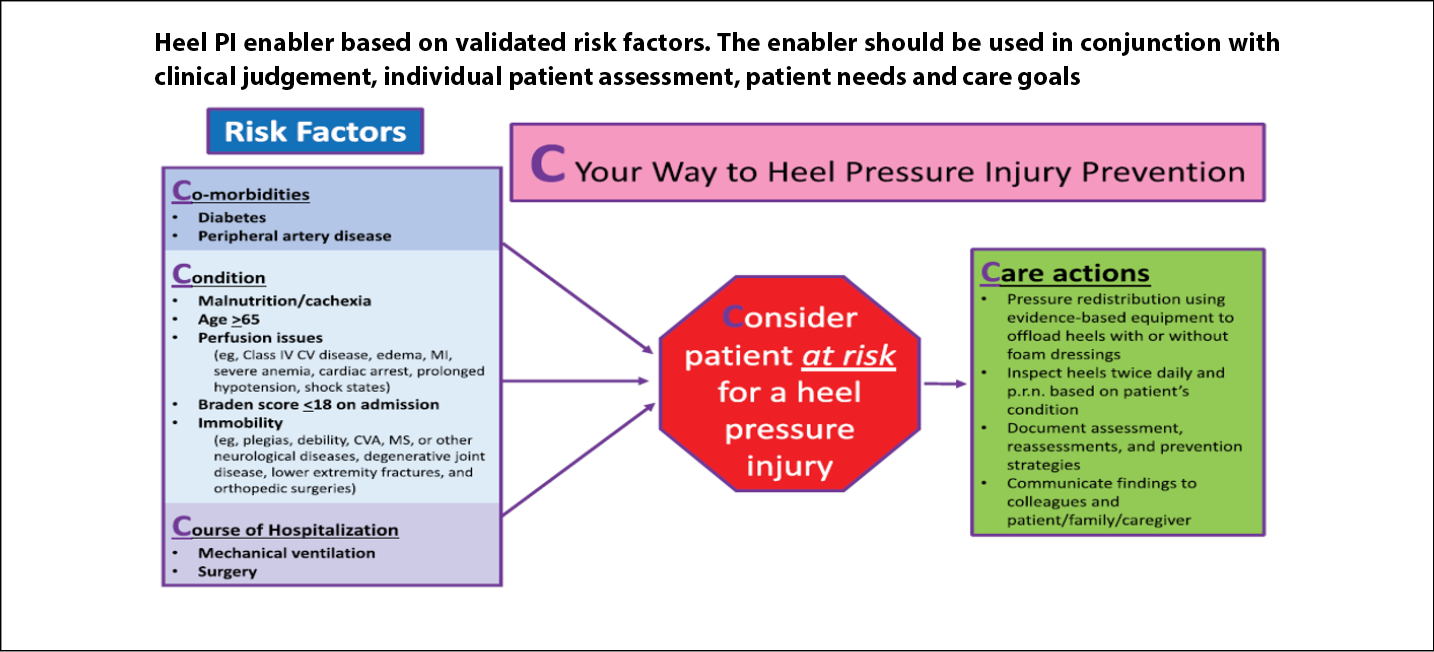
Figure 4. Heel pressure injury algorithm [©Delmore, Ayello & Smart 2020, used with permission]32–34
CV – cardiovascular; CVA – cerebrovascular accident; MI – myocardial infarction; MS – multiple sclerosis
Foot position may also be a risk factor. In another study of 10 healthy male volunteers, there was more strain on the heel tissue when the foot was in external rotation rather than upright (90°)36. Our recent clinical practice point may be helpful to clinicians as to proper foot positioning to help prevent heel PIs34.
Sacrum/coccygeal/ischial tuberosities
The sacrum is the most common anatomical site for PIs. Some research suggests that a patient’s skeletal morphology may be an intrinsic non-modifiable risk for Pl. The work of Gefen37 provides knowledge about changes in persons with spinal cord injury that increase risk for PI. This includes skeletal muscle atrophy, fat infiltration into muscles, bone shape loss leading to flattening of the tips of the ischial tuberosities and thinning of the skin around the ischial tuberositites37.
A recent retrospective case-control study by Delmore and colleagues compared the skeletal sacrococcygeal region of 15 patients with full-thickness PIs to 15 patients without full-thickness PIs using MRIs38. The premise of this study was to determine if the skeletal sacrococcygeal region may act as a possible intrinsic PI risk factor. Findings revealed that patients with full-thickness PIs did have different morphology and morphometry, resembling patients with other conditions. This study also noted that PIs in this region were more located in the coccyx region.
Risk Assessment Instruments and Technology
There is some growing debate in the literature about use of risk assessment scales as they may not capture all important risk factors, so do think about patient comorbidities that may not be captured on a risk assessment scale. There is research to study identification of additional risk factors and/or early indicators for PI including skin temperature39,40 as well as subdermal moisture and imaging41–43. It will be interesting to see how various technologies will reduce cost43. The future of PI risk assessment may include a systematic risk assessment including a valid and reliability scale, patient characteristics such as comorbidities, and technology that will impact on reducing PI incidence.
Conclusion and summary
There are several valid and reliable PI risk assessment scales available for use in practice. Although research continues to provide evidence as to which are the best in terms of predictive ability, identification of patient co-morbidities as well as technology may be additional data to help clinicians identify persons at risk for PIs. It is most important to remember that PI assessment is a process with the care goal of implementing a care plan in a timely manner to prevent avoidable PI44 from occurring.
Conflict of Interest
Dr Ayello was a member of the small working group on medical device-related pressure injuries for the 2019 EPUAP/NPIAP/PPPIA Prevention and treatment of pressure ulcers/injuries1. Dr Delmore is a Board Member of the National Pressure Injury Advisory Panel and is on the Editorial Board for Advances in Skin and Wound Care. She was a member of a small working group on heel pressure injuries for the 2019 EPUAP/NPIAP/PPPIA Prevention and treatment of pressure ulcers/injuries1.
Funding
The authors received no funding for this study.
Avaliação do risco de lesões por pressão
Elizabeth A Ayello and Barbara A Delmore
DOI: https://doi.org/10.33235/wcet.42.4.31-37
Sumário
Este manuscrito destaca os instrumentos de avaliação de risco (escalas) das lesões por pressão (LP) normalmente utilizados e outras considerações que o médico deve ter em conta para utilização na prática diária, a fim de determinar se o seu paciente está em risco para uma LP.
Introdução
Todos os anos em Novembro, muitas organizações profissionais participam no Dia de Parar as Lesões/Úlceras por Pressão. Proporciona uma oportunidade para sensibilizar o público em geral, bem como a outros profissionais de saúde, para as lesões por pressão (LP). Prevenir as LP é uma parte importante da prática diária de um clínico. A intenção deste artigo é o de fornecer um resumo sucinto de alguns dos instrumentos (escalas) de avaliação de risco de LP que são normalmente utilizados, assim como outras características dos pacientes a considerar como parte de um processo abrangente de avaliação de risco.
Visão geral da avaliação de risco
O objetivo da avaliação de risco é o de identificar se uma pessoa está em risco para uma LP e, em caso afirmativo, implementar um plano de prevenção individualizado, especialmente considerando os fatores de risco modificáveis e não modificáveis1. A Diretriz Internacional de 2019 com recomendações de implementação1 fornece assistência aos clínicos para as melhores práticas a utilizar em indivíduos em risco para uma LP, independentemente do ambiente de cuidados. A avaliação dos riscos é um dos componentes-chave a considerar na prevenção de LP. É um processo sistemático que inclui, no mínimo, o exame da pele da pessoa para identificar quaisquer alterações, o conhecimento de quaisquer dispositivos, incluindo objetos médicos e outros que possam causar pressão, a avaliação das características individuais do paciente que se saiba serem fatores de risco e a avaliação utilizando um instrumento de avaliação de risco (escala) validado/fiável e também a avaliação clínica do clínico.
Instrumentos de avaliação de risco
Existem vários instrumentos (escalas) válidos e fiáveis para a avaliação de risco (Quadro 1), pelo que é importante utilizar aquele que reflete a idade da sua população e o seu ambiente de prática. Alguns dos instrumentos de avaliação de risco têm um manual de instruções ou um glossário de termos para a sua utilização. O médico deve compreender a definição dos termos utilizados no instrumento para que saiba como avaliar com precisão o seu paciente em cada um dos fatores de risco definidos no instrumento escolhido.
A maioria dos ambientes de prática têm uma política ou orientação específica sobre o momento em que as avaliações de risco devem ser realizadas. A primeira prática geral para a realização de uma avaliação de risco define que esta é efetuada quando a pessoa é admitida numa unidade, por exemplo, hospital, cuidados de longa duração/casa de internamento, reabilitação, ambulatório (por exemplo, clínicas) ou colocada em cuidados domiciliários. As avaliações de risco subsequentes são baseadas na situação clínica. Por exemplo, em instalações de cuidados intensivos, os clínicos realizam diariamente uma avaliação de risco aquando da transferência para outra unidade de enfermagem, quando o estado do doente muda e no momento da alta da unidade. Em lares ou em instalações de cuidados de longa duração, os clínicos tendem a realizar avaliações de risco semanais e no momento da alta. Nas organizações de cuidados domiciliários, os clínicos tendem a realizar uma avaliação de risco em cada visita, assim como quando está em ambulatórios. É evidente que o clínico deve seguir a política do seu local de trabalho e avaliar com precisão a pessoa de acordo com cada fator de risco identificado no instrumento. É importante notar que um clínico deve também aplicar o seu julgamento para o risco de LP de uma pessoa fora da utilização de um instrumento de avaliação de risco.
A secção seguinte fornece uma breve descrição dos instrumentos de avaliação de risco mais frequentemente utilizados.
Instrumentos de avaliação de risco para adultos
Escala de Norton para avaliação de Risco de Úlcera por Pressão
A Escala de Norton para avaliação de Risco de Úlcera por Pressão é amplamente identificada como a primeira escala conhecida2. Foi criada por Doreen Norton em Inglaterra em 1962. Tem cinco categorias (Quadro 1) e com base nos termos do descritor é atribuída uma pontuação numérica a cada uma. Quando as pontuações são totalizadas, determina-se que o risco baixo é >18, o risco médio de 14-18 e os números inferiores indicam um risco mais elevado, sendo que com <10 são considerados de risco muito elevado3.
Pontuação de Waterlow para a Prevenção/Tratamento de Úlceras por Pressão
A pontuação de Waterlow foi criada em 1985 no Reino Unido por Judy Waterlow e foi revista em 2005 por Queensland Health4. Tem seis categorias, como se pode ver no Quadro 1. Além disso, a Ferramenta de Rastreio de Subnutrição (MST) é utilizada para avaliar o estado nutricional da pessoa nesta escala. Existe também uma secção intitulada "Riscos especiais". As pontuações são totalizadas, sendo uma pessoa considerada em risco quando a pontuação é >10, de risco elevado a >15 e de risco muito elevado a >20. O verso do cartão de escala tem um breve resumo das estratégias de prevenção, assim como as definições de classificação do European Pressure Ulcer Advisory Panel (EPUAP); mais detalhes podem ser encontrados no site judy-waterlow.co.uk5.
Escala de Braden para Previsão de Risco de Úlcera por Pressão
Conhecida por muitos como a Escala Braden, foi criada nos EUA pelas Drs. Barbara Braden e Nancy Bergstrom, com base num esquema conceptual que publicaram em 19876–8. A Escala tem seis fatores de risco para avaliação - sensorial/perceção, humidade, atividade, mobilidade, nutrição e fricção/cisalhamento (Quadro 1). Várias publicações iniciais sobre a validação da escala foram publicadas posteriormente 8-11. Ao longo dos anos tem sido utilizado em todo o mundo e tem tido muita pesquisa para validação da sua utilização numa variedade de tons de pele12. A sua utilização está prevista para idades compreendidas entre os 8-100+ anos de idade. Uma pontuação de 15-18 é considerada de risco moderado, de 13-14 risco moderado, de 10-12 risco elevado e <9 risco grave.
Escala de Braden II©
A Escala de Braden para Previsão de Risco de Úlcera por Pressão foi originalmente publicada nos finais dos anos 806-8. Os direitos de autor da Escala Braden são desde Abril de 2021 propriedade da Health Sense Ai e agora denominados Braden II©13. Foi atualizada para a Escala Braden II© em colaboração com os criadores da escala original, Drs. Barbara Braden e Nancy Bergstrom. Pode solicitar autorização de direitos de autor para utilizar a Escala de Braden II© acedendo ao seu site(www.bradenscale.com13), preenchendo os formulários de utilização da licença e pagando a respectiva taxa.
A Escala Braden II© tem os mesmos seis fatores de avaliação de risco que a Escala Braden original - sensorial/perceção, humidade, actividade, mobilidade, nutrição e fricção/ cisalhamento. As atualizações da Escala de Braden II© incluem linguagem para conseguir que a Escala esteja em conformidade com a taxonomia atualmente utilizada, como sendo a alteração de úlcera por pressão a lesões por pressão. Adicionalmente, existem atualizações às descrições das subsecções para facilitar aos utilizadores a pontuação exata do instrumento. Não existem alterações nas pontuações de corte em que um paciente é considerado em risco, mas pretende-se abordar no plano de cuidados ao paciente quaisquer subescalas com pontuações mais elevadas, mesmo que a pontuação total da escala global não indique que o paciente está em risco. A Escala de Braden II© está disponível em inglês, francês e em espanhol.
Para ajudar os clínicos a pontuar a escala, foi criado e disponibilizado um glossário de termos para utilização quando se obtém a permissão de utilização por parte dos direitos de autor. A Health Sense AI/HD Nursing também dispõe de vários materiais de recurso para ajudar a educar os clínicos sobre a Escala Braden II©, incluindo exemplos de casos que ilustram como utilizar corretamente a escala13. O glossário Braden Scale II© e o módulo de formação compõem agora o Braden Scale II Toolkit© que é apresentado como um pacote quando se licencia a Braden Scale II©. Isto ajuda a garantir que os funcionários são formados corretamente para utilização da escala nos cuidados diretos ao paciente.
Instrumentos de avaliação de risco pediátrico
Escala de Braden Q
O instrumento de avaliação de risco Braden Q foi adaptado da Escala Braden por Curley e colegas14 e, desde então, tem sido frequentemente testado no que diz respeito à sua fiabilidade e validade15. Na prática a sua utilização destina-se a pacientes pediátricos com idades compreendidas entre os 21 dias (incluindo os corrigidos até à idade gestacional de 21 dias) e os 8 anos de idade. O instrumento inclui as mesmas seis subescalas da Escala de Braden, mas com a inclusão de um sétimo item - perfusão e oxigenação de tecidos. Uma pontuação de 25 é considerada de baixo risco, 21 de risco médio e 16 ou menos é considerada de risco para uma LP (Quadro 1).
Quadro 1. Instrumentos (escalas) de avaliação de risco de LP mais frequentemente utilizados [©Delmore & Ayello 2022]
Escala de Braden QD
O Braden QD é um dos mais recentes instrumentos de avaliação de risco criados por Curley e colegas16 e está baseado na Escala Braden Q. Destina-se a ser utilizado em pacientes pediátricos, desde a idade pré-termo até aos 21 anos de idade. Contém cinco itens do Braden Q (mobilidade, perceção sensorial, fricção/cisalhamento, nutrição, perfusão e oxigenação de tecidos) aos quais se adiciona o número de dispositivos médicos e reposicionabilidade/proteção da pele, este último item abordando especificamente os dispositivos médicos (Tabela 1). Uma pontuação de >13 é considerada de risco para um LP17.
Escala Pediátrica Glamorgan de Avaliação de Risco de úlcera de Pressão
Esta escala foi criada no final dos anos 2000 como a Escala Pediátrica Glamorgan de Avaliação de Risco de Úlcera de Pressão (Escala Glamorgan) e referenciada como sendo a primeira escala de avaliação de risco pediátrica a incluir dispositivos como um dos fatores de avaliação de risco18. Outros pontos da escala abordam a mobilidade, o estado da criança, anemia, nutrição, perfusão, peso, incontinência inadequada para a idade, temperatura corporal, níveis de albumina e hemoglobina e dispositivos. Qualquer pontuação de 10-14 é considerada de risco, de 15-19 é considerada de alto risco e uma pontuação de ≥20 é considerada de muito alto risco para um LP.
Escala Neonatal de Avaliação de Risco de Pele
Esta escala foi criada por Huffines e Logsdon no final dos anos 90 e foi baseada na Escala de Braden19. Foi a primeira escala testada relativamente à fiabilidade e validade para uma população neonatal. O recém-nascido é pontuado com base na condição física geral (idade gestacional), estado mental, mobilidade, atividade, nutrição e humidade. Uma pontuação de ≥13 é considerada como em risco.
Populações em risco
Adultos mais idosos
A idade avançada(>65 anos) é um fator de risco intrínseco da LP. Muito do risco é originado por alterações cutâneas que ocorrem devido ao processo de envelhecimento, tais como o desbaste epidérmico e a perda de tecido adiposo como função protetora. Além disso, o peso da doença e a presença de comorbidades nesta população criam um risco de LP20,21. A avaliação de risco utilizando uma escala válida e fiável é apenas uma componente da avaliação do risco de LP de um adulto mais idoso. Nestes casos, devem ser considerados fatores de risco que não estão incluídos (por exemplo, idade, peso da doença) ou que refletem o grau de gravidade de uma condição (por exemplo, subnutrição)20-22.
Pacientes com obesidade
De acordo com a Diretriz Internacional de 2019, os pacientes com obesidade são considerados uma população que requer avaliações diligentes de risco de LP23. A obesidade é uma condição complexa reconhecida22. Os Centros de Controle e Prevenção de Doenças (CDC) definem a obesidade por categorias de índice de massa corporal (IMC): Classe 1, IMC de 30-35kg/m2; Classe 2, IMC de 35-40kg/m2; e Classe 3, IMC de 40kg/m2 ou superior e considerado severo24. Nesta população, os LP ocorrem devido a uma variedade de fatores tais como a desnutrição, doenças e condições associadas à obesidade e LP relacionadas com os dispositivos originados por equipamento mal adaptado22,23.
Pacientes cirúrgicos
A avaliação da literatura de investigação na Diretriz Internacional de 2019 sustenta que a duração do tempo a partir do momento em que uma pessoa é admitida até quando é operada, bem como o período de tempo em que está em cirurgia, podem ser marcadores da imobilidade de um paciente1. Além disso, a Classificação do Estado Físico pela Sociedade Americana de Anestesiologistas (ASA) de uma pessoa pode ser um marcador do estado clínico do paciente22. Todos estes três aspetos devem ser considerados como fatores de risco para uma pessoa submetida a cirurgia.
Cuidados intensivos
Os pacientes críticos são outra população especial que deve ser considerada de alto risco para a formação de LP e que, portanto, requer avaliações diligentes de risco de LP23. A razão deste elevado risco deve-se à doença crítica desta população, ao cenário em si e à presença abundante de dispositivos médicos necessários para o tratamento25,26. É primordial monitorizar de perto esta população, uma vez que a adição de uma LP a uma situação já de si complexa é considerada uma comorbilidade adicional, a qual pode eventualmente levar à mortalidade23.
Outras Considerações sobre o Risco
Dispositivos e objetos
Os dispositivos médicos e outros objetos, tais como óculos e tampas de garrafas, podem causar LP27-29. Os dispositivos médicos são a etiologia mais frequente para lesões por pressão em recém-nascidos e crianças relacionadas com dispositivos médicos (MDRPI)1,16-18,30 (Figura 1); portanto, justifica-se considerar a utilização da Escala de Braden QD16 e da Escala Glamorgan18, já que ambas incluem avaliações para dispositivos médicos.

Figura 1. LP que se desenvolveu a partir de bebé deitado em tubos IV [©EA Ayello 2015, usado com autorização]
O MDRPI também ocorre em adultos27 (Figura 2). Atualmente, nenhuma das escalas de avaliação de risco de LP de adultos avalia o MDRPI, apesar de a Diretriz Internacional de 2019 abordar a LP de dispositivos - médicos e de outras origens27. Por conseguinte, a sensibilização sobre os dispositivos em adultos como etiologia para as LP relacionadas com dispositivos é de grande importância1,27-29. Considerar a utilização da mnemónica SORE para alertar os funcionários para dispositivos médicos e para outros dispositivos que possam causar LP28. A investigação tem apoiado que o MDRPI ocorre 3 dias mais cedo do que outros LP, pelo que os funcionários precisam de estar vigilantes na avaliação dos pacientes que têm dispositivos médicos29. Lembre-se de manter um registo da incidência MDRPI da sua unidade28. Além disso, o MDRPI no lábio não pode ser identificado como mucosa, não queratiniza e, portanto, não pode ser classificado usando o sistema NPIAP de classificação de estágio1,27,28.

Figura 2. LP como resultado de um conector intravenoso (IV) que foi fixado diretamente à pele. Repare na impressão na pele que corresponde ao desenho do conector intravenoso IV [©Delmore 2015, usado com autorização]
Áreas anatómicas específicas em risco
Calcanhares
Acredita-se que os calcanhares são a segunda zona anatómica mais comum para LP31. Devido à anatomia do calcanhar e ao tecido limitado pelo calcâneo, o calcanhar é particularmente vulnerável ao risco de um LP31-36 (Figura 3). Dois estudos de investigação32,33 forneceram provas de que as comorbidades dos pacientes, especificamente a diabetes mellitus e a doença vascular, juntamente com a imobilidade, são fatores de risco para o desenvolvimento de LP de calcanhar e que devem ser consideradas na avaliação do risco de uma pessoa para LP do calcanhar, juntamente com um instrumento validado de avaliação de risco32-34.

Figura 3. Lesão por pressão profunda dos tecidos do calcanhar direito (DTPI). Ao contrário dos LP da Fase 1 que estão intactos e com um vermelho/rosa mais claro, os DTPIs também estão intactos, mas têm uma descoloração mais profunda indicando um nível de dano mais importante. Estes LP de espessura total evoluem frequentemente para uma Fase 3 ou 4, ou para um LP instável [©B Delmore & EA Ayello, 2020, usado com permissão]
Na análise principal (n=337) num determinado hospital, as variáveis preditores para os LP do calcanhar foram a diabetes, a doença vascular, a imobilidade e a Escala de Braden <1832. O estudo foi alargado a outros hospitais, utilizando dados do Sistema Cooperativo de Planeamento e Investigação do Estado de Nova Iorque (SPARCS)33. A análise principal continha 1.697 pacientes (323 pacientes que tinham LP de calcanhar e 1.374 que não a apresentavam). Existiam sete preditores significativos e independentes - diabetes, doença vascular, problemas de perfusão, nutrição deficiente, idade >65 anos, ventilação mecânica e cirurgia. Com base em parte destes dois estudos, os autores concluíram que as comorbilidades dos pacientes, neste caso tanto a diabetes como a doença vascular, devem ser consideradas como fatores de risco, em conjunto com os resultados dos instrumentos formais de avaliação do risco33. Os médicos podem considerar que o nosso algoritmo de calcanhares é útil na sua prática34 (Figura 4).

Figura 4. Algoritmo de lesão do calcanhar por pressão [©Delmore, Ayello & Smart 2020, usado com permissão]32-34
CV - cardiovascular; AVC - acidente vascular cerebral; IM - enfarte do miocárdio; EM - esclerose múltipla
A posição dos pés também pode constituir um fator de risco. Num outro estudo com 10 voluntários masculinos saudáveis, existiu mais tensão no tecido do calcanhar quando o pé estava em rotação externa do que quando se encontrava na vertical (90°)36. O nosso ponto de prática clínica recente pode ser útil para os clínicos quanto ao posicionamento adequado do pé para ajudar a evitar LP do calcanhar34.
Sacro/coccígeo/tuberosidades isquiáticas
O sacro é a zona anatómica mais comum para as LP. Algumas investigações sugerem que a morfologia esquelética de um paciente pode ser um risco intrínseco não modificável para o LP. O trabalho de Gefen37 fornece conhecimentos sobre alterações em pessoas com lesão medular que aumentam o risco de LP. Isto inclui atrofia do músculo esquelético, infiltração de gordura nos músculos, perda da forma óssea levando ao achatamento das pontas das tuberosidades isquiáticas e desbaste da pele em torno das tuberosidades isquiáticas37.
Um recente estudo retrospetivo de controlo de casos realizado por Delmore e colegas comparou a região sacrococcígea esquelética de 15 pacientes com LP de espessura total a 15 pacientes sem LP de espessura total utilizando MRI38. A premissa deste estudo foi a de determinar se a região sacrococcígea esquelética pode atuar como um possível fator de risco intrínseco da LP. Os resultados revelaram que os pacientes com LP de espessura total tinham uma morfologia e morfometria diferentes, assemelhando-se a pacientes com outras condições. Este estudo também observou que os LP nesta região estavam mais localizados na zona do cóccix.
Instrumentos e Tecnologia de Avaliação de Riscos
Existe um debate crescente na literatura sobre a utilização de escalas de avaliação de risco, uma vez que podem não captar todos os fatores de risco importantes, por isso pense nas comorbilidades dos pacientes que podem não ser capturadas numa escala de avaliação de risco. Existe investigação para estudar a identificação de fatores de risco adicionais e/ou indicadores precoces de LP, incluindo a temperatura da pele39,40 , bem como a humidade subdérmica e as imagens41-43. Será interessante verificar como várias tecnologias irão reduzir os custos43. O futuro da avaliação do risco da LP poderá incluir uma avaliação sistemática do risco incluindo uma escala válida e fiável, características do paciente tais como comorbidades e tecnologia que terá impacto na redução da incidência da LP.
Conclusão e resumo
Há várias escalas válidas e fiáveis de avaliação de risco de LP disponíveis para utilização prática. Embora a investigação continue a fornecer provas sobre quais são as melhores em termos de capacidade de previsão, a identificação de comorbidades de pacientes, bem como a tecnologia, podem ser dados adicionais para ajudar os clínicos a identificar pessoas em risco de infeção por LP. É muito importante lembrar que a avaliação da LP é um processo com o objetivo de implementar um plano de cuidados em tempo útil para evitar a ocorrência de um LP44 evitável.
Conflito de Interesses
O Dr. Ayello era membro do pequeno grupo de trabalho sobre lesões por pressão relacionadas com dispositivos médicos para a EPUAP/NPIAP/PPPIA de 2019, Prevenção e tratamento de úlceras/lesões por pressão1. O Dr. Delmore é membro da Direção do Painel Consultivo Nacional de Lesões por Pressão e faz parte do Conselho Editorial para os Avanços nos Cuidados de Pele e Feridas. Foi membro de um pequeno grupo de trabalho sobre lesões do calcanhar por pressão para o EPUAP/NPIAP/PPPIA 2019, Prevenção e tratamento de úlceras/lesões por pressão1.
Financiamento
Os autores não receberam qualquer financiamento para o presente estudo.
Author(s)
Elizabeth A Ayello*
PhD, RN, CWON, MAPWCA, FAAN
Co-Editor in Chief, Advances in Skin and Wound Care
Executive Editor Emeritus, WCET® Journal
New York, NY, USA
Barbara A Delmore
PhD, RN, CWCN, MAPWCA, IIWCC-NYU, FAAN
Senior Nurse Scientist, Center for Innovations in the Advancement of Care (CIAC), NYU Langone Health, New York, NY, USA
Clinical Assistant Professor, Hansjörg Wyss Department of Plastic Surgery, NYU Grossman School of Medicine, New York, NY, USA
* Corresponding author
References
- European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel and Pan Pacific Pressure Injury Alliance (EPUAP/NPIAP/PPPIA). Prevention and treatment of pressure ulcers/injuries: clinical practice guideline. The international guideline. Emily Haesler, editor. Perth, WA: Cambridge Media; 2019.
- Norton D, et al. An investigation of geriatric nursing problems in hospital. London, UK: National Corporation for the Care of Old People; 1962.
- Royal Commission into Aged Care Quality and Safety. The Norton Pressure Sore Risk-Assessment Scale Scoring System; n.d. Available from: https://agedcare.royalcommission.gov.au/system/files/2020-06/RCD.9999.0096.0460.pdf
- Waterlow J. Pressure sores: a risk assessment card. Nurs Times 1985;81(48):49–55.
- judy-waterlow.co.uk. The Waterlow Score; 2007. Available from: http://www.judy-waterlow.co.uk/waterlow_score.htm
- Braden B, Bergstrom N, Laguzza V, Homan A. The Braden Scale for Predicting Pressure Sore Risk. Nurs Res 1987;36(4):205–10.
- Braden B, Bergstrom N. A conceptual schema for the study of the etiology of pressure sores scale. Rehab Nurs 1987;12(1):8–12, 16.
- Bergstrom, N, Demuth PJ, Braden BJ. A clinical trial of the Braden Scale for Predicting Pressure Sore Risk. Nurs Clin North Am 1987;22:417–28.
- Bergstrom N, Braden B, Kemp M, Champagne M, Ruby E. Predicting pressure ulcer risk: a multisite study of the predictive validity of the Braden Scale. Nurs Res 1998;47(5):261–269. doi:10.1097/00006199-199809000-00005
- Braden B, Bergstrom N. Predictive validity of the Braden Scale for pressure sore risk in a nursing home population. Res Nurse Health 1994;17:459–70.
- Bergstrom N, Braden B. A prospective study of pressure sore risk among institutionalized elderly. J Am Geriatr Soc 1992;40:742–58.
- Lyder CH, et al. The Braden Scale for pressure ulcer risk: evaluating the predictive validity in Black and Latino/Hispanic elders. App Nurs Res 1999;12(2):60–8.
- Braden Scale II© Predicting Pressure Injuries. Available from: http://www.bradenscale.com.
- Curley MAQ, et al. Predicting pressure ulcer risk in pediatric patients: the Braden Q Scale. Nurs Res 2003;52(1):22–31.
- Noonan C, Quigley S, Curley MAQ. Using the Braden Q Scale to predict pressure ulcer risk in pediatric patients. J Pediatr Nurs 2011;26:566–75.
- Curley MAQ, Hasbani NR, Quigley SM, et al. Predicting pressure injury risk in pediatric patients: the Braden QD Scale. J Pediatr 2018;192:189–195.
- Chamblee TB, Pasek TA, Caillouette CN, et al. How to predict pediatric pressure injury risk with the Braden QD Scale. Am J Nurs 2018;118(11):34–43.
- Willock J, Baharestani MM, Anthony D. The development of the Glamorgan paediatric pressure ulcer risk assessment scale. J Wound Care 2009;18(1):17–21. Available from: http://www.ncbi.nlm.nih.gov/pubmed/19131913
- Huffines B, Logsdon MC. The Neonatal Skin Risk Assessment Scale for predicting skin breakdown in neonates. Issues Compr Pediatr Nurs 1997;20(2):103–114. doi:10.3109/01460869709026881
- European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel and Pan Pacific Pressure Injury Alliance (EPUAP/NPIAP/PPPIA). Chapter 4: Risk factors and risk assessment. In: Haesler E, editor. Prevention and treatment of pressure ulcers/injuries: clinical practice guideline. The international guideline. Perth, WA: Cambridge Media; 2019. p. 38–72.
- Jaul E, Barron J, Rosenzweig JP, Menczel J. An overview of co-morbidities and the development of pressure ulcers among older adults. BMC Geriatr 2018;18(305):1–11. doi:10.1186/s12877-018-0997-7
- Munoz N, Litchford M, Cox J, Nelson JL, Nie AM, Delmore B. National Pressure Injury Advisory Panel White Paper malnutrition and pressure injury risk in vulnerable populations: application of 2019 International Clinical Practice Guideline. Adv Skin Wound Care 2022;35(March):156–165. doi:10.1097/01.ASW.0000816332.60024.05
- European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel and Pan Pacific Pressure Injury Alliance (EPUAP/NPIAP/PPPIA). Chapter 3: Populations with specific pressure injury related needs. In: Haesler E, editor. Prevention and treatment of pressure ulcers/injuries: clinical practice guideline. The international guideline. Perth, WA: Cambridge Media; 2019. p. 28–37.
- Centers for Disease Control and Prevention. Defining adult overweight and obesity; 2021 [cited 2022 Nov 23]. Available from: https://www.cdc.gov/obesity/adult/defining.html
- Cox J. Pressure injury risk factors in adult critical care patients: a review of the literature. Ostomy Wound Manag 2017;63(11):30–43.
- Alderden J, Rondinelli J, Pepper G, Cummins M, Whitney JA. Risk factors for pressure injuries among critical care patients: a systematic review. Int J Nurs Stud 2017;71:97–114. doi:10.1016/j.ijnurstu.2017.03.012
- European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel and Pan Pacific Pressure Injury Alliance (EPUAP/NPIAP/PPPIA). Chapter 11: Device related pressure injuries. In: Haesler E, editor. Prevention and treatment of pressure ulcers/injuries: clinical practice guideline. The international guideline. Perth, WA: Cambridge Media; 2019. p. 181–193.
- Delmore B, Ayello EA. Pressure injuries caused by medical devices and other objects: a clinical update. Am J Nurs 2017;117(12):36–45.
- Kayser SA, VanGilder CA, Ayello EA, Lachenbruch C. Prevalence and analysis of medical device-related pressure injuries: results from the International Pressure Ulcer Prevalence Survey. Adv Skin Wound Care 2018;31(6):276–285.
- Delmore B, Deppisch M, Sylvia C, Luna-Anderson C, Nie AM. Pressure injuries in the pediatric population: a National Pressure Ulcer Advisory Panel White Paper. Adv Skin Wound Care 2019;32(9):394–408. doi:10.1097/01.ASW.0000577124.58253.66
- European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel and Pan Pacific Pressure Injury Alliance (EPUAP/NPIAP/PPPIA). Chapter 9: Heel pressure injuries. In: Haesler E, editor. Prevention and treatment of pressure ulcers/injuries: clinical practice guideline. The international guideline. Perth, WA: Cambridge Media; 2019. p. 145–154.
- Delmore B, Lebovits S, Suggs B, Rolnitzky L, Ayello EA. Risk factors associated with heel pressure ulcers in hospitalized patients. JWOCN 2015;42(3):242–248.
- Delmore B, Ayello EA, Smith D, Rolnitzky L, Chu AS. Refining heel pressure injury risk factors in the hospitalized patient. Adv Skin Wound Care 2019:32(11):512–519.
- Delmore B, Ayello EA. Practice point: heel pressure injuries. Adv Skin Wound Care 2021;34(5):236-237.
- Gefen A. Why is the heel particularly vulnerable to pressure ulcers. Br J Nurs 2017;8;26(Sup20):S62-S74. doi:10.12968/bjon.2017.26.Sup20.S62.
- Tenenbaum S, Shabshin N, Levy A, Herman A, Gefen AJ. Effects of foot posture and heel padding devices on soft tissue deformations under the heel in supine position in males: MRI studies. J Rehabil Res Dev 2013;50(8):1149–56. doi:10.1682/JRRD/2012.10.0183.
- Gefen A. Tissue changes in patients following spinal cord injury and implications for wheelchair cushions and tissue loading: a literature review. Ostomy Wound Manage 2014;60(2):34–45.
- Delmore B, Sprigle S, Samim M, et al. Does sacrococcygeal skeletal morphology and morphometry influence pressure injury formation in adults. Adv Skin Wound Care 2022;35(11):586–95.
- Sprigle S, et al. Clinical skin temperature measurement to predict incipient pressure ulcers. Adv Skin Wound Care 2001;14(3):133–37.
- Langemo D, Spahn JG. A reliability study using long-wave infrared thermography device to identify relative tissue temperature variations of the body surface and underlying tissue. Adv Skin Wound Care 2017;30(3):109–119.
- Bates-Jensen BM, McCreath HE, Pongquan V. Subdermal moisture is associate with early pressure ulcer damage in nursing home residents with dark skin tones. JWOCN 2009;36(3):277–84.
- Ross G, Gefen A. Assessment of sub-epidermal moisture by direct measurement of tissue biocapacitance. Med Eng Physic 2019;73:92–99.
- Koerner, S, Adams D, Harper SL, Black JM, Langemo DK. Use of thermal imaging to identify deep-tissue pressure injury on admission reduces clinical and financial burdens of hospital-acquired pressure injuries. Adv Skin Wound Care 2019;32(7):312–20.
- Wound, Ostomy and Continence Nurses Society. (2017). WOCN Society position paper: Avoidable versus unavoidable pressure ulcers (injuries). Mt. Laurel, NJ: Author.



