Volume 39 Number 4
Management of complex head wounds involving the temporalis and sternocleidomastoid muscles: a case series
Angela Yi Jia Liew and Yee Yee Chang
Keywords Head and neck, wound breakdown, chronic wound, chemo-radiation therapy, split skin graft, wound bed preparation
For referencing Liew AYJ & Chang YY. Management of complex head wounds involving the temporalis and sternocleidomastoid muscles: a case series. WCET® Journal 2019;39(4):41-44
DOI https://doi.org/10.33235/wcet.39.4.41-44
Abstract
The use of a comprehensive wound assessment tool and appropriate selection of dressing products can aid clinicians in the management of complex wounds. This paper describes the care of two patients presenting with head wounds. The first case is a patient who suffered from a right temporalis flap failure and exposed periosteum after wide excision. The second case explores the management of a sternocleidomastoid abscess that developed during radiotherapy for head and neck cancer. The paper outlines how the choice of healing by secondary intention can prevent patients from undergoing additional surgeries where outcomes may not be favourable.
Introduction
Medical advancements in the management of head and neck cancers allow patients the flexibility of choice in their treatment. However, factors such as active immunotherapy treatments or previous surgical resection can affect the healing outcome or result in an unhealthy wound bed1. In addition, patients may not be suitable candidates for surgery or may prefer conservative management.
This case series will explore two cases which utilised conventional dressing products to assist with wound closure. The first case discusses a patient with a failed right temporal split skin graft with exposed cranium after wide excision for treatment of basal cell carcinoma. The second case focused on a patient who developed a neck abscess at the sternocleidomastoid region during chemotherapy and had undergone incision and drainage. Both cases were reviewed using the triangle of wound assessment which provided the clinicians with a guide for holistic evaluation2.
Case one
Mr A was a 77-year-old Chinese gentleman who presented at the head and neck specialist outpatient clinic in an acute tertiary hospital with a right temporal lesion on 29 April 2016. The lesion had been present since birth; however he had noticed an increase in size to 1x3cm after an accidental injury during a haircut two years ago. The lesion had no contact bleeding, no discharge and was non-tender. Head and neck examination revealed no palpable cervical lymph nodes. Mr A underwent an excision biopsy of the right temporal lump in May 2016. Histology showed apocrine adenocarcinoma and basal cell carcinoma arising from a nevus sebaceous cyst. A positron emission tomography (PET) scan showed no significant Fludeoxyglucose (FDG) uptake in other areas, but Mr A required a wider excision for adequate clearance of the tumour.
On 23 May 2016, Mr A underwent a wide excision in which a right temporalis flap was used to cover the exposed periosteum, followed by a split skin graft to cover the wound bed. The split skin graft was anchored down with a polyurethane foam dressing, and the patient was discharged 2 days later. Initial wound inspection of the right temporalis flap 10 days later showed that the split skin graft had taken well. However, wound inspection a week later showed slough at the edges of the split skin graft, and that the periosteum was exposed. The patient’s wound was managed with Aquacel® Ag (United Kingdom), a hydrofiber with silver, and he was offered another surgery for flap coverage as the wound remained stagnant despite every other day change of dressing. His primary surgeon referred him to the wound care team as Mr A refused surgery and requested a conservative approach instead.
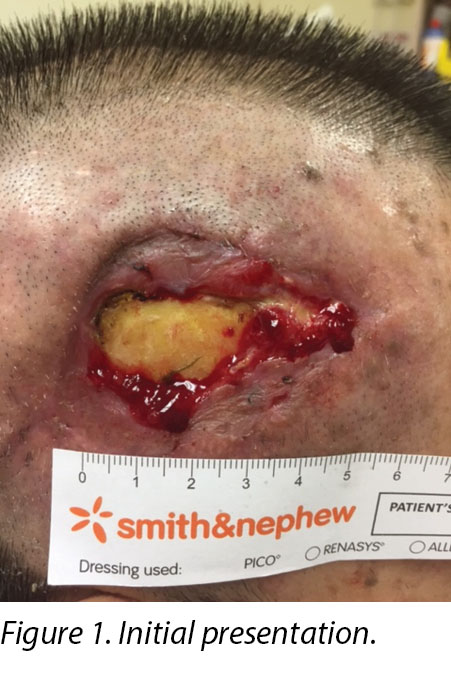
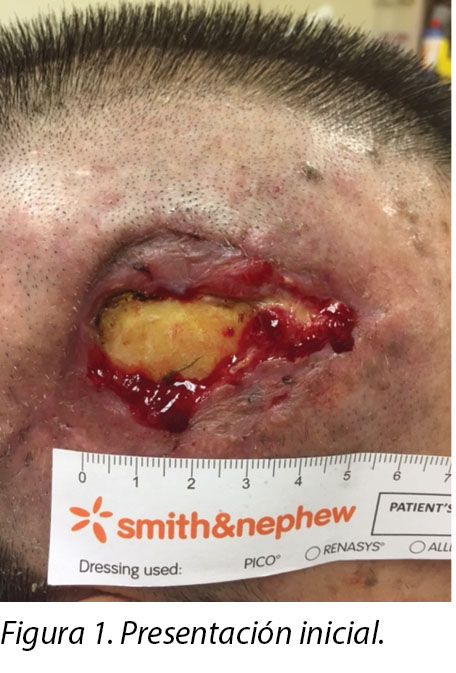
On inspection, the right temporalis wound measured 3x5cm overall with a depth of 1cm (Figure 1). The wound bed contained the exposed periosteum measuring 2x3cm with sloughy wound edges and areas of grafted skin which had taken. No signs of local infection were detected. Shaving of hair around the periwound region was done to maintain a good margin for the application of dressings. Wound clinicians did conservative sharp debridement of devitalised tissue at the wound edges. The wound was cleaned with normal saline and primarily dressed with Heliaid®, a collagen sheet dressing. The patient was taught to change the external gauze if stained for exudate control.
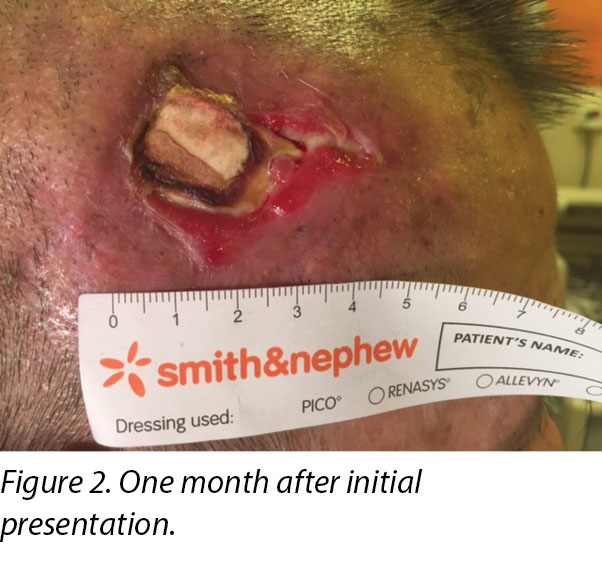
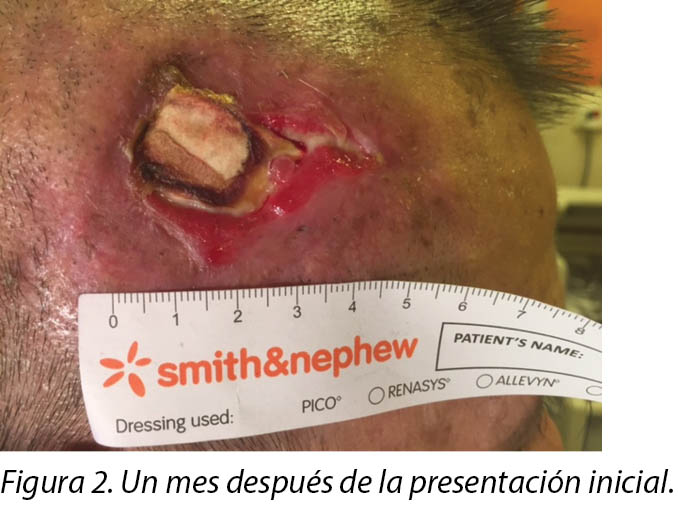
On presentation 1 month later, the patient’s wound showed friable, hyper granulating tissue at the inferior aspect of the wound bed (Figure 2). Shave excision using a blade was done to manage the hyper granulating tissue weekly, and the collagen dressing was not changed if it had not degraded as it served as a scaffold for granulating tissue to migrate and cover the exposed periosteum3.
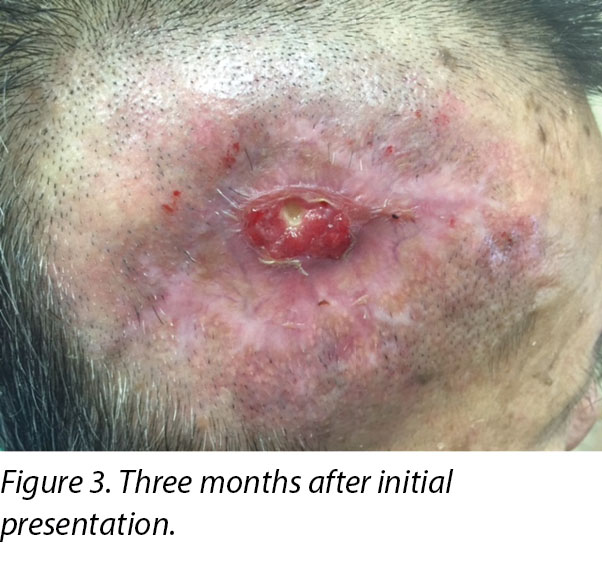
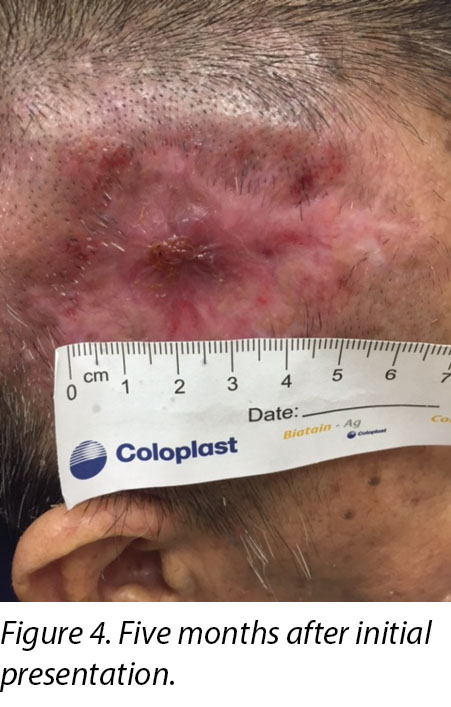
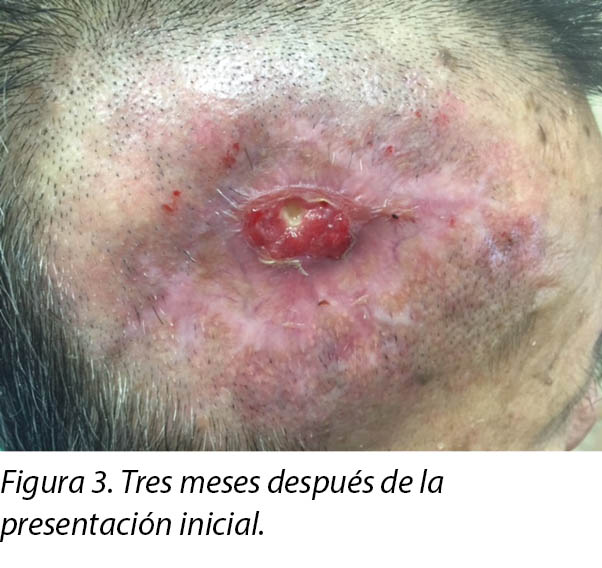
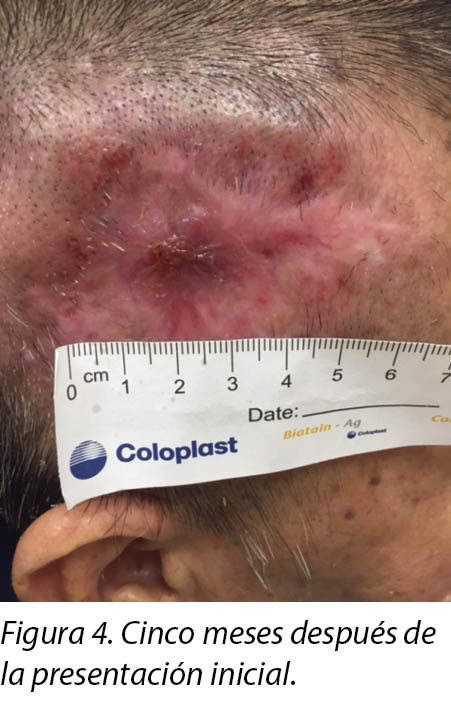
A review by the surgeon 3 months later showed the edges of the wound contracting, covering the periosteum (Figure 3). Hypertrophic granulation was still present at wound edges and required periodic shave excision. Collagen dressing was used until full epithelialisation occurred 5 months after the initial consultation with the wound care team (Figure 4).
Case Study 2
Mr B, a 71-year-old Chinese gentleman who had radiotherapy for squamous cell carcinoma (SCC) of the right tonsil presented to the emergency department with an abscess over the right sternocleidomastoid region. A computerised tomography (CT) scan of the neck showed the development of a multi-loculated abscess along the entire length of the right sternocleidomastoid muscle with overlying cellulitis. He underwent emergency incision and drainage of the abscess. As Mr B was undergoing active radiotherapy treatment and was therefore not a surgical candidate for removal of the SCC, he was referred to the wound care team for follow-up management of his surgical site.
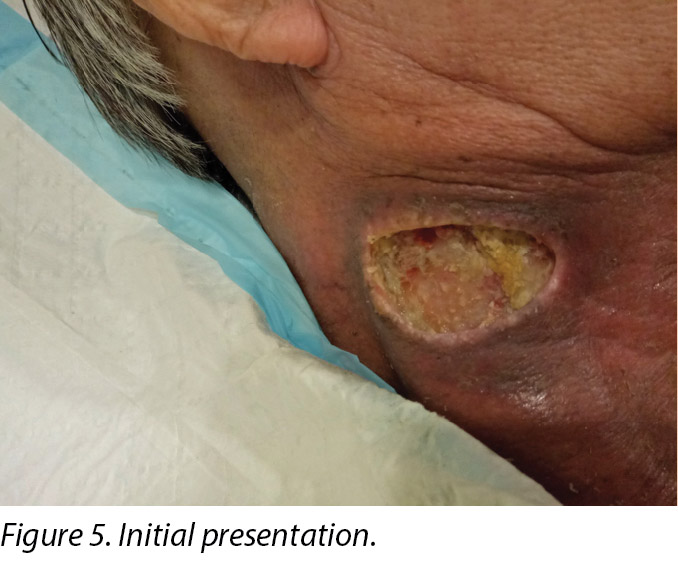
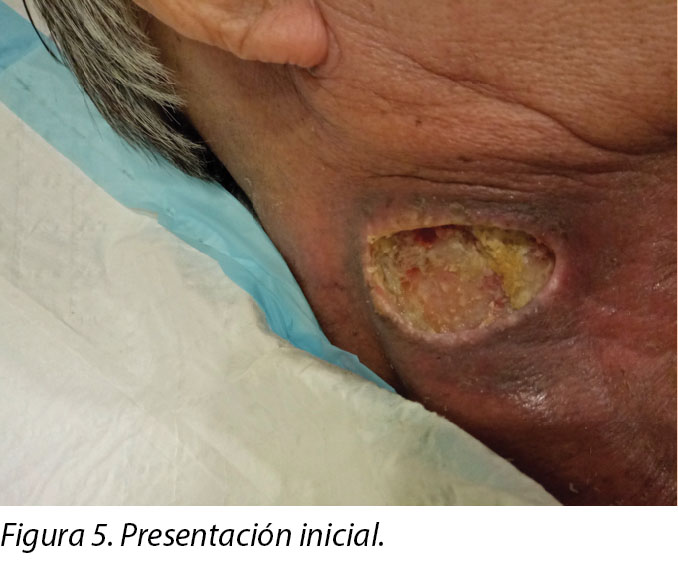
An initial assessment was done on 15 August 2016 in the wound specialist clinic in an acute tertiary hospital. The right sternocleidomastoid wound was a sloughy wound base that measured 3x4.5cm with a depth of 1cm and undermining from 12–2 o’clock to a length of 1cm (Figure 5). Periwound erythema, acute radiotherapy hyperpigmentation, and tenderness with a minimal amount of exudate was present. In addition, as the wound bed was near major neck vessels, sharp debridement was not considered an advisable option. As the patient needed to complete his prescribed radiotherapy treatment, plans were made for the initial management of his wound with a topical antimicrobial. Hence the patient was managed with daily povidone-iodine dressing as it was cost-effective and reduced the bioburden on the wound bed4.
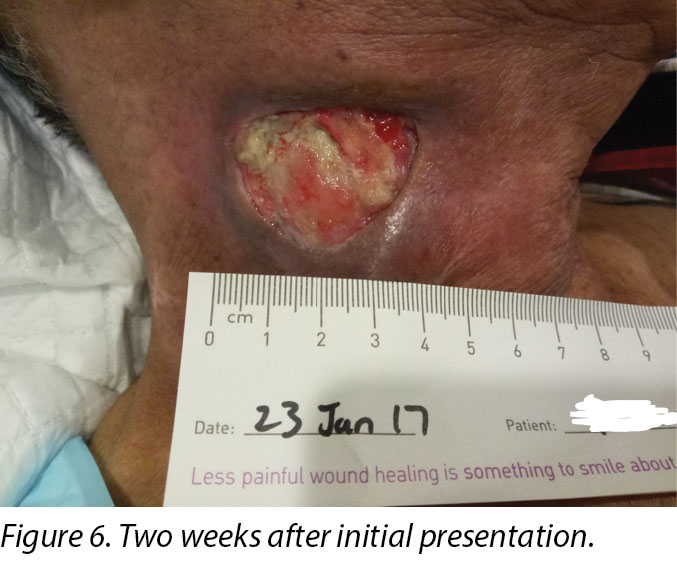
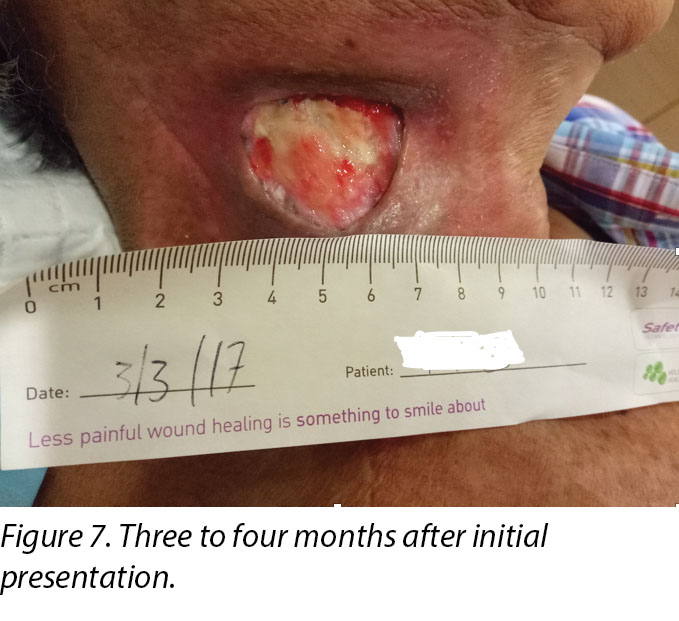
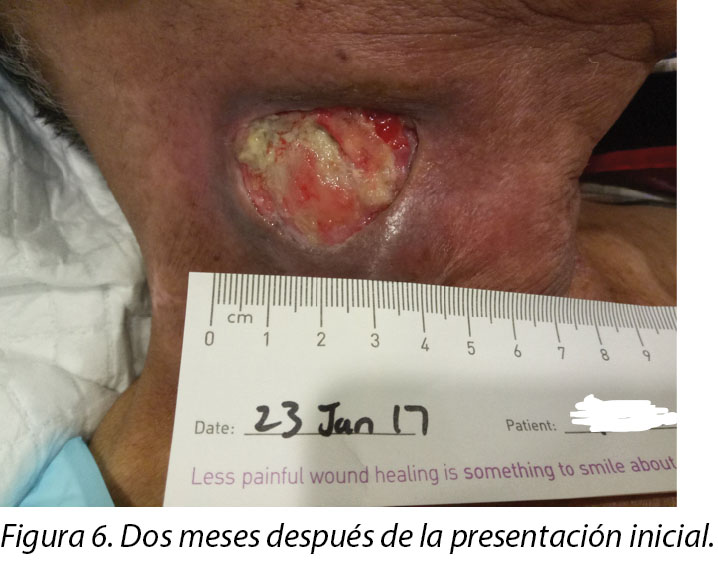
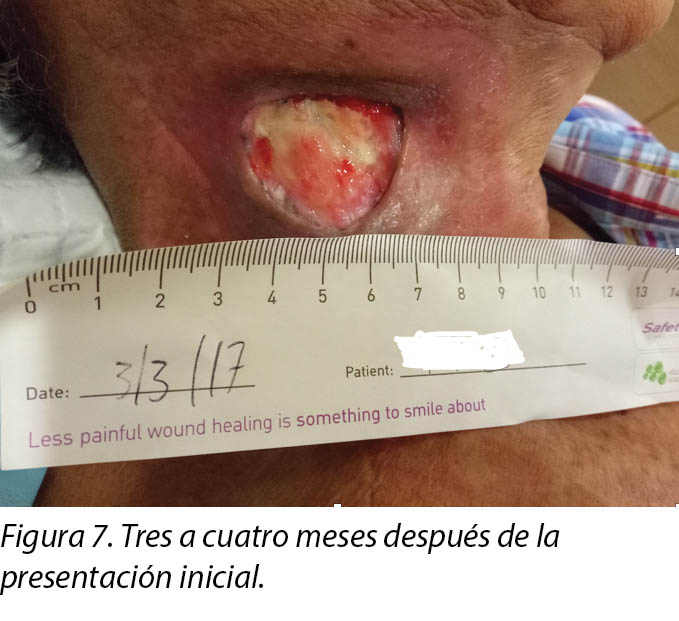
Upon completion of his oncology treatment 2 weeks later, reassessment of his wound was done (Figure 6). Wound measurements were 3x4.5cm with a 1cm depth. Minimal areas of granulation were noted, and the wound bed was mostly covered by adherent slough. Cleansing of the wound was done with normal saline. Mr B was initially started on Iodosorb® (New Zealand) cadexomer iodine powder then switched to cadexomer iodine ointment with Duoderm® CGF® (Denmark) hydrocolloid wafer as a secondary dressing to promote a moist wound healing environment4. As the wound progression was slow, after 3–4 months the treatment modality was switched to Askina® Calgitrol (United Kingdom), a silver gel, but this was stopped after 1 month as more fibrotic tissue was deposited on the wound bed (Figure 7). Mr B was then placed back on cadexomer iodine ointment with a hydrocolloid wafer. He was seen twice a week at the wound care clinic for careful debridement of loose devitalised tissue given the anatomy of major vessels around the wound bed. As the periwound skin was dry, Mr B was advised on the application of moisturiser daily.
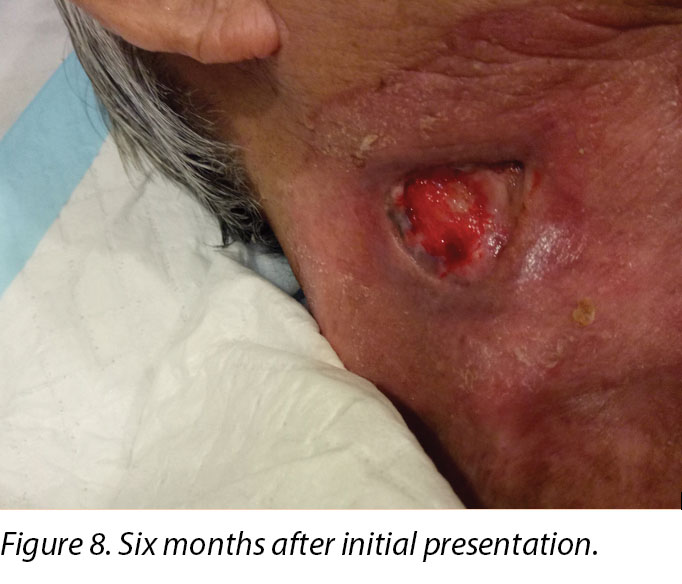
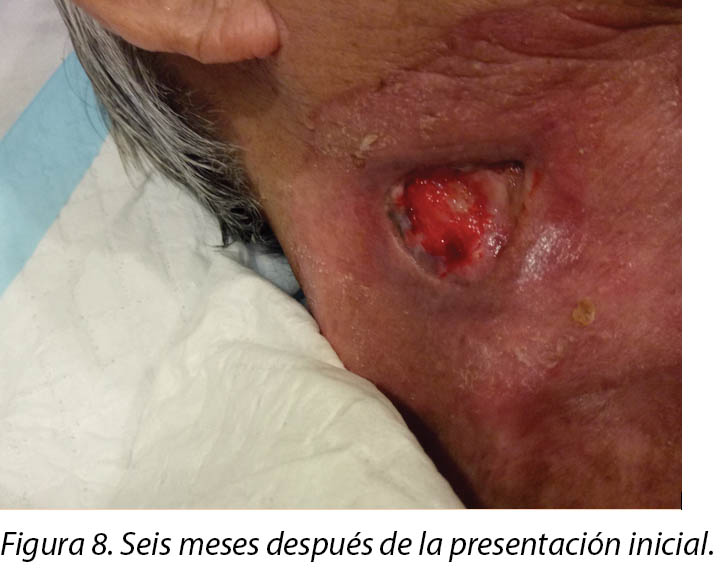
Six months after the initial treatment and review, the wound bed measured 3x4cm with a wound depth of 0.5cm (Figure 8). Mr B continued twice weekly dressings at the wound clinic for debridement of loose devitalised tissue with Iodosorb® cadexomer iodine ointment and Duoderm® CGF® hydrocolloid (Denmark) dressing. Once all fibrotic tissue had been debrided and the wound bed was superficial, the patient continued with hydrocolloid wafer primarily to facilitate granulation4. Full epithelialisation occurred 1 year after the initial presentation.
Discussion
Winter’s study5 on wound epithelialisation in porcine models showed that for wound healing to occur, a combination of three factors must be considered – reduction of bacterial burden on the wound bed, vascularisation, and wound hydration. In addition, a recent paper included debridement and oedema management as crucial factors to consider in wound healing6. Understanding these principles, combined with the usage of the triangle of wound assessment tool, aided wound clinicians in developing a patient-centric treatment plan which guided their choice of dressing products for these two cases7.
In the case of Mr A, his wound bed was the exposed periosteum which was devoid of blood supply8. The exudate level on this wound bed provided enough moisture for wound healing and was not excessive. Mr A’s wound did not present with any signs of local, spreading nor systemic infection. The wound edges consisted of hypertrophic tissue3. The temporal region, which was covered with hair, was the periwound area. The periwound skin condition was healthy, with no signs of eczema, maceration nor dehydration. The management plan was therefore to: promote granulation from the edges to close the wound; shear the hypertrophic tissue at the wound edge; and protect the wound bed from external sources of infection that can occur with non-adherence of the secondary dressing. The wound presentation narrowed down the dressing product selection to the ones that could promote angiogenesis and granulation such as collagen2.
The outer layer of the periosteum is cell poor; hence, epithelial advancement is challenging in such a wound bed due to the lack of blood supply and viable tissue for collagen synthesis9. Elastase, which activates matrix metalloproteinase (MMPs), is often present in such non-healing wounds3. It inhibits the extracellular matrix components of elastin and collagen by binding and depleting collagen levels within the wound bed. This resulted in the extracellular matrix degrading and a reduction in fibroblast levels crucial in the proliferative phase for wound healing3. Using a collagen dressing can disrupt the elastase levels, reducing MMP levels by binding to growth factors and further inactivating MMPs on the wound bed3. Also, using a collagen dressing can improve the deposition of new collagen within the wound bed, as fibroblast and macrophages anchor well to the three-dimensional collagen structure. This can propel the wound from the inflammatory to the proliferative phase, initiating angiogenesis3. Lastly, it stimulates cellular migration by providing a moist wound environment and fluid balance within the wound bed3.
Conservative sharp debridement was done for hypertrophic tissue at the wound edges periodically for easier cell migration laterally2. The application of a secondary dressing was challenging; hence shaving of the temporal region was necessary for better visualisation and to prevent foreign bodies such as hair from contaminating the wound bed10. Sebum from hair follicles also made adherence of secondary dressing difficult. Hence a layer of non-sting barrier spray was applied to the periwound area before the application of any secondary dressing.
As for Mr B, the wound presentation differed as he continued on radiotherapy treatment. Initial wound presentation was a wound bed which was dry; the initial treatment goal post-incision and drainage was to reduce the bioburden on the wound bed. Subsequent assessment of his wound post-radiation therapy was a fibrotic, dry and sloughy wound bed. The wound edge and periwound skin were also dry. The management plan was to: rehydrate the wound bed, wound edge and periwound skin to promote a moist wound healing environment; debride the non-viable tissue; and keep the wound free from infection. Conservative sharp debridement was risky to undertake given the anatomical location of the wound and the proximity of large vessels at the sternocleidomastoid region, hence autolytic debridement was selected together with an antimicrobial product which continued to reduce the bioburden on the wound bed4.
With Mr B, the wound clinicians witnessed the early and delay effects of radiation therapy on wound healing, given its proximity to the sternocleidomastoid wound. The redness that Mr B had immediately post-radiation (shown in Figures 5 and 6 in the periwound region), was due to the dry desquamation caused by radiation therapy11. There was also alteration in all layers of tissue post-radiation therapy in which the dermis and subcutaneous tissue were progressively replaced by dense and fibrotic tissue. This was due to the irregularity in collagen fibrils caused by abnormalities in collagen production formed by fibroblasts and myofibroblasts11.
Cadexomer iodine ointment was selected for its antimicrobial and autolytic properties12. The occlusive nature of hydrocolloid dressings helped facilitate granulation and inhibited bacterial growth4. Mr B preferred the conformability and exudate absorption capability of hydrocolloid dressings. He was advised to apply moisturiser on his periwound skin as it was dry and caused him some itch and discomfort. Though the wound size is small, it took almost a year before Mr B could achieve full epithelialisation of his wound.
The triangle of wound assessment tool provided wound clinicians with a comprehensive look at the assessment of a wound so a suitable management plan could be developed. The tool was used in combination with the understanding of wound healing in irradiated areas or wound beds devoid of blood supply. It was also noted that it would be costly for patients if the clinicians were unable to select a dressing product for its intended purpose4. Armed with this information, the wound clinician and the patient were able to set realistic treatment goals and timeframes for healing.
Conclusion
A favourable outcome in wound closures for complex wounds by secondary intention is determined by understanding the challenges a complex wound can pose. The wound clinician can develop a realistic, patient-centric treatment plan and select the appropriate dressing product which is suitable for its intended purpose.
Conflict of Interest
The authors declare that there is no conflict of interest involved in the studies.
Funding
The authors received no funding for this study.
Tratamiento de heridas complejas en la cabeza que comprenden los músculos temporales y esternocleidomastoideos: una serie de casos
Angela Yi Jia Liew and Yee Yee Chang
DOI: https://doi.org/10.33235/wcet.39.4.41-44
Resumen
El uso de una herramienta para realizar una evaluación exhaustiva de las heridas y una selección adecuada de los productos para vendajes pueden ayudar a los médicos a tratar las heridas complejas. Este documento describe el cuidado de dos pacientes que tuvieron heridas en la cabeza. El primer caso se trata de un paciente que padeció una deficiencia del colgajo del músculo temporal derecho y de un periostio expuesto después de una escisión amplia. El segundo caso explora el tratamiento de un absceso del músculo esternocleidomastoideo que apareció durante la radioterapia para el cáncer de cabeza y cuello. El documento describe la manera en que la cicatrización por segunda puede evitar que los pacientes se sometan a otras cirugías cuando el resultado puede no ser favorable.
Introducción
Los avances médicos en el tratamiento de los cánceres de cabeza y cuello les permiten a los pacientes tener la posibilidad de elegir su tratamiento. Sin embargo, los factores tales como los tratamientos activos de innmunoterapia o la resección quirúrgica pueden afectar la cicatrización o dar como resultado un lecho de herida tórpido1. Además, es posible que los pacientes no sean candidatos adecuados para la cirugía o que prefieran un tratamiento conservador.
Esta serie de casos investigará dos casos en los que se utilizaron productos para vendajes convencionales para ayudar a cerrar la herida. El primer caso es un debate sobre un paciente que tiene una deficiencia en el injerto de piel parcial en el músculo temporal derecho con el cráneo expuesto después de una escisión amplia para el tratamiento de carcinoma de células basales. El segundo caso se enfoca en un paciente que tuvo un absceso en el cuello, en la región del músculo esternocleidomastoideo, durante la quimioterapia y se sometió a una incisión y drenaje. Se revisaron ambos casos utilizando un triángulo de valoración de heridas que brindó a los médicos una guía para la evaluación holística2.
Caso uno
El Sr. A. era un caballero chino de 77 años que se presentó el 29 de abril de 2016 en los consultorios externos especializados en cabeza y cuello en el hospital terciario para enfermedades agudas con una lesión en el temporal derecho. La lesión era de nacimiento; sin embargo, él había notado un aumento de tamaño a 1x3 cm después de una lesión accidental durante un corte de cabello dos años antes. La lesión no tenía hemorragia de contacto, ni supuración, y no dolía cuando la palpaban. El examen de cabeza y cuello no reveló ganglios linfáticos cervicales palpables. Se sometió al Sr. A. a una biopsia por escisión del bulto del temporal derecho en mayo de 2016. La histología mostró un adenocarcinoma apocrino y un carcinoma de células basales que provenían de un quiste sebáceo nuevo. Una tomografía por emisión de positrones (TEP) no mostró una infiltración importante de fludeoxiglucosa (FDG) en otras áreas, pero fue necesario practicarle una escisión más amplia al Sr. A. para eliminar el tumor de manera adecuada.
El 23 de mayo de 2016, el Sr. A. se sometió a una escisión amplia en la cual se utilizó un colgajo del músculo temporal derecho para cubrir el área expuesta del periostio, seguido de un injerto de piel parcial para cubrir el lecho de la herida. Se fijó el injerto de piel parcial con un vendaje de espuma de poliuretano y se dio de alta al paciente dos días después. El examen inicial de la herida del colgajo del músculo temporal derecho que se realizó después de 10 días demostró que el injerto de piel parcial había tomado bien. Sin embargo, un examen de la herida una semana más tarde mostró que había una escara en los bordes del injerto de piel parcial y que el periostio estaba expuesto. Se trató la herida del paciente con Aquacel® Ag (Reino Unido), una hidrofibra con plata y se le ofreció practicarle otra cirugía para cubrir el colgajo, dado que la herida seguía igual a pesar de cambiar el vendaje día por medio. Su cirujano principal lo derivó al equipo de cuidado de heridas, dado que el Sr. A. se negó a hacerse otra cirugía y solicitó un enfoque conservador.
Al momento del examen, la herida del músculo temporal medía 3x5 cm en general y tenía una profundidad de 1 cm (Figura 1). El lecho de la herida tenía el periostio expuesto que medía 2x3 cm, con bordes de la herida con fibrina y áreas de piel injertada que se habían prendido. No se detectaron signos de infección local. Se le rasuró el cabello alrededor de la región periférica de la herida para mantener un buen margen para la colocación de los vendajes. Los médicos especializados en heridas hicieron un desbridamiento agudo conservador del tejido desvitalizado en los bordes de las heridas. Se limpió la herida con solución salina normal y se colocó un vendaje con Heliaid®, un vendaje en capas con colágeno. Se le enseñó al paciente a cambiar la gasa externa si se manchaba para controlar el exudado.
Al examinarla después de un mes, la herida del paciente se mostraba friable, con un tejido de hipergranulación en el aspecto inferior del lecho de la herida (Figura 2). Se rasuró la escisión con un bisturí para controlar el tejido de hipergranulación, semanalmente, y no se cambió el vendaje con colágeno si no se había deteriorado, dado que servía como armazón para que el tejido de granulación migre y cubra el periostio expuesto3.
Una evaluación realizada por el médico tres meses más tarde mostró que los bordes de la herida se habían contraído y que cubrían el periostio (Figura 3). Aún había granulación hipertrófica en los bordes de la herida y fue necesario realizar una escisión periódica de rasurado. Se utilizó vendaje con colágeno hasta la epitelización completa, que ocurrió cinco meses después de la consulta inicial con el equipo de cuidado de heridas (Figura 4).
Estudio de caso 2
El Sr. B., caballero chino de 71 años, que tuvo radioterapia por carcinoma espinocelular (SCC, por sus siglas en inglés) de la amígdala derecha se presentó en el servicio de urgencias con un absceso en la región derecha del músculo esternocleidomastoideo. Una tomografía computarizada (TC) del cuello mostró el desarrollo de un absceso en diferentes lugares en toda la extensión del músculo esternocleidomastoideo derecho con celulitis superpuesta. Se lo sometió a una incisión de urgencia y a un drenaje del absceso. Dado que el Sr. B se estaba sometiendo a un tratamiento activo de radioterapia, por consiguiente, no era candidato para una cirugía para extraer el SCC. Se lo derivó al equipo de cuidado de heridas para un tratamiento de seguimiento del lecho quirúrgico.
Se realizó la evaluación inicial el 15 de agosto de 2016 en los consultorios especializados en heridas del hospital terciario para enfermedades agudas. La herida del músculo esternocleidomastoideo era una herida de base de piel con fribrina que medía 3x4,5 cm, tenía una profundidad de 1 cm y socavamiento de 12 a 2 en punto a una longitud de 1 cm (Figura 5). Presentaba eritema en periferia de la herida, hiperpigmentación aguda por radioterapia y dolor a la palpación con una cantidad mínima de exudado. Además, dado que el lecho de la herida estaba cerca de los grandes vasos sanguíneos del cuello, no se consideró como una opción recomendable el desbridamiento agudo. Dado que el paciente debía completar el tratamiento de radioterapia prescrito, se hizo una planificación para el tratamiento inicial de su herida con un antimicrobiano tópico. Por consiguiente, se trató al paciente con un vendaje con povidona iodada, dado que era económico y se redujo la carga biológica en el lecho de la herida4.
Al finalizar su tratamiento oncológico dos semanas más tarde, se realizó una evaluación de la herida nuevamente (Figura 6). Las medidas de la herida eran de 3x4,5 cm y tenían una profundidad de 1 cm. Se notaron áreas mínimas de granulación y el lecho de la herida estaba mayormente cubierto por piel con fibrina adherida. Se limpió la herida con solución salina normal. El Sr. B. comenzó al principio con polvo de cadexómero iodado Iodosorb® (Nueva Zelanda), después cambió a un ungüento de cadexómero iodado con oblea hidrocoloidal Duoderm® CGF® (Dinamarca) como vendaje secundario para fomentar un entorno húmedo para la cicatrización de la herida4. Dado que la evolución de la herida era lenta, después de 3–4 meses se cambió la modalidad del tratamiento por Askina® Calgitrol (Reino Unido), un gel de plata, pero se suspendió después de un mes, dado que había más tejido fibrótico depositado en el lecho de la herida (Figura 7). Luego se volvió a colocarle al Sr. B. ungüento de cadexómero iodado con oblea hidrocoloidal. Se lo atendió dos veces por semana en el consultorio de cuidado de heridas para realizarle un desbridamiento cuidadoso del tejido desvitalizado flojo, dada la anatomía de los grandes vasos sanguíneos alrededor del lecho de la herida. Dado que la piel de la periferia de la herida estaba seca, se le recomendó al Sr. B la aplicación diaria de una crema humectante.
Seis meses después del tratamiento inicial y de una evaluación, el lecho de la herida medía 3x4 cm y tenía una profundidad de 0,5 cm (Figura 8). El Sr. B. siguió asistiendo al consultorio de cuidado de heridas, dos veces por semana, para desbridamiento del tejido desvitalizado flojo con ungüento de cadexómero iodado Iodosorb® y vendaje con oblea hidrocoloidal Duoderm® CGF® (Dinamarca). Una vez que se hubo realizado el desbridamiento del tejido fibrótico y que el lecho de la herida fuera superficial, el paciente siguió con oblea hidrocoloidal principalmente para facilitar la granulación4. La epitelización completa tuvo lugar un año después de la presentación inicial.
Discusión
El estudio de Winter5 sobre epitelización de heridas en modelos porcinos mostró que para que cicatrice la herida, se debe tener en cuenta una combinación de tres factores: reducción de la carga bacteriana en el lecho de la herida, vascularización e hidratación de la herida. Además, un documento reciente incluyó el desbridamiento y el tratamiento de edema como factores cruciales para tener en cuenta en la cicatrización de la herida6. La comprensión de estos principios, combinada con el uso del triángulo de la herramienta de valoración de heridas, ayudó a los médicos especializados en heridas a elaborar un plan de tratamiento centrado en el paciente que orientó la elección de productos para vendajes para estos dos casos7.
En el caso del Sr. A., el lecho de la herida era el periostio expuesto que carecía de flujo sanguíneo8. El nivel de exudado del lecho de la herida proporcionó suficiente humectación para la cicatrización de la herida y no fue excesivo. La herida del Sr. A. no presentó ningún signo de infección que se diseminara a nivel local o sistémico. Los bordes de la herida eran de tejido hipertrófico3. La región temporal, que estaba cubierta por cabello, era el área de la periferia de la herida. La condición de la periferia de la herida era sana, sin signos de eccema, maceración ni deshidratación. Por consiguiente, el plan de tratamiento fue: fomentar la granulación de los bordes para cerrar la herida; cortar el tejido hipertrófico en el borde de la herida; y proteger el lecho de la herida de fuentes de infección externas que pueden aparecer si no se adhiere el vendaje secundario. La presentación de la herida limitó la selección de producto de vendaje a los que pudieran fomentar la angiogénesis y la granulación, tal como el colágeno2.
La capa externa del periostio tiene falta de células; por consiguiente, la evolución epitelial en el lecho de semejante herida es un reto debido a la falta de flujo sanguíneo y de tejido viable para la síntesis del colágeno9. La elastasa, que activa las metaloproteasas matrices (MMP), a menudo se presenta en esas heridas no cicatrizantes3. Inhibe los componentes de matriz extracelular de elastina y colágeno uniendo y consumiendo los niveles de colágeno dentro del lecho de la herida. Esto dio como resultado la degradación de la matriz extracelular y una reducción de los niveles de fibroblasto cruciales para la cicatrización de la herida en la etapa proliferativa3. El uso de un vendaje con colágeno puede alterar los niveles de elastasa, reducir los niveles de MMP al comprometer los factores de crecimiento e inactivar aún más los MMP en el lecho de la herida3. También, el uso de un vendaje con colágeno puede mejorar el depósito de colágeno nuevo en el lecho de la herida, dado que el fibroblasto y los macrófagos fijan bien la estructura tridimensional del colágeno. Esto puede hacer que la herida pase de la fase inflamatoria a la proliferativa, iniciando la angiogénesis3. Por último, estimula la migración celular proporcionando un entorno de humedad a la herida y un equilibrio líquido dentro del lecho de la herida3.
Periódicamente, se realizó el desbridamiento conservador agudo para el tejido hipertrófico en los bordes de la herida para facilitar la migración celular de manera lateral2. La aplicación del vendaje secundario presentó un reto; por consiguiente, fue necesario rasurar la región temporal para una mejor visualización y para evitar que cuerpos extraños, como el cabello, contaminaran el lecho de la herida10. El sebo de los folículos pilosos también dificultó la adherencia del vendaje secundario. Por lo tanto, se aplicó una capa de rocío no irritante como barrera para el área de la periferia de la herida antes de aplicar cualquier vendaje secundario.
En cuanto al Sr. B, la presentación de la herida varió a medida que él continuó con el tratamiento de radioterapia. La presentación inicial de la herida fue un lecho de la herida que estaba seco; el objetivo del tratamiento inicial después de la incisión y del drenaje fue reducir la carga biológica en el lecho de la herida. Una valoración posterior de la herida después de la radioterapia mostró un lecho de la herida fibrótico, seco y con piel con fibrina. El borde de la herida y la piel de la periferia de la herida también estaban secos. El plan de tratamiento fue: rehidratar el lecho de la herida, el borde de la herida y la piel de la periferia de la herida para fomentar un entorno húmedo para la cicatrización de la herida; desbridar el tejido no viable y mantener la herida sin infección. Era riesgoso realizar el desbridamiento conservador agudo, dada la ubicación anatómica de la herida y la proximidad de los grandes vasos sanguíneos en la región esternocleidomastoideo, por lo tanto, se eligió el desbridamiento autolítico junto con un producto antimicrobiano que continuó reduciendo la carga biológica en el lecho de la herida4.
Con el Sr. B., los médicos especializados en heridas fueron testigos de los efectos precoces y tardíos de la radioterapia en la cicatrización de la herida, dada su proximidad a la herida del músculo esternocleidomastoideo. El color rojizo que presentó el Sr. B. después de la radiación (que se muestra en las Figuras 5 y 6 de la región de la periferia de la herida), se debió a la descamación por sequedad provocada por la radioterapia11. También hubo una modificación en todas las capas del tejido después de la radioterapia en las cuales la dermis y el tejido subcutáneo fueron sustituidos de manera progresiva por tejido fibrótico y denso. Esto se debió a la irregularidad en las fibrilas del colágeno por anormalidades en la producción del colágeno formada por fibroblastos y miofibroblastos11.
Se eligió el ungüento de cadexómero iodado por sus propiedades antimicrobianas y autolíticas12. La naturaleza oclusiva de los vendajes hidrocoloidales ayudó a facilitar la granulación e inhibió el crecimiento bacteriano4. El Sr. B. prefirió los vendajes hidrocoloidales, dada su capacidad de absorción del exudado y de adaptabilidad. Se le recomendó que se aplicara crema humectante en la piel de la periferia de la herida, dado que estaba seca y que le producía picazón y malestar. A pesar de que el tamaño de la herida es pequeño, le llevó casi un año al Sr. B. poder lograr la epitelización completa de la herida.
El triángulo de la herramienta de valoración de heridas les brindó a los médicos especializados en heridas una mirada exhaustiva con respecto a la valoración de la herida de modo que se pudo elaborar un plan de tratamiento adecuado. Se utilizó la herramienta junto con el conocimiento de la cicatrización de la herida en áreas irradiadas o en lechos de la herida carentes de flujo sanguíneo. También se observó que sería costoso para los pacientes si los médicos no podían elegir un producto de vendaje para el objetivo propuesto4. En virtud de esta información, los médicos especializados en heridas y el paciente pudieron establecer objetivos de tratamiento realistas y plazos para la cicatrización.
Conclusión
Un resultado favorable con respecto al cierre de heridas por segunda para heridas complejas está basado en el conocimiento de los retos que puede presentar una herida compleja. El médico especializado en heridas puede elaborar un plan de tratamiento realista, centrado en el paciente, y elegir el producto de vendaje adecuado que sea apropiado para el objetivo propuesto.
Conflicto de intereses
Los autores declaran que no hay conflictos de intereses en este estudio.
Financiación
Los autores no recibieron financiación para este estudio.
Author(s)
Angela Yi Jia Liew*
RN, CWOCN
Assistant Nurse Clinician, Division of Nursing, Speciality Nursing (Wound Care), Singapore General Hospital, Singapore
Email Angela.liew.y.j@sgh.com.sg
Yee Yee Chang
MN, RN, CWOCN
Nurse Clinician, Division of Nursing, Speciality Nursing (Wound Care), Singapore General Hospital, Singapore
* Corresponding author
References
- Coskun H, Erisen L, Basut O. Factors affecting wound infection rates in head and neck surgery. Otolaryngol Neck Surg [Internet]. 2000;123(3):328–33.
- Dowsett C, Protz K, Drouard M, Harding K. Triangle of wound assessment made easy. Wounds Asia [Internet]. 2015;1–6.
- Fleck CA, Simman R. Modern collagen wound dressings: function and purpose. J Am Col Certif Wound Spec [Internet]. 2010;2(3):50–4.
- Vowden K, Vowden P. Wound dressings: principles and practice. Surg (UK) [Internet]. 2017;35(9):489–94.
- Winter GD. Some factors affecting skin and wound healing. J Tissue Viability [Internet]. 2006;16(2):20–3.
- Jones J. Winter’s concept of moist wound healing: a review of the evidence and impact on clinical practice. J Wound Care 2005;14(6):273–6.
- Baranoski S, Ayello EA. Wound dressings: an evolving art and science. Adv Ski Wound Care 2012;25(2):87–92.
- Dwek JR. The periosteum: what is it, where is it, and what mimics it in its absence? Skeletal Radiol 2010;39(4):319–23.
- Agarwal A, Andrew LE, Ayello EA, Baranoski S, Bates-Jensen BM, Bauer C, et al. Chapter two: wound healing. In: Doughty DB, McNichol L, editors. Wound, Ostomy and Continence Nurses SocietyTM core curriculum: wound management. 1st ed. Philadelphia: Wolters Kluwer; 2016. p. 24–68.
- Sebastian S. Does preoperative scalp shaving result in fewer postoperative wound infections when compared with no scalp shaving? A systematic review. J Neurosci Nurs [Internet]. 2012;44(3):149–56.
- Wang J, Boerma M, Fu Q, Hauer-Jensen M. Radiation responses in skin and connective tissues: effect on wound healing and surgical outcome. Hernia 2006;10(6):502–6.
- Sandoz H, Swanson T, Weir D, Schultz G. Biofilm-based wound care with cadexomer iodine. Wounds Int [Internet]. 2017;(November):1–6.



