Volume 40 Number 4
A quality improvement project comparing two treatments for deep-tissue pressure injuries to feet and lower legs of long-term care residents
Autumn Henson and Laurie Kennedy-Malone
Keywords pressure injury, deep-tissue pressure injury, lower-extremity injury, long-term care, offloading, polymeric membrane dressings, skin barrier film
For referencing Henson A and Kennedy-Malone L. A quality improvement project comparing two treatments for deep-tissue pressure injuries to feet and lower legs of long-term care residents. WCET® Journal 2020;40(4):30-35
DOI https://doi.org/10.33235/wcet.40.4.30-35
Abstract
Objective To retrospectively examine clinical outcomes from a feasibility study that compared two treatment options for deep-tissue pressure injuries (DTPIs), including the clinical indicators increasing the risk of deteriorating DTPIs among long-term care residents.
Methods A retrospective chart audit of 40 DTPIs from 33 long-term care residents in two long-term care facilities were conducted to compare 1: polymeric membrane dressings (PMDs) with offloading; and 2: a skin barrier film with offloading.
Results Of the 13 DTPIs treated with PMDs, only 23% deteriorated to a stage 3 or 4 pressure injury (PI), whereas of the 27 DTPIs treated with skin barrier film, 41% deteriorated to a stage 3 or 4 PI. The clinical factors found to increase the risk of developing and deteriorating DTPIs included weight loss, hypoalbuminemia, debility, dementia, coronary artery disease, and cerebrovascular disease.
Conclusions The PMD group’s DTPIs evolved into fewer open PIs despite having higher percentages of clinical indicators for DTPIs. The project findings support the use of PMD dressings for DTPIs; however, more robust research is warranted.
Introduction
A pressure injury (PI) is pressure-related damage to a local area of skin and the underlying tissue, generally over a bony prominence.1 These injuries present a significant challenge for the staff of long-term care facilities (LTCFs) and affect their residents’ quality of life, escalating healthcare costs, readmissions, risk of infection, pain, depression, and death.2,3 Deep-tissue pressure injuries (DTPIs) are PIs that occur under intact skin, which are thought to first develop in the deep tissues of the body and then appear on the skin surface4 as nonblanchable red, purple, or maroon discoloration or a blood-filled blister.1
Despite current treatment, these injuries often rapidly become open wounds.4 Typically, DTPI treatment aims to prevent further damage and avoid devolution to stage 3 or 4 PI.4 However, there is limited research on DTPI treatment, so this quality improvement project was implemented to retrospectively analyse the findings of a feasibility study that compared a drug-free polymeric membrane dressing (PMD) with the use of a skin barrier film among residents in two LTCFs with DTPIs on their feet and lower legs. The PMD is a foam dressing designed to reduce inflammatory factors and edema related to skin damage while requiring infrequent dressing changes.5 The PMD was chosen because of its easy accessibility and supply in the study LTCFs. Skin barrier films come in multiple forms and comprise a transparent coating to protect skin from trauma and moisture.6 The previous DTPI treatments used in the two facilities were a skin barrier film and offloading; despite using the skin barrier film twice a day, the facilities continued to see deteriorating DTPIs, prompting the feasibility study.
Along with the current treatment concerns regarding DTPIs, research is ongoing to ascertain whether there are clinical indicators that influence the evolution of DTPIs into open wounds. In LTCFs, most residents have multiple comorbidities that influence PI risk, including DTPIs.7 Further studies are needed to conclusively establish the clinical indicators that potentially contribute to DTPIs so they can be mitigated.
Background and Clinical Problem
The prevalence of DTPIs has increased threefold since 2006, presumably because of the classification of DTPIs, which were defined in 2007. This increased the awareness of DTPIs.4 Changes in regulations and improvements in prevention and treatment have not reduced their incidence, and the number and cost of all PIs continue to increase.8 In addition to causing pain and suffering for LTCF residents, DTPIs cost LTCFs as much as $3.3 billion annually.9
The most common location for a DTPI is on the heel. Heels are mostly bony prominences covered by a thin layer of skin with little padding or protection from pressure.10,11 Further, other medical conditions, such as respiratory and/or cardiovascular issues, increase the time residents spend supine, and they often require the head of the bed to be elevated, which places additional pressure on the feet and legs.10-13 The same pressure mechanisms damage the soft tissues of the lateral areas of the foot and toes; because of chronic lateral positioning, these areas often experience sustained, unrelieved pressure.11
Shearing is a common risk factor to consider in the evolution of DTPIs.13,14 The layers of skin stretched against a surface with friction and pressure result in damage on the surface and deeper internal tissues.14 Shearing risk includes passive repositioning of residents, elevating the head of the bed, and involuntary active movements involving spasms or tremors from medical conditions, which increase the constant positioning/pressure of the feet against the mattress.14 The risk of pressure and shearing consequently increases the risk of deterioration of DTPIs of the feet and lower legs.4,14,15
In addition to the lack of standard treatment for DTPIs, there is concern about whether DTPI deterioration could be affected by certain clinical indicators. In many LTCFs, a large percentage of residents with limited mobility and debility have a higher risk of developing a PI. As residents age, the number of medical conditions they encounter increases.7 Published studies show that medical conditions such as anemia, diabetes mellitus, fecal or urinary incontinence, vascular disease, or malnutrition increase the risk of developing PIs and (more recently) DTPIs.3,4,7,16 Of these risk factors, anemia has been most commonly associated with an increased risk of DTPIs.3,4 A review by Gefen et al13 notes that variables such as fever, uncontrolled cardiovascular disease, or respiratory acidosis could also increase the risk of DTPIs. Accordingly, this project not only compared two different treatment options for DTPIs, but also considered the resident’s clinical indicators and their potential influence on DTPI deterioration.
The treatment of DTPIs generally falls into one of two categories: offloading and application. In a Cochrane systematic review, McGinnis and Stubbs17 studied heel pressure-reducing devices for offloading in the treatment of heel ulcers. According to their results, there is no single device available that meets all of the criteria for comfort in the prevention and treatment of heel ulcers by removing pressure with offloading. There also is a need for further research into relieving heel pressure and treating PIs with offloading.17 Van Leen et al18 reviewed pressure-reducing techniques for PI treatment in a longitudinal study in a Dutch LTCF. Offloading the feet and lower legs led to a statistically significant decrease in PIs from 16.6% to 5.5%, with the most benefit for patients with medium to high risk of PIs. Over the years of the study, 57.8% of the patients at medium to high risk of PI with documented offloading of feet and legs (as well as educational intervention) were less likely to develop a PI.18
The other category of treatment is the application of dressings. A randomised controlled study by Sullivan19 evaluated the treatment of DTPIs with dressings and demonstrated that 74% of DTPIs decreased in size or resolved with the use of a self-adherent, multilayered, silicone-based border foam dressing. Of the 128 DTPIs in this study, only one opened to deeper tissue, and the other injuries either did not open or opened to the dermis with a mean healing time of 17.8 days. Essentially, the multilayered foam dressings decreased deterioration and improved resolution time.19
Campbell et al16 evaluated the use of padded-heel dressings to treat heel wounds. The treatment group showed 100% improvement among the 20 participants, whereas only 13 of 20 wounds in the control group closed. The study also demonstrated that the treatment group required less time and financial expense to heal.16
The National Pressure Injury Advisory Panel recommends the use of offloading and preventive dressings on residents who are at high risk of developing heel ulcers.20 Levy et al15 observed that prophylactic dressings applied to the heels decreased the risk of DTPIs by reducing stress and shear. Ultimately, the use of dressings to protect skin and offload pressure and shearing is widely recommended, although comparison studies are limited and warranted.
Methods
The purpose of this project was to retrospectively compare, analyse, and evaluate the documented deterioration of DTPIs to open PI among residents using two different treatments. The secondary purpose was to determine the prevalence of clinical indicators known to contribute to the development of DTPIs in the PMD group versus the skin barrier film group.
This project sought to answer the following research questions:
(1) Do PMDs and foot offloading reduce deterioration of DTPIs for residents 55 years or older better than skin barrier film with offloading?
(2) What was the prevalence of various clinical indicators among residents who developed a DTPI on their foot and/or lower extremity, and would a change in treatment have an impact on the evolution of the DTPI?
Study Initiation and Ethics
An analysis of administrative data collected by the quality assurance and performance improvement team from two LTCFs during 2014 and 2015 showed that 36% of DTPIs evolved into open stage 3 or 4 PIs when treated with offloading and the twice-daily application of a skin barrier film. This finding was the catalyst to perform a feasibility study comparing the skin barrier film with PMDs for DTPIs that developed between October 2015 and May 2017 in the two facilities. The PMD was chosen because it was new to the facilities’ formulary lists, was easily accessible, and had evidence of benefit for other types of wounds.
This retrospective comparative analysis project conducted in fall 2017 examined the outcomes for the 33 residents with a total of 40 DTPIs included in the feasibility study. Researchers conducted a systematic chart audit comparing the treatments of PMD or skin barrier film for the sample of residents with DTPIs and based on the type of treatment used from October 2015 to May 2017. Charts were included in the project if the resident had a DTPI to the feet and lower legs, were at least 55 years old, and were treated with either PMDs or skin barrier film with offloading.
During the feasibility study, each resident in each group had an ongoing order for offloading to the DTPI. The residents chosen for the PMD group either provided consent for the new treatment or permission was granted by the resident’s responsible party. Treatment with PMD included cutting the PMD to a size slightly larger than the DTPI as well as the application of a transparent medical dressing to cover the PMD once applied. The dressing was changed twice a week. The skin barrier film wipes were applied twice daily, and skin was allowed to dry following the application. The university’s institutional review board deemed the current project exempt. The LTCFs’ corporate holding company, administrative leadership teams, and medical providers’ board members approved the project.
Setting and Participants
The two participating LTCFs are Medicare and Medicaid approved, with private pay residents and a bed capacity of approximately 90 and 110 residents, respectively. They are in the southeastern US. These facilities provide short- and long-term care services that include rehabilitation and complex medical care for residents with reduced physical and mental functioning and multiple comorbidities such as PIs and DTPIs.
Data were extracted, deidentified, audited for the inclusion criteria, and given to the principal investigator by chart auditors. The sample was developed based on resident treatment, with the skin barrier group comprising 23 residents with 27 DTPIs, and the PMD group, 10 residents with 13 DTPIs.
Data Collection and Outcome Measures
Trained medical records experts from each facility extracted previously recorded data from the electronic medical record program called the Electronic Charting System. The data collectors were trained by the principal investigator as to what specific data to extrapolate and code for data entry. The data collectors received standardised training from the investigator to ensure the accuracy of the data collection and the systematic retrieval of the information. Data were retrieved from the electronic medical record on each resident for every DTPI documented. The generated data reports were deidentified and transferred into a private, secure PDF file by the data collectors. The PDF file was then coded and converted into a Microsoft Excel form and organised into a secure database and stored in a password-protected file for retrieval by the principal investigator for analysis.
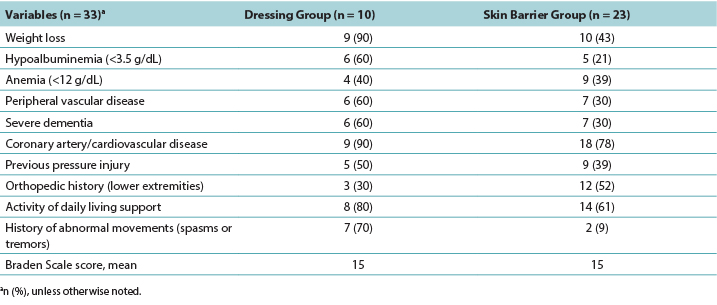
Data extracted from the medical charts consisted of both demographics and clinical indicators. Demographics included resident age, sex, and ethnicity. The clinical indicators included laboratory test results (anemia and hypoalbuminemia screening), chronic diseases/comorbidities, health history, functional status, and Braden Scale scores.
The Braden Scale is an assessment tool used to determine the risk of developing a PI. The Braden Scale scoring ranges from less than 9 to 32. The lower the Braden Scale score, the higher the risk of developing a PI.21 Residents with albumin levels less than 3.2 g/dL (reference range, 3.5-5.2 g/dL) demonstrated hypoalbuminemia, which may reflect a decrease in nutrition status in certain patient populations.7 Anemia was identified as a hemoglobin level below the reference range of 12 to 15 g/dL. Chronic diseases and comorbidities were identified with a diagnosis or International Classification of Diseases, 10th Revision code and included peripheral vascular disease, dementia, coronary artery disease, and/or cerebrovascular disease.
Further data included history of previous PI and recent orthopedic history such as any fracture or surgery to the lower half of the body. In addition, information on the resident’s level of activities of daily living support and any history of chronic involuntary movements was retrieved. Weight changes were also noted, that is, whether each resident had weight gain or weight loss prior to the identification of the DTPI(s).
Any diagnosis of peripheral vascular disease noted in the residents’ chart was captured in the data collection. Because no residents had a documented ankle-brachial pressure index to confirm diagnosis, residents with peripheral artery disease were excluded. In addition, residents with previously diagnosed diabetic or arterial ulcers were excluded.
The outcome variables included DTPI deterioration and PI stage at the time of opening, if applicable.
Statistical Analysis
The Microsoft Excel Descriptive Statistics Tool (Redmond, Washington) was used to analyse the data from the two groups. Descriptive statistics were used to describe the sample. Independent χ2 tests were used to compare each group with the clinical outcomes of opening or not opening. P < .05 was considered statistically significant.
Results
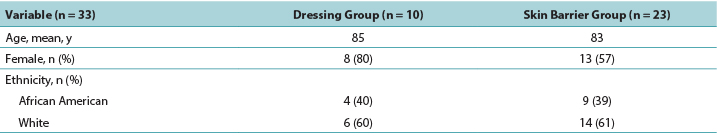
The majority of participants were White women with a mean age of 84 years. The PMD group was slightly older than the skin barrier film group (Table 1).
Table 1. Demographics of Residents with deep-tissue pressure injury by treatment group
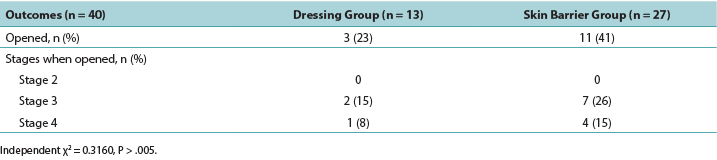
A simple statistical analysis compared the primary outcome measure between groups; according to the independent χ2 test, the difference was not statistically significant (P = .3160). In the PMD group, 23% of the DTPIs deteriorated to an open PI, whereas 41% of the DTPIs in skin barrier film group opened to a stage 3 or 4 PI. Of the DTPIs that opened, only two of the PMD group wounds opened to a stage 3 PI, and only one opened to a stage 4 PI. Of the DTPIs in the skin barrier film group, seven DTPIs opened to a stage 3 PI, and four opened to a stage 4 PI (Table 2).
Table 2. Wound outcomes
Descriptive data were generated for the clinical indicators that increased the risk of developing a DTPI (Table 3). The PMD group had more residents with known clinical indicators for DTPIs. The number of residents needing two people to assist in their activities of daily living was a significant factor, representing 80% of the PMD group and 61% of the skin barrier film group. Residents in both groups had an average Braden Scale score of 15, indicating at least a moderate risk of developing a DTPI. Weight loss and lower albumin scores were implicated, especially for the PMD group, with 90% seeing weight loss and 60% hypoalbuminemia. The residents with severe dementia (PMD, 60%; skin barrier film, 30%) also demonstrated a higher risk of DTPI, as well as residents with a diagnosis of coronary artery disease or cerebrovascular disease (PMD, 90%; skin barrier film, 78%). To investigate shearing, data were collected on residents who had abnormal lower extremity movement such as tremors or spasms. In the PMD group, this clinical indicator may have contributed to the development of DTPIs in 70% of the residents. Interestingly, anemia was an indicator for DTPIs (PMD, 40%; skin barrier film, 39%), although not to the significance level noted in other studies.
Table 3. Clinical Indicators of Residents with deep-tissue pressure injury by treatment group
Discussion
This retrospective project concluded that skin barrier film and offloading did not prevent the deterioration of DTPIs. Only three DTPIs evolved into an open wound in the PMD group, compared with 11 of the DTPIs in the skin barrier film group. Although this project did not have the statistical power to demonstrate significance, results indicate a possible benefit to changing the current treatment from the skin barrier film with offloading to PMDs with offloading.
This project found a higher risk of deteriorating DTPIs in the residents with more clinical indicators, in accordance with previous studies.7,16 Many of the LTCF residents’ medical conditions continue to be significant indicators, including weight loss, lower albumin levels, abnormal movements such as spasms or tremors, coronary artery disease, and cerebrovascular disease.4,16 Indicators such as anemia, previous orthopedic surgeries or fractures, peripheral vascular disease, and severe dementia were associated with a moderate risk of deteriorating DTPIs; previous studies found these were high-risk indicators.4,7,16 Interestingly, the PMD group had more clinical indicators for DTPI deterioration on average and yet had better outcomes. This demonstrates that treatment and management can outweigh the effects of clinical indicators for DPTI progression.
Limitations
The convenience sample size was small because of the total number of residents with diagnosed DTPI during the feasibility study period. Although all of the data collectors were trained by one person at the same time, there was no interrater reliability testing. Further, the diagnosis of DTPI was extracted by the data collectors based on provider diagnosis, because an International Classification of Diseases, 10th Revision code for DTPI was not established until 2019. Finally, it is important to note that PMDs may not be available in all healthcare settings, limiting the generalisability of the findings.
Implications for Clinical Practice
Offloading and repositioning of LTCF residents continue to be the recommended treatment for DTPIs. However, complications related to deteriorating DTPIs affect LTCF residents and strain the healthcare system. This project compares two different treatments for DTPIs, while considering the clinical indicators that may increase the risk of DTPI deterioration. Although further evidence is needed to address the cost-effectiveness of these treatments, PMD likely reduced the deterioration of DTPIs. Therefore, PMDs may be attractive to facilities striving to deliver efficient healthcare for their residents, especially those with high-risk residents.
Conclusions
Although prevention is crucial, once a DTPI has developed, having a fast and reliable treatment option to prevent further deterioration is of the utmost importance. By addressing DTPIs with offloading and screening for clinical indicators of deterioration, along with a preventive treatment such as PMD, the trajectory for these injuries could be vastly improved.
Conflict of Interest
The authors declare no conflicts of interest.
Funding
The authors received no funding for this study.
Proyecto de mejoramiento de calidad al comparar dos tratamientos para lesiones por presión de tejido profundo en los pies y las partes inferiores de las piernas en residentes con cuidado de largo plazo
Autumn Henson and Laurie Kennedy-Malone
DOI: https://doi.org/10.33235/wcet.40.4.30-35
Resumen
Objetivo Analizar de manera retrospectiva los resultados clínicos de un estudio de factibilidad que comparó dos opciones de tratamiento para las lesiones por presión de tejido profundo (DTPI, por sus siglas en inglés), que incluye los indicadores clínicos del riesgo de deterioro de las DTPI entre los residentes de cuidado de largo plazo.
Métodos Se realizó una auditoría de registros retrospectiva de 40 DTPI de 33 residentes de cuidado a largo plazo en dos instituciones de cuidado de largo plazo para comparar: 1: vendajes de membrana polimérica (PMD, por sus siglas en inglés) con descarga; y 2: una película como barrera cutánea con descarga.
Resultados De las 13 DTPI tratadas con PMD, solo un 23 % se deterioró hasta llegar a un estado 3 o 4 de lesión por presión (PI), mientras que, de las 27 DTPI tratadas con una película como barrera cutánea, un 41 % se deterioró hasta llegar a un estadio 3 o 4 de lesión por presión. Entre los factores clínicos encontrados para aumentar el riesgo de desarrollar y deteriorar las DTPI incluyeron, pérdida de peso, hipoalbuminemia, debilidad, demencia, arteriopatía coronaria y enfermedad cerebrovascular.
Conclusiones Las DTPI del grupo de PMD evolucionó en menos PI abiertas, a pesar de tener porcentajes de indicadores clínicos más altos para las DTPI. Los hallazgos del proyecto respaldan el uso de vendajes de PMD para las DTPI; sin embargo, se garantiza una investigación más robusta.
Introducción
Una lesión por presión (PI) es un daño relacionado con la presión a un área local de la piel y el tejido subyacente, por lo general, sobre una prominencia ósea.1 Estas lesiones presentan un reto importante para el personal de las instituciones de cuidado de largo plazo (LTCF, por sus siglas en inglés) y afectan la calidad de vida de sus residentes, escalando en los costes de asistencia sanitaria, readmisiones, riesgo de infección, dolor, depresión y muerte.2,3 Las lesiones por presión del tejido profundo (DTPI) son PI que ocurren bajo la piel intacta, que se cree que se desarrollan en primer lugar en los tejidos profundos del cuerpo y luego aparecen en la superficie de la piel como4 una descoloración roja no blanqueable, purpúrica o marrón o una ampolla llena con sangre.1
A pesar del tratamiento actual, estas lesiones a menudo se convierten rápidamente en heridas abiertas.4 Generalmente, el objetivo del tratamiento de las DTPI es impedir más daño y evitar la evolución a un estadio 3 o 4.4 Sin embargo, hay investigación limitada sobre el tratamiento de la DTPI, de modo que se implementó un proyecto de mejoramiento de la calidad para analizar de manera retrospectiva los hallazgos de un estudio de factibilidad que comparara un vendaje con membrana polimérica sin medicamentos con el uso de una película como barrera cutánea entre los residentes de LTCF con DTPI en los pies y parte inferior de las piernas. El PMD es un vendaje con esponja diseñado para reducir los factores inflamatorios y el edema relacionado con el daño de la piel mientras no se requieren cambios de vendajes frecuentes.5 En el estudio de las LTCF se eligió el PMD por su fácil accesibilidad y suministro. Las películas como barreras cutáneas vienen de diversas formas y comprenden una capa transparente para proteger la piel de las lesiones y la humedad.6 Los tratamientos anteriores de DTPI usados en dos instituciones fueron una película como barrera cutánea y descarga; a pesar de utilizar una película como barrera cutánea dos veces por día, las instituciones siguieron viendo el deterioro de las DTPI que dieron lugar a este estudio de factibilidad.
Junto con las inquietudes actuales sobre el tratamiento con respecto a las DTPI, la investigación es permanente para verificar si hay indicadores clínicos que influyen en la evolución de las DTPI en las heridas abiertas. En las LTCF, la mayoría de los residentes tienen múltiples comorbilidades que influyen en el riesgo de PI, además de las DTPI.7 Se necesitan más estudios para establecer de manera concluyente los indicadores clínicos que contribuyen potencialmente a las DTPI de modo que se las pueda mitigar.
Antecedentes y problemas clínicos
La prevalencia de las DTPI se ha triplicado desde 2006, supuestamente debido a la clasificación de DTPI, que fue definida en 2007. Esto aumentó la concienciación de las DTPI.4 Los cambios en las reglamentaciones y las mejoras en la prevención y el tratamiento no han reducido la incidencia, y la cantidad y el coste de todas las PI siguen aumentando.8 Además de causar dolor y sufrimiento a los residentes de LTCF, el coste de las DTPI a las LTCF es de $3300 millones anualmente.9
El sitio más común de una DTPI es en el talón. Los talones son las mayores prominencias óseas cubiertas por una capa fina de piel con poco acolchado o protección contra la presión.10,11 Además, otras enfermedades, tales como problemas respiratorios o cardiovasculares aumentan el tiempo que los residentes pasan en posición supina y, a menudo, es necesario que se les levante la cabecera de la cama, hecho que produce más presión en los pies y en las piernas.10-13 Los mismos mecanismos de presión dañan las partes blandas de las áreas laterales del pie y de los dedos. Debido a la posición lateral crónica, dichas áreas a menudo sufren una presión sostenida y persistente.11
La fricción es un factor de riesgo común para tener en cuenta en la evolución de las DTPI.13,14 Las capas de piel se estiran en la superficie con fricción y la presión causa daño en la superficie y la parte más profunda de las partes internas.14 El riesgo de fricción incluye volver a colocar a los residentes de manera pasiva, elevando la cabecera de la cama y movimientos activos involuntarios que involucran espasmo o temblores de las enfermedades, que aumentan el posicionamiento/presión constante de los pies contra el colchón.14 El riesgo de la presión y la fricción por consiguiente aumenta el riesgo de deterioro de la DTPI de los pies y la parte inferior de las piernas.4,14,15
Además de la falta de tratamiento estándar para las DTPI, hay preocupación con respecto a si el deterioro de la DTPI podría ser afectado por ciertos indicadores clínicos. En muchas LTCF, un gran porcentaje de residentes con movilidad restringida y debilidad corren un riesgo más alto de presentar una PI. A medida que los residentes envejecen, la cantidad de enfermedades que enfrentan aumentan.7 Los estudios publicados muestran que las enfermedades, tales como anemia, diabetes mellitus, incontinencia fecal o urinaria, enfermedad vascular o desnutrición aumentan el desarrollo de PI y (de manera más reciente) de DTPI.3,4,7,16 De estos factores de riesgo, la anemia ha sido más asociada comúnmente con un riesgo incrementado de DTPI.3,4 Una revisión realizada por Gefen y cols.13 destaca que las variables, p. ej. fiebre, enfermedad cardiovascular sin control o acidosis respiratoria podrían aumentar el riesgo de las DTPI. De la misma manera, este proyecto no solo compara dos opciones de tratamiento diferentes para DTPI, sino también que tiene en cuenta los indicadores clínicos del residente y su posible influencia en el deterioro de la DTPI.
El tratamiento de las DTPI generalmente está comprendido en una de dos categorías: descarga y aplicación. En una revisión sistemática de Cochrane, McGinnis y Stubbs17 estudiaron los dispositivos que reducen la presión del talón debido a la descarga en el tratamiento de úlceras del talón. Según los resultados, no hay un dispositivo único disponible que cumpla con todos los criterios de comodidad en la prevención y el tratamiento de las úlceras del talón al eliminar la presión con descarga. También es necesario realizar más investigación con respecto a la presión del talón y el tratamiento de PI con descarga.17 Van Leen y cols.18 revisaron técnicas que reducen la presión para el tratamiento de las PI en un estudio longitudinal en una LTCF holandesa. La descarga de los pies y la parte inferior de las piernas conducen a una disminución importante desde el punto de vista estadístico en las PI de un
16,6 % a un 5,5 %, que brinda más beneficio a los pacientes con riesgo de PI de mediano a alto. Con el paso de los años del estudio, un 57,8 % de los pacientes con PI de riesgo de mediano a alto con descarga documentada de pies y piernas (así como también la intervención educativa) fueron menos probables de desarrollar PI.18
La otra categoría de tratamiento es la aplicación de vendajes. Un estudio de control aleatorio realizado por Sullivan19 evaluó el tratamiento de las DTPI con vendajes y demostró que un 74 % de las DTPI disminuyó en tamaño o que se solucionaron con el uso de vendajes de esponja con una barrera de silicona, multicapa y autoadherente. De las 128 DTPI de este estudio, solo una se abrió en un tejido más profundo, y las otras lesiones no se abrieron o la dermis no se abrió con un tiempo de cicatrización medio de 17,8 días. Esencialmente, los vendajes de esponja multicapas disminuyeron el deterioro y mejoraron el tiempo de resolución.19
Campbell y cols.16 evaluó el uso de los vendajes con talón acolchado para tratar las heridas del talón. El grupo de tratamiento mostró un 100 % de mejora entre los 20 pacientes, mientras que se se cerraron solo 13 de las 20 heridas del grupo de control. El estudio también ha demostrado que el grupo de tratamiento necesitó menos tiempo y gasto financiero para la cicatrización.16
El Panel Consultivo Nacional para las Lesiones por Presión recomienda el uso de descarga y de vendajes preventivos en los residentes que corren un alto riesgo of de desarrollar úlceras de talón.20 Levy y cols.15 observó que los vendajes profilácticos aplicados a los talones disminuyeron el riesgo de las DTPI reduciendo el estrés y la fricción. En consecuencia, se recomienda ampliamente el uso de vendajes para proteger la piel y la presión de descarga y fricción, a pesar de que los estudios de comparación son limitados y garantizados.
Métodos
El objetivo de este proyecto fue comparar de manera retrospectiva, analizar y evaluar el deterioro documentado de las DTPI y las PI abiertas entre los residentes utilizando dos tratamientos diferentes. El objetivo secundario fue determinar la prevalencia de los indicadores clínicos conocidos para contribuir al desarrollo de las DTPI en el grupo de PMD en comparación con el grupo que usó la película como barrera cutánea.
Este proyecto buscaba la respuesta a las siguientes preguntas de investigación:
(1) ¿Las PMD y la descarga en el pie reducen el deterioro provocado por las DTPI en los residentes mayores de 55 años de edad más que la película como barrera cutánea con descarga?
(2) ¿Cuál fue la prevalencia de los diferentes indicadores clínicos que desarrollaron una DTPI en el pie o en la extremidad inferior, y un cambio en el tratamiento tendría un impacto en la evolución de la DTPI?
Inicio de estudio y ética
Un análisis de los datos administrativos recopilados por el grupo de aseguramiento de calidad y del mejoramiento de desempeño de dos LTCF durante 2014 y 2015 demostró que un 36 % de las DTPI alcanzaron un estadio abierto 3 o 4 cuando a las PI se las trataron con descarga y con dos aplicaciones diarias de una película como barrera cutánea. El presente hallazgo fue el catalizador para realizar un estudio de factibilidad que comparaba la película como barrera cutánea con PMD para las DTPI, que se desarrolló en dos instituciones entre octubre de 2015 y mayo de 2017. Se eligió un PMD porque era nuevo en la lista de formulario de las instituciones, era muy accesible y tenía pruebas de brindar beneficios para otro tipo de heridas.
El presente proyecto de análisis comparativo retrospectivo realizado en otoño boreal de 2017 analizó los resultados para los 33 residentes con un total de 40 DTPIs incluidas en el estudio de factibilidad. Desde octubre de 2015 hasta mayo de 2017, los investigadores llevaron a cabo una auditoría de registros sistemática que comparaba los tratamientos de PMD o la película como barrera cutánea para la muestra de residentes con DTPI y basada en el tipo de tratamiento utilizado. Se incluyeron registros en el proyecto si el residente tenía una DTPI en los pies y la parte inferior de las piernas, tenían por lo menos 55 años de edad y estaban tratados con PMD o con una película como barrera cutánea con descarga.
Durante el estudio de factibilidad, cada residente de cada grupo tenía una orden permanente de descarga de DTPI. Los residentes elegidos para el grupo de PMD dieron un consentimiento para el nuevo tratamiento o la parte responsable del residente otorgó el permiso. El tratamiento con PMD incluyó cortar un PMD a un tamaño un poco mayor que la DTPI, así como también la aplicación de un vendaje médico transparente para cubrir el PMD una vez que fuera aplicado. El vendaje se cambió dos veces por semana. Dos veces por día se aplicaron apósitos con película como barrera cutánea, y se dejó que la piel secara después de la aplicación. La junta de revisión institucional de la universidad consideró la exención del proyecto actual. La casa matriz corporativa de las LTCF, los equipos de liderazgo administrativo y los miembros de la junta de prestadores médicos aprobaron el proyecto.
Entorno y participantes
Las dos LTCF participantes estaban aprobadas por Medicare y Medicaid, y tenían residentes pagos privados y una capacidad de camas de aproximadamente 90 y 110 residentes, respectivamente. Se encuentran ubicados en el sudeste de EE. UU. Estas instituciones prestan servicios de cuidado de corto y largo plazo que incluyen cuidado de rehabilitación y médico de complejidad para los residentes con funciones físicas y mentales reducidas y múltiples comorbilidades, tales como PI y DTPI.
Los auditores de gráficos extrajeron los datos, los anonimizaron, los auditaron para determinar los criterios de inclusión, y se los entregaron al investigador principal. La muestra se elaboró basada en el tratamiento del residente, con un grupo de barrera cutánea que comprendía 23 residentes con 27 DTPI y el grupo de PMD con 10 residentes con 13 DTPI.
Recopilación de datos y medidas resultantes
Los expertos en historias clínicas formados de cada institución registraron datos anteriormente de los programas de historias clínicas electrónicas llamado Sistema de Historias Clínicas Electrónicas. El investigador principal formó a los recopiladores de datos con respecto a qué datos específicos se debían extrapolar y los códigos para la entrada de datos. Los recopiladores de datos recibieron formación estandarizada del investigador para garantizar la exactitud de la recopilación de datos y la recuperación sistemática de la información. Los datos se recuperaron a partir de los registros médicos electrónicos sobre cada residentes para cada DTPI documentado. Los recopiladores de datos anonimizaron los informes de datos generados y transfirieron a un archivo de PDF seguro y privado. Después se codificó el archivo de PDF y se lo convirtió a un formato de Microsoft Excel y se lo organizó en una base de datos segura y se lo almacenó en un archivo protegido por contraseña para la recuperación para que el investigador principal lo recuperara para análisis.
Los datos extraídos de los registros médicos consistían en indicadores tanto demográficos como clínicos. Los datos demográficos incluían edad del residente, el sexo y la etnia. Los indicadores clínicos incluían los resultados de los análisis de laboratorio (cribado de anemia e hipoalbuminemia), enfermedades crónicas/comorbilidades, historia clínica, estado funcional y puntuaciones de la escala de Braden.
La escala de Braden es una herramienta de evaluación utilizada para determinar el riesgo de desarrollar una PI. Los rangos de puntuación de la escala de Braden varían entre menos de 9 y 32. Cuanto más baja es la puntuación de la escala de Braden, más alto es el riesgo de desarrollar una PI.21 Los residentes con niveles de albúmina menores de 3,2 g/dL (reference rango, 3,5-5,2 g/dL) demostraron hipoalbuminemia, que puede reflejar una disminución en el estado de la nutrición en ciertas poblaciones de pacientes.7 Se identificó anemia como un nivel de hemoglobina inferior al reference rango de 12 a 15 g/dL. Las enfermedades crónicas y las comorbilidades fueron identificadas con un diagnóstico o un código International Classification of Diseases, 10th Revision e incluyeron enfermedad vascular periférica, demencia, arteriopatía coronaria o enfermedad cerebrovascular.
Otros datos incluyeron los antecedentes de PI anteriores y antecedentes ortopédicos recientes, tales como cualquier fractura o cirugía de la mitad inferior del cuerpo. Además, se recuperó el nivel de actividades de la vida cotidiana del residente y cualquier antecedente de movimientos involuntarios crónicos. También se anotaron los cambios de peso, es decir, si cada residente aumentó de peso o bajó de peso antes de identificar la(s) DTPI.
En la recopilación de datos se capturó cualquier diagnóstico de enfermedad vascular periférica notada en el gráfico de los residentes. Debido a que los residentes no tenían un índice braquial del tobillo documentado para confirmar el diagnóstico, se excluyeron los residentes con una enfermedad arterial periférica. También se excluyeron los residentes con úlceras arteriales o de diabético diagnosticadas anteriormente. Las variables de resultados incluyeron el deterioro de la DTPI y el estadio de la PI al mismo tiempo de abrirlo, si correspondía.
Análisis estadístico
Se utilizó la herramienta de estadísticas descriptivas de Microsoft Excel (Redmond, Washington) para analizar los datos de dos grupos. Se utilizaron las estadísticas descriptivas para describir la muestra. Se utilizaron pruebas independientes χ2 para comparar cada grupo con los resultados clínicos de apertura o no. P < 0,05 fue considerada importante desde el punto de vista estadístico.
Resultados
La mayoría de los participantes eran mujeres blancas con una media de edad de 84 años. El grupo de PMD era levemente mayor que el grupo de la película como barrera cutánea (Cuadro 1).
Cuadro 1. Datos demográficos de los residentes con lesión por presión de tejido profundo por grupo de tratamiento
Un análisis estadístico sencillo comparó la medición de resultado primario entre los dos grupos. Según una prueba independiente χ2, la diferencia no era importante desde el punto de vista estadístico (P = 0,3160). En el grupo de PMD, un 23 % de las DTPI se empeoró a una PI abierta, mientras que un 41 % de las DTPI en el grupo de película como barrera cutánea se abrió a una PI de estadio 3 o 4. De las DTPI que se abrieron, solo dos heridas del grupo de PMD se abrieron a una PI de estadio 3 y solo uno se abrió a una PI de estadio 4. De las DTPI en el grupo de película como barrera cutánea, siete DTPI se abrieron a PI de estadio 3 y cuatro se abrieron a PI de estadio 4 (Cuadro 2).
Cuadro 2. Resultados de heridas

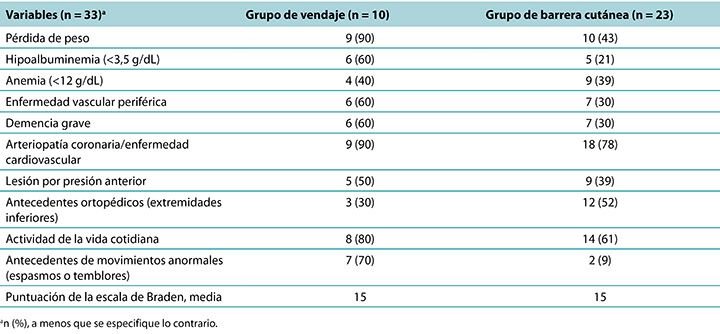
Se generaron datos descriptivos para los indicadores clínicos que aumentaron el riesgo de desarrollar una DTPI (Cuadro 3). El grupo de PMD tenía más residentes con indicadores clínicos conocidos para las DTPI. Debido a la cantidad de residentes se necesitaron dos personas para ayudar en sus actividades de la vida cotidiana que fue un factor decisivo, lo que representa un 80 % del grupo de PMD y un 61 % del grupo de la película como barrera cutánea. Los residentes de ambos grupos tenían una puntuación de 15 promedio en la escala de Braden que indicaba por lo menos un riesgo moderado de desarrollar una DTPI. Estaban implicados una pérdida de peso y la puntuación de albúmina inferior, especialmente para el grupo de PMD y un 90 % vio una pérdida de peso y un 60 % presentó hipoalbuminemia. Los residentes con demencia grave (PMD, 60 %; película como barrera cutánea, 30%) también mostraron un riesgo mayor de of DTPI, así como también los residentes con un diagnóstico de arteriopatía coronaria o enfermedad cerebrovascular (PMD, 90 %; película como barrera cutánea, 78 %). Para investigar la fricción, se recopilaron datos de los residentes que tenían un movimiento anormal de extremidad inferior, tales como temblores o espasmos. En el grupo de PMD, este indicador clínico puede haber contribuido al desarrollo de las DTPI en un 70 % de los residentes. Curiosamente, la anemia fue un indicador para las DTPI (PMD, 40 %; película como barrera cutánea, 39 %), si bien no tuvo el nivel de importancia observado en otros estudios.
Cuadro 3. Indicadores clínicos de los residentes con lesión por presión de tejido profundo por grupo de tratamiento
Discusión
Este proyecto retrospectivo llegó a la conclusión de que la película como barrera cutánea y la descarga no evitaron el deterioro de las DTPI. Solamente tres de las DTPI evolucionaron en una herida abierta en el grupo de PMD en comparación con 11 de las DTPI en el grupo de película como barrera cutánea. Si bien este proyecto no tuvo el poder estadístico para demostrar la importancia, los resultados indican un posible beneficio con respecto al cambio del tratamiento actual de la película como barrera cutánea con descarga por los PMD con descarga.
Este proyecto encontró un riesgo mayor de deterioro de las DTPI en los residentes con más indicadores clínicos, según estudios anteriores.7,16 Muchas de las enfermedades de los residentes de las LTCF siguen siendo indicadores importantes, que incluye pérdida de peso, niveles de albúmina más bajos, movimientos anormales, tales como espasmos o temblores, arteriopatía coronaria y enfermedad cerebrovascular.4,16 Los indicadores, tales como anemia, cirugías o fracturas ortopédicas anteriores, enfermedad vascular periférica y demencia grave estaban asociados con un riesgo moderado de deterioro de las DTPI; estudios anteriores encontraron que estos son indicadores de alto riesgo.4,7,16 Curiosamente, en promedio, el grupo de PMD tenían más indicadores clínicos para el deterioro de la DTPI y, aun así, tuvo mejores resultados. Esto demuestra que el tratamiento y el manejo pueden superar los efectos de los indicadores clínicos para la progresión de la DPTI.
Limitaciones
El tamaño conveniente de la muestra era pequeño debido a la cantidad total de residentes con diagnósticos de DTPI durante el período de estudio de factibilidad. A pesar de que todos los recopiladores de datos fueron formados por una sola persona al mismo tiempo, no hubo pruebas de fiabilidad entre los valores. Además, los recopiladores de datos extrajeron el diagnóstico de la DTPI basados en el diagnóstico del prestador, debido a que no se estableció para DTPI un código de la International Classification of Diseases, 10th Revision hasta 2019. Finalmente, es importante observar que los PMD pueden no estar disponibles en todos los entornos de asistencia sanitaria, limitando la generalización de los hallazgos.
Implicancias para la práctica clínica
La descarga y el reposicionamiento de los residentes de las LTCF sigue siendo el tratamiento recomendado para las DTPI. Sin embargo, las complicaciones relacionadas con el deterioro de las DTPI afectan a los residentes de las LTCF y ponen presión en el sistema de asistencia sanitaria. Este proyecto compara dos tratamientos diferentes para DTPI, a la vez que tiene en cuenta los indicadores clínicos que pueden aumentar el riesgo de deterioro de la DTPI. A pesar de que se necesitan más pruebas para abordar la eficacia en función del coste de estos tratamientos, es posible que el PMD reduzca el deterioro de las DTPI. Por consiguiente, los PMD pueden ser atractivos para las instituciones que se esfuerzan por brindar una asistencia sanitaria eficiente para sus residentes, especialmente para aquellos residentes con alto riesgo.
Conclusiones
Si bien la prevención es crucial, una vez que se ha desarrollado una DTPI, es de suma importancia tener una opción de tratamiento rápida y confiable para prevenir más deterioro. Al abordar las DTPI con la descarga y el cribado para los indicadores clínicos del deterioro, junto con un tratamiento preventivo, tal como el PMD, la trayectoria de estas lesiones se podrían mejorar ampliamente.
Conflicto de intereses
Los autores declaran que no hay conflictos de intereses.
Financiación
Los autores no recibieron financiación para este estudio.
Author(s)
Autumn Henson*
DNP, GNP-BC, WCC Nurse Practitioner, Physicians Eldercare, Winston-Salem, North Carolina.
Laurie Kennedy-Malone
PhD, GNP-BC, FAANP, FGSA Professor of Nursing, University of North Carolina at Greensboro.
* Corresponding author
References
- National Pressure Injury Advisory Panel. NPIAP Pressure Injury Stages. 2016. https://cdn.ymaws.com/npiap.com/resource/resmgr/online_store/npiap_pressure_injury_stages.pdf. Last accessed June 15, 2020.
- Peart J. The aetiology of deep tissue injury: a literature review. Br J Nurs 2016;25(15):840-3.
- Honaker J, Brockopp D, Moe K. Suspected deep tissue injury profile. Adv Skin Wound Care 2014;27(3):133-40.
- Preston A, Rao A, Strauss R, Stamm R, Zalman D. Deep tissue pressure injury. Am J Nurs 2017;117(5):50-7.
- Gefen A. The future of pressure ulcer prevention is here: detecting and targeting inflammation early. EWMA 2018;19(2):7-13.
- Kestrel Health Information. Liquid skin protectors/sealants. WoundSource. 2019. www.woundsource.com/print/product-category/skin-care/liquid-skin-protectantssealants. Last accessed June 6, 2020.
- Ahn H, Cowan L, Garvan C, Lyon D, Stechmiller J. Risk factors for pressure ulcers including suspected deep tissue injury in nursing home facility residents. Adv Skin Wound Care 2016;29(4):178-90.
- Centers for Medicare & Medicaid Services. Nursing Home Data Compendium 2015 Edition. 2015. www.cms.gov/Medicare/Provider-Enrollment-and-Certification/CertificationandComplianc/Downloads/nursinghomedatacompendium_508-2015.pdf. Last accessed June 6, 2020.
- Agency for Healthcare Research & Quality. AHRQ’s Safety Program for Nursing Homes: On-Time Pressure Ulcer Prevention. 2016. www.ahrq.gov/professionals/systems/long-term-care/resources/ontime/pruprev/index.html. Last accessed June 6, 2020.
- Grothier L. Management of residents with heel located pressure damage. J Community Nurs 2013;27(5):42-6.
- Levy A, Gefen A. Computer modeling studies to assess whether a prophylactic dressing reduces the risk for DTI in the heels of supine residents with diabetes. Ostomy Wound Manage 2016;62(4):42-52.
- Santamaria N, Gerdtz M, Sage S, et al. A randomized controlled trial of the effectiveness of soft silicone multi-layered foam dressings in the prevention of sacral and heel pressure ulcers in trauma and critically ill patients: the border trial. Int Wound J 2013;12(3):302-8.
- Gefen A, Farid K, Shaywitz I. A review of deep tissue injury development detection and prevention: shear savvy. Ostomy Wound Manage 2013;59(2):26-35.
- Cutting K. Improving patient outcomes: bridging the gap between science and efficacy. Br J Nurs 2016;25(6):S28-S32.
- Levy A, Frank M, Gefen A. The biomechanical efficacy of dressings in preventing heel ulcers. J Tissue Viability 2015;24(1):1-11.
- Campbell N, Campbell D, Turner A. A retrospective quality improvement study comparing use versus nonuse of a padded heel dressing to offload heel ulcers of different etiologies. Ostomy Wound Manage 2015;61(11):44-52.
- McGinnis E, Stubbs N. Pressure-relieving devices for treating heel pressure ulcers. Cochrane Database Syst Rev 2014;12(2):1-31.
- Van Leen M, Schols J, Hovius S, Halfens R. A secondary analysis of longitudinal prevalence data to determine the use of pressure ulcer preventive measures in Dutch nursing homes, 2005-2014. Ostomy Wound Manage 2017;63(09):10-20.
- Sullivan R. Use of a soft silicone foam dressing to change the trajectory of destruction associated with suspected deep tissue pressure ulcers. Medsurg Nurs 2015;24(4):237-42.
- National Pressure Injury Advisory Panel. Pressure injury prevention points. 2016. https://npiap.com/page/PreventionPoints#:~:text=Inspect%20all%20of%20the%20skin,elbows%20and%20beneath%20medical%20devices. Last accessed June 15, 2020.
- Kalowes P, Messina V, Li M. Five-layered soft silicone foam dressing to prevent pressure ulcers in the intensive care unit. Am J Crit Care 2016;25(6):e108-19.