Volume 41 Number 2
WHAM evidence summary: effectiveness of topical coconut products
Robin Watts, Teresa Solomon and Emily Haesler
Keywords skin conditions, topical coconut, coconut oil, wound management, low- and middle-resource countries
For referencing Watts R et al. WHAM evidence summary: effectiveness of topical coconut products. WCET® Journal 2021;41(2):32-35
DOI https://doi.org/10.33235/wcet.41.2.32-35
Clinical Question
What is the best available evidence on the use of topical coconut products in wound management and the treatment of skin conditions?
Summary
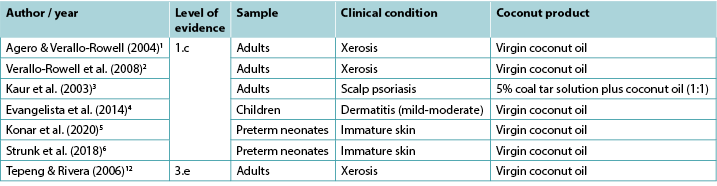
Despite the wide use of topical coconut products for medicinal purposes in tropical geographic regions, only a limited number of clinical studies reporting its effectiveness in treating skin conditions and no studies reporting its use in wound management were identified is this rapid review. Level 1 evidence1,2 demonstrated that topical virgin coconut oil (VCO) is associated with improvements in signs and symptoms of xerosis1,2 and psoriasis3 in adults, and mild-to-moderate dermatitis in children4. There is some evidence that VCO improves scores of skin immaturity in preterm neonates5,6. Currently no evidence is available on the use of topical coconut products for healing human wounds.
Clinical practice recommendations
All recommendations should be applied with consideration to the wound, the person, the health professional and the clinical context.
- Topical VCO could be considered for the treatment of mild-to-moderate xerosis (Grade B).
- Topical VCO could be considered for the treatment of psoriasis in the absence of access to topical corticosteroid therapy (Grade B).
- Topical VCO could be considered for the treatment of mild-to-moderate atopic dermatitis in children (Grade B).
Sources of evidence
This summary was conducted using methods published by the Joanna Briggs Institute (JBI)7–11. The summary is based on a systematic literature search combining search terms related to wounds and skin conditions with terms related to coconut palm. Searches were conducted in Embase, Medline, Global Health, and Allied and Complementary Medicine databases, and in 10 healthcare journals from low- and middle-income countries for evidence published up to May 2021 in English. Studies were assigned a level of evidence (Table 1) based on JBI’s hierarchy7–11. Recommendations are made based on the body of evidence and are graded according to the system reported by JBI7–11.
Table 1. Levels of evidence

Background
Various parts of the coconut tree have been used for a multitude of purposes in traditional medicine for thousands of years, to the extent that the plant is often called the “tree of life”16. Products derived from Cocos nucifera Linn: Arecaacae include coconut water, oil from coconut milk or copra (dried kernel), dried coconut shell and husk fibre17,18. The most used coconut product, virgin coconut oil (VCO), is extracted directly from coconut flesh and contains medium chain fatty acids that have surfactant qualities1,19,20. Another tested product, coconut shell liquid smoke (CS-LS) is produced by burning coconut shells at 400˚C resulting in a solution arising from condensation of vapour of wood smoke14. Coconut shells contain the highest antioxidant properties of any parts of the coconut14.
Laboratory testing and biochemical analysis of these products have identified a number of useful properties – anti-inflammatory, antimicrobial, antifungal, antioxidant, antineoplastic and analgesic17,18,20–24. When applied topically, VCO provides barrier protection for the stratum corneum and reduces transepidermal water loss (TEWL), promoting skin moisturisation19,20,24,25. When used on wounds, VCO and other coconut-derived products are reported to promote collagen synthesis and faster epithelisation15,20,24.
Evidence
Evidence from animal studies
Evidence on the wound healing effect of coconut comes from animal studies. Results from three studies13–15 are provided as examples of the significant amount of laboratory work on this topic. In the first study13, undertaken in India, VCO was applied daily for 10 days to open dermal wounds in rats. There were three groups of six rats each – a control group, a group treated with 0.5ml VCO, and a third treated with 1ml VCO. Time to complete epithelisation and composition of granulation tissue (e.g., collagen and fibroblasts) were among the outcome measures. In terms of both time to complete epithelisation and total collagen content, groups 2 and 3 were statistically significant compared to the control (p<0.05), 1ml being more effective than 0.5ml13 (Level 5).
The second study14 was conducted in Indonesia to evaluate the healing activity of CS-LS for burns. Thirty-six mice were randomised into three groups (n=12/group) – CS-LS, normal saline 0.9% (NaCl), and 10% povidone iodine. The burn wounds were left open, with treatment applied twice daily for 25 days. Wound contraction was measured on days 1, 5, 10 and 25 after burn induction. The CS-LS group showed the fastest wound contraction of the three groups by day 5 (p<0.001). On day 10 there was a statistically significant difference to the povidone iodine group (p<0.001) and on day 25 there was a statistically significant difference to the NaCl group (p<0.05)14 (Level 5).
In the third study15, VCO for treating diabetic ulcers was explored with a rat population. Rats with ulcers were divided into four groups – non-treated, non-diabetic rats (n=18), non-treated diabetic rats (n=18), diabetic rats receiving 1ml VCO applied daily for 14 days (n=18), and diabetic rats receiving silver sulfadiazine cream applied daily for 14 days (n=18). Wound closure rates were measured on days 5, 10 and 14. Diabetic ulcers treated with VCO had statistically significantly faster closure rates (p<0.05) compared with diabetic ulcers receiving no treatment on all days. On days 5 and 14 there was a statistically significant difference between the VCO and the silver sulfadiazine cream groups (p<0.05), favouring VCO15 (Level 5).
Evidence from human studies
Evidence on effectiveness for treating wounds
No evidence on topical coconut products for use in treating human wounds was identified.
Evidence on effectiveness for treating skin conditions
Xerosis in adults
Two blinded RCTs1,2 provided evidence for using VCO to relieve xerosis (dry skin) in adults. The first RCT1 was conducted on 34 individuals with mild-to-moderate xerosis to determine the effectiveness and safety of VCO compared with mineral oil when used as a therapeutic moisturiser. The solutions were applied to the legs twice daily for 14 days. Skin hydration and skin lipids were tested to measure effectiveness while TEWL and skin pH were the quantitative measures for safety. Xerosis was evaluated for dryness, scaling, roughness and pruritus by both an investigator using Wehr’s Grading and by participants using a visual analogue scale. Data were collected at baseline, day 7 and day 14. Participants also evaluated side effects (e.g., erythema, stinging or itching). Both treatments were comparable in terms of outcome measures for effectiveness and safety. By the end of the study 81% (13/16) of the participants in the VCO group showed improvement of at least one level in xerosis grading compared to 72% (13/18) of the mineral oil group1 (Level 1).
The second RCT2 compared VCO to virgin olive oil (VOO) for relieving xerosis and eliminating Staphylococcus aureus from skin in adults with atopic dermatitis (n=52). One group was treated with VCO and the other with VOO, with oils massaged gently into the skin twice daily at two skin sites displaying no clinical signs of infection. Outcome measures were skin cultures, photography and the objective component of the SCORAD severity index (O-SSI). Assessment occurred at baseline and at 4 weeks. At 4 weeks, the VCO group improved more significantly on the O-SSI compared to the VOO group (p=0.004)2. Of the VCO group, 77% (20/26) were positive for S. aureus on entry to the study compared 46% (12/26) in the VOO group. Following treatment, only 5% (1/12) of the VCO group remained positive versus 50% (6/12) of the VOO group. The relative risk for VCO was 0.1 compared to 10.1 for VOO (p=0.00; 95% confidence interval [CI], 0.01–0.73, number needed to treat [NNT]=2.2) (Level 1).
Psoriasis in adults
Two studies provided evidence on the use of coconut oil for treating psoriasis. In an RCT (n=40)3, adults with scalp psoriasis were randomised into three groups to assess the effectiveness of relatively bland emollients: 5% coal tar solution plus coconut oil (1:1); 10% urea, 10% lactic acid, 10% propylene glycol plus 10% liquid paraffin (in a cream base); and VCO alone. All three groups showed comparable significant improvement over time, showing 57%, 64.4% and 58.3% clearing of symptoms respectively (p<0.01) without adverse effects. The authors noted that topical corticosteroids have demonstrated substantially higher response and clearance rates than this study found3 (Level 1).
An observational study (n=31)12 explored the use of VCO applied twice daily for 8 weeks to psoriasis lesions in adults. Erythema, scaling and plaque elevation were evaluated every second week using photography and a clinical assessment of symptom clearance. At the completion of the study 16% of participants (5/31) had complete clearance. Scaling was observed to be most reduced in the 4–6-week period of treatment, while erythema and plaque elevation were most improved in the 6–8-week period. No adverse effects were experienced12 (Level 3).
Dermatitis in children
One RCT4 (n=117) compared the effectiveness of topical VCO to that of topical mineral oil for children (aged between 1–13 years) with mild-to-moderate atopic dermatitis. For both treatment groups, 5ml of oil was applied twice daily. Impact on epidermal function was measured using a clinical assessment tool (SSI) and by measuring TEWL and skin capacitance, all measured at baseline and 2, 4 and 8 weeks. On the SSI measure the VCO was significantly more effective than the mineral oil (mean reduction in symptoms 68.23% versus 38.13%, p<0.001). The VCO also produced significantly effective results in terms of the TEWL over the 8-week period compared to the mineral oil group (decrease in TEWL 70.7% versus 35.36%). In terms of the emollient effect of the two oils, a statistically significant difference between the two became apparent at 8 weeks of treatment (p=0.03). No adverse effects were reported in the VCO group, while five children in the mineral oil group required “rescue” treatment with topical corticosteroids4 (Level 1).
Treatment of immature skin in preterm neonates
Two non-blinded RCTs5,6 investigated application of VCO to preterm neonates to promote skin maturity. In both studies, skin maturity was assessed on days 7, 14 and 21 using the Neonatal Skin Condition Scale (NSCS) that includes evaluation of dryness, erythema and skin breakdown. In both studies, babies with existing skin conditions (e.g., infection or rash) were excluded5,6.
In the largest RCT (n=2,294)5, preterm neonates (<37 weeks) were randomised to a treatment group receiving 5ml VCO applied four times daily or to a control group receiving massage only (no topical treatment). Babies receiving VCO had statistically significantly better NSCS scores than the control group at days 7, 14, 21 and 28 (p<0.01) and were significantly less likely to experience a decrease in skin maturity (p<0.01) or hypothermia (p<0.01), without increase in adverse events including rash or accidental slippage of the baby. However, parents were significantly more likely to rate the intervention as cumbersome (2% versus 0.3%, p<0.001) (Level 1).
In the second RCT6, 72 preterm babies (n<30 weeks) received either no topical emollient (n=36) or 5ml/kg VCO applied twice daily over the body (excluding face, scalp and around medical devices). After 3 weeks of treatment, NSCS score declined for the babies in the control group but remained stable for those receiving VCO (p=0.01). There was no significant difference in adverse events including skin irritation or temperature instability6 (Level 1).
Due to methodological limitations of these studies, more evidence is required to recommend VCO for routine care of immature neonate skin. However, available research suggests that the practice is safe to explore5,6.
Table 2. Summary of clinical evidence for topical coconut products
Considerations for use
- When used as a skin moisturiser, VCO is applied to adults and children by rubbing directly on skin and/or lesions, usually twice daily1,2,4,12,22.
- Topical application of VCO for mild-to-moderate skin conditions is associated with a lower rate of adverse effects than topical corticosteroids4,12.
- To apply VCO to the immature skin of very preterm neonates, stroke the oil onto skin for 2–3 minutes without massage during routine care to avoid excessive handling6.
Conflict of Interest
The authors declare no conflicts of interest in accordance with International Committee of Medical Journal Editors (ICMJE) standards.
The method for development of WHAM (Wound Healing and Management unit at Curtin University, Perth) evidence summaries is consistent with methodology published in Munn Z, Lockwood C, Moola S. The development and use of evidence summaries for point of care information systems: a streamlined rapid review approach. Worldviews Evid Based Nurs 2015;12(3):131–8 and other resources on rapid evidence summaries published by the JBI as cited above. WHAM evidence summaries undergo peer-review by an international multidisciplinary Wound Expert Reference Group. WHAM evidence summaries provide a summary of the best available evidence on specific topics and make suggestions that can be used to inform clinical practice. Evidence contained within this summary should be evaluated by appropriately trained professionals with expertise in wound prevention and management, and the evidence should be considered in the context of the individual, the professional, the geographic and clinical setting and other relevant clinical information.
Funding
The authors received no funding for this evidence summary.
Copyright © 2021 Wound Healing and Management Unit, Curtin University.
![]()
Resumen de la evidencia de WHAM: efectividad de los productos tópicos de coco
Robin Watts, Teresa Solomon and Emily Haesler
DOI: https://doi.org/10.33235/wcet.41.2.32-35
Pregunta Clínica
¿Cuál es la mejor evidencia disponible sobre el uso de productos tópicos de coco en el manejo de heridas y en el tratamiento de afecciones cutáneas?
Resumen
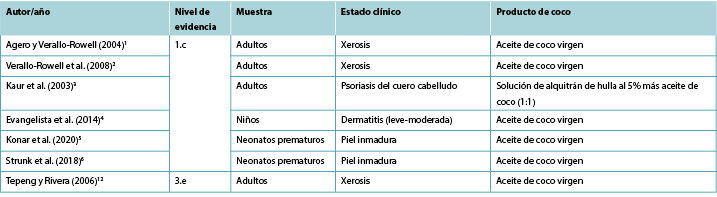
A pesar del amplio uso de los productos tópicos de coco con fines medicinales en las regiones geográficas tropicales, en esta revisión rápida sólo se ha identificado un número limitado de estudios clínicos que informen de su eficacia en el tratamiento de afecciones cutáneas y ningún estudio que informe de su uso en el tratamiento de heridas. Las pruebas de nivel 1 1,2 demostraron que el aceite de coco virgen (VCO) tópico se asocia a la mejora de los signos y síntomas de la xerosis1,2 y la psoriasis3 en adultos, y de la dermatitis leve a moderada en niños4. Hay algunas pruebas de que el VCO mejora las puntuaciones de inmadurez de la piel en los neonatos prematuros5,6. Actualmente no se dispone de pruebas sobre el uso de productos tópicos de coco para la curación de heridas en humanos.
Recomendaciones para la práctica clínica
Todas las recomendaciones deben aplicarse teniendo en cuenta la herida, la persona, el profesional sanitario y el contexto clínico.
- El VCO tópico podría considerarse para el tratamiento de la xerosis de leve a moderada (Grado B).
- El VCO tópico podría considerarse para el tratamiento de la psoriasis en ausencia de acceso a la terapia tópica con corticosteroides (Grado B).
- El VCO tópico podría considerarse para el tratamiento de la dermatitis atópica de leve a moderada en niños (Grado B).
Fuentes de evidencias
Este resumen se realizó utilizando los métodos publicados por el Instituto Joanna Briggs (JBI)7-11. El resumen se basa en una búsqueda bibliográfica sistemática que combina términos de búsqueda relacionados con heridas y afecciones cutáneas con términos relacionados con la palma de coco. Se realizaron búsquedas en las bases de datos Embase, Medline, Global Health y Allied and Complementary Medicine, así como en 10 revistas de atención sanitaria de países de ingresos bajos y medios, en busca de pruebas publicadas hasta mayo de 2021 en inglés. A los estudios se les asignó un nivel de evidencia (Tabla 1) basado en la jerarquía del JBI7-11. Las recomendaciones se basan en el conjunto de la evidencia y se clasifican de acuerdo con el sistema reportado por el JBI7-11.
Tabla 1. Niveles de evidencia

Antecedentes
Diversas partes del cocotero se utilizan desde hace miles de años en la medicina tradicional con múltiples fines, hasta el punto de que a menudo se denomina a la planta "árbol de la vida "16. Productos derivados de Cocos nucifera Linn: Las arecaacas incluyen el agua de coco, el aceite de la leche de coco o la copra (almendra seca), la cáscara de coco seca y la fibra de la cáscara17,18. El producto de coco más utilizado, el aceite de coco virgen (VCO), se extrae directamente de la pulpa del coco y contiene ácidos grasos de cadena media que tienen cualidades surfactantes1,19,20. Otro producto probado, el humo líquido de cáscara de coco (CS-LS), se produce quemando cáscaras de coco a 400˚C, lo que da lugar a una solución que surge de la condensación del vapor del humo de la madera14. La cáscara del coco contiene las mayores propiedades antioxidantes de todas las partes del coco14.
Las pruebas de laboratorio y los análisis bioquímicos de estos productos han identificado una serie de propiedades útiles: antiinflamatorias, antimicrobianas, antifúngicas, antioxidantes, antineoplásicas y analgésicas17,18,20-24. Cuando se aplica de forma tópica, el VCO proporciona una protección de barrera para el estrato córneo y reduce la pérdida de agua transepidérmica (TEWL), favoreciendo la hidratación de la piel19,20,24,25. Cuando se utilizan en las heridas, el VCO y otros productos derivados del coco promueven la síntesis de colágeno y una epitelización más rápida15,20,24.
Evidencia
Evidencia de estudios en animales
Las pruebas del efecto curativo del coco provienen de estudios en animales. Los resultados de tres estudios13-15 se ofrecen como ejemplo de la gran cantidad de trabajos de laboratorio sobre este tema. En el primer estudio13, realizado en la India, se aplicó VCO diariamente durante 10 días a heridas dérmicas abiertas en ratas. Había tres grupos de seis ratas cada uno: un grupo de control, un grupo tratado con 0,5 ml de VCO y un tercero tratado con 1 ml de VCO. El tiempo hasta la epitelización completa y la composición del tejido de granulación (por ejemplo, colágeno y fibroblastos) fueron algunas de las medidas de resultado. Tanto en términos de tiempo para completar la epitelización como de contenido total de colágeno, los grupos 2 y 3 fueron estadísticamente significativos en comparación con el control (p<0,05), 1ml fue más efectivo que 0,5ml13 (Nivel 5).
El segundo estudio14 se realizó en Indonesia para evaluar la actividad curativa del CS-LS para las quemaduras. Treinta y seis ratones fueron distribuidos aleatoriamente en tres grupos (n=12/grupo): CS-LS, solución salina normal al 0,9% (NaCl) y povidona yodada al 10%. Las heridas de las quemaduras se dejaron abiertas y se aplicó el tratamiento dos veces al día durante 25 días. La contracción de la herida se midió en los días 1, 5, 10 y 25 después de la inducción de la quemadura. El grupo CS-LS mostró la contracción más rápida de la herida de los tres grupos en el día 5 (p<0,001). En el día 10 hubo una diferencia estadísticamente significativa con el grupo de povidona yodada (p<0,001) y en el día 25 hubo una diferencia estadísticamente significativa con el grupo de NaCl (p<0,05)14 (Nivel 5).
En el tercer estudio15, se exploró el VCO para el tratamiento de las úlceras diabéticas con una población de ratas. Las ratas con úlceras se dividieron en cuatro grupos: no tratadas, ratas no diabéticas (n=18), ratas diabéticas no tratadas (n=18), ratas diabéticas que recibieron 1ml de VCO aplicado diariamente durante 14 días (n=18), y ratas diabéticas que recibieron crema de sulfadiazina de plata aplicada diariamente durante 14 días (n=18). Las tasas de cierre de la herida se midieron en los días 5, 10 y 14. Las úlceras diabéticas tratadas con VCO tuvieron tasas de cierre significativamente más rápidas desde el punto de vista estadístico (p<0,05) en comparación con las úlceras diabéticas que no recibieron tratamiento en todos los días. En los días 5 y 14 hubo una diferencia estadísticamente significativa entre los grupos de VCO y los grupos de crema de sulfadiazina de plata (p<0,05), favoreciendo VCO15 (Nivel 5).
Evidencia de estudios en humanos
Evidencia de la eficacia del tratamiento de las heridas
No se identificaron pruebas sobre productos tópicos de coco para su uso en el tratamiento de heridas humanas.
Evidencia de la eficacia del tratamiento de las afecciones cutáneas
Xerosis en adultos
Dos Ensayos aleatorios ciegos (RCTs)1,2 aportaron pruebas del uso del VCO para aliviar la xerosis (piel seca) en adultos. El primer RCT1 se llevó a cabo en 34 personas con xerosis de leve a moderada para determinar la eficacia y la seguridad del VCO en comparación con el aceite mineral cuando se utiliza como hidratante terapéutico. Las soluciones se aplicaron en las piernas dos veces al día durante 14 días. La hidratación de la piel y los lípidos de la piel se probaron para medir la eficacia, mientras que la TEWL y el pH de la piel fueron las medidas cuantitativas para la seguridad. La xerosis fue evaluada en cuanto a sequedad, descamación, aspereza y prurito tanto por un investigador mediante la clasificación de Wehr como por los participantes mediante una escala visual analógica. Los datos se recogieron al inicio, el día 7 y el día 14. Los participantes también evaluaron los efectos secundarios (por ejemplo, eritema, escozor o picor). Ambos tratamientos fueron comparables en cuanto a las medidas de resultado de eficacia y seguridad. Al final del estudio, el 81% (13/16) de los participantes del grupo de VCO mostraron una mejora de al menos un nivel en la clasificación de la xerosis, en comparación con el 72% (13/18) del grupo de aceite mineral1 (Nivel 1).
El segundo RCT2 comparó el VCO con el aceite de oliva virgen (VOO) para aliviar la xerosis y eliminar el Staphylococcus aureus de la piel en adultos con dermatitis atópica (n=52). Un grupo fue tratado con VCO y el otro con VOO, con aceites masajeados suavemente en la piel dos veces al día en dos sitios de la piel que no mostraban signos clínicos de infección. Las medidas de resultado fueron los cultivos de piel, la fotografía y el componente objetivo del índice de gravedad SCORAD (O-SSI). La evaluación se realizó al inicio y a las 4 semanas. A las 4 semanas, el grupo VCO mejoró más significativamente en el O-SSI en comparación con el grupo VOO (p=0,004)2. Del grupo VCO, el 77% (20/26) fueron positivos para S. aureus al entrar en el estudio, en comparación con el 46% (12/26) en el grupo VOO. Tras el tratamiento, sólo el 5% (1/12) del grupo VCO siguió siendo positivo frente al 50% (6/12) del grupo VOO. El riesgo relativo del VCO fue de 0,1 en comparación con el 10,1 de la VOO (p=0,00; intervalo de confianza [IC] del 95%, 0,01-0,73, número necesario para tratar [NNT]=2,2) (Nivel 1).
Psoriasis en adultos
Dos estudios aportaron pruebas sobre el uso del aceite de coco para el tratamiento de la psoriasis. En un RCT (n=40)3, los adultos con psoriasis del cuero cabelludo fueron distribuidos aleatoriamente en tres grupos para evaluar la eficacia de emolientes relativamente suaves: Solución de alquitrán de hulla al 5% más aceite de coco (1:1); 10% de urea, 10% de ácido láctico, 10% de propilenglicol más 10% de parafina líquida (en una base de crema); y VCO solo. Los tres grupos mostraron una mejora significativa comparable a lo largo del tiempo, mostrando un 57%, un 64,4% y un 58,3% de desaparición de los síntomas respectivamente (p<0,01) sin efectos adversos. Los autores señalaron que los corticosteroides tópicos han demostrado tasas de respuesta y de eliminación sustancialmente más altas que las encontradas en este estudio3 (Nivel 1).
Un estudio observacional (n=31)12 exploró el uso del VCO aplicada dos veces al día durante 8 semanas en lesiones de psoriasis en adultos. El eritema, la descamación y la elevación de la placa se evaluaron cada dos semanas mediante fotografías y una evaluación clínica de la desaparición de los síntomas. Al final del estudio, el 16% de los participantes (5/31) tenían una eliminación completa. Se observó que la descamación se redujo más en el periodo de 4-6 semanas de tratamiento, mientras que el eritema y la elevación de la placa mejoraron más en el periodo de 6-8 semanas. No se experimentaron efectos adversos12 (Nivel 3).
Dermatitis en niños
Un RCT4 (n=117) comparó la eficacia del VCO tópico con la del aceite mineral tópico en niños (de 1 a 13 años) con dermatitis atópica de leve a moderada. Para ambos grupos de tratamiento, se aplicaron 5 ml de aceite dos veces al día. El impacto en la función epidérmica se midió mediante una herramienta de evaluación clínica (SSI) y midiendo la TEWL y la capacitancia de la piel, todo ello medido al inicio y a las 2, 4 y 8 semanas. En la medida de la SSI, el VCO fue significativamente más eficaz que el aceite mineral (reducción media de los síntomas del 68,23% frente al 38,13%, p<0,001). El VCO también produjo resultados significativamente eficaces en términos de la TEWL durante el período de 8 semanas en comparación con el grupo de aceite mineral (disminución de TEWL 70,7% frente a 35,36%). En cuanto al efecto emoliente de los dos aceites, se puso de manifiesto una diferencia estadísticamente significativa entre ambos a las 8 semanas de tratamiento (p=0,03). No se notificaron efectos adversos en el grupo de VCO, mientras que cinco niños del grupo de aceite mineral requirieron un tratamiento de "rescate" con corticosteroides tópicos4 (Nivel 1).
Tratamiento de la piel inmadura en neonatos prematuros
Dos RCTs no cegados5,6 investigaron la aplicación de VCO a neonatos prematuros para promover la madurez de la piel. En ambos estudios, la madurez de la piel se evaluó en los días 7, 14 y 21 mediante la Escala de condición de la piel neonatal (NSCS) que incluye la evaluación de la sequedad, el eritema y la ruptura de la piel. En ambos estudios, se excluyeron los bebés con afecciones cutáneas existentes (por ejemplo, infecciones o erupciones)5,6.
En el mayor RCT (n=2,294)5, los neonatos prematuros (<37 semanas) fueron asignados aleatoriamente a un grupo de tratamiento que recibió 5 ml de VCO aplicados cuatro veces al día o a un grupo de control que sólo recibió masaje (sin tratamiento tópico). Los bebés que recibieron el VCO obtuvieron puntuaciones de NSCS significativamente mejores que el grupo de control en los días 7, 14, 21 y 28 (p<0,01) y fueron significativamente menos propensos a experimentar una disminución de la madurez de la piel (p<0,01) o hipotermia (p<0,01), sin que aumentaran los acontecimientos adversos, como el sarpullido o el deslizamiento accidental del bebé. Sin embargo, los padres fueron significativamente más propensos a calificar la intervención como engorrosa (2% frente a 0,3%, p<0,001) (Nivel 1).
En el segundo RCT6, 72 bebés prematuros (n<30 semanas) no recibieron ningún emoliente tópico (n=36) o 5ml/kg de VCO aplicado dos veces al día sobre el cuerpo (excluyendo la cara, el cuero cabelludo y alrededor de los dispositivos médicos). Después de 3 semanas de tratamiento, la puntuación NSCS disminuyó para los bebés del grupo de control, pero se mantuvo estable para los que recibieron VCO (p=0,01). No hubo diferencias significativas en los acontecimientos adversos, como la irritación de la piel o la inestabilidad de la temperatura6 (Nivel 1).
Debido a las limitaciones metodológicas de estos estudios, se necesitan más pruebas para recomendar el VCO para el cuidado rutinario de la piel de los neonatos inmaduros. Sin embargo, las investigaciones disponibles sugieren que la práctica es segura de explorar5,6.
Tabla 2. Resumen de la evidencia clínica de los productos tópicos de coco
Consideraciones de uso
- Cuando se utiliza como hidratante de la piel, el VCO se aplica a adultos y niños frotando directamente sobre la piel y/o las lesiones, normalmente dos veces al día1,2,4,12,22.
- La aplicación tópica del VCO para las afecciones cutáneas de leves a moderadas se asocia a una menor tasa de efectos adversos que los corticosteroides tópicos4,12.
- Para aplicar el VCO a la piel inmadura de los neonatos muy prematuros, acariciar el aceite sobre la piel durante 2 ó 3 minutos sin masajear durante los cuidados rutinarios para evitar una manipulación excesiva6.
Conflicto de Intereses
Los autores declaran no tener conflictos de intereses de acuerdo con las normas del Comité Internacional de Editores de Revistas Médicas (ICMJE).
El método para el desarrollo de los resúmenes de evidencia de WHAM (Unidad de Curación y Tratamiento de Heridas en Universidad de Curtin, Perth) es consistente con la metodología publicada en Munn Z, Lockwood C, Moola S. El desarrollo y uso de resúmenes de evidencia para los sistemas de información de los puntos de atención: un enfoque de revisión rápida racionalizado. Worldviews Evid Based Nurs 2015;12(3):131-8 y otros recursos sobre resúmenes rápidos de evidencia publicados por el JBI citados anteriormente. Los resúmenes de las pruebas de la WHAM se someten a la revisión de un grupo de referencia de expertos en heridas, de carácter multidisciplinar e internacional. Los resúmenes de evidencia de la WHAM proporcionan un resumen de la mejor evidencia disponible sobre temas específicos y hacen sugerencias que pueden ser utilizadas para informar la práctica clínica. La evidencia contenida en este resumen debe ser evaluada por profesionales debidamente formados y con experiencia en la prevención y el tratamiento de heridas, y la evidencia debe considerarse en el contexto del individuo, el profesional, el entorno geográfico y clínico y otra información clínica relevante.
Financiación
Los autores no recibieron financiación para este resumen de evidencia.
Copyright © 2021 Unidad de Curación y Tratamiento de Heridas, Universidad de Curtin.
![]()
Author(s)
Robin Watts AM, PhD, MHSc, BA, Dip NEd, FRCNA
Emeritus Professor, School of Nursing, Midwifery and Paramedicine, Wound Healing and Management (WHAM) unit, Curtin University, Perth, WA, Australia
Teresa Solomon BA, Grad Dip Lib Sc ALIA
Curtin University, Perth, WA, Australia
Emily Haesler* PhD, BN, P Grad Dip Adv Nurs, FWA
Adjunct Associate Professor, School of Nursing, Midwifery and Paramedicine, Wound Healing and Management (WHAM) unit, Curtin University, Perth, WA, Australia
Email Emily.haesler@curtin.edu.au
* Corresponding author
References
- Agero AL, Verallo-Rowell VM. A randomized double-blind controlled trial comparing extra virgin coconut oil with mineral oil as a moisturizer for mild to moderate xerosis. Dermatitis 2004;15(3):109–16.
- Verallo-Rowell VM, Dillague KM, Syah-Tjundawan BS. Novel antibacterial and emollient effects of coconut and virgin olive oils in adult atopic dermatitis. Dermatitis 2008;19(6):308–15.
- Kaur I, Saraswat A, Kumar B. A comparison of three therapeutic modalities in scalp psoriasis and a review of literature. Indian J Dermatol 2003;48.
- Evangelista MT, Abad-Casintahan F, Lopez-Villafuerte L. The effect of topical virgin coconut oil on SCORAD index, transepidermal water loss, and skin capacitance in mild to moderate pediatric atopic dermatitis: a randomized, double-blind, clinical trial. Int J Dermatol 2014;53(1):100–8.
- Konar MC, Islam K, Roy A, Ghosh T. Effect of virgin coconut oil application on the skin of preterm newborns: a randomized controlled trial. J Trop Pediatr 2020;66(2):129–35.
- Strunk T, Pupala S, Hibbert J, Doherty D, Patole S. Topical coconut oil in very preterm infants: an open-label randomised controlled trial. Neonatol 2018;113(2):146–51.
- Munn Z, Lockwood C, Moola S. The development and use of evidence summaries for point of care information systems: a streamlined rapid review approach. Worldviews Evid Based Nurs 2015;12(3):131–8. doi:10.1111/wvn.12094. PMID: 25996621.
- Aromataris E, Munn Z, editors. JBI manual for evidence synthesis. Joanna Briggs Institute; 2021. Available from: https://synthesismanual.jbi.global
- Joanna Briggs Institute (JBI) Levels of Evidence and Grades of Recommendation Working Party. New JBI grades of recommendation; 2013. Available from: https://jbi.global/sites/default/files/2019-05/JBI-grades-of-recommendation_2014.pdf
- Joanna Briggs Institute (JBI) Levels of Evidence and Grades of Recommendation Working Party. Supporting document for the Joanna Briggs Institute Levels of Evidence and Grades of Recommendation; 2014. Available from: https://jbi.global/sites/default/files/2019-05/JBI%20Levels%20of%20Evidence%20Supporting%20Documents-v2.pdf
- Joanna Briggs Institute (JBI) Levels of Evidence and Grades of Recommendation Working Party. JBI levels of evidence; 2013. Available from: https://jbi.global/sites/default/files/2019-05/JBI-Levels-of-evidence_2014_0.pdf
- Tepeng K, Rivera F. Virgin coconut oil for psoriasis. J Am Acad Dermatol 2006;54(3):AB210.
- Nevin KG, Rajamohan T. Effect of topical application of virgin coconut oil on skin components and antioxidant status during dermal wound healing in young rats. Skin Pharmacol Physiol 2010;23(6):290–7.
- Tarawan VM, Mantilidewi KI, Dhini IM, Radhiyanti PT, Sutedja E. Coconut shell liquid smoke promotes burn wound healing. J Evid Based Complement Altern Med 2017;22(3):436–40.
- Soliman AM, Lin TS, Ghafar NA, Das S. Virgin coconut oil and diabetic wound healing: histopathological and biochemical analysis. Eur J Anat 2018;22(2):135–44.
- DebMandalm M, Mandalm S. Coconut (Cocos nucifera L.: Arecaceae): in health promotion and disease prevention. Asian Pacific J Trop Med 2011;4(3):241–7.
- Dua K, Sheshala R, Ling T, Ling S, Gorajana A. Anti-inflammatory, antibacterial and analgesic potential of Cocos nucifera Linn.: a review. Med Chem (Los Angeles) 2013;12(2):158–64.
- Vaughn AR, Clark AK, Sivamani RK, Shi VY. Natural oils for skin-barrier repair: ancient compounds now backed by modern science. Am J Clin Dermatol 2018;19(1):103–17.
- Ayanlowo O, -Adeife OC, Ilomuanya M, Ebie C, Adegbulu A, Ezeanyache O, Odiase O, Ikebudu V, Akanbi B. African oils in dermatology. Dermatol Ther 2021 Apr 30:e14968. doi:10.1111/dth.14968. PMID: 33928725.
- Chew YL. The beneficial properties of virgin coconut oil in management of atopic dermatitis. Pharmacog Rev 2019;13(25):24–7.
- Lima E, Sousa C, Meneses L, Ximenes N, Santos Junior G, Vasconcelos G, Lima N, Patroninio M, Macedo D, Vasconcelos S. Cocos nucifera (L.) (Arecaceae): a phytochemical and pharmacological review. Braz J Med Biol Res 2015;48(11):953–64.
- Alves AQ, da Silva VA, Goes AJS, Silva MS, de Oliveira GG, Bastos IVGA, de Castro Neto AG, Alves AJ. The fatty acid composition of vegetable oils and their potential use in wound care. Adv Skin Wound Care 2019;32(8):1–8.
- Kh H, Kuttinath S, Rammohan R. First description of antibacterial and in vitro wound healing properties of Cocos nucifera tomentum. Asian J Pharm Clin Res 2019;12(5):118–22.
- Lin TK, Zhong L, Santiago JL. Anti-inflammatory and skin barrier repair effects of topical application of some plant oils. Int J Mol Sci 2018;19(1).
- Karagounis TK, Gittler JK, Rotemberg V, Morel KD. Use of “natural” oils for moisturization: review of olive, coconut, and sunflower seed oil. Pediatr Dermatol 2019;36(1):9–15.



