Volume 42 Number 1
Nursing care of severe hand foot syndrome caused by the oral anti-tumour drug Xeloda: a case study
Shuangshuang Zhang, Wenxing Zhao and Mengmeng Zhang
Keywords nursing, hand foot syndrome, Xeloda, biocellulose dressing
For referencing Zhang S, Zhao W and Zhang M. Nursing care of severe hand foot syndrome caused by the oral anti-tumour drug Xeloda: a case study. WCET® Journal 2022;42(1):29-33
DOI
https://doi.org/10.33235/wcet.42.1.29-33
Submitted 14 October 2021
Accepted 9 March 2021
Abstract
This case study summarises the nursing experience of a patient with grade III hand foot syndrome (HFS) caused by the oral anti-tumour drug Xeloda. The key points of nursing were a multi-disciplinary team consultation to make a clear diagnosis of grade III HFS, effectively control infection, apply a biocellulose dressing, and promote granulation growth and epidermal cell regeneration on the premise that the anti-tumour drug Xeloda cannot be reduced or stopped. After 98 days of comprehensive nursing intervention the wound healed completely; 6 months later, the ulcer did not reoccur.
Introduction
This case study will summarise the nursing experience of caring for a patient with grade III hand foot syndrome (HFS) caused by the oral anti-tumour drug Xeloda (Capecitabine). The key points of nursing care are the importance of a multi-disciplinary team (MDT) consultation process to provide a definitive diagnosis of a grade III HFS, effectively control infection and apply a biocellulose dressing to the wound to promote the growth of granulation tissue and epidermal cell regeneration on the premise that the anti-tumour drug Xeloda could not be reduced or stopped. After 98 days of comprehensive nursing interventions, the wound had healed completely; 6 months later, the ulcer had not re-occurred.
HFS is also known as palmar-plantar erythrodysesthesia, syndrome, acral erythema and Burgdorf’s syndrome. It is an adverse dermatologic skin reaction that may occur in patients with malignant tumours during treatments with systemic chemotherapy or molecular targeted therapy1–3. Localised tissue injury occurs as a result of a toxic reaction caused by drug accumulation from damage to the eccrine gland system. Further, the drugs used are excreted in sweat in the terminal limb capillaries of the palms of the hand and soles of the feet, making these areas more susceptible to HFS. The vascularity of and increased pressures and skin temperature of the hands and feet may exacerbate this effect2,4. While HFS is not life-threatening, it may severely impact a person’s quality of life, especially older people3. The clinical manifestations of HFS are palmoplantar numbness, insensitivity, a tingling sensation, rapid skin swelling or erythema, desquamation, skin cracking or blisters (usually advanced stage) or severe pain3,5. The palms of the hands are usually affected first. There may be progressive aggravations of any skin lesions.
It is important the HFS is not mistaken for hand-foot skin reaction (HFSR) arising from the use of multikinase or BRAF inhibitors. Skin reactions from the use of these groups of drugs manifest as yellowish, painful hyperkeratotic plaques on the heels, fingertips, within interdigital web spaces and over joints3.
According to National Cancer Institute (NCI)6, HFS is divided into three grades: grade I is dermatitis with skin changes (such as fingerprint disappearance, pigmentation, erythema, skin numbness, insensitivity, paresthesia, desquamation, etc.) with or without pain; grade II is skin change or dermatitis, with pain but without dysfunction; grade III is skin change or dermatitis (such as skin wet desquamation, ulcer, blister), severe pain and dysfunction. Grade III severe ulcers are rare. The pathological manifestations of grade III ulcers are vacuolar degeneration (liquefaction) of basal keratinocytes, infiltration of lymphocytes around skin vessels, apoptosis of keratinocytes and skin oedema7. The Xeloda antithetical couplet named capecitabine tablets, the new generation of oral fluorouracil broad spectrum anti-tumour drugs8, is used for the treatment of advanced breast cancer patients after chemotherapy; tumour cells can be intentionally killed if Xeloda is used independently. Xeloda can also be used in conjunction with other chemotherapy agents9. Further, Xeloda is usually taken orally BD after food and in cases of metastatic breast cancer Xeloda is used for maintenance therapy as long as it remains effective. Adverse reactions to Xeloda mainly include HFS, nausea, diarrhoea and neutropenia. The incidence of HFS is the highest among the adverse reactions to Xeloda, reaching 45–68%8. Furthermore, 20–50% of the patients who used Xeloda were forced to reduce the dosage or even discontinue treatment due to HFS10,11.
On 26 May 2020, a patient with severe grade III HFS caused by oral Xeloda was admitted to our hospital’s specialist nursing clinic of wound ostomy incontinence. Without stopping the drug, the wound was completely healed in 98 days after comprehensive nursing and medical intervention. The nursing methods are reported as follows.
Case Presentation
Background
A 65-year-old female patient, Ms Li, presented with a history of desquamation and skin peeling of the palms of both hands and the soles of both feet, inflamed dermatitis and occasional blisters for 3 years, and an ulcer on the right heel for 2 months. Her skin conditions and wounds were not healed by moist wound healing methods in two grade III, class A hospitals in the province.
Her past medical history included being diagnosed 13 years ago with breast cancer. Further, axillary lymph node metastasis and bilateral lung metastasis occurred 4 years ago. After six courses of chemotherapy, Xeloda 1.5g BID was taken orally as targeted therapy, and the disease did not progress. After oral administration of Xeloda for 2 weeks, grade I and II HFS appeared, such as dry hands and feet and desquamation.
Systemic evaluation
A systemic evaluation of Ms Li included the following reviews:
- Laboratory examinations undertaken within the last 6 months showed:
- CEA (carcinoembryonic antigen) marker was 5.53–12ng/ml (normal: 0-5).
- Ca (Cancer antigen)-153: 20.04–28.45u/ml (normal: 0–25).
- Pain assessment. Numeric Rating Scale (NRS) score: 8 points (0 represents no pain and 10 represents the worst pain imaginable).
- Mobility: unable to walk affecting normal life, e.g. family members were required to use a wheelchair to push Ms Li to the clinic for dressing changes.
- Nutritional status: average; BMI 19.9kg/m2.
- Psychological status: anxiety and fear were exhibited.
- Local lower limb:
- The dorsalis pedis artery and posterior tibial artery had good pulsation after hand felt without formal assessment with equipment.
- No prior history of lower extremity arteriovenous disease.
- Wound assessment:
- Wound location: the right heel.
- Wound measurement: the size of the wound bed was 5x5cm.
- Wound bed: the wound bed was covered with 100% yellow sloughy non-viable tissue.
- Wound exudate: there was a medium amount of exudate that was purulent and had a slight odour.
- Wound edge: a black hard scab was evident and circumferential around the wound bed.
- The peri-wound skin was dry and a large portion of dry epidermis was peeled away during wound cleansing (Figure 1).
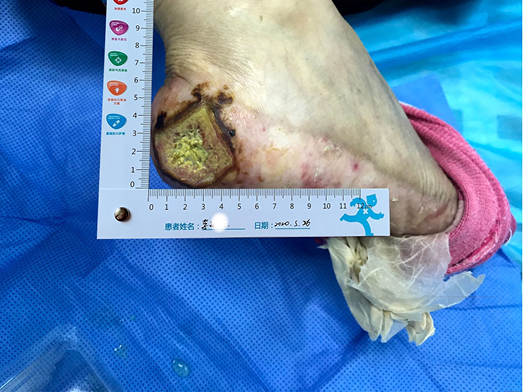
Figure 1. The wound on presentation
Multidiscipinary team and nursing care plan
From a nursing perspective there were a number of difficulties encountered and challenges to be overcome. These included:
- Assessing and managing a chronic non-healing wound. The wound was not healed after 2 months of moist healing treatment in two other grade III, class A hospitals in the province.
- Identifying the cause and type of wound. Was this a cancerous wound, pyoderma gangrenosum or HFS with an accompanying severe ulcer? There was no clear pathology or definitive diagnosis.
- Oral Xeloda therapy can affect wound healing. This raised the question of whether oral Xeloda could be reduced or stopped.
Due to the above nursing assessment and nursing difficulties, a multidisciplinary team (MDT) consultation, including the general surgeon, oncologist and wound care nurse, was quickly convened. Representatives from the relevant departments of the hospital were invited to formulate a diagnosis and treatment plan. The general surgery department suggested that pathology and bacterial culture should be undertaken. The results showed there were dense perivascular and interstitial neutrophilic infiltration of the tissue. However, there were no signs of vasculitis or malignant tumour. The bacteria cultured were identified as Proteus. The diagnosis of grade III HFS with rare severe ulcer was confirmed. Post oncology consultation, the oncologist’s opinion was that, considering the recurrence of breast cancer after 4 years, double lung metastasis as well as multiple unstable tumour markers, oral Xeloda could not be reduced or stopped.
Wound management: initial strategies
The initial goals of wound management were to control infection, promote autolysis of and debride non-viable tissue when required, and to relieve pain. The principles of TIME (Tissue, Infection, Moisture, Exudate) were used to guide local wound management and manage the characteristics of the wound described above. Normal saline and gauze was used to clean and mechanically debride the wound bed. Considering the moderate amount of wound exudate, and dry skin at the edge and around the wound, a sulfadiazine silver lipid hydrocolloid dressing was selected as the primary contact layer to control infection and keep the wound moist. The function of this dressing is to reduce the bacterial burden within the wound and control infection, assist with autolysis and debridement, and reduce pain during dressing changes12. The skin around the wound was dry and partly desquamated. In order to prevent avulsion, a soft silicone foam dressing was used as the secondary or external dressing, which also absorbed the exudate vertically and protected the fragile peri-wound skin.
Evaluation
Initial wound management strategies
After using the sulfadiazine silver lipid hydrocolloid dressing from 26 May to 4 June, the localised infection was controlled. Autolysis of non-viable tissue via the dressing product in conjunction with mechanical debridement had occurred, leaving the wound bed with 100% granulation tissue. The wound edge retained a little dip and within the peri-wound skin part of the epidermis was still exfoliated (Figure 2). The amount of wound exudate remained moderate but the odour had disappeared. Dressing pain was reduced. The size of the wound bed was reduced from 5x5cm to 4.5x4.5cm (Figures 3 & 4). The NRS score was reduced to 6 points, and the patient could be helped by her family to come to the clinic for dressing changes.
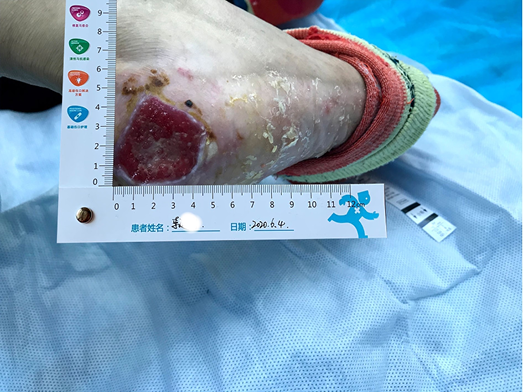
Figure 2. Autolysis of non-viable tissue revealing granulation tissue
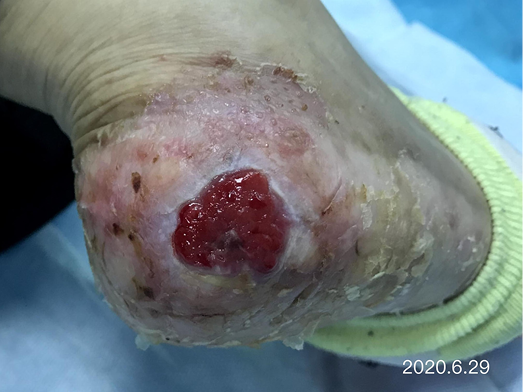
Figure 3. Continued wound healing
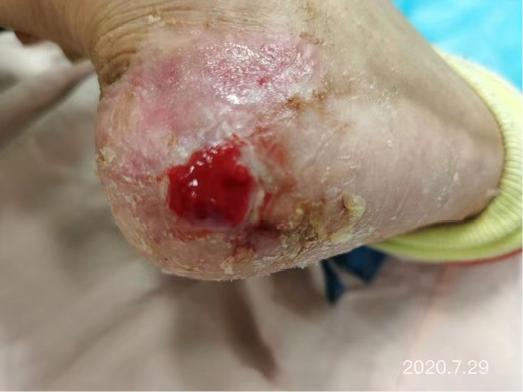
Figure 4. Continued wound healing
Secondary wound management strategies
After the wound infection was controlled and non-viable tissue was removed from the wound bed, the sulfadiazine silver lipid hydrocolloid was stopped and the treatment plan was changed. After considering the delays in wound healing that had occurred over a 2-month period within other hospitals plus our hospital, consideration was given as to what other auxiliary wound management products could be used to promote granulation tissue and epidermal cell regeneration to facilitate wound closure of this chronic wound. Therefore, to guide selection of another primary dressing, the MDT considered the factors under ‘S’ in the acronym MOIST. MOIST was developed as an adjunct to TIME to cater for the development of new wound technologies. MOIST refers to ‘M’ Moisture balance; ‘O’ Oxygen balance; ‘I’ Infection control; ‘S’ Support and ‘T’ Tissue management13. The S refers to modification of the wound environment e.g. inflammatory mediators, pH levels and growth factors. Consequently, a biocellulose wound dressing (Nanoderm® from China Shandong Nameide Biotechnology) was selected. This is a natural biomaterial which is safe and non-stimulating for tumour growth within cancer patients and can effectively promote granulation tissue and epidermal cell regeneration. A soft silicone foam dressing was chosen for the secondary/external dressing.
After dressing changes every 3–4 days, the granulation tissue increased and the size of the wound gradually reduced. By 11 August, the wound had narrowed to 1.5x1.5cm and entered the epithelialisation stage (Figure 5). The primary biocellulose wound dressing was discontinued. The skin around the wound was fragile and so the soft silicone foam dressing was still used. At this time, the NRS score was 2, and the patient could come to the hospital for dressing changes. After almost 3 months’ treatment, the wound had healed completely on 31 August (Figure 6). At follow-up 6 months later, the patient’s ulcer had not re-ocurred. In order to express her gratitude, the patient specifically came to the clinic and said that she had recovered her state of health to that of 4 years ago and had returned to a normal life that included square dancing.
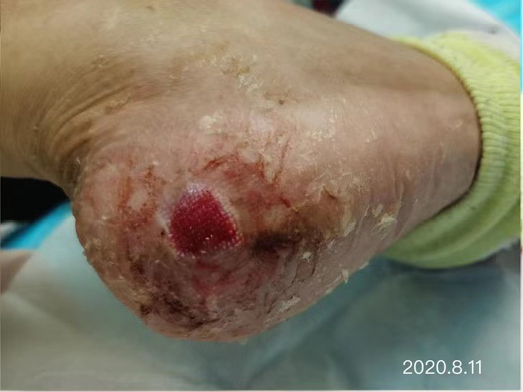
Figure 5. The epithelialisation stage
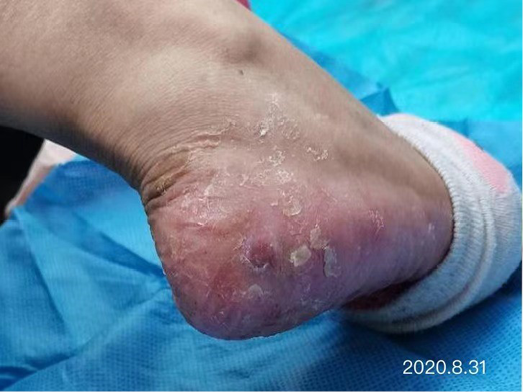
Figure 6. Final stages of healing
Discussion
Many articles were searched for the best evidence to assist with the management of this case. In terms of systemic therapy, Xeloda-targeted therapy combined with high-dose vitamin B6 (300mg/d) and Vit E cream for both hands and feet can reduce the severity of HFS14. Nearly half of the patients treated thought that HFS is the most serious side effect of chemotherapy received, which has a serious impact on the confidence and compliance of treatment. It is important to provide patients who will receive Xeloda therapy relevant knowledge of the benefits and side effects of the treatment and health guidance to manage any adverse effects. Having sufficient psychological preparation may assist patients to overcome the underlying disease and any treatment related side effects. The effective management of chronic wounds is enhanced through a MTD approach to determine the cause of the wound and factors that may complicate wound healing, and to determine evidence-based wound management strategies to facilitate wound healing and improve patients’ quality of life15.
Summary
HFS with severe skin ulcers is very rare. When Xeloda is unable to be reduced or stopped, the wound is difficult to heal. This presents great challenges to wound specialist nurses in determining wound management strategies. In this case, through MDT consultation and wound specialist nurse evaluation of the patient, the wound and systemic treatments, the wound infection was controlled using a sulfadiazine silver lipid hydrocolloid dressing, and a biocellulose dressing was applied to effectively promote granulation tissue and epidermal cell regeneration. In this case the treatment of primary disease was not affected, the patient’s pain was minimised, and wound healing realised.
Cuidados de enfermería del síndrome mano-pie grave causado por el fármaco antitumoral oral Xeloda: un estudio de caso
Shuangshuang Zhang, Wenxing Zhao and Mengmeng Zhang
DOI: https://doi.org/10.33235/wcet.42.1.29-33
Resumen
Este estudio de caso resume la experiencia de enfermería de un paciente con síndrome mano-pie (HFS) de grado III causado por el fármaco antitumoral oral Xeloda. Los puntos clave de la enfermería fueron una consulta del equipo multidisciplinar para hacer un diagnóstico claro de HFS de grado III, controlar eficazmente la infección, aplicar un apósito de biocelulosa y promover el crecimiento de la granulación y la regeneración de las células epidérmicas bajo la premisa de que el fármaco antitumoral Xeloda no puede reducirse ni suspenderse. Tras 98 días de intervención integral de enfermería, la herida se curó por completo; 6 meses después, la úlcera no volvió a aparecer.
Introducción
Este estudio de caso resumirá la experiencia de enfermería en el cuidado de un paciente con síndrome mano-pie (HFS) de grado III causado por el fármaco antitumoral oral Xeloda (Capecitabina). Los puntos clave de los cuidados de enfermería son la importancia de un proceso de consulta del equipo multidisciplinar (MDT) para proporcionar un diagnóstico definitivo de un HFS de grado III, controlar eficazmente la infección y aplicar un apósito de biocelulosa a la herida para promover el crecimiento del tejido de granulación y la regeneración de las células epidérmicas bajo la premisa de que el fármaco antitumoral Xeloda no podía reducirse o suspenderse. Tras 98 días de exhaustivas intervenciones de enfermería, la herida se había curado por completo; 6 meses después, la úlcera no había vuelto a aparecer.
El HFS también se conoce como eritrodisestesia palmar-plantar, síndrome, eritema acral y síndrome de Burgdorf. Es una reacción dermatológica adversa de la piel que puede ocurrir en pacientes con tumores malignos durante los tratamientos con quimioterapia sistémica o terapia molecular dirigida1–3. La lesión tisular localizada se produce como resultado de una reacción tóxica causada por la acumulación del fármaco a partir del daño al sistema de glándulas ecrinas. Además, los fármacos utilizados se excretan en el sudor en los capilares de las extremidades terminales de las palmas de las manos y las plantas de los pies, lo que hace que estas zonas sean más susceptibles de sufrir HFS. La vascularidad y el aumento de la presión y la temperatura de la piel de las manos y los pies pueden exacerbar este efecto2,4. Si bien el HFS no pone en peligro la vida, puede afectar gravemente a la calidad de vida de una persona, especialmente de las personas mayores3. Las manifestaciones clínicas del HFS son el entumecimiento palmoplantar, la insensibilidad, la sensación de hormigueo, la rápida hinchazón o eritema de la piel, la descamación, el agrietamiento de la piel o las ampollas (normalmente en fase avanzada) o el dolor intenso3,5. Las palmas de las manos suelen ser las primeras afectadas. Pueden producirse agravaciones progresivas de cualquier lesión cutánea.
Es importante que el HFS no se confunda con la reacción cutánea mano-pie (HFSR) derivada del uso de inhibidores multicinasa o BRAF. Las reacciones cutáneas derivadas del uso de estos grupos de fármacos se manifiestan en forma de placas hiperqueratósicas amarillentas y dolorosas en los talones, las yemas de los dedos, dentro de los espacios interdigitales y sobre las articulaciones3.
Según el Instituto Nacional del Cáncer (NCI)6, el HFS se divide en tres grados: el grado I es la dermatitis con cambios en la piel (como desaparición de la huella dactilar, pigmentación, eritema, entumecimiento de la piel, insensibilidad, parestesia, descamación, etc.) con o sin dolor; el grado II es el cambio en la piel o la dermatitis, con dolor pero sin disfunción; el grado III es el cambio en la piel o la dermatitis (como descamación húmeda de la piel, úlcera, ampolla), dolor intenso y disfunción. Las úlceras graves de grado III son raras. Las manifestaciones patológicas de las úlceras de grado III son la degeneración vacuolar (licuefacción) de los queratinocitos basales, la infiltración de linfocitos alrededor de los vasos cutáneos, la apoptosis de los queratinocitos y el edema cutáneo7. La pareja antitumoral Xeloda, denominada capecitabina en comprimidos, es la nueva generación de fármacos antitumorales orales con fluorouracilo de amplio espectro8, se utiliza para el tratamiento de pacientes con cáncer de mama avanzado después de la quimioterapia; las células tumorales pueden ser eliminadas intencionadamente si se utiliza Xeloda de forma independiente. Xeloda también puede utilizarse junto con otros agentes quimioterapéuticos9. Además, Xeloda suele tomarse por vía oral después de la comida y, en los casos de cáncer de mama metastásico, se utiliza como terapia de mantenimiento mientras siga siendo eficaz. Las reacciones adversas a Xeloda incluyen principalmente HFS, náuseas, diarrea y neutropenia. La incidencia de HFS es la más alta entre las reacciones adversas a Xeloda, alcanzando el 45-68%8. Además, entre el 20 y el 50% de los pacientes que utilizaron Xeloda se vieron obligados a reducir la dosis o incluso a interrumpir el tratamiento debido al HFS10,11.
El 26 de mayo de 2020, una paciente con HFS severa de grado III causado por Xeloda oral ingresó en la clínica de enfermería especializada de nuestro hospital por incontinencia de ostomía de la herida. Sin suspender el fármaco, la herida se curó completamente en 98 días tras una exhaustiva intervención médica y de enfermería. Los métodos de enfermería son los siguientes.
Presentación del caso
Antecedentes
Una paciente de 65 años, la Sra. Li, presentó una historia de descamación y descascarillado de la piel de las palmas de ambas manos y las plantas de ambos pies, dermatitis inflamada y ampollas ocasionales durante 3 años, y una úlcera en el talón derecho durante 2 meses. Las condiciones de su piel y sus heridas no se curaron con métodos de curación húmeda en dos hospitales de grado III, clase A, de la provincia.
Su historial médico incluye el diagnóstico de cáncer de mama hace 13 años. Además, hace 4 años se produjo una metástasis en los ganglios linfáticos axilares y una metástasis pulmonar bilateral. Tras seis ciclos de quimioterapia, tomó Xeloda 1,5g BID por vía oral como terapia dirigida, y la enfermedad no progresó. Tras la administración oral de Xeloda durante 2 semanas, aparecieron HFS de grado I y II, tales como manos y pies secos y descamación.
Evaluación sistémica
Una evaluación sistémica de la Sra. Li incluyó las siguientes revisiones:
- Los exámenes de laboratorio realizados en los últimos 6 meses mostraron:
- El marcador CEA (antígeno carcinoembrionario) era de 5,53-12ng/ml (normal: 0-5).
- Ca (antígeno del cáncer)-153: 20,04-28,45u/ml (normal: 0-25).
- Evaluación del dolor. Puntuación de la Escala de Calificación Numérica (NRS): 8 puntos (0 representa que no hay dolor y 10 representa el peor dolor imaginable).
- Movilidad: incapacidad para caminar que afecta a la vida normal, por ejemplo, los miembros de la familia tuvieron que utilizar una silla de ruedas para empujar a la Sra. Li a la clínica para los cambios de vendas.
- Estado nutricional: medio; IMC 19,9kg/m2.
- Estado psicológico : se exhibió ansiedad y miedo.
Miembro inferior local:
- La arteria dorsalis pedis y la arteria tibial posterior presentaban una buena pulsación tras la palpación de la mano sin una evaluación formal con equipos.
- No hay antecedentes de enfermedad arteriovenosa de las extremidades inferiores.
- Evaluación de las heridas:
- Ubicación de la herida : el talón derecho.
- Medición de la herida: el tamaño del lecho de la herida era de 5x5cm.
- Lecho de la herida: el lecho de la herida estaba cubierto por un 100% de tejido amarillo no viable.
- Exudado de la herida: había una cantidad media de exudado que era purulento y tenía un ligero olor.
- Borde de la herida: una costra negra y dura era evidente y circunferencial alrededor del lecho de la herida.
- La piel peri-herida estaba seca y una gran parte de la epidermis seca se desprendió durante la limpieza de la herida (Figura 1).

Figura 1. La herida en la presentación
Equipo multidisciplinar y plan de cuidados de enfermería
Desde el punto de vista de la enfermería, hubo una serie de dificultades y retos que superar. Entre ellos se encuentran:
- Evaluación y tratamiento de una herida crónica que no cicatriza. La herida no se curó después de 2 meses de tratamiento de curación húmeda en otros dos hospitales de grado III, clase A, de la provincia.
- Identificar la causa y el tipo de herida. ¿Era una herida cancerosa, un pioderma gangrenoso o un HFS con una úlcera grave? No había una patología clara ni un diagnóstico definitivo.
- El tratamiento con Xeloda oral puede afectar a la curación de las heridas. Esto planteó la cuestión de si Xeloda oral podía reducirse o suspenderse.
Debido a la evaluación de enfermería mencionada y a las dificultades de enfermería, se convocó rápidamente una consulta del equipo multidisciplinar (MDT), que incluía al cirujano general, al oncólogo y al enfermero de atención a las heridas. Se invitó a representantes de los departamentos pertinentes del hospital a formular un diagnóstico y un plan de tratamiento. El departamento de cirugía general sugirió que se realizara una patología y un cultivo bacteriano. Los resultados mostraron que había una densa infiltración neutrofílica perivascular e intersticial en el tejido. Sin embargo, no había signos de vasculitis o tumor maligno. Las bacterias cultivadas fueron identificadas como Proteus. Se confirmó el diagnóstico de HFS de grado III con úlcera grave poco frecuente. Tras la consulta de oncología, la opinión del oncólogo fue que, teniendo en cuenta la reaparición del cáncer de mama después de 4 años, la doble metástasis pulmonar, así como los múltiples marcadores tumorales inestables, no se podía reducir o suspender el Xeloda oral.
Tratamiento de las heridas: estrategias iniciales
Los objetivos iniciales del tratamiento de la herida eran controlar la infección, promover la autolisis y desbridar el tejido no viable cuando fuera necesario, y aliviar el dolor. Se utilizaron los principios de TIME (Tejido, Infección, Humedad, Exudado) para guiar el tratamiento local de la herida y gestionar las características de ésta descritas anteriormente. Se utilizó solución salina normal y gasas para limpiar y desbridar mecánicamente el lecho de la herida. Teniendo en cuenta la cantidad moderada de exudado de la herida y la sequedad de la piel en el borde y alrededor de la herida, se seleccionó un apósito hidrocoloide lipídico de plata con sulfadiazina como capa de contacto principal para controlar la infección y mantener la herida húmeda. La función de este apósito es reducir la carga bacteriana dentro de la herida y controlar la infección, ayudar a la autolisis y al desbridamiento, y reducir el dolor durante los cambios de apósito12. La piel alrededor de la herida estaba seca y parcialmente descamada. Para evitar la avulsión, se utilizó un apósito de espuma de silicona suave como apósito secundario o externo, que también absorbía el exudado verticalmente y protegía la frágil piel peri-herida.
Evaluación
Estrategias de tratamiento inicial de las heridas
Después de utilizar el apósito hidrocoloide lipídico de plata con sulfadiazina desde el 26 de mayo hasta el 4 de junio, se controló la infección localizada. Se había producido la autolisis del tejido no viable a través del producto del apósito junto con el desbridamiento mecánico, dejando el lecho de la herida con un 100% de tejido de granulación. El borde de la herida conservaba un pequeño hundimiento y dentro de la piel peri-herida parte de la epidermis seguía exfoliada (Figura 2). La cantidad de exudado de la herida seguía siendo moderada, pero el olor había desaparecido. Se redujo el dolor del vendaje. El tamaño del lecho de la herida se redujo de 5x5cm a 4,5x4,5cm (Figuras 3 y 4). La puntuación de la NRS se redujo a 6 puntos, y la paciente pudo ser ayudada por su familia a acudir a la clínica para los cambios de apósito.

Figura 2. Autolisis del tejido no viable que revela el tejido de granulación

Figura 3. Continuación de la curación de heridas

Figura 4. Continuación de la curación de heridas
Estrategias de tratamiento de heridas secundarias
Una vez controlada la infección de la herida y eliminado el tejido no viable del lecho de la herida, se suspendió el hidrocoloide lipídico de plata con sulfadiazina y se cambió el plan de tratamiento. Tras considerar los retrasos en la curación de heridas que se habían producido durante un periodo de 2 meses en otros hospitales además de en el nuestro, se consideró qué otros productos auxiliares para el tratamiento de la herida podrían utilizarse para promover la regeneración del tejido de granulación y de las células epidérmicas para facilitar el cierre de esta herida crónica. Por lo tanto, para guiar la selección de otro apósito primario, el MDT consideró los factores bajo la "S" en el acrónimo MOIST. MOIST se desarrolló como complemento de TIME para atender el desarrollo de nuevas tecnologías para heridas. MOIST hace referencia a la "M" de equilibrio de humedad; la "O" de equilibrio de oxígeno; la "I" de control de infecciones; la "S" de apoyo y la "T" de gestión de tejidos13. La S se refiere a la modificación del entorno de la herida, por ejemplo, los mediadores inflamatorios, los niveles de pH y los factores de crecimiento. En consecuencia, se seleccionó un apósito de biocelulosa para heridas (Nanoderm® de China Shandong Nameide Biotechnology). Se trata de un biomaterial natural que es seguro y no estimula el crecimiento de los tumores en los pacientes con cáncer y puede promover eficazmente la regeneración del tejido de granulación y de las células epidérmicas. Se eligió un apósito de espuma de silicona suave para el apósito secundario/externo.
Tras los cambios de apósito cada 3-4 días, el tejido de granulación aumentó y el tamaño de la herida se redujo gradualmente. El 11 de agosto, la herida se había reducido a 1,5x1,5 cm y había entrado en la fase de epitelización (Figura 5). El apósito primario de biocelulosa se suspendió. La piel alrededor de la herida era frágil, por lo que se siguió utilizando el apósito de espuma de silicona suave. En ese momento, la puntuación de la NRS era de 2, y la paciente podía acudir al hospital para los cambios de apósito. Tras casi 3 meses de tratamiento, la herida había cicatrizado completamente el 31 de agosto (Figura 6). En el seguimiento realizado 6 meses después, la úlcera de la paciente no había reaparecido. Para expresar su gratitud, la paciente acudió expresamente a la clínica y dijo que había recuperado su estado de salud al de hace 4 años y había vuelto a hacer una vida normal que incluía el baile en la plaza.

Figura 5. La etapa de epitelización

Figura 6. Etapas finales de la curación
Discusión
Se buscaron muchos artículos para encontrar la mejor evidencia para ayudar en el manejo de este caso. En cuanto a la terapia sistémica, la terapia dirigida con Xeloda, combinada con altas dosis de vitamina B6 (300 mg/día) y crema de vitamina E para las manos y los pies, puede reducir la gravedad del HFS14. Casi la mitad de los pacientes tratados consideraron que el HFS es el efecto secundario más grave de la quimioterapia recibida, lo que tiene un grave impacto en la confianza y el cumplimiento del tratamiento. Es importante proporcionar a los pacientes que van a recibir el tratamiento con Xeloda los conocimientos pertinentes sobre los beneficios y los efectos secundarios del tratamiento, así como orientaciones sanitarias para manejar cualquier efecto adverso. Tener una preparación psicológica suficiente puede ayudar a los pacientes a superar la enfermedad subyacente y cualquier efecto secundario relacionado con el tratamiento. El tratamiento eficaz de las heridas crónicas se ve reforzado por un enfoque de MTD para determinar la causa de la herida y los factores que pueden complicar la curación de ésta, y para determinar estrategias de tratamiento de heridas basadas en la evidencia para facilitar la curación de heridas y mejorar la calidad de vida de los pacientes15.
Resumen
El HFS con úlceras cutáneas graves es muy raro. Cuando Xeloda no se puede reducir o detener, la herida es difícil de curar. Esto supone un gran reto para los enfermeros especializados en heridas a la hora de determinar las estrategias de tratamiento de las mismas. En este caso, a través de la consulta del MDT y la evaluación del enfermero especialista en heridas del paciente, la herida y los tratamientos sistémicos, se controló la infección de la herida utilizando un apósito hidrocoloide lipídico con sulfadiazina y plata, y se aplicó un apósito de biocelulosa para promover eficazmente el tejido de granulación y la regeneración de las células epidérmicas. En este caso, el tratamiento de la enfermedad primaria no se vio afectado, el dolor del paciente se minimizó y la curación de heridas se realizó.
Author(s)
Shuangshuang Zhang MSN, ET
The First Affiliated Hospital of Shandong First Medical University, Shandong Province Qianfoshan Hospital, Jinan, Shandong, China
Wenxing Zhao* MSN, ET
Central Hospital Affiliated to Shandong First Medical University, Jinan Central Hospital Affiliated to Shandong University, Jinan, Shandong, China
Mengmeng Zhang MSN, ET
Central Hospital Affiliated to Shandong First Medical University, Jinan Central Hospital Affiliated to Shandong University, Jinan, Shandong, China
* Corresponding author
References
- Zhang YH, Shao CHY. Nursing experience of 26 cases of hand foot syndrome caused by anti-tumor treatment. Jilin Medical Science 2014;35(7):1568.
- Inokuchi M, Ishikawa I, Furukawa H et al. Treatment of capecetibane-induced hand-foot syndrome using a topical retinoid: a case report. Oncology Letters 2014;7(2):444–448.
- Kwakman JJM, Elshot YS, Punt CJA, Koopman M. Management of cytotoxic chemotherapy-induced hand-foot syndrome. Oncology Reviews 2020;14(1):57–63.
- Xu L, Xue M, Wang J, Zhang W. Analysis of risk factors of hand foot syndrome induced by apatinib mesylate and nursing countermeasures. Nursing Research 2019;33(23):4049–4054.
- Nikolaou V, Syrigos K, Saif MW. Incidence and implications of chemotherapy related hand-foot syndrome. Journal of Expert Opinions of Drug Safety 2016;15(12):1625–1633.
- Dong Y, Lu Z, Yang Y. Nursing research progress of hand foot syndrome caused by capecitabine. Nursing Research 2016;30(1):275–278.
- Janusch M,Fischer M, Marsch WC, et al. The hand-foot syndrome a frequent secondary manifestation in antineoplastic chemotherapy. European Journal of Dermatology 2006;16(5):494–499.
- Li X, Liu D, Wu D, Fan X, Zhang J. Research progress on the relationship between capecitabine related gene polymorphism and hand foot syndrome. Journal of Practical Oncology 2018;32(2):149–153.
- Liu SL, Yu ZY, Liu HF. Xeloda maintenance therapy in the treatment of advanced breast cancer. Chinese and Foreign Women Health 2020;7(13):68,91.
- Guo QH, Ma JL, Zhang J, et al. Clinical observation of hand foot syndrome caused by capecitabine and 5-fluorouracil. Journal of Chinese Medical Guide 2013;11(31):36–37.
- Gao J, He Q, Hua D, et al. Polymorphism of TS 3’ - UTR predicts survival of Chinese advanced gastric cancer patients receiving first-line capecitabine plus paclitaxel. Clinical and Translational Oncology 2013;15(8):619–625.
- Sood A, Granick MS, Tomaselli NL. Wound dressings and comparative effectiveness data. Advances in Wound Care 2014;(3):511–529.
- Dissemond J, Assenheimer B, Engels B et al. Clinical letter, MOIST. Journal of the German Society of Dermatology 2017;(4):443–445.
- Chen Z, Zhou S, Xu S, Ding P, Zhang H. Clinical observation of hand foot soaking formula in the prevention and treatment of capecitabine related hand foot syndrome. China Science and Technology of Traditional Chinese Medicine 2016;23(3):329–330.
- Lei J, Sun L, Li P, Zhu C, Lin Z, et al. The wound dressings and their applications in wound healing and management. Health Science Journal 2019;13(4):662–668.



