Volume 42 Number 3
Pressure injury management in critically ill patients with COVID-19 in a makeshift hospital in Indonesia: A report of two cases
Kezia Eveline, Hemma W Indirayani, Rachmaniar Pramanasari, Firas F Alkaff
Keywords pressure injury, COVID-19, Case report, ICU, Indonesia
For referencing Eveline K et al. Pressure injury management in critically ill patients with COVID-19 in a makeshift hospital in Indonesia: A report of two cases. WCET® Journal 2022;42(3):23-29
DOI
https://doi.org/10.33235/wcet.42.3.23-29
Submitted 9 January 2022
Accepted 15 March 2022
Abstract
Patients who are critically ill with COVID-19 need ventilation support in the ICU. However, ICU patients are at higher risk of developing a pressure injury (PI). Unfortunately, PI prevention is not optimally implemented in Indonesia, especially in the makeshift hospitals created during the COVID-19 pandemic.
Here, the authors report two cases of critically ill COVID-19 patients who developed large sacral PIs during hospitalisation in a makeshift hospital in Indonesia. The first patient developed a grade III, 7 cm × 7 cm sacral PI on the 14th day of hospitalisation. The second patient developed a grade IV, 12 cm × 8 cm sacral PI on the 16th day of hospitalisation. Both patients had elevated D-dimer levels and used a noninvasive ventilator for one week.
The wounds were treated with surgical debridement, silver hydrogel dressing, and hydrocolloid dressing, and complemented with static air mattress overlay.
The authors recommend that in situations where there is a shortage of healthcare workers, the government should provide pressure-redistribution devices and silicone foam dressings for all critically ill patients to prevent PI development and lighten the workload of healthcare workers.
Copyright Advances in Skin & Wound Care and the World Council of Enterostomal Therapists®.
Introduction
COVID-19 has a wide clinical spectrum.1 Although the majority of those infected with COVID-19 are asymptomatic or have only mild symptoms, older adults and those with comorbidities are more likely to become critically ill.2 Among patients who are critically ill with COVID-19, the majority develop acute respiratory distress syndrome (ARDS), a life-threatening form of respiratory failure with a high mortality rate.3,4 Patients who develop ARDS require ventilation support in the ICU. However, patients in the ICU are also at higher risk of pressure injury (PI) development due to prolonged immobilisation.5
Unfortunately, PI prevention measures are not optimally implemented in Indonesia,8 especially in the makeshift hospitals created during the COVID-19 pandemic. Here, the authors report two cases of critically ill COVID-19 patients who developed large PIs during hospitalisation in a makeshift hospital in one of the largest cities in Indonesia. Written informed consent was provided by the legal guardian (for case 1) and by the subject of the case (for case 2) to publish the case details and associated images. The authors highlight challenges in PI management during the COVID-19 pandemic and propose several suggestions to aid PI prevention.
Case report
Case 1
A 40-year-old man with a medical history of schizophrenia and intellectual disability presented to the ER with the chief complaints of irritability, fever, dry cough, and shortness of breath. Three days before admission, the patient developed a fever of 38° C at home. On physical examination at the ER, the patient’s temperature was 37.8° C, BP was 120/80 mmHg, heart rate was 102 beats per minute, respiratory rate was 24 breaths per minute, and oxygen saturation was 85% without any oxygen support. Lung auscultation revealed rales in the left lung and chest X-ray revealed pulmonary infiltrates in the left lung (Figure 1). Laboratory evaluation showed elevated D-dimers (>20.000 ng/mL FEU) and hypoalbuminemia (2.2 mg/dl). Based on the initial evaluation, COVID-19 infection was suspected. A nasopharynx specimen was taken for COVID-19 reverse transcriptase-polymerase chain reaction evaluation to confirm the COVID-19 diagnosis.
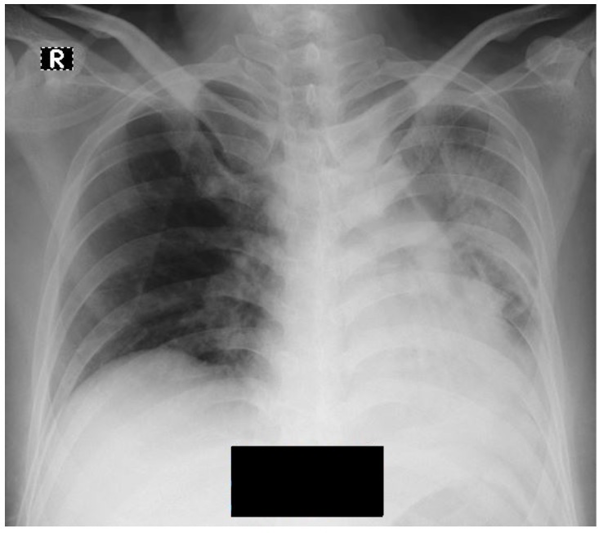
Figure 1. Chest x-ray in case 1,X-ray showing infiltrate in left lung.
While waiting for the test result, the patient was given 15 liters per minute oxygen via nonrebreathing mask and treated with intravenous moxifloxacin 400 mg daily, intravenous acetylcysteine 500 mg daily, intravenous albumin 50 grams daily, and 40 mg subcutaneous enoxaparin twice daily. To treat the symptoms of schizophrenia, the patient was given oral clozapine 50 mg twice daily, oral quetiapine 200 mg twice daily, and oral trihexyphenidyl 2mg twice daily. Because the patient was uncooperative, the patient was restrained on the bed after his legal guardian provided written consent. A foley catheter was then inserted and a diaper was used. The following day, the patient’s COVID-19 test result came back positive. The patient was then given additional treatment of intravenous oseltamivir 75 mg twice daily.
During hospitalisation, the patient’s oxygen saturation was not improving. On day 10, blood gas analysis showed uncompensated respiratory acidosis (pH 7.28, PO2 122 mmHg, PCO2 51.8 mmHg, and HCO3 24.9 mEq/L) with Jackson Reese circuit oxygen support. The patient also developed ARDS (PaO2/FiO2 ratio 122). Because this makeshift hospital lacked mechanical ventilators, a noninvasive ventilator was used. The patient had mean arterial pressure of 60 mmHg and Glasgow Coma Scale of 8, indicating ongoing septic shock. Thus, intravenous norepinephrine (0.1 mcg/kg/min) was administered continuously using syringe pump. Because the patient was immobilised, 30 minutes right-oblique and 30 minutes left-oblique passive mobilisation was undertaken every 8 hours. The restraints were released prior to mobilisation and retied after mobilisation to the new position. To maintain nutrition intake, a nasogastric feeding tube was inserted. The required nutrition was calculated by the dietitian and given as milk feeding.
Due to the limited number of healthcare workers (HCWs) available every shift and their high workloads, PI risk assessment was not performed. However, the patient’s skin was inspected every 8 hours during diaper changes. On day 14, a 7 cm × 7 cm bilateral sacral wound was noted with epithelial surface and superficial wound bed (Figure 2a). The wound was cleansed using normal saline and wound irrigation solution and a silver hydrogel dressing was applied to the wound bed. A hydrocolloid foam dressing was placed on top of the silver hydrogel dressing and extended 2 cm around the wound to protect the peri-wound skin from maceration. To prevent urine or fecal contamination, nonsterile gauze was placed above the hydrocolloid foam dressing and fixed with retention tape. In addition, a static air mattress overlay was placed on the bed as a pressure-redistribution device (PRD). The wound dressing was changed every 3 days, or earlier if contaminated with urine or feces.
On day 18, the sacral wound enlarged to 15 cm × 10 cm with slough and suspicion of “deeper ulceration” (Figure 2b). Surgical debridement was then performed by the nurses at the bedside. After surgical debridement, fascia was seen as the wound bed (Figure 2c). According to the 2016 National Pressure Ulcer Advisory Panel (NPUAP) staging system,10 the wound was classified as grade III. Because of the deep cavity wound, sterile gauze was placed in the cavity to fill the space after applying a silver hydrogel dressing onto the wound bed. The wound dressing was changed every 2 days instead of every 3 days, or earlier if contaminated with urine or feces. When needed, surgical debridement was performed again. On day 26, granulation began to appear from the wound (Figure 2d). The patient was discharged on day 39. Nurses followed up with weekly home visits until the wound was completely closed to evaluate the wound-healing process, perform surgical debridement if needed, change the wound dressing, and teach family members how to change the wound dressing in between home visits.
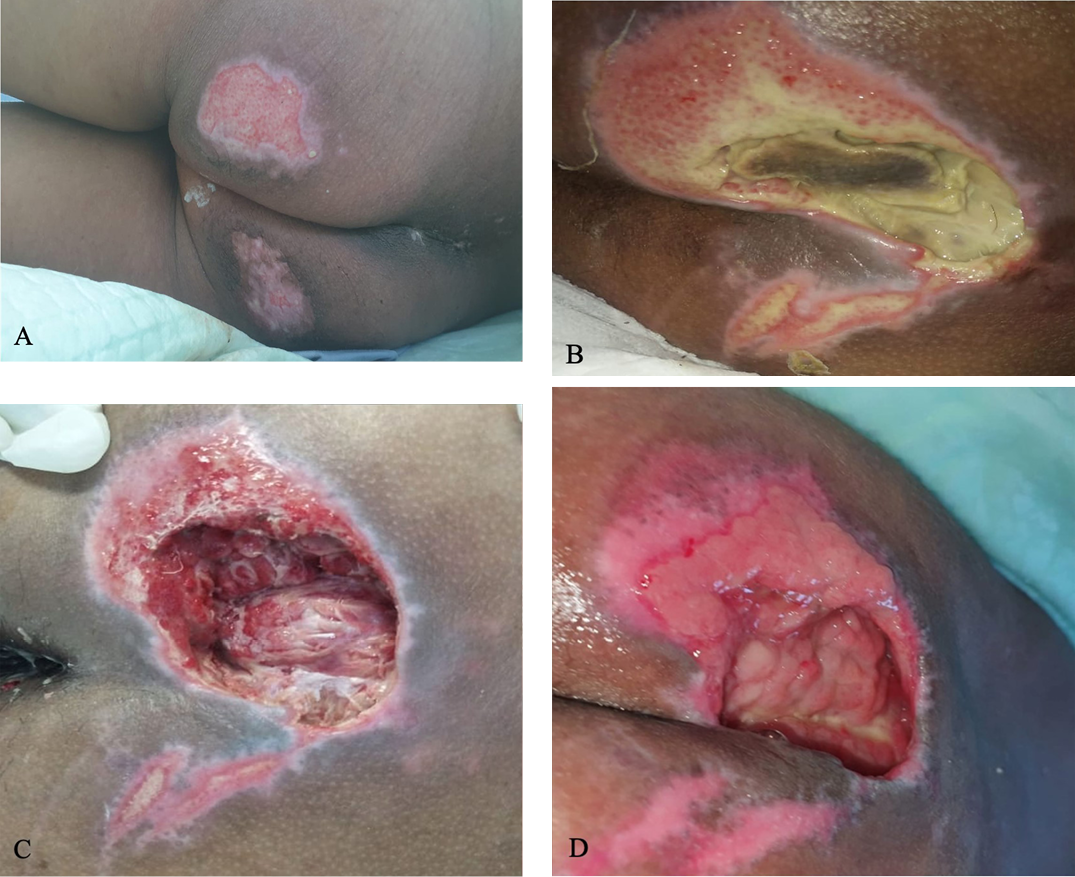
Figure 2. Sacral ulcer in case 1
A) Sacral ulcer with epithelial wound bed measuring 7 cm × 7 cm on day 14. B) Covered by slough and suspicion of “deeper ulcer,” measuring 15 cm × 10 cm on day 18. C) Minimal slough and fascia in the wound bed after surgical debridement and wound dressing, 15 cm x 10 cm with depth of 6 cm on day 22. D) Granulation tissue on day 26, measuring 10 cm × 6 cm.
Case 2
A 59-year-old man with a medical history of type 2 diabetes mellitus, hypertension, and cerebrovascular accident (CVA) presented to the ER with the chief complaints of fever, cough, and shortness of breath. Five days earlier, the patient had developed a cough and fever of 38.5° C at home. The patient tested positive for COVID-19 3 days before presenting to the ER. On physical examination at the ER, the temperature was 37.5° C, BP was 140/90 mmHg, heart rate was 110 beats per minute, respiratory rate was 24 breaths per minute, and oxygen saturation was 75% without any oxygen support. The patient had left-side hemiplegia due to the CVA. Lung auscultation revealed rales in both lungs. Chest X-ray revealed bilateral pulmonary opacities and cardiomegaly (Figure 3). Laboratory evaluation showed elevated D-dimers (2.100 ng/mL FEU), elevated interleukin-6 level (120 pg/mL), and hypoalbuminemia (2.8 mg/dl). Based on the initial evaluation, the patient was diagnosed with COVID-19 and recent CVA.
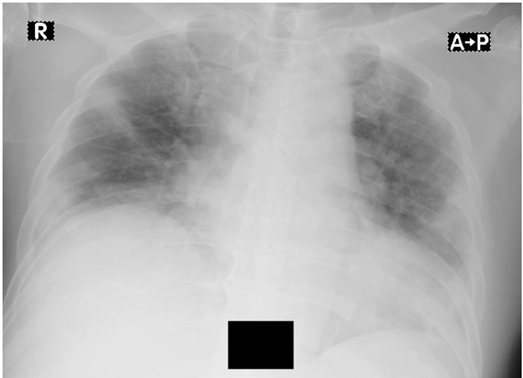
Figure 3. Chest x-ray in case 2
X-ray showing infiltrate in both lungs and cardiomegaly with cardio-thoracic ratio of 60%.
The patient was given 15 liters per minute oxygen via Jackson Rees circuit and treated with intravenous moxifloxacin 400 mg daily, intravenous acetylcysteine 500 mg daily, intravenous albumin 50 grams daily, subcutaneous heparin 5000 International Unit (IU), intravenous dexamethasone 6 mg daily, 400 mg intravenous Tocilizumab single dose, and oral oseltamivir 75 mg twice daily. To treat the hypertension, the patient was given oral amlodipine 10 mg once daily and oral candesartan 16 mg once daily. The patient also received subcutaneous long actin insulin 20 IU once daily and rapid acting insulin 16 IU thrice daily to treat the diabetes mellitus.
During hospitalisation, the patient’s oxygen saturation was not improving. On day 7, blood gas analysis showed uncompensated respiratory acidosis (pH 7.3, PO2 150 mmHg, PCO2 50.2 mmHg, and HCO3 23.5 mEq/L) with Jackson Reese circuit oxygen support. The patient developed ARDS (PaO2/FiO2 ratio 150) and was given a noninvasive ventilator due to the lack of mechanical ventilators. Because the patient was immobilised, 30 minutes right-oblique and 30 minutes left-oblique passive mobilisation was undertaken every 8 hours. To maintain nutritional intake, a nasogastric feeding tube was inserted; milk feeding was calculated by a dietician.
Due to the limited number of HCWs every shift and their high workloads, PI risk assessment was not performed. However, the patient’s skin was inspected every 8 hours during diaper changes. On day 16, a 12 cm × 8 cm sacral wound with suspicion of “deeper ulceration” was found on both sides of the sacrum (Figure 4a). On day 18, central necrotic tissue was present (Figure 4b). Nurses performed surgical debridement at the bedside (Figure 4c) and the wound was cleansed using normal saline and wound irrigation solution. A silver hydrogel dressing was applied on the wound bed and a hydrocolloid foam dressing was placed on top of the silver hydrogel dressing and extended 2 cm around the wound to protect the peri-wound skin from maceration. To prevent urine or fecal contamination, nonsterile gauze was placed above the hydrocolloid foam dressing and fixed with retention tape. Further, a static air mattress overlay was placed on the bed as a PRD. The wound dressing was changed every 3 days, or earlier if contaminated with urine or feces. When needed, surgical debridement was performed again.
Two days after treatment, the wound bed was more profound than the initial wound with bone and tendon exposure (Figure 4d). According to the 2016 NPUAP staging system,10 the wound was grade IV. Because of the deep cavity wound, the cavity was filled with sterile gauze after applying a silver hydrogel dressing onto the wound bed. The wound dressing was changed every 2 days instead of every 3 days, or earlier if contaminated with urine or feces. On day 25, granulation tissue presented on the ulcer (Figure 4e) and by day 30, the ulcer had narrowed (Figure 4f). The patient was discharged on day 35. Nurses followed up with weekly home visits until the wound was completely closed to evaluate the wound-healing process, perform surgical debridement if needed, change the wound dressing, and teach family members how to change the wound dressing in between the scheduled home visits.
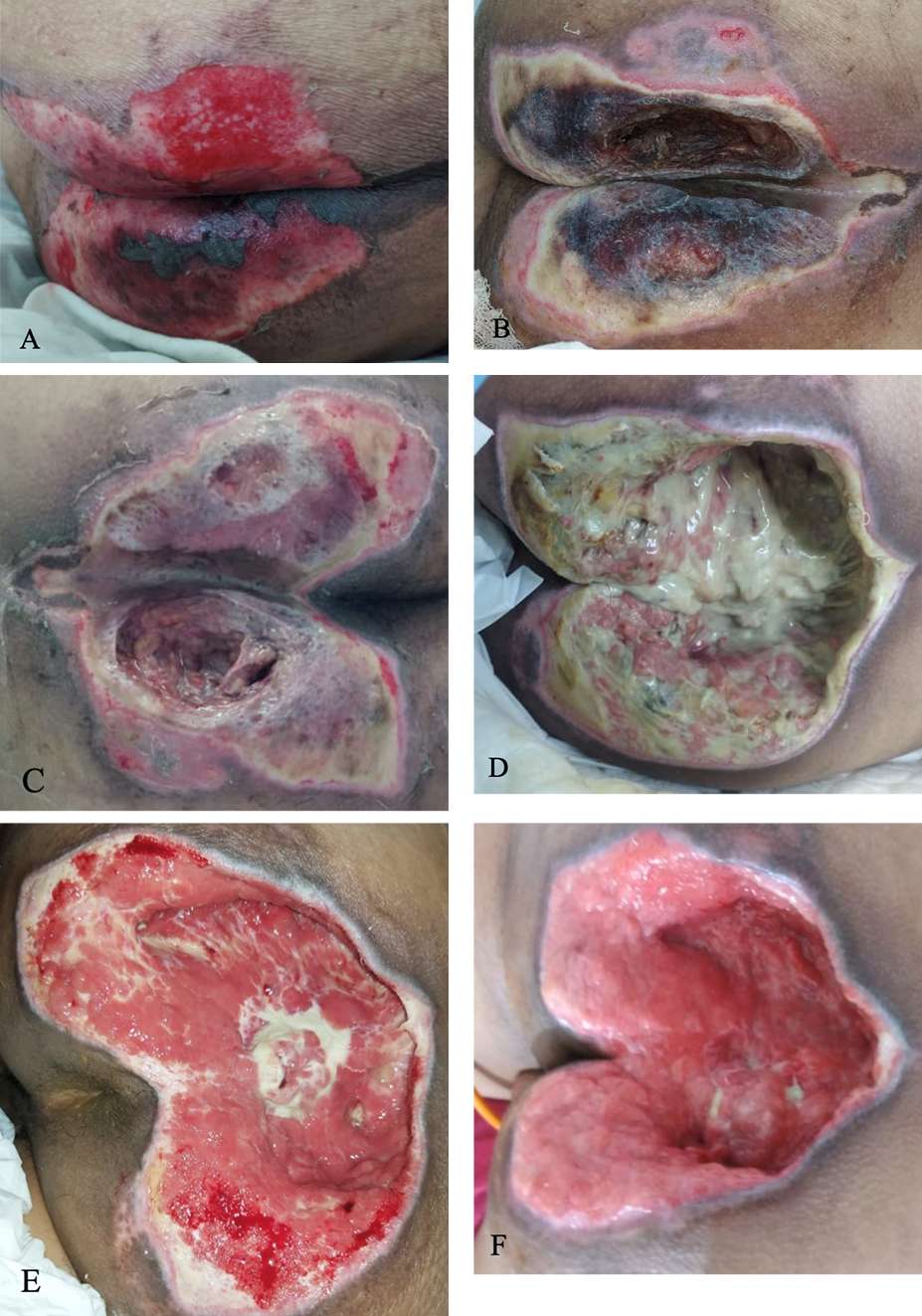
Figure 4. Sacral ulcer in case 2
A) Sacral ulcer on both side of buttocks with epithelial wound bed and necrotic tissue on central side, measuring 12 cm x 8 cm on day 16. B) Covered with both slough and necrotic tissue, measuring 12 cm x 10 cm on day 18. C) After surgical debridement on day 18. D) Covered with massive slough, depth of 7 cm on day 20. E) Granulation tissue and minimal slough on day 25. F) Granulation tissue on day 30.
Discussion
As reflected in the latest NPUAP definition of PI, the main factors influencing PI development are pressure, shear, and soft tissue tolerance.10 Pressure refers to sustained pressure on a local point, whereas shearing force occurs when two opposing surfaces slide in opposite directions. When pressure and shear disrupt blood flow and local tissue hypoxia lasts for a critical period of time, tissue damage results. However, at what intensity and duration of force tissue damage occurs depends on the tissue tolerance.12 Pressure injuries usually occur in bony areas such as the sacrum.13
Researchers have identified a number of PI risk factors, including immobility, being confined to bed, malnutrition, dehydration, infection, urinary and bowel incontinence, diabetes, vascular disease, and vasopressor use.14-16 Sedated patients are particularly prone to PI because they do not perceive painful stimuli from intense and prolonged pressure and are not able to actively change their position in bed.7,17,18 Recently, it has been reported that patients who are critically ill with COVID-19 are also at higher risk of PI.19 These patients have reduced perfusion and are more likely to develop systemic coagulopathy, which leads to decreased tissue tolerance.19 In the first case, the patient was critically ill with COVID-19 and required a vasopressor. This patient had impaired mental health as a comorbidity. People with severe mental health impairment such as schizophrenia tend to have poor diet and may neglect their personal hygiene, causing similar conditions to having urinary and bowel incontinence.13 In the second case, the patient was also critically ill with COVID-19 and had CVA and diabetes mellitus as comorbidities.
Pressure injury is associated with prolonged hospitalisation.20-22 The length of stay was 39 days for the first case report patient and 35 days for the second patient. The first patient could have been discharged 9 days earlier if there were no PI present; the second patient could have been discharged 5 days earlier. In a previous case series of three severely ill patients with COVID-19, PIs were first noted between 7 and 19 days after hospitalisation.19 For the patients described herein, PI was noted on day 14 of hospitalisation for the first patient, and on day 16 for the second patient.
According to the latest guidelines, comprehensive PI risk assessment, preventive skin care, and early mobilisation and repositioning are some of the PI management strategies that should be considered.23 In terms of patients who are critically ill with COVID-19, Tang et al24 found that PIs can be managed by improving the underlying contributing factors, providing PRD with proper positioning, improving mobility, minimising excessive moisture, correcting malnutrition, and performing close daily monitoring of the PI including the dressing, surrounding skin, and any possible complications.
However, proper PI management translates to an extra workload for nurses. Unfortunately, due to significant staffing shortages, HCWs’ workload during the COVID-19 pandemic in Indonesia is already high.9 In this makeshift hospital, there are only one doctor and three nurses on every shift, resulting in a HCW-to-patient ratio of 1:5. In addition, most of the patients with COVID-19 were critically ill. With a very unbalanced HCW-to-patient ratio and resultant high workload for the HCWs, it is not possible to follow the guidelines for proper PI management. As a result, PI risk assessment was not performed when patients arrived at the makeshift hospital; mobilisation and skin assessment were performed every 8 hours (once per HCW’s working shift) instead of being individualised according to risk assessment.
With regard to PRDs, a recent study found that PRD use was associated with an 88% reduced risk of PI development in high risk ICU patients.25 Similarly, a previous systematic review also concluded that PRD should be provided to patients who are at high risk of PI development.26 Pressure-redistribution devices help prevent PIs by decreasing the magnitude and duration of pressure as well as reducing the shear and friction between the patient and the bed surface.10,25 Thus, providing PRDs for all critically ill patients with COVID-19 would be a beneficial strategy for PI prevention. However, in the makeshift hospital, only two PRDs are available, and thus are allocated for PI treatment and not for PI prevention.
Based on the difficulties experienced during the COVID-19 pandemic, the authors recommend several PI prevention strategies for hospitals with HCW shortages:23,28
Re-educate HCWs about PI management
Conduct skin assessments as often as possible
Ensure patients have adequate nutrition and hydration
Use PRDs for all patients who are critically ill with COVID-19
Apply silicone foam dressings over the bony prominences that serve as the main pressure points in all critically ill patients with COVID-19.
Conclusions
Patients who are critically ill with COVID-19 are also at greater risk of PI development during hospitalisation. In a situation where there is a shortage of HCWs, governments should compensate by providing additional PRDs and silicone foam dressings for all critically ill patients to prevent PI development and lighten the workload of HCWs.
Conflict of Interest
The authors declare no conflicts of interest.
Funding
The authors received no funding for this study.
Tratamiento de las lesiones por presión en pacientes críticos con COVID-19 en un hospital improvisado de Indonesia: Un informe de dos casos
Kezia Eveline, Hemma W Indirayani, Rachmaniar Pramanasari, Firas F Alkaff
DOI: https://doi.org/10.33235/wcet.42.3.23-29
Resumen
Los pacientes en estado crítico con COVID-19 necesitan apoyo ventilatorio en la UCI. Sin embargo, los pacientes de la UCI tienen un mayor riesgo de desarrollar una lesión por presión (PI). Lamentablemente, la prevención de las PI no se aplica de forma óptima en Indonesia, especialmente en los hospitales improvisados creados durante la pandemia de COVID-19.
Aquí, los autores informan de dos casos de pacientes con COVID-19 en estado crítico que desarrollaron grandes PI sacras durante su hospitalización en un hospital improvisado en Indonesia. El primer paciente desarrolló una PI sacra de grado III, de 7 cm × 7 cm, el 14º día de hospitalización. El segundo paciente desarrolló una PI sacra de grado IV, de 12 cm × 8 cm, el 16º día de hospitalización. Ambos pacientes tenían niveles elevados de dímero D y utilizaron un ventilador no invasivo durante una semana.
Las heridas se trataron con desbridamiento quirúrgico, apósito de hidrogel de plata y apósito de hidrocoloide, y se complementaron con una superposición de colchón de aire estático.
Los autores recomiendan que, en situaciones de escasez de trabajadores sanitarios, el gobierno proporcione dispositivos de redistribución de la presión y vendajes de espuma de silicona para todos los pacientes en estado crítico, a fin de prevenir el desarrollo de PI y aligerar la carga de trabajo de trabajadores sanitarios
Copyright Avances en el cuidado de la piel y heridas y el Consejo Mundial de Terapeutas Enterostomales®.
Introduccion
El COVID-19 tiene un amplio espectro clínico.1 Aunque la mayoría de los infectados por COVID-19 son asintomáticos o sólo presentan síntomas leves, los adultos mayores y los que tienen comorbilidades tienen más probabilidades de enfermar gravemente.2 Entre los pacientes que se encuentran en estado crítico con COVID-19, la mayoría desarrolla el síndrome de dificultad respiratoria aguda (ARDS), una forma de insuficiencia respiratoria potencialmente mortal con una alta tasa de mortalidad.3,4 Los pacientes que desarrollan el ARDS requieren apoyo ventilatorio en la UCI. Sin embargo, los pacientes de la UCI también tienen un mayor riesgo de desarrollar lesiones por presión (PI) debido a la inmovilización prolongada.5
Lamentablemente, las medidas de prevención de PI no se aplican de forma óptima en Indonesia,8 especialmente en los hospitales improvisados creados durante la pandemia de COVID-19. Aquí, los autores informan de dos casos de pacientes con COVID-19 en estado crítico que desarrollaron grandes PI durante su hospitalización en un hospital improvisado en una de las mayores ciudades de Indonesia. El tutor legal (para el caso 1) y el sujeto del caso (para el caso 2) dieron su consentimiento informado por escrito para publicar los detalles del caso y las imágenes asociadas. Los autores destacan los retos en la gestión de PI durante la pandemia de COVID-19 y proponen varias sugerencias para ayudar a la prevención de las PI.
Informe de caso
Caso 1
Un hombre de 40 años, con antecedentes de esquizofrenia y discapacidad intelectual, acudió a Urgencias con quejas de irritabilidad, fiebre, tos seca y dificultad respiratoria. Tres días antes del ingreso, la paciente presentó una fiebre de 38°C en su casa. En la exploración física en urgencias, la temperatura de la paciente era de 37.8°C, la tensión arterial era de 120/80 mmHg, la frecuencia cardíaca era de 102 latidos por minuto, la frecuencia respiratoria era de 24 respiraciones por minuto y la saturación de oxígeno era del 85% sin ningún tipo de soporte de oxígeno. La auscultación pulmonar reveló estertores en el pulmón izquierdo y la radiografía de tórax reveló infiltrados pulmonares en el pulmón izquierdo (Figura 1). La evaluación de laboratorio mostró una elevación de los dímeros D (>20,000 ng/mL de FEU) y una hipoalbuminemia (2,2 mg/dl). Basándose en la evaluación inicial, se sospechó de una infección por COVID-19. Se tomó una muestra de nasofaringe para la evaluación de la reacción en cadena de la polimerasa con transcriptasa inversa de COVID-19 para confirmar el diagnóstico de COVID-19.

Figura 1. Radiografía de tórax en el caso 1, radiografía que muestra un infiltrado en el pulmón izquierdo.
Mientras esperaba el resultado de la prueba, el paciente recibió 15 litros por minuto de oxígeno a través de una máscara no respiratoria y fue tratado con moxifloxacina intravenosa 400 mg al día, acetilcisteína intravenosa 500 mg al día, albúmina intravenosa 50 gramos al día y 40 mg de enoxaparina subcutánea dos veces al día. Para tratar los síntomas de la esquizofrenia, el paciente recibió clozapina oral 50 mg dos veces al día, quetiapina oral 200 mg dos veces al día y trihexifenidilo oral 2 mg dos veces al día. Como el paciente no cooperaba, se le sujetó en la cama después de que su tutor legal diera su consentimiento por escrito. A continuación, se introdujo un catéter foley y se utilizó un pañal. Al día siguiente, el resultado de la prueba COVID-19 del paciente fue positivo. El paciente recibió entonces un tratamiento adicional de oseltamivir intravenoso de 75 mg dos veces al día.
Durante la hospitalización, la saturación de oxígeno del paciente no mejoraba. El día 10, la gasometría mostró una acidosis respiratoria no compensada (pH 7.28, PO2 122 mmHg, PCO2 51.8 mmHg y HCO3 24.9 mEq/L) con soporte de oxígeno en el circuito Jackson Reese. El paciente también desarrolló ARDS (relación PaO2/FiO2 122). Como este hospital improvisado carecía de ventiladores mecánicos, se utilizó un ventilador no invasivo. El paciente tenía una presión arterial media de 60 mmHg y una escala de coma de Glasgow de 8, lo que indicaba un shock séptico en curso. Así, se administró norepinefrina intravenosa (0.1 mcg/kg/min) de forma continua mediante una bomba de jeringa. Dado que el paciente estaba inmovilizado, se realizó una movilización pasiva de 30 minutos en el lado derecho y 30 minutos en el lado izquierdo cada 8 horas. Las sujeciones se soltaron antes de la movilización y se retiraron después de la movilización a la nueva posición. Para mantener la ingesta de nutrientes, se insertó una sonda de alimentación nasogástrica. La nutrición requerida fue calculada por el dietista y administrada en forma de alimentación láctea.
Debido al limitado número de trabajadores sanitarios (HCW) disponibles en cada turno y a su elevada carga de trabajo, no se realizó la evaluación del riesgo de PI. Sin embargo, se inspeccionó la piel del paciente cada 8 horas durante el cambio de pañales. El día 14, se observó una herida sacra bilateral de 7 cm × 7 cm con superficie epitelial y lecho de la herida superficial (Figura 2a). La herida se limpió con solución salina normal y solución de irrigación de la herida y se aplicó un apósito de hidrogel de plata en el lecho de la herida. Se colocó un apósito de espuma hidrocoloide sobre el apósito de hidrogel de plata y se extendió 2 cm alrededor de la herida para proteger la piel periherida de la maceración. Para evitar la contaminación por orina o heces, se colocó una gasa no estéril sobre el apósito de espuma hidrocoloide y se fijó con cinta de retención. Además, se colocó un colchón de aire estático sobre la cama como dispositivo de redistribución de la presión (PRD). El apósito de la herida se cambiaba cada 3 días, o antes si se contaminaba con orina o heces.
El día 18, la herida del sacro se amplió hasta 15 cm × 10 cm con esfacelos y sospecha de "ulceración más profunda" (Figura 2b). A continuación, el personal de enfermería realizó el desbridamiento quirúrgico a pie de cama. Tras el desbridamiento quirúrgico, se observó la fascia como lecho de la herida (Figura 2c). Según la comisión consultiva nacional sobre las úlceras por presión (NPUAP) de 2016,10 la herida se clasificó como grado III. Debido a la profunda cavidad de la herida, se colocó una gasa estéril en la cavidad para rellenar el espacio después de aplicar un apósito de hidrogel de plata en el lecho de la herida. El apósito de la herida se cambiaba cada dos días en lugar de cada tres, o antes si estaba contaminado con orina o heces. Cuando fue necesario, se volvió a realizar un desbridamiento quirúrgico. En el día 26, empezó a aparecer granulación en la herida (Figura 2d). El paciente fue dado de alta el día 39. Los enfermeros hicieron un seguimiento con visitas semanales a domicilio hasta que la herida se cerró por completo para evaluar el proceso de cicatrización, realizar un desbridamiento quirúrgico si era necesario, cambiar el apósito de la herida y enseñar a los familiares a cambiar el apósito de la herida entre las visitas a domicilio.

Figura 2. Úlcera sacra en el caso 1
A) Úlcera sacra con lecho de herida epitelial de 7 cm × 7 cm en el día 14. B) Cubierta de esfacelos y sospecha de "úlcera más profunda", de 15 cm × 10 cm el día 18. C) Mínimo desprendimiento y fascia en el lecho de la herida tras el desbridamiento quirúrgico y el vendaje de la herida, 15 cm x 10 cm con una profundidad de 6 cm el día 22. D) Tejido de granulación en el día 26, que mide 10 cm × 6 cm.
Caso 2
Un hombre de 59 años con antecedentes de diabetes mellitus tipo 2, hipertensión y accidente cerebrovascular (CVA) acudió a Urgencias con quejas de fiebre, tos y dificultad respiratoria. Cinco días antes, la paciente había desarrollado tos y fiebre de 38.5°C en su casa. El paciente dio positivo en la prueba de COVID-19 3 días antes de acudir a Urgencias. En la exploración física en urgencias, la temperatura era de 37.5°C, la PA era de 140/90 mmHg, la frecuencia cardíaca era de 110 latidos por minuto, la frecuencia respiratoria era de 24 respiraciones por minuto y la saturación de oxígeno era del 75% sin ningún tipo de soporte de oxígeno. El paciente tenía una hemiplejía del lado izquierdo debido al CVA. La auscultación pulmonar reveló estertores en ambos pulmones. La radiografía de tórax reveló opacidades pulmonares bilaterales y cardiomegalia (Figura 3). La evaluación de laboratorio mostró una elevación de los dímeros D (2,100 ng/mL FEU), un nivel elevado de interleucina 6 (120 pg/mL) y una hipoalbuminemia (2.8 mg/dl). Basándose en la evaluación inicial, el paciente fue diagnosticado de COVID-19 y de CVA reciente.

Figura 3. La radiografía de tórax del caso 2
muestra un infiltrado en ambos pulmones y una cardiomegalia con una relación cardio-torácica del 60%.
El paciente recibió 15 litros por minuto de oxígeno a través del circuito Jackson Rees y fue tratado con moxifloxacina intravenosa 400 mg al día, acetilcisteína intravenosa 500 mg al día, albúmina intravenosa 50 gramos al día, heparina subcutánea 5000 Unidades Internacionales (IU), dexametasona intravenosa 6 mg al día, Tocilizumab intravenoso 400 mg en dosis única y oseltamivir oral 75 mg dos veces al día. Para tratar la hipertensión, el paciente recibió amlodipino oral 10 mg una vez al día y candesartán oral 16 mg una vez al día. La paciente también recibió insulina subcutánea de acción larga 20 IU una vez al día e insulina de acción rápida 16 IU tres veces al día para tratar la diabetes mellitus.
Durante la hospitalización, la saturación de oxígeno del paciente no mejoraba. El día 7, la gasometría mostró una acidosis respiratoria no compensada (pH 7,3, PO2 150 mmHg, PCO2 50,2 mmHg y HCO3 23,5 mEq/L) con soporte de oxígeno en el circuito Jackson Reese. El paciente desarrolló un ARDS (relación PaO2/FiO2 150) y se le administró un ventilador no invasivo debido a la falta de ventiladores mecánicos. Dado que el paciente estaba inmovilizado, se realizó una movilización pasiva de 30 minutos en el lado derecho y 30 minutos en el lado izquierdo cada 8 horas. Para mantener la ingesta nutricional, se insertó una sonda de alimentación nasogástrica; la alimentación láctea fue calculada por un dietista.
Debido al limitado número de trabajadores sanitarios en cada turno y a su elevada carga de trabajo, no se realizó la evaluación de riesgos de PI. Sin embargo, se inspeccionó la piel del paciente cada 8 horas durante el cambio de pañales. El día 16, se encontró una herida sacra de 12 cm × 8 cm con sospecha de "ulceración más profunda" en ambos lados del sacro (Figura 4a). En el día 18, había tejido necrótico central (Figura 4b). El personal de enfermería realizó el desbridamiento quirúrgico a pie de cama (Figura 4c) y la herida se limpió con solución salina normal y solución de irrigación de la herida. Se aplicó un apósito de hidrogel de plata en el lecho de la herida y se colocó un apósito de espuma hidrocoloide encima del apósito de hidrogel de plata y se extendió 2 cm alrededor de la herida para proteger la piel periherida de la maceración. Para evitar la contaminación por orina o heces, se colocó una gasa no estéril sobre el apósito de espuma hidrocoloide y se fijó con cinta de retención. Además, se colocó un colchón de aire estático sobre la cama como PRD. El apósito de la herida se cambiaba cada 3 días, o antes si se contaminaba con orina o heces. Cuando fue necesario, se volvió a realizar un desbridamiento quirúrgico.
Dos días después del tratamiento, el lecho de la herida era más profundo que el de la herida inicial, con exposición de huesos y tendones (Figura 4d). Según el sistema de estadificación de la NPUAP de 2016,10 la herida era de grado IV. Debido a la profunda cavidad de la herida, la cavidad se rellenó con una gasa estéril después de aplicar un apósito de hidrogel de plata en el lecho de la herida. El apósito de la herida se cambiaba cada dos días en lugar de cada tres, o antes si estaba contaminado con orina o heces. En el día 25, se presentó tejido de granulación en la úlcera (Figura 4e) y en el día 30, la úlcera se había estrechado (Figura 4f). El paciente fue dado de alta el día 35. Los enfermeros hicieron un seguimiento con visitas semanales a domicilio hasta que la herida se cerró por completo para evaluar el proceso de cicatrización, realizar un desbridamiento quirúrgico si era necesario, cambiar el apósito de la herida y enseñar a los familiares a cambiar el apósito de la herida entre las visitas domiciliarias programadas.

Figura 4. Úlcera sacra en el caso 2
A) Úlcera sacra en ambos lados de las nalgas con lecho de herida epitelial y tejido necrótico en el lado central, que mide 12 cm × 8 cm el día 16. B) Cubierta de esfacelos y tejido necrótico, que mide 12 cm × 10 cm el día 18. C) Después del desbridamiento quirúrgico en el día 18. D) Cubierta de fango masivo, profundidad de 7 cm en el día 20. E) Tejido de granulación y mínima descamación en el día 25. F) Tejido de granulación en el día 30.
Discusion
Como se refleja en la última definición de PI de la NPUAP, los principales factores que influyen en el desarrollo de la PI son la presión, el cizallamiento y la tolerancia de los tejidos blandos.10 La presión se refiere a la presión sostenida en un punto local, mientras que la fuerza de cizallamiento se produce cuando dos superficies opuestas se deslizan en direcciones opuestas. Cuando la presión y el cizallamiento interrumpen el flujo sanguíneo y la hipoxia tisular local se prolonga durante un periodo de tiempo crítico, se producen daños en los tejidos. Sin embargo, a qué intensidad y duración de la fuerza se produce el daño tisular depende de la tolerancia del tejido.12 Las lesiones por presión suelen producirse en zonas óseas como el sacro.13
Los investigadores han identificado una serie de factores de riesgo de PI, como la inmovilidad, el confinamiento en la cama, la desnutrición, la deshidratación, la infección, la incontinencia urinaria e intestinal, la diabetes, la enfermedad vascular y el uso de vasopresores.14-16 Los pacientes sedados son especialmente propensos a la PI porque no perciben los estímulos dolorosos de la presión intensa y prolongada y no son capaces de cambiar activamente su posición en la cama.7,17,18 Recientemente se ha informado de que los pacientes en estado crítico con COVID-19 también tienen un mayor riesgo de PI.19 Estos pacientes tienen una perfusión reducida y son más propensos a desarrollar una coagulopatía sistémica, que conduce a una disminución de la tolerancia tisular.19 En el primer caso, el paciente estaba en estado crítico con COVID-19 y requería un vasopresor. Este paciente tenía una salud mental deteriorada como comorbilidad. Las personas con un deterioro grave de la salud mental, como la esquizofrenia, tienden a tener una mala alimentación y pueden descuidar su higiene personal, lo que provoca condiciones similares a la incontinencia urinaria e intestinal.13 En el segundo caso, el paciente también estaba gravemente enfermo con COVID-19 y tenía un CVA y diabetes mellitus como comorbilidades.
Las lesiones por presión se asocian a una hospitalización prolongada.20-22 La duración de la estancia fue de 39 días para el primer paciente del informe y de 35 días para el segundo. El primer paciente podría haber sido dado de alta 9 días antes si no hubiera habido PI; el segundo paciente podría haber sido dado de alta 5 días antes. En una serie de casos anterior de tres pacientes gravemente enfermos con COVID-19, las PI se observaron por primera vez entre 7 y 19 días después de la hospitalización.19 En los pacientes descritos aquí, las PI se observaron el día 14 de la hospitalización en el primer paciente, y el día 16 en el segundo.
Según las últimas directrices, la evaluación exhaustiva del riesgo de PI, el cuidado preventivo de la piel y la movilización y el reposicionamiento tempranos son algunas de las estrategias de gestión de PI que deben considerarse.23 En cuanto a los pacientes en estado crítico con COVID-19, Tang et al24 descubrieron que las PI pueden gestionarse mejorando los factores contribuyentes subyacentes, proporcionando PRD con un posicionamiento adecuado, mejorando la movilidad, minimizando la humedad excesiva, corrigiendo la desnutrición y realizando una estrecha vigilancia diaria de las PI, incluyendo el vendaje, la piel circundante y cualquier posible complicación.
Sin embargo, la gestión adecuada de las PI se traduce en una carga de trabajo adicional para los enfermeros. Lamentablemente, debido a la importante escasez de personal, la carga de trabajo de los trabajadores sanitarios durante la pandemia de COVID-19 en Indonesia ya era elevada.9 En este hospital improvisado, sólo había un médico y tres enfermeross en cada turno, lo que hacía que la proporción de trabajadores sanitarios por paciente fuera de 1:5. Además, la mayoría de los pacientes con COVID-19 estaban en estado crítico. Con una proporción muy desequilibrada entre trabajadores sanitarios y los pacientes, y con la consiguiente carga de trabajo para los trabajadores sanitarios , no era posible seguir las directrices para una gestión adecuada de las PI. En consecuencia, la evaluación del riesgo de PI no se realizaba cuando los pacientes llegaban al hospital improvisado; la movilización y la evaluación de la piel se realizaban cada 8 horas (una vez por turno de trabajo de los trabajadores sanitarios) en lugar de individualizarse según la evaluación del riesgo.
Con respecto a las PRD, un estudio reciente descubrió que el uso de las PRD se asociaba con una reducción del 88% del riesgo de desarrollo de PI en pacientes de alto riesgo en la UCI.25 Del mismo modo, una revisión sistemática anterior también llegó a la conclusión de que se debe proporcionar PRD a los pacientes con alto riesgo de desarrollo de PI.26 Los dispositivos de redistribución de la presión ayudan a prevenir las PI al disminuir la magnitud y la duración de la presión, así como al reducir el cizallamiento y la fricción entre el paciente y la superficie de la cama.10,25 Por lo tanto, proporcionar dispositivos de redistribución de la presión a todos los pacientes críticos con COVID-19 sería una estrategia beneficiosa para la prevención de las PI. Sin embargo, en el hospital improvisado, sólo se dispone de dos PRD, por lo que se asignan para el tratamiento de las PI y no para la prevención de la misma.
Basándose en las dificultades experimentadas durante la pandemia de COVID-19, los autores recomiendan varias estrategias de prevención de la PI para los hospitales con escasez de trabajadores sanitarios:23,28
Reeducar a los trabajadores sanitarios sobre la gestión de las PI
Realizar evaluaciones de la piel con la mayor frecuencia posible
Garantizar que los pacientes tengan una nutrición e hidratación adecuadas
Utilizar los PRD para todos los pacientes en estado crítico con COVID-19
Aplique apósitos de espuma de silicona sobre las prominencias óseas que sirven como principales puntos de presión en todos los pacientes críticos con COVID-19.
Conclusiones
Los pacientes en estado crítico con COVID-19 también tienen un mayor riesgo de desarrollar PI durante la hospitalización. En una situación de escasez de trabajadores sanitarios, los gobiernos deberían compensar proporcionando más PRD y apósitos de espuma de silicona para todos los pacientes críticos, con el fin de prevenir el desarrollo de PI y aligerar la carga de trabajo de los trabajadores sanitarios.
Conflicto de intereses
Los autores declaran no tener conflictos de intereses.
Financiación
Los autores no recibieron financiación para este estudio.
Author(s)
Kezia Eveline MD
Plastic Reconstructive and Aesthetic Surgery Resident, Faculty of Medicine Universitas Airlangga, Dr Soetomo General Academic Hospital, Surabaya, Indonesia
Hemma W Indirayani MD
Internist, Menur Mental Hospital, Surabaya, Indonesia
Rachmaniar Pramanasari MD
Plastic Reconstructive and Aesthetic Surgeon, Airlangga University Hospital, Surabaya, Indonesia
Firas F Alkaff* MD
Lecturer, Division of Pharmacology and Therapy, Department of Anatomy, Histology and Pharmacology, Faculty of Medicine Universitas Airlangga
PhD Researcher, Division of Nephrology, Department of Internal Medicine, University Medical Centre, Groningen, The Netherlands
* Corresponding author
Kezia Eveline, MD is Plastic Reconstructive and Aesthetic Surgery Resident at Faculty of Medicine Universitas Airlangga, Dr. Soetomo General Academic Hospital, Surabaya, Indonesia. Hemma W. Indriyani, MD is Internist at Menur Mental Hospital, Surabaya. Rachmaniar Pramanasari, MD, is Plastic Reconstructive and Aesthetic Surgeon at Airlangga University Hospital, Surabaya. Firas F. Alkaff, MD is Lecturer at Division of Pharmacology and Therapy, Department of Anatomy, Histology, and Pharmacology, Faculty of Medicine Universitas Airlangga and PhD Researcher at Division of Nephrology, Department of Internal Medicine, University Medical Center Groningen, Groningen, The Netherlands
Kezia Eveline, MD es residente de Cirugía Plástica Reconstructiva y Estética en la Facultad de Medicina Universitas Airlangga, Hospital Académico General Dr. Soetomo, Surabaya, Indonesia. El doctor Hemma W. Indriyani es internista en el Hospital Mental de Menur, en Surabaya. El Dr. Rachmaniar Pramanasari es cirujano plástico y estético en el Hospital Universitario Airlangga de Surabaya. Firas F. Alkaff, MD es profesor de la División de Farmacología y Terapia del Departamento de Anatomía, Histología y Farmacología de la Facultad de Medicina de la Universitas Airlangga e investigador de la División de Nefrología del Departamento de Medicina Interna del Centro Médico Universitario de Groningen, Groningen, Países Bajos
References
- Ramos-Casals M, Brito-Zeron P, Mariette X. Systemic and organ-specific immune-related manifestations of COVID-19. Nat Rev Rheumatol 2021;17:315-32.
- Gao YD, Ding M, Dong X, et al. Risk factors for severe and critically ill COVID-19 patients: a review. Allergy 2021;76:428-55.
- Xu W, Sun NN, Gao HN, et al. Risk factors analysis of COVID-19 patients with ARDS and prediction based on machine learning. Sci Rep 2021;11:2933.
- Yang X, Yu Y, Xu J, et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study. Lancet Respir Med 2020;8:475-81.
- Challoner T, Vesel T, Dosanjh A, Kok K. The risk of pressure ulcers in a proned COVID population. Surgeon 2021;S1479-666X(21)00121-9.
- He M, Tang A, Ge X, Zheng J. Pressure ulcers in the intensive care unit: an analysis of skin barrier risk factors. Adv Skin Wound Care 2016;29:493-8.
- Keller BP, Wille J, van Ramshorst B, van der Werken C. Pressure ulcers in intensive care patients: a review of risks and prevention. Intensive Care Med 2002;28:1379-88.
- Amir Y, Lohrmann C, Halfens RJ, Schols JM. Pressure ulcers in four Indonesian hospitals: prevalence, patient characteristics, ulcer characteristics, prevention and treatment. Int Wound J 2017;14:184-93.
- Mahendradhata Y, Andayani N, Hasri ET, et al. The capacity of the Indonesian healthcare system to respond to COVID-19. Front Public Health 2021;9:649819.
- Edsberg LE, Black JM, Goldberg M, McNichol L, Moore L, Sieggreen M. Revised National Pressure Ulcer Advisory Panel pressure injury staging system: revised pressure injury staging system. J Wound Ostomy Continence Nurs 2016;43:585-97.
- Defloor T. The risk of pressure sores: a conceptual scheme. J Clin Nurs 1999;8:206-16.
- Mervis JS, Phillips TJ. Pressure ulcers: Pathophysiology, epidemiology, risk factors, and presentation. J Am Acad Dermatol 2019;81:881-90.
- Bhattacharya S, Mishra RK. Pressure ulcers: current understanding and newer modalities of treatment. Indian J Plast Surg 2015;48(1):4-16.
- Cox J, Roche S. Vasopressors and development of pressure ulcers in adult critical care patients. Am J Crit Care 2015;24:501-10.
- Ahn H, Cowan L, Garvan C, Lyon D, Stechmiller J. Risk factors for pressure ulcers including suspected deep tissue injury in nursing home facility residents: analysis of national minimum data set 3.0. Adv Skin Wound Care 2016;29:178-90; quiz E1.
- Mawhirt SL, Frankel D, Diaz AM. Cutaneous manifestations in adult patients with COVID-19 and dermatologic conditions related to the COVID-19 pandemic in health care workers. Curr Allergy Asthma Rep 2020;20(12):75.
- Nedergaard HK, Haberlandt T, Toft P, Jensen HI. Pressure ulcers in critically ill patients - preventable by non-sedation? A substudy of the NONSEDA-trial. Intensive Crit Care Nurs 2018;44:31-5.
- Sasabe Y, Niitani M, Teramoto C, et al. Deep sedation predicts pressure injury in patients admitted to intensive care units. Nurs Crit Care 2022;DOI: 10.1111/nicc.12753.
- Young S, Narang J, Kumar S, et al. Large sacral/buttocks ulcerations in the setting of coagulopathy: a case series establishing the skin as a target organ of significant damage and potential morbidity in patients with severe COVID-19. Int Wound J 2020;17:2033-7.
- Triantafyllou C, Chorianopoulou E, Kourkouni E, Zaoutis TE, Kourlaba G. Prevalence, incidence, length of stay and cost of healthcare-acquired pressure ulcers in pediatric populations: a systematic review and meta-analysis. Int J Nurs Stud 2021;115:103843.
- Gupta P, Shiju S, Chacko G, et al. A quality improvement programme to reduce hospital-acquired pressure injuries. BMJ Open Qual 2020;9(3):e000905.
- Allman RM, Goode PS, Burst N, Bartolucci AA, Thomas DR. Pressure ulcers, hospital complications, and disease severity: impact on hospital costs and length of stay. Adv Wound Care 1999;12:22-30.
- European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel, Pan Pacific Pressure Injury Alliance. Prevention and Treatment of Pressure Ulcers/Injuries: Clinical Practice Guideline. The International Guideline. EPUAP/NPIAP/PPPIA; 2019.
- Tang J, Li B, Gong J, Li W, Yang J. Challenges in the management of critical ill COVID-19 patients with pressure ulcer. Int Wound J 2020;17:1523-4.
- Bai DL, Liu TW, Chou HL, Hsu YL. Relationship between a pressure redistributing foam mattress and pressure injuries: an observational prospective cohort study. PLoS One 2020;15(11):e0241276.
- McInnes E, Jammali-Blasi A, Bell-Syer SE, Dumville JC, Middleton V, Cullum N. Support surfaces for pressure ulcer prevention. Cochrane Database Syst Rev 2015;9:CD001735.
- Shi C, Dumville JC, Cullum N. Support surfaces for pressure ulcer prevention: a network meta-analysis. PLoS One 2018;13(2):e0192707.
- Team V, Team L, Jones A, Teede H and Weller CD (2021) Pressure Injury Prevention in COVID-19 Patients With Acute Respiratory Distress Syndrome. Front. Med. 7:558696. doi: 10.3389/fmed.2020.558696



