Volume 43 Number 2
WHAM evidence summary: sugar dressing for wound healing and treating wound infection in resource limited settings
Emily Haesler
Keywords Traditional wound management, sugar dressing, sugar paste
For referencing Haesler E. WHAM evidence summary: sugar dressing for wound healing and treating wound infection in resource limited settings . WCET® Journal 2023;43(2):35-40
DOI https://doi.org/10.33235/wcet.43.2.35-40
Clinical question
What is the best available evidence for sugar dressing improving wound healing and for reducing signs and symptoms of wound infection?
Summary
Granular/crystalized white sugar is readily accessible at low cost in most geographic regions. It has been used as a wound treatment for hundreds of years because it is sterile, non-toxic, absorbs fluid and has some antimicrobial properties1. Sugar is most often used in its granular form, packed into a wound cavity and secured with a wound dressing. Alternatively, it is ground into a powder, combined with glycerine or petroleum jelly and applied as a paste1, 2. There was no evidence comparing the effectiveness of sugar to modern dressings that promote moist wound healing. Level 1 evidence3, 4 at high risk of bias showed sugar dressing was associated with acceptable wound healing rates3, 4 and reduction in wound infection4, but might not be as effective as Edinburgh University Solution of Lime (EUSOL)3 or honey4, which are both commonly used in settings with limited resources. Level 35-7 and 48-15 evidence at moderate or high risk of bias provided evidence that sugar dressing might promote healing5, 6, 8, 9, 11-15, improve the wound bed tissue5, 9, 13-15, and reduce bacterial infection6, 12-15, wound pain5, and wound malodour7, 10.
Clinical practice recommendations
All recommendations should be applied with consideration to the wound, the person, the health professional and the clinical context.
|
Sugar dressing could be considered for use as a natural wound dressing to reduce signs and symptoms of infection and to promote healing when there is limited access to modern wound dressings (Grade B). |
Sources of evidence: search and appraisal
This summary was conducted using methods published by the Joanna Briggs Institute16-18. The summary is based on a systematic literature search combining search terms related to sugar dressing and wound healing. Searches were conducted for evidence reporting use of granulated sugar in human wounds published up to December 2022 in English in the following databases: Cumulative Index to Nursing and Allied Health Literature (CINAHL), Medline (Ovid), Google Scholar, Embase (Ovid), AMED and Health Internetwork Access to Research Initiative (Hinari, access via Research4Life) and Cochrane Library. Studies on other sugar sources (e.g., honey) or sugar combined with povidone-iodine (Knutson’s formula) were not eligible for inclusion (excepting when reported as a comparator). Levels of evidence for intervention studies are reported in Table 1.
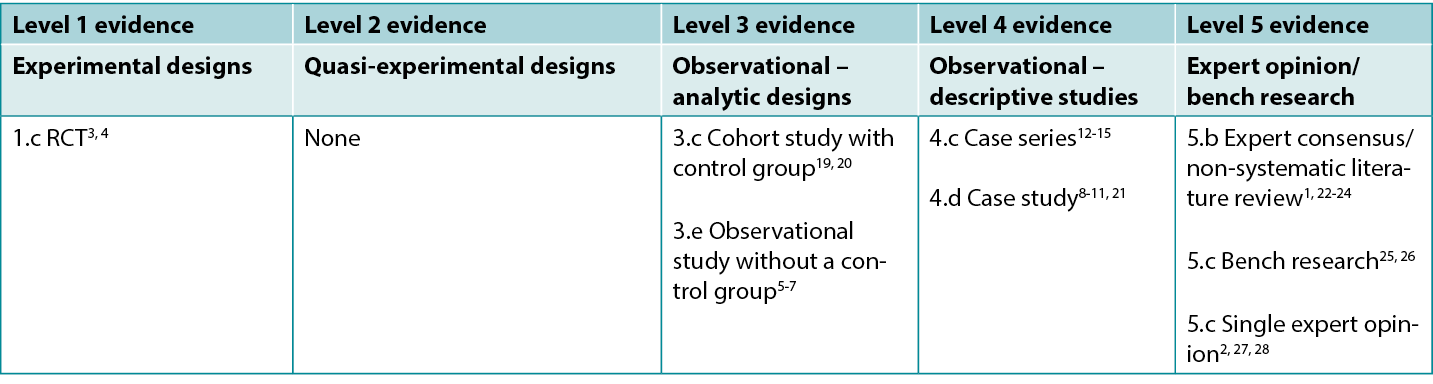
Table 1: Levels of evidence for clinical studies
Background
Sugar has been used since the late 1600s as a wound cleanser and the early 1700s as a treatment to promote wound healing1, 22. It is readily accessible at a very low cost in most geographic regions. In its granular/crystalized form, sugar consists of glucose and fructose, bound together to form sucrose (a disaccharide)13, 26. Sugar is present as a monosaccharide in other natural treatments, including honey, saps and fruit22. In its crystalized form, sugar’s mechanism for wound healing is different than that of honey and fruits. Crystalized sugar is sometimes used in combination with povidone-iodine to treat wounds29-33, and is commercially marketed as a sugar-povidone-iodine paste in some countries. The evidence for sugar in other natural forms (e.g., honey) and in combination with povidone iodine is not reported in this evidence summary, excepting as a comparator to sugar dressing.
There are several mechanisms through which granular white sugar is presumed to promote wound healing. First, sugar is hygroscopic; that is, it absorbs moisture from the environment around it, contributing to reduction in wound exudate22, 28. This also leads to mechanical debridement through slough adherence to the sugar dressing for removal without damage to healthy tissue1, 3, 22. In addition, sugar’s hygroscopic property contributes to autolytic debridement13, and reduction of edema in the wound bed and surrounding tissues1, 13.
Sugar increases osmolality of the wound environment, which influences water level activity. This mechanism attracts lymphocytes and macrophages to the wound bed1, and can inhibit the growth of bacteria5, 7, 25, 26. Sugar also releases hydrogen peroxide at low, non-toxic levels, which further inhibits bacteria activity7, 13, 27. Invitro studies have demonstrated sugar’s activity against a range of bacteria, including S. aureus, P aeruginosa, S. faecalis, E. coli, K. pneumoniae, and C. albicans5, 8, 25; and this was supported in an in-vivo study reported below4. In comparison to many other antiseptics, sugar has low toxicity and lowers the wound bed pH to around 5.0, which is more conducive to healing than an alkaline pH1, 7.
Clinical evidence on sugar dressing
Studies reporting clinical outcomes for treatment with sugar dressings are summarised in Table 2.
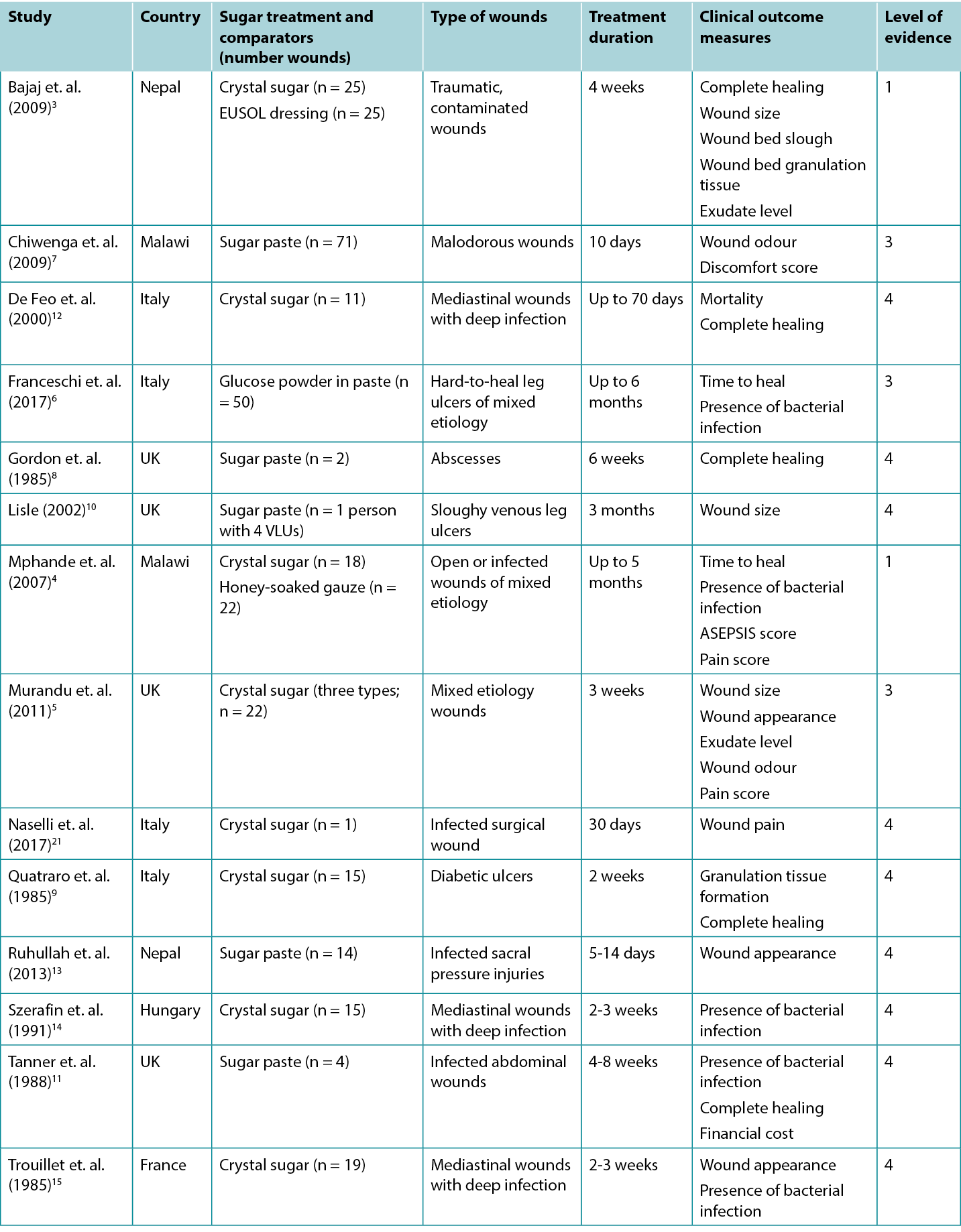
Table 2: Summary of the evidence for traditional sugar dressing/paste
Sugar dressing for promoting wound healing
An RCT3 (n = 50 wounds) that was at high risk of bias compared sugar dressing to EUSOL dressing for treating traumatic, contaminated wounds associated with bone injuries. EUSOL is a traditional hypolochlorite made from chlorinated lime and boric acid34. In both groups the wounds were lavaged with normal saline. The sugar group received granulated white sugar plus a gauze dressing. The EUSOL group received a 30-minute EUSOL soak followed by packing with EUSOL gauze. Both groups received concurrent systemic antibiotics based on culture and sensitivity of organisms in the wounds. After four weeks both groups had good healing rates, but the EUSOL group showed superiority (77% healed versus 66% healed, p < 0.05). The EUSOL group had a 1.23 times higher likelihood of achieving healing within four weeks. The EUSOL group also had superior outcomes on other measures including wound size and wound bed tissue type3 (Level 1).
A second RCT4 (n = 40) that was at high risk of bias compared sugar dressing to a honey dressing in open or infected wounds in children and adults. Debris was removed using saline and gauze, then wounds were either packed with granulated sugar or with honey-soaked gauze. Dressings were initially performed daily, increasing to weekly based on wound condition. After two weeks of treatment, the median healing rate was higher in the honey group (3.8 cm2/week versus 2.2 cm2/week, p = not reported). Median time to complete healing was shorter in the honey group (31.5 days [range 14 – 98] versus 56 days [range 21 – 133]). Both treatments were considered effective. Honey was reported as superior; however, no statistical analysis was reported to support this conclusion4 (Level 1).
In a proof-of-concept study at high risk of bias5, 22 wounds of mixed etiology were treated with a sugar dressing for three weeks. At baseline, the wounds had sloughy/necrotic tissue and moderate to heavy exudate levels. Wounds were cleansed, packed with granulated sugar and an absorbent pad applied, either daily or twice daily. There was progressive improvement in wound bed appearance for all the wounds over the short study period, and a reduction in mean wound area (baseline mean: 34.7 cm2 [range 6–144]; 3-week mean: 28.9 cm2 (range 4.63 – 142.4])5 (Level 3).
Several case studies8-11 at high risk of bias reported successful healing of hard-to-heal wounds with various sugar preparations. In one8, two people with complex abscesses that had previously failed to heal with surgical debridement and EUSOL gauze packing achieved complete healing within six weeks of commencing treatment with sugar paste (powdered sugar combined with polyethylene glycol and hydrogen peroxide)8. Quatraro et. al. (1985)9 reported that packing diabetic ulcers (n = 15) with sugar replaced every 3 to 4 hours was associated with rapid wound bed granulation (5 to 6 days) and complete healing within 12 days9. Another case report10 described the use of sugar paste replaced daily to reduce wound malodour and heal multiple, sloughy, partial thickness leg ulcers in one person. Finally, Tanner et. al. (1988)11 reported four cases in which sugar paste was applied to infected abdominal wounds to achieve healing within 4 to 8 weeks. In this report, thicker sugar paste was applied directly to open wound beds, and a thinner sugar paste (with increased volume of polyethylene glycol and hydrogen peroxide) was installed into abscess cavities with a syringe and catheter11 (Level 4).
Sugar dressing for signs and symptoms of wound infection
In an observational study6 (n = 50) at high risk of bias, hard-to-heal leg ulcers were selected for trial of a 60% sugar powder and 40% petroleum jelly paste preparation. At baseline, wound swabs were taken, with results showing bacterial presence in 100% of ulcers. Treatment was wound cleansing with tap water (no debridement performed), weekly application of the sugar paste, bandaging and etiological-based management (e.g., compression therapy or conservative hemodynamic correction of venous insufficiency [CHIVA]). A second wound swab was performed at 30 to 40 days; 100% of ulcers were bacteria-free. Complete healing rate was 96%, with a mean healing time of 109 days6 (Level 3).
Another observational study7 (n = 71) at high risk of bias explored sugar paste to manage wound odour and pain. Malodorous wounds selected for treatment had a mean baseline odour score of 5.45 that reduced to 2.94 at ten days of treatment (score rated from 1 to 10, where 10 was worst odour). Patient-rated discomfort reduced from a mean of 6.73 to 3.87 (score from 1 to 10, where 10 was worst pain)7 (Level 3).
A case series12 (n = 11) at high risk of bias reported outcomes for mediastinal wound infection following cardiac surgery when treated with sugar dressing. On detection of wound infection, surgical exploration, debridement and povidone iodine irrigation were performed, and the wound was surgically closed. However, wound infection did not resolve for any participants. The sternal wound was re-opened, and sugar dressing was performed up to four times daily until complete healing or flap reconstruction. Mean time to resolution of infection (based on microbiological assessment) after sugar dressing commenced was 11.22 ± 1.6 days. Mean duration of sugar dressing was 44 ± 27.8 days12 (Level 4). In a later report19, 20 at moderate risk of bias, the researchers compared this cohort to two other cohorts with mediastinal wound infection following cardiac surgery that received different treatments based on a range of standardized protocols at the time of their admission. Mortality rates were significantly better for sugar dressing versus conservative treatment/closed irrigation (30.6% versus 2.4%, p < 0.05), but mortality was higher for people treated with sugar dressing versus negative pressure wound therapy (1.8% versus 2.4%, p < 0.05)19. However, all the people in this study were critically ill and it was not evident that the type of dressing influenced mortality outcomes (Level 3). Other small case series at high risk of bias13-15 achieved similar clinical outcomes in both surgical wounds14, 15 and chronic wounds13 using sugar dressing14, 15 or paste13 to resolve local wound infection, debride the wound bed and promote granulation in preparation for surgical repair (Level 4).
The RCT4 comparing sugar to honey dressings evaluated signs and symptoms of infection with microbiological assessment, ASEPSIS score and pain assessment (categorically described as no pain, moderate pain or severe pain). Both groups showed similar reduction in signs and symptoms of wound infection. After one week of treatment, the percent of wounds treated with sugar that returned positive cultures reduced from baseline (52% to 39%). The median ASEPSIS score for sugar-treated wounds showed a reduction in the first three weeks (8.3 points/week) and the percent of people describing severe pain during dressing changes or with movement also reduced4 (Level 1).
In the short proof-of-concept study described above, Murandu et. al. (2011)5 reported resolution of signs and symptoms of infection (i.e., exudate, malodour and wound pain). Malodour completely resolved by seven days of treatment in all 11 wounds that were assessed as malodorous at baseline. All 22 wounds had moderate-to-heavy exudate levels at baseline; exudate decreased in the first week and was absent or minimal for all wounds by trial end. Pain requiring opiates was reported by five people at baseline, and this resolved within three days of treatment5 (Level 3).
Considerations for use
Preparation and use of sugar dressing
The studies included in this evidence summary used various methods to apply sugar to the wound. Some researchers5, 9, 15 packed granular white sugar directly into the wound cavity and retained it with gauze, absorbent pad, dry gauze or adhesive dressing (see Table 3 for an example of a recommended application method24). Muranda et. al. (2011)5 described using yellow paraffin to build a ‘ridge’ around wounds in awkward anatomical locations (e.g., heels) to further assist in retaining sugar in the wound. In these studies, packing sugar directly into the wound required replacement of the sugar dressing at least twice daily to maintain a well-packed wound cavity5, 9, 15, because sugar combines with wound exudate and drains from the wound7. Other researchers describe the addition of glycerin or petroleum jelly to make a sugar paste that could more easily be retained in the wound6-8, 13 and had a consistency that eased application7.
Table 3: One method for applying sugar to a wound

Adverse effects
- Some people reported a burning pain on application of sugar dressing that resolved quickly5, 7. Sugar has also been reported to cause itching of the peri-wound skin.24 These effects are thought to occur due to the drying effect sugar has on the wound bed and might be reduced by using a sugar paste in preference to granular sugar28.
- Evidence on the effect of topically applied sugar on blood sugar levels in people with diabetes is mixed. Sugar is a disaccharide (i.e., glucose and fructose combine to form sucrose) that is absorbed through the intestines, so theoretically it should not influence blood sugar levels when applied to a wound bed1, 23, 35. Some studies explored and confirmed that applying sugar to a wound does not influence blood sugar levels5, 15; however, there was one case report in which raised blood sugar level was observed1, 22, and in another study people with diabetes were given higher insulin doses20.
- There is one report of acute kidney failure associated with sugar paste23. In some of the reports12, 14, 15, people who had a wound treated with sugar dressing died; however, these people had serious disease and death was likely not related to the sugar dressing.
Other considerations
- White granulated sugar is considered sterile. Care should be taken to guarantee the product used is not contaminated and that sterility is maintained (e.g., if powdering the sugar).
- The evidence in this summary came from settings with limited access to wound care resources. Consider the medico-legal implications of using a sugar dressing in resource-rich settings.
- Optimal frequency of sugar dressing replacements is twice daily7, 13, 21, 26 to maintain sufficient osmolality and hydrogen peroxide production to sustain inhibition of bacteria22, 27. However, this is rarely possible in resource-limited settings7. Numerous studies reported wound dressing frequencies of up to 5 to 7 days4, 6, 7, 13, particularly after wound exudate reduces.
- Patient and health practitioner satisfaction levels were reported to be high in one study, and in this study feasibility of people performing their own sugar dressing in the community was demonstrated5.
- Sugar is reported to have a lower attraction to flies than honey, which may be a consideration when selecting a wound dressing in resource-limited settings28.
- Sugar paste was prepared by a hospital pharmacy from by using powdered, additive-free sugar combined with polyethylene glycol and hydrogen peroxide11, with ratio of ingredients varying based on the viscosity required for ease of application. Hydrogen peroxide is not recommended for use in cavity wounds and sterility might not be maintained when powdering the sugar.
- A cost comparison that considered cost of dressing materials and community nursing time for a four-month treatment regime in the 1980s in the UK reported a sugar paste dressing to be a cheaper option than gauze or paraffin gauze11.
Conflicts of interest
The author declares no conflicts of interest in accordance with International Committee of Medical Journal Editors (ICMJE) standards.
About WHAM evidence summaries
WHAM evidence summaries are consistent with methodology published in Munn Z, Lockwood C, Moola S. The development and use of evidence summaries for point of care information systems: A streamlined rapid review approach, Worldviews Evid Based Nurs. 2015;12(3):131-8.
Methods are outlined in resources published by the Joanna Briggs Institute16-18 and on the WHAM Collaborative website: http://WHAMwounds.com. WHAM evidence summaries undergo peer-review by an international, multidisciplinary Expert Reference Group. WHAM evidence summaries provide a summary of the best available evidence on specific topics and make suggestions that can be used to inform clinical practice. Evidence contained within this summary should be evaluated by appropriately trained professionals with expertise in wound prevention and management, and the evidence should be considered in the context of the individual, the professional, the clinical setting and other relevant clinical information.
Copyright © 2023 Wound Healing and Management Collaboration, Curtin Health Innovations Research Institute, Curtin University
Resumen de pruebas WHAM: apósito de azúcar para la cicatrización de heridas y el tratamiento de la infección de heridas en entornos con recursos limitados
Emily Haesler
DOI: https://doi.org/10.33235/wcet.43.2.35-40
Pregunta clinica
¿Cuál es la mejor evidencia disponible de que el apósito de azúcar mejora la cicatrización de la herida y reduce los signos y síntomas de infección de la herida?
Sumario
El azúcar blanco granulado/cristalizado es fácilmente accesible a bajo coste en la mayoría de las regiones geográficas. Se ha utilizado como tratamiento de heridas durante cientos de años porque es estéril, no tóxico, absorbe líquidos y tiene algunas propiedades antimicrobianas1. El azúcar se utiliza sobre todo en forma granulada, envasada en la cavidad de la herida y fijada con un apósito. Alternativamente, se muele en polvo, se combina con glicerina o vaselina y se aplica en forma de pasta1, 2. No había pruebas que compararan la eficacia del azúcar con los apósitos modernos que favorecen la cicatrización húmeda de las heridas. Las pruebas de nivel 1 3, 4 con alto riesgo de sesgo mostraron que el apósito de azúcar se asoció con tasas aceptables de cicatrización de heridas3, 4 y reducción de la infección de heridas4, pero podría no ser tan eficaz como la Solución de Cal de la Universidad de Edimburgo (EUSOL)3 o la miel4, que se utilizan habitualmente en entornos con recursos limitados. Las pruebas de nivel 35-7 y 48-15 con riesgo moderado o alto de sesgo proporcionaron pruebas de que el apósito de azúcar podría favorecer la cicatrización5, 6, 8, 9, 11-15, mejorar el tejido del lecho de la herida5, 9, 13-15 y reducir la infección bacteriana6, 12-15, el dolor de la herida5 y el mal olor de la herida7, 10.
Recomendaciones para la practica clinica
Todas las recomendaciones deben aplicarse teniendo en cuenta la herida, la persona, el profesional sanitario y el contexto clínico.
| El apósito de azúcar podría considerarse para su uso como apósito natural para heridas con el fin de reducir los signos y síntomas de infección y favorecer la cicatrización cuando el acceso a los apósitos modernos es limitado (Grado B). |
Fuentes de evidencias: busqueda y valoracion
Este resumen se realizó utilizando los métodos publicados por el Instituto Joanna Briggs16-18. El resumen se basa en una búsqueda bibliográfica sistemática que combina términos de búsqueda relacionados con apósitos de azúcar y cicatrización de heridas. Se realizaron búsquedas de pruebas que informaran sobre el uso de azúcar granulado en heridas humanas publicadas hasta diciembre de 2022 en inglés en las siguientes bases de datos: Indice acumulativo de la bibliografía sobre enfermería y profesiones afines (CINAHL), Medline (Ovid), Google Académico, Embase (Ovid), AMED e Iniciativa de acceso a la investigación a la red sanitaria (Hinari, acceso a través de Research4Life) y Biblioteca Cochrane. Los estudios sobre otras fuentes de azúcar (p. ej., miel) o azúcar combinado con povidona yodada (fórmula de Knutson) no fueron elegibles para su inclusión (excepto cuando se informó como comparador). Los niveles de evidencia de los estudios de intervención se recogen en la Tabla 1.
Tabla 1: Niveles de evidencia de los estudios clínicos

Antecedentes
El azúcar se ha utilizado desde finales del siglo XVII como limpiador de heridas y a principios del siglo XVIII como tratamiento para favorecer la cicatrización1, 22. Es fácilmente accesible a un coste muy bajo en la mayoría de las regiones geográficas. En su forma granulada/cristalizada, el azúcar se compone de glucosa y fructosa, unidas para formar sacarosa (un disacárido)13, 26. El azúcar está presente como monosacárido en otros tratamientos naturales, como la miel, la savia y la fruta22. En su forma cristalizada, el mecanismo del azúcar para la cicatrización de heridas es diferente al de la miel y las frutas. El azúcar cristalizado se utiliza a veces en combinación con povidona yodada para tratar las heridas29-33, y en algunos países se comercializa como pasta de azúcar-povidona yodada. La evidencia sobre el azúcar en otras formas naturales (p. ej., miel) y en combinación con povidona yodada no se recoge en este sumario de evidencia, excepto como comparador del apósito de azúcar.
Existen varios mecanismos a través de los cuales se supone que el azúcar blanco granulado favorece la cicatrización de las heridas. En primer lugar, el azúcar es higroscópico; p. ej, absorbe la humedad del entorno que le rodea, lo que contribuye a reducir el exudado de la herida22, 28. Esto también conduce al desbridamiento mecánico mediante la adherencia de la piel al apósito de azúcar para su eliminación sin dañar el tejido sano1, 3, 22. Además, la propiedad higroscópica del azúcar contribuye al desbridamiento autolítico13 y a la reducción del edema en el lecho de la herida y los tejidos circundantes1, 13.
El azúcar aumenta la osmolalidad del entorno de la herida, lo que influye en la actividad del nivel de agua. Este mecanismo atrae linfocitos y macrófagos al lecho de la herida1, y puede inhibir el crecimiento de bacterias5, 7, 25, 26. El azúcar también libera peróxido de hidrógeno a niveles bajos y no tóxicos, lo que inhibe aún más la actividad de las bacterias7, 13, 27. Los estudios in vitro han demostrado la actividad del azúcar frente a una serie de bacterias, como S. aureus, P aeruginosa, S. faecalis, E. coli, K. pneumoniae y C. albicans5, 8, 25; y esto se corroboró en un estudio in vivo del que se informa acontinuación4. En comparación con muchos otros antisépticos, el azúcar tiene una toxicidad baja y reduce el pH del lecho de la herida a alrededor de 5,0, que es más propicio para la cicatrización que un pH alcalino1, 7.
Pruebas clinicas sobre el aposito de azucar
Los estudios que informan de los resultados clínicos del tratamiento con apósitos de azúcar se resumen en la Tabla 2.
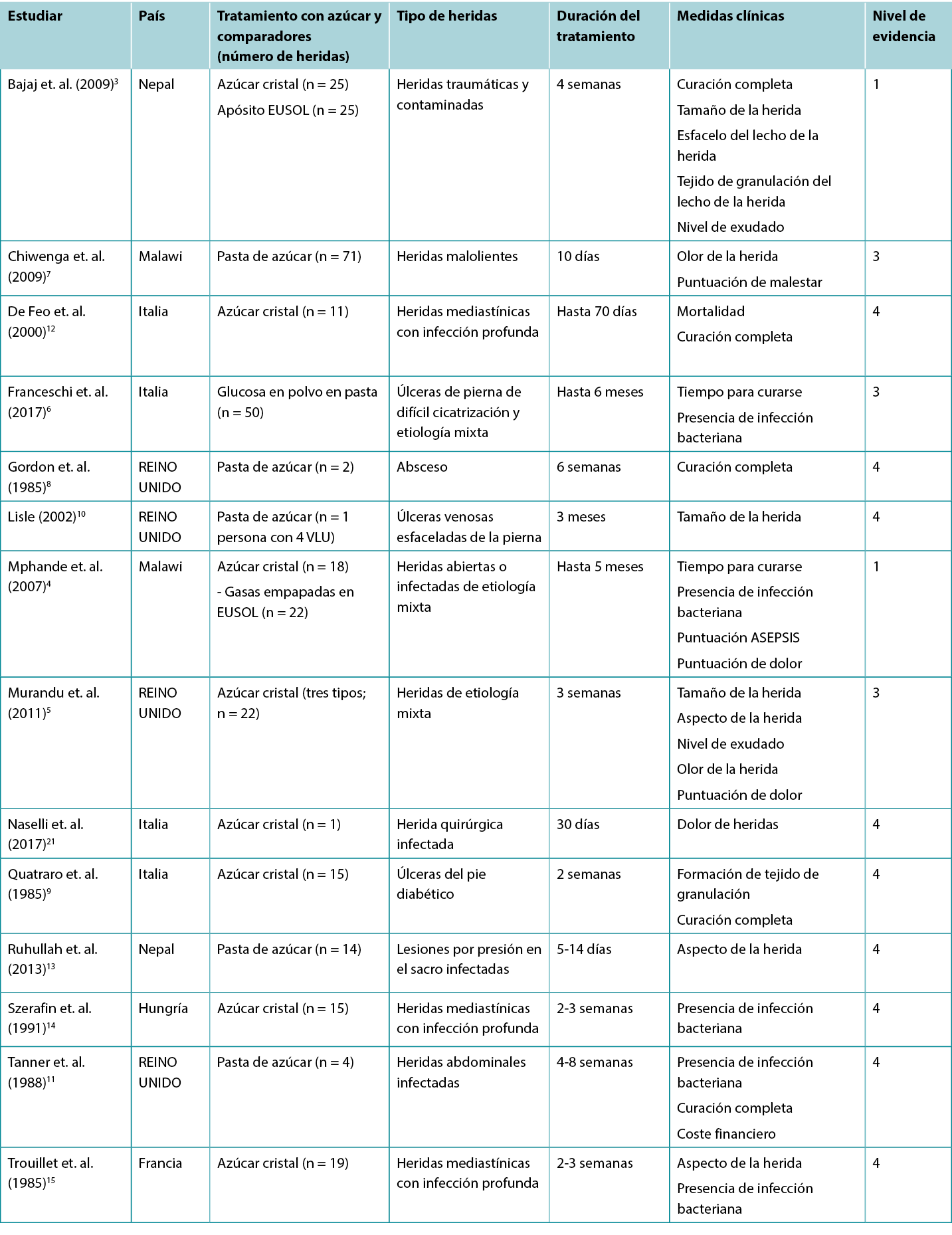
Tabla 2. Resumen de la evidencia sobre el apósito/pasta de azúcar tradicional
Apósito de azúcar para favorecer la cicatrización de las heridas
Un RCT3 (n = 50 heridas) con alto riesgo de sesgo comparó el apósito de azúcar con el apósito de EUSOL para el tratamiento de heridas traumáticas contaminadas asociadas a lesiones óseas. EUSOL es un hipoclorito tradicional fabricado a partir de cal clorada y ácido bórico34. En ambos grupos se lavaron las heridas con solución salina normal. El grupo del azúcar recibió azúcar blanco granulado más un apósito de gasa. El grupo EUSOL recibió un remojo EUSOL de 30 minutos seguido de un taponamiento con gasa EUSOL. Ambos grupos recibieron antibióticos sistémicos concurrentes basados en el cultivo y la sensibilidad de los organismos de las heridas. Tras cuatro semanas, ambos grupos presentaban buenas tasas de cicatrización, pero el grupo EUSOL mostró superioridad (77% cicatrizado frente a 66% cicatrizado, p < 0,05). El grupo EUSOL tenía una probabilidad 1,23 veces mayor de lograr la curación en cuatro semanas. El grupo EUSOL también obtuvo resultados superiores en otras medidas, como el tamaño de la herida y el tipo de tejido del lecho de la herida3 (Nivel 1).
Un segundo RCT4 (n = 40) con alto riesgo de sesgo comparó el apósito de azúcar con un apósito de miel en heridas abiertas o infectadas en niños y adultos. Se retiraron los restos con suero fisiológico y gasas y, a continuación, se taponaron las heridas con azúcar granulado o con gasas empapadas en miel. Los apósitos se realizaron inicialmente a diario, aumentando a semanales en función del estado de la herida. Tras dos semanas de tratamiento, la mediana de la tasa de cicatrización fue mayor en el grupo de la miel (3,8 cm2/semana frente a 2,2 cm2/semana, p = no comunicado). La mediana de tiempo hasta la cicatrización completa fue más corta en el grupo de la miel (31,5 días [intervalo 14 - 98] frente a 56 días [intervalo 21 - 133]). Ambos tratamientos se consideraron eficaces. Se informó de que la miel era superior; sin embargo, no se informó de ningún análisis estadístico que apoyara esta conclusión4 (Nivel 1).
En un estudio de prueba de concepto con alto riesgo de sesgo5, se trataron 22 heridas de etiología mixta con un apósito de azúcar durante tres semanas. Al inicio del estudio, las heridas presentaban tejido esfacelado/necrótico y niveles de exudado de moderados a elevados. Se limpiaron las heridas, se rellenaron con azúcar granulado y se aplicó una compresa absorbente, a diario o dos veces al día. Se observó una mejora progresiva del aspecto del lecho de la herida en todas las heridas a lo largo del breve periodo de estudio, así como una reducción de la superficie media de la herida (media basal: 34,7 cm2 [intervalo 6-144]; media a las 3 semanas: 28,9 cm2 (rango 4,63 - 142,4])5 (Nivel 3).
Varios estudios de casos8-11 con alto riesgo de sesgo informaron de la curación satisfactoria de heridas difíciles de cicatrizar con diversos preparados de azúcar. En uno8, dos personas con abscesos complejos que no habían logrado curarse previamente con desbridamiento quirúrgico y compresas de gasa EUSOL consiguieron una curación completa a las seis semanas de iniciar el tratamiento con pasta de azúcar (azúcar en polvo combinado con polietilenglicol y peróxido de hidrógeno)8. Quatraro et. al. (1985)9 informaron de que el empaquetamiento de úlceras diabéticas (n = 15) con azúcar sustituido cada 3 o 4 horas se asociaba a una granulación rápida del lecho de la herida (5 a 6 días) y a una cicatrización completa en 12 días9. En otro caso clínico10 se describió el uso de pasta de azúcar sustituida diariamente para reducir el mal olor de la herida y curar múltiples úlceras esfaceladas y de espesor parcial en las piernas de una persona. Por último, Tanner et. al. (1988)11 informaron de cuatro casos en los que se aplicó pasta de azúcar a heridas abdominales infectadas para lograr la cicatrización en un plazo de 4 a 8 semanas. En este informe, la pasta de azúcar más espesa se aplicó directamente a lechos de heridas abiertas, y una pasta de azúcar más fina (con mayor volumen de polietilenglicol y peróxido de hidrógeno) se instaló en cavidades de abscesos con una jeringa y un catéter11 (Nivel 4).
Apósito de azúcar para signos y síntomas de infección de la herida
En un estudio observacional6 (n = 50) con alto riesgo de sesgo, se seleccionaron úlceras de pierna de difícil cicatrización para el ensayo de un preparado de pasta con un 60% de azúcar en polvo y un 40% de vaselina. Al inicio del estudio se tomaron frotis de la herida, cuyos resultados mostraron la presencia de bacterias en el 100% de las úlceras. El tratamiento consistió en la limpieza de la herida con agua del grifo (sin desbridamiento), la aplicación semanal de la pasta de azúcar, el vendaje y un tratamiento basado en la etiología (p. ej terapia de compresión o corrección hemodinámica conservadora de la insuficiencia venosa [CHIVA]). Se realizó un segundo frotis de la herida a los 30-40 días; el 100% de las úlceras estaban libres de bacterias. La tasa de cicatrización completa fue del 96%, con un tiempo medio de cicatrización de 109 días6 (Nivel 3).
Otro estudio observacional7 (n = 71) con alto riesgo de sesgo exploró la pasta de azúcar para tratar el olor y el dolor de las heridas. Las heridas malolientes seleccionadas para el tratamiento tenían una puntuación media de olor inicial de 5,45 que se redujo a 2,94 a los diez días de tratamiento (puntuación valorada de 1 a 10, donde 10 era el peor olor). Las molestias valoradas por los pacientes se redujeron de una media de 6,73 a 3,87 (puntuación de 1 a 10, donde 10 era el peor dolor)7 (Nivel 3).
Una serie de casos12 (n = 11) con alto riesgo de sesgo informó de los resultados de la infección de la herida mediastínica tras cirugía cardíaca cuando se trató con apósito de azúcar. Al detectarse infección de la herida, se realizó exploración quirúrgica, desbridamiento e irrigación con povidona yodada, y la herida se cerró quirúrgicamente. Sin embargo, la infección de la herida no se resolvió en ninguno de los participantes. Se reabrió la herida esternal y se realizaron apósitos de azúcar hasta cuatro veces al día hasta la cicatrización completa o la reconstrucción con colgajo. El tiempo medio transcurrido hasta la resolución de la infección (basado en la evaluación microbiológica) tras el inicio del apósito de azúcar fue de 11,22 ± 1,6 días. La duración media del apósito de azúcar fue de 44 ± 27,8 días12 (Nivel 4). En un informe posterior19, 20 con riesgo moderado de sesgo, los investigadores compararon esta cohorte con otras dos cohortes con infección de la herida mediastínica tras cirugía cardiaca que recibieron diferentes tratamientos basados en una serie de protocolos estandarizados en el momento de su ingreso. Las tasas de mortalidad fueron significativamente mejores para el apósito de azúcar frente que para el tratamiento conservador/irrigación cerrada (30,6% frente a 2,4%, p < 0,05), pero la mortalidad fue mayor para las personas tratadas con vendaje con azúcar frente a la terapia de presión negativa para heridas (1,8% frente a 2,4%, p < 0,05)19. Sin embargo, todas las personas de este estudio estaban gravemente enfermas y no era evidente que el tipo de vendaje influyera en los resultados de mortalidad (nivel 3). Otras pequeñas series de casos con alto riesgo desesgo13-15 obtuvieron resultados clínicos similares tanto en heridas quirúrgicas14, 15 como en heridas crónicas13 utilizando apósitos de azúcar14, 15 o pasta13 para resolver la infección local de la herida, desbridar el lecho de la herida y promover la granulación como preparación para la reparación quirúrgica (Nivel 4).
El RCT4 que comparó los apósitos de azúcar con los de miel evaluó los signos y síntomas de infección con la evaluación microbiológica, la puntuación ASEPSIS y la evaluación del dolor (descrito categóricamente como sin dolor, dolor moderado o dolor intenso). Ambos grupos mostraron una reducción similar de los signos y síntomas de infección de la herida. Tras una semana de tratamiento, el porcentaje de heridas tratadas con azúcar que dieron cultivos positivos se redujo con respecto al valor inicial (del 52% al 39%). La mediana de la puntuación ASEPSIS de las heridas tratadas con azúcar mostró una reducción en las tres primeras semanas (8,3 puntos/semana) y también se redujo el porcentaje de personas que describían dolor intenso durante los cambios de apósito o con el movimiento4 (Nivel 1).
En el breve estudio de prueba de concepto descrito anteriormente, Murandu et. al. (2011)5 informaron de la resolución de los signos y síntomas de infección (p. ej exudado, mal olor y dolor en la herida). El mal olor se resolvió completamente a los siete días de tratamiento en las 11 heridas que se evaluaron como malolientes al inicio. Las 22 heridas presentaban niveles de exudado de moderados a elevados al inicio del ensayo; el exudado disminuyó en la primera semana y era inexistente o mínimo en todas las heridas al final del ensayo. Cinco personas declararon al inicio del estudio dolor que requería opiáceos, que se resolvió a los tres días del tratamiento5 (nivel 3).
Consideraciones de uso
Preparación y uso del apósito de azúcar
Los estudios incluidos en este sumario de evidencia utilizaron diversos métodos para aplicar azúcar a la herida. Algunos investigadores5, 9, 15 envasaron azúcar blanco granulado directamente en la cavidad de la herida y lo retuvieron con gasa, almohadilla absorbente, gasa seca o apósito adhesivo (véase en la Tabla 3 un ejemplo de método de aplicación recomendado24). Muranda et. al. (2011)5 describieron el uso de parafina amarilla para construir una "cresta" alrededor de las heridas en ubicaciones anatómicas incómodas (p. ej, talones) para ayudar aún más a retener el azúcar en la herida. En estos estudios, el empaquetado de azúcar directamente en la herida requería la sustitución del apósito azucarado al menos dos veces al día para mantener una cavidad de la herida bien empaquetada5, 9, 15, porque el azúcar se combina con el exudado de la herida y drena de la misma7. Otros investigadores describen la adición de glicerina o vaselina para hacer una pasta de azúcar que pudiera retenerse más fácilmente en la herida6-8, 13 y tuviera una consistencia que facilitara su aplicación7.
Tabla 3. Un método para aplicar azúcar a una herida

Efectos adversos
- Algunas personas refirieron un dolor urente al aplicar el apósito de azúcar que se resolvió rápidamente5, 7. También se ha descrito que el azúcar provoca picor en la piel periherida.24 Se cree que estos efectos se deben al efecto desecante que tiene el azúcar sobre el lecho de la herida y podrían reducirse utilizando una pasta de azúcar en lugar de azúcar granulado28.
- Los datos sobre el efecto de la aplicación tópica de azúcar en los niveles de azúcar en sangre de las personas con diabetes son contradictorios. El azúcar es un disacárido (p. ej, la glucosa y la fructosa se combinan para formar sacarosa) que se absorbe a través de los intestinos, por lo que teóricamente no debería influir en los niveles de azúcar en sangre cuando se aplica sobre el lecho de una herida1, 23, 35. Algunos estudios exploraron y confirmaron que la aplicación de azúcar en una herida no influye en los niveles de azúcar en sangre5, 15; sin embargo, hubo un informe de un caso en el que se observó un aumento del nivel de azúcar en sangre1, 22, y en otro estudio se administraron dosis más altas de insulina a personas con diabetes20.
- Existe un informe de insuficiencia renal aguda asociada a la pasta de azúcar23. En algunos de los informes12, 14, 15, las personas que tenían una herida tratada con apósito de azúcar murieron; sin embargo, estas personas tenían una enfermedad grave y es probable que la muerte no estuviera relacionada con el apósito de azúcar.
Otras consideraciones
- El azúcar blanco granulado se considera estéril. Hay que tener cuidado para garantizar que el producto utilizado no esté contaminado y que se mantenga la esterilidad (p. ej, si se espolvorea el azúcar).
- Los datos de este resumen proceden de entornos con acceso limitado a recursos para el cuidado de heridas. Considere las implicaciones médico-legales del uso de un apósito azucarado en entornos con pocos recursos.
- La frecuencia óptima de los recambios de apósitos de azúcar es de dos veces al día7, 13, 21, 26 para mantener una osmolalidad y una producción de peróxido de hidrógeno suficientes para mantener la inhibición de las bacterias22, 27. Sin embargo, esto rara vez es posible en entornos con recursos limitados7. Numerosos estudios informan de frecuencias de vendaje de heridas de hasta 5 a 7 días4, 6, 7, 13, sobre todo después de que se reduzca el exudado de la herida.
- Los niveles de satisfacción de pacientes y profesionales sanitarios fueron elevados en un estudio, y en este estudio se demostró la viabilidad de que las personas realicen su propio apósito de azúcar en la comunidad5.
- Según los informes, el azúcar atrae menos a las moscas que la miel, lo que puede ser una consideración a tener en cuenta a la hora de seleccionar un apósito para heridas en entornos con recursos limitados28.
- La pasta de azúcar se preparó en la farmacia de un hospital a partir de azúcar en polvo sin aditivos combinado con polietilenglicol y peróxido de hidrógeno11, variando la proporción de los ingredientes en función de la viscosidad necesaria para facilitar la aplicación. No se recomienda el uso de peróxido de hidrógeno en heridas cavitarias y podría no mantenerse la esterilidad al espolvorear el azúcar.
- Una comparación de costes en la que se tuvo en cuenta el coste de los materiales del apósito y el tiempo de enfermería comunitaria para un régimen de tratamiento de cuatro meses en la década de 1980 en el Reino Unido informó de que un apósito de pasta de azúcar era una opción más barata que la gasa o la gasa de parafina11.
Conflictos de intereses
Los autores declaran no tener conflictos de intereses de acuerdo con las normas del Comité Internacional de Editores de Revistas Médicas (ICMJE).
Sobre los resumenes de evidencia de la WHAM
Los resúmenes de evidencias de la WHAM son coherentes con la metodología publicada en Munn Z, Lockwood C, Moola S. El desarrollo y uso de resúmenes de evidencia para los sistemas de información de los puntos de atención: Un enfoque de revisión rápida racionalizado, Visiones del mundo Evid Based Nurs. 2015;12(3):131-8.
Los métodos se describen en los recursos publicados por el Instituto Joanna Briggs16-18 y en el sitio web de la Colaboración WHAM: http://WHAMwounds.com. Los resúmenes de evidencia de la WHAM son revisados por un Grupo de Referencia de Expertos internacional y multidisciplinar. Los resúmenes de evidencia de la WHAM proporcionan un resumen de la mejor evidencia disponible sobre temas específicos y hacen sugerencias que pueden ser utilizadas para informar la práctica clínica. La evidencia contenida en este resumen debe ser evaluada por profesionales debidamente formados y con experiencia en la prevención y el tratamiento de heridas, y la evidencia debe considerarse en el contexto del individuo, el profesional, el entorno clínico y otra información clínica relevante.
Copyright © 2023 Unidad de Curación y Gestión de Heridas, Instituto de Investigación de Innovaciones Sanitarias de Curtin, Universidad de Curtin
Author(s)
Emily Haesler
PhD P Grad Dip Adv Nurs (Gerontics), BN, FWA
Adjunct Professor, Curtin University, Curtin Health Innovation Research Institute, Wound Healing and Management (WHAM) Collaborative
References
- Biswas A, Bharara M, Hurst C, Gruessner R, Armstrong D, Rilo H. Use of sugar on the healing of diabetic ulcers: A review. J Diabetes Sci Technol, 2010; 4: 1139 - 45.
- Bitter CC, Erickson TB. Management of burn injuries in the wilderness: Lessons from low-resource settings. Wilderness Environ Med, 2016; 27(4): 519-25.
- Bajaj G, Karn NK, Shrestha BP, Kumar P, Singh MP. A randomised controlled trial comparing EUSOL and sugar as dressing agents in the treatment of traumatic wounds. Tropical Doctor, 2009; 39(1): 1-3.
- Mphande AN, Killowe C, Phalira S, Jones HW, Harrison WJ. Effects of honey and sugar dressings on wound healing. J Wound Care, 2007; 16(7): 317-9.
- Murandu M, Webber M, Simms M, Dealey C. Use of granulated sugar therapy in the management of sloughy or necrotic wounds: A pilot study. J Wound Care, 2011; 20(5): 206-16.
- Franceschi C, Bricchi M, Delfrate R. Anti-infective effects of sugar-vaseline mixture on leg ulcers. Veins and Lymphatics, 2017; 6(2).
- Chiwenga S, Dowlen H, Mannion S. Audit of the use of sugar dressings for the control of wound odour at Lilongwe Central Hospital, Malawi. Tropical Doctor, 2009; 39(1): 20-2.
- Gordon H, Middleton K, Seal D, Sullens K. Sugar and wound healing. Lancet, 1985; 2(8456): 663-5.
- Quatraro A, Minei A, Donzella C, Caretta F, Consoli G, Giugliano D. Sugar and wound healing. Lancet, 1985; 2(8456): 665.
- Lisle J. Use of sugar in the treatment of infected leg ulcers. Br J Community Nurs, 2002; 7(6 Suppl): 40, 2, 4, 6.
- Tanner A, Owen E, Seal D. Successful treatment of chronically infected wounds with sugar paste. Eur J Clin Microbiol Infect Dis, 1988; 7(4): 524-5.
- De Feo M, Gregorio R, Renzulli A, Ismeno G, Romano GP, Cotrufo M. Treatment of recurrent postoperative mediastinitis with granulated sugar. J Cardiovasc Surg, 2000; 41(5): 715-9.
- Ruhullah M, Sanjay S, Singh H, Sinha K, Irshad M, Abhishek B, Kaushal S, Shambhu S. Experience with the use of sugar paste dressing followed by reconstruction of sacral pressure sore with V-Y flap: A reliable solution for a major problem. Medical Practice and Reviews 2013; 4(4): 23-6.
- Szerafin T, Vaszily M, Péterffy A. Granulated sugar treatment of severe mediastinitis after open-heart surgery. Scand J Thorac Cardiovasc Surg, 1991; 25(1): 77-80.
- Trouillet JL, Chastre J, Fagon JY, Pierre J, Domart Y, Gibert C. Use of granulated sugar in treatment of open mediastinitis after cardiac surgery. Lancet, 1985; 2(8448): 180-4.
- Aromataris E, Munn Z (editors). Joanna Briggs Institute Reviewer’s Manual. https://reviewersmanual.joannabriggs.org/ The Joanna Briggs Institute, 2017.
- Joanna Briggs Institute Levels of Evidence and Grades of Recommendation Working Party. New JBI Grades of Recommendation. Adelaide: Joanna Briggs Institute, 2013.
- The Joanna Briggs Institute Levels of Evidence and Grades of Recommendation Working Party. Supporting Document for the Joanna Briggs Institute Levels of Evidence and Grades of Recommendation. www.joannabriggs.org: The Joanna Briggs Institute, 2014.
- De Feo M, Vicchio M, Santè P, Cerasuolo F, Nappi G. Evolution in the treatment of mediastinitis: single-center experience. Asian Cardiovasc Thorac Ann, 2011; 19(1): 39-43.
- De Feo M, Gregorio R, Della Corte A, Marra C, Amarelli C, Renzulli A, Utili R, Cotrufo M. Deep sternal wound infection: the role of early debridement surgery. Eur J Cardiothorac Surg, 2001; 19(6): 811-6.
- Naselli A, Accame L, P. B, Loy A, Bandettini R, Garaventa A, Alberighi O, Castagnola E. Granulated sugar for adjuvant treatment of surgical wound infection due to multi-drug-resistant pathogens in a child with sarcoma: a case report and literature review. Le Infezioni in Medicina, 2017; 4(35): 358-61.
- Pieper B, Caliri M. Nontraditional wound care: A review of the evidence for the use of sugar, papaya/papain, and fatty Aacids. J Wound Ostomy Cont Nurs, 2003; 30: 175–83.
- Valls L, Altisen M, Poblador R, Alvarez A, Biosca R. Sugar paste for treatment of decubital ulcers. J Pharm Technol, 1996; 12: 289 - 90.
- International Committee of the Red Cross (ICRC). ICRC Nursing Guideline 3: Sugar Dressing. IN: ICRC Nursing Guidelines. Geneva, Switzerland: ICRC; 2021.
- Chirife J, Herszage L, Joseph A, Kohn ES. In vitro study of bacterial growth inhibition in concentrated sugar solutions: microbiological basis for the use of sugar in treating infected wounds. Antimicrob Agents Chemother, 1983; 23(5): 766-73.
- Middleton KR, Seal DV. Development of a semi-synthetic sugar paste for promoting healing of Iinfected wounds. In: Wadström T, Eliasson I, Holder I, Ljungh Å, editors. Pathogenesis of Wound and Biomaterial-Associated Infections. London: Springer London; 1990. p. 159-62.
- Molan P, Cooper R. Honey and sugar as a dressing for wounds and ulcers Tropical Doctor, 2000; 30(4): 249-50.
- Tovey F. Honey and sugar as a dressing for wounds and ulcers. Tropical Doctor, 2000; 30: 1.
- Di Stadio A, Gambacorta V, Cristi MC, Ralli M, Pindozzi S, Tassi L, Greco A, Lomurno G, Giampietro R. The use of povidone-iodine and sugar solution in surgical wound dehiscence in the head and neck following radio-chemotherapy. Int Wound J, 2019; 16(4): 909-15.
- Knutson RA, Merbitz LA, Creekmore MA, Snipes HG. Use of sugar and povidone-iodine to enhance wound healing: five year’s experience. South Med J, 1981; 74(11): 1329-35.
- Nakao H, Yamazaki M, Tsuboi R, Ogawa H. Mixture of sugar and povidone - Iodine stimulates wound healing by activating keratinocytes and fibroblast functions. Arch Dermatol Res, 2006; 298(4): 175-82.
- Shimamoto Y, Shimamoto H, Fujihata H. Topical application of sugar and povidone-iodine in the management of decubitus ulcers in aged patients. Hiroshima Journal of Medical Sciences, 1986; 35(2): 167-9.
- Topham J. Sugar paste and povidone-iodine in the treatment of wounds. J Wound Care, 1996; 5(8): 364-5.
- Haesler E, Carville K. WHAM evidence summary: traditional hypochlorite solutions. WCET® Journal, 2023; 43(1): 35-40.
- Bogdanov S, Jurendic T, Sieber R, Gallmann P. Honey for nutrition and health: a review. J Am Coll Nutr, 2008; 27(6): 677-89.




