Volume 44 Number 3
Examining the association of immunosuppressants and wound healing: a narrative review
Aria Appoo, Brandon L Christensen, Ranjani Somayaji
Keywords wound healing, Calcineurin inhibitors, glucocorticoids, immunosuppressants, monoclonal antibodies, mTOR inhibitors
For referencing Appoo A, Christensen BL, Somayaji R. Examining the association of immunosuppressants and wound healing: a narrative review. WCET® Journal 2024;44(3):12-19.
DOI 10.33235/wcet.44.3.12-19
Abstract
Objective To review how different classes of immunosuppressants affect wound healing.
Data Sources A literature search was conducted in PubMed, Google Scholar, and the University of Calgary Health Sciences Library.
Study Selection The researchers initially screened article titles using key words such as “immunosuppressive medication,” “wound healing,” and “immunosuppression.” Articles in which the title and/or abstract contained these key words, that addressed wound healing related to immunosuppressant medications, and were published after 2000 were included in the review. When human data were not available for an immunosuppressant (class), animal studies were included.
Data Extraction The 61 included articles underwent full text review and summarisation.
Data Synthesis: All included studies were summarised descriptively including immunosuppressive mechanism of action, study participants or subjects, and evidence of effects on wound healing.
Conclusions Corticosteroids and mechanistic target of rapamycin inhibitors most consistently demonstrate detrimental effects on wound healing. For other classes of immunosuppressants, evidence is limited with varying effects on wound healing described. Larger, high-quality studies are required to better understand the effects of immunosuppressants, including those with new mechanisms of action, to identify those with the most impact on wound healing.
Introduction
Immunosuppressants are medications with a variety of indications including in solid organ and hematopoietic transplants and autoimmune diseases. They function by suppressing the activity of various components of the adaptive immune system, thus diminishing the cascade of inflammatory response to normal host tissue or modulating the natural rejection response to transplanted materials.1 The main classes of immunosuppressants are corticosteroids/glucocorticoids,2,3 calcineurin inhibitors (CNIs),2,4,5 mechanistic target of rapamycin (mTOR) inhibitors,2,4 monoclonal antibodies (mAbs),2,4 polyclonal antibodies (pAbs),2,4 and antiproliferative agents.2 For the purpose of this review, wounds are defined as an opening in the skin as a result of surgery, trauma, or disease that is susceptible to infection.
The immune system plays an important role in infection prevention as well as the healing process of wounds; inflammatory effects lead to cellular proliferation and secretion of important intracellular and extracellular components.6 With immunosuppressants, the immune system is modulated, thus potentially affecting a wound’s healing time and susceptibility to infection.7 With a growing number of patients on immunosuppressing medications, particularly patients postsurgical transplant, the effect of immunosuppressants on wound healing is an important issue. This review article aims to provide clinicians with an understanding of how different classes of immunosuppressants affect wound healing.
Methods
The authors conducted a literature search using the generic names of several common immunosuppressants (glucocorticoids/corticosteroids, mTOR inhibitors, methotrexate, mAbs, pAbs, CNIs, mycophenolate, azathioprine), as well as the terms “wound healing” and “immunosuppression.” The primary database searched was PubMed, supplemented by Google Scholar and the University of Calgary Health Science Library database. When possible, the search formatted as follows: “immunosuppressant name [MeSH Terms] AND “wound healing [MeSH Terms].” If the immunosuppressant name was not available as a MeSH term, then the term was searched with no restriction applied. The search was limited to articles in English published between 2000 and 2021.
The researchers screened article titles and abstracts for relevance. Articles were considered relevant if they compared various immunosuppressants, discussed their effects on wound healing, and measured wound healing or reported deleterious effects on wounds. If search terms did not identify any studies with human participants, the authors then included studies that used animals to evaluate the immunosuppressive effects of a given drug class on wound healing. When no data were available from 2000 onward, researchers conducted a historic search for the relevant immunosuppressive medications.
All included studies were summarised descriptively including immunosuppressive mechanism of action, study participants/subjects, and evidence of effects on wound healing.
Results
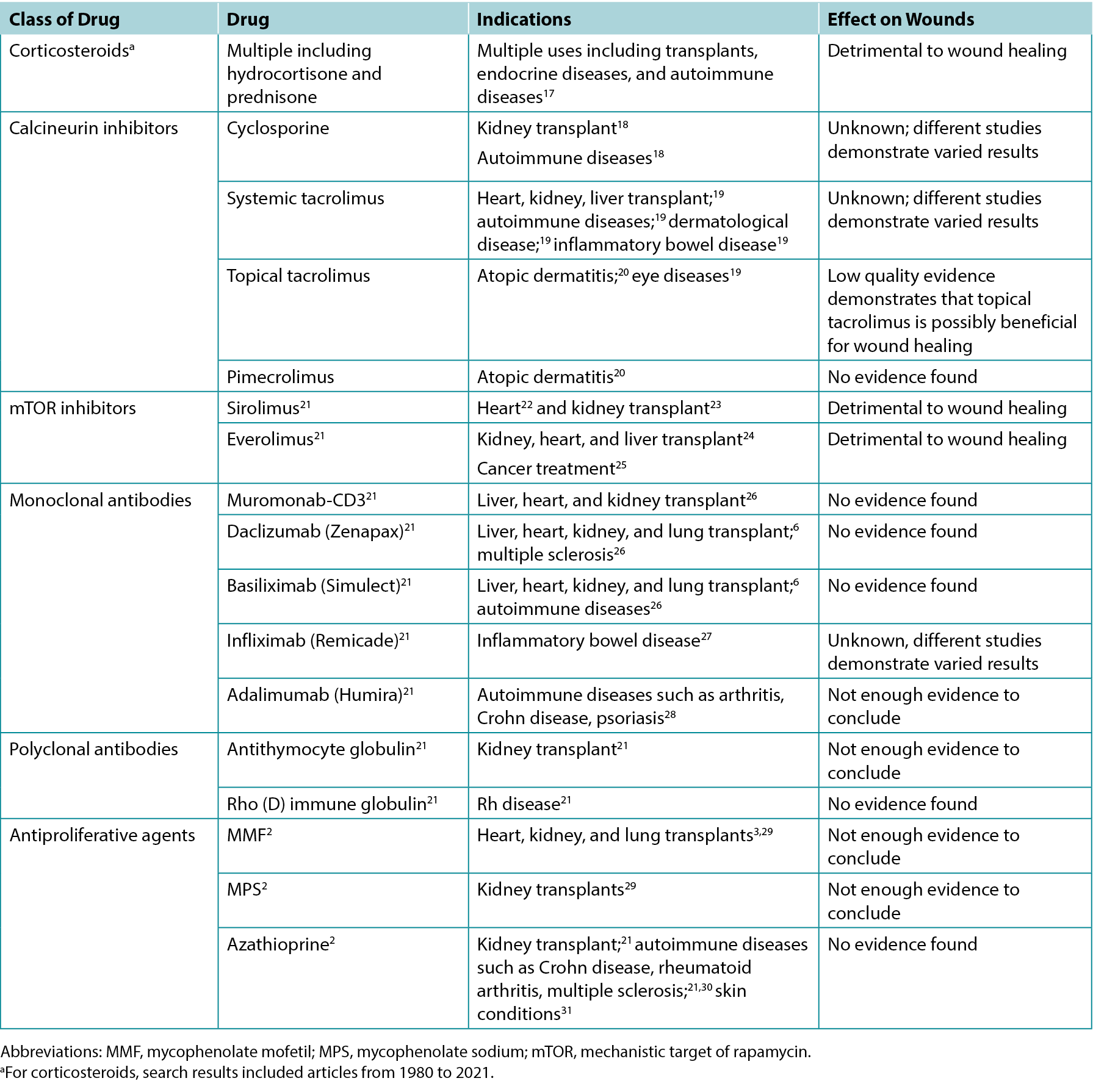
The authors screened 200 article titles and abstracts, and of these, 61 articles were included in the review. Table 1 highlights the results of select clinical and animal studies. The specific indications for various immunosuppressants including their possible impacts on wounds are outlined in Table 2.
Table 1. Select studies comparing the effects of different immunosuppressants on wound healing
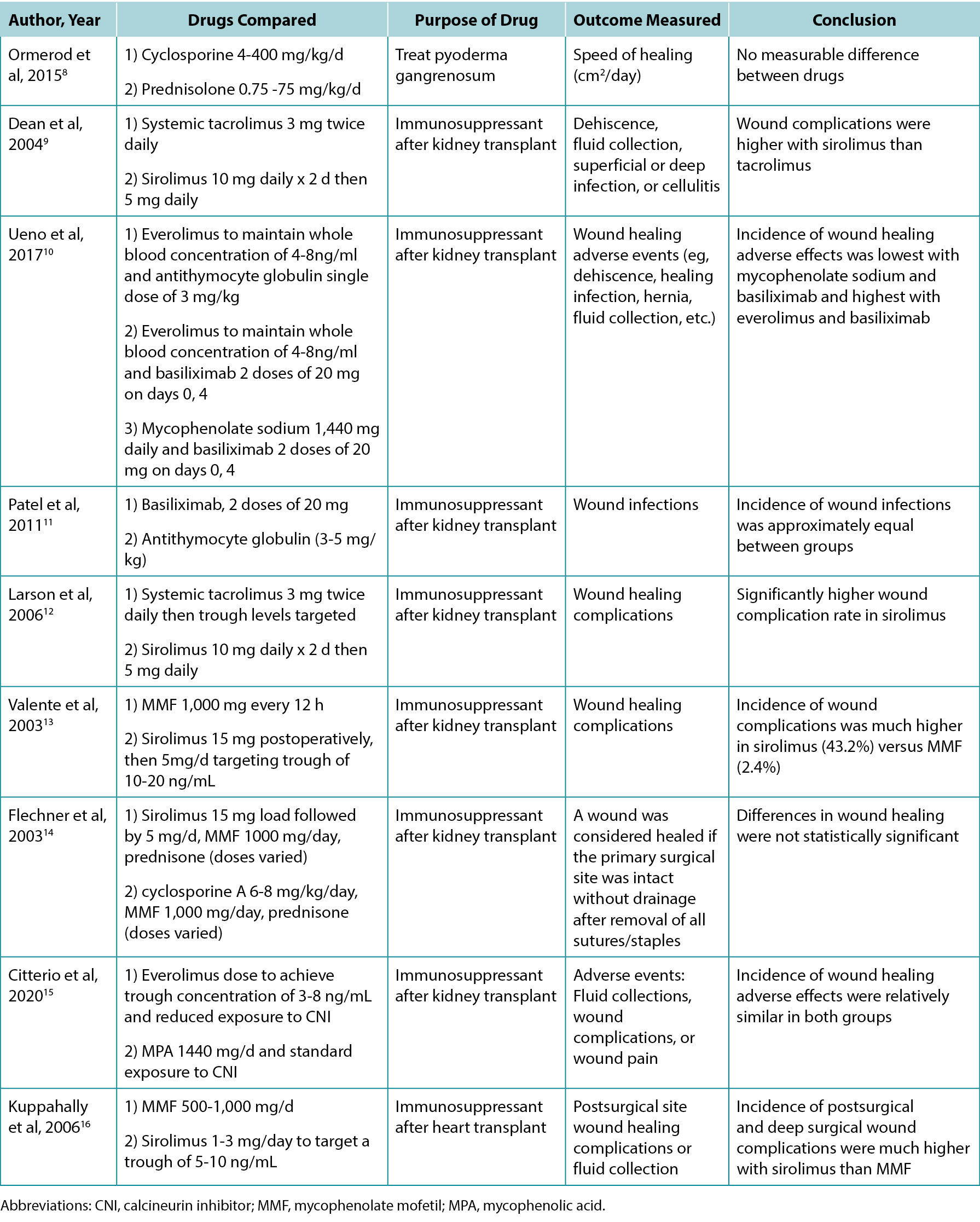
Table 2. Overview of indications and wound effects of various immunosuppressants
Calcineurin inhibitors
Calcineurin inhibitors are used for a variety of autoimmune diseases, organ transplants, dermatologic conditions, and chronic wounds.32 There are three main types of CNIs: cyclosporine (systemic), tacrolimus (systemic and topical), and pimecrolimus (topical).33 They work by binding to part of the calcineurin molecule found in human cells, thus stopping the release of certain cytokines that are responsible for activating T cells.32 Therefore, CNIs disable one of the main arms of the body’s adaptive immune response.
Systemic. Few studies have focused on the effects of CNIs on wound healing in humans; however, many basic science studies on animals have been performed. Two such studies using rats compared the effect of various doses of systemic tacrolimus versus a control, testing the breaking strengths of the wounds created through surgery.7,34 Willems et al7 concluded that tacrolimus does not affect wound healing, whereas Schäffer et al34 concluded that tacrolimus is detrimental to wound healing. In a case report using systemic tacrolimus as a treatment for ulcers in a person with lichen planus and pyoderma gangrenosum, Miller35 demonstrated treatment success with this therapy.
No recent human studies have investigated the effect of cyclosporine on wound healing, and two studies using rat models yielded contradictory results. These rat studies focused on the effects of cyclosporine on different markers in the body that signify effective wound healing.36,37 Nemlander et al36 compared cyclosporine to methylprednisolone and found that cyclosporine A had no suppressive effect on various inflammatory and biochemical markers in comparison with the glucocorticoid therapy. In contrast, Petri et al37 found that cyclosporine A had a negative effect on other markers within granulation fibroblasts, most notably activin A among procollagen 1, integrin 1, interleukin 6, transforming growth factor 1, and keratinocyte growth factor. In another animal study, Goldberg et al38 assigned dogs to one of three groups – no immunosuppression, methylprednisolone plus azathioprine, or cyclosporine A – after a lung transplant. They found that cyclosporine A had no significant effect on the healing of the surgical wound as measured by breaking strength in comparison with glucocorticoid and azathioprine immunosuppression. Overall, the literature on systemic CNIs and wound healing is limited with a heterogeneity of comparators and mixed results on wound healing.
Topical. Topical CNIs (tacrolimus and pimecrolimus) are often used for dermatologic conditions such as atopic dermatitis or pyoderma gangrenosum.20,39,40 Some case studies have shown that tacrolimus is effective at healing complex leg ulcers in the context of venous insufficiency or necrobiosis lipoidica when regular treatment strategies have been ineffective.41,42 Further, a rat-based study with acute cutaneous injury demonstrated that wounds treated with topical tacrolimus versus control (petrolatum) did not differ in healing speed.43
Monoclonal antibodies
There are a variety of different mAb therapies with indications in transplants and autoimmune disorders such as rheumatoid arthritis and psoriasis.21 In general, mAbs work by binding to different receptors and antigens to inhibit the effect of cytokines and other signal pathways that activate the immune system.21 In a small prospective cohort study among patients with rheumatoid arthritis undergoing orthopedic surgery, Bibbo and Goldberg44 found that there was no increased risk of surgical wound infections or healing complications in patients on infliximab versus conventional therapy. Further, Streit et al45 reported a case in which topical infliximab was helpful in healing leg ulcers that were resistant to standard treatment, suggesting that inhibiting tumor necrosis factor α is helpful for wound healing. Similarly, there was a case report that treated pyoderma gangrenosum with infliximab resulting in ulcer improvement.46 Inhibiting tumor necrosis factor α was further associated with wound healing in venous leg ulcers through the systemic use of adalimumab.47 However, a study that used infliximab on rat abdominal wounds found that tensile strength was significantly lower in the wounds of rats who had been given infliximab versus control.48 Overall, the literature is limited but suggests clinical outcomes may be favourable in terms of wound healing.
Polyclonal Antibodies
Polyclonal antibodies are very similar to mAbs in function, with slightly varied mechanism of action.49,50 Unlike mAbs, a group of pAbs is created from many different lines of B cells, and different pAbs bind to different epitopes of an antigen. In contrast, mAbs come from a single line of B cells and can bind to only one antigen.49,50
There are two main pAbs: antithymocyte globulin (also known as antihuman thymocyte globulin) and rho (ρ) immune globulin.21 Antithymocyte globulin is most commonly used as an immunosuppressant after kidney transplantation and works by binding to a variety of lymphocytes and depleting the number of T cells in the body.21 Rho immune globulin is used in pregnancies in which the gestational parent is Rh- and the fetus is Rh+ to essentially stop the formation of anti-Rh+ antibodies in the mother.21
Few studies have investigated the effects of pAbs on wound healing. However, two studies outlined the effects of antithymocyte globulin and basiliximab. Ueno et al10 investigated the use of these drugs combined with everolimus in patients with renal transplants. They reported higher rates of adverse effects on wound healing with basiliximab.10 Patel et al11 demonstrated that the incidence of wound infections was equal in patients taking basiliximab versus antithymocyte globulin after renal transplant. White blood cells play a key role in wound healing by secreting necessary cytokines and preventing infection51; thus, it is reasonable to hypothesise that antithymocyte globulin would affect wound healing because it reduces the number of white blood cells and their regulatory mechanisms.
mTOR Inhibitors
Mechanistic target of rapamycin inhibitors interact with proteins in complex signaling pathways to prevent cells from moving into the S phase of the cell cycle and therefore suppressing proliferation.3,21 Although mTOR predominantly targets T cells, it can also affect B cells.3 Interestingly, mTOR can increase production of certain inflammatory cytokines such as interleukin 6 and decrease production of interleukin 10, an anti-inflammatory cytokine.3 There are two main mTOR inhibitors: sirolimus and everolimus.3,21 In general, mTOR inhibitors have a variety of applications including cancer therapy and after transplants.3,21 Everolimus inhibits the proliferation of fibroblasts in in vitro models,52 suggesting that it could have negative consequences for wound healing because fibroblasts are essential for creating an extracellular matrix and scaffolding other cells.53 In a study comparing sirolimus and systemic tacrolimus, sirolimus had a wound complication rate of 47%, whereas the rate with tacrolimus was only 8%.9 This is consistent with another study by Larson et al12 demonstrating more frequent wound complications with sirolimus compared with tacrolimus. Those authors found that patients with obesity who were on sirolimus had very high rates of wound complications; as a result, the authors excluded all patients with obesity from the study.12 In line with previous findings, a study on rats showed that increased sirolimus doses decreased breaking strength.54 The authors hypothesised that this effect may be caused by lower levels of vascular endothelial growth factor and nitric oxide in rats receiving higher doses of sirolimus.54 In a review article, Nashan and Citterio55 concluded that mTOR inhibitors are harmful to wound healing in high doses, but seem to have a neutral effect in low does. Given early concerns with mTOR inhibitors and wound healing, regimens using these immunosuppressive agents have evolved with lower doses of the mTOR inhibitors and combination therapy. In the large TRANSFORM (Advancing renal TRANSplant eFficacy and safety Outcomes with an eveRoliMus-based regimen) randomised controlled trial, Citterio et al15 compared everolimus plus reduced-dose CNI with mycophenolic acid plus standard-dose CNI (standard care) in patients with renal transplants. They found that wound-related adverse events did not differ between groups (20.6% vs 17.3%; risk ratio, 1.19; 95% CI, 0.99 to 1.43).15 One limitation of this study was close monitoring of everolimus concentrations and difficulties achieving the targeted plasma concentrations C0 between 3 and 8 ng/mL.15 Overall, the current literature suggests that mTOR inhibitors have a detrimental effect on wound healing, especially at higher doses, and that improved dosing regimens may lessen or mitigate this risk.
Antiproliferative agents
There are three regularly used antiproliferative agents: mycophenolate mofetil (MMF), mycophenolate sodium (MPS), and azathioprine.2,29 Both MMF and MPS are inosine monophosphate dehydrogenase inhibitors. They have a similar effect to mTOR inhibitors in terms of their mechanism of immunosuppression. In the body, MMF and MPS are converted into mycophenolic acid, which blocks a portion of a pathway that is crucial for DNA synthesis to decrease proliferation of T and B cells.2,5,29 Whereas MMF is used for its immunosuppressive effect in heart, kidney, and lung transplants,3,29 MPS is used for kidney transplants.29 Azathioprine is used as an immunosuppressive drug for kidney transplants as well as autoimmune diseases, including rheumatoid arthritis, Crohn disease, and multiple sclerosis.21,30 Azathioprine reacts with glutathione in the body and is converted into 6-mercaptopurine. Additional metabolites are then generated, ultimately blocking purine synthesis and T-cell stimulation.3,21
In a study comparing two different doses of MMF in kidney transplant recipients, Flechner et al56 found no significant difference in the incidence of wounds requiring surgical intervention, similarly for wounds treated with local wound care. In analysing article titles for the present review, the authors did not find any studies regarding the sole effect of azathioprine on external wound healing in humans. However, Ginestal et al57 compared the effects of azathioprine versus placebo in a rat study. They found that the wounds of the rats who were on azathioprine took longer to heal than those on the placebo, suggesting that azathioprine may have detrimental effects on wound healing, but the extent that it would affect humans is unclear.57
Antimetabolite
Methotrexate is a commonly used folate antagonist with indications in many rheumatologic disorders. It also has antineoplastic activity in higher doses. Upon absorption, it enters the cell and is converted to methotrexate polyglutamates where it competes for dihydrofolate reductase, thus preventing the transformation of folic acid for its use in the building of nucleic acids.6 Experimental in vitro animal studies suggest that methotrexate may impair wound healing, but these effects have not been borne out in clinical studies, particularly in postsurgical wounds.6 Thus, it is recommended that this drug be continued postoperatively.
Corticosteroids/Glucocorticoids
Glucocorticoids prevent the formation of inflammatory chemicals such as cytokines, cell-adhesion molecules, and complement factors.3 By inhibiting interleukin 2 formation, glucocorticoids also prevent T-cell proliferation and activation.21 They also impair monocytes and B cells.3,21 Glucocorticoids were the first antirejection drugs created; however, there has been a movement to phase them out because of their serious adverse effects.3,21 Glucocorticoids are highly detrimental to wound healing because they interfere with many key stages, such as collagen deposition and synthesis, angiogenesis, fibroblast proliferation, growth factors, and phagocytosis, among others.2,3,58,59
Practical considerations for healthcare providers
Persons with compromised immune systems (due to medications, comorbidities, or age) require additional considerations for chronic wound management. Specific to immunosuppressive medications, healthcare providers should take a careful history not only of the medications and dosing (including changes in dosing), but also of the underlying conditions requiring these medications (eg, autoimmune disorders, organ transplantation). Because many immunosuppressive medications can impair wound healing, it is crucial for healthcare providers to assess healing potential early on to set and manage patient expectations. Early referral to medical or surgical specialists to assist with wound care and a team-based approach is essential, given the increased complexity of caring for these individuals. In cases when wounds are not healing, set alternate goals of care for the wound with the patient (eg, maintenance or nonhealable) if immunosuppressive doses cannot be reduced (assuming it is contributing to poor healing); undertake changes in consultation with the patient’s primary or specialist care providers. As individuals and populations with comorbidities live longer, caring for persons with chronic wounds on immunosuppressive medications will become increasingly common and wound care clinicians must be proactive in managing these patients.
Discussion
With the ongoing advances in medicine, the need for immunosuppression in the context of transplant, autoimmune disease, and malignancy has increased. This review highlights the paucity of robust studies in this field and the mixed effects of various immunosuppression on wound healing. High-quality evidence exists with respect to the deleterious effects of glucocorticoid therapy and mTOR therapy (particularly sirolimus) on wound healing. Four studies compared sirolimus with either MMF or systemic tacrolimus, and all four demonstrated that sirolimus was associated with an increased incidence of wound complications.9,12,13,16
The literature on agents such as systemic CNIs is mixed, with some suggesting adverse effects on wounds and others suggesting benefits; additional research focusing on this question is needed. Newer topical CNIs have shown little impact on delayed wound healing and, in some cases, may benefit healing, but additional investigation is warranted for their use in chronic wounds directly. Studies indicate that antiproliferative agents, antimetabolites, and newer mABs do not negatively impact wound healing. However, additional research is needed, given the lack of evidence on wound healing in mAB therapy.
Overall, the evidence in this area is limited and draws variable conclusions surrounding the effects of immunosuppressants on wound healing. In particular, few studies have included human participants. In general, when immunosuppressives are prescribed after transplants to prevent rejection, patients take more than one drug to effectively prevent rejection. Therefore, challenges exist in performing human studies evaluating the effects of individual drugs in isolation.
Because this was not a systematic review, the authors may not have identified all relevant articles. However, as one form of validation, the authors identified a few key reviews before conducting the literature search and then ensured these articles appeared in the search as expected. Given the paucity of literature in this area, particularly as it relates to the wound care field, a narrative review adds value to educate and increase awareness when working with individuals on these medications.
With the growing need for immunosuppression, additional study in this field is critical. Future research should investigate newer classes of immunosuppressants in animal models to identify potential pathways to delayed wound healing and potential ways to mitigate such effects. Further, additional high-quality human studies that evaluate both individual and combination immunotherapies are required to better understand the risks and how different immunosuppressants may impact wound healing. To explore immunosuppressants as a potential treatment for chronic or complex wounds, it is important for future studies to be conducted on a large scale and control for confounding clinical factors, such as through randomised controlled trials.
Conclusions
Immunosuppressants range from possibly beneficial to clearly deleterious in terms of wound healing. There is little conclusive evidence in this field, and the effects of immunosuppressants on wound healing are worth exploring further to better tailor immunosuppression to patients at risk for or experiencing chronic, nonhealing wounds. Some immunosuppressants may offer benefits in wound treatment when conventional therapies have failed, opening up the possibility of a new treatment option for wounds.
Acknowledgments
Alberta Innovates High School Youth Research Summer (HYRS) Program, which provided an educational stipend to the lead author for her work on this and other projects.
Conflict of Interest
The authors declare no conflicts of interest.
Funding
The authors have disclosed no financial relationships related to this article.
Examen de la asociación entre inmunosupresores y curación de heridas: una revisión narrativa
Aria Appoo, Brandon L Christensen, Ranjani Somayaji
DOI: 10.33235/wcet.44.3.12-19
Resumen
Objetivo Revisar cómo afectan las diferentes clases de inmunosupresores a la curación de heridas.
Fuentes de datos Se realizó una búsqueda bibliográfica en PubMed, Google Scholar y la Biblioteca de Ciencias de la Salud de la Universidad de Calgary.
Selección de estudios Los investigadores examinaron inicialmente los títulos de los artículos utilizando palabras clave como "medicación inmunosupresora", "curación de heridas" e "inmunosupresión" Si el título y/o el resumen contenían estas palabras clave y abordaban la curación de heridas relacionada con la medicación inmunosupresora y se habían publicado después del 2000, se incluyeron en la revisión. Cuando no se disponía de datos en humanos para un inmunosupresor (clase), se incluyeron estudios en animales.
Extracción de datos Los 61 artículos incluidos se sometieron a revisión y resumen del texto completo.
Síntesis de datos Todos los estudios incluidos se resumieron de forma descriptiva, incluyendo el mecanismo de acción inmunosupresor, los sujetos de estudio y las pruebas de los efectos sobre la curación de heridas.
Conclusiones Los corticosteroides y los inhibidores del blanco faramacodinámico de la rapamicina son los que demuestran de forma más sistemática efectos perjudiciales sobre la cicatrización de heridas. Para otras clases de inmunosupresores, la evidencia es limitada y se han descrito efectos variables sobre la curación de heridas. Se necesitan estudios más amplios y de mayor calidad para comprender mejor los efectos de los inmunosupresores, incluidos aquellos con nuevos mecanismos de acción, a fin de identificar aquellos con mayor impacto en la curación de heridas.
Introducción
Los inmunosupresores son medicamentos con diversas indicaciones, como los trasplantes de órganos sólidos y hematopoyéticos y las enfermedades autoinmunes. Funcionan suprimiendo la actividad de diversos componentes del sistema inmunitario adaptativo, disminuyendo así la cascada de respuesta inflamatoria al tejido normal del huésped o modulando la respuesta natural de rechazo a los materiales trasplantados.1 Las principales clases de inmunosupresores son los corticosteroides/glucocorticoides,2,3 los inhibidores de la calcineurina (CNIs),2,4,5 los inhibidores del blanco faramacodinámico de la rapamicina (mTOR),2,4 los anticuerpos monoclonales (mAbs),2,4 los anticuerpos policlonales (pAbs),2,4 y los agentes antiproliferativos.2 A efectos de esta revisión, las heridas se definen como una abertura en la piel como consecuencia de una intervención quirúrgica, un traumatismo o una enfermedad susceptible de infección.
El sistema inmunitario desempeña un papel importante en la prevención de infecciones, pero también en el proceso de curación de las heridas, ya que los efectos inflamatorios conducen a la proliferación celular y a la secreción de importantes componentes intra y extracelulares.6 Con los inmunosupresores, el sistema inmunitario se modula, lo que puede afectar al tiempo de curación de una herida y a la susceptibilidad a la infección.7 Con un número creciente de pacientes que reciben medicación inmunosupresora, en particular pacientes posquirúrgicos trasplantados, el efecto de los inmunosupresores sobre la curación de heridas es una cuestión importante que debe tenerse en cuenta. El objetivo de este artículo de revisión es proporcionar a los médicos un conocimiento de cómo afectan las distintas clases de inmunosupresores a la curación de heridas.
Métodos
Los autores realizaron una búsqueda bibliográfica utilizando los nombres genéricos de varios inmunosupresores comunes (glucocorticoides/corticosteroides, Inhibidores mTOR, metotrexato, mAbs, pAbs, CNIs, micofenolato, azatioprina), así como los términos "curación de heridas" e "inmunosupresión" La base de datos primaria buscada fue PubMed, complementada por Google Scholar y la base de datos de la Biblioteca de Ciencias de la Salud de la Universidad de Calgary. Cuando sea posible, la búsqueda se formateará de la siguiente manera: "nombre inmunosupresor" [Términos MeSH] Y "cicatrización de heridas [Términos MeSH]." Si el nombre del inmunosupresor no estaba disponible como término MeSH, se buscó el término sin aplicar ninguna restricción. La búsqueda se limitó a artículos en inglés publicados entre 2000 y 2021.
Los investigadores examinaron los títulos y resúmenes de los artículos para determinar su pertinencia. Los artículos se consideraron relevantes si comparaban diversos inmunosupresores, discutían sus efectos sobre la curación de heridas y medían la curación de heridas o informaban de efectos deletéreos sobre las heridas. Si los términos de búsqueda no identificaban ningún estudio con participantes humanos, los autores incluyeron entonces estudios que utilizaban animales para evaluar los efectos inmunosupresores de una determinada clase de fármacos sobre la curación de heridas. Cuando no se dispuso de datos a partir del 2000, se realizó una búsqueda histórica de los medicamentos inmunosupresores pertinentes.
Todos los estudios incluidos se resumieron de forma descriptiva, incluyendo el mecanismo de acción inmunosupresor, los participantes/sujetos de estudio y las pruebas de los efectos sobre la curación de heridas.
Resultados
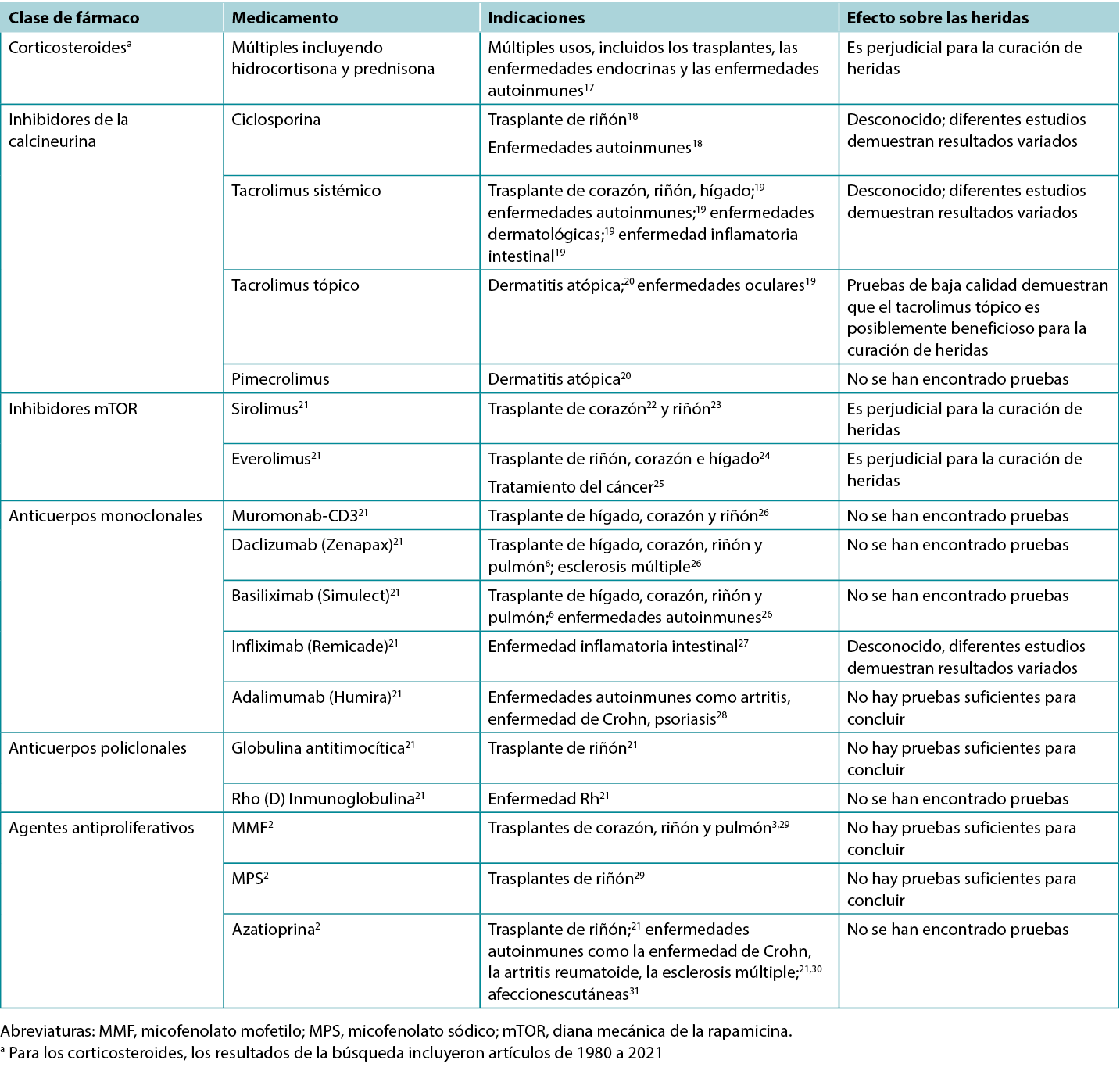
Los autores examinaron 200 títulos de artículos y resúmenes, y de éstos, 61 artículos se incluyeron en la revisión. En la Tabla 1 se destacan los resultados de estudios clínicos y con animales seleccionados. Las indicaciones específicas de los distintos inmunosupresores, incluidos sus posibles efectos sobre las heridas, se describen en la Tabla 2.
Tabla 1. Estudios que comparan los efectos de distintos inmunosupresores en las heridas
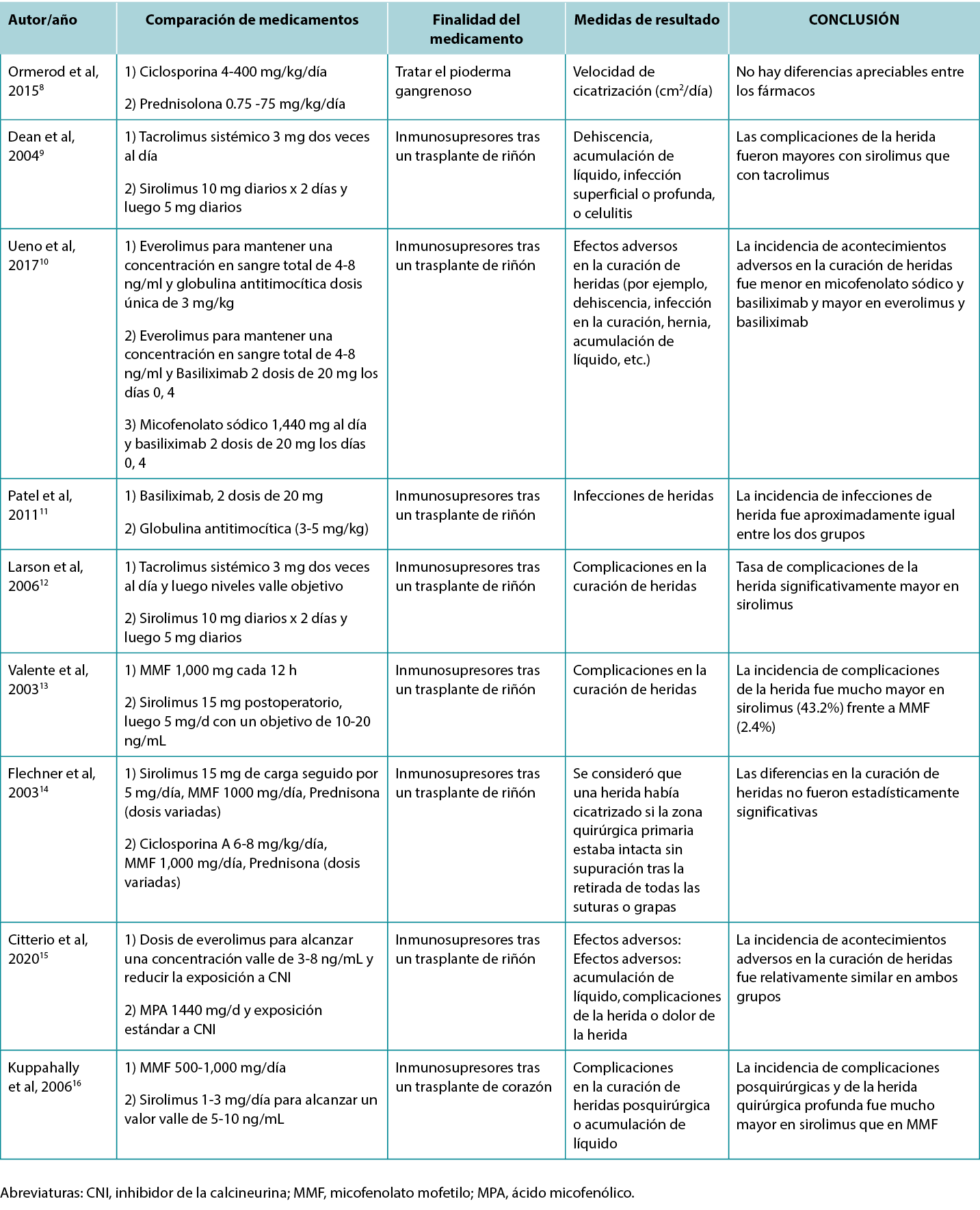
Tabla 2. Visión general de las indicaciones y los efectos sobre las heridas de diversos inmunosupresores
Inhibidores de la calcineurina
Los inhibidores de la calcineurina se utilizan como inmunosupresores en diversas enfermedades autoinmunes, trasplantes de órganos, afecciones dermatológicas y heridas crónicas32 Existen tres tipos principales de CNIs: ciclosporina (sistémico), tacrolimus (sistémico y tópico) y pimecrolimus (tópico).33 Los CNIs actúan uniéndose a una parte de la molécula de calcineurina que se encuentra en las células humanas, deteniendo así la liberación de determinadas citoquinas responsables de la activación de las células T.32 Por lo tanto, los CNIs desactivan una de las principales ramas de la respuesta inmunitaria adaptativa del organismo.
Sistémico Faltan estudios centrados directamente en los efectos de los CNIs sobre la curación de heridas en humanos; sin embargo, se han realizado muchos estudios de ciencia básica en animales. En dos de estos estudios con ratas se comparó el efecto de diversas dosis de tacrolimus sistémico frente a un control, comprobando la resistencia a la rotura de las heridas creadas mediante cirugía.7,34 Willems et al7 concluyeron que el tacrolimus no afecta a la curación de heridas, mientras que Schäffer et al34 concluyeron que el tacrolimus es perjudicial para la curación de las heridas. En un caso clínico en el que se utilizó tacrolimus sistémico como tratamiento de las úlceras en una persona con liquen plano y pioderma gangrenoso,Miller35 demostró el éxito del tratamiento con esta terapia.
Ningún estudio reciente en humanos ha investigado el efecto de la ciclosporina en la curación de heridas, y dos estudios realizados con modelos de ratas arrojaron resultados contradictorios. Estos estudios con ratas se centraron en los efectos de la ciclosporina sobre diferentes marcadores del organismo que significan una curación eficaz de heridas.36,37 Nemlander etal36 compararon la ciclosporina con la metilprednisona y descubrieron que la ciclosporina A no tenía ningún efecto supresor sobre diversos marcadores inflamatorios y bioquímicos en comparación con el tratamiento con glucocorticoides. Por el contrario, Petri et al37 observaron que la ciclosporina A tenía un efecto negativo sobre otros marcadores de los fibroblastos de granulación, en particular la activina A entre el procolágeno 1, la integrina 1, la interleucina 6, el factor de crecimiento transformante 1 y el factor de crecimiento de los queratinocitos. En otro estudio con animales, Goldberg et al38 asignaron perros a uno de tres grupos -sin inmunosupresión, metilprednisona más azatioprina o ciclosporina A- tras un trasplante de pulmón. Descubrieron que la ciclosporina A no tenía un efecto significativo sobre la curación de heridas quirúrgica medida por la resistencia a la rotura en comparación con la inmunosupresión con glucocorticoides y azatioprina. En general, la bibliografía sobre los CNIs sistémicos y la curación de heridas es limitada, con una heterogeneidad de comparadores y resultados dispares sobre la curación de heridas.
Tópico Los CNIs tópicos (tacrolimus y pimecrolimus) a menudo se usan para afecciones dermatológicas como dermatitis atópica o pioderma gangrenoso.20,39,40 Algunos estudios de casos han demostrado que el tacrolimus es eficaz para curar úlceras complejas de las piernas en el contexto de la insuficiencia venosa o la necrobiosis lipoídica, cuando las estrategias de tratamiento habituales han sido ineficaces.41,42 Además, un estudio realizado en ratas con lesiones cutáneas agudas demostró que las heridas tratadas con tacrolimus tópico cicatrizaban igual de rápido que el control (vaselina).43
Anticuerpos monoclonales
Existe una gran variedad de terapias mAb con indicaciones en trasplantes y trastornos autoinmunitarios como la artritis reumatoide y la psoriasis.21 En general, los mAbs actúan uniéndose a diferentes receptores y antígenos para inhibir el efecto de las citocinas y otras vías de señalización que activan el sistema inmunitario.21 En un pequeño estudio prospectivo de cohortes entre pacientes con artritis reumatoide sometidos a cirugía ortopédica, Bibbo y Goldberg44 observaron que no había mayor riesgo de infecciones de herida quirúrgica ni de complicaciones de la curación en los pacientes que recibían infliximab frente al tratamiento convencional. Además, Streit et al45 informaron de un caso en el que el infliximab tópico fue útil para curar úlceras de pierna resistentes al tratamiento estándar, lo que sugiere que la inhibición del factor de necrosis tumoral α es útil para la curación de heridas. Del mismo modo, se informó de un caso en el que se trató el pioderma gangrenoso con infliximab, lo que produjo una mejoría de la úlcera.46 La inhibición del factor de necrosis tumoral α se asoció además con la curación de heridas en úlceras venosas de la pierna mediante el uso sistémico de adalimumab.47 Sin embargo, un estudio en el que se utilizó infliximab en heridas abdominales de ratas descubrió que la resistencia a la tracción era significativamente inferior en las heridas de las ratas a las que se había administrado infliximab frente a las de control.48 En general, la bibliografía es limitada, pero sugiere que los resultados clínicos pueden ser favorables en términos de curación de heridas.
Anticuerpos policlonales
Los anticuerpos policlonales son muy similares a los mAbs en cuanto a su función, con un mecanismo de acción ligeramente distinto.49,50 A diferencia de los mAbs, un grupo de pAbs se crea a partir de muchas líneas diferentes de células B y, dentro del grupo, diferentes pAbs se unen a diferentes epítopos de un antígeno. Por el contrario, los mAbs proceden de una única línea de linfocitos B y sólo pueden unirse a un antígeno.49,50
Existen dos pAbs principales: la globulina antitimocítica (también conocida como globulina antitimocítica humana) y la inmunoglobulina rho (ρ).21 La globulina antitimocítica se utiliza con mayor frecuencia como inmunosupresor tras el trasplante de riñón y actúa uniéndose a diversos linfocitos y reduciendo el número de células T en el organismo.21 La inmunoglobulina Rho se utiliza en embarazos en los que el progenitor gestacional es Rh- y el feto es Rh+ para detener la formación de anticuerpos anti-Rh+ en la madre.21
Se han encontrado pocos estudios que analicen los efectos de los pAbs en la curación de heridas. Dos estudios esbozaron los efectos de la globulina antitimocítica y el basiliximab. Ueno et al10 investigaron el uso de estos fármacos combinados con everolimus en pacientes con trasplante renal. Informaron de tasas más elevadas de efectos adversos en la curación de heridas con basiliximab.10 Patel et al11 demostraron que la incidencia de infecciones de herida era igual en los pacientes que recibían basiliximab que en los que recibían globulina antitimocítica tras un trasplante renal. Los glóbulos blancos desempeñan un papel clave en la curación de heridas al segregar las citoquinas necesarias y prevenir lainfección51; por tanto, es razonable plantear la hipótesis de que la globulina antitimocítica afectaría a la curación de heridas porque reduce el número de glóbulos blancos y sus mecanismos reguladores.
Inhibidores mTOR
Los inhibidores de la diana mecánica de la rapamicina interactúan con proteínas en vías de señalización complejas para impedir que las células pasen a la fase S del ciclo celular y, por tanto, suprimir la proliferación.3,21 Aunque mTOR se dirige predominantemente a las células T, también puede afectar a las células B.3 Curiosamente, mTOR puede aumentar la producción de ciertas citocinas inflamatorias, como la interleucina 6, y disminuir la producción de interleucina 10, una citocina antiinflamatoria.3 Existen dos inhibidores principales de mTOR: sirolimus y everolimus.3,21 En general, los Inhibidores mTOR tienen diversas aplicaciones, como la terapia del cáncer y después de los trasplantes.3,21 El everolimus inhibe la proliferación de fibroblastos en modelos in vitro,52 lo que sugiere que podría tener consecuencias negativas para la curación de heridas, ya que los fibroblastos son esenciales para la creación de una matriz extracelular y el andamiaje de otras células.53 En un estudio en el que se compararon el sirolimus y el tacrolimus sistémico, el sirolimus presentó una tasa de complicaciones de la herida del 47%, mientras que la tasa con tacrolimus fue sólo del 8%.9 Esto concuerda con otro estudio de Larson et al12 en el que se demostró una mayor frecuencia de complicaciones de la herida con sirolimus en comparación con tacrolimus. Dichos autores descubrieron que los pacientes con obesidad que recibían sirolimus presentaban tasas muy elevadas de complicaciones de la herida; en consecuencia, los autores excluyeron del estudio a todos los pacientes con obesidad.12 En consonancia con hallazgos anteriores, un estudio realizado en ratas demostró que el aumento de las dosis de sirolimus disminuía la resistencia a la rotura.54 Los autores plantearon la hipótesis de que este efecto podría estar causado por unos niveles más bajos de factor de crecimiento endotelial vascular y óxido nítrico en ratas que recibían dosis más altas de sirolimus.54 En un artículo de revisión, Nashan yCitterio55 concluyeron que los Inhibidores mTOR son perjudiciales para la curación de heridas en dosis altas, pero parecen tener un efecto neutro en dosis bajas. Dadas las preocupaciones iniciales sobre los Inhibidores mTOR y la curación de heridas, los regímenes que utilizan estos agentes inmunosupresores han evolucionado con dosis más bajas de los Inhibidores mTOR y terapia combinada. En el amplio ensayo controlado aleatorio TRANSFORM (Mejora de la eficacia y los Resultados de seguridad del trasplante renal con un régimen basado en eveRoliMus), Citterio et al15 compararon everolimus más dosis reducida de CNI con ácido micofenólico más dosis estándar de CNI (tratamiento estándar) en pacientes con trasplante renal. Descubrieron que los acontecimientos adversos relacionados con las heridas no diferían entre los grupos (20.6% frente a 17.3%; cociente de riesgos, 1.19; 95% CI, 0.99 a 1.43).15 Una limitación de este estudio fue la estrecha vigilancia de las concentraciones de everolimus y las dificultades para alcanzar las concentraciones plasmáticas objetivo C0 entre 3 y 8 ng/mL.15 En general, la bibliografía actual sugiere que los Inhibidores mTOR tienen un efecto perjudicial sobre la curación de heridas, especialmente a dosis más altas, y que la mejora de los regímenes de dosificación puede disminuir o mitigar este riesgo.
Agentes antiproliferativos
Existen tres agentes antiproliferativos utilizados regularmente: el micofenolato mofetilo (MMF), el micofenolato sódico (MPS) y la azatioprina.2,29 Tanto el MMF como el MPS son inhibidores de la inosina monofosfato deshidrogenasa. Tienen un efecto similar al de los Inhibidores mTOR en cuanto a su mecanismo de inmunosupresión. En el organismo, el MMF y el MPS se convierten en ácido micofenólico, que bloquea una parte de una vía crucial para la síntesis del DNA, con el fin de disminuir la proliferación de linfocitos T y células B.2,5,29 El MMF se utiliza por su efecto inmunosupresor en los trasplantes de corazón, riñón y pulmón.3,29 El MPS se utiliza en los trasplantes de riñón.29 La azatioprina se utiliza como fármaco inmunosupresor en los trasplantes de riñón y las enfermedades autoinmunes, como la artritis reumatoide, la enfermedad de Crohn y la esclerosis múltiple.21,30 La azatioprina reacciona con el glutatión en el organismo y se convierte en 6-mercaptopurina. A continuación, se generan metabolitos adicionales que, en última instancia, bloquean la síntesis de purinas y la estimulación de las células T.3,21
En un estudio en el que se compararon dos dosis diferentes de MMF en receptores de trasplante de riñón , Flechner et al56 no hallaron diferencias significativas en la incidencia de heridas que requirieron intervención quirúrgica, al igual que para las heridas tratadas con cuidados locales. Al analizar los títulos de los artículos para la presente revisión, los autores no encontraron ningún estudio relativo al efecto único de la azatioprina sobre la curación de heridas externas en humanos. Sin embargo, Ginestal et al57 compararon los efectos de la azatioprina frente al placebo en un estudio con ratas. Cuando se comparó la azatioprina con un placebo en un estudio con ratas, las heridas de las ratas que tomaban azatioprina tardaron más en cicatrizar que las que tomaban el placebo, lo que sugiere que la azatioprina puede tener efectos perjudiciales sobre la curación de heridas, pero no está claro hasta qué punto afectaría a los seres humanos.57
Antimetabolito
El metotrexato es un agente inmunosupresor antagonista del folato de uso común, con indicaciones en muchos trastornos reumatológicos. También tiene actividad antineoplásica en dosis más elevadas. Tras su absorción, entra en la célula y se convierte en poliglutamatos de metotrexato, donde compite por la dihidrofolato reductasa, impidiendo así la transformación del ácido fólico para su uso en la construcción de ácidos nucleicos.6 Al igual que otros agentes descritos, existen estudios experimentales en animales con estudios in vitro que sugieren una alteración en la curación de heridas, pero estos efectos no se han confirmado en estudios clínicos, especialmente en heridas posquirúrgicas.6 Por lo tanto, se recomienda continuar con este fármaco en el postoperatorio.
Corticosteroides/Glucocorticoides
Los glucocorticoides impiden la formación de sustancias químicas inflamatorias como las citocinas, las moléculas de adhesión celular y los factores del complemento.3 Al inhibir la formación de interleucina2, los glucocorticoides también impiden la proliferación y activación de las células T.21 También perjudican a los monocitos y las células B.3,21 Los glucocorticoides fueron los primeros fármacos antirrechazo que se crearon, pero con el paso del tiempo se ha producido un movimiento para eliminarlos gradualmente debido a sus graves efectos secundarios.3,21 Existe consenso en que los glucocorticoides son muy perjudiciales para la curación de heridas, ya que interfieren en muchas fases clave de la curación de heridas, como la deposición y síntesis de colágeno, la angiogénesis, la proliferación de fibroblastos, los factores de crecimiento y la fagocitosis, entre otras.2,3,58,59
Consideraciones prácticas para los profesionales sanitarios
Las personas con sistemas inmunitarios comprometidos (debido a medicamentos, comorbilidades o edad extrema) requieren consideraciones adicionales para el tratamiento de heridas crónicas. Por lo que respecta específicamente a los medicamentos inmunosupresores, los profesionales sanitarios deben elaborar un historial minucioso no sólo de los medicamentos y la dosificación (incluidos los cambios de dosificación), sino también de las afecciones subyacentes que requieren estos medicamentos (por ejemplo, trastornos autoinmunitarios, trasplante de órganos). Dado que muchos medicamentos inmunosupresores pueden perjudicar la curación de las heridas, es fundamental que los profesionales sanitarios evalúen el potencial de curación desde el principio para establecer y gestionar las expectativas de los pacientes. La derivación precoz a especialistas médicos o quirúrgicos para ayudar con el cuidado de heridas y un enfoque basado en el equipo serán esenciales dada la mayor complejidad de estas personas. En algunos casos en los que las heridas no cicatrizan, puede ser necesario establecer objetivos alternativos para el cuidado de la herida (por ejemplo, mantenimiento o no cicatrizable) si no se pueden reducir las dosis de inmunosupresores (suponiendo que esté contribuyendo a una mala curación) y debe hacerse en consulta con sus profesionales de atención primaria o especializada. A medida que las personas y poblaciones con comorbilidades vivan más tiempo, el cuidado de personas con heridas crónicas bajo medicamentos inmunosupresores será cada vez más frecuente y debe ser reconocido precozmente por los clínicos encargados del cuidado de heridas.
Discusion
Con los continuos avances de la medicina, ha aumentado la necesidad de inmunosupresión en el contexto de los trasplantes, las enfermedades autoinmunes y los tumores malignos. En nuestra revisión, destacamos la pobreza de estudios sólidos en este campo y resaltamos los efectos mixtos de diversas inmunosupresiones sobre la curación de heridas. Existen pruebas de alta calidad con respecto a los efectos nocivos del tratamiento con glucocorticoides, así como del tratamiento con mTOR, en particular sirolimus, sobre la curación de heridas. Cuatro estudios compararon sirolimus con MMF o tacrolimus sistémico, y los cuatro demostraron que sirolimus se asoció con una mayor incidencia de complicaciones de heridas.9,12,13,16
La bibliografía sobre agentes como los CNIs sistémicos es contradictoria, ya que algunos sugieren efectos adversos sobre las heridas y otros sugieren beneficios, por lo que es necesario realizar estudios adicionales centrados directamente en esta cuestión. Los CNIs tópicos más recientes han mostrado escasa repercusión en la curación retardada de las heridas y, en algunos casos, beneficios, pero se justifica una investigación adicional para su uso directo en heridas crónicas. Los estudios indican que los agentes antiproliferativos, los antimetabolitos y los mABs más recientes no afectan negativamente a la curación de las heridas. Sin embargo, se necesitan estudios adicionales dada la escasez de pruebas sobre la curación de heridas en la terapia con mAB.
En general, nuestra revisión halló que las pruebas en esta área son anticuadas, con conclusiones variables en torno a los efectos del inmunosupresor sobre la curación de heridas. En particular, pocos estudios han incluido participantes humanos. En general, cuando se prescriben inmunosupresores tras un trasplante para prevenir el rechazo, los pacientes toman más de un fármaco para prevenirlo eficazmente. Por lo tanto, la realización de estudios en humanos que evalúen los efectos de fármacos individuales de forma aislada plantea dificultades.
Al no tratarse de una revisión sistemática, es posible que los autores no hayan identificado todos los artículos pertinentes. Sin embargo, como una forma de validación, los autores identificaron algunas revisiones clave antes de realizar la búsqueda bibliográfica y luego se aseguraron de que estos artículos aparecieran en la búsqueda como se esperaba. Además, dada la escasez de bibliografía en este ámbito, especialmente en lo que se refiere al cuidado de heridas, una revisión narrativa añade valor para educar y aumentar la concienciación cuando se trabaja con personas que toman estos medicamentos.
Con la creciente necesidad de inmunosupresión, es fundamental realizar más estudios en este campo. En futuras investigaciones se deberían estudiar nuevas clases de inmunosupresores en modelos animales para identificar posibles vías de retraso en la curación de heridas y posibles formas de mitigar dichos efectos. Además, se necesitan más estudios de alta calidad para evaluar tanto las inmunoterapias individuales como las combinadas, a fin de comprender mejor los riesgos y el modo en que los distintos inmunosupresores pueden influir en la curación de las heridas. Para explorar los inmunosupresores como tratamiento potencial de las heridas crónicas o complejas, es importante que los futuros estudios se realicen a mayor escala y controlen los factores clínicos de confusión, por ejemplo mediante ensayos controlados aleatorizados.
Conclusiones
En conclusión, los inmunosupresores varían de posiblemente beneficiosos a realmente nocivos en la curación de heridas. Aunque hay pocas pruebas concluyentes en este campo, merece la pena explorar los efectos de los inmunosupresores en la curación de heridas para adaptar mejor la inmunosupresión a los pacientes con riesgo de sufrir heridas crónicas que no cicatrizan o que las padecen. Algunos inmunosupresores pueden ofrecer ventajas en el tratamiento de heridas cuando las terapias convencionales han fracasado, lo que abre la posibilidad de una nueva opción terapéutica para las heridas.
Agradecimientos
Alberta Innovates High School Youth Research Summer (HYRS) Program, que proporcionó un estipendio educativo a la autora principal por su trabajo en este y otros proyectos.
Conflictos de intereses
Los autores declaran no tener conflictos de intereses.
Financiación
Los autores no han revelado ninguna relación financiera relacionada con este artículo.
Author(s)
Aria Appoo
Medical Student, University of Oxford, Oxford, United Kingdom
Brandon L Christensen*
MD
Resident Physician, Division of Infectious Diseases
University of Calgary, Alberta, Canada
Ranjani Somayaji
BScPT MD MPH
Assistant Professor, Departments of Medicine, Microbiology
Immunology and Infectious Disease and Community Health Sciences
* Corresponding author
References
- Fireman M, DiMartini AF, Armstrong SC, Cozza KL. Immunosuppressants. Psychosomatics 2004;45(4):354-60.
- Taylor AL, Watson CJE, Bradley JA. Immunosuppressive agents in solid organ transplantation: mechanisms of action and therapeutic efficacy. Crit Rev Oncol Hematol 2005;56(1):23-46.
- Weltz A, Scalea J, Popescu M, Xu J, Bromberg JS. Mechanisms of immunosuppressive drugs. In: Kidney Transplantation. New York: Springer; 2014:127-42.
- Subramanian S, Trence DL. Immunosuppressive agents: effects on glucose and lipid metabolism. Endocrinol Metab Clin North Am 2007;36(4):891-905.
- Mika A, Stepnowski P. Current methods of the analysis of immunosuppressive agents in clinical materials: a review. J Pharm Biomed Anal 2016;127:207-31.
- Pountos I, Giannoudis P V. Effect of methotrexate on bone and wound healing. Expert Opin Drug Saf 2017;16(5):535-45.
- Willems MCM, van der Vliet JA, Lomme RMLM, Hendriks T. Tacrolimus does not affect early wound healing in a rodent model of bowel anastomoses and abdominal wall closure. PLoS One 2013;8(9):e76348.
- Ormerod AD, Thomas KS, Craig FE, et al. Comparison of the two most commonly used treatments for pyoderma gangrenosum: results of the STOP GAP randomised controlled trial. BMJ 2015;350:h2958.
- Dean PG, Lund WJ, Larson TS, et al. Wound-healing complications after kidney transplantation: a prospective, randomized comparison of sirolimus and tacrolimus. Transplantation 2004;77(10):1555-61.
- Ueno P, Felipe C, Ferreira A, et al. Wound healing complications in kidney transplant recipients receiving everolimus. Transplantation 2017;101(4):844-50.
- Patel S, Pankewycz O, Kohli R, et al. Obesity in renal transplantation: the role of induction therapy on long-term outcomes. Transplant Proc 2011;43(2):469-71.
- Larson TS, Dean PG, Stegall MD, et al. Complete avoidance of calcineurin inhibitors in renal transplantation: a randomized trial comparing sirolimus and tacrolimus. Am J Transplant 2006;6(3):514-22.
- Valente JF, Hricik D, Weigel K, et al. Comparison of sirolimus vs. mycophenolate mofetil on surgical complications and wound healing in adult kidney transplantation. Am J Transplant 2003;3(9):1128-34.
- Flechner SM, Zhou L, Derweesh I, et al. The impact of sirolimus, mycophenolate mofetil, cyclosporine, azathioprine, and steroids on wound healing in 513 kidney-transplant recipients. Transplantation 2003;76(12):1729-34.
- Citterio F, Henry M, Kim DY, et al. Wound healing adverse events in kidney transplant recipients receiving everolimus with reduced calcineurin inhibitor exposure or current standard-of-care: insights from the 24 month TRANSFORM study. Expert Opin Drug Saf 2020;19(10):1339-48.
- Kuppahally S, Al-Khaldi A, Weisshaar D, et al. Wound healing complications with de novo sirolimus versus mycophenolate mofetil-based regimen in cardiac transplant recipients. Am J Transplant 2006;6(5Pt1)986-92.
- Kapugi M, Cunningham K. Corticosteroids. Orthop Nurs 2019;38(5):336-9.
- Ponticelli C. Cyclosporine: from renal transplantation to autoimmune diseases. Ann N Y Acad Sci 2005;1051(1):551-8.
- Akar Y, Yucel G, Durukan AH, Yucel I, Arici G. Systemic toxicity of tacrolimus given by various routes and the response to dose reduction. Clin Exp Ophthalmol 2005;33(1):53-9.
- Frazier W, Bhardwaj N. Atopic dermatitis: diagnosis and treatment. Am Fam Physician 2020;101(10):590-8.
- Khan MM. Immunopharmacology. New York, NY: Springer US; 2008.
- Kurian K, Addisu A. Sirolimus: a novel immunosuppressive drug in heart transplantation. Recent Pat Cardiovasc Drug Discov 2009;4(3):187-91.
- Sehgal SN. Sirolimus: its discovery, biological properties, and mechanism of action. Transplant Proc 2003;35(3):S7-14.
- Van Gelder T, Fischer L, Shihab F, Shipkova M. Optimizing everolimus exposure when combined with calcineurin inhibitors in solid organ transplantation. Transplant Rev 2017;31(3):151-7.
- Falkowski S, Woillard JB. Therapeutic drug monitoring of everolimus in oncology: evidences and perspectives. Ther Drug Monit 2019;41(5):568-74.
- National Institutes of Diabetes and Digestive and Kidney Diseases. Clinical and Research Information on Drug-Induced Liver Injury. LiverTox. 2012. February 5, 2024. https://www.ncbi.nlm.nih.gov/books/NBK547852/. Last accessed January 25, 2024.
- Lichtenstein L, Ron Y, Kivity S, et al. Infliximab-related infusion reactions: systematic review. J Crohns Colitis 2015;9(9):806-15.
- Tracey D, Klareskog L, Sasso EH, Salfeld JG, Tak PP. Tumor necrosis factor antagonist mechanisms of action: a comprehensive review. Pharmacol Ther 2008;117(2):244-79.
- Staatz CE, Tett SE. Clinical Pharmacokinetics and pharmacodynamics of mycophenolate in solid organ transplant recipients. Clin Pharmacokinet 2007;46(1):13-58.
- Casetta I, Iuliano G, Filippini G. Azathioprine for multiple sclerosis. Cochrane Database Syst Rev 2007;2007(4):CD003982.
- Chavez-Alvarez S, Herz-Ruelas M, Villarreal-Martinez A, Ocampo-Candiani J, Garza-Garza R, Gomez-Flores M. Azathioprine: its uses in dermatology. An Bras Dermatol 2020;95(6):731-6.
- Azzi JR, Sayegh MH, Mallat SG. Calcineurin inhibitors: 40 years later, can’t live without. J Immunol 2013;191(12):5785-91.
- Safarani OA, Patel J. Calcineurin Inhibitors. StatPearls Publishing; 2021.
- Schäffer MR, Fuchs N, Proksch B, Bongartz M, Beiter T, Becker HD. Tacrolimus impairs wound healing: a possible role of decreased nitric oxide synthesis. Transplantation 1998;65(6):813-8.
- Miller S. The effect of tacrolimus on lower extremity ulcers: a case study and review of the literature. Wound Manag Prev 2008;54(4):36-42.
- Nemlander A, Ahonen J, Wiktorowicz K, et al. Effect of cyclosporine on wound healing an analysis with viscous cellulose sponges. Transplantation 1983;36(1):1-5.
- Petri J, Schurk S, Gebauer S, Haustein U. Cyclosporine A delays wound healing and apoptosis and suppresses activin beta-A expression in rats. Eur J Dermatol 1998;8(2):104-13.
- Goldberg M, Lima O, Morgan E, et al. A comparison between cyclosporin A and methylprednisolone plus azathioprine on bronchial healing following canine lung autotransplantation. J Thorac Cardiovasc Surg 1983;85(6):821-6.
- Sussman G. The use of topical calcineurin inhibitors in chronic wound management. Wound Pract Res 2000;26(3):140-5.
- Lyon C, Stapleton M, Smith A, Mendelsohn S, Beck M, Griffiths C. Topical tacrolimus in the management of peristomal pyoderma gangrenosum. J Dermatol Treat 2001;12(1):13-7.
- Ginocchio L, Draghi L, Darvishian F, Ross FL. Refractory ulcerated necrobiosis lipoidica: closure of a difficult wound with topical tacrolimus. Adv Skin Wound Care 2017;30(10):469-72.
- Mackelfresh J, Soon S, Arbiser JL. Combination therapy of doxycycline and topical tacrolimus for venous ulcers. JAMA Dermatol 2005;141(11):1476-7.
- Namkoong S, Chung J, Yoo J, et al. Topical tacrolimus does not negatively impact acute skin wound healing. Exp Dermatol 2013;22(5):369-71.
- Bibbo C, Goldberg JW. Infectious and healing complications after elective orthopaedic foot and ankle surgery during tumor necrosis factor-alpha inhibition therapy. Foot Ankle Int 2004;25(5):331-5.
- Streit M, Beleznay Z, Braathen LR. Topical application of the tumour necrosis factor-alpha antibody infliximab improves healing of chronic wounds. Int Wound J 2006;3(3):171-9.
- Hewitt D, Tait C. Use of infliximab in pyoderma gangrenosum. Australas J Dermatol 2007;48(2):95-8.
- Fox JD, Baquerizo-Nole KL, Keegan BR, et al. Adalimumab treatment leads to reduction of tissue tumor necrosis factor-alpha correlated with venous leg ulcer improvement: a pilot study. Int Wound J 2016;13(5):963-6.
- De Lopes JV, Freitas LAM, Marques RD, Bocca AL, de Sousa JB, de Oliveira PG. Analysis of the tensile strength on the healing of the abdominal wall of rats treated with infliximab. Acta Cir Bras 2008;23(5):441-6.
- Larrañaga MD, Lewis S, Richard J, Robert A, eds. Polyclonal antibodies. In: Hawley’s Condensed Chemical Dictionary. 16th ed. Hoboken, NJ: Wiley; 2016.
- Johnson M. Monoclonal antibodies. In: Longe JL, ed. Gale Encyclopedia of Nursing and Allied Health. 4th ed. Credo Reference; 2018.
- Kordestani SS. Wound healing process. In: Atlas of Wound Healing. Abyaneh MS, Fayyazbakhsh F, eds. Elsevier; 2019:11-22.
- Azzola A, Havryk A, Chhajed P, et al. Everolimus and mycophenolate mofetil are potent inhibitors of fibroblast proliferation after lung transplantation. Transplantation 2004;77(2):275-80.
- Bainbridge, P. Wound healing and the role of fibroblasts. J Wound Care, 2013;22(8):407-412.
- Schäffer M, Schier R, Napirei M, Michalski S, Traska T, Viebahn R. Sirolimus impairs wound healing. Langenbecks Arch Surg 2007;392(3):207-303.
- Nashan B, Citterio F. Wound healing complications and the use of mammalian target of rapamycin inhibitors in kidney transplantation. Transplantation 2012;94(6):547-61.
- Flechner SM, Feng J, Mastroianni B, et al. The effect of 2-gram versus 1-gram concentration controlled mycophenolate mofetil on renal transplant outcomes using sirolimus-based calcineurin inhibitor drug-free immunosuppression. Transplantation 2005;79(8):926-34.
- Ginestal R, Pérez-Köhler B, Pérez-López P, et al. Comparing the influence of two immunosuppressants (fingolimod, azathioprine) on wound healing in a rat model of primary and secondary intention wound closure. Wound Repair Regen 2019;27(1):59-68.
- Wicke C. Effects of steroids and retinoids on wound healing. Arch Surg 2000;135(11):1265-70.
- Anstead G. Steroids, retinoids, and wound healing. Adv Wound Care (New Rochelle) 1998;11(6):277-85.



