Volume 39 Number 3
Application of irrigation and negative pressure wound therapy (INPWT) to treat diabetic foot gangrene: a case report
Ai-hua Chen, Huiling Liu, Chunmei Zhang and Ping Zou
Keywords negative pressure wound therapy, Diabetic foot gangrene, irrigation, moist dressing
For referencing Chen A et al. Application of irrigation and negative pressure wound therapy (INPWT) to treat diabetic foot gangrene: a case report. WCET® Journal 2019; 39(3):20–25
DOI https://doi.org/10.33235/wcet.39.3.20-25
Abstract
This case study summarises the treatment of a patient with diabetic foot gangrene. By undergoing irrigation and negative pressure wound therapy (INPWT) with moist dressing, foot amputation was avoided. The treatment process included: the comprehensive assessment of systemic and local condition; choosing suitable debridement such as sharp surgical debridement; preventing the spread of infection; applying INPWT to reduce endotoxin absorption; and active treatments of primary disease such as controlling blood sugar and blood pressure, and improving microcirculation and nutrition. After 2 months of vigorous INPWT, the patient’s wound bed improved. After the application of a moist dressing, the wound closed and healed successfully at 3 months.
Introduction
The global prevalence of diabetes mellitus is 8.5%, with roughly 90% of cases being type 2 diabetes1,2. Over the last several decades, the prevalence of diabetes has drastically increased worldwide – with rates quadrupling since 19802. This can be attributed to a quickly aging population, general population growth, and increased incidences of obesity. It is estimated that there will be nearly 550 million people with diabetes globally by 2030, making diabetes a key public health issue and a global concern. China currently houses the most diabetics in the world. According to the latest epidemiological survey conducted by the National Health Committee in 2018, 11.6% of the Chinese population has diabetes, totalling 114 million people. Furthermore, China has a low treatment rate (32.2%) and control rate (49.2%), resulting in many incidences of complications, including the risk of heart disease, stroke, blindness, kidney failure and amputation. These complications have serious consequences on the quality of life of patients.
One of the most prevalent comorbidities of diabetes is foot ulcers. The World Health Organization (WHO) classifies a diabetic foot disease as a foot infection, ulcer and/or deep tissue damage related to local nerve abnormality and lower limb distal peripheral vascular pathological changes3. The incidence of foot ulcers in individuals with diabetes is 6.3%, with a lifetime incidence of between 19–34% in this population4,5. A main concern with foot ulcers in people with diabetes is the prolonged period the wound takes to heal. The likelihood of the wounds healing decreases in diabetics due to a number of factors, including circulatory dysfunction, hyperglycaemia, neuropathy, hypoxia and impaired neuropeptide signalling, as well as comorbidities such as end-stage kidney disease, congestive heart failure and peripheral artery disease4,6. Many of these factors contributed to the initial development of the diabetic foot ulcers. Additional factors that advance ulcer development include a high body mass index, foot deformity, being of the male gender, prolonged infliction of diabetes, advanced age, and poor foot self-care habits7.
For individuals with diabetic foot ulcers, the infection rate is over 50%8. Infection is a process comprised of invading microorganisms, the body’s inflammatory response to the invasion, and tissue degradation and destruction9. Factors that contribute to an infection in an individual with diabetic foot ulcers include wounds that last longer than 30 days, deep wounds, wounds that were caused traumatically, and wounds that are comorbid with peripheral arterial disease8,9.
Additionally, if diabetic foot ulcers become infected they may progress to gangrene10. Diabetic foot gangrene is the final stage of diabetic foot disease, which is often comorbid with nerve and vascular lesions of other organs2. Infections can include osteomyelitis, cellulitis, abscesses, fasciitis or septic arthritis11. These infections can be caused by both fungi and bacteria such as Staphylococcus, Proteobacteria, Pseudomonas aeruginosa, Streptococcus and coliform bacteria10.
Due to infection and slow healing times, diabetic foot ulcers may eventually lead to the need for amputation; individuals with diabetic foot ulcers are 10–20 times more likely to need amputation compared with their non-diabetic counterparts2,7. Amputation can lead to additional complications – the 5-year survival rate post-amputation is 30% for individuals with diabetes4. One study found that amputation rates were around 46–78% for moderate to severe infections respectively8.
Infection is generally managed through antibiotic therapy, surgical intervention and wound debridement8,11. Other adjunct therapies used with these methods include negative pressure wound therapy (NPWT) and hyperbaric oxygen therapy. Comprehensive treatment and local management of diabetic foot gangrene is therefore important to reduce the amputation rate of patients with diabetic foot disease, to maintain foot function and mobility, and to improve the quality of life for individuals afflicted with diabetic foot disease12.
NPWT is a form of wound management wherein negative pressure is exhibited across the entire surface area of the wound and is maintained by a dressing that is sealed and connected via a tube to an external vacuum. It acts to bring the edges of the wound together in healing – this promotes granulation tissue formation, reduces oedema, thereby increasing microcirculation, and removes small debris and exudate via suction13. This therapy can be combined with other approaches, such as instillation, which delivers a controlled amount of a cleansing solution – such as antiseptics or antibiotics – in order to treat diabetic foot infections13,14.
In May 2016, a case of Wagner IV diabetic foot gangrene was admitted to our hospital. This paper will explore the clinical history of the patient, patient assessment and treatment. After 3 months of treatment, the patient’s wound was healed successfully, and foot amputation was avoided.
Case report
Clinical history and assessment
The patient was an 88-year-old male who was admitted to the hospital on 22 May 2016. He had experienced polydipsia and polyuria for more than 3 years. Upon physical examination, the patient had a temperature of 37.8oC, pulse of 84 beats/min, and blood pressure of 160/90 mmHg. The patient appeared alert and oriented. The patient had a fasting blood glucose of 11 mmol/L, haemoglobin of 110 g/L, albumin level of 38.1 g/L, and a white blood cell count of 11x109/L.
The right side of dorsalis pedis artery pulse was weak and the front of his right foot appeared black–purple in colour. The patient’s first and second toe were missing on the right foot, with toes three, four and five appearing purple–black with necrosis. Tissue was only partially connected with the plantar skin. Yellowish tissue covered 100% of the wound bed, with large amounts of grey, purulent, malodourous exudate at the wound site indicating severe infection. The edge of wound was irregular with oedema, high skin temperature and appeared purple–black. The patient’s skin temperature on his right lower limb was higher than that of the left lower limb. The wound was classified as a Wagner Grade 4. On a numeric rating scale, pain was scored by the patient as eight out of 10 on a scale where 0 is no pain and 10 the worse pain.
The patient’s admission diagnosis was as follows: type II diabetes mellitus and diabetic foot gangrene and infection; coronary atherosclerotic heart disease with unstable angina, with a chronic non-ST segment elevations myocardial infarction event 2 years previously, arrhythmia, and third stage of paroxysmal atrial fibrillation; hypertension level 3 (high risk); cerebral infarction sequela; and artery plaque formation in double lower limbs. The doctor recommended amputation of the foot, but the patient refused.
In June 2016 the patient was referred to an enterostomal (ET) nurse for foot treatment and wound care. The patient had right femoral artery stenosis (90%) and popliteal artery and posterior tibial artery stenosis (61%, 80%). A right lower extremity artery stent was implanted, which was in place for 5 months, and resulted in positive postoperative arterial blood flow. After a comprehensive assessment, the ET nurse found no contraindications in the patient to NPWT. This is the first case of using irrigation and NPWT (INPWT) in this large hospital to treat diabetic foot ulcer. Factors affecting wound healing in the patient were being of an older age, and having a variety of comorbidities such as diabetes, cardiovascular disease, poor nutrition, long-term chronic disease as well as poor mental health.
Systemic treatment
As outlined above, the treatment process included preventing the spread of infection, as well as active treatments of primary disease such as controlling blood sugar and blood pressure, and improving microcirculation and nutrition.
The goal for wound healing rate is 0.2 cm per week, but when the wound bacterial count is at or above 106/mm2, healing speed is expected to decrease to 0.055 cm/week. The more serious a bacterial infection, the slower wound healing is to be expected3. It is therefore vital to have systemic infection control practices in place when performing local wound management. The patient was prescribed a peracillin sodium intravenous infusion at a rate of 2.5 g once per 8 hours. Wound cultures showed growth of Staphylococcus aureus and Pseudomonas aeruginosa, suggesting the need for ofloxacin; therefore, a levofloxacin sodium chloride injection of 0.4 g was given through intravenous infusion once a day for 1 week. The patient’s temperature was normal, and his condition was stable.
To control blood glucose, phosphate sieglidine tablets at a dosage of 100 mg were given orally once a day. The patient was also prescribed acarbosaccharides (baicana) 50 mg orally three times a day, which helped control his fasting blood glucose at 7 mmol/l and postprandial blood glucose around 10 mmol/l.
To reduce blood pressure, the patient was given amberyl mertolol (betatolak) 47.5 mg orally once a day, mononitrate isosorbate sustained-release capsule (isole) 50 mg orally once a day, and valsartan lodipine (combination of amlodipine 5 mg and valsartan 80) one tablet orally once every 12 hours, which kept blood pressure at 130/80 mmHg.
The patient was given pancreatopeptidase (yi-open) 240 units orally three times daily to increase local blood circulation and promote wound healing. The patient had anaemia, low protein, and other nutritional deficiencies which affected wound healing. To counterbalance this, the patient was given a high protein and high vitamin diet which was distributed via small meals under the precondition of controlling blood sugar.
Wound management process
To manage the wound, the inactivated tissue was removed to prevent the spread of infection. Necrotic tissues and microorganisms were also removed to prevent the absorption of toxins. To promote granulation growth, the patient’s dead bone tissue was also excised, and the sinus cavity was closed. Eschar was removed to repair the wound edge and promote epithelium creep. The edges of the wound were trimmed to protect granulation and epithelial tissue. Skin moisturisers were used around the wound to promote blood circulation.
At initial wound management (28 June 2016), an iodine solution was used to disinfect the wound, and a sodium chloride solution was used to rinse the wound. Tissue cultures were taken from the wound to assist in guiding antimicrobial therapy. Surgical debridement was used to remove senescent cells and decrease bacterial burden. INPWT was then applied to the wound. The irrigation liquid that was used was 0.01% iodide normal saline (NaCl 500ml+5% iodide 10 ml), with a speed of 20 drops per min. The negative pressure was kept between 80–125 mmHg (Figure 1).
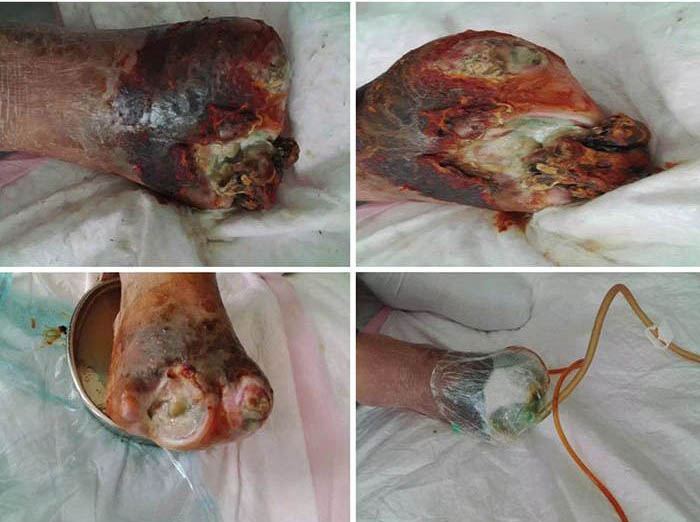
Figure 1. Initial stage of wound management (28 June 2016).
At the second stage of wound management (5 July), the wound bed was 50% erythematous and 50% yellowish (Figure 2). The wound continued to have a foul odour, with oedema around the wound, dark pigmentation, and edge impregnation. Treatment included continued debridement, and other methods as stated before. INPWT was also continued.
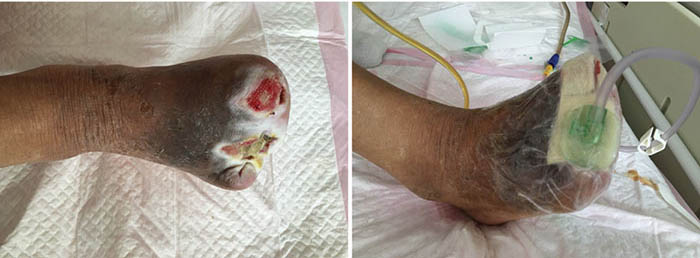
Figure 2. Second stage of wound management (5 July 2016).
At third stage management (8 July), after the removal of the dead bone, sinus cavities 3.5 cm and 2.5 cm in depth were found in the first and third digits respectively (Figure 3). The total size of wound was 3x7.5 cm. To heal the wounds, conservative debridement was applied, with washing of the sinus cavities and an implanted sponge to ensure that washing fluid reached the bottom of the sinus cavity without leaving a dead cavity. Continued INPWT was used in the treatment.
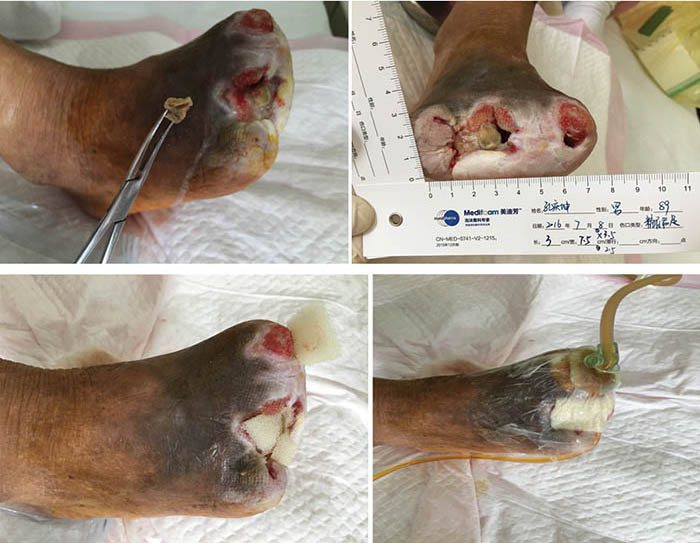
Figure 3. Third stage of wound management (8 July 2016).
After roughly 6 weeks of treatment, at ninth stage of wound management (12 August), the sinus cavity in the first toe closed (Figure 4). The wound bed was fully erythematous. The wound was managed with continued conservative debridement using NPWT; however, irrigation was discontinued.
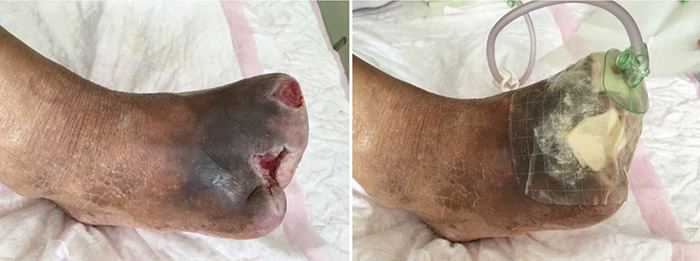
Figure 4. Ninth stage of wound management (12 August 2016).
At the 12th stage of wound management (23 August), the wound bed continued to be fully erythematous (Figure 5). The edges of the wound were macerated, and the wound no longer smelled foul. Conservative debridement to remove necrotic tissue was applied. NPWT was stopped and treatment was switched to moist dressings. A hydrocolloid film was applied to the inner later of the dressing to promote epithelisation, while a silicon foam dressing was applied to the outer layer to promote the absorption of exudate.
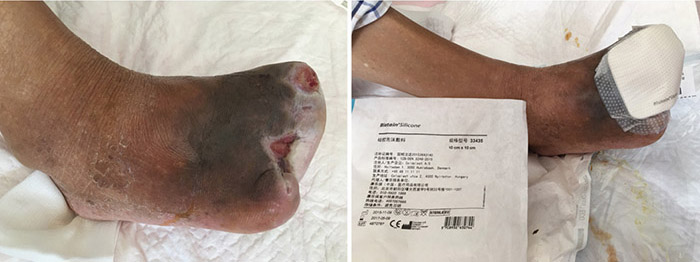
Figure 5. Twelfth stage of wound management (23 August 2016).
At the 15th stage of wound management at 3 months (27 September), toes one and three were totally healed through wound care management (Figure 6). Figure 7 shows a comparison of the initial presentation and the wound after 3 months of treatment. Figure 8 shows the fully healed wound in May 2019, some 3 years after initial presentation.
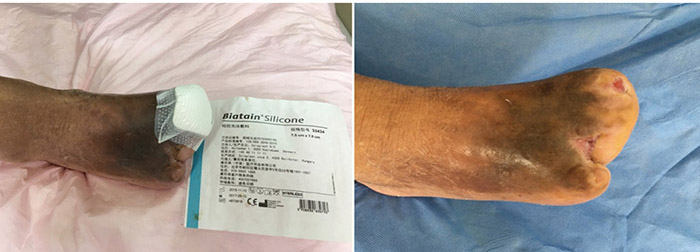
Figure 6. Fifteenth stage of wound management (27 September 2016).
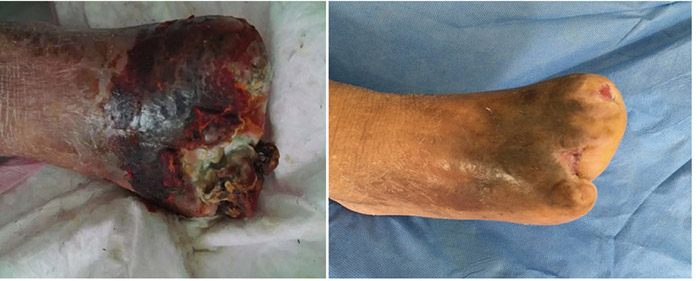
Before treatment Three months later
Figure 7. Comparison of treatment from initial presentation to after 3 months of treatment.
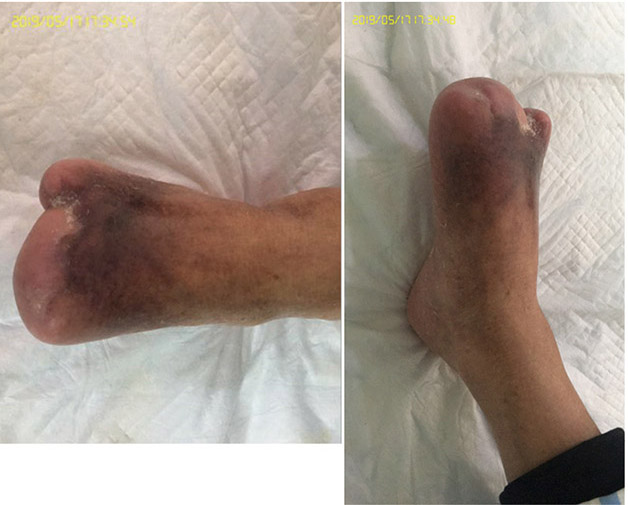
Figure 8. Fully healed wound, 3 years after initial presentation (May 2019).
Prevention
Diabetic foot is prone to relapse after healing or may reoccur in the other foot. Therefore, prevention is of vital importance. The patient needs to control their blood sugar levels and blood pressure, refrain from smoking, and participate in a consistent exercise regime. Moreover, the patient needs to diligently preform self-checkups on the problematic foot daily, practise proper foot care, wear comfortable diabetic shoes, practise regular foot hygiene, and visit the hospital for annual checkups. If any issues should arise, the patient must contact a diabetic podiatrist for examination and early treatment.
Discussion
This case report indicated that INPWT can be used to treat diabetic foot ulcers when combined with other therapies to promote wound healing. The total treatment process lasted for 3 months and cost 27,500 RMB. The success in wound treatment prevented foot amputation which could negatively impact patient health and quality of life. In addition, life-threatening infection and sepsis were prevented. The patient and their family were very satisfied with the effectiveness of the treatment.
Managing a wound in a diabetic foot is a clinical challenge – it requires multiple care strategies which are interdependent in order to reach the ultimate goal of wound healing. The literature suggests that the treatment process of a diabetic foot ulcer is lengthy, expensive and has a low curation rate12. However, this case study adds to the growing body of knowledge about utilising INPWT and adjunct therapies to heal advanced diabetic foot ulcers.
In the case of our patient, INPWT, managing patient comorbidities, and good nutrition played key roles in successfully healing his wound. The INPWT used a water bath therapy combined with closed aspiration. The main principle of INPWT is to bathe the infected wound in the cleansing solution to dissolve debris such as liquefied necrotic tissue or bacteria, inflammatory mediators, and purulent secretions. Debris can then be removed from the wound bed through a suction device. When an abundance of irrigation solution is utilised, the concentration of harmful cellular debris and metabolic by-products is effectively lowered, thus efficiently eliminating harmful substances on the surface of the wound.
Fully draining the wound secretions also reduced the wound burden and promoted local blood circulation, speeding up growth of granulation tissue15. Draining is an important process as bacterial by-products – such as endotoxins and metalloproteases from cellular metabolism during the colonisation process – can interfere with wound healing at various stages. This interference can occur through increased metabolic demands, negative microcirculatory changes, and can signal an inflammatory response. INPWT acts to produce mechanical stress on cells, removes interstitial fluid, and stimulates new cell proliferation. Meanwhile, the irrigated solution enhances these affects or introduces antimicrobial properties16.
The successful healing of our patient’s wound matches other research findings regarding INPWT. Gabriel et al.16 found that instillation of an irrigation solution in combination with NPWT enhanced wound healing through autolytic processes, prevention of glycocalyx establishment, mechanical debridement, and increased the viscosity of wound exudate which allowed for easier removal through the INPWT system. Additionally, Zelen and colleagues14 found that INPWT was effective at closing both small and large wounds resulting from diabetic neuropathy by promoting epithelialisation and granulation at the wound.
Our patient’s case was of greater complexity as he had many comorbidities alongside a severe wound infection. In addition to managing the patient’s local wound, emphasis was therefore placed on systemic treatment such glycaemic control, blood pressure reduction, improving microcirculation and ensuring better nutritional status. These strategies are in alignment with the Practical guidelines on the management and prevention of the diabetic foot 201117 which notes the importance of proper nutrition and maintaining blood sugar levels at less than 8 mmol/L.
Another study highlighted the importance of good nutrition for preventing amputation in individuals with diabetic foot ulcers. Their findings illuminated how nutritional status has a significant impact on limb preservation. The proposed mechanism through which poor nutritional status impacts wound healing is multi-faceted. Nutrients are lost in wound exudate, and comorbidities can impact nutrient uptake which are major concerns due to the metabolic requirements for the products of wound healing such as collagen formation and fibroblast proliferation18. Thus, if nutrition is inadequate, wound healing can be delayed or severe progressions in the ulcer can develop and lead to the need for amputation. Through comprehensive treatment, the patient’s wound healed successfully, and amputation was avoided. A plethora of research has demonstrated that amputation will drastically decrease quality of life, therefore avoiding amputation was of vital importance for the patient19.
Conflict of Interest
The authors declare no conflicts of interest. The patient consented to the usage of the photographs in this article.
Funding
The authors received no funding for this study.
Traitement de la gangrène du pied diabétique par irrigation et thérapie par pression négative : une étude de cas
Ai-hua Chen, Huiling Liu, Chunmei Zhang and Ping Zou
DOI: https://doi.org/10.33235/wcet.39.3.20-25
Résumé
Cette étude de cas résume le traitement d’un patient souffrant d’une gangrène du pied diabétique. Une irrigation et une thérapie par pression négative à l’aide de pansements humides ont permis d’éviter une amputation du pied. Le traitement consistait en : un examen complet de l’état de santé du patient, général et local ; le choix du type de parage adapté (parage avec instruments chirurgicaux par exemple) ; contenir l’infection pour éviter sa propagation ; irrigation et thérapie par pression négative pour réduire l’absorption d’endotoxines ; et traitements actifs contre les causes primaires comme le contrôle de la glycémie et de la tension artérielle et l’amélioration de la microcirculation et de la nutrition. Après 2 mois d’irrigation et de thérapie par pression négative intenses, le lit de la plaie du patient s’est amélioré. Après l’application de pansements humides, la plaie s’est refermée et a cicatrisé au bout de 3 mois.
Introduction
Le taux de prévalence dans le monde du diabète sucré s’élève à 8,5 %. Près de 90 % des cas sont des diabètes de type 2.1, 2 Au cours des dernières décennies, le taux de prévalence du diabète dans le monde a considérablement augmenté, puisqu’il a été multiplié par quatre depuis 1980.2 Cela peut être attribué à un vieillissement rapide de la population, à une croissance démographique générale et à une augmentation des cas d’obésité. L’on estime que d’ici 2030, le nombre de personnes diabétiques dans le monde atteindra près de 550 millions, ce qui fera du diabète un problème de santé publique crucial à l’échelle mondiale. C’est actuellement en Chine qu’on trouve le plus grand nombre de personnes diabétiques. Selon la toute dernière étude épidémiologique menée par le Comité national de santé en 2018, 11,6 % de la population chinoise souffre de diabète (114 millions de diabétiques dans le pays). En outre, la Chine affiche des taux de traitement (32,2 %) et de contrôle (49,2 %) faibles, ce qui multiplie les cas de complications (risques de maladies cardiovasculaires, d’accident vasculaire cérébral, de cécité, d’insuffisance rénale et d’amputation). Ces complications ont des conséquences gaves sur la qualité de vie des patients.
L’une des comorbidités les plus fréquentes du diabète est l’ulcère du pied. L’Organisation mondiale de la Santé (OMS) définit la maladie du pied diabétique comme une infection, un ulcère et / ou une destruction des tissus profonds du pied dû à une anomalie locale des nerfs et à des changements pathologiques vasculaires périphériques distaux dans un membre inférieur.3 Les cas d’ulcères du pied chez les personnes diabétiques est de 6,3 %, avec une incidence à vie de 19 à 34 % au sein de la population.4, 5 Le principal problème des ulcères du pied chez les diabétiques est que la cicatrisation de la plaie prend beaucoup de temps. La probabilité de cicatrisation d’une plaie est moindre chez les diabétiques en raison de nombreux facteurs comme le dysfonctionnement circulatoire, l’hyperglycémie, la neuropathie, l’hypoxie et le défaut des signaux des neuropeptides, et à cause de comorbidités comme les rénopathies en phase terminale, l’insuffisance cardiaque congestive et les maladies de l’artère périphérique.4, 6 Bon nombre de ces facteurs contribuent au développement initial des ulcères du pied diabétique. Il existe d’autres facteurs qui contribuent à la progression de l’ulcère : un indice de masse corporelle élevé, une difformité du pied, être de sexe masculin, être atteint depuis longtemps de diabète, être d’un âge avancé et une mauvaise hygiène des pieds.7
Pour les personnes souffrant d’un ulcère du pied diabétique, le taux d’infection est supérieur à 50 %.8 L’infection est un processus qui suit plusieurs étapes : invasion des micro-organismes, réaction inflammatoire à l’invasion et dégradation et destruction des tissus.9 Les facteurs contribuant à une infection d’un ulcère de pied diabétique sont les plaies de plus de 30 jours, les plaies profondes, les plaies traumatiques et les plaies concomitantes à une maladie artérielle périphérique.8, 9
En outre, l’infection d’un ulcère de pied diabétique peut aboutir à une gangrène.10 La gangrène du pied diabétique est le stade final de la maladie du pied diabétique, souvent concomitante à des lésions nerveuses et vasculaires des autres organes.2 Les infections peuvent être l’ostéomyélite, la cellulite, les abcès, la fasciite ou l’arthrite septique.11 Ces infections peuvent être causées aussi bien par des champignons et des bactéries comme le staphylocoque, la protéobactérie, la bacille pyocyanique, le streptocoque et les bactéries coliformes.10
En raison de l’infection et du temps particulièrement long de cicatrisation, les ulcères de pied diabétique peuvent entraîner des amputations. Les individus souffrant d’un ulcère du pied diabétique ont 10 à 20 fois plus de risques de subir une amputation comparé aux personnes non diabétiques.2, 7 L’amputation peut entraîner d’autres complications et le taux de survie 5 ans après l’amputation est de 30 % pour les personnes diabétiques.4 Une étude a révélé que les taux d’amputation pour les infections modérées à graves étaient respectivement d’environ 46 à 78 %.8
L’infection est généralement traitée par des antibiotiques, une intervention chirurgicale et un parage de la plaie.8, 11 D’autres thérapies auxiliaires accompagnant ces méthodes incluent la thérapie de plaie par pression négative (TPN) et l’oxygénothérapie hyperbare. Un traitement complet et une gestion locale de la gangrène du pied diabétique sont donc essentiels si l’on veut réduire le taux d’amputation des patients souffrant de maladies du pied diabétique afin qu’ils gardent leur pied et toute leur mobilité, et ne voient pas leur qualité de vie se dégrader.12
La thérapie de plaie par pression négative (TPN) est une forme de traitement consistant à placer toute la surface d’une plaie sous une pression négative maintenue par un pansement occlusif et raccordé à une source de dépression externe par un tube. La TPN permet de rapprocher les extrémités de la plaie pour favoriser la cicatrisation. Cela encourage la formation des tissus de granulation, réduit l’œdème, facilite la microcirculation, et permet de se débarrasser des petits débris et de recueillir l’exsudat par aspiration13. Cette thérapie peut être associée à d’autres traitements comme l’instillation qui ajoute une quantité précise de solution de nettoyage, comme un antiseptique ou un antibiotique, afin de traiter les infections du pied diabétique.13, 14
En mai 2016, une personne souffrant d’une gangrène de pied diabétique classé Wagner IV a été hospitalisée dans notre service. Le présent article traite des antécédents cliniques de ce patient, de son examen et de son traitement. Après un traitement de 3 mois, la plaie du patient était bien cicatrisée et l’amputation du pied a pu être évitée.
Étude de cas
Antécédents cliniques et examen
Le patient, un homme âgé de 88 ans, fut hospitalisé le 22 mai 2016. Il souffrait de polydipsie et de polyurie depuis plus de trois ans. Un examen physique a révélé une température corporelle de 37,8oC, un pouls de 84 battements / minute et une tension artérielle de 160 / 90 mmHg. L’homme semblait éveillé et savoir où il était. Sa glycémie à jeun s’élevait à 11 mmol/l, son hémoglobine à 110 g/l, son taux d’albumine à 38,1 g/l et sa leucocytémie à 11 x 109/l.
Le pouls de l’artère pédieuse sur le côté droit était faible et la partie frontale de son pied droit était de couleur noire / mauve. Les premier et deuxième orteils du pied droit du patient étaient absents et les trois autres étaient de couleur mauve / noire avec une nécrose apparente. Les tissus n’étaient que partiellement reliés à la peau de la voûte plantaire. Des tissus jaunâtres recouvraient l’intégralité du lit de la plaie avec de larges exsudats gris, purulents et malodorants au niveau de la plaie, preuves d’une infection grave. Le bord de la plaie était d’apparence mauve / noire, irrégulier, avec un œdème et une peau dégageant de la chaleur. La température de la peau du membre inférieur droit du patient était supérieure à celle du membre inférieur gauche. La plaie a été classée Wagner de grade 4. Sur une échelle de valeurs numériques, le patient a indiqué une douleur de 8 / 10 où 0 correspond à aucune douleur et 10 à la pire douleur.
Le diagnostic effectué au moment de l’admission du patient a été le suivant : diabète sucré de type II et gangrène et infection du pied diabétique, maladie coronarienne athérosclérotique avec angine instable et avec, deux ans plus tôt, un infarctus du myocarde sans élévation du segment ST chronique, arythmie et fibrillation auriculaire paroxystique de phase 3, hypertension artérielle de niveau 3 (risque élevé), séquelles d’infarctus cérébral et formation d’une plaque artérielle dans les deux membres inférieurs. Le docteur a préconisé une amputation du pied, mais le patient a refusé.
En juin 2016, le patient a été redirigé vers du personnel infirmier d’entérostomie pour un traitement du pied et des soins de sa plaie. Le patient souffrait d’une sténose de l’artère fémorale du côté droit (90 %) et d’une sténose de l’artère poplitée et de l’artère tibiale postérieure (61 %, 80 %). Un stent sur l’artère périphérique inférieure droite a été posé et est resté en place pendant 5 mois. Il a permis un débit sanguin artériel postopératoire positif. Après un examen complet, le personnel infirmier d’entérostomie n’a pas émis de contre-indications quant à une thérapie par pression négative (TPN) du patient. C’était la première fois, dans ce grand hôpital, qu’était utilisé un traitement avec irrigation et pression négative pour traiter un ulcère de pied diabétique. Les facteurs ayant influé sur la guérison du patient ont été son grand âge, les différentes comorbidités comme le diabète, la maladie cardiovasculaire, une mauvaise nutrition, une maladie chronique et sa santé mentale.
Traitement systémique
Comme indiqué ci-avant, le traitement incluait de stopper la propagation de l’infection, mais comprenait également des traitements actifs des maladies primaires comme un contrôle de la glycémie et de la tension artérielle, ainsi qu’une amélioration de la microcirculation et de la nutrition.
L’objectif de cicatrisation de la plaie était de 0,2 cm par semaine, mais avec une numération bactérienne de la plaie égale ou supérieure à à 106/mm2, la vitesse de cicatrisation diminue en principe à 0,055 cm/semaine. Plus l’infection bactérienne est grave, plus la cicatrisation de la plaie est longue.3 Il est donc essentiel de mettre en place des mesures systémiques de contrôle de l’infection dans le cadre du traitement local de la plaie. Le patient s’est vu prescrire une perfusion intraveineuse de pipéracilline sodique à un débit de 2,5 g toutes les 8 heures. Des cultures de plaie ont indiqué une multiplication des Staphylococcus aureus et des Pseudomonas aeruginosa, suggérant un besoin d’ofloxacine. De ce fait, une injection de chlorure de sodium de lévofloxacine de 0,4 g a été administrée par perfusion intraveineuse une fois par jour pendant une semaine. La température du patient était normale et son état était stable.
Afin de contrôler sa glycémie, il a pris des tablettes de phosphate sieglidine d’une dose de 100 mg une fois par jour. Ont également été prescrits au patient des carbosaccharides (baicana) à raison de 50 mg trois fois par jour (prise orale) pour l’aider à contenir sa glycémie à jeun à 7 mmol/l et sa glycémie postprandiale à environ 10 mmol/l.
Pour faire baisser sa tension artérielle, le patient a reçu de l’amberyl mertolol (betatolak) à raison de 47,5 mg (prise orale) par jour, une capsule à libération prolongée de mononitrate d’isosorbide (isole) à raison de 50 mg une fois par jour (prise orale) et un comprimé de Lodipine/Valsartan (combinaison d’amlodipine à 5 mg et de Valsartan 80) (prise orale) toutes les 12 heures. Cela a permis de maintenir sa tension artérielle à 130/80 mmHg.
Le patient a reçu 240 unités de pancréatopeptidase (yi-open) (prise orale) trois fois par jour pour améliorer sa circulation sanguine locale et la cicatrisation de la plaie. Le patient souffrait d’anémie, d’un faible taux de protéines et d’autres carences nutritionnelles affectant la cicatrisation de sa plaie. Pour compenser ses carences, le patient a suivi un régime riche en protéines et en vitamines sous forme de repas légers, sous condition de vérification de sa glycémie.
Traitement de la plaie
Pour traiter la plaie, des tissus inactivés ont été retirés pour stopper la propagation de l’infection. Des tissus et micro-organismes nécrotiques ont également été retirés pour empêcher toute absorption de toxines. Pour encourager la croissance de tissus granulaires, des tissus d’os mort du patient ont été excisés et la cavité de la fistule a été fermée. Une escarre a été retirée pour permettre une réparation de la lèvre de plaie et encourager la progression de l’épithélium. Les lèvres de la plaie ont été taillées pour protéger la granulation et les tissus épithéliaux. Des produits hydratants pour la peau ont été appliqués autour de la plaie pour faciliter la circulation sanguine.
Lors du traitement initial de la plaie (le 28 juin 2016), une solution iodée et une solution de chlorure de sodium ont été utilisées respectivement pour désinfecter et rincer la plaie. Des cultures de tissus ont été prélevées de la plaie pour mieux orienter le traitement antimicrobien. Un parage chirurgical a été effectué pour retirer les cellules sénescentes et réduire la charge bactérienne. La thérapie par irrigation et pression négative a alors été renouvelée sur la plaie. Le liquide d’irrigation utilisé était une solution isotonique de chlorure de sodium d’iodure à 0,01 % (NaCl 500 ml + 5 % iodure 10 ml), à un débit de 20 gouttes par minute. La pression négative a été maintenue à 80 - 125 mmHg (figure 1).
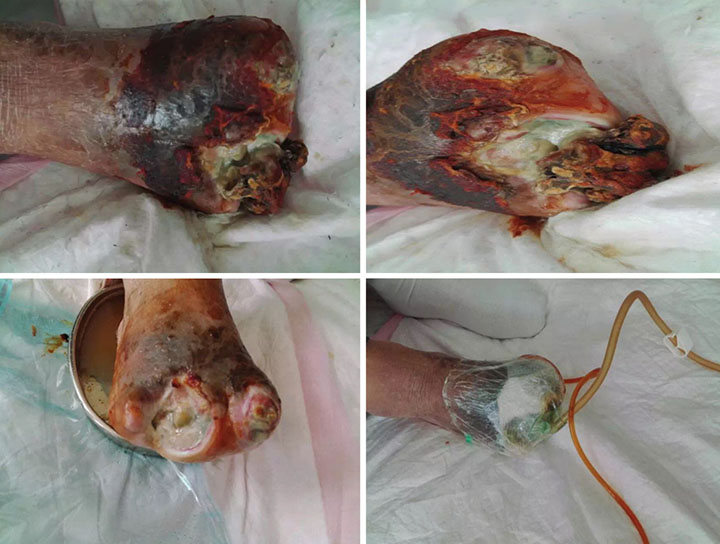
Figure 1 : stade initial du traitement de la plaie (28 juin 2016)
Au deuxième stade du traitement de la plaie (le 5 juillet), le lit de la plaie était 50 % érythémateux et 50 % jaunâtre (figure 2). De la plaie continuait d’émaner une terrible odeur avec autour de la plaie, un œdème, une pigmentation sombre et une imprégnation sur les bords. Le traitement incluait un parage et d’autres méthodes déjà mentionnées ici. La thérapie par irrigation et pression négative s’est poursuivie.
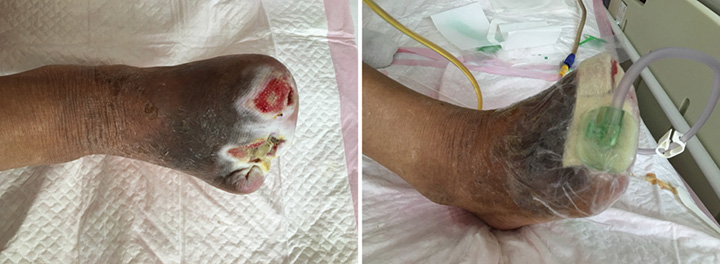
Figure 2 : deuxième stade du traitement de la plaie (5 juillet 2016)
Au troisième stade du traitement (le 8 juillet), après le retrait de l’os mort, des cavités de fistule d’une profondeur de 3,5 cm et de 2,5 cm ont été trouvées respectivement au niveau du premier et du troisième orteil (figure 3). Les dimensions totales de la plaie étaient de 3 x 7,5 cm. Afin de cicatriser les plaies, un parage conservateur a été effectué, ainsi qu’un nettoyage des cavités des fistules et un implant d’éponge pour s’assurer que le produit de lavage atteigne le fond de la cavité sans laisser de cavité morte. La thérapie par irrigation et pression négative s’est poursuivie.
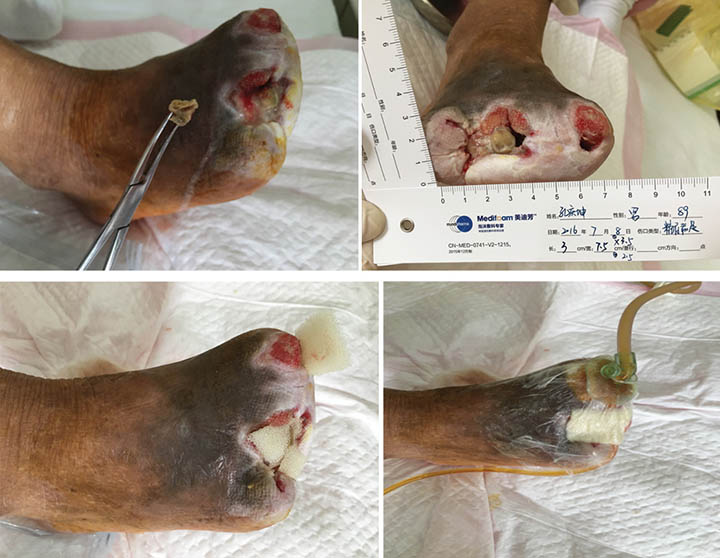
Figure 3 : troisième stade du traitement de la plaie (8 juillet 2016)
Après environ 6 semaines de traitement, c’est au neuvième stade du traitement de la plaie (le 12 août) que la cavité du premier orteil s’est refermée (figure 4). Le lit de la plaie était entièrement érythémateux. La plaie a été traitée par un parage conservateur continu avec thérapie par irrigation et pression négative, mais l’irrigation a été stoppée.
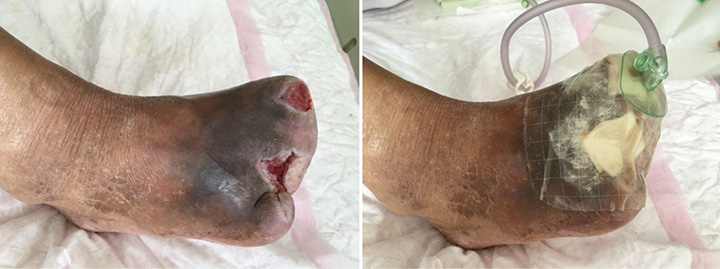
Figure 4 : neuvième stade du traitement de la plaie (12 août 2016)
Au 12e stade du traitement (le 23 août), le lit de la plaie continuait d’être totalement érythémateux (figure 5). Les bords de la plaie ont été macérés et l’odeur nauséabonde en émanant a cessé. Un parage conservateur pour retirer les tissus nécrotiques a été effectué. La thérapie par irrigation et pression négative a cessé et un traitement avec pansements humides a commencé. Un film hydrocolloïde a été appliqué sur la couche interne du pansement pour permettre une épithélialisation et un pansement de mousse à base de silicone a été appliqué sur la couche externe pour permettre l’absorption d’exsudat.
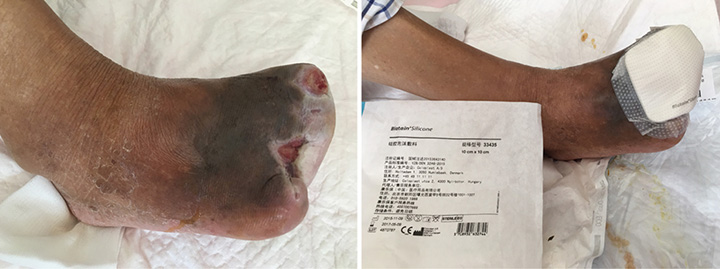
Figure 5 : douzième stade du traitement de la plaie (23 août 2016)
Au 15e stade du traitement de la plaie (à 3 mois, le 27 septembre), les premier et troisième orteils étaient entièrement cicatrisés grâce à un traitement de la plaie (figure 6). La figure 7 illustre une comparaison entre le pied à l’arrivée du patient à l’hôpital et ce même pied après trois mois de traitement. La figure 8 présente la plaie entièrement cicatrisée en mai 2019, près de 3 ans après l’arrivée du patient à l’hôpital.
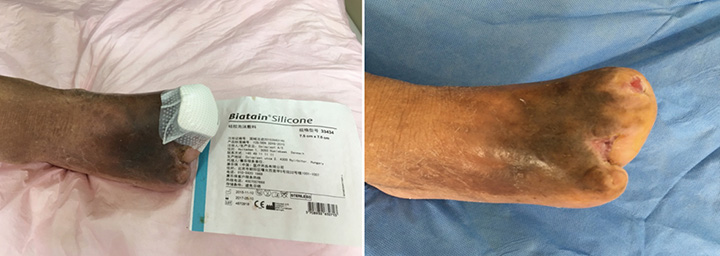
Figure 6 : quinzième stade du traitement de la plaie (27 septembre 2016)
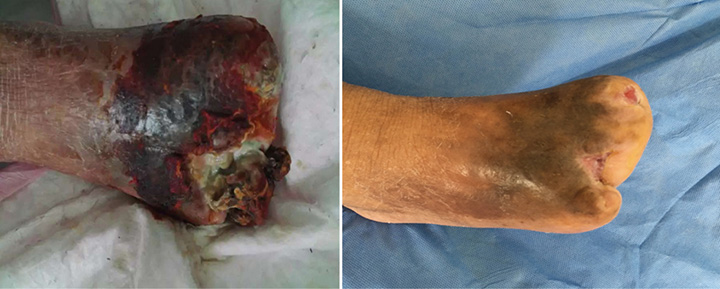
Avant le traitement Trois mois plus tard
Figure 7 : évolution du traitement de la première consultation à 3 mois après le traitement
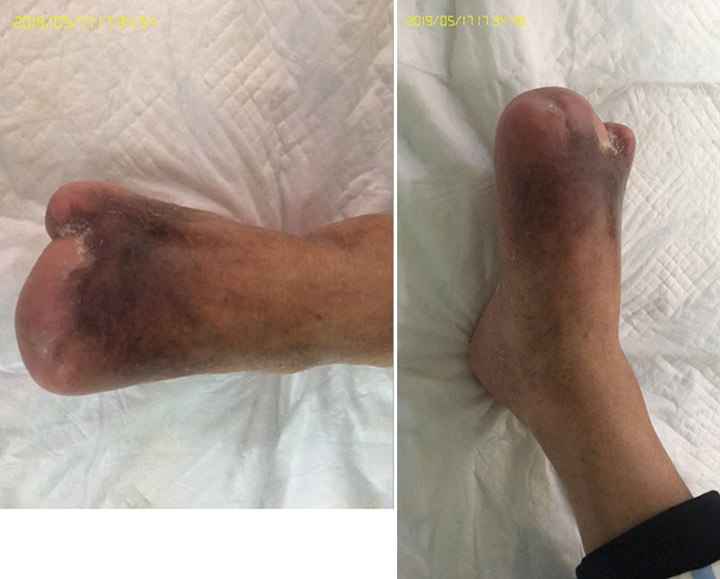
Figure 8 : plaie totalement cicatrisée, 3 ans après la première consultation (mai 2019)
Prévention
Il existe des risques de récidive du pied diabétique après la cicatrisation ou l’infection peut affecter l’autre pied. La prévention est donc absolument vitale. Le patient doit contrôler sa glycémie et sa tension artérielle, ne pas fumer et pratiquer des activités sportives de manière régulière. En outre, le patient doit procéder chaque jour à un examen minutieux de son pied malade, en prendre bien soin et porter des chaussures confortables pour pieds diabétiques, avoir une bonne hygiène régulière des pieds et aller à l’hôpital une fois par an pour un bilan de santé. En cas de problème, le patient doit contacter un podiatre spécialisé dans les pieds diabétiques pour se faire examiner et éventuellement suivre un traitement au plus tôt.
Discussion
Cette étude de cas indique que la thérapie par irrigation et pression négative peut être utilisée pour traiter les ulcères de pieds diabétiques, associée à d’autres thérapies pour stimuler la cicatrisation des plaies. Le traitement complet a duré 3 mois et a coûté 27 500 yuans. Étant donné que la plaie a pu être soignée, l’amputation du pied a pu être évitée. Elle aurait eu un impact négatif sur la santé et la qualité de vie du patient. En outre, l’infection engageant le pronostic vital et la septicémie ont pu être évitées. Le patient et sa famille étaient très satisfaits de l’efficacité du traitement.
Le traitement d’un pied diabétique est un défi clinique de taille, qui exige la mise en œuvre de plusieurs stratégies de soins interdépendantes afin d’atteindre l’objectif ultime : la cicatrisation de la plaie. Des publications suggèrent que le traitement de l’ulcère du pied est long et coûteux, et que son taux de guérison est faible.12 Cependant, cette étude de cas enrichit les connaissances sur l’utilisation de la thérapie par irrigation et pression négative et de thérapies adjuvantes pour soigner les ulcères du pied diabétique à un stade avancé.
Dans le cas présent, la thérapie par irrigation et pression négative, la gestion des comorbidités du patient et une bonne nutrition ont joué un rôle essentiel dans la guérison de sa plaie. La thérapie par irrigation et pression négative a utilisé une thérapie de bain d’eau combinée à une aspiration fermée. Le principe clé de la thérapie par irrigation et pression négative est d’immerger la plaie infectée dans une solution de nettoyage pour dissoudre les débris tels que les tissus nécrotiques liquéfiés ou les bactéries, les médiateurs inflammatoires et les sécrétions purulentes. Des débris peuvent ensuite être retirés du lit de la plaie à l’aide d’un dispositif d’aspiration. Une solution d’irrigation utilisée en abondance permet de diminuer de manière efficace la concentration de débris cellulaires nocifs et de sous-produits métaboliques, et de bien éliminer les substances nocives en surface de la plaie.
Un drainage complet des sécrétions de la plaie réduit également sa charge et facilite la circulation sanguine locale, accélérant la croissance des tissus granulaires.15 Le drainage est une étape importante car les sous-produits bactériologiques, comme les endotoxines et les métalloprotéinases du métabolisme cellulaire pendant le processus de colonisation, peuvent interférer à différents stades de la cicatrisation de la plaie. Cette interférence peut survenir à un moment où les besoins métaboliques augmentent, en cas de changements microcirculatoires négatifs, et peut signaler une réaction inflammatoire. La thérapie par irrigation et pression négative agit pour produire un stress mécanique sur les cellules, retire le liquide interstitiel et stimule la prolifération de nouvelles cellules. Entre temps, la solution irriguée améliore ces effets ou introduit des propriétés antimicrobiennes.16
La cicatrisation réussie de la plaie de notre patient concordait avec d’autres résultats en matière de thérapie par irrigation et pression négative. Gabriel et al.16 ont révélé que l’instillation d’une solution d’irrigation en association avec une thérapie par irrigation et pression négative améliorait la cicatrisation de la plaie par des processus autolytiques, une prévention de la mise en place du glycolemme et un parage mécanique. Cela augmentait la viscosité de l’exsudat de la plaie, permettant un retrait plus simple à l’aide du dispositif de thérapie par irrigation et pression négative. De plus, Zelen et ses collègues14 ont découvert que la thérapie par irrigation et pression négative était efficace pour fermer des plaies aussi bien larges que petites dues à une neuropathie diabétique en encourageant l’épithélialisation et la granulation au niveau de la plaie.
Le cas de notre patient était d’une plus grande complexité et l’infection de plaie grave dont il souffrait s’accompagnait de nombreuses comorbidités. En plus de gérer la plaie du patient au niveau local, la priorité a été un traitement systémique comme le contrôle de la glycémie, la baisse de la tension artérielle, l’amélioration de la microcirculation et de son état nutritionnel. Ces stratégies sont conformes aux Recommandations pratiques de traitement et de prévention du pied diabétique 201117 qui soulignent l’importance d’une bonne nutrition et du maintien du taux de glycémie à moins de 8 mmol/l.
Une autre étude a confirmé l’importance d’une bonne nutrition pour prévenir les amputations chez les personnes souffrant d’un ulcère du pied diabétique. Leurs résultats nous ont éclairés sur les effets significatifs de l’état nutritionnel sur la préservation des membres. Les raisons pour lesquelles l’état nutritionnel a des effets sur la cicatrisation de la plaie sont multiples. Il y a une perte de nutriments avec l’exsudat de la plaie et les comorbidités peuvent avoir un impact sur la prise d’aliments. Cela pose problème en raison des besoins du métabolisme pour la cicatrisation de la plaie (formation de collagène et prolifération de fibroblaste).18 Ainsi, si la nutrition n’est pas adaptée, la cicatrisation de la plaie pourrait être retardée ou l’ulcère risque de progresser, avec tous les risques d’amputation que cela comporte. C’est grâce à un traitement global que la plaie du patient a bien cicatrisé et que l’amputation a pu être évitée. De très nombreuses études ont démontré qu’une amputation nuit considérablement à la qualité de vie du patient et de ce fait, il est crucial de tout faire pour l’éviter.19
Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts. Le patient a consenti à l’utilisation des photographies du présent article.
Financement
Les auteurs n’ont reçu aucun fonds pour cette étude.
Author(s)
Ai-hua Chen
ET, RN, BScN
Director of Wenzhou Enterostomal Therapy Nursing Education Programs, Second Affiliated Hospital of Wenzhou Medical University, Wenzhou, Zhejiang Province, P. R. China
Huiling Liu
ET, RN
971 Hospital of the Chinese People’s Liberation Army Navy, Qingdao, Shandong Province, P. R. China
Chunmei Zhang
RN,PhD
Nursing Director of Second Affiliated Hospital and Yuying
Children’s Hospital of Wenzhou Medical University, Wenzhou, Zhejiang Province, P. R. China
Ping Zou*
RN, PhD
Associate Professor, School of Nursing, Nipissing University, Toronto, ON, Canada
Email pingz@nipissingu.ca
* Corresponding author
References
- Chen L, Magliano DJ, Zimmet PZ. The worldwide epidemiology of type 2 diabetes mellitus: present and future perspectives. Nature Rev Endocrin 2012;8(4):228.
- World Health Organization. Global report on diabetes. WHO Press, World Health Organization, 20 Avenue Appia, 1211 Geneva 27, Switzerland: World Health Organization; 2016.
- Xiao-bing F. The treatment of diabetic foot and management of its related chronic refractory wounds. People’s Military Medical Publishing Press; 2013.
- Armstrong DG, Boulton AJ, Bus SA. Diabetic foot ulcers and their recurrence. N Engl J Med 2017;376(24):2367–75.
- Zhang P, Lu J, Jing Y, Tang S, Zhu D, Bi Y. Global epidemiology of diabetic foot ulceration: a systematic review and meta-analysis. Annals Med 2017;49(2):106–16.
- Baltzis D, Eleftheriadou I, Veves A. Pathogenesis and treatment of impaired wound healing in diabetes mellitus: new insights. Adv Ther 2014;31(8):817–36.
- Yazdanpanah L, Nasiri M, Adarvishi S. Literature review on the management of diabetic foot ulcer. World J Diabetes 2015;6(1):37.
- Hobizal KB, Wukich DK. Diabetic foot infections: current concept review. Diabetic Foot Ankle 2012;3(1):18409.
- Lipsky BA, Aragón‐Sánchez J, Diggle M, Embil J, Kono S, Lavery L, et al. IWGDF guidance on the diagnosis and management of foot infections in persons with diabetes. Diabetes/Metab Res Rev;2016;32:45–74.
- Noor S, Zubair M, Ahmad J. Diabetic foot ulcer: a review on pathophysiology, classification and microbial etiology. Diabetes Metabo Synd: Clin Res Rev 2015;9(3):192–9.
- Barshes NR, Sigireddi M, Wrobel JS, Mahankali A, Robbins JM, Kougias P, et al. The system of care for the diabetic foot: objectives, outcomes, and opportunities. Diabetic Foot Ankle 2013;4(1):21847.
- Qiu X, Zhao W, Du X. Clinical analysis of 56 cases of diabetic foot gangrene treatment J North China Uni (natural science edition) 2011;18(4):506–7.
- Back DA, Scheuermann‐Poley C, Willy C. Recommendations on negative pressure wound therapy with instillation and antimicrobial solutions: when, where and how to use: what does the evidence show? Int Wound J 2013;10(s1):32–42.
- Zelen CM, Stover B, Nielson D, Cunningham M. A prospective study of negative pressure wound therapy with integrated irrigation for the treatment of diabetic foot ulcers. Eplasty 2011;11.
- Chou TH. The application of “TIME” principle in the preparation of wound beds. J Chin Nurs 2013;48(9):855–7.
- Gabriel A, Shores J, Heinrich C, Baqai W, Kalina S, Sogioka N, et al. Negative pressure wound therapy with instillation: a pilot study describing a new method for treating infected wounds. Int Wound J 2008;5(3):399–413.
- Bakker K, Apelqvist J, Schaper NC, Board IWGotDFE. Practical guidelines on the management and prevention of the diabetic foot 2011. Diabetes/Metab Res Rev 2012;28:225–31.
- Gau B-R, Chen H-Y, Hung S-Y, Yang H-M, Yeh J-T, Huang C-H, et al. The impact of nutritional status on treatment outcomes of patients with limb-threatening diabetic foot ulcers. J Diabetes Complications 2016;30(1):138–42.
- Laiteerapong N, Karter AJ, Liu JY, Moffet HH, Sudore R, Schillinger D, et al. Correlates of quality-of-life in older adults with diabetes: The Diabetes & Aging Study. Diabetes Care 2011;DC_102424.
