Volume 41 Number 3
The nursing assessment of pemphigus vulgaris ulcers
Mariana Takahashi Ferreira Costa, Luiza Keiko Matsuka Oyafuso, Mônica Antar Gamba and Kevin Y Woo
Keywords nursing, skin diseases, dermatology, vesiculobullous, acantholysis
For referencing Costa MTF et al. The nursing assessment of pemphigus vulgaris ulcers. WCET® Journal 2021;41(3):27-37
DOI
https://doi.org/10.33235/wcet.41.3.27-37
Submitted 16 March 2021
Accepted Accepted 18 July 2021
Abstract
Introduction Pemphigus vulgaris (PV) is a severe autoimmune bullous dermatosis resulting in the formation of intraepidermal blisters affecting the skin and mucous membranes. Epidemiologic data shows an incidence of 0.1–0.5 per 100,000 inhabitants per year, and mortality at almost 5–10%.
Objective The objective of this integrative literature review was to examine the classification/terminology of PV ulcers according to the description of skin lesions.
Method This is an integrative review of primary studies, series/clinical reviews or validation studies that describe or evaluate PV ulcers. Search strategies included relevant papers that were published between 2011–2019 using terms such as pemphigus, skin ulcer, dermatology, diagnostic, nursing assessment. The studies were selected for analysis after application of eligibility criteria and exclusion by duplicity.
Results The initial search resulted in 2,934 publications; 14 articles were eligible for analysis. The synthesis of the studies was organised as follows – 57.14% series/clinical reviews, 50% written by physicians, 64.29% level of evidence 4. The terminology used to describe PV ulcers included skin/mucosal erythema, new erythema, post-inflammatory hyperpigmentation, oral lesions, epithelialisation scabs, blisters, bullae, erosions, eroded areas, erosive exudative lesions, dry erosive.
Conclusions Studies with better levels of evidence are needed on this issue in order to determine the best way to describe the lesions using the dermatological glossary for nursing assessment.
Introduction
Pemphigus vulgaris (PV) is a severe autoimmune bullous dermatosis in which the antibodies destroy the desmosomes, resulting in the formation of intraepidermal blisters that affect the skin and mucous membranes. PV occurs mainly between the 4th and 6th decades of life, affecting males and females with an incidence of 0.1–0.5 / 100,000 inhabitants / year and with a mortality rate of 5–10%. The disease distribution is universal, but most commonly affects people of Jewish ancestry–3.
In PV, autoantibodies act predominantly on desmoglein 3 (Dsg3) which is expressed predominantly in the deeper layers of the epidermis2,3. Identifying the layer on which acantholysis occurs is a factor that assists in the diagnosis of bullous dermatoses. For example, it is possible to differentiate PV from pemphigus foliaceus by the site where acantholysis occurs, since pemphigus foliaceus affects the granular layer whereas PV affects the spinous layer2,3. These manifestations involve the formation of blisters with consequent ulceration and skin damage which can be devastating, affecting social interaction and even loss of employment4.
The impact of disfigurement associated with PV on patients’ quality of life, self-image, family and social dynamics has been well documented4. In addition to cutaneous involvement, PV may involve mucosal tissue in the mouth, pharynx, larynx, nasal passage and ear canals (Figures 1 & 2). Areas affected by the disease can compromise normal breathing as well as the ability to speak and to eat to maintain adequate nutritional intake2,3.
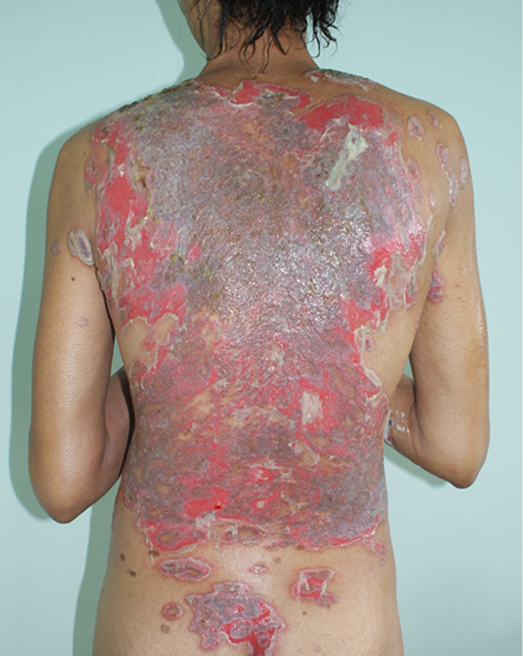
Figure 1. Cutaneous lesions on trunk
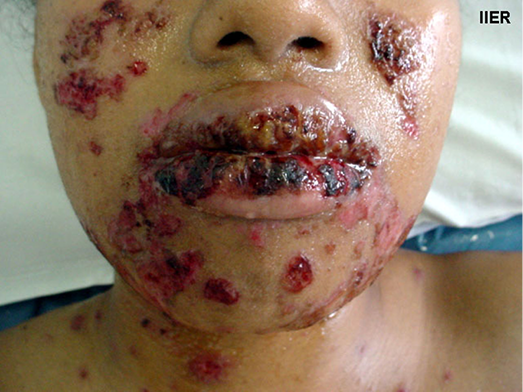
Figure 2. Oral mucosa lesions
The classification of PV has been the object of studies in recent years. The Commitment Index of Skin and Mucous in Pemphigus Vulgaris uses four different parameters to score the disease clinical status: (a) the number of blisters or eroded areas; (b) the size of blisters or eroded areas; (c) evidence of the Nikolsky sign (where sliding the finger firmly with pressure over the skin separates normal-appearing epidermis, producing an erosion); and (d) mucousal involvement and sepsis. The total score may vary from 0–100, and the patients are classified as follows: Class I score 0–30; Class II 35–65; Class III 70–100, meaning that the higher the score, the more critical the status1.
Pemphigus classifications tools, the Pemphigus Disease Area Index (PDAI) and the Japanese Pemphigus Disease Severity Score (JPDSS), were compared by Shimizu et al.5. PDAI measures skin and mucosal involvement by size and number of blisters in each anatomical region, and the score ranges from 0–263. JPDSS uses parameters for scoring: (I) the ratio of affected area of skin to the body’s surface area; (II) the presence or absence of Nikolsky’s sign phenomenon; (III) the number of newly developed blisters per day; (IV) the presence or absence of oral lesions; and (V) the titer of pemphigus antibodies. Each parameter has a score ranging 0–3. In Shimizu et al.’s study5, the results show that PDAI more accurately reflects disease severity. The authors therefore propose the use of indexes to guide a uniform treatment according to grading criteria. Corticotherapy is the treatment of choice, and it can be associated with immunosuppressants if there is no improvement with isolated corticotherapy2,3.
Although considered a relatively rare disease, there is a need for nurses to recognise skin lesions associated with PV and communicate appropriate findings in order to help patients seek early treatment, evaluate disease progression, and monitor responses to treatment6. The purpose of this integrative review was to describe the taxonomy for the description and assessment of skin changes related to PV by nurses.
Method
This integrative review was conducted to identify, analyse and synthesise studies that use qualitative, quantitative and mixed methods in this theme7. We have chosen the method described by Mendes7 to guide the review which consisted of six stages: (1) formulation of the guiding question; (2) establishment of criteria for inclusion and exclusion of studies and data collection (search in the literature); (3) categorisation of studies; (4) evaluation of studies included in the review; (5) analysis and interpretation of data; and (6) synthesis of the knowledge evidenced in the articles analysed (presentation of the results)7.
Formulation of the guiding question
The research question was – How are the lesions that characterise PV described in the literature in its definition and classification?
Establishment of criteria for inclusion and exclusion of studies and data collection
The medical and nursing literature was searched from 2011–2019 in conjunction with a librarian to assist in answering the research question. Searches included Web of Science, LILACS, EMBASE, SCOPUS, PUBMED, BVS, CINAHL and COCHRANE with specific inclusion and exclusion criteria. To identify relevant publications, databases were searched using the following key terms – dermatology, pemphigus, skin ulcer, diagnostic and nursing assessment. The inclusion criteria included articles published in English, Spanish and Portuguese, peer-reviewed literature and consensus documents; the dates of publication were from 1 January 2011 to 31 December 2019. Commentary and editorials were excluded.
Categorisation of studies
Selected studies were then categorised according to the six levels of evidence8:
• Level 1: evidence from meta-analysis of multiple controlled and randomised studies.
• Level 2: evidence from individual studies with experimental design.
• Level 3: evidence from quasi-experimental studies, time series or case-controls.
• Level 4: evidence from descriptive studies (non-experimental or qualitative approach).
• Level 5: evidence of case / experience reports.
• Level 6: evidence based on expert committee opinions, including interpretations of non-research based information, regulatory or legal opinions.
Evaluation of studies included in the review
This step included the evaluation of the studies as well as data extraction. A standardised data collection form was used to extract the following information: authors; professional category of authors; title of the article; journal; year of publication; level of evidence; goals; methodological design; sampling detail; synthesis of information; evaluation/assessment of skin ulcers in pemphigus; methodology used to validate the instrument; description of the instrument; terminology used to characterise ulcers; and results and conclusions.
Analysis and interpretation of data
The data evaluation stage included evaluating the quality of the primary sources using a specific methodological approach to determine the quality of the source. The data were evaluated and coded according to two criteria – the methodological rigour and the relevance to the topic of skin assessment. Studies were analysed and the rigour rated on a score from 0–4. The relevance to the topic was also scored and indicated, with 1 having no relevance to the topic and 2 indicating the article was relevant.
Synthesis / presentation of results
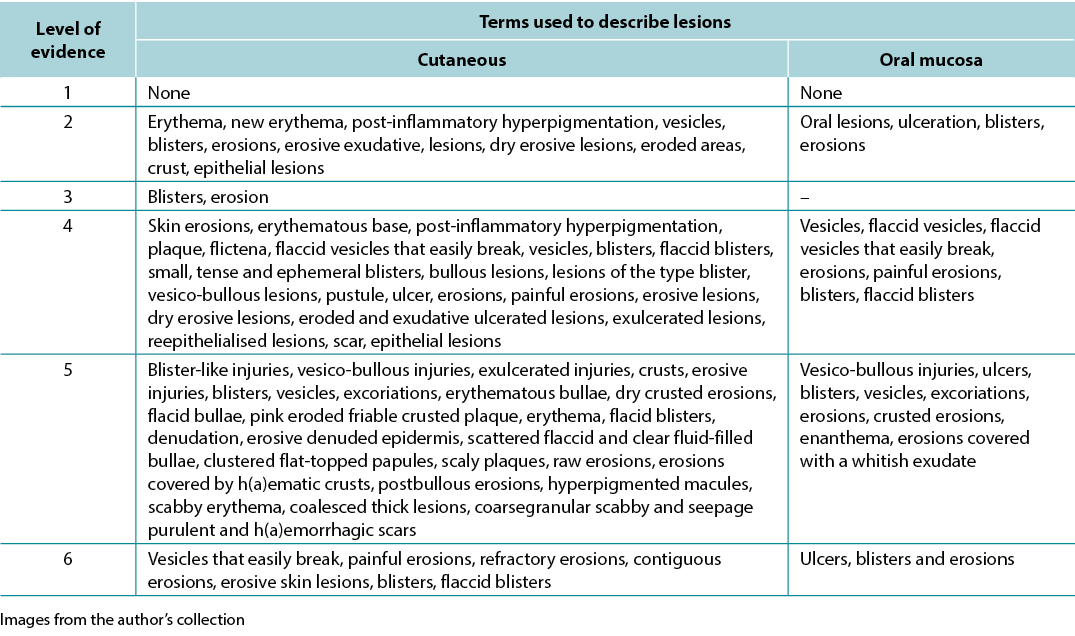
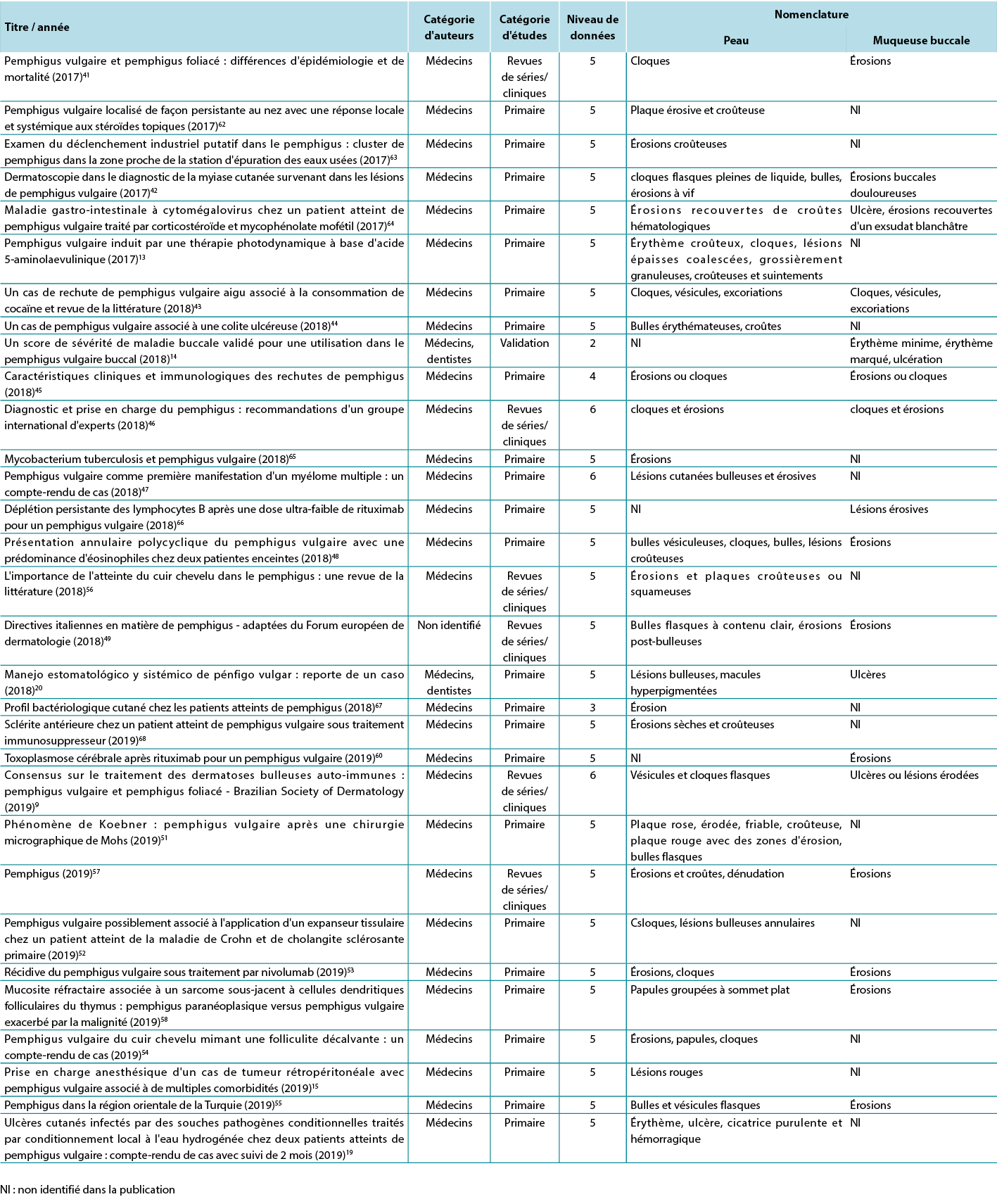
The data analysis for the qualitative studies were reviewed and were systematically categorised, analysed and synthesised, and placed into distinct themes, patterns and relationships using a matrix method. The synthesis of the studies was organised into three axis: (1) characteristics of scientific publications on PV; (2) terminology used to describe cutaneous lesions related to PV (Table 1); and (3) comparison of terminologies used in studies and dermatological description of skin lesions.
Table 1. Terms identified grouped by level of evidence of the studies
Ethical and legal aspects
The research project was submitted and approved by the Research Ethics Committee / UNIFESP: 0450/2015 and followed the ethical and legal precepts of research with human beings according to Resolution 196/96 of the National Health Council.
Results
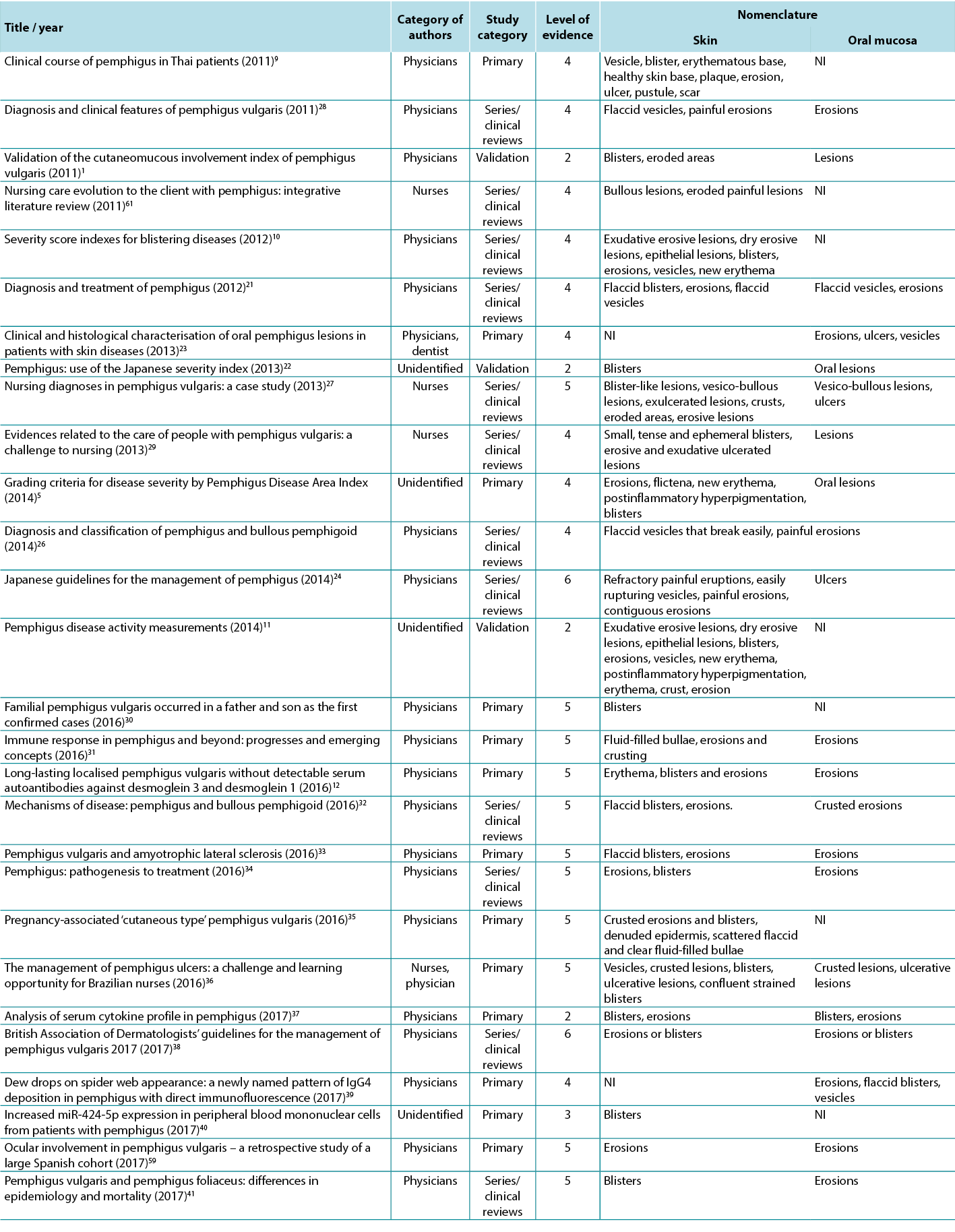
The initial search identified 2934 articles; 356 articles were included from review of the titles. After review of the abstracts, another 258 papers were not suitable for review since they did not meet the inclusion criteria; specifically, the excluded papers did not address PV and lesion assessment. A total of 58 articles were then selected for the study after exclusion of 40 duplicates. Of the 58 articles, 37 (63.79%) were primary studies, 17 (29.31%) were series/clinical reviews and four (6.90%) were validation studies.
A variety of terms were used in the literature to describe PV-related lesions. These are summarised below.
Primary skin lesions
Flat spots or maculae
The first is flat skin lesions, including colour changes and blood-vascular stains. Nomenclature used were new erythema, erythema, minimal erythema, and marked erythema9–15. Erythema is defined as a red colour resulting from vasodilation that disappears by digital pressure or diascopy. Diascopy is a refinement in which a piece of clear glass or plastic is pressed against the skin while the observer looks directly at the lesion under pressure15,16.
Solid formations / oedematous elevations
Solid formations may include bullae and papulae (small superficial solid elevations of the skin) while oedematous elevations could be cutanaeous lesions, scales or pustulae (defined elevation of the skin containing purulent fluid). These clinical features might be associated with a positive Nikolsky sign17.
Pigment spots
Nomenclature used in this section were post-inflammatory hyperpigmentation and hyperpigmented macules5,11,16, 18–20. Hyperchromia is defined as a spot of variable colour, caused by the increase of melanin or deposit of another pigment. The increase in melanin / melanodermic spots has a variable colour from light brown to dark bluish or black16,18.
Liquid content
Nomenclature used here were vesicles, blisters and bullous lesions1,5,9,10,12,13,20–55. Vesicles are defined as of circumscribed elevation, containing clear liquid, up to 1cm in size. The fluid, which is primitively clear (serous), may become cloudy (purulent) or red (haemorrhagic)16,18. A blister is defined as elevation containing clear liquid, greater than 1cm in size. The fluid, which is primitively clear, may become yellowish-red or reddish, forming a purulent or haemorrhagic blister16,18. The term bullous lesions is used to refer to any liquid collections.
Secondary skin lesions
Thickness changes
Nomenclature used here are epithelial lesions, denuded epidermis and scar9–11,13,19,22,35,51,54,56–58. A scar is defined as a flat, salient or depressed lesion, without grooves, pores and hairs, movable, adherent or retractable. It associates atrophy with fibrosis and dyschromia. It results from the repair of destructive process of the skin. It can be: atrophic (thin, pleated, papyraceous); pitted (small holes appear); or hypertrophic (nodular, elevated, vascular, with excessive fibrous proliferation, with a tendency to regress)16,18.
Tissue losses
Nomenclature used are erosions, eroded areas, erosive lesions, crust, ulceration, ulcer, ulcerative lesions, raw erosions and excoriations1,5,9–15,19–21,23–60. Erosion or exulceration is defined as superficial loss that affects only the epidermis. Crust is defined as a concretion of light yellow to greenish or dark red colour which forms in an area of tissue loss. It results from the desiccation of serosity (meliceric), pus (purulent) or blood (haemorrhagic), mixed with epithelial remains16,18.
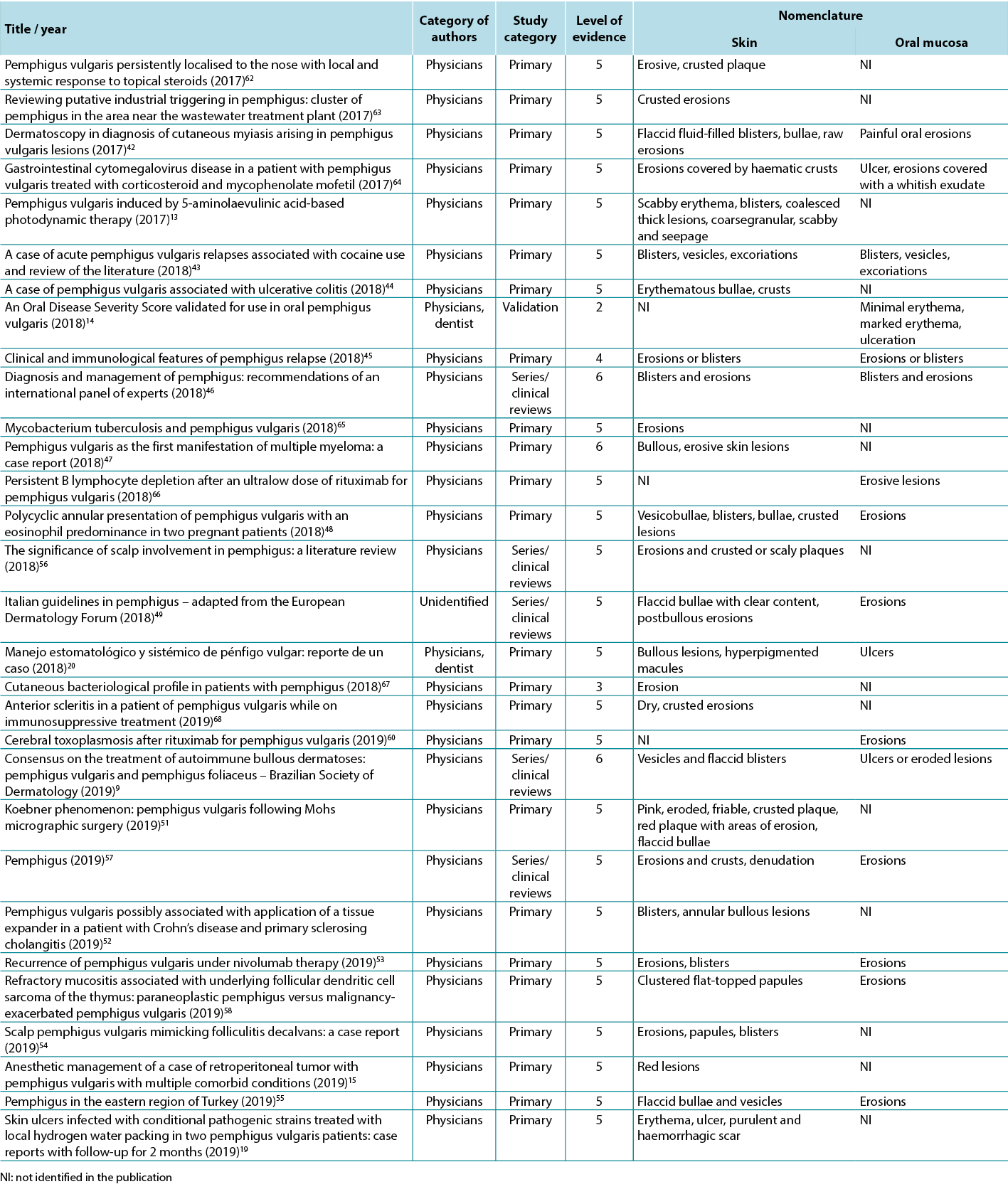
Therefore, in view of the integrative review, it was possible to identify studies describing the dermatological alterations of PV ulcers according to criteria established by dermatological glossaries. In order to illustrate the correlation of the identified terms and their corresponding study, the third analysis correlates the terms identified with the year, author category, study category and level of evidence, shown in Table 2.
Table 2. Terms identified in selected articles
Discussion
As evidenced by the results, studies in this area are scant and nurses have had little contribution. However, this is needed to highlight the consistency demonstrated between the terms used by authors and the terminology of elementary lesions.
To promote excellence in dermatological care it is necessary for nurses and health professionals to develop skills for the evaluation of cutaneous manifestations, especially skin lesions. The skin, as the largest organ of the human body, has protection as one of its numerous functions. Far beyond essentially dermatological affections, it can translate the person’s general condition, signalling the presence of systemic disorders and sometimes presenting manifestations that are recognised as cutaneous markers of certain pathologies. However, the paucity of studies in PV has led to poor description and evaluation of skin lesions in PV. This may result in delayed diagnosis and suboptimal care and treatment6,20,29,36.
In fact, this subject points to the need for further investigation to compose a framework of knowledge based on scientific evidence in this area, so that dermatology nurses may develop an accurate consideration of the assessment of skin manifestations, especially skin ulcers. These professionals publish little on this subject, which corroborates with the lack of formulation of new evidence for their topical care. This lack of evidence makes nursing assistance to these people less secure, since a theoretical framework is essential for evidence-based care given the specificity and complexity of caring for these patients16,25.
The main researchers in this area, Brandão and Santos4,6,25,29, investigate this issue from the point of view of integral care, with a social-poetic approach and a nursing diagnosis that support the comfort and relief of pain among those affected.
Through clinical observation, the authors of this study concluded that traditional topical care generates high rates of hospital stay, pain and discomfort. This clinical observation was the trigger to build evidence of the best evaluation tools and descriptors and base this on the use of topical therapies that optimise the potential of healing by managing cofactors such as pH, thermoregulation, humidity, microbial load and adherence of the dressing25,36.
It can be observed that when the nursing descriptor was used, the literature search resulted in a much smaller number of articles in comparison to those searches without this descriptor. Although dermatological nursing is a recognised specialty in Brazil, the descriptors ‘nursing in dermatology’ or ‘dermatologist nurse’ or ‘dermatological nursing’ do not exist. Therefore, in search of studies, the descriptors ‘nursing’ and ‘nursing assessment’ were used.
Among the nomenclatures used in the different levels of studies, we can observe that all use the dermatological glossary to describe the lesions, with only a small variation with detailed description of the tissue such as exudative erosions. Despite the scarcity of studies written by nurses, it was possible to observe that the terminology used did not differ between professional categories25,29,36.
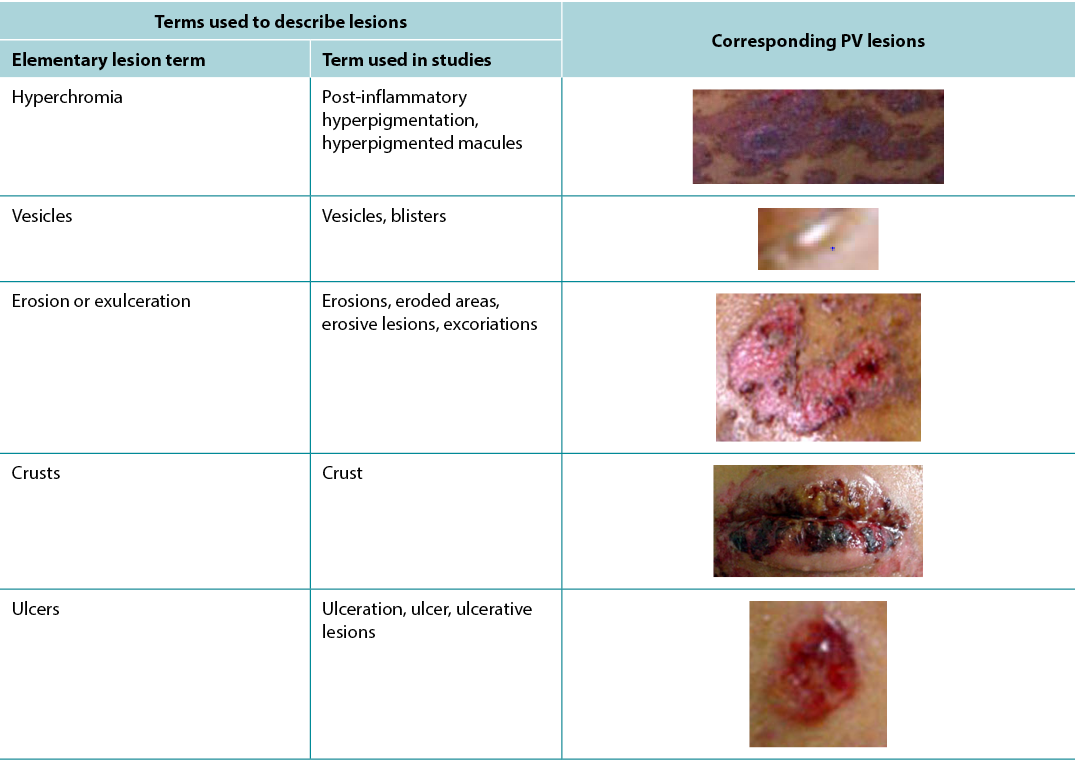
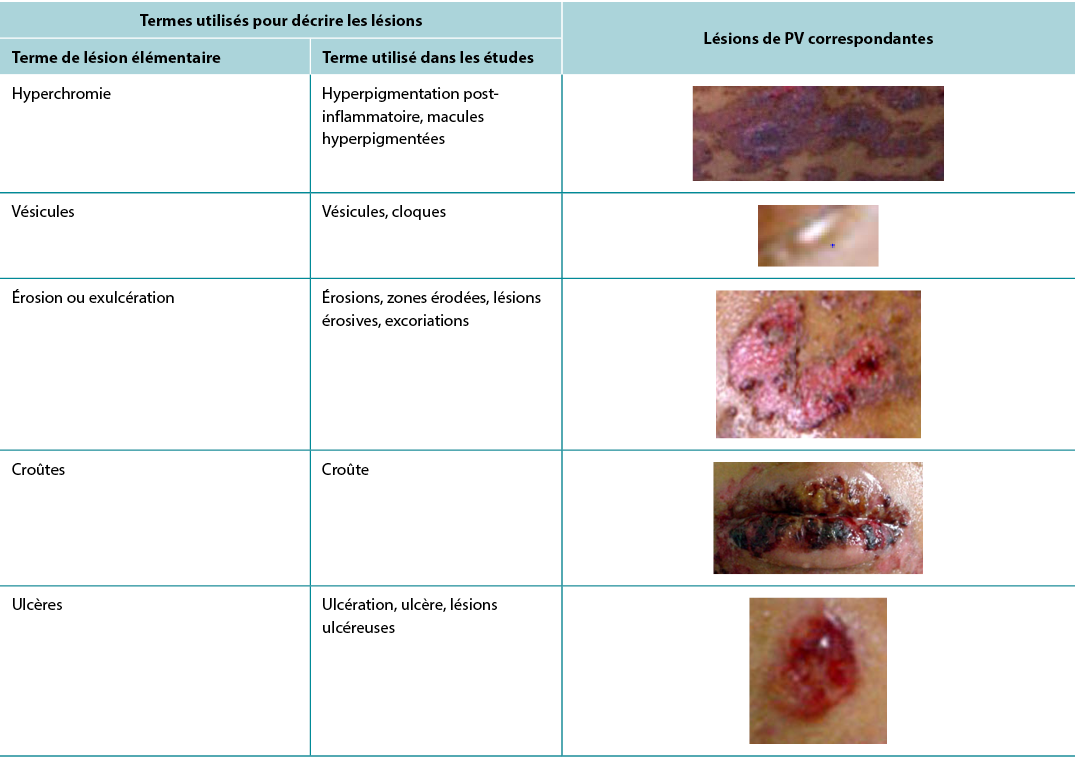
According to Sampaio and Rivitti3, skin lesion classification is like letters of the alphabet; just as letters compose words, through their combination they form morphological signs that allow us to “read” the cutaneous manifestations16,18. As shown in the results, the skin lesions, associated with complementary information, can help in the definition of diagnostic hypotheses, intervention decision and monitoring of healing evolution. The use of clinical descriptors to characterise skin lesions or ulcers standardises this information, making it more understandable for health professionals. In Table 3 examples of PV lesions related to the correspondent elementary skin lesion term are given.
Table 3. Elementary skin lesion terms and corresponding examples of PV lesion
Skin lesions are classified into six groups: colour changes; oedematous elevations; solid formations; liquid formations; thickness changes; and losses and repairs. This classification may be grouped into:
- Primary: flat spots or maculae (colour changes); solid (solid formations); oedematous elevations (rash, oedema); liquid content (liquid formations).
- Secondary: changes in consistency and thickness (changes in thickness); or loss of substance (tissue losses and repairs)16,18.
Diagnoses, interventions and nursing outcomes according to the North American Nursing Diagnosis Association (NANDA), Nursing Interventions Classification (NIC) and Nursing Outcomes Classification (NOC) for patients with PV were proposed by Pena et al.27. The analysis of the nursing diagnosis ‘impaired skin integrity’ and ‘impaired oral mucous membrane’ made it possible to perceive that the nurse assessment to arrive at this diagnosis does not require a specialised evaluation since the defining characteristics for such diagnoses involve only the rupture of the skin or mucosa, not requiring evaluation of thickness, tissue type or other characteristics assessed in a wound. In the proposed NOC outcome ‘healing’, in which one of the indicators used was granulation tissue, the knowledge about the tissue types that a wound can present is necessary. The proposed NIC intervention ‘wound care’ involves the decision about the intervention to be adopted, presupposing specific knowledge, skills and preparation in this area27. Considering the increasing performance of dermatology nursing as a specialty, these nomenclatures are becoming increasingly familiar to nurses.
As the nomenclature used to describe skin lesions becomes standard, whether secondary to PV or not, the interlocution between professionals tends to become more uniform, avoiding misunderstanding and resulting in safer patient care. However, in wound assessment there is still a great diversity in the terminology used to describe the skin damage, for example: slough and fibrin; wet necrosis and liquefaction necrosis; dry necrosis, ‘scar’ and pressure injury; granulation tissue, extra cellular matrix or viable tissue. This richness of terminologies causes doubt, within professionals consulting the records, often generating interpretations that differ from those of the person who registered them. In order to standardise the register of PV ulcers, we suggest the use of the elementary lesions terms – vesicles, blisters, erosions, ulcers and generalised crusts.
The chronic character and the cutaneous manifestation of PV steal from the patient their right to confidentiality. Frequently, the lesions are associated with contagion, impacting on social and familiar relations, and perpetuating stigma and isolation4. For Brandão, nursing actions become productive as they aim to reach the patient’s holistic balance. Thus there is a constant search for alternatives that attend to the needs of people suffering from changes in skin integrity, and the development of technologies and techniques that promote healing in order to improve their quality of life4,27.
Conclusions
This study compared the terminology used to describe cutaneous ulcers in PV studies with the terminology used in describing elementary lesions. It also demonstrated that the publications authored by physicians were the most common ones, followed by those authored by nurses, and lacked uniformity in the description of the lesions.
This study demonstrated that the skin changes in PV can be classified as primary skin lesions (colour changes and liquid collections) or secondary skin lesions (changes in thickness and tissue loss). In view of the extensive dermatological glossary, lesions secondary to PV can be characterised as vesicles, blisters, erosions, ulcers and generalised crusts to support the practice of nursing in dermatology.
Lastly, it is concluded that studies with a higher level of evidence in this area are necessary in order to determine the best way to evaluate the lesions, as well as the nomenclature to be used for improved nursing care.
Conflict of Interest
The authors declare no conflicts of interest.
Funding
The authors received no funding for this study.
L'évaluation infirmière des ulcères du pemphigus vulgaire
Mariana Takahashi Ferreira Costa, Luiza Keiko Matsuka Oyafuso, Mônica Antar Gamba and Kevin Y Woo
DOI: https://doi.org/10.33235/wcet.41.3.27-37
Résumé
Introduction Le pemphigus vulgaire (PV) est une dermatose bulleuse auto-immune sévère qui se traduit par la formation de vésicules intra-épidermiques affectant la peau et les muqueuses. Les données épidémiologiques montrent une incidence de 0,1-0,5 pour 100000 habitants par an, et une mortalité de près de 5-10%.
Objectif L'objectif de cette revue documentaire intégrative était d'examiner la classification/terminologie des ulcères PV en fonction de la description des lésions cutanées.
Méthode Il s'agit d'une revue intégrative des études primaires, des séries/examens cliniques ou des études de validation qui décrivent ou évaluent les ulcères PV. Les stratégies de recherche ont inclus les articles pertinents qui ont été publiés entre 2011-2019 en utilisant des termes tels que pemphigus, ulcère cutané, dermatologie, diagnostic, évaluation infirmière. Les études ont été sélectionnées pour l'analyse après application des critères d'éligibilité et exclusion par duplicité.
Résultats La recherche initiale a donné lieu à 2 934 publications ; 14 articles étaient éligibles pour l'analyse. La synthèse des études a été organisée comme suit : 57,14% de séries/examens cliniques, 50% rédigés par des médecins, 64,29% de niveau de données 4. La terminologie utilisée pour décrire les ulcères PV comprenait l'érythème cutané/muqueux, le nouvel érythème, l'hyperpigmentation post-inflammatoire, les lésions buccales, les croûtes d'épithélialisation, les cloques, les bulles, les érosions, les zones érodées, les lésions exsudatives érosives, les érosions sèches.
Conclusions Des études avec de meilleurs niveaux de données sont nécessaires sur cette question afin de déterminer la meilleure façon de décrire les lésions en utilisant le glossaire dermatologique pour l'évaluation infirmière.
Introduction
Le pemphigus vulgaire (PV) est une dermatose bulleuse auto-immune sévère dans laquelle les anticorps détruisent les desmosomes, entraînant la formation de vésicules intra-épidermiques qui affectent la peau et les muqueuses. Le PV survient principalement entre la 4ème et la 6ème décennie de la vie, touchant les hommes et les femmes avec une incidence de 0,1-0,5 pour 100 000 habitants par an et un taux de mortalité de 5-10%. La distribution de la maladie est universelle, mais elle touche le plus souvent les personnes d'ascendance israélite-3.
Dans le PV, les auto-anticorps agissent principalement sur la desmogleine 3 (Dsg3) qui est exprimée surtout dans les couches profondes de l'épiderme2,3. L'identification de la couche sur laquelle se produit l'acantholyse est un facteur qui aide au diagnostic des dermatoses bulleuses. Par exemple, il est possible de différencier le PV du pemphigus foliacé en fonction du site où se produit l'acantholyse, puisque le pemphigus foliacé affecte la couche granuleuse alors que le PV affecte la couche épineuse2,3. Ces manifestations impliquent la formation de cloques, avec pour conséquence des ulcérations et des lésions cutanées qui peuvent être dévastatrices, affectant l'interaction sociale et même la perte d'emploi4.
L'impact de la défiguration associée au PV sur la qualité de vie des patients, l'image de soi, la dynamique familiale et sociale a été bien documenté4. Outre l'atteinte cutanée, le PV peut toucher les tissus muqueux de la bouche, du pharynx, du larynx, des voies nasales et des conduits auditifs (Figures 1 et 2). Les zones touchées par la maladie peuvent compromettre la respiration normale ainsi que la capacité à parler et à manger de façon à maintenir un apport nutritionnel adéquat2,3.

Figure 1. Lésions cutanées sur le tronc

Figure 2. Lésions de la muqueuse buccale
La classification des PV a fait l'objet d'études ces dernières années. The Commitment Index of Skin and Mucous dans le pemphigus vulgaire utilise quatre paramètres différents pour évaluer l'état clinique de la maladie : (a) le nombre de vésicules ou de zones érodées; (b) la taille des vésicules ou des zones érodées; (c) la mise en évidence du signe de Nikolsky (où le fait de glisser fermement le doigt avec pression sur la peau différencie l'épiderme d'apparence normale, produisant une érosion); (d) l'atteinte des muqueuses et la septicémie. Le score total peut varier de 0 à 100, et les patients sont classés comme suit : Le score de la classe I est de 0 à 30; celui de la classe II de 35 à 65; celui de la classe III de 70 à 100, ce qui signifie que plus le score est élevé, plus le statut est critique1.
Les outils de classification du pemphigus, le Pemphigus Disease Area Index (PDAI) et le Japanese Pemphigus Disease Severity Score (JPDSS), ont été comparés par Shimizu et al.5. Le PDAI mesure l'atteinte de la peau et des muqueuses par la taille et le nombre de vésicules dans chaque région anatomique, et le score varie de 0 à 263. JPDSS utilise des paramètres pour la notation : (I) le rapport entre la surface de la peau affectée et la surface du corps; (II) la présence ou l'absence du phénomène du signe de Nikolsky; (III) le nombre de nouvellles vésicules développées par jour; (IV) la présence ou l'absence de lésions buccales; et (V) le titre des anticorps du pemphigus. Le score de chaque paramètre s’échelonne de 0 à 3. Dans l'étude de Shimizu et al.5, les résultats montrent que le PDAI reflète plus précisément la gravité de la maladie. Les auteurs proposent donc l'utilisation d'index pour orienter un traitement uniforme selon des critères de gradation. La corticothérapie est le traitement de choix, et elle peut être associée à des immunosuppresseurs s'il n'y a pas d'amélioration avec la corticothérapie isolée2,3.
Bien qu'il s'agisse d'une maladie relativement rare, les infirmières et infirmiers doivent savoir reconnaître les lésions cutanées associées au PV et communiquer les résultats appropriés afin d'aider les patients à rechercher un traitement précoce, à évaluer la progression de la maladie et à surveiller les réponses au traitement6. L'objectif de cette revue intégrative était de décrire la taxonomie pour la description et l'évaluation des changements cutanés liés au PV par les infirmières.
Méthode
Cette revue intégrative a été menée pour identifier, analyser et synthétiser les études qui utilisent des méthodes qualitatives, quantitatives et mixtes sur ce thème7. Nous avons choisi la méthode décrite par Mendes7 pour conduire la revue qui a consisté en six étapes : (1) formulation de la question directrice; (2) établissement des critères d'inclusion et d'exclusion des études et collecte des données (recherche dans la littérature); (3) catégorisation des études; (4) évaluation des études incluses dans la revue; (5) analyse et interprétation des données; et (6) synthèse des connaissances mises en évidence dans les articles analysés (présentation des résultats)7.
Formulation de la question directrice
La question de recherche était la suivante : comment les lésions qui caractérisent le PV sont-elles décrites dans la littérature, dans sa définition et sa classification ?
Établissement des critères d'inclusion et d'exclusion des études et collecte des données
La recherche a été menée dans la littérature médicale et infirmière de 2011 à 2019 en collaboration avec un bibliothécaire pour aider à répondre à la question de recherche. Les recherches ont porté sur Web of Science, LILACS, EMBASE, SCOPUS, PUBMED, BVS, CINAHL et COCHRANE avec des critères d'inclusion et d'exclusion spécifiques. Pour identifier les publications pertinentes, des bases de données ont été consultées en utilisant les termes clés suivants : dermatologie, pemphigus, ulcère cutané, diagnostic et évaluation infirmière. Les critères d'inclusion comprenaient les articles publiés en anglais, en espagnol et en portugais, la littérature évaluée par des pairs et les documents de consensus; les dates de publication étaient comprises entre le 1er janvier 2011 et le 31 décembre 2019. Les commentaires et les éditoriaux ont été exclus.
Catégorisation des études
Les études sélectionnées ont ensuite été classées selon les six niveaux de données8 :
• Niveau 1 : données issues d'une méta-analyse de plusieurs études contrôlées et randomisées.
• Niveau 2 : données tirées d'études individuelles avec conception expérimentale.
• Niveau 3 : données provenant d'études quasi-expérimentales, de séries chronologiques ou de contrôles de cas.
• Niveau 4 : données issues d'études descriptives (approche non expérimentale ou qualitative).
• Niveau 5 : données de compte-rendu de cas / d'expériences.
• Niveau 6 : données fondées sur les avis de comités d'experts, y compris les interprétations d'informations non fondées sur la recherche, les avis réglementaires ou juridiques.
Évaluation des études incluses dans la revue
Cette étape comprenait l'évaluation des études ainsi que l'extraction des données. Un formulaire standardisé de collecte de données a été utilisé pour extraire les informations suivantes : auteurs; catégorie professionnelle des auteurs; titre de l'article; publication; année de publication; niveau de données; objectifs; conception méthodologique; détail de l'échantillonnage; synthèse des informations; évaluation/appréciation des ulcères cutanés de pemphigus; méthodologie utilisée pour valider l'instrument; description de l'instrument; terminologie utilisée pour caractériser les ulcères; et résultats et conclusions.
Analyse et interprétation des données
L'étape d'évaluation des données comprenait l'évaluation de la qualité des sources primaires en utilisant une approche méthodologique spécifique pour déterminer la qualité de la source. Les données ont été évaluées et codées selon deux critères : la rigueur méthodologique et la pertinence par rapport au sujet de l'évaluation cutanée. Les études ont été analysées et la rigueur évaluée sur une échelle de 0 à 4. La pertinence par rapport au sujet a également été notée et indiquée, 1 indiquant que l'article n'était pas pertinent par rapport au sujet et 2 indiquant que l'article était pertinent.
Synthèse / présentation des résultats
Les analyses de données des études qualitatives ont été examinées et ont été systématiquement catégorisées, analysées et synthétisées, et placées dans des thèmes, des modèles et des relations distincts en utilisant une méthode matricielle. La synthèse des études a été organisée en trois axes : (1) les caractéristiques des publications scientifiques sur le PV; (2) la terminologie utilisée pour décrire les lésions cutanées liées au PV (tableau 1); (3) la comparaison des terminologies utilisées dans les études et la description dermatologique des lésions cutanées.
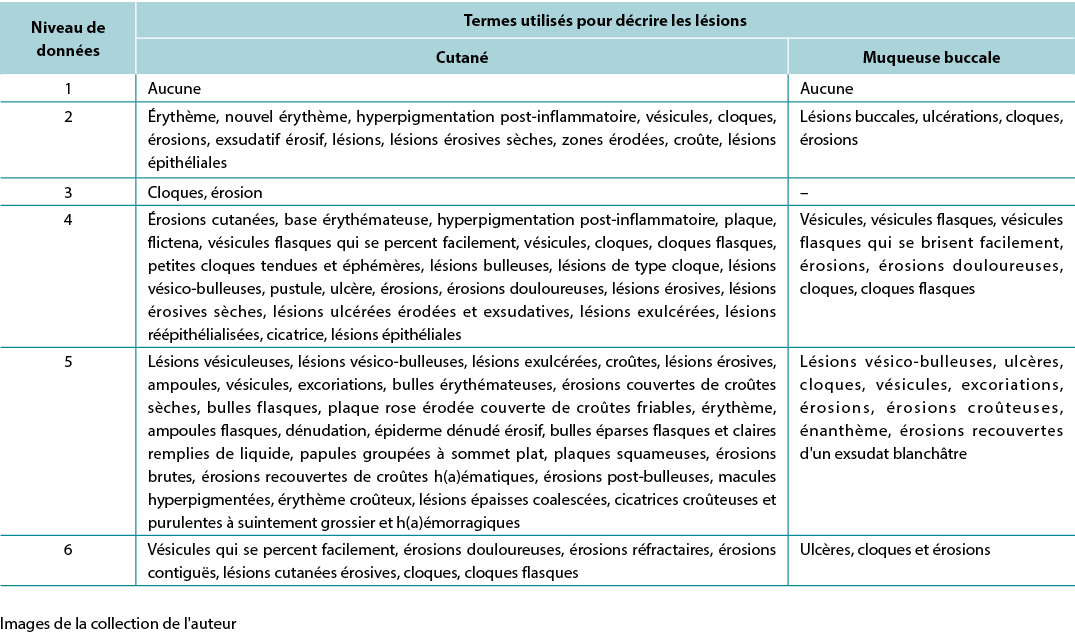
Tableau 1. Termes identifiés regroupés par niveau de données des études
Aspects éthiques et juridiques
Le projet de recherche a été soumis et approuvé par le Research Ethics Committee / UNIFESP : 0450/2015 et a suivi les préceptes éthiques et juridiques de la recherche avec l’être humain selon la résolution 196/96 du National Health Council.
Résultats
La recherche initiale a permis d'identifier 2934 articles; 356 articles ont été inclus après examen des titres. Après examen des résumés, 258 autres articles ne convenaient pas pour la revue examinés car ils ne répondaient pas aux critères d'inclusion; en particulier, les articles exclus ne traitaient pas du PV et de l'évaluation des lésions. Un total de 58 articles a ensuite été sélectionné pour l'étude après exclusion de 40 doublons. Sur les 58 articles, 37 (63,79%) étaient des études primaires, 17 (29,31%) des séries/examens cliniques et quatre (6,90%) des études de validation.
Une variété de termes a été utilisée dans la littérature pour décrire les lésions liées au PV. Elles sont résumées ci-dessous.
Lésions cutanées primaires
Taches plates ou macules
La première concerne les lésions cutanées planes, y compris les changements de couleur et les taches hémato-vasculaires. La nomenclature utilisée était la suivante : nouvel érythème, érythème, érythème minimal et érythème marqué9-15. L'érythème est défini comme une couleur rouge résultant d'une vasodilatation qui disparaît par pression digitale ou diascopie. La diascopie est un perfectionnement dans lequel un morceau de verre ou de plastique transparent est pressé contre la peau tandis que l'observateur regarde directement la lésion sous pression15,16.
Formations solides / soulèvements oedémateux
Les formations solides peuvent inclure des bulles et des papules (petits soulèvements solides superficiels de la peau) tandis que les soulèvements œdémateux peuvent être des lésions cutanées, des squames ou des pustules (soulèvement délimité de la peau contenant un liquide purulent). Ces caractéristiques cliniques pourraient être associées à un signe de Nikolsky positif17.
Taches pigmentaires
Les nomenclatures utilisées dans cette section sont l'hyperpigmentation post-inflammatoire et les macules hyperpigmentées5,11,16,18-20. L'hyperchromie est définie comme une tache de couleur variable, causée par l'augmentation de la mélanine ou le dépôt d'un autre pigment. L'augmentation de la mélanine / des taches mélanodermiques présente une couleur variable allant du brun clair au bleuâtre foncé ou au noir16,18.
Contenu liquide
La nomenclature utilisée ici est celle des vésicules, des cloques et des lésions bulleuses1,5,9,10,12,13,20-55. Les vésicules sont définies comme une élévation circonscrite, contenant un liquide clair, d'une taille maximale de 1 cm. Le liquide, qui est primitivement clair (séreux), peut devenir trouble (purulent) ou rouge (hémorragique)16,18. Une cloque est définie comme un soulèvement contenant un liquide clair, d'une taille supérieure à 1 cm. Le liquide, primitivement clair, peut devenir rouge-jaunâtre ou rougeâtre, formant une cloque purulente ou hémorragique16,18. Le terme de lésions bulleuses est utilisé pour désigner toute collection de liquide.
Lésions cutanées secondaires
Changements d'épaisseur
La nomenclature utilisée ici comprend lésions épithéliales, épiderme dénudé et cicatrice9-11,13,19,22,35,51,54,56-58. Une cicatrice est définie comme une lésion plate, saillante ou déprimée, sans sillons, pores et poils, mobile, adhérente ou rétractable. Elle associe l'atrophie à la fibrose et à la dyschromie. Elle résulte de la réparation du processus de destruction de la peau. Elle peut être : atrophique (fine, plissée, papyracée); piquée (apparition de petits trous); ou hypertrophique (nodulaire, élevée, vasculaire, avec une prolifération fibreuse excessive, avec une tendance à la régression)16,18.
Pertes de tissus
La nomenclature utilisée comprend érosions, zones érodées, lésions érosives, croûte, ulcération, ulcère, lésions ulcératives, érosions à vif et excoriations1,5,9-15,19-21,23-60. L'érosion ou exulcération est définie comme une perte superficielle qui n'affecte que l'épiderme. La croûte est définie comme une concrétion de couleur jaune clair à verdâtre ou rouge foncé qui se forme dans une zone de perte tissulaire. Elle résulte de la dessiccation de sérosité (mélicérique), de pus (purulente) ou de sang (hémorragique), mélangés à des restes épithéliaux16,18.
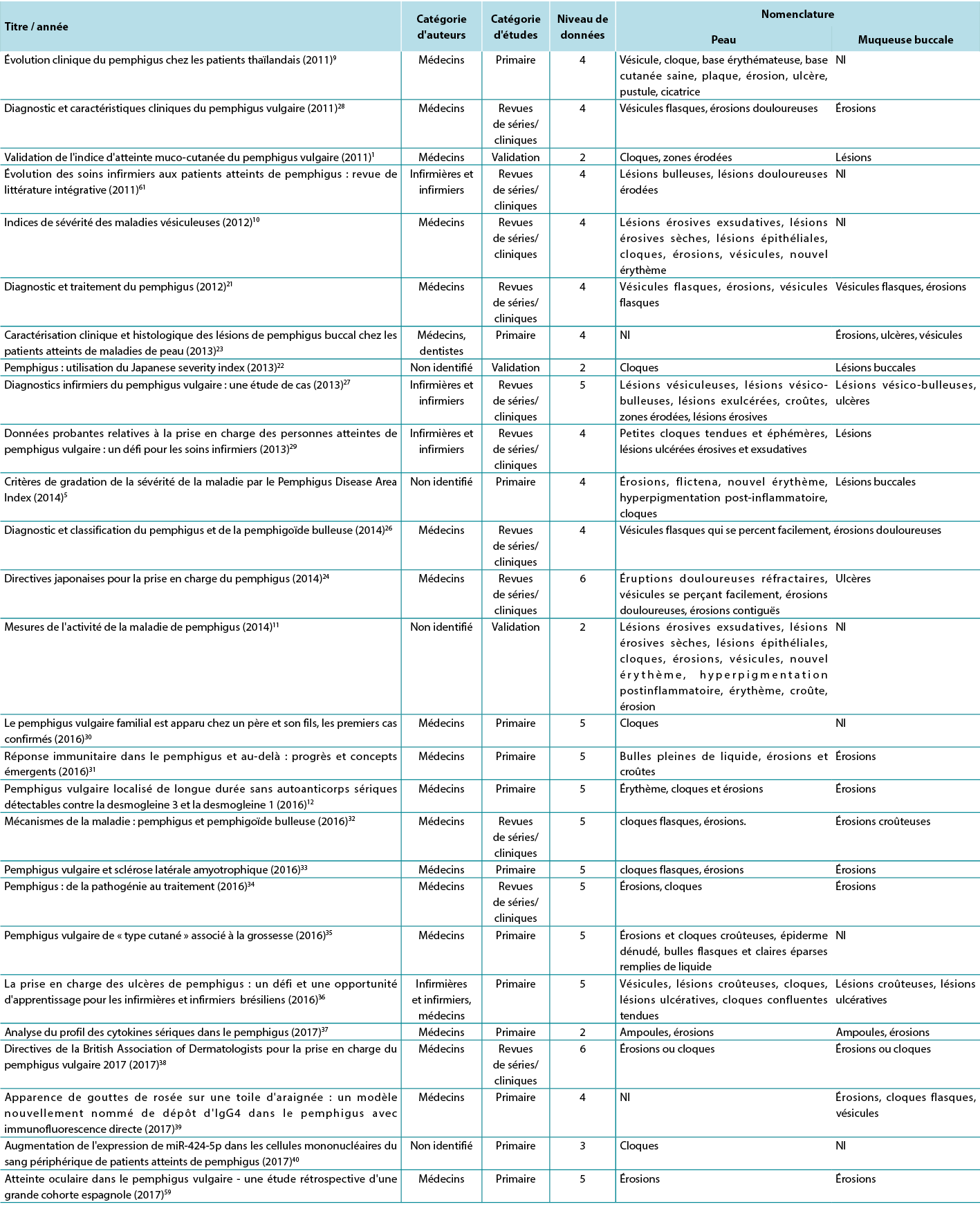
Par conséquent, au vu de la revue intégrative, il a été possible d'identifier les études décrivant les altérations dermatologiques des ulcères PV selon les critères établis par les glossaires dermatologiques. Afin d'illustrer la corrélation entre les termes identifiés et l'étude correspondante, la troisième analyse met en corrélation les termes identifiés avec l'année, la catégorie d'auteur, la catégorie d'étude et le niveau de données, comme le montre le tableau 2.
Tableau 2. Termes identifiés dans les articles sélectionnés
Discussion
Comme en témoignent les résultats, les études dans ce domaine sont rares et les infirmières et infirmiers y ont peu contribué. Cependant, cela est nécessaire pour mettre en évidence la cohérence démontrée entre les termes utilisés par les auteurs et la terminologie des lésions élémentaires.
Pour promouvoir l'excellence des soins dermatologiques , il est nécessaire que les infirmières et infirmiers ainsi que les professionnels de santé développent des compétences pour l'évaluation des manifestations cutanées, en particulier des lésions cutanées. L'une des nombreuses fonctions de la peau, en tant que plus grand organe du corps humain, est la protection. Bien au-delà des affections essentiellement dermatologiques, elle peut traduire l'état général de la personne, signaler la présence de troubles systémiques et parfois présenter des manifestations reconnues comme des marqueurs cutanés de certaines pathologies. Cependant, la rareté des études sur le PV a conduit à une description et une évaluation médiocres des lésions cutanées dans le PV. Cela peut entraîner un retard de diagnostic et des soins et traitements sous-optimisés6,20,29,36.
En fait, ce sujet met en évidence la nécessité de poursuivre les recherches afin de composer un cadre de connaissances fondé sur des données scientifiques dans ce domaine, de sorte que les infirmières et infirmiers en dermatologie puissent développer une réflexion précise sur l'évaluation des manifestations cutanées, en particulier les ulcères cutanés. Ces professionnels publient peu sur ce sujet, ce qui corrobore l'absence de formulation de nouvelles données probantes pour leurs soins topiques. Ce manque de données rend l'assistance infirmière à ces personnes moins sûre, car un cadre théorique est essentiel pour des soins fondés sur des données probantes compte-tenu de la spécificité et de la complexité de la prise en charge de ces patients16,25.
Les principaux chercheurs dans ce domaine, Brandão et Santos4,6,25,29, étudient cette question du point de vue de la prise en charge intégrale, avec une approche socio-poétique et un diagnostic infirmier qui favorisent le confort et le soulagement de la douleur chez les personnes affectées.
Grâce à l'observation clinique, les auteurs de cette étude ont conclu que les soins topiques traditionnels génèrent des taux élevés de séjour hospitalier, de douleur et d'inconfort. Cette observation clinique a été l'élément déclencheur dans le recueil des données sur les meilleurs outils d'évaluation et les descripteurs, en fondant ce processus sur l'utilisation de thérapies topiques qui optimisent le potentiel de guérison en intégrant des cofacteurs tels que le pH, la thermorégulation, l'humidité, la charge microbienne et l'adhérence du pansement25,36.
On peut observer que lorsque le descripteur "soins infirmiers" est utilisé, la recherche documentaire aboutit à un nombre d'articles beaucoup plus faible que les recherches sans ce descripteur. Bien que les soins infirmiers en dermatologie soient une spécialité reconnue au Brésil, les descripteurs "soins infirmiers en dermatologie" ou "infirmière ou infirmier dermatologue" ou "soins infirmiers dermatologues" n'existent pas. Par conséquent, pour la recherche d'études, les descripteurs "soins infirmiers" et "évaluation des soins infirmiers" ont été utilisés.
Parmi les nomenclatures utilisées dans les différents niveaux d'études, nous pouvons observer que toutes utilisent le glossaire dermatologique pour décrire les lésions, avec seulement une petite variation dans la description détaillée des tissus comme les érosions exsudatives. Malgré la rareté des études rédigées par des infirmières et infirmiers, il a été possible d'observer que la terminologie utilisée ne différait pas entre les catégories professionnelles25,29,36.
Selon Sampaio et Rivitti3, la classification des lésions cutanées est comme les lettres de l'alphabet; tout comme les lettres composent les mots, elles forment par leur combinaison des signes morphologiques qui nous permettent de "lire" les manifestations cutanées16,18. Comme le montrent les résultats, les lésions cutanées, associées à des informations complémentaires, peuvent aider à la définition d'hypothèses diagnostiques, à la décision d'intervention et au suivi de l'évolution de la guérison. L'utilisation de descripteurs cliniques pour caractériser les lésions ou les ulcères cutanés permet de standardiser ces informations et de les rendre plus compréhensibles pour les professionnels de santé. Le tableau 3 donne des exemples de lésions PV rapportées au terme de lésion cutanée élémentaire correspondant.
Tableau 3. Termes élémentaires de lésions cutanées et exemples correspondants de lésions de PV
Les lésions cutanées sont classées en six groupes : changements de couleur; soulèvements œdémateux; formations solides; formations liquides; changements d'épaisseur; pertes et réparations. Cette classification peut être regroupée en plusieurs catégories:
- Primaires : taches plates ou macules (changements de couleur); solides (formations solides); soulèvements œdémateux (éruption, œdème); contenu liquide (formations liquides).
- Secondaires : changements de consistance et d'épaisseur (changements d'épaisseur); ou perte de substance (pertes et réparations tissulaires)16,18.
Les diagnostics, interventions et résultats des soins infirmiers selon la North American Nursing Diagnosis Association (NANDA), la Nursing Interventions Classification (NIC) et la Nursing Outcomes Classification (NOC) pour les patients atteints de PV ont été proposés par Pena et al.27. L'analyse du diagnostic infirmier "altération de l'intégrité de la peau" et "altération de la muqueuse buccale" a permis de voir que l'évaluation infirmière pour arriver à ce diagnostic ne nécessite pas d'évaluation spécialisée puisque les caractéristiques définissant ces diagnostics impliquent uniquement la rupture de la peau ou de la muqueuse, ne nécessitant pas l'évaluation de l'épaisseur, du type de tissus ou d'autres caractéristiques évaluées pour une plaie. Dans le cas du résultat NOC proposé "cicatrisation", pour lequel l'un des indicateurs utilisés est le tissu de granulation, la connaissance des types de tissus qu'une plaie peut présenter est nécessaire. La proposition d'intervention NIC "soin des plaies" implique la décision de l'intervention à adopter, ce qui présuppose des connaissances, des compétences et une préparation spécifiques dans ce domaine27. Compte-tenu des performances croissantes des soins infirmiers en dermatologie en tant que spécialité, ces nomenclatures sont de plus en plus familières aux infirmières et infirmiers.
Au fur et à mesure que la nomenclature utilisée pour décrire les lésions cutanées devient standard, qu'elles soient secondaires au PV ou non, les interlocutions entre professionnels tendent à s'uniformiser, ce qui évite les malentendus et se traduit par des soins plus sûrs pour les patients. Cependant, dans l'évaluation des plaies, la terminologie utilisée pour décrire les lésions cutanées est encore très variée, par exemple : mucus et fibrine; nécrose humide et nécrose de liquéfaction; nécrose sèche, "cicatrice" et blessure de pression; tissu de granulation, matrice extracellulaire ou tissu viable. Cette richesse terminologique suscite le doute chez les professionnels qui consultent les dossiers, générant souvent des interprétations différentes de celles de la personne qui les a enregistrés. Afin de standardiser le registre des ulcères PV, nous suggérons l'utilisation des termes de lésions élémentaires : vésicules, cloques, érosions, ulcères et croûtes généralisées.
Le caractère chronique et la manifestation cutanée du PV privent le patient de son droit à la confidentialité. Les lésions sont souvent associées à la contagion, ce qui impacte les relations sociales et familiales et perpétue la stigmatisation et l'isolement4. Pour Brandão, les actions infirmières deviennent productives car elles visent à atteindre l'équilibre holistique du patient. Il y a donc une recherche constante d'alternatives qui répondent aux besoins des personnes souffrant de changements dans l'intégrité de la peau, et le développement de technologies et de techniques qui favorisent la guérison afin d'améliorer leur qualité de vie4,27.
Conclusions
Cette étude a comparé la terminologie utilisée pour décrire les ulcères cutanés dans les études de PV avec la terminologie utilisée pour décrire les lésions élémentaires. Elle a également démontré que les publications rédigées par les médecins étaient les plus courantes, suivies de celles rédigées par les infirmières et infirmiers, et qu'elles manquaient d'uniformité dans la description des lésions.
Cette étude a démontré que les changements cutanés dans le PV peuvent être classés en lésions cutanées primaires (changements de couleur et collections de liquide) ou en lésions cutanées secondaires (changements d'épaisseur et perte de tissu). Compte tenu du vaste glossaire dermatologique, les lésions secondaires au PV peuvent être caractérisées comme des vésicules, des cloques, des érosions, des ulcères et des croûtes généralisées, afin de soutenir la pratique des soins infirmiers en dermatologie.
Enfin, il est conclu que des études avec un niveau de données plus élevé dans ce domaine sont nécessaires afin de déterminer la meilleure façon d'évaluer les lésions, ainsi que la nomenclature à utiliser pour améliorer les soins infirmiers.
Conflit d'intérêt
Les auteurs ne déclarent aucun conflit d'intérêt.
Financement
Les auteurs n'ont reçu aucun financement pour cette étude.
Author(s)
Mariana Takahashi Ferreira Costa*
Master’s Degree student, School of Nursing, Federal University of São Paulo, Brazil
Nurse member of Group for Prevention and Treatment of Wounds, de Emílio Ribas Infectology Institute, State Secretary of Health, São Paulo, SP, Brazil
Email marianatakahashicosta@hotmail.com
Luiza Keiko Matsuka Oyafuso
Supervisor of Health Technical Team, Emílio Ribas Infectology Institute, State Secretary of Health, São Paulo, SP, Brazil
Assistant Professor, ABC University Foundation
Mônica Antar Gamba
Associate Professor, School of Nursing, Federal University of São Paulo, São Paulo, SP, Brazil
Coordinator of the Dermatology Nursing Specialization Course, Mentor Professor at the Nursing Postgraduation Program
Kevin Y Woo PhD RN FAPWCA
Assistant Professor, School of Nursing, Faculty of Health Sciences, Queen’s University, Kingston, ON, Canada
Adjunct Research Professor, MClSc program, School of Physical Therapy, Faculty of Health Sciences, Western University
Wound Care Consultant, West Park Healthcare Centre
Clinical Web Editor, Advances in Skin and Wound Care
* Corresponding author
References
- Souza SR, Azulay-Abulafia L, Nascimento LV. Validation of the cutaneomucosal involvement index of pemphigus vulgaris for the clinical evaluation of patients with pemphigus vulgaris. An Bras Dermatol 2011;86(2):284–91.
- Hanauer L, Azulay-Abulafia L, Azulay DR, Azulay RD. Buloses. In: Azulay RD. Dermatology. 7th ed. Rio de Janeiro: Guanabara Koogan; 2017. p. 242–245.
- Sampaio SAP, Rivitti EA. Dermatology. 4th ed. São Paulo: Artes Médicas; 2018. p.300–316.
- Brandão ES, Santos I, Lanzillotti RS. Reduction of pain in clients with autoimmune bullous dermatoses: evaluation by fuzzy logic. Online Braz J Nurs 2016 Dec; 15(4):675–682. Available from: http://www.objnursing.uff.br/index.php/nursing/article/view/546
- Shimizu T, Takebayashi T, Sato Y, Niizeki H, Aoyama Y, et al. Grading criteria for disease severity by Pemphigus Disease Area Index. J Dermatol 2014;41:969–973.
- Brandão ES, Santos I, Lanzillotti RS. Nursing care to comfort people with immunobullous dermatoses: evaluation by fuzzy logic. Rev Enferm UERJ, Rio de Janeiro 2018; 26:e32877.
- Mendes KD, Silveira RC, Galvão CM. Integrative literature review: a research method to incorporate evidence in health care and nursing. Text & Cont Enferm 2008;17(4):758–64.
- Galvão CM, Sawada NO, Mendes IAC. The search for the best evidence. Rev Esc Enferm USP 2003;37:43–50.
- Kulthanan K, Chularojanamontri L, Tuchinda P, AL Sirikudta W, Pinkaew S. Clinical course of pemphigus in Thai patients. Asian Pac J Allergy Immunol 2011;29:161–8.
- Daniel BS, Hertl M, Werth VP, Eming R, Murrell DF. Severity score indexes for blistering diseases. Clin Dermatol 2012;30:108–113.
- Rahbar Z, Daneshpazhooh M, Mirshams-Shahshahani M, Esmaili N, Heidari K, et al. Pemphigus disease activity measurements: pemphigus disease area index, autoimmune bullous skin disorder intensity score and pemphigus vulgaris activity score. JAMA Dermatol 2014;150(3):266–72.
- Yoshifuku A, Fujii K, Kawahira H, Katsue H, Baba A, et al. Long-lasting localized pemphigus vulgaris without detectable serum autoantibodies against desmoglein 3 and desmoglein 1. Indian J Dermatol 2016;61(4):427.
- Zhou Q, Wang P, Zhang L, Wang B, Shi L, et al. Pemphigus vulgaris induced by 5-aminolaevulinic acid-based photodynamic therapy. Photodiagnosis Photodyn Ther 2017;156–158.
- Ormond M, McParland H, Donaldson ANA, Andiappan M, Cook RJ, Escudier M, Shirlaw PJ. An Oral Disease Severity Score validated for use in oral pemphigus vulgaris. Br J Dermatol 2018;179(4):872–881.
- Mishra S, Joshi S. Anesthetic management of a case of retroperitoneal tumor with pemphigus vulgaris with multiple comorbid conditions. Egyptian J Anaesthes 2016;32(1):151–153.
- Rivitti EA. Dermatologia. 4th ed. São Paulo: Artes Médicas; 2018. p. 109–118.
- Kasperkiewicz M, Ellebrecht CT, Takahashi H, Yamagami J, Zillikens D, Payne AS, Amagai M. Pemphigus. Nat Rev Dis Primers 2017 May 11;3:17026. doi:10.1038/nrdp.2017.26. PMID: 28492232; PMCID: PMC5901732.
- Azulay RD. Dermatology. 7th ed. Rio de Janeiro: Guanabara Koogan; 2017. p. 52–64.
- Yang F, Chen Z, Chen SA, Zhu Q, Wang L, et al. Skin ulcers infected with conditional pathogenic strains treated with local hydrogen water packing in two pemphigus vulgaris patients: case reports with follow-up for 2 months. Dermatol Ther 2019 Sep;32(5):e13027. doi:10.1111/dth.13027. Epub 2019 Jul 28. PMID: 31323168.
- Carmona Lorduy M, Porto Puerta I, Berrocal Torres S, Camacho Chaljub F. Manejo estomatológico y sistémico de pénfigo vulgar: reporte de un caso. Rev Cienc Salud 2018;16(2):357–367.
- Tsuruta D, Ishii N, Hashimoto T. Diagnosis and treatment of pemphigus. Immunother 2012;4(7):735.
- Benchikhi H, Nani S, Baybay H, et al. Pemphigus: use of the Japanese severity index in 56 Moroccan patients. Pan Afr Med J 2013;16:96.
- Suliman NM, Åstrøm AN, Ali RW, et al. Clinical and histological characterization of oral pemphigus lesions in patients with skin diseases: a cross sectional study from Sudan. BMC Oral Health 2013;13(1):66.
- Amagai M, Tanikawa A, Shimizu T, et al. Japanese guidelines for the management of pemphigus. J Dermatol 2014;41: 471–486.
- Brandão ES, Santos I, Lanzillotti RS, Ferreira AM, Gamba MA, et al. Nursing diagnoses in patients with immune-bullous dermatosis. Rev Lat Am Enfermagem 2016;24:e2766. doi:10.1590/1518-8345.0424.
- Kershenovich R, Hodak E, Mimouni D. Diagnosis and classification of pemphigus and bullous pemphigoid. Autoimmun Rev 2014;13:477–81.
- Pena SB, Guimarães HC, Bassoli SR, et al. Nursing diagnoses in pemphigus vulgaris: a case study. Int J Nurs Know 2013;24(3):176–179.
- Venugopal SS, Murrell DF. Diagnosis and clinical features of pemphigus vulgaris. Dermatol Clin 2011;29:373–380.
- Brandão ES, Santos I. Evidences related to the care of people with pemphigus vulgaris: a challenge to nursing. Online Braz J Nurs 2013 Sept;12(1):162–77. Available from: http://www.objnursing.uff.br/index.php/nursing/article/view/3674/html.
- Eskiocak AH, Ozkesici B, Uzun S. Familial pemphigus vulgaris occurred in a father and son as the first confirmed cases. Case Rep Dermatol Med 2016;1653507. doi:10.1155/2016/1653507. Epub 2016 Jun 15. PMID: 27403352; PMCID: PMC4925942.
- Di Zenzo G, Amber KT, Sayar BS, Müller EJ, Borradori L. Immune response in pemphigus and beyond: progresses and emerging concepts. Semin Immunopathol 2016 Jan;38(1):57–74.
- Hammers CM, Stanley JR. Mechanisms of disease: pemphigus and bullous pemphigoid. Annu Rev Pathol 2016;11:175–197.
- Mokhtari F, Matin M, Rajati F. Pemphigus vulgaris and amyotrophic lateral sclerosis. J Res Med Sci 2016 Oct18;21:82.
- DiMarco, C. Pemphigus: pathogenesis to treatment. R I Med J 2016;99(12):28–31.
- Rangel, J. Pregnancy-associated ‘cutaneous type’ pemphigus vulgaris. Perm J 2016;20(1):e101-e102. doi:10.7812/TPP/15-059.
- Costa MTF, Oyafuso LKM, Costa IG, Gamba MA, Woo KY. The management of pemphigus ulcers: a challenge and learning opportunity for Brazilian nurses. WCET J 2016;36(2):14–20.
- Lee SH, Hong WJ, Kim SC. Analysis of serum cytokine profile in pemphigus. Ann Dermatol 2017;29(4), 438–445.
- Harman KE, Brown D, Exton LS, Groves RW, Hampton PJ, Mohd Mustapa MF, Buckley DA. British Association of Dermatologists’ guidelines for the management of pemphigus vulgaris 2017. Br J Dermatol 2017;177(5):1170–1201.
- Dmochowski M, Gornowicz-Porowska J, Bowszyc-Dmochowska M. Dew drops on spider web appearance: a newly named pattern of IgG4 deposition in pemphigus with direct immunofluorescence. Postȩpy Dermatol Alergol 2017;34(4):295.
- Wang M, Liang L, Li L, Han K, Li Q, Peng Y, Zeng K. Increased miR-424-5p expression in peripheral blood mononuclear cells from patients with pemphigus. Mol Med Rep 2017;15(6):3479–3484.
- Kridin K, Zelber-Sagi S, Bergman R. Pemphigus vulgaris and pemphigus foliaceus: differences in epidemiology and mortality. Acta Derm Venereol 2017;97(8–9):1095–1099.
- Vinay K, Handa S, Khurana S, Agrawal S, De D. Dermatoscopy in diagnosis of cutaneous myiasis arising in pemphigus vulgaris lesions. Indian J Dermatol 2017;62(4):440.
- Jiménez-Zarazúa O, Guzmán-Ramírez A, Vélez-Ramírez LN, López-García JA, Casimiro-Guzmán L, Mondragón JD. A case of acute pemphigus vulgaris relapses associated with cocaine use and review of the literature. Dermatol Ther 2018;8(4):653–663.
- Seo JW, Park J, Lee J, Kim MY, Choi HJ, Jeong HJ, Kim WK. A case of pemphigus vulgaris associated with ulcerative colitis. Intest Res 2018;16(1):147.
- Ujiie I, Ujiie H, Iwata H, Shimizu H. Clinical and immunological features of pemphigus relapse. Br J Dermatol 2019 Jun;180(6):1498–1505. doi:10.1111/bjd.17591. Epub 2019 Mar 6. PMID: 30585310.
- Murrell D, Peña S, Joly P, Marinovic B, Hashimoto T, et al. Diagnosis and management of pemphigus: recommendations by an international panel of experts. J Am Acad Dermatol 2020 Mar;82(3):575–585.e1. doi:10.1016/j.jaad.2018.02.021. Epub 2018 Feb 10. PMID: 29438767; PMCID: PMC7313440.
- Sendrasoa FA, Ranaivo IM, Rakotoarisaona MF, Raharolahy O, Razanakoto NH, Andrianarison M, Rabenja FR. Pemphigus vulgaris as the first manifestation of multiple myeloma: a case report. J Med Case Rep 2018;12(1):255.
- Küçükoğlu R, Sun GP, Kılıç S. Polycyclic annular presentation of pemphigus vulgaris with an eosinophil predominance in two pregnant patients. Dermatol Online 2018;24(10).
- Feliciani C, Cozzani E, Marzano AV, Caproni M, Di Zenzo G, Calzavara-Pinton P, Lora V. Italian guidelines in pemphigus-adapted from the European Dermatology Forum (EDF) and European Academy of Dermatology and Venerology (EADV). G Ital Dermatol Venereol 2018;153(5):599–608.
- Porro A M, Hans Filho G, Santi CG. Consensus on the treatment of autoimmune bullous dermatoses: pemphigus vulgaris and pemphigus foliaceus: Brazilian Society of Dermatology. An Bras Dermatol 2019;94(2):20–32.
- Hattier G, Beggs S, Sahu J, Trufant J, Jones E. Koebner phenomenon: pemphigus vulgaris following Mohs micrographic surgery. Dermatol Online J 2019;25(1).
- Badavanis G, Pasmatzi E, Kapranos N, Monastirli A, Constantinou P, Psaras G, Tsambaos D. Pemphigus vulgaris possibly associated with application of a tissue expander in a patient with Crohn’s disease and primary sclerosing cholangitis. Acta Dermatovenerol Alp Pannonica Adriat 2019;28(4):173–176.
- Krammer S, Krammer C, Salzer S, Bağcı IS, French LE, Hartmann D. Recurrence of pemphigus vulgaris under nivolumab therapy. Front Med 2019;6:262.
- Bosseila M, Nabarawy EA, Latif MA, Doss S, ElKalioby M, Saleh MA. Scalp pemphigus vulgaris mimicking folliculitis decalvans: a case report. Dermatol Pract Concept 2019;9(3):215–17.
- Yavuz IH, Yavuz GO, Bayram I, Bilgili SG. Pemphigus in the eastern region of Turkey. Postȩpy Dermatol Alergol 2019;36(4):455–60.
- Sar-Pomian M, Rudnicka L, Olszewska M. The significance of scalp involvement in pemphigus: a literature review. Biomed Res Int 2018;2018: 6154397. doi:10,1155/2018/6154397
- Schmidt E, Kasperkiewic M, Joly P. Pemphigus. Lancet 2019;394(10201):882–894.
- Streifel AM, Wessman LL, Schultz BJ, Miller D, Pearson DR. Refractory mucositis associated with underlying follicular dendritic cell sarcoma of the thymus: paraneoplastic pemphigus versus malignancy-exacerbated pemphigus vulgaris. JAAD Case Rep 2019;5(11):933.
- España A, Iranzo P, Herrero‐González J, Mascaro Jr JM, Suárez R. Ocular involvement in pemphigus vulgaris: a retrospective study of a large Spanish cohort. J Dtsch Dermatol Ges 2017;15(4):396–403.
- Lee EB, Ayoubi N, Albayram M, Kariyawasam V, Motaparthi K. Cerebral toxoplasmosis after rituximab for pemphigus vulgaris. JAAD Case Rep 2019;6(1):37–41. doi:10.1016/j.jdcr.2019.10.015. PMID: 31909136; PMCID: PMC6938870.
- Brandão E, Santos I, Carvalho M, Pereira SK. Nursing care evolution to the client with pemphigus: integrative literature review. Revista Enfermagem 2011;19:479–484.
- Zhang C, Goldscheider I, Ruzicka T, Sardy M. Pemphigus vulgaris persistently localized to the nose with local and systemic response to topical steroids. Acta Derm Venereol 2017;97(8–9):1136–1137.
- Pietkiewicz P, Gornowicz-Porowska J, Bartkiewicz P, Bowszyc-Dmochowska M, Dmochowski M. Reviewing putative industrial triggering in pemphigus: cluster of pemphigus in the area near the wastewater treatment plant. Postȩpy Dermatol Alergol 2017;34(3):185.
- Oliveira LB, Maruta CW, Miyamoto D, Salvadori FA, Santi CG, Aoki V, Duarte-Neto AN. Gastrointestinal cytomegalovirus disease in a patient with pemphigus vulgaris treated with corticosteroid and mycophenolate mofetil. Autops Case Reps 2017;7(1):23.
- Osipowicz K, Kowalewski C, Woźniak K. Mycobacterium tuberculosis and pemphigus vulgaris. Postȩpy Dermatol Alergol 2018;35(5):532.
- Lazzarotto A, Ferranti M, Meneguzzo A, Sacco G, Alaibac M. Persistent B lymphocyte depletion after an ultralow dose of rituximab for pemphigus vulgaris. J Investig Allergol Clin Immunol 2018;28(5):347.
- Kiran KC, Madhukara J, Abraham A, Muralidharan S. Cutaneous bacteriological profile in patients with pemphigus. Indian J Dermatol 2018;63(4):301.
- Dube M, Takkar B, Asati D, Jain S. Anterior scleritis in a patient of pemphigus vulgaris while on immunosuppressive treatment. Indian J Dermatol 2019;64(6):499–500.
