Volume 43 Number 3
Current perspectives on pressure injuries in persons with dark skin tones from the National Pressure Injury Advisory Panel
Joyce Black, Jill Cox, Virginia Capasso, Donna Z Bliss, Barbara Delmore, Vignesh Iyer, Jacqueline Massaro, Cassendra Munro, Joyce Pittman, Elizabeth A Ayello
Keywords health equity, pressure injuries, dark skin tones, skin assessment, social determinants of heath
For referencing Black J et al. Current perspectives on pressure injuries in persons with dark skin tones from the National Pressure Injury Advisory Panel. WCET® Journal 2023;43(3):18-29.
DOI
https://doi.org/10.33235/wcet.43.3.18-29
Submitted 30 April 2023
Accepted 26 June 2023
Abstract
Background Pressure injury (PI) development is multifactorial. In patients with dark skin tones, identifying impending PIs by visual skin assessment can be especially challenging. The need for improved skin assessment techniques, especially for persons with dark skin tones, continues to increase. Similarly, greater awareness of the need for inclusivity with regard to representation of diverse skin colours/tones in education materials has been apparent in recent years.
Objective To provide current perspectives from the literature surrounding skin assessment and PI development in patients with dark skin tones.
Methods The following elements will be discussed through the lens of skin tone: 1) historical perspectives of PI staging from the National Pressure Injury Advisory Panel, 2) epidemiology of PI, 3) anatomy and physiology of the skin, 3) skin tone assessment and measurement, 4) augmented visual assessment modalities, 5) PI prevention, 6) PI healing, 7) social determinants of health, and 8) gaps in clinician education.
Conclusions This review highlights the gap in our clinical knowledge regarding PIs in patients with dark skin tones. Racial disparities with regard to PI development and healing are especially highlighted among patients with dark skin tones. Skin tone colour assessment must be standardised and quantifiable in clinical education, practice, and research. This work is urgently needed, and support from private and governmental agencies is essential.
Introduction
Racial diversity across the United States has increased over the past 2 decades. The US Census Bureau reports that the overall diversity index has increased from 54.9% in 2010 to 61.1% in 2020 and is projected to continue to escalate over the next decade.1 Worldwide, people with dark skin tones comprise the majority of the population.2
Over the past 20 years, there has been a growing awareness of and interest in the need for skin assessment that is inclusive of all persons regardless of their skin colour.3-24 The clinical reality is that in the US and worldwide, skin tone demographics have shifted, and awareness of various skin colours has increased, such that the need for accurate skin assessment and diagnosis for all patients has taken on great urgency. Moreover, awareness of the need to include diverse skin colours/tones in education materials (basic professional and ongoing education) for students and clinicians has also increased in recent years.13
In this article, the authors outline current perspectives on pressure injuries (PIs) in patients with dark skin tones. The first section addresses the historical efforts of the National Pressure Injury Advisory Panel (NPIAP; formally the NPUAP) to address this disparity and revise staging definitions to be relevant for all skin tones. Additional topics addressed through the lens of skin tone include the epidemiology of PIs, anatomy and physiology of the skin, visual and augmented skin assessment techniques and modalities, PI prevention and healing, social determinants of health (SDOH) considerations, and professional education gaps.
Historical perspectives on PI staging in persons with dark skin tones
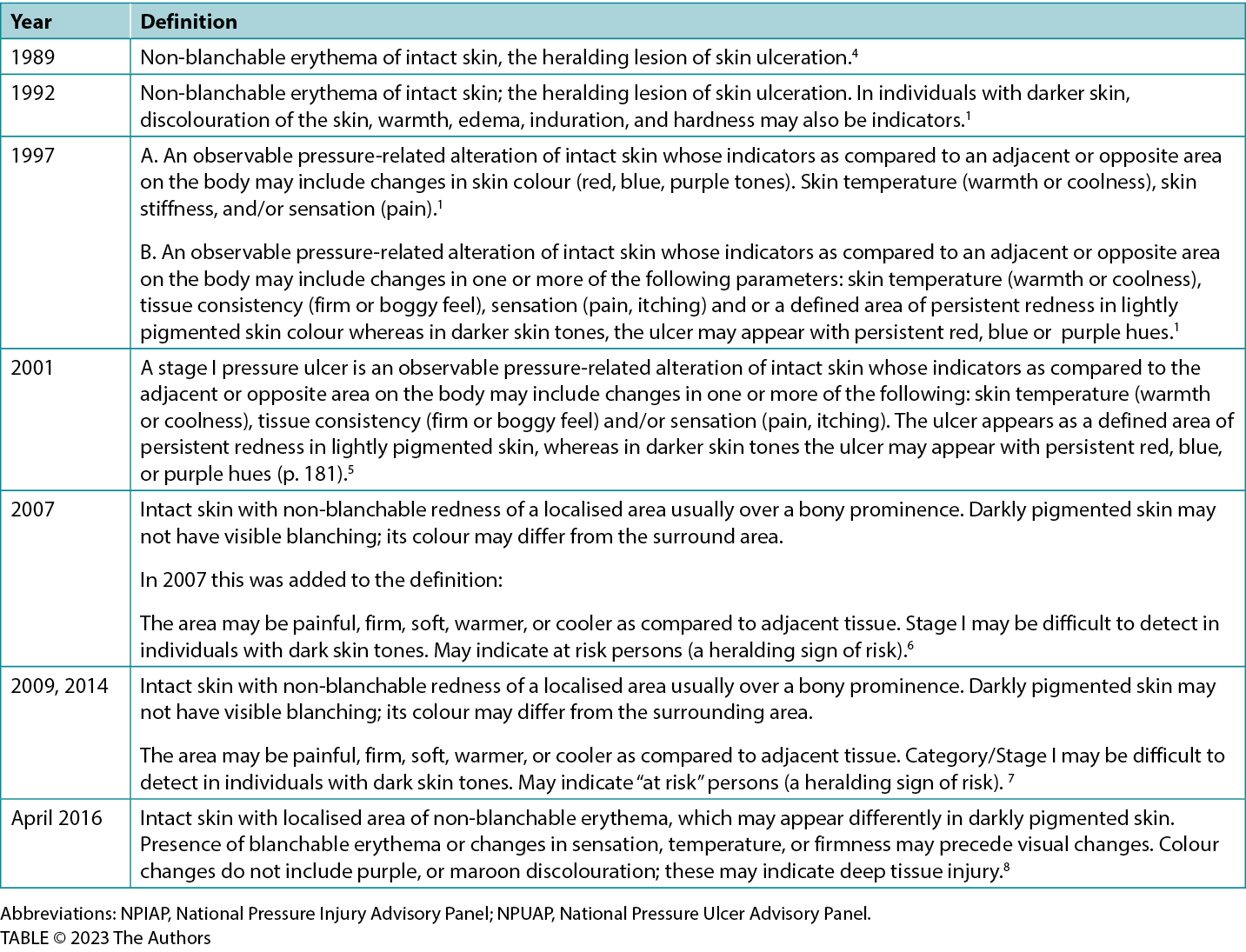
In the mid-1990s, clinicians and NPIAP board members recognised the need for the stage 1 definition to include how these PIs would appear in persons with dark skin tones.1 They noted that assessments that identify a stage 1 PI, such as “erythema” and “non-blanchable erythema,” were not always visible in patients with dark skin tones and, therefore, other indicators of stage 1 PI were needed. A task force was formed to address these issues.2,4
The NPIAP Task Force agreed on the following assumptions:20
- Intact skin has a variety of colour changes
- Very darkly pigmented skin does not have visible blanching
- The person’s race and ethnicity are not predictive of skin pigmentation
- Non-blanchable erythema only reflected one description of change in skin colour seen in early PI; it was not a universal descriptor
- Other objective findings of stage 1 PI could include temperature changes (warmth, coolness, edema, induration).
Table 1 lists the various iterations of the definition over the years.1,5,9,17,18,20
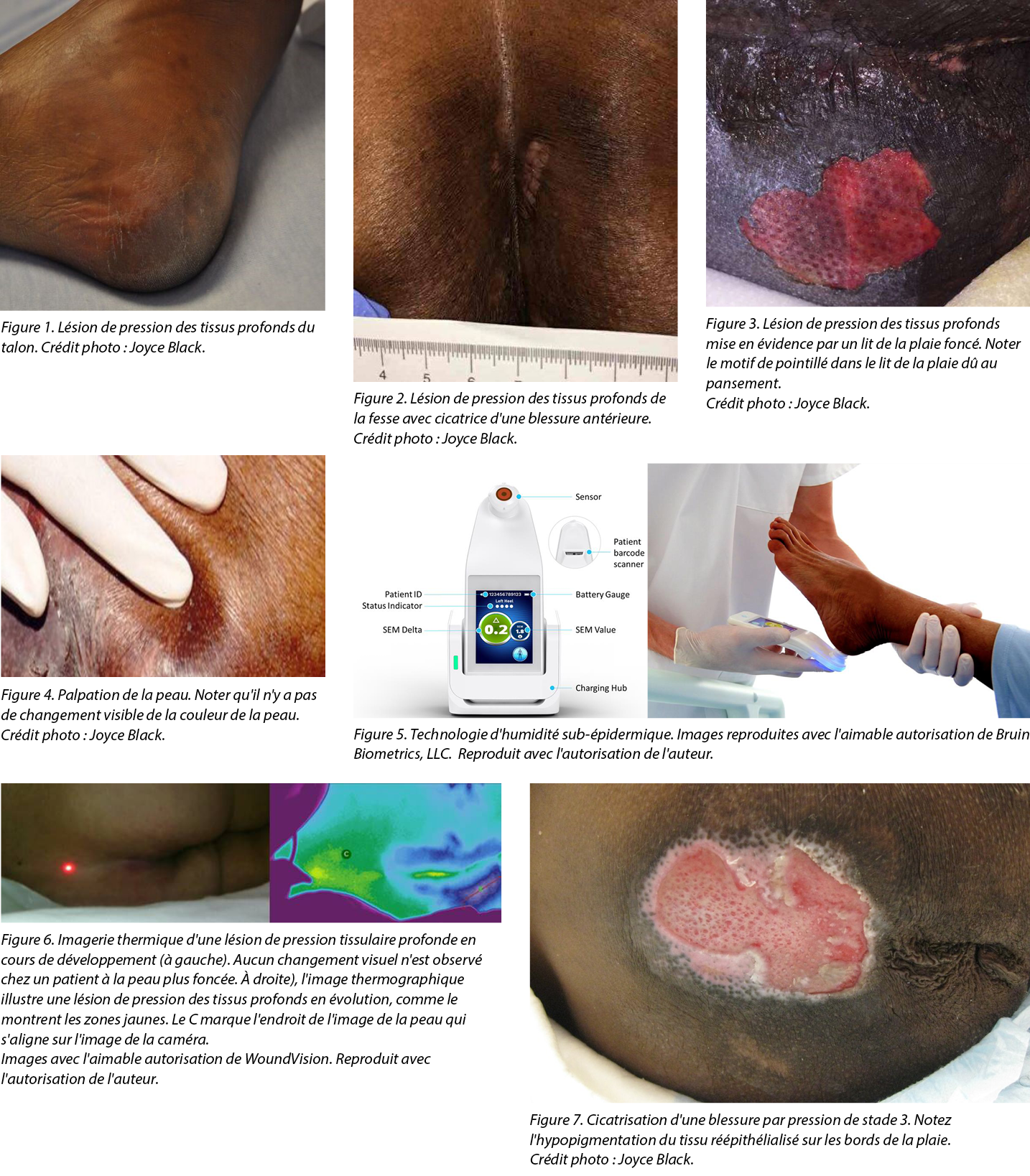
In 2005, the NPIAP identified deep tissue PIs (DTPIs). As with stage 1 PIs, DTPIs are difficult to detect in patients with dark skin tones (Figures 1-3).25 Other NPIAP initiatives that call attention to skin tone diversity include staging diagrams illustrating different skin colours/tones (available on the NPIAP website).
Table 1. Npuap/npiap stage 1 pressure injury definitions: historical evolution
Epidemiology of PIs in persons with dark skin tones
A limited number of studies have examined PI rates by race/ethnicity or skin tone in individuals admitted to acute care settings or long-term care facilities or residing in a nursing home. However, in a literature review of PIs in patients with dark skin tones, Gunowa and colleagues26 report that patients with dark skin tones are more likely to develop higher stage PIs regardless of the type of healthcare setting. The following discussion outlines what is known regarding the prevalence/incidence of PIs among patients with dark skin tones delineated by healthcare setting.
PIs among admissions to nursing homes
Using the Minimum Data Set (MDS) version 2.0, PIs (stage 2, 3 or 4) were present in 15% of older adults admitted to US nursing homes.27,28 Higher rates of PIs have been reported among Black individuals admitted to nursing homes. Approximately twice as many Black patients (16.6%) admitted to 59 nursing homes in Maryland had a PI compared with White patients (8.4%).29 In a national chain of nursing homes, Harms et al28 reported rates of PIs among older adults admitted to nursing homes by race and ethnicity (American Indian and Alaskan Native, Asian or Pacific Islander, Black not Hispanic, Hispanic, White not Hispanic). Black patients admitted to nursing homes had the greatest mean number of PIs per resident at 2.4 (SD, 2.2). The prevalences of stage 2, 3, or 4 PIs were lowest among White patients compared with all other racial and ethnic groups. The prevalence of a stage 1 PI among Black patients at admission was 7%, whereas stage 2 injury prevalence was 20%. Among all racial/ethnic groups, Black patients also had the highest prevalences of the most severe PIs at 7% (stage 3) and 8% (stage 4); White patients had the lowest prevalences at 3% for both stages.
PI prevalence among nursing home residents
Ahn et al30 found that among individuals residing in all US nursing homes, 8.4% had a PI, and 1.7% had a suspected DTPI.30 A greater percentage of Black residents (18.2%) compared with White residents (13.8%) had a PI in a set of nursing homes in New York.31 In a study examining differences in the prevalence of PIs among high-risk residents in US nursing homes over 5 years, PI prevalence decreased for both Black and White residents. However, there was a 5.4% overall unadjusted difference in PI prevalence (higher in Black patients).32 In a study examining the reporting of PIs by nursing homes using the MDS version 3.0, Chen et al33 found that the percentage of stage 4 PIs was higher among short-stay Black residents (50.4%) compared with White residents (40.8%).33 Black race was significantly associated with having a stage 2 to 4 PI (odds ratio [OR], 11.44; 95% CI, 1.44–1.47). Hispanic ethnicity was significantly associated with having a suspected DTPI (OR, 2.63; 95% CI, 1.47–1.58).
PI incidence in nursing homes
Cai et al31 found that Black residents in New York nursing homes were more likely to develop a PI during their stay than were White residents, controlling for other risk factors (OR, 1.203; P = .01).31 In another study, 7.7% of approximately 90,500 nursing residents developed stage 2 to 4 PIs after they were admitted to a nursing home. Black residents who developed a PI during their nursing home stay did so sooner than did White residents.34 The disparity in time to development of a PI among Black residents increased over time: The disparity was 3% at 3 months post-admission and grew to 5.8% at 6 months. During a 12-week surveillance in a nursing home in Pennsylvania, a greater percentage of Black residents (47%) developed a stage 2 to 4 PI than White residents (18%).35 Moreover, no stage 1 PIs were identified in Black residents.
PIs among hospitalised patients
Studies specifically examining PI prevalence and incidence in the acute care setting with a focus on racial distribution or patients with dark skin tones are scarce, with most studies conducted over a decade ago. In a large, multiyear prevalence study conducted between 1989 to 2005, Van Gilder and colleagues36 found the proportion of stage 1 PIs in patients with dark skin tones to be much lower (13%) than in those with medium (32%) to light (38%) skin tones. This finding may be attributed to difficulty in detection of stage 1 PIs in patients with dark skin. More severe PIs (stage 3, stage 4, eschar) were also found among patients with dark skin tones as compared with those with light or medium skin tones (11% vs 6-7%, 13% vs 6-7%, and 9% vs 5-6%, respectively). In a large, multiyear national study using the National Inpatient Sample (NIS) database from 2008 to 2012, Bauer and colleagues37 reported that among patients who identified as African American, PI rates were significantly higher than among all other racial groups at 2.4%; patients who identified as White had the second highest incidence reported at 1.8%. Moreover, the PI stage was more severe in African American patients (stage 3), whereas stage 2 was the most common stage among White patients.37
Using the NIS database from 2003, Fogerty and colleagues38 identified that African Americans were more likely to be discharged from US hospitals with PIs in comparison with non-African Americans (OR, 2.3; no CI provided). No analysis of PI stage was conducted in this investigation. A recent investigation conducted by Cox and Thomas-Hawkins39 echoes the results of these previous works. In this investigation of 17,781 patients with PIs using the 2018 Healthcare Cost and Utilization Project (HCUP) State-Specific Database (New Jersey), a higher proportion of patients identifying as Black had an admitting diagnosis of PIs (5.0% vs 3.5%; P < .05) as well as a higher proportion of stage 4 PIs (3.3% vs 2.3%) when compared to all other races combined. When secondary diagnoses of PIs were examined, Black patients had a significantly lower proportion of stage 1 PIs (4.7% vs 18%; P < .05) but a higher proportion of stage 4 PIs (28.7% vs 16.9%; P < .05) when compared to all other races combined. Limitations cited for this study include the single state nature of the data and a lack of multivariate analysis.
Collectively, this limited body of work highlights some important considerations with regard to PI reporting across healthcare settings. First, there is the paucity of recent studies that have considered or examined race or dark skin tones as a potential risk factor for PI development. This is important because the change in racial diversity across the US warrants investigation. Second, the similarities in PI rates across these limited studies are striking and may highlight the need for specific clinical and diagnostic tools in practice to identify impending PIs in patients with dark skin tones.
Anatomy and physiology of skin
The skin consists of two distinct layers: epidermis and dermis.40-43 The epidermis is cellular and avascular, consisting of 90% keratinocytes which synthesize the strong, water-insoluble structural protein, keratin. The epidermis protects from water loss, shear, friction, and toxic irritants. It also prevents invasion of bacteria and other pathogens by three mechanisms: 1) a mechanical barrier, 2) an acid mantle (pH, 4-6.6) suppressing bacterial growth, and 3) shedding of skin cells to minimize bioburden.
The epithelium is composed of five layers of cells: stratum corneum (SC), stratum lucidum, stratum granulosum, stratum spinosum, and stratum basale.40 Available evidence about epidermal layers with known differences in persons with dark versus light skin tones include the stratum corneum, stratum spinosum, and stratum basale.
The stratum basale is the deepest of the five layers of the epidermis.44 A basal cell is a stem cell that is a precursor of the keratinocytes of the epidermis. All keratinocytes are produced from this single layer of cells, which are constantly undergoing mitosis to produce new cells. As basal cells divide, one cell moves toward the surface and the other remains to continue reproduction.
In addition to basal cells, Merkel cells and melanocytes are also present in this layer. The Merkel cell functions as a receptor responsible for stimulating sensory nerves that the brain perceives as touch. Melanocytes produce the melanin pigment, which gives hair and skin its colour and protects living cells of the epidermis from ultraviolet radiation damage.
Differences in skin anatomy and physiology between dark and light skin tones
Pigmentation is the most obvious difference in the skin among racial groups.45 Racial variation is dependent on the quantity of melanin, amount of UV exposure, genetics, melanosome content, and type of pigments found in the skin. Four chromophores are responsible for the differences in colour found in human skin: hemoglobin, oxyhemoglobin, melanin, and carotenoids. Hemoglobin and oxyhemoglobin are responsible for the pinkish colour of white skin. Melanin accounts for the various brown shades in black and sun-tanned skin. Carotenes underlie yellow-orange pigmentation. Individuals with the most lightly pigmented skin have approximately half as much epidermal melanin as the most darkly pigmented skin types.
Differences in the SC have been reported between darkly pigmented skin (Fitzpatrick Classification Scale V and VI) and lightly pigmented skin (Fitzpatrick I/II/III).46 Darkly pigmented skin has more layers of corneocytes than lightly pigmented skin at a mean of 21.8 cells versus 16.7 cells, respectively. No differences have been reported in the size or thickness of the cells, although the cell layers in dark skin tones are thought to be more compact, reflecting greater intercellular cohesion. Although study results vary, the rate of spontaneous desquamation may be 2.5 times higher in persons with dark skin tones than those with lighter skin tones, accounting for the higher frequency of xerosis in individuals with dark skin tones.47 Differences in desquamation also vary by body site between individuals with dark versus light skin tones (eg, higher rates of desquamation of lightly pigmented skin on the cheeks and forehead).
Corneocyte size, quality, and phenotype are important because smaller cells usually correlate with epidermal (keratinocyte) hyperproliferation and development of dry skin from reduced lipid levels. Although study results vary, individuals with dark skin tones have the lowest levels of ceramides (lipid) at approximately 50% of the SC ceramide levels of individuals with lighter skin tones.2 Consequently, dark skin tones are linked to higher transepidermal water loss (TEWL) yielding lower water content (WC) of the SC. In addition, darkly pigmented skin has lower skin vascular reactivity to external factors (eg, vasodilators). Cumulatively, higher TEWL, lower WC, and reduced thermoregulatory skin response heighten the vulnerability of individuals with dark skin tones to PI development.48 Although studies are inconclusive, reduced vascular reactivity also may hinder visualization of blanching erythema of stage 1 PIs.
Gefen proposes a mechanical strain model for dark SC.48 Reduced WC in the SC may increase SC stiffness, resulting in less effective dispersion of friction and greater mechanical stress. Thus, a vicious cycle of shear damage occurs in persons with dark SC leading to progressive increases in TEWL. The WC in dark damaged SC decreases with increasing TEWL, further elevating mechanical stress concentrations. As TEWL increases, the skin becomes drier and more inflamed, heightening risk of skin injury from pressure, shear, and friction.
Skin tone assessment and measurement
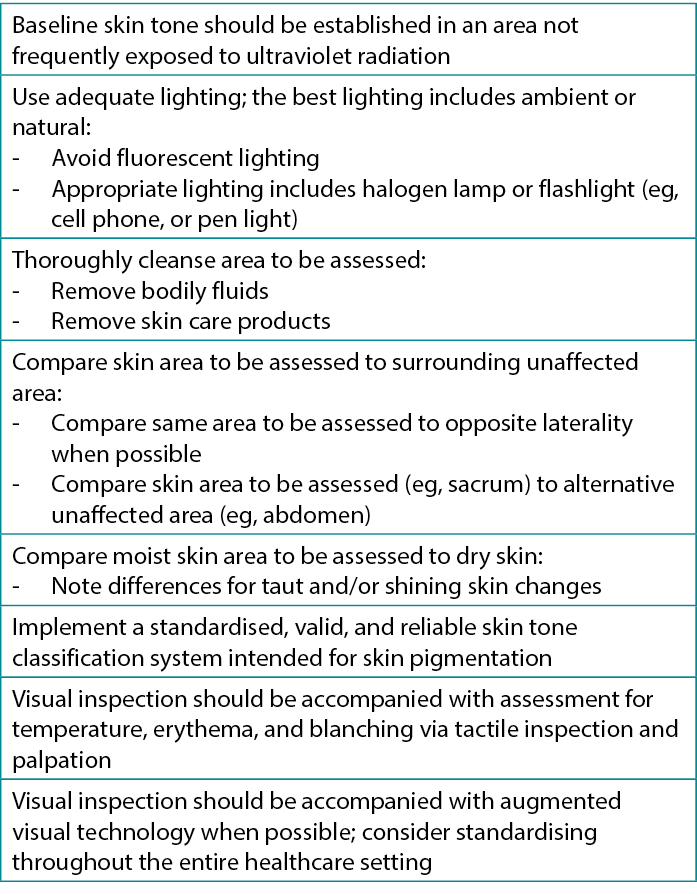
Variations in skin pigmentation, condition (dry or moist), and temperature; the presence of fluid or products; the visual acuity of the observer; and lighting are some of the factors that can influence the subjective nature of skin assessments performed by clinicians.49 Visual inspection of skin changes related to pressure, such as blanching, redness, or erythema is complemented by touch and technology (Figure 4).50,51 However, for visual inspection practices, standardization in terms and technique is key to ensure consistency among various clinician assessments. It is important to note that visual inspection alone is unreliable.22,51 Table 2 provides key information on visual assessment for diverse skin tones to assist clinicians in identifying early skin changes.22,52,53
Table 2. Visual skin assessment for diverse skin tones22,54
Skin tone classification scales
Classification of skin colour was often previously based on self-reported ethnicity and race. Colour categories based on observers’ descriptions have not been widely systematised. The use of classification scales offers some regularity; however, the function is varied. In addition to the validity and scientific rigor in the development and design of the scales, the effectiveness of classification models is dependent on individual competence and inter-rater reliability, which varies from setting to setting. These scales offer a constitutive (baseline) skin colour, facultative skin colour (sun or UV exposure), and PI-induced change in skin colour.22,54
The Fitzpatrick Classification Scale was developed to identify complexion and tolerance to sunlight and designed as a measure of sun sensitivity.22,53-57 The Fitzpatrick Scale is not reliable when evaluating skin exposed to UV radiation (environmental factors) and would be best used to assess skin not exposed.
The Munsell Colour System (MCS), designed by an artist for painting, describes qualities of hue, lightness (value), and intensity (chroma), and was initially used in soil research.58 In healthcare settings, this scale has undergone minimal validity and reliability testing despite its use in skin tone assessments.53,57,59
The Massey-Martin Scale (MMS), also known as the New Immigrant Survey (NIS) Skin Colour Scale, is a skin tone survey instrument designed for skin tone observation.53,60 The initial instructions for use avoided the comparison of the pictorial guide to the person’s skin side-by-side, as this was intended for social surveys conducted in person (by memory for the observer) or by phone (results indicated as unknown).
The Skin Tone Colour Scale (STCS) system by Konishi et al59 was designed based on the MCS and is intended for skin and lesion tone assessment. The system is vast in the selection of diverse skin tones making it the most comprehensive classification available to clinicians.
Overall, current terms to describe skin colour tone are subjective, imprecise, non-standardised, and can have offensive connotations. Visual assessment scales, such as the Munsell61,62 and Fitzpatrick scales,63 which use images of skin colour tones are limited in that they cannot represent the full range of tones among individuals or even between body locations of the same individual in a feasible and useful way.
Recognising these problematic issues of assessing skin colour tone, the British Association of Dermatologists (BAD) recommended that terminology about skin colour tone be neutral, based on objective measurements, and reflective of multiethnic populations.6,64 The most objective measure is via genetically established skin tone by melanogenesis. Pigmentation presents where melanocyte cells produce melanin in the skin. Dadzie et al6 and BAD proposed the use of eumelanin pigment nomenclature for skin tone description and developed the Eumelanin Human Skin Colour Scale (ESCS) specifically for visual skin assessment. The scale is based on and named after eumelanin, which comprises 90% of the pigment found in human skin. The ESCS has five categories of melanin index that is measured by light reflectance: eumelanin low (<25), eumelanin intermediate low (25-<50), eumelanin intermediate (50-<75), eumelanin intermediate high (75-<100), and eumelanin high (≥100).6 There are small, lightweight, portable, easy-to-use instruments for measuring melanin index. The ESCS has potential for use in classifying outcomes of PIs such as incidence and healing and monitoring for disparities/inequities.
Early visual detection technologies and dark skin tones
In individuals with dark skin tones, it is especially challenging to visually identify early skin changes that may herald an impending PI. The use of augmented visual technologies such as subepidermal moisture (SEM) assessment technology and long wave infrared technology (LWIT) hold promise for early identification of skin and tissue changes before they are visible to the naked eye. Thus, use of these technologies may create a window of opportunity for targeted interventions before the visible and tactile manifestations of tissue damage occur.65 Absent these technologies, this window is invisible to direct care clinicians. The subclinical nature of developing PIs has resulted in diagnostic latency, which then contributes to interventional latency. In individuals with dark skin tones, this lag results in a higher probability of PIs remaining undetected.66 Early detection technologies may help resolve this problem.
SEM technology
Subepidermal moisture assessment technology is based on the contemporary understanding of PI etiology (Figure 5).67,68 The onset of microscopic damage in the early development of PIs and DTPIs is consistent regardless of skin pigmentation. Cell and tissue damage triggered by sustained pressure, shear, and friction signal acute inflammatory responses. As the level of tissue damage increases, so does the inflammatory response.67 This immune response results in interstitial edema. Localised edema or SEM is one of the earliest indicators of nonvisible pressure damage. The ICD-10 coding for stage 1 PIs characterizes this early damage as ‘pre-ulcer skin changes limited to persistent focal edema.’69 This subclinical progression of tissue damage is further described in the etiology chapter of the 2019 clinical practice guidelines for the prevention and treatment of PIs.51
The SEM scanner device is FDA approved as a PI management tool and is indicated for adults of all skin tones at risk of PI development. The noninvasive point-of-care device detects persistent focal edema and reports the results as a SEM delta (∆) value (Figure 1). The SEM assessment technology measures changes in SEM between healthy and inflamed tissue.70 Increased SEM values may indicate an anatomy-specific increased risk for PI development in all skin tones.68
Meta-analyses from systematic reviews report early detection of PI development via SEM assessments by a median of 5 days before visual assessments (P ≤ .001).71,72 In a dual-arm study of 175 participants (n = 48/175, non-White), SEM assessments reported a diagnostic sensitivity and specificity of 86.8% and 88% in detecting PIs, resulting in an area-under-the-curve significantly exceeding clinical judgement (P < .0001).70 In a cohort study, SEM assessments detected developing stage 1 PIs 1 week earlier than a visible diagnosis of a stage 1 erythema (OR, 5.3; CI 1.87-15.11; P < .001) in individuals with dark skin tones (n = 11/66).73 In a multi-ethnic clinical study, SEM measurements were statistically significant in detecting concurrent and future stage 1 PIs and DTPIs in both heels in residents with dark skin tones as per Munsell value (n = 68/417; P < .001).74 An observational study of 15 patients (n = 4/15, Fitzpatrick type III and above) reported early indication of tissue damage based on SEM measurements that agreed with a later confirmation of suspected DTPIs via ultrasound-based identification of hypoechoic lesions and visual assessments.75 In a retrospective study of 69 patients in surgical intensive care, nurses indicated SEM assessments enabled more accurate skin assessments in patients with dark skin tones (n = 29/69).76
Long-Wave Infrared Thermography device
Long-wave infrared thermography (LWIT) is a noninvasive, multimodal device for use in clinical environments. It incorporates LWIT with a camera to detect PIs before visual or tactile changes occur. The device assesses changes in skin temperature because localised heat, edema, and changes in tissue consistency are all typical warning signs for PI development.77 The device can be useful in patients with light or dark skin tones. It is particularly helpful in detecting DTPIs, which can remain undetected on the skin for up to 72 hours (Figure 6).9,78 This feature is particularly important for patients with dark skin tones because dark skin pigmentation can mask the typical deep colours of purple and maroon that serve as the heralding visual signs for a DTPI.
As a combination photographic and LWIT device, it uses two imaging modalities by measuring long-wave infrared radiation (energy emitted from the human body) to create the final digital images. The energy, or lack thereof, is created from blood flow, perfusion, and, ultimately, metabolic activity. The device uses a relative temperature differential to compare the environmental temperature with the adjacent skin temperature and adapts for intrinsic and extrinsic factors (eg, elevated core body temperature, room temperature). A cooler temperature in comparison with the adjacent skin indicates less perfusion and deeper ischemic damage; warmer temperatures indicate increased metabolic activity and inflammation.
The reliability and validity of using LWIT to detect PIs have been confirmed in several studies.79-84 The 2019 International Pressure Injury Prevention and Treatment Clinical Practice Guideline identified thermography as an area of high research priority.85
Pi prevention in persons with dark skin tones
Pressure injury prevention is rooted in both risk assessment and routine, comprehensive skin and soft tissue assessment.51 Current evidence-based prevention practices apply to persons with dark skin tones and should be implemented.51,86 Because early PI detection is challenging in patients with dark skin tones, the identification of a later stage PI stage (at the time of discovery), has been reported when compared to lighter pigmented persons.87 Incorporating enhanced skin assessment techniques and visual augmentation devices into clinical practice should be a considered to enhance PI prevention in an effort to close the gap in early-stage identification.
PI treatment and healing in persons with dark skin tones
The process of healing a PI includes hemostasis, inflammation, proliferation, and maturation involving numerous molecular mechanisms.88,89 Healing is influenced by a patient’s clinical factors and treatments received. In patients with dark skin tones, healing PIs and especially the surrounding skin may appear differently to clinicians than in patients with lighter skin tones. For example, hypopigmentation of newly re-epithelialised tissue may be visible at the wound margins of a healing full thickness PI in patients with dark skin tones. (Figure 7). Although a few studies have reported differences and disparities in the prevalence or incidence of PIs by race or ethnicity,32,90 studies focused on the healing of PIs are far less common. Bliss et al91 analysed a nation-wide dataset of MDS records of older adults admitted to nursing homes. Of 10,862 older (65+ years) individuals admitted to a nursing home with a PI, 44% had healed by 90 days. However, there was a significant overall disparity of 6% in the healing of PIs (stages 2 to 4) present on admission at the required 90-day assessment among Black residents. In a study reporting on time to PI development during nursing home stays,90 99% of all residents with a PI received treatment for it, thus no disparity was found in the number of treatments by race or ethnic group. However, in other healthcare settings, such as acute care or the home care setting, there is a lack of evidence regarding disparities with regard to PI healing rates and treatment among patients with dark skin tones.

Social determinants of health
The impacts of SDOH on PI development and treatment are largely understudied and, thus, unknown. The US Department of Health and Human Services defines SDOH within five domains: economic stability, education access and quality, healthcare access and quality, neighborhood and built environments, and social and community context.92 Examination of these domains reveals potential health disparities and inequities across racial groups. Overall, people of colour have been disproportionately affected by and fare worse within all domains of SDOH compared with White individuals.93 Communities in Action: Pathways to Health Equity states that health equity is crucial for the well-being of communities.94 Although large gains have been made in healthcare coverage across racial/ethnic groups under the Affordable Care Act, people of colour remain more likely to be uninsured.94 Disparities exist with regard to income as well. In 2021, higher median incomes were reported for households headed by Asian or White individual, whereas households headed by persons identifying as Black or Hispanic reported median incomes lower than the national median.95
In two studies focused on PI development and the impact of race, elements of SDOH (economic stability and healthcare access and quality) were operationalised through patients’ income based on zip code of residence and health insurance payor status. Using the NIS database in 2009, Fogerty and colleagues38 identified an increased risk for PIs among African Americans insured by Medicare and Medicaid compared with Caucasians. With regard to income, a higher proportion of African Americans were found in the lower income quartiles (50.6%) than Caucasians (21.4%). However, in multivariate analysis, the researchers reported no significant differences between races for PI risk based on either payor status or income. Cox and Thomas-Hawkins39 reported a significantly higher proportion of Black individuals with PIs insured with Medicaid compared with patients with PIs from all other racial groups combined using 2018 HCUP state level data from New Jersey. With regard to income, reported by quartiles based on zip code of residence, a statistically significant higher proportion of Black persons with PIs resided in the lower income zip code quartiles and a lower proportion at the upper zip code income quartiles. In their sample, over 50% of Black patients with PIs lived in areas with reported incomes of $58,999 or less as compared with 19% of all other races combined. No multivariate analysis was conducted in this study. In a recent scoping review of the impact of SDOH on PI progression, Sasson and colleagues96 found that detriments in SDOH related to food scarcity (as identified through ICD-10 codes) and Black race were both significant, independent predictors of longer PI duration.96
Two recent national reports have validated the health inequities experienced by patients with dark skin tones who have PIs. In 2021, the Urban Institute reported that Black patients in the US were 31.9% less likely to be admitted to hospitals considered high quality with regard to PI prevention.97 Moreover, an Agency for Healthcare Research and Quality Disparities Report in 2019 identified that for both short- and long-stay nursing home patients, poorer quality of care associated with PIs was found among Black patients as compared with Whites patients.98 It is plausible that the development or worsening of a PI is influenced by access to quality healthcare, and this may play a pivotal role in the higher rates of PIs among Black patients. Without access to evidence-based prevention or treatment modalities, the ability to prevent a PI or facilitate wound healing is compromised. At this time, the extent of this disparity has not been studied and is unknown. This is an area in need of further exploration.
Clinician education and skin assessment in dark skin tones
Inaccurate skin assessment and lack of knowledge of PI appearance in dark skin tones can delay early identification and treatment, resulting in more severe PIs and financial penalties to the healthcare organization.99 Health inequities and racial disparities occur when healthcare professionals, whether through explicit or implicit biases, fail to adequately assess, identify, and prevent PIs in people of colour who are at risk of a PI.100,101 Inaccurate skin assessment can also occur because of the difficulty of visualising skin colour changes and discolourations in people with dark skin tones. Education provided to nurses and other clinicians related to assessment of people with diverse skin colours is sadly lacking.
As nurses, our reputation among the public is one of honesty, trust, and caring. Nurses have been ranked as the most honest and ethical of professions for more than 20 consecutive years.102 Yet, often nursing students emerge from our education programs not adequately prepared to understand the consequences of SDOH and the emphasis on providing safe and equitable care across the diverse populations we serve. Despite widespread goals to include diversity, equity, and inclusion and SDOH into nursing education curricula, whether this has been accomplished is uncertain.99 Recent evidence demonstrates there is a health disparity in undergraduate nurse education with education directed toward people with pale skin tones.99 Oozageer and colleagues99 conducted a documentary and observational study of nursing education and lectures on PIs at five undergraduate nursing programs in England. The investigators found an overwhelming focus on PIs in people with Caucasian skin tones with only brief, superficial information on people with dark skin tones.99 In a qualitative study in these five nursing education programs using focus groups, the investigators found a predominant theme of White normativity. Specifically, the investigators identified a dominance of Whiteness in the teaching about PIs and the implications for student nurses of Whiteness as the norm.99
In 2023, Pittman and Black103 examined health equity in nursing education textbooks, specifically examining physical assessment textbooks’ skin and integument content relevant to skin colour tones. Using a convenience sampling of physical assessment textbooks for undergraduate and graduate level nursing programs, the investigators modified Oozageer’s Diversity Observation Teaching Tool (DOTT) with permission to better fit their project aims. The textbooks’ content (ie, Integument/Skin Chapter) were reviewed independently, then data were reviewed for consistency or differences. Each investigator also explored their university’s simulation lab for evidence of diversity in manikin skin colour tones. Of the nine textbooks and 11 chapters, no chapter objectives included skin tone diversity. Six of the nine textbooks had visual descriptors of PI, including stages. However, of the six textbooks with photos, only three had photos with dark skin tones. The textbooks had 534 photos of various skin graphics or images but of those, only 35 (7%) were of dark skin tones. Conversely, 499 (93%) of the 534 images were of light skin tones. Both universities had simulation labs with 60 to 65% of the manikins having light skin tones and 35 to 40% having dark skin tones. However, it is not known if skin tone is discussed in the simulation scenarios. These findings support those of Oozageer and colleagues and demonstrate the lack of education regarding skin tone diversity that nursing students receive.
Conclusions
Racial disparities exist with regard to PI development and healing, especially highlighted among patients with dark skin tones. This article explored the current state of the science and identified gaps in the terms used to describe skin colour, making any data-based comparisons and trending impossible. With increasing racial diversity in the United States, including persons of mixed ethnic and racial backgrounds, the “race” of a patient should no longer be used as a demographic term or a risk factor for PIs. Skin tone colour must be more standardised and quantifiable in clinical education, practice, and research. In the face of a more racially diverse country in the upcoming decades, the ability to identify and treat developing PIs earlier will improve the quality of life for all patients. This work is urgently needed and support from private and governmental agencies is essential.
Conflict of Interest
The authors declare no conflicts of interest.
Funding
The authors received no funding for this study.
Perspectives actuelles sur les lésions de pression chez les personnes à la peau foncée par le Groupe consultatif national sur les lésions de pression
Joyce Black, Jill Cox, Virginia Capasso, Donna Z Bliss, Barbara Delmore, Vignesh Iyer, Jacqueline Massaro, Cassendra Munro, Joyce Pittman, Elizabeth A Ayello
DOI: https://doi.org/10.33235/wcet.43.3.18-29
Résumé
Contexte Le développement des lésions de pression (LP) est multifactoriel. Chez les patients à la peau foncée, il peut être particulièrement difficile d'identifier les LP imminentes par une évaluation visuelle de la peau. La nécessité d'améliorer les techniques d'évaluation de la peau, en particulier pour les personnes à la peau foncée, ne cesse de croître. De même, ces dernières années, on a constaté une plus grande prise de conscience de la nécessité d'intégrer la représentation des différentes couleurs de peau dans le matériel pédagogique.
Objectif Présenter les perspectives actuelles de la littérature concernant l'évaluation de la peau et le développement de LP chez les patients à la peau foncée.
Méthodes Les éléments suivants seront examinés sous l'angle de la couleur de la peau : 1) perspectives historiques de la classification des LP par le Groupe consultatif national sur les lésions de pression, 2) épidémiologie des LP, 3) anatomie et physiologie de la peau, 3) évaluation et mesure du teint de la peau, 4) modalités d'évaluation visuelle améliorée, 5) prévention des LP, 6) cicatrisation des LP, 7) déterminants sociaux de la santé, et 8) lacunes dans la formation de la pratique clinique.
Conclusions Cette revue met en évidence les lacunes de nos connaissances cliniques concernant les LP chez les patients à la peau foncée. Les disparités ethniques en matière de développement et de cicatrisation des LP sont particulièrement marquées chez les patients à la peau foncée. L'évaluation des teints de peau doit être standardisée et quantifiable dans la formation clinique, la pratique et la recherche. Ce travail est urgent et le soutien des organismes privés et gouvernementaux est essentiel.
Introduction
La diversité etnique s'est accrue aux États-Unis au cours des deux dernières décennies. Le Bureau du recensement des États-Unis indique que l'indice de diversité global est passé de 54,9 % en 2010 à 61,1 % en 2020 et qu'il devrait continuer à augmenter au cours de la prochaine décennie.1 Dans le monde, les personnes à la peau foncée constituent la majorité de la population.2
Au cours des 20 dernières années, on a assisté à une prise de conscience et à un intérêt croissants pour la nécessité d'une évaluation de la peau qui soit inclusive pour toutes les personnes, quelle que soit la couleur de leur peau.3-24 La réalité clinique est qu'aux États-Unis et dans le monde entier, la démographie des couleurs de peau a évolué et la conscience de différentes couleurs de peau s'est accrue, de sorte que la nécessité d'une évaluation et d'un diagnostic pointus de la peau pour tous les patients est devenue très urgente. En outre, la prise de conscience de la nécessité d'inclure diverses couleurs de peau dans le matériel pédagogique (formation professionnelle de base et formation continue) destiné aux étudiants et aux praticiens cliniques s'est également accrue ces dernières années.13
Dans cet article, les auteurs décrivent les perspectives actuelles concernant les lésions de pression chez les patients à la peau foncée. La première section aborde les efforts historiques du Groupe consultatif national sur les lésions de pression (NPIAP, anciennement NPUAP) pour remédier à cette disparité et réviser les définitions de stadification afin qu'elles soient pertinentes pour toutes les couleurs de peau. Parmi les autres sujets abordés sous l'angle de la couleur de peau figurent l'épidémiologie des LP, l'anatomie et la physiologie de la peau, les techniques et modalités d'évaluation visuelle et augmentée de la peau, la prévention et la cicatrisation des LP, les considérations relatives aux déterminants sociaux de santé (DSS) et les lacunes en matière de formation professionnelle.
Perspectives historiques sur la stadification des LP chez les personnes à la peau foncée
Au milieu des années 1990, des cliniciens et des membres du conseil d'administration du NPIAP ont reconnu la nécessité d'inclure dans la définition du stade 1 la façon dont ces LP apparaîtraient chez les personnes à la peau foncée.1 Ils ont noté que les évaluations qui identifient une LP de stade 1, telles que "érythème" et "érythème non-blanchâtre", n'étaient pas toujours visibles chez les patients à la peau foncée et que, par conséquent, d'autres indicateurs de LP de stade 1 étaient nécessaires. Un groupe de travail a été constitué pour traiter ces questions.2,4
Le groupe de travail NPIAP s'est accordé sur les hypothèses suivantes :20
- La peau intacte présente divers changements de couleur
- La peau à pigmentation très foncée ne présente pas de blanchiment visible
- Le groupe de population et l'origine ethnique de la personne ne permettent pas d’induire la pigmentation de la peau
- L'érythème non-blanchâtre ne reflète qu'une description du changement de couleur de la peau observé au début d’une LP ; il ne s'agit pas d'un descripteur universel
- D'autres constatations objectives des LP de stade 1 peuvent inclure des changements de température (chaleur, fraîcheur, œdème, induration).
Le tableau 1 énumère les différentes itérations de la définition au fil des ans.1,5,9,17,18,20
En 2005, le NPIAP a identifié les LP de tissus profonds (LPTP). Comme pour les LP de stade 1, les LPTP sont difficiles à détecter chez les patients à la peau foncée (figures 1 à 3).25 D'autres initiatives du NPIAP attirent l'attention sur la diversité des teints de peau, notamment des diagrammes de stades illustrant différents couleurs/teints de peau (disponibles sur le site internet du NPIAP).
Tableau 1. Définitions des lésions de pression de stade 1 de la Npuap/npiap : évolution historique

Épidémiologie des lp chez les personnes ayant à la peau foncée
Un nombre limité d'études a examiné les taux de LP en fonction du groupe de population /de l’ethnie ou de la couleur de peau chez les personnes admises dans des établissements de soins aigus ou des établissements de soins de longue durée ou résidant dans une maison de repos. Cependant, dans une revue de la littérature sur les LP chez les patients à la peau foncée, Gunowa et ses collègues26 rapportent que les patients à la peau foncée sont plus susceptibles de développer des LP à de stade plus élevé, quel que soit le type d'établissement de soins de santé. La discussion qui suit présente les connaissances relatives à la prévalence/incidence des LP chez les patients à la peau foncée, en fonction de l'établissement de soins de santé.
Les LP parmi les admissions en maison de repos
D'après la version 2.0 de l'Ensemble de données minimales (EDM), 15 % des personnes âgées admises dans des maisons de repos aux États-Unis présentaient des LP (stade 2, 3 ou 4).27,28 Des taux plus élevés de LP ont été signalés chez les personnes noires admises dans les maisons de repos. Environ deux fois plus de patients noirs (16,6 %) admis dans 59 maisons de repos du Maryland avaient une LP que de patients blancs (8,4 %).29 Dans une chaîne nationale de maisons de repos, Harms et al.28 ont comptabilisé les taux de LP chez les personnes âgées admises dans les maisons de repos en fonction des groupes de population et de l'appartenance ethnique (Indiens d'Amérique et autochtones d'Alaska, Asiatiques ou insulaires du Pacifique, Noirs non hispaniques, Hispaniques, Blancs non hispaniques). Les patients noirs admis dans des maisons de repos avaient le plus grand nombre moyen de LP par résident, soit 2,4 (écart-type, 2,2). Les prévalences des LP de stade 2, 3 ou 4 étaient les plus faibles chez les patients blancs par rapport à tous les autres groupes de population et ethniques. La prévalence des LP de stade 1 chez les patients noirs à l'admission était de 7 %, tandis que la prévalence des lésions de stade 2 était de 20 %. Parmi tous les groupes de population/ethniques, les patients noirs présentaient également les prévalences les plus élevées des LP les plus sévères, soit 7 % (stade 3) et 8 % (stade 4). Les patients blancs présentaient les prévalences les plus faibles, soit 3 % pour les deux stades.
Prévalence des LP chez les résidents des maisons de repos
Ahn et al.30 ont constaté que parmi les personnes résidant dans l'ensemble des maisons de repos des États-Unis, 8,4 % avaient une LP et 1,7 % une suspicion de LPTP.30 Un pourcentage plus élevé de résidents noirs (18,2 %) que de résidents blancs (13,8 %) avaient une LP dans un ensemble de maisons de repos à New York.31 Dans une étude examinant les différences de prévalence des LP parmi les résidents à haut risque dans les maisons de repos américaines sur une période de 5 ans, la prévalence des LP a diminué à la fois pour les résidents noirs et les résidents blancs. Cependant, il y avait une différence globale non ajustée de 5,4 % dans la prévalence des LP (plus élevée chez les patients noirs).32 Dans une étude examinant les déclarations de LP par les maisons de repos utilisant la version 3,0 de l’EDM, Chen et al.33 ont constaté que le pourcentage de LP de stade 4 était plus élevé chez les résidents noirs de court séjour (50,4 %) comparé aux résidents blancs (40,8 %).33 La peau noire était significativement associée au fait d'avoir une LP de stade 2 à 4 (odds ratio [OR], 11,44 ; IC 95 %, 1,44-1,47). L'appartenance à une ethnie hispanique était significativement associée à la suspicion de LPTP (OR, 2,63 ; IC 95 %, 1,47-1,58).
Incidence des LP dans les maisons de repos
Cai et al.31 ont constaté que les résidents noirs des maisons de repos de New York étaient plus susceptibles de développer une LP pendant leur séjour que les résidents blancs, en tenant compte des autres facteurs de risque (OR, 1,203 ; P = 0,01).31 Dans une autre étude, 7,7 % d'environ 90 500 résidents de maisons de repos ont développé une LP de stade 2 à 4 après avoir été admis dans une maison de repos. Les résidents noirs qui ont développé une LP pendant leur séjour en maison de repos l'ont fait plus tôt que les résidents blancs.34 La disparité dans le délai de développement d'une LP chez les résidents noirs croissait au fil du temps : La disparité était de 3 % trois mois après l'admission et atteignait
5,8 % six mois plus tard. Au cours d'une surveillance de 12 semaines dans une maison de repos de Pennsylvanie, un pourcentage plus élevé de résidents noirs (47 %) que de résidents blancs (18 %) a développé une LP de stade 2 à 4.35 En outre, aucune LP de stade 1 n'a été identifiée chez les résidents noirs.
Les LP chez les patients hospitalisés
Les études portant spécifiquement sur la prévalence et l'incidence des LP dans les établissements de soins aigus et mettant l'accent sur la répartition etnique ou les patients à la peau foncée sont rares, la plupart d'entre elles ayant été réalisées il y a plus de dix ans. Dans une vaste étude de prévalence pluriannuelle menée entre 1989 et 2005, Van Gilder et ses collègues36 ont constaté que la proportion de LP de stade 1 chez les patients à la peau foncée était beaucoup plus faible (13 %) que chez ceux à la peau de teint moyen (32 %) ou claire (38 %). Cette constatation peut être attribuée à la difficulté de détecter les LP de stade 1 chez les patients à la peau foncée. Des LP plus sévères (stade 3, stade 4, escarre) ont également été observées chez les patients à la peau foncée par rapport à ceux au teint clair ou moyen (11 % contre 6 % et 7 %, 13 % contre 6 % et 7 % et 9 % contre 5 % et 6 %, respectivement). Dans une vaste étude nationale pluriannuelle utilisant la base de données National Inpatient Sample (NIS) de 2008 à 2012, Bauer et ses collègues37 ont rapporté que parmi les patients s’identifiant comme Afro-Américains, les taux de LP étaient significativement plus élevés que dans tous les autres groupes de population (2,4 %) ; les patients s'identifiant comme Blancs présentaient la deuxième incidence la plus élevée (1,8 %). En outre, le stade des LP était plus sévère chez les patients afro-américains (stade 3), alors que le stade 2 était le plus fréquent chez les patients blancs.37
En utilisant la base de données NIS de 2003, Fogerty et ses collègues38 ont constaté que les Afro-Américains étaient plus susceptibles de sortir des hôpitaux américains avec des LP que les non-Afro-Américains (OR, 2,3 ; pas d'IC fourni). Aucune analyse de stade de LP n'a été réalisée dans le cadre de cette enquête. Une enquête récente menée par Cox et Thomas-Hawkins39 fait écho aux résultats de ces travaux antérieurs. Dans cette enquête portant sur 17 781 patients souffrant d’une LP à l'aide de la base de données 2018 du Projet coût et utilisation des soins de santé (HCUP), la State-Specific Database (New Jersey), une proportion plus élevée de patients s'identifiant comme Noirs avaient un diagnostic de LP à l'admission (5,0 % contre 3,5 % ; P < 0,05) ainsi qu'une proportion plus élevée de LP de stade 4 (3,3 % contre 2,3 %) par rapport à toutes les autres populations confondues. Lorsque les diagnostics secondaires de LP ont été examinés, les patients noirs avaient une proportion significativement plus faible de LP de stade 1 (4,7 % contre 18 % ; P < 0,05) mais une proportion plus élevée de LP de stade 4 (28,7 % contre 16,9 % ; P < 0,05) par rapport à toutes les autres populations confondues. Les limites citées pour cette étude comprennent la nature unique des données et l'absence d'analyse multivariée.
Collectivement, ce corpus limité de travaux met en lumière certaines considérations importantes concernant les déclarations de LP dans les établissements de soins de santé. Tout d'abord, peu d'études récentes ont considéré ou examiné le groupe ethnique ou un teint de peau foncé comme un facteur de risque potentiel pour le développement des LP. Ce point est important car l'évolution de la diversité etnique aux États-Unis mérite d'être étudiée. Deuxièmement, les similitudes entre les taux de LP dans ces études limitées sont frappantes et peuvent mettre en évidence le besoin d'outils cliniques et diagnostiques spécifiques dans la pratique pour identifier les LP imminentes chez les patients à la peau foncée.
Anatomie et physiologie de la peau
La peau se compose de deux couches distinctes : l'épiderme et le derme.40-43 L'épiderme est cellulaire et avasculaire, composé à 90 % de kératinocytes qui synthétisent la kératine, une protéine structurelle solide et insoluble dans l'eau. L'épiderme protège contre la perte d'eau, le cisaillement, la friction et les irritants toxiques. Il empêche également l'invasion de bactéries et autres agents pathogènes par trois mécanismes : 1) une barrière mécanique, 2) un manteau acide (pH : 4 à 6,6) empêchant la croissance bactérienne, et 3) l'élimination des cellules cutanées pour minimiser la charge biologique.
L'épithélium est composé de cinq couches de cellules : stratum corneum (SC), stratum lucidum, stratum granulosum, stratum spinosum et stratum basale.40 Les données disponibles sur les couches épidermiques présentant des différences connues chez les personnes ayant des teints de peau foncés par rapport aux personnes ayant des teints de peau clairs comprennent le stratum corneum, le stratum spinosum et le stratum basale.
La couche basale est la plus profonde des cinq couches de l'épiderme.44 Une cellule basale est une cellule souche qui est un précurseur des kératinocytes de l'épiderme. Tous les kératinocytes sont issus de cette couche unique de cellules, qui subissent constamment des mitoses pour produire de nouvelles cellules. Lorsque les cellules basales se divisent, une cellule se déplace vers la surface et l'autre reste pour poursuivre la reproduction.
Outre les cellules basales, les cellules de Merkel et les mélanocytes sont également présents dans cette couche. La cellule de Merkel fonctionne comme un récepteur responsable de la stimulation des nerfs sensoriels que le cerveau perçoit comme le toucher. Les mélanocytes produisent le pigment de mélanine, qui donne sa couleur aux cheveux et à la peau et protège les cellules vivantes de l'épiderme des dommages causés par les rayons ultraviolets.
Différences dans l'anatomie et la physiologie de la peau entre les teints de peau foncés et clairs
La pigmentation est la différence la plus évidente entre les groupes de population.45 Les variations ethniques dépendent de la quantité de mélanine, de l'exposition aux UV, de la génétique, du contenu en mélanosomes et du type de pigments présents dans la peau. Quatre chromophores sont responsables des différences de couleur de la peau humaine : l'hémoglobine, l'oxyhémoglobine, la mélanine et les caroténoïdes. L'hémoglobine et l'oxyhémoglobine sont responsables de la couleur rosée de la peau blanche. La mélanine est à l'origine des différentes nuances marron de la peau noire et de la peau bronzée. Les carotènes sont à la base de la pigmentation jaune-orange. Les personnes dont la peau est la plus légèrement pigmentée ont environ deux fois moins de mélanine épidermique que les personnes dont la peau est la plus foncée.
Des différences dans la couche cornée (SC) ont été décrites entre les peaux à pigmentation foncée (échelle de classification de Fitzpatrick V et VI) et les peaux à pigmentation claire (Fitzpatrick I/II/III).46 Les peaux à pigmentation foncée ont plus de couches de cornéocytes que les peaux à pigmentation légère, avec une moyenne de 21,8 cellules contre 16,7 cellules, respectivement. Aucune différence n'a été décrite en ce qui concerne la taille ou l'épaisseur des cellules, bien que l'on pense que les couches cellulaires des peaux foncées sont plus compactes, reflétant une plus grande cohésion intercellulaire. Bien que les résultats des études varient, le taux de desquamation spontanée peut être 2,5 fois plus élevé chez les personnes à la peau foncée que chez celles à la peau plus claire, ce qui explique la fréquence plus élevée de la xérose chez les personnes à la peau foncée.47 Les différences de desquamation varient également selon le site corporel entre les personnes à la peau foncée et celles à la peau claire (par exemple, les taux de desquamation de la peau légèrement pigmentée sur les joues et le front sont plus élevés).
La taille, la qualité et le phénotype des cornéocytes sont importants, car des cellules plus petites sont généralement associées à une hyperprolifération de l'épiderme (kératinocytes) et au développement d'une peau sèche en raison d'une diminution des taux de lipides. Bien que les résultats des études varient, les personnes à la peau foncée ont les niveaux de céramides (lipides) les plus bas, soit environ 50 % des niveaux de céramides de la couche cornée des personnes à la peau plus claire.2 Par conséquent, les peaux foncées sont sujettes à une perte d'eau transépidermique (PETE) plus élevée, ce qui se traduit par une teneur en eau (TE) plus faible de la couche cornée. En outre, une peau à pigmentation foncée présente une réactivité vasculaire cutanée plus faible aux facteurs externes (par exemple, aux vasodilatateurs). Cumulativement, une PETE plus élevée, une TE plus basse et une réponse cutanée thermorégulatrice réduite augmentent la vulnérabilité des personnes à la peau foncée au développement des LP.48 Bien que les études ne soient pas concluantes, une réactivité vasculaire réduite peut également entraver la visualisation de l'érythème blanchâtre des LP de stade 1.
Gefen propose un modèle de déformation mécanique pour les SC foncées.48 La réduction de la TE dans la SC peut augmenter la rigidité de la SC, ce qui entraîne une dispersion moins efficace de la friction et un stress mécanique plus important. Ainsi, un cercle vicieux de dommages causés par le cisaillement se produit chez les personnes dont la CS est foncée, entraînant des augmentations progressives de la PETE. La TE dans une SC foncée endommagée diminue avec l'augmentation de la PETE, ce qui augmente encore les concentrations de stress mécanique. À mesure que la PETE augmente, la peau devient plus sèche et plus inflammée, ce qui accroît le risque de lésions cutanées dues à la pression, au cisaillement et à la friction.
Évaluation et mesure des teints de peau
Les variations de la pigmentation, de l'état (sec ou humide) et de la température de la peau, la présence de liquides ou de produits, l'acuité visuelle de l'observateur et l'éclairage sont quelques-uns des facteurs qui peuvent influencer la nature subjective des évaluations de la peau effectuées par les praticiens cliniques.49 L'inspection visuelle des changements cutanés liés à la pression, tels que le blanchiment, la rougeur ou l'érythème, est complétée par le toucher et la technologie (figure 4).50,51 Toutefois, pour les pratiques d'inspection visuelle, la normalisation des termes et de la technique est essentielle pour garantir la cohérence entre les différentes évaluations cliniques. Il est important de noter que l'inspection visuelle seule n'est pas fiable.22,51 Le tableau 2 fournit des informations clés sur l'évaluation visuelle des différents teints de peau afin d'aider les praticiens cliniques à identifier les changements cutanés précoces.22,52,53
Tableau 2. Évaluation visuelle de la peau pour différents teints de peau22,54

Échelles de classification des teints de peau
Auparavant, la classification des couleurs de la peau était souvent basée sur l'ethnicité et le groupe de population déclarés par les intéressés. Les catégories de couleurs basées sur les descriptions des observateurs n'ont pas été largement systématisées. L'utilisation d'échelles de classification offre une certaine régularité, mais la fonction est variée. Outre la validité et la rigueur scientifique du développement et de la conception des échelles, l'efficacité des modèles de classification dépend de la compétence individuelle et de la fiabilité inter-évaluateurs, qui varie d'un contexte à l'autre. Ces échelles proposent une couleur de peau constitutive (de base), une couleur de peau facultative (exposition au soleil ou aux UV) et un changement de couleur de peau induit par les LP.22,54
L'échelle de classification de Fitzpatrick a été mise au point pour identifier la carnation et la tolérance à la lumière du soleil et a été conçue comme une mesure de la sensibilité au soleil.22,53-57 L'échelle de Fitzpatrick n'est pas fiable pour évaluer la peau exposée aux rayons UV (facteurs environnementaux) et serait mieux utilisée pour évaluer la peau non exposée.
Le système de couleurs de Munsell (SCM), ou nuancier de Munsell, conçu par un artiste pour la peinture, décrit les qualités de teinte, de clarté (valeur) et d'intensité (chroma) et a été initialement utilisé dans la recherche de terrain.58 Dans le domaine de la santé, cette échelle a fait l'objet de tests de validité et de fiabilité minimaux bien qu’elle soit utilisée dans l'évaluation des teints de peau.53,57,59
L'échelle de Massey-Martin (SMM), également connue sous le nom d’échelle de couleur de peau d’enquête sur les nouveaux immigrants (NIS), est un instrument d'enquête sur les teints de peau conçu pour l'observation des teints de la peau.53,60 Initialement, le mode d’emploi ne prévoyait pas la comparaison du guide pictural juxtaposé à la peau de la personne, car il était destiné aux enquêtes sociales menées en présentiel (de mémoire pour l'observateur) ou par téléphone (résultats indiqués comme étant inconnus).
Le système d’échelle de couleur des teints de peau (STCS) de Konishi et al.59 a été conçu sur la base du SCM et est destiné à l'évaluation des teints de la peau et des lésions. Ce système est vaste dans la sélection des différents teints de peau, ce qui en fait la classification la plus complète à la disposition des praticiens cliniques.
Dans l'ensemble, les termes actuels pour décrire la couleur de la peau sont subjectifs, imprécis, non standardisés et peuvent avoir des connotations offensantes. Les échelles d'évaluation visuelle, telles que les échelles de Munsell61,62 et de Fitzpatrick,63 qui utilisent des visuels de teints de peau, sont limitées en ce sens qu'elles ne peuvent pas représenter de manière réaliste et utile toute la gamme des teints variés des individus, ni même des différentes parties du corps d'un même individu.
Reconnaissant ces problèmes d'évaluation de la couleur de la peau, l’Association britannique des Dermatologistes (ABD) a recommandé que la terminologie relative à la couleur de la peau soit neutre, basée sur des mesures objectives et reflétant les populations multiethniques.6,64 La mesure la plus objective est la couleur de la peau établie génétiquement par la mélanogénèse. La pigmentation se manifeste lorsque les cellules mélanocytaires produisent de la mélanine dans la peau. Dadzie et al.6 et l’ABD ont proposé l'utilisation de la nomenclature des pigments d'eumélanine pour la description de la couleur de la peau et ont développé l'échelle des couleurs de la peau humaine de l’eumélanine (ESCS) spécifiquement pour l'évaluation visuelle de la peau. L'échelle est basée sur l'eumélanine, qui représente 90 % du pigment de la peau humaine, et lui emprunte sa dénomination. L'ESCS comprend cinq catégories d'indice de mélanine mesuré par réflectance lumineuse : eumélanine faible (<25), eumélanine intermédiaire faible (25 à <50), eumélanine intermédiaire (50 à <75), eumélanine intermédiaire élevée (75 à <100) et eumélanine élevée (≥100).6 Il existe de petits instruments, légers, portables et faciles à utiliser pour mesurer l'indice de mélanine. L'ESCS peut être utilisé pour classer les résultats des LP, tels que l'incidence et la cicatrisation, et pour surveiller les disparités/inégalités.
Technologies de détection visuelle précoce et teints de peau foncés
Chez les personnes à la peau foncée, il est particulièrement difficile d'identifier visuellement les changements cutanés précoces qui peuvent annoncer une LP imminente. L'utilisation de technologies visuelles améliorées telles que la technologie d'évaluation de l'humidité sub-épidermique (HSE) et la technologie infrarouge à ondes longues (TIOL) est prometteuse pour l'identification précoce des modifications de la peau et des tissus avant qu'elles ne soient visibles à l'œil nu. Ainsi, l'utilisation de ces technologies peut créer une fenêtre d'opportunité pour des interventions ciblées avant que les manifestations visibles et tactiles des lésions tissulaires ne se produisent.65 En l'absence de ces technologies, cette fenêtre est invisible pour les praticiens cliniques en charge des soins directs. La nature subclinique du développement des LP a entraîné une latence diagnostique, qui contribue ensuite à la latence interventionnelle. Chez les personnes à la peau foncée, ce décalage augmente la probabilité que les LP ne soient pas détectées.66 Les technologies de détection précoce peuvent contribuer à résoudre ce problème.
Technologie HSE
La technologie d'évaluation de l'humidité sub-épidermique est basée sur la compréhension actuelle de l'étiologie des LP (figure 5).67,68 L'apparition de lésions microscopiques dans le développement précoce des LP et des LPTP est cohérente, quelle que soit la pigmentation de la peau. Les lésions cellulaires et tissulaires déclenchées par une pression, un cisaillement et une friction soutenus signalent des réponses inflammatoires aiguës. La réponse inflammatoire augmente avec le niveau des lésions tissulaires.67 Cette réponse immunitaire entraîne un œdème interstitiel. L'œdème localisé ou HSE est l'un des premiers indicateurs de lésions de pression non visibles. Le codage CIM-10 pour les LP de stade 1 caractérise ces dommages précoces comme des "changements cutanés pré-ulcéreux limités à un œdème focal persistant".69 Cette progression subclinique des dommages tissulaires est décrite plus en détail dans le chapitre sur l'étiologie des Directives de pratique clinique 2019 pour la prévention et le traitement des LP.51
Le scanner HSE est approuvé par la FDA en tant qu'outil de prise en charge des LP et est indiqué pour tous les adultes présentant un risque de développement de LP, quelle que soit leur couleur de peau. Ce dispositif non invasif détecte l'œdème focal persistant et fournit les résultats sous la forme d'une valeur delta (∆) de l’HSE (figure 1). La technologie d'évaluation HSE mesure les changements d’HSE entre les tissus sains et les tissus enflammés.70 Des valeurs d’HSE plus élevées peuvent indiquer un risque accru de développement de LP, spécifique à l'anatomie, pour toutes les couleurs de peau.68
Des méta-analyses issues de revues systématiques font état d'une détection précoce du développement des LP via les évaluations HSE, en moyenne 5 jours avant les évaluations visuelles (P ≤ 0,001).71,72 Dans une étude à double branche de 175 participants (n = 48/175, non-Blancs), les évaluations HSE ont fait état d'une sensibilité et d'une spécificité diagnostiques de 86.8 % et 88 % pour la détection des LP, ce qui donne une zone sous la courbe dépassant largement le jugement clinique (P < 0,0001).70 Dans une étude de cohorte, les évaluations HSE ont détecté des LP de stade 1 en développement une semaine plus tôt qu'un diagnostic visible d'érythème de stade 1 (OR, 5,3 ; CI 1,87-15,11 ; P < 0,001) chez les personnes à la peau foncée (n = 11/66).73 Dans une étude clinique multiethnique, les mesures HSE étaient statistiquement significatives pour détecter les LP comme les DTPI de stade 1 concomitants et futurs du talon chez les résidents à la peau foncée selon la valeur Munsell (n = 68/417 ; P < 0,001).74 Une étude d'observation portant sur 15 patients (n = 4/15, type III de Fitzpatrick et plus) a fait état d'indications précoces de lésions tissulaires basées sur des mesures HSE qui concordaient avec une confirmation ultérieure de DTPI présumées via l'identification échographique de lésions hypoéchogènes et des évaluations visuelles.75 Dans une étude rétrospective portant sur 69 patients en soins intensifs chirurgicaux, les infirmières et infirmiers ont indiqué que les évaluations par HSE permettaient des évaluations plus précises de la peau chez les patients à la peau foncée (n = 29/69).76
Dispositif de thermographie infrarouge à ondes longues
La thermographie infrarouge à ondes longues (TIOL) est un dispositif non invasif et multimodal destiné à être utilisé dans les environnements cliniques. Il intègre la TIOL au moyen d’une caméra pour détecter les LP avant que des changements visuels ou tactiles ne se produisent. L’appareil évalue les changements de température cutanée, car la chaleur localisée, l'œdème et les changements de consistance des tissus sont des signes d'alerte typiques du développement des LP.77 Le dispositif peut être utile chez les patients dont la peau est claire ou foncée. Il est particulièrement utile pour détecter les LPTP, qui peuvent rester indétectables sur la peau jusqu'à 72 heures (Figure 6).9,78 Cette caractéristique est particulièrement importante pour les patients à la peau foncée, car la pigmentation de la peau foncée peut masquer les couleurs profondes typiques de violet et de marron qui servent de signes visuels annonciateurs d'une LPTP.
En tant que dispositif combinant la photographie et la TIOL, il utilise deux modalités d'imagerie en mesurant le rayonnement infrarouge à ondes longues (énergie émise par le corps humain) pour créer les images numériques finales. L'énergie, ou l'absence d'énergie, est créée par le flux sanguin, la perfusion et, en fin de compte, l'activité métabolique. Le dispositif utilise un différentiel de température relative pour comparer la température de l'environnement avec la température de la peau adjacente et s'adapte aux facteurs intrinsèques et extrinsèques (par exemple, température corporelle élevée, température ambiante). Une température plus froide par rapport à la peau adjacente indique une perfusion moindre et des lésions ischémiques plus profondes ; des températures plus chaudes indiquent une augmentation de l'activité métabolique et de l'inflammation.
La fiabilité et la validité de l'utilisation de la TIOL pour détecter les LP ont été confirmées dans plusieurs études.79-84 La Directive de pratique clinique 2019 de la Prévention et traitement des lésions de pression a identifié la thermographie comme étant un domaine de recherche hautement prioritaire.85
Prévention des LP chez les personnes à la peau foncée
La prévention des lésions de pression repose à la fois sur l'évaluation des risques et sur une évaluation systématique et complète de la peau et des tissus mous.51 Les pratiques actuelles de prévention fondées sur des données probantes s'appliquent aux personnes à la peau foncée et doivent être mises en œuvre.51,86 La détection précoce des LP étant difficile chez les patients de couleur de peau foncée, l'identification de stades plus avancés de LP (au moment de la découverte) a été signalée par rapport aux personnes à la pigmentation plus claire.87 L'intégration de techniques améliorées d'évaluation de la peau et de dispositifs d'augmentation visuelle dans la pratique clinique devrait être envisagée pour améliorer la prévention des LP en vue de combler les lacunes dans l'identification des stades précoces.
Traitement et cicatrisation des LP chez les personnes à la peau foncée
Le processus de cicatrisation d'une LP comprend l'hémostase, l'inflammation, la prolifération et la maturation impliquant de nombreux mécanismes moléculaires.88,89 La cicatrisation est influencée par les facteurs cliniques du patient et les traitements reçus. Chez les patients à la peau foncée, la cicatrisation des LP et en particulier de la peau environnante peut apparaître de façon différente aux praticiens cliniques que chez les patients à la peau plus claire. Par exemple, l'hypopigmentation du tissu nouvellement réépithélialisé peut être visible sur les bords de la plaie d'une LP de pleine épaisseur en cours de cicatrisation chez les patients à la peau foncée. (Figure 7). Bien que quelques études aient fait état de différences et de disparités dans la prévalence ou l'incidence des LP en fonction du groupe de population ou de l'origine ethnique,32,90 les études axées sur la cicatrisation des LP sont beaucoup plus rares. Bliss et al.91 ont analysé un ensemble de données nationales de dossiers EDM de personnes âgées admises dans des maisons de repos. Sur les 10 862 personnes âgées (65 ans et plus) admises dans une maison de repos avec une LP, 44 % avaient cicatrisé à 90 jours. Cependant, il y avait une disparité globale significative de 6 % dans la cicatrisation des LP (stades 2 à 4) présentes à l'admission lors de l'évaluation requise à 90 jours parmi les résidents noirs. Dans une étude portant sur le délai d'apparition d'une LP au cours d'un séjour en maison de repos,90 à 99 % des résidents présentant une LP ont reçu un traitement, et aucune disparité n'a donc été constatée dans le nombre de traitements en fonction de la population ou du groupe ethnique. Cependant, dans d'autres contextes de soins, tels que les soins aigus ou les soins à domicile, il n'existe pas de données probantes concernant les disparités en matière de taux de cicatrisation des LP et de traitement chez les patients à la peau foncée.
Déterminants sociaux de santé
L'impact des DSS sur le développement et le traitement des LP est largement sous-étudié et donc inconnu. Le ministère américain de la santé et des services sociaux définit les DSS dans cinq domaines : stabilité économique, accès à l'éducation et qualité de l'éducation, accès aux soins de santé et qualité des soins de santé, voisinage et environnement bâti, et contexte social et sociétal.92 L'examen de ces domaines révèle des disparités potentielles en matière de santé et des inégalités entre les groupes de différentes origines ethniques. Dans l'ensemble, les personnes à la peau foncée ont été affectées de manière disproportionnée par les DSS et s'en sortent moins bien que les Blancs dans tous les domaines.93 Communities in Action : Pathways to Health Equity (La société en action : chemins vers une santé équitable) affirme que l'égalité en matière de santé est cruciale pour le bien-être de la société.94 Bien que des progrès importants aient été réalisés en matière de couverture des soins de santé au sein des groupes de population/ethniques dans le cadre de l'Affordable Care Act, les personnes à la peau foncée restent plus susceptibles de ne pas être assurées.94 Des disparités existent également en matière de revenus. En 2021, les revenus médians des ménages menés par des Asiatiques ou des Blancs étaient plus élevés que ceux des ménages menés par des Noirs ou des Hispaniques, alors que les revenus médians des ménages menés par des Noirs ou des Hispaniques étaient inférieurs à la médiane nationale.95
Dans deux études portant sur le développement des LP et l'impact de l’origine ethnique, les éléments de DSS (stabilité économique et accè/qualité des soins de santé) ont été opérationnalisés par le biais du revenu des patients en fonction du code postal de résidence et du statut de payeur de l'assurance maladie. En utilisant la base de données NIS en 2009, Fogerty et ses collègues38 ont identifié un risque accru de LP parmi les Afro-Américains assurés par Medicare et Medicaid par rapport aux Caucasiens. En ce qui concerne le revenu, une plus grande proportion d'Afro-Américains (50,6 %) que de Caucasiens (21,4 %) se trouvaient dans les quartiles de revenu inférieurs. Cependant, dans l'analyse multivariée, les chercheurs n'ont pas signalé de différences significatives entre les groupes ethniques de population en ce qui concerne le risque de LP en fonction du statut de payeur ou du revenu. Cox et Thomas-Hawkins39, d’après les données 2018 du HCUP au niveau de l'État du New Jersey, ont fait état d’une proportion significativement plus élevée de personnes noires présentant une LP assurées par Medicaid par rapport aux patients issus de tous les autres groupes de population combinés présentant une LP. En ce qui concerne le revenu, défini par quartiles basés sur le code postal de résidence, une proportion statistiquement plus élevée de personnes noires présentant une LP résidait dans les quartiles de code postal de revenus inférieurs et une proportion plus faible dans les quartiles de code postal de revenus supérieurs. Dans leur échantillon, plus de 50 % des patients noirs présentant une LP vivaient dans des zones où les revenus déclarés étaient inférieurs ou égaux à 58 999 dollars, contre 19 % pour tous les autres groupes ethniques combinés. Aucune analyse multivariée n'a été réalisée dans cette étude. Dans un récent examen de la portée de l'impact des DSS sur la progression des LP, Sasson et ses collègues96 ont constaté que les préjudices des DSS liés à la pénurie alimentaire (telle qu'identifiée par les codes de la CIM-10) et à la peau noire étaient tous deux des prédicteurs significatifs et indépendants d'une plus longue durée des LP.96
Deux récents rapports nationaux ont validé les inégalités de santé dont souffrent les patients à la peau foncée présentant une LP. En 2021, l'Urban Institute a établi que les patients noirs aux États-Unis avaient 31,9 % moins de chances d'être admis dans des hôpitaux considérés comme de haute qualité en ce qui concerne la prévention des LP.97 En outre, un rapport sur les disparités de l’Agence de recherche sur les soins de santé et leur qualité publié en 2019 a identifié que pour les patients des maisons de repos à court et à long terme, la qualité des soins associée aux LP était moins bonne pour les patients noirs que pour les patients blancs.98 Il est plausible que le développement ou l'aggravation d'une LP soit influencé par l'accès à des soins de santé de qualité, ce qui pourrait jouer un rôle central dans les taux plus élevés de LP chez les patients noirs. Sans accès à des modalités de prévention ou de traitement fondées sur des données probantes, la capacité à prévenir une LP ou à faciliter la cicatrisation de la plaie est compromise. À l'heure actuelle, l'ampleur de cette disparité n'a pas été étudiée et n'est pas connue. Il s'agit d'un domaine qui doit être exploré plus avant.
Formation clinique et évaluation de la peau pour les teints foncés
Une évaluation imprécise de la peau et une méconnaissance de l'apparence des LP pour les teints foncés de la peau peuvent retarder l'identification et le traitement précoces, ce qui entraîne des LP plus sévères et des pénalités financières pour l'organisme de santé.99 Les inégalités en matière de santé et les disparités ethniques se produisent lorsque les professionnels de santé, en raison de préjugés explicites ou implicites, n'évaluent pas, n'identifient pas et ne préviennent pas correctement les LP chez les personnes à la peau foncée qui sont à risque de LP.100,101 Une évaluation erronée de la peau peut également se produire en raison de la difficulté à visualiser les changements de couleur de la peau et les décolorations chez les personnes ayant un teint de peau foncée. La formation dispensée aux infirmières et infirmiers ainsi qu’aux autres praticiens cliniques concernant l'évaluation des personnes ayant une couleur de peau différente fait cruellement défaut.
En tant qu'infirmières et infirmiers, notre réputation auprès du public est celle de l'honnêteté, de la confiance et de la bienveillance. Les infirmières et infirmiers ont été classés parmi les professions les plus honnêtes et les plus éthiques pendant plus de 20 années consécutives.102 Pourtant, les étudiants en soins infirmiers sortent souvent de nos programmes de formation mal préparés à comprendre les conséquences des DSS et l'importance de fournir des soins sûrs et équitables aux diverses populations que nous servons. Malgré les objectifs largement répandus visant à inclure la diversité, l'égalité et l'inclusion ainsi que les DSS dans les programmes d'enseignement des sciences infirmières, il n'est pas certain que ces objectifs aient été atteints.99 Des données récentes démontrent qu'il existe une disparité en matière de santé dans la formation des infirmières et infirmiers de premier cycle, la formation étant axée sur les personnes au teint pâle.99 Oozageer et ses collègues99 ont mené une étude documentaire et d'observation sur la formation des infirmières et infirmiers et sur les cours sur les LP dans cinq programmes de formation des infirmières et infirmiers de premier cycle en Angleterre. Les enquêteurs ont constaté que l'accent était mis sur les LP chez les personnes au teint de peau caucasien et que seules des informations brèves et superficielles étaient données sur les personnes à la peau foncée.99 Dans une étude qualitative menée dans ces cinq programmes de formation en soins infirmiers à l'aide de groupes de discussion, les enquêteurs ont constaté que le thème prédominant était celui de la normativité blanche. Plus précisément, les enquêteurs ont identifié une dominance de la couleur blanche dans l'enseignement sur les LP et les implications pour les étudiants infirmiers comme quoi la couleur blanche était la norme.99
En 2023, Pittman et Black103 ont examiné l'égalité en matière de santé dans les manuels de formation en soins infirmiers, et plus particulièrement le contenu des manuels d'évaluation physique relatif à la peau et aux téguments en fonction des teints de peau. À partir d'un échantillonnage de commodité de manuels d'évaluation physique destinés aux programmes de soins infirmiers de premier et deuxième cycles, les chercheurs ont modifié l'outil d'enseignement par observation de la diversité (OEOD) d'Oozageer, avec son autorisation, pour mieux l'adapter aux objectifs de leur projet. Le contenu des manuels (c'est-à-dire le chapitre sur le tégument et la peau) a été examiné indépendamment, puis les données ont été examinées pour vérifier la cohérence ou les différences. Chaque chercheur a également exploré le laboratoire de simulation de son université à la recherche de preuves de la diversité des teints de peau des mannequins. Sur les neuf manuels et les onze chapitres, aucun sujet de chapitre n'incluait la diversité des couleurs de peau. Six des neuf manuels présentaient des descripteurs visuels de LP, y compris des stades. Cependant, sur les six manuels comportant des photos, seuls trois présentaient des potos avec des teints de peau foncés. Les manuels contenaient 534 photos de différents graphismes ou images de peau, mais seules 35 d'entre elles (7 %) représentaient des tons de peau foncés. À l'inverse, 499 (93 %) des 534 images présentaient des teintes de peau claires. Les deux universités disposaient de laboratoires de simulation dont 60 à 65 % des mannequins avaient des teintes de peau claires et 35 à 40 % des teintes de peau foncées. Toutefois, on ne sait pas si la couleur de la peau est abordée dans les scénarios de simulation. Ces résultats confirment ceux d'Oozageer et de ses collègues et démontrent le manque de formation des étudiants en soins infirmiers en ce qui concerne la diversité des couleurs de peau.
Conclusions
Il existe des disparités ethniques en ce qui concerne le développement et la cicatrisation des LP, particulièrement marquées chez les patients à la peau foncée. Cet article explore l'état actuel de la science et identifie les lacunes dans les termes utilisés pour décrire la couleur de la peau, ce qui rend impossible toute comparaison basée sur des données et toute détermination de tendance. Compte tenu de la diversité de population croissante aux États-Unis, y compris des personnes d'origine ethnique mixte, l’appartenance d'un patient à un groupe de population ne devrait plus être utilisée comme un terme démographique ou un facteur de risque pour les LP. Le teint de la peau doit être davantage normalisée et quantifiable dans l'enseignement clinique, la pratique et la recherche. Face à un pays qui sera plus diversifié sur le plan ethnique dans les décennies à venir, la capacité d'identifier et de traiter plus tôt les LP en développement améliorera la qualité de vie de tous les patients. Ce travail est urgent et le soutien des organismes privés et gouvernementaux est essentiel.
Conflit d'intérêt
Les auteurs ne déclarent aucun conflit d'intérêt.
Financement
Les auteurs n'ont reçu aucun financement pour cette étude.
Author(s)
Joyce Black
PhD RN FAAN
Jill Cox
PhD RN APN-C CWOCN FAAN
Virginia Capasso
PhD CNP CNS CWS FACCWS FAAN
Donna Z Bliss
PhD RN FGSA FAAN
Barbara Delmore
PhD RN CWCN MAPWCA FAAN
Vignesh Iyer
MS
Jacqueline Massaro
MSN RN CWOCN
Cassendra Munro
PhD RN CNOR
Joyce Pittman
PhD RN ANP-BC FNP-BC CWOCN FAAN
Elizabeth A Ayello
PhD MS ETN RN CWON MAPWCA FAAN
* Corresponding author
Joyce Black is President, National Pressure Injury Advisory Panel, and Florence Niedfelt Professor of Nursing, College of Nursing, University of Nebraska.
Jill Cox is Member, Board of Directors, National Pressure Injury Advisory Panel; Clinical Professor, Rutgers University School of Nursing, Rutgers, New Jersey; and Wound/Ostomy/Continence Advanced Practice Nurse, Englewood Health, Englewood, New Jersey.
Virginia Capasso is Member, Board of Directors, National Pressure Injury Advisory Panel; Instructor in Surgery, Harvard Medical School, Cambridge Massachusetts; and Advanced Practice Nurse and Nurse Scientist, Massachusetts General Hospital, Boston.
Donna Z. Bliss, is School of Nursing Foundation Professor of Nursing Research, and Chair, Adult and Gerontological Health Cooperative, University of Minnesota School of Nursing, Minneapolis.
Barbara Delmore is Alumna, Board of Directors, National Pressure Injury Advisory Panel, and Senior Nurse Scientist and Clinical Assistant Professor, NYU Langone Health, New York.
Vignesh Iyer is Director, Medical Affairs, Bruin Biometrics, Los Angeles, California.
Jacqueline Massaro, MSN, RN, CWOCN, is Wound/Ostomy/Continence Nurse, Brigham and Women’s Hospital, Boston, Massachusetts.
Cassendra Munro, is Nurse Scientist, Office of Research Patient Care Services, Stanford Health Care, Palo Alto, California.
Joyce Pittman is Alumna, Board of Directors, National Pressure Injury Advisory Panel, and Associate Professor, College of Nursing, University of South Alabama, Mobile.
Elizabeth A Ayello is Alumna, Board of Directors, and Past President, National Pressure Injury Advisory Panel, and President, Ayello, Harris & Associates, Inc, New York.
Joyce Black est présidente du Groupe consultatif national sur les lésions de pression et Florence Niedfelt professeure de sciences infirmières, faculté de sciences infirmières, université du Nebraska.
Jill Cox est membre du conseil d'administration du Groupe consultatif national sur les lésions de pression, professeure de clinique à la l’école infirmière de l’université Rutgers, Rutgers, New Jersey, et infirmière spécialisée en plaies, stomies et incontinence, Englewood Health, Englewood, New Jersey.
Virginia Capasso est membre du conseil d'administration du Groupe consultatif national sur les lésions de pression, instructrice en chirurgie à la Harvard Medical School, à Cambridge (Massachusetts), infirmière en pratique avancée et infirmière scientifique à l’hôpital général du Massachusetts, Boston.
Donna Z. Bliss est professeure de recherche en sciences infirmiers à la Fondation de l'école des sciences infirmières et présidente de la coopérative sur la santé des adultes et la gérontologie à l'école des sciences infirmières de l'université du Minnesota, Minneapolis.
Barbara Delmore est ancienne élève, membre du conseil d'administration du Groupe consultatif national sur les lésions de pression, infirmière scientifique principale et professeure assistante de clinique, NYU Langone Health, New York.
Vignesh Iyer est directeur des affaires médicales chez Bruin Biometrics, Los Angeles, Californie.
Jacqueline Massaro, MSN, RN, CWOCN, est infirmière spécialisée dans les plaies, les stomies et la continence, Brigham and Women's Hospital, Boston, Massachusetts.
Cassendra Munro, est infirmière scientifique, Office of Research Patient Care Services, Stanford Health Care, Palo Alto, Californie.
Joyce Pittman est ancienne élève, membre du conseil d'administration du Groupe consultatif national sur les lésions de pression et professeure associée à la faculté des sciences infirmières de l'éniversité du Sud Alabama, Mobile.
Elizabeth A. Ayello est ancienne élève, membre du conseil d'administration et ancienne présidente du Groupe consultatif national sur les lésions de pression, et présidente de Ayello, Harris & Associates, Inc, New York.
References
- United States Census Bureau. 2020 Census Statistics Highlight Local Population Changes and Nation’s Racial and Ethnic Diversity. https://www.census.gov/newsroom/press-releases/2021/population-changes-nations-diversity.html. Last accessed June 26, 2023.
- Rawlings AV. Ethnic skin types: are there differences in skin structure and function? Int J Cosmet Sci 2006;28(2):79-93.
- Ayello EA, Lyder CH. Pressure ulcers in person of colors: race and ethnicity. In Pressure Ulcers in America: Prevalence, Incidence, and Implications for the Future. Eds, Cuddigan J et al. Reston, VA: National Pressure Ulcer Advisory Panel; 2001.
- Bennett MA. Report of the task force on the implications for darkly pigmented intact skin in the predication and prevention of pressure ulcers. Adv Wound Care 1995;8(6)34-5.
- Black J, Baharestani MM, Cuddigan J et al. National Pressure Ulcer Advisory Panel’s updated pressure ulcer staging system. Adv Skin Wound Care 2007;20(5):269-74.
- Dadzie OE, Sturm RA, Fajuyigbe D, Petit A, Jablonski NG. The Eumelanin Human Skin Colour Scale: a proof of concept study. Br J Dermatol 2022;187:99-104.
- Dhoonmoon L, Fletcher J. Assessing skin tones in practice: results of an international survey. Wounds Int 2022;13(2):6-9.
- Dhoonmoon L, Nair HKR, Abbas Z, et al. International Consensus Document: Wound Care and Skin Tone Signs, Symptoms and Terminology for all Skin Tones. Wounds International. 2023. Available at www.woundsinternational.com.
- Edsberg LE, Black J, Goldberg M, et al. Revised National Pressure Ulcer Advisory Panel Pressure Injury Staging System. J Wound Ostomy Continence Nurs 2016;43(6):585-97.
- Eilers S, Bach DQ, Gaber R, et al. Accuracy of self-report in assessing Fitzpatrick skin phototypes I through VI. JAMA Dermatol 2013;149(11):1289-94.
- Fletcher J. The challenges of dark skin tone assessment: the importance of language. Wounds UK 2022;18(2):6,8.
- Gass M, Dadzie OE, Dlova N, Petit A, Goad N. Skin diversity erythema description guidance. British Association of Dermatology. February 2021. https://cdn.bad.org.uk/uploads/2022/02/29200007/Skin-diversity-descriptors-erythema-redness-guidance.pdf. Last accessed July 3, 2023.
- Gunowa NO. Skin tone bias and wound care: highlighting the current evidence and addressing the gaps in knowledge of dark skin tones. Wounds UK 2022;18(1):22-7.
- Lester JC, Jia JL, Zhang L, Okoye GA, Linos E. Absence of images of skin of colour in publication of COVID-19 skin manifestations. Br J Dermatol 2020;183:564-95.
- Matas A, Sowa MG, Taylor V, Taylor G, Schattka BJ, Mantsch HG. Eliminating the issue of skin color in assessment of the blanch response. Adv Skin Wound Care 2001;14(4):180-8.
- Mukwende M, Tamony P, Turner M. Mind the Gap: A Clinical Handbook of Signs in Black and Brown Skin. St. George’s University of London; 2020. https://www.blackandbrownskin.co.uk/mindthegap. Last accessed June 26, 2023.
- National Pressure Ulcer Advisory Panel. Pressure ulcers prevalence, cost and risk assessment: consensus development consensus statement. Decubitus 1989;2(2):24-8.
- National Pressure Ulcer Advisory Panel. Cuddigan J, Ayello EA, Sussman C. (Eds). Pressure Ulcers in America: Prevalence, Incidence, and Implications for the Future. Reston, VA: NPUAP; 2001.
- National Pressure Ulcer Advisory Panel (NPUAP), European Pressure Ulcer Advisory Panel (EPUAP), Pan Pacific Pressure Injury Alliance (PPPIA). Prevention and Treatment of Pressure Ulcers: Clinical Practice Guideline. Emily Haesler (Ed). Osborne Park, WA: Cambridge Media; 2014.
- Henderson CT, Ayello EA, Sussman C et al. Draft definition of stage I pressure ulcers: inclusion of persons with darkly pigmented skin. NPUAP Task Force on Stage I Definition and Darkly Pigmented Skin. Adv Wound Care 1997;10(5):16-9.
- National Pressure Ulcer Advisory Panel. NPUAP Pressure Injury Stages. 2016. Available from www.npiap.org
- Pusey Reid E, Quinn L, Samost ME, Reidy PA. Skin assessment in patients with dark skin tone. Am J Nurs 2023;123(3):36-43.
- Salcido S. Finding a window into the skin: it depends on the color of your skin. Adv Skin Wound Care 2008;22(1):8.
- Skin of Color Society. https://skinofcolorsociety.org/about-socs/. Last accessed June 26, 2023.
- Ankrom M, Bennett R, Sprigle S, et al. Pressure-related deep tissue injury under intact skin and the current pressure ulcer staging systems. Adv Skin Wound Care 2005;18 (1):35-42.
- Gunowa NO, Hutchinson M, Brooke J, Jackson D. Pressure injuries in people with darker skin tones: a literature review. J Clin Nurs 2017:27(17-18); 3266-75.
- Bliss DZ, Harms S, Garrard JM, et al. Prevalence of incontinence by race and ethnicity of older people admitted to nursing homes. J Am Med Directors Assoc 2013;14(6):451.e1-451.e7.
- Harms S, Bliss DZ, Garrad JM, et al. Prevalence of pressure ulcers by race and ethnicity for older people admitted to nursing homes. J Gerontol Nurs 2014;40(3);20-6.
- Baumgarten M, Margolis D, van Doorn C, et al. Black/White differences in pressure ulcer incidence in nursing home residents. J Am Geriatr Soc 2004;52(8):1293-8.
- Ahn H, Cowan L, Garvan C, Lyon D, Stechmiller J. Risk factors for pressure ulcers including suspected deep tissue injury in nursing home facility residents: analysis of National Minimum Data Set 3.0. Adv Skin Wound Care 2016;29(4):178-90.
- Cai S, Mukamel DB, Temkin-Greener H. Pressure ulcer prevalence among black and white nursing home residents in New York state: evidence of racial disparity? Medical Care 2010;48(3):233-9.
- Li Y, Yin J, Cai X, Temkin-Greener J, Mukamel DB. Association of race and sites of care with pressure ulcers in high-risk nursing home residents. JAMA 2011;306(2):179-86.
- Chen Z, Gleason LJ, Sanghavi P. Accuracy of pressure ulcer events in US nursing home ratings. Medical Care 2022;60(10):775-83.
- Bliss DZ, Gurvich O, Savik K, et al. Are there racial-ethnic disparities in time to pressure ulcer development and pressure ulcer treatment in older adults after nursing home admission? J Aging Health 2015;27(4):571-93.
- Rosen J, Mittal V, Degenholtz H, et al. Pressure ulcer prevention in Black and White nursing home residents: a QI initiative of enhanced ability, incentives, and management feedback. Adv Skin Wound Care 2006;19(5):262-9.
- Vangilder C, Macfarlane GD, Meyer S. Results of nine international pressure ulcer prevalence surveys: 1989 to 2005. Ostomy Wound Manage 2008;54(2):40-54.
- Bauer K, Rock K, Nazzal M, Jones O, Qu W. Pressure ulcers in the United States’ inpatient population from 2008 to 2012: results of a retrospective nationwide study. Ostomy Wound Manage 2016;62(11):30-8.
- Fogerty M, Guy J, Barbul A, Nanney LB, Abumrad NN. African Americans show increased risk for pressure ulcers: a retrospective analysis of acute care hospitals in America. Wound Repair Regen 2009;17(5):678–84.
- Cox J, Thomas Hawkins C. Racial disparities and pressure injuries among hospitalized patients. Adv Skin Wound Care 2023;36(2):78–84.
- Anatomy and Physiology of Skin, Soft Tissue, and Beyond. In Course Content, Wound Certification Prep Course. Malvern PA: HMP Communications, June 2022.
- Mufti A, Ayello EA, Sibbald RG: Anatomy and physiology of the skin. In: Doughty D, McNichol L (eds): Wound, Ostomy and Continence Nurses Society Core Curriculum, Wound Management. Philadelphia, PA: Wolters Kluwer; 2016.
- Lawton S. Skin 1: the structure and functions of the skin. Nurs Times 2019;115(12):30-3.
- Baranowski S, Ayello EA, Levine JM, Sibbald RG. Skin: an essential organ. In: Baranowski S, Ayello EA, eds. Wound Care Essentials 5th Edition. Philadelphia, PA: Wolters Kluwer; 2020:57-59, 66-67.
- Anatomy and Physiology 5.1 Layers of Skin. OpenStax Anatomy & Physiology. https://openstax.org/Anatomy-and-Physiology-2e/pages/5-1/layers-of- skin. Last accessed June 30, 2023.
- Rawlings AV. Ethnic skin types: are there differences in skin structure and function? Int J Cosmet Sci 2006;28(2):79-93.
- Fitzpatrick TB. The validity and practicality of sun-reactive skin types I through VI. Arch Dermatol 1988;124(6):869-71.
- Wesley NO, Maibach HI. Racial (ethnic) differences in skin properties: the objective data. Am J Clin Dermatol 2003;4(12)843-60.
- Gefen A. Application of the mechanical strain model to darkly pigmented skin. NPIAP 2023 Annual Conference; San Diego CA, March 18, 2023.
- Sullivan R. A 5-year retrospective study of descriptors associated with identification of stage I and suspected deep tissue pressure ulcers in persons with darkly pigmented skin. Wounds 2014;26(12):351–9.
- Clark M. Skin assessment in dark pigmented skin: a challenge in pressure ulcer prevention. Nurs Times 2010;106(30):16–7.
- National Pressure Injury Advisory Panel, European Pressure Ulcer Advisory Panel, & Pan Pacific Pressure Ulcer Injury Alliance. Prevention and treatment of pressure ulcers/injury: clinical practice guideline. The International Guideline; 2019.
- Black, J. & Simende, A. Top ten tips: assessing darkly pigmented skin. Wounds Int 2020;11(3):8-11.
- Francis, K. Assessment and identification of skin disorders in skin of color. J Wound Ostomy Continence Nurs 2023;50(2):107-14.
- Forman R, Zappas M, Lavell J. Dermatology in skin of color. Nurse Pract 2022;47(2):10-14.
- Khosla NN, Grullon K, Rosenblatt AE. Prevention of racialized medicine in pediatric dermatology: A call to re-examine skin tone typing. Pediatr Dermatol 2021;38(Suppl. 2):167–9.
- Del Bino S, Duval C, Bernard F. Clinical and biological character-ization of skin pigmentation diversity and its consequences on UV impact. Int J Mol Sci 2018;19(2668):1-44.
- Martin MK, Zaman T, Okello AM, Dennis LK. Validity of a self-assessment skin tone palette compared to a colorimeter for characterizing skin color for skin cancer research. Curr Oncol 2023;30:3189–200.
- Keuhni R. The early development of Munsell system. Color Res Appl 2002;27(1):20-7.
- Konishi N, Kawada A, Morimoto Y, et al. New approach to the evaluation of skin color of pigmentary lesions using Skin Tone Color Scale. J Dermatol 2007;34:441-6.
- Hannon L, DeFina R. Reliability concerns in measuring respondent skin tone by interviewer observation. Public Opin Quarterly 2016;80(2):534-41.
- McCreath HE, Bates-Jensen BM, Nakagami G, et al. Use of Munsell color charts to measure skin tone objectively in nursing home residents at risk for pressure ulcer development. J Adv Nurs 2016;72(9):2077-85.
- Munsell Color. (https://munsell.com/).
- Fitzpatrick TB. The validity and practicality of sun-reactive skin types I through VI. Arch Dermatol 1988;124(6):869-71.
- Gass KM, Dadzie OE, Dlova N, Petit A, Goad N. Skin diversity erythema description guidance. https://cdn.bad.org.uk/uploads/2022/02/29200007/Skin-diversity-descriptors-erythema-redness-guidance.pdf. Last accessed July 10, 2023.
- Moore Z, Patton D, Rhodes SL, O’Connor T. Subepidermal moisture (SEM) and bioimpedance: a literature review of a novel method for early detection of pressure-induced tissue damage (pressure ulcers). Int Wound J. Apr 2017;14(2):331-337.
- Baumgarten M, Margolis D, van Doorn C, et al. Black/White differences in pressure ulcer incidence in nursing home residents. J Am Geriatr Soc 2004;52(8):1293-8.
- Gefen A, Brienza DM, Cuddigan J, Haesler E, Kottner J. Our contemporary understanding of the aetiology of pressure ulcers/pressure injuries. Int Wound J 2022;19(3):692-704.
- Bryant RA, Moore ZE, Iyer V. Clinical profile of the SEM Scanner - modernizing pressure injury care pathways using sub-epidermal moisture (SEM) scanning. Expert Rev Med Devices 2021;18(9):833-47.
- World Health Organization. L89 Pressure Ulcers. In International Statistical Classification of Diseases and Related Health Problems; Tenth Revision. 2nd ed. Geneva: World Health Organization; 2020.
- Gershon S, Okonkwo H. Evaluating the sensitivity, specificity and clinical utility of algorithms of spatial variation in sub-epidermal moisture (SEM) for the diagnosis of deep and early-stage pressure-induced tissue damage. J Wound Care 2021;30(1):41-53.
- Chaboyer W, Coyer F, Harbeck E, et al. Oedema as a predictor of the incidence of new pressure injuries in adults in any care setting: a systematic review and meta-analysis. Int J Nurs Stud 2022;128:104189.
- Moore Z, McEvoy NL, Avsar P, et al. Measuring subepidermal moisture to detect early pressure ulcer development: a systematic review. J Wound Care 2022;31(8):634-47.
- Bates-Jensen BM, McCreath HE, Pongquan V. Subepidermal moisture is associated with early pressure ulcer damage in nursing home residents with dark skin tones: pilot findings. J Wound Ostomy Continence Nurs 2009;36(3):277-284.
- Bates-Jensen BM, McCreath HE, Nakagami G, Patlan A. Subepidermal moisture detection of heel pressure injury: The pressure ulcer detection study outcomes. Int Wound J 2018;15(2):297-309.
- Gefen A, Gershon S. An observational, prospective cohort pilot study to compare the use of subepidermal moisture measurements versus ultrasound and visual skin assessments for early detection of pressure injury. Ostomy Wound Manage 2018;64(9):12-27.
- Pittman J, Mulekar M. Enhanced skin assessment methodology to equitably detect early tissue damage and pressure injuries in adult patients in the acute care setting. Paper presented at NPIAP Annual Conference. 2023; San Diego, CA.
- European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel, Pan Pacific Pressure Injury Alliance. Skin and Tissue Assessment. In: Haesler E, ed. Prevention and Treatment of Pressure Ulcers/Pressure Injuries: Clinical Practice Guideline: The International Guideline 2019. European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel and Pan Pacific Pressure Injury Alliance; 2019:73-83.
- Simman R, Angel C. Early identification of deep-tissue pressure injury using long-wave infrared thermography: a blinded prospective cohort study. Adv Skin Wound Care 2022;35(2):95-101.
- Langemo D, Spahn J, Snodgrass L. Accuracy and reproducibility of the Wound Shape Measuring and Monitoring System. Adv Skin Wound Care 2015;28(7):317-23.
- Langemo D, Spahn JG. A multimodality imaging and software system for combining an anatomical and physiological assessment of skin and underlying tissue conditions. Adv Skin Wound Care 2016;29(4):155-63.
- Langemo DK, Spahn JG. A reliability study using a long-wave infrared thermography device to identify relative tissue temperature variations of the body surface and underlying tissue. Adv Skin Wound Care 2017;30(3):109-19.
- Langemo D, Spahn J, Spahn T, Chowdry Pinnamaneni V. Comparison of standardized clinical evaluation of wounds using ruler length by width and scout length by width measure and scout perimeter trace. Adv Skin Wound Care 2015;28(3):116-21.
- Cox J, Kaes L, Martinez M, Moles D. A prospective, observational study to assess the use of thermography to predict progression of discolored intact skin to necrosis among patients in skilled nursing facilities. Ostomy Wound Manage 2016;62(10):14-33.
- Koerner S, Adams D, Harper SL, Black JM, Langemo DK. Use of thermal imaging to identify deep-tissue pressure injury on admission reduces clinical and financial burdens of hospital-acquired pressure injuries. Adv Skin Wound Care 2019;32(7):312-20.
- European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel, Pan Pacific Pressure Injury Alliance. Future Research. In: Haesler E, ed. Prevention and Treatment of Pressure Ulcers/Pressure Injuries: Clinical Practice Guideline. The International Guideline. European Pressure Ulcer Advisory Panel, National Pressure Injury Advisory Panel, Pan Pacific Pressure Injury Alliance; 2019:373-7.
- Padula WV, Black JM. The Standardized Pressure Injury Prevention Protocol for improving nursing compliance with best practice guidelines. J Clin Nurs 2019;28(3-4):367-71.
- Clark M. Skin assessment in dark pigmented skin: a challenge in pressure ulcer prevention. Nurs Times 2010;106(30):16-7.
- Eming SA, Martin P, Tomic-Canic M. Wound repair and regeneration: mechanisms, signaling, and translation. Sci Transl Med 2014;6(265):265sr6.
- Ozgok Kangal MK, Regan JP. Wound Healing. StatPearls [Internet]. Treasure Island, FL: StatPearls Publishing; 2022.
- Bliss DZ, Gurvich O, Savik K, et al. Are there racial-ethnic disparities in time to pressure ulcer development and pressure ulcer treatment in older adults after nursing home admission? J Aging Health 2015;27(4):571-93.
- Bliss DZ, Gurvich O, Savik K, et al. Racial and ethnic disparities in the healing of pressure ulcers present at nursing home admission. Arch Gerontol Geriatr 2017;72:187-94.
- U.S Department of Health and Human Services, Healthy People 2030. Social Determinants of Health. https://health.gov/healthypeople/priority-areas/social-determinants-health. Last accessed June 30, 2023.
- Kaiser Family Foundation. Key Facts on Health and Health Care by Race and Ethnicity. 2023. https://www.kff.org/report-section/key-facts-on-health-and-health-care-by-race-and-ethnicity-social-determinants-of-health/. Last accessed June 30, 2023.
- National Academies of Sciences, Engineering, and Medicine, Health and Medicine Division, Board on Population Health and Public Health Practice, Committee on Community-Based Solutions to Promote Health Equity in the United States, Baciu A, Negussie Y, Geller A, & Weinstein JN (Eds.). Communities in Action: Pathways to Health Equity. National Academies Press (US); 2017.
- Peter G Peterson Foundation. Wealth is an important component of Americans economic status. 2022. https://www.pgpf.org/blog/2022/11/income-and-wealth-in-the-united-states-an-overview-of-recent-data. Last accessed June 30, 2023.
- Sasson DC, Duan K, Patel SM, Junn A, Hsia HC. The impact of social determinants of health on pressure injury progression: a retrospective chart and scoping review. Adv Skin Wound Care 2023;36(2):106–11.
- Gangopadhyaya, A. Black Patients Are More Likely than White Patients to Be in Hospitals with Worse Patient Safety Outcomes. Robert Wood Johnson Foundation; 2021. https://www.urban.org/sites/default/files/publication/103925/black-patients-are-more-likely-than-white-patients-to-be-in-hospitals-with-worse-patient-safety-conditions_0.pdf. Last accessed June 30, 2023.
- Agency for Healthcare Quality and Research. National Healthcare Quality and Disparity Report, 2019. https://www.ahrq.gov/sites/default/files/wysiwyg/research/findings/nhqrdr/2019qdr-core-measures-disparities.pdf. Last accessed June 30, 2023.
- Oozageer Gunowa N, Brooke J, Hutchinson M, Jackson D. Embedding skin tone diversity into undergraduate nurse education: through the lens of pressure injury. J Clin Nurs 2020;29(21-22):4358-67.
- Matthew D. Just Medicine: A Cure for Racial Inequality in American Healthcare. NYU Press; 2015.
- Institute of Medicine. Unequal Treatment: Confronting Racial and Ethnic Disparities in Health Care. Committee On Understanding and Eliminating Racial and Ethnic Disparities in Health Care. Smedley B, Stith A, and Nelson A. (Eds). National Academies Press (US); 2003.
- Brenan, M. 2023. Nurses Retain Top Ethics Rating in U.S, But Below 2020 High. Gallop News; Jan 10, 2023. https://news.gallup.com/poll/467804/nurses-retain-top-ethics-rating-below-2020-high.aspx. Last accessed June 30, 2023.
- Pitman J, Black J. 2023 Gaps in professional education on skin assessment. National Pressure Injury Advisory Panel annual conference presentation: promoting equity in prevention and treatment of pressure injury. San Diego, March 2023.
