Volume 44 Number 1
Wound bed preparation 2024: Delphi consensus on foot ulcer management in resource-limited settings
Hiske Smart, R Gary Sibbald, Laurie Goodman, Elizabeth A Ayello, Reneeka Jaimangal, John H Gregory, Sadanori Akita, Afsaneh Alavi, David G Armstrong, Helen Arputhanathan, Febe Bruwer, Jeremy Caul, Beverley Chan, Frans Cronje, Belen Dofitas, Jassin Hamed, Catherine Harley, Jolene Heil, Mary Hill, Devon Jahnke, Dale Kalina, Chaitanya Kodange, Bharat Kotru, Laura Lee Kozody, Stephan Landis, Kimberly LeBlanc, Mary MacDonald, Tobi Mark, Carlos Martin, Dieter Mayer, Christine Murphy, Harikrishna Nair, Cesar Orellana, Brian Ostrow, Douglas Queen, Patrick Rainville, Erin Rajhathy, Gregory Schultz, Ranjani Somayaji, Michael C Stacey, Gulnaz Tariq, Gregory Weir, Catharine Whiteside, Helen Yifter, Ramesh Zacharias
Keywords Diabetes, wound bed preparation, low-resource settings, foot ulcer, rural, delphi consensus, low- and middle-income countries, innovation
For referencing Smart H et al. Wound bed preparation 2024: Delphi consensus on foot ulcer management in resource-limited settings. WCET® Journal 2024;44(1):13-35.
DOI 10.33235/wcet.44.1.13-35
Abstract
Background Chronic wound management in low-resource settings deserves special attention. Rural or underresourced settings (ie, those with limited basic needs/healthcare supplies and inconsistent availability of interprofessional team members) may not be able to apply or duplicate best practices from urban or abundantly resourced settings.
Objective The authors linked world expertise to develop a practical and scientifically sound application of the wound bed preparation model for communities without ideal resources.
Methods A group of 41 wound experts from 15 countries reached a consensus on wound bed preparation in resource-limited settings.
Results Each statement of 10 key concepts (32 substatements) reached more than 88% consensus.
Conclusions The consensus statements and rationales can guide clinical practice and research for practitioners in low-resource settings. These concepts should prompt ongoing innovation to improve patient outcomes and healthcare system efficiency for all persons with foot ulcers, especially persons with diabetes.
General purpose
To review a practical and scientifically sound application of the wound bed preparation model for communities without ideal resources.
Target audience
This continuing education activity is intended for physicians, physician assistants, nurse practitioners, and nurses with an interest in skin and wound care.
Learning objectives/putcomes
After participating in this educational activity, the participant will:
- Summarise issues related to wound assessment.
- Identify a class of drugs for the treatment of type II diabetes mellitus that has been shown to improve glycemia, nephroprotection, and cardiovascular outcomes.
- Synthesise strategies for wound management, including treatment in resource-limited settings.
- Specify the target time for edge advancement in chronic, healable wounds.
Introduction
A framework for wound bed preparation (WBP) was introduced in 2000 to emphasise treating the whole person as a foundation of optimal local wound care.1 As this has evolved into an international framework, it became clear that not all wounds are healable. These concepts of maintenance and nonhealable wounds led to revisions of local wound care principles and WBP expansion. The importance of integrated coordinated care with nurses, doctors, and allied healthcare professionals working together to optimise patient care outcomes and healthcare system utilisation was paramount in further WBP developments.
This article focuses on applying the WBP framework to manage foot-related wounds, particularly in persons with diabetes (PWDs), leprosy-related neuropathic foot ulcers, and other complications that include neuropathy and vascular disease. Several parameters are critical to PWDs, including poor glycemic control, BP changes, high cholesterol, inadequate plantar pressure redistribution, infections, and lack of exercise. The effects of smoking are also particularly detrimental to saving limbs and lives of PWDs.
Critical for this article is a set definition for resource-restricted settings, including low resource availability; lacking or restricted funding; remote, isolated, or rural settings; and Indigenous populations. These terms all relate to healthcare settings that may have challenges accessing supplies, equipment, specialists, and advanced wound care competencies and skills. Low-resource settings can be present anywhere in the world and are not limited to lower-income or developing countries.
The Delphi process underpinning this work expanded and developed the WBP framework in its current format. Forty-one authors drawn from 15 countries took part in the Delphi process, which occurred over two rounds using a four-part Likert-type scale (1, strongly agree; 2, agree; 3, disagree; 4, strongly disagree). The first round consisted of 29 statements. Although all statements exceeded the desired 80% consensus level, there were 299 comments considered by the lead group of authors. A professional editor was employed to improve the comprehension and grammatical accuracy of the statements before a Delphi round 2 was deployed with 32 constructed statements. All statements exceeded 88% consensus level.
In round 2, 14 statements achieved 100% consensus. One statement stood out and was rated as “strongly agree” by all Delphi panel members: 10C. Establish timely and effective communication that includes the patient and all interprofessional wound care team members for improved healthcare system wound outcomes. In parallel, each of the international wound experts worked in groups to develop the manuscript content. Refer to Supplemental Table 1 (http://links.lww.com/NSW/A176) for the consensus statements.
The consensus aimed to set a scientifically based minimal standard of care that could be optimised for available resources. Refer to Table 1 for the 10 key steps and 32 substatements for wounds in limited-resource environments. This consensus process updated the framework for WBP to be applicable regardless of resource availability. In addition, it also includes the concepts of healing trajectories and healthcare system change for the first time (Figure 1).
The remainder of this report will highlight the 10 consensus statements and discuss the rationale for each statement.
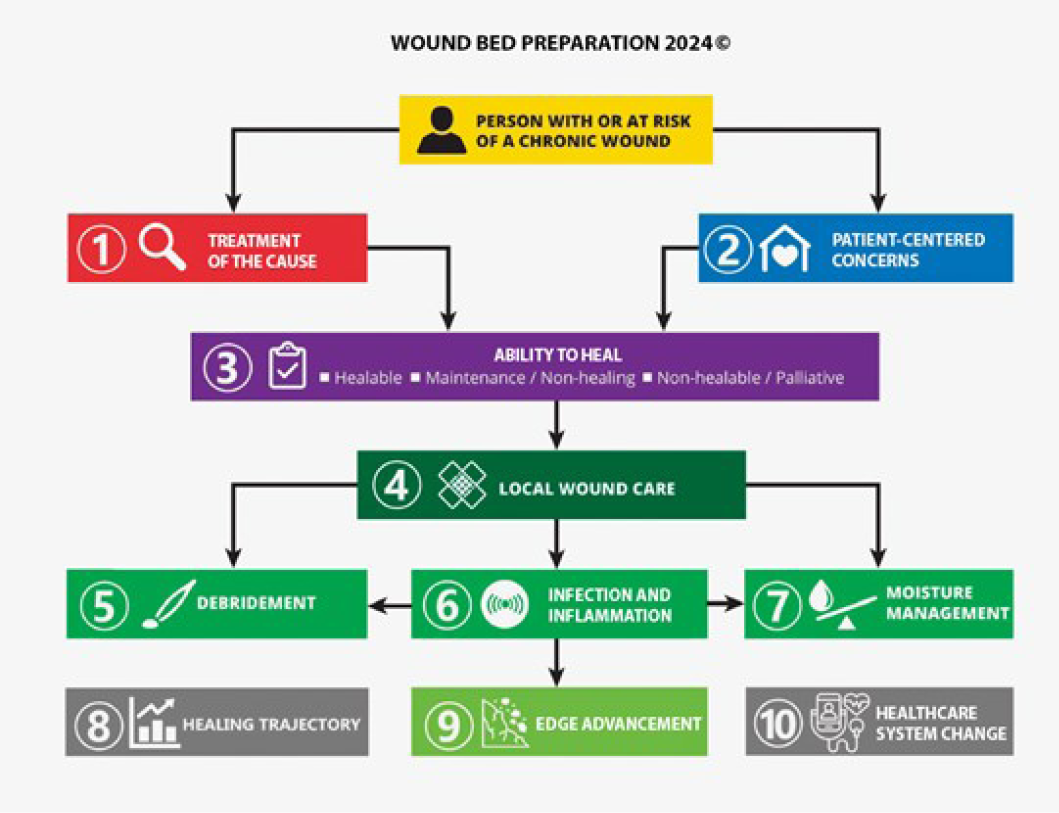
Figure 1. Wound bed preparation 2024. ©WoundPedia 2023
Table 1. Wound bed preparation for wounds below the knee in environments with limited resource availability
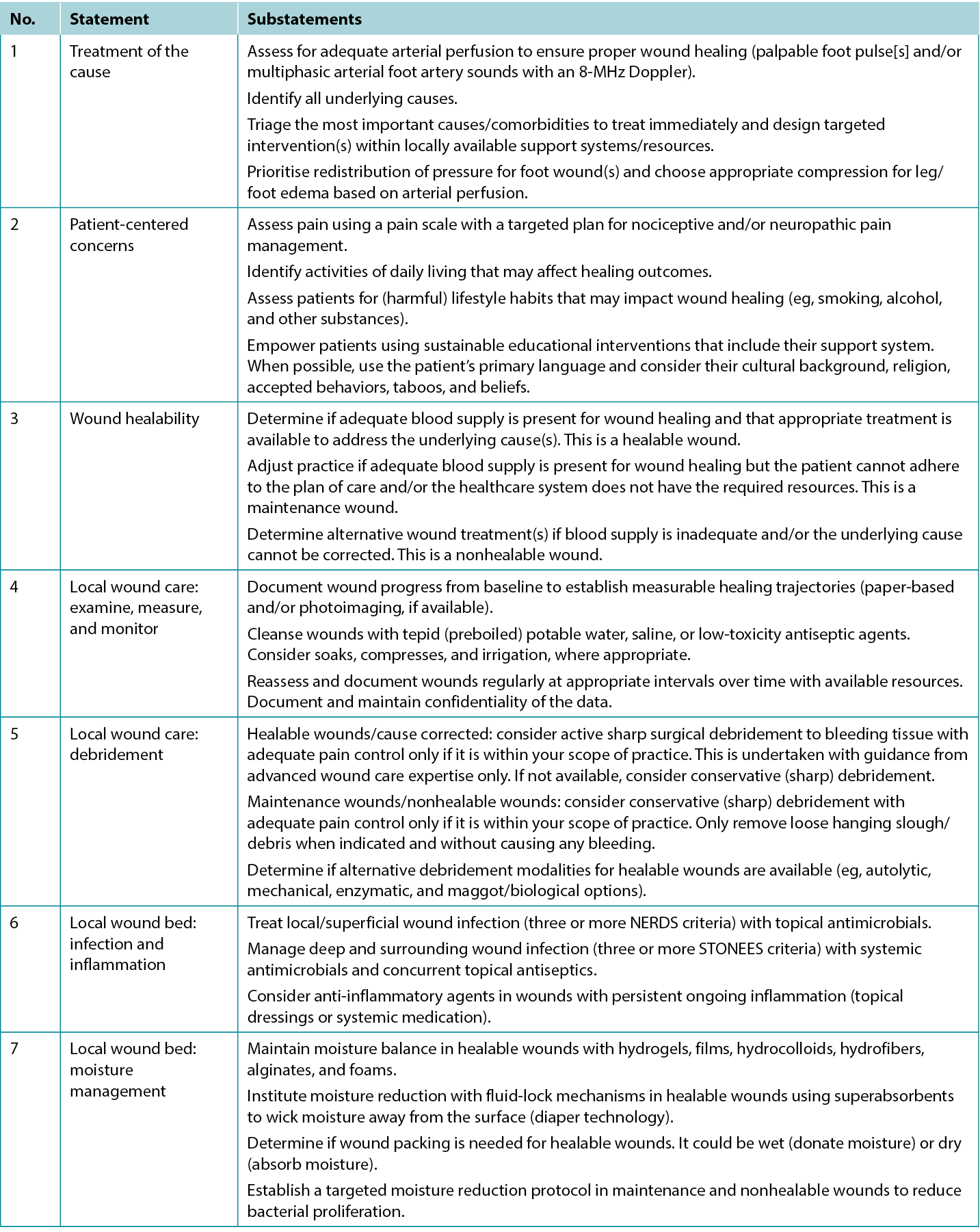

Statement 1: treatment of the cause
1A. Assess for adequate arterial perfusion to ensure proper wound healing (palpable foot pulse[s] and/or multiphasic arterial foot artery sounds with an 8-MHz Doppler)
To determine lower-limb blood flow, find a palpable foot pulse(s) as a vital first action. Start with the dorsalis pedis and/or the posterior tibial pulses. If an 8-MHz handheld Doppler is available, confirm multiphasic flow patterns (biphasic/triphasic). Refer to vascular specialists when a monophasic or absent Doppler sound is observed or foot pulses are not palpable. Other signs of inadequate arterial perfusion are lower limb pain at rest and ischemic limb changes (cold extremity with dependent rubor that blanches on elevation).
Persons with diabetes are susceptible to microvascular issues (peripheral neuropathy, Charcot foot changes) and macrovascular complications including peripheral arterial disease (PAD). These conditions contribute to calluses, foot ulcers, and mixed tissue loss. Because up to 50% of susceptible populations experience both diabetes and PAD,2 timely identification of PAD is critical (using physical examination and vascular tests) because it is a major risk factor for poor ulcer healing and amputation. If detected, immediate revascularisation (angioplasty or vascular bypass) is vital to restore proper arterial flow to the foot. Additional assessment may include capillary refill time, a Buerger blanching test (pale on elevation, bright red rubor on dependency), and claudication with walking.
Vascular examination. In cases of arterial insufficiency, the extremity is often cool to the touch because of insufficient nutrient and oxygen supply (Table 2). Severe cases may manifest tissue necrosis presenting as ulcers, macerated toe webs (often with secondary infection), fissures, or gangrene. Other severe case indicators include pallor upon leg elevation, exercise-induced claudication that resolves with rest, dependent cyanosis or rubor, and muscle atrophy. Notably, lower extremity edema is more indicative of venous rather than arterial issues. Arterial lesions are generally punched out, with a deep base that often contains tendons, whereas venous ulcers show irregular border morphology with a shallow granulation tissue base.3
Table 2. Vascular supply needed for tissue healing
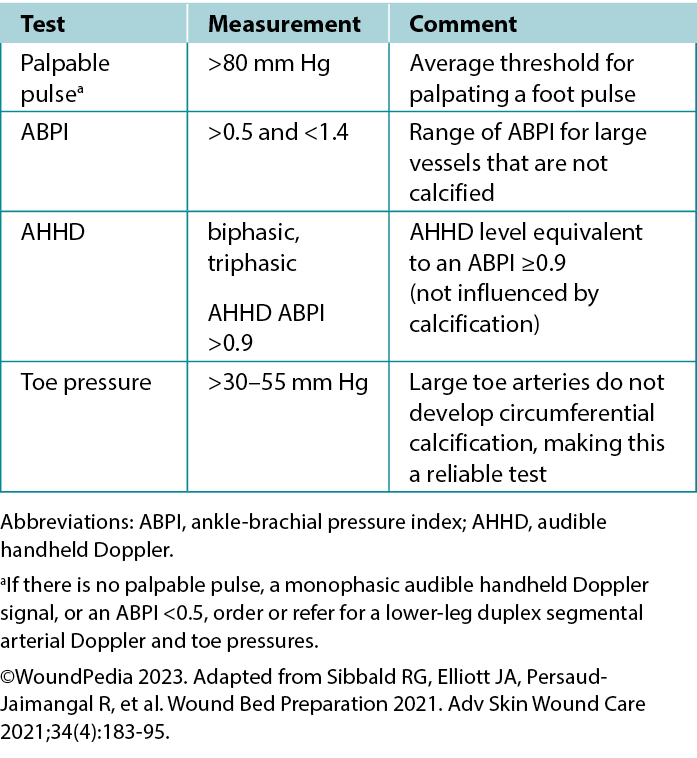
Ankle-brachial pressure index (ABPI) examination. The ABPI measures the ratio of ankle systolic BP divided by the brachial systolic BP using an 8-MHz Doppler. The procedure involves using a BP cuff and recording systolic BP when arterial sounds reappear after cuff inflation. However, factors such as edema, inflammation, and arterial calcification can affect its accuracy. If an 8-MHz Doppler cannot be afforded/obtained, early referral to a tertiary assessment center becomes the priority in cases where the absent foot pulses are present. In certain healthcare settings, an ABPI is still required as vital quantification assessment before beginning any lower limb intervention.
Audible handheld Doppler (AHHD) examination. An AHHD can easily be added as an additional parameter in certain settings, should providers choose a simpler and faster test (not influenced by calcification, no need to squeeze a painful calf, and no need to be recumbent for 20 minutes). The AHHD assessment also can provide accurate results in case of large toe amputation and be recorded as an MP3 or MP4 file and transferred for remote verification of the signal interpretation.
Healthcare professionals should apply gel on the appropriate foot pulse sites with an 8-MHz Doppler probe positioned at a 45° angle to the skin on the dorsalis pedis, posterior tibial, and peroneal arteries. The acquired Doppler signals/waveforms can then be analysed (either by audible sound or visual tracings): A comprehensive tutorial on the AHHD procedure is available online at https://journals.lww.com/aswcjournal/Pages/videogallery.aspx?videoId=20. Optimise signal quality with careful repositioning of the probe to obtain the loudest or most multiphasic signal.
A monophasic or absent waveform warrants a comprehensive vascular assessment, including a Duplex segmental lower leg arterial Doppler in the vascular laboratory. A multiphasic waveform typically indicates the absence of peripheral vascular disease.4 In PWDs, interpret the ABPI ratio with caution (due to arteriosclerosis or arterial calcification); AHHD multiphasic findings are a preferable choice to confirm adequate blood supply for wound healing. A multiphasic waveform (biphasic, triphasic) suggests an AHHD value equivalent to a normal ABPI ≥0.9.
Although AHHD is effective in excluding arterial disease, it may not identify existing segmental perfusion deficits—islands of ischemia or angiosome defects.5 Therefore, physical examination of the foot and lower limb is vital for a conclusive diagnosis. Healthcare professionals can record AHHD signals and transmit them to specialists, facilitating either synchronous or asynchronous assessments remotely. Synchronous assessments enable real-time patient involvement and prompt decision-making.
Chronic venous insufficiency. Chronic venous insufficiency may coexist in PWDs and those with foot ulcers. It mainly affects the lower limbs and impairs the return of deoxygenated blood to the heart and lungs. This condition often arises from venous valve dysfunction that can be triggered by factors including pregnancy or weight gain. Symptoms commonly include varicose veins, edema, skin discoloration from hemosiderin, lipodermatosclerosis, and venous ulcers.6 These ulcers can be any size (from small to circumferential) and form quickly over areas of venous pooling, usually on the medial aspects of the lower limbs.
The cornerstone of treatment for venous ulcers is compression therapy. This compensates for valve dysfunction by enhancing the peristaltic action of the calf muscle pump. Additional measures include leg elevation and walking. Venous ablative procedures may be considered when ulcers are attributed to superficial veins. Untreated venous edema can delay foot ulcer healing.7
For the medical optimisation of PAD, key strategies include optimal BP control, initiating cholesterol medication, and, often, starting statin therapy. Recent studies also recommend treating patients with PAD and concurrent coronary artery disease or carotid disease using a combination of low-dose aspirin (91-100 mg PO daily) and low-dose rivaroxaban (2.5 mg PO BID).8 Additional modifiable factors are smoking cessation and walking or exercise programs. For patients with a foot ulcer (especially in PWDs), appropriate plantar pressure redistribution or offloading is essential.
1B. Identify all underlying causes
Foot complications are of great concern to PWDs and represent a significant burden of disease to healthcare systems. A holistic approach is represented by the mnemonic AIM (assessment, identification, management) and focuses on treating or mitigating the underlying cause of diabetic foot issues, especially neuropathy. The application of a focused assessment approach as a baseline standard of care (VIPS: vascular, infection, pressure, surgical debridement) is crucial in preventing severe complications, including foot ulcerations, lower limb amputations, and an increased incidence of early/preventable death. Some critical foot-related elements in resource-challenged settings include late presentations to formal care, delayed diagnosis,9 barefoot walking, neglected wounds, and the absence of preventive foot care. A hospital-based observational analysis conducted in Ethiopia identified several factors contributing to diabetic foot complications;10 these included high humidity, foot deformity, neuropathy, unidentified active ulcers, inadequate or ill-fitting footwear, poor foot hygiene (eg, foot and toenail fungus), and lack of foot care awareness. A systematic review on plantar ulcers among patients with leprosy (n = 7 studies) identified the following risk factors for developing ulcers: inability to feel a 10 g monofilament on sensory testing, severe foot deformities or hyperpronation, lower education, and unemployment.11 Addressing these challenges in any resource-challenged environment requires a multipronged approach that may include patient and healthcare professional education, early detection, access to care, footwear programs, and community engagement.
Regular and thorough foot assessments include detecting neuropathy (loss of protective sensation), vascular issues (poor or absent lower limb blood circulation), signs of infection, areas of high pressure (callus formation), and friction (blisters, often with hemorrhagic components) to facilitate timely interventions. The simplified 60-second screening tool may be a valuable means to quickly assess, stratify, and follow up patients based on their risk levels without significant cost.12 Patients with a history of ulceration, amputation, peripheral vascular surgery, or Charcot neuroarthropathy are at the highest risk for skin breakdown and should receive additional attention to prevent ulceration and further complications.
To detect infection, the NERDS (superficial wound infection: nonhealing, exudate, red friable granulation tissue, debris, smell) or STONEES (deep and surrounding wound infection: size increased, 3 °F temperature warmer, os [probe to bone], new areas of breakdown, erythema >2, exudate, smell) criteria along with using noncontact infrared thermometry can be helpful.13 Elevated temperatures of 3 °F compared with the opposite limb may signal inflammation and a foot at a higher risk of ulceration.13 A comparative change of 1.67 °C is difficult to measure clinically. This same finding in a person with a lower leg or foot ulcer is eight times more likely to signify deep and surrounding infection when accompanied by two or more additional STONEES criteria.13
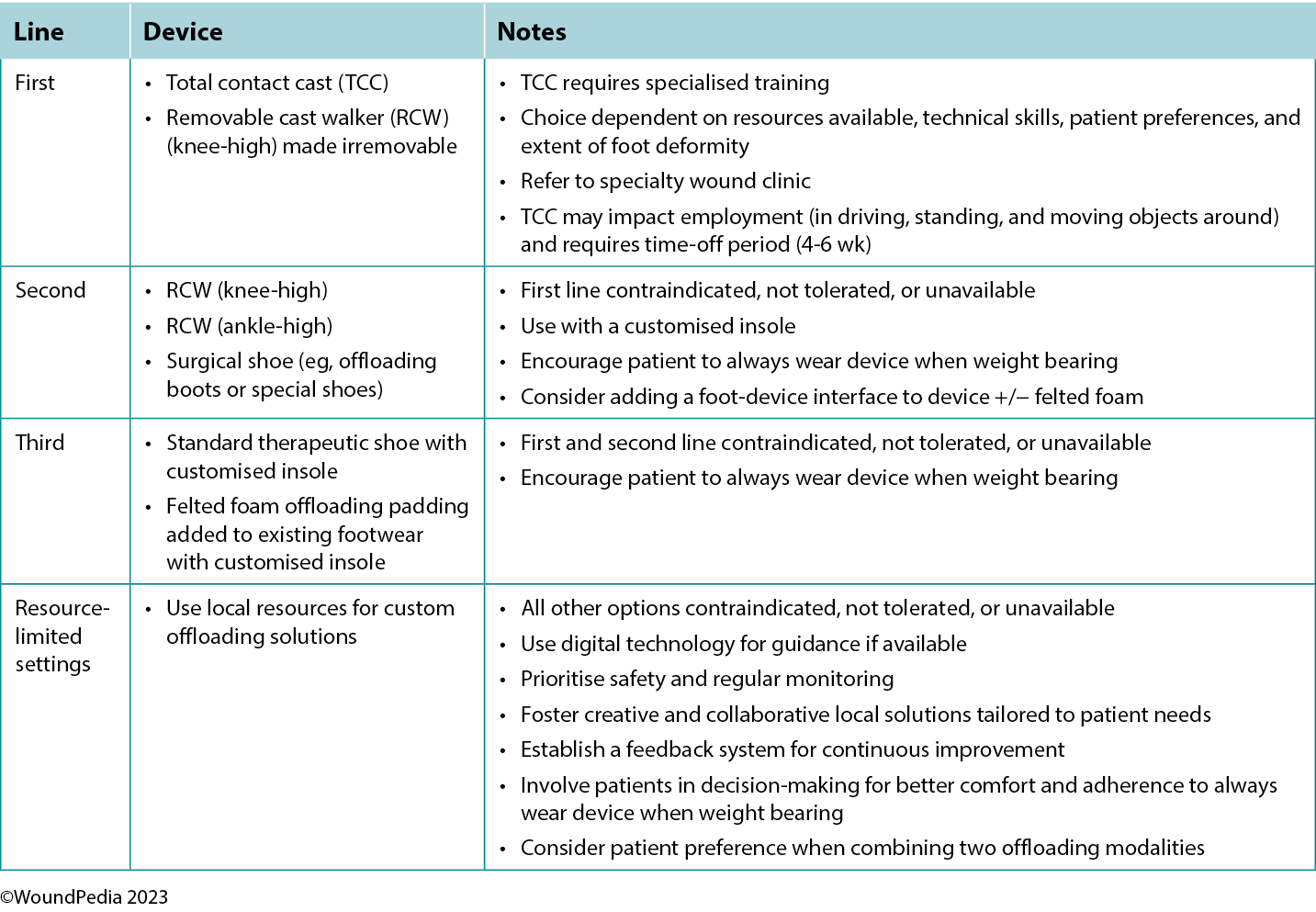
Patients with neuropathy without an ulcer and presenting with a hot swollen foot could have acute Charcot neuroarthropathy. Infrared thermometry is a valuable assessment tool in these cases: acute Charcot feet may be 8 to 15 °F warmer than the mirror image on the opposite foot. These patients require a comprehensive medical history, physical examination, and radiographic images to facilitate early detection. Further actions include the application of a total contact cast for stabilisation and complete plantar pressure offloading with a wheelchair to prevent further bone deterioration and prevent lower limb amputation (Table 3).
Table 3. Offloading interventions for a plantar diabetic/neuropathic foot wound28
Callus formation in PWDs is positively correlated with pressure and shear stress. In individuals with diabetic neuropathy, various factors including foot deformities, limited joint mobility, repetitive stress during walking, and poorly fitting shoes can increase the risk of callus formation.14 Moreover, the presence of calluses can pose a significant risk because repetitive trauma may lead to subcutaneous hemorrhage and eventually progress to ulceration. Provide tailor-made pressure redistribution devices (soft insoles, cobbler interventions to adapt shoes, and reduced barefoot walking) to prevent subsequent callous-to-ulcer progression.
Different etiologic causes may lead to foot ulcers in PWDs: neuropathic because of peripheral neuropathy, ischemic associated with PAD, or a combination of both—neuroischemic foot complications. The presence of diabetic neuropathy is established from medical history; physical examination (5.07/10 g monofilament test); altered sensation distributed symmetrically in both limbs (stocking and glove distribution); and burning, stinging, shooting, or stabbing pain.
1C. Triage the most important causes/comorbidities to treat immediately and design targeted intervention(s) within locally available support systems/resources
A diabetic foot ulcer (DFU) occurs in 25% to 34% of PWDs and is one of the most feared complications, potentially leading to lower limb amputation, severe disability, and reduced life expectancy.15 Multifactorial in origin, diabetes-related peripheral neuropathy and PAD leave feet highly vulnerable to traumatic injury. Access to timely diagnosis and intervention are determinant factors in effective management and limb preservation.
Chronic hyperglycemia measured by elevated hemoglobin A1c (HbA1c) is a major risk factor for sensory, motor, and autonomic neuropathy. Both PAD and dry skin increase foot vulnerability to infection and delayed healing, all contributing to poor outcomes. Chronic kidney disease adds to the risk.16 Recent studies of continuous glucose monitoring report that high glucose variability (reduced time to target range levels) may additionally contribute to long-term complications.17
Up to 50% of PWDs will develop neuropathy with no known cure. Management includes proper daily foot inspections for evidence of trauma or infection, foot care, and effective glucose control.18 In addition to neuropathy, PAD contributes equally to DFUs; PAD is largely asymptomatic and may remain underdiagnosed and untreated for a prolonged period. Individuals with diabetes have more than a twofold increased prevalence of PAD compared with those without.19 A systematic review of community-based studies for global prevalence and risk factors for PAD ranked diabetes highest next to smoking.20
The European Society of Hypertension recommends providers and patients target a systolic BP less than 130 mm Hg and diastolic BP less than 80 mm Hg. In PWDs, systolic BP should not fall less than 120 mm Hg to prevent reduced blood flow to vital organs and lower limbs.21 Although diuretics, calcium-channel blockers, angiotensin-converting enzyme inhibitors, angiotensin receptor blockers, and β-blockers can all be used, angiotensin-converting enzyme inhibitors and angiotensin receptor blockers reduce cardiovascular events.22,23 Recently, SGLT2 inhibitors have shown excellent results in improving glycemia, nephroprotection, and cardiovascular outcomes.24 In addition, DFU incidence is reduced by early detection of PAD with lifestyle modifications.17
The complexity of managing a DFU requires an interprofessional team approach to identify biological, social, geographic, and cultural determinants of health. In Denmark, PWDs are registered by region with access to specialised clinics with interprofessional wound care teams. Lower limb amputation rates have declined significantly due to improved diabetes care, regular foot inspection, better self-care, and timely treatment.25 In more geographically dispersed diverse populations (eg, Ontario, Canada), significant disparities in amputation rates exist, highest in rural regions where timely prevention such as revascularisation surgery and foot care specialists are underserviced or absent.
The most vulnerable persons for diabetic foot-related amputations in Canada are Indigenous people, immigrants, and persons living in rural and northern regions.26 The Indigenous Diabetes Health Circle provides a culturally sensitive approach to local Ontario First Nations communities with education and knowledge about diabetes, wellness, and self-management. Its holistic foot care program supports a continuum of services that connects community members to Indigenous agency partners and local healthcare professionals and is proven to reduce DFU incidence and prevent amputations.27
1D. Prioritise redistribution of pressure for foot wound(s) and choose appropriate compression for leg/foot edema based on arterial perfusion
The criterion standard for plantar pressure redistribution devices is the total contact cast or the removable cast walker made irremovable.28 Even in healthcare systems in which these offloading modalities are readily available, less than 10% of eligible patients are fitted for and adherent to the use of these devices.29
Offloading is paramount to healing foot ulcers (Table 3). The aim is to select the best device for the patient incorporating patient-centered concerns, the goals of care, and best practice evidence. Consider creative solutions to repurpose local materials such as soft felted inserts for offloading in resource-limited settings. It is important to establish an early surveillance program between the patient and healthcare professional to monitor and ensure the desired offloading outcomes. Healthcare professionals need to evaluate the effectiveness of the devices and continually make modifications as needed through established follow-up. In regions lacking specialised practitioners, empowering healthcare workers with competencies in basic offloading can bridge this gap.
Statement 2: patient-centred concerns
2A. Assess pain using a pain scale with a targeted plan for nociceptive and/or neuropathic pain management
The perception of pain involves a stimulus that may be physical or chemical. There are two main types of pain: nociceptive and neuropathic (Table 4). Wound-related pain is an important component of patient-centered concerns that is often undervalued by healthcare professionals. By the late 1990s, wound pain was a focus for healthcare professionals with the launch of a pivotal position document focused on wound pain.30 The document recognised and focused on the distress of chronic wound pain and its influence on patients’ health-related quality of life. The management of wound pain was then integrated into the WBP framework.1,31
Table 4. Pain types and responses30
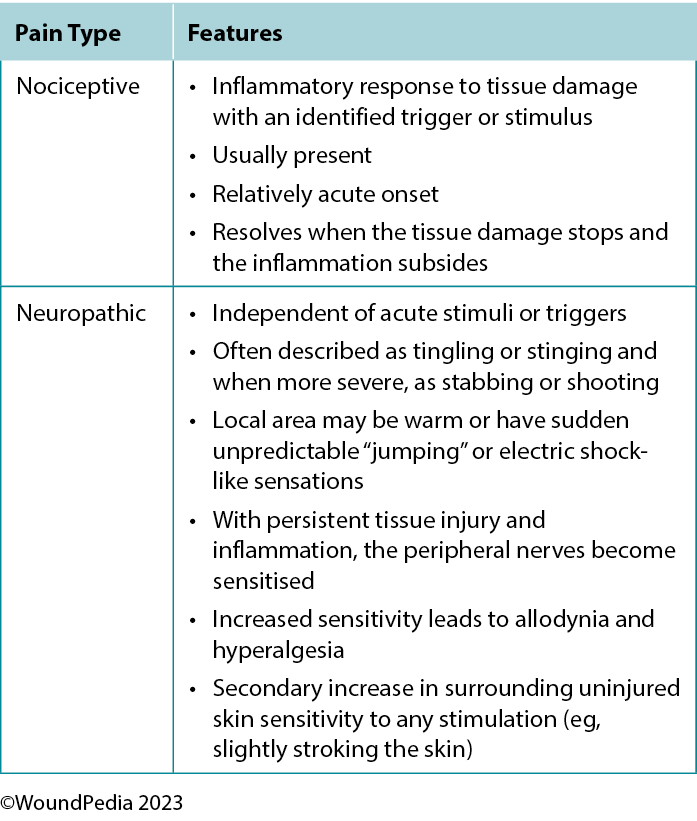
Pain can play a significant role in the total management of persons with wounds and their ultimate healing success.32 Pain signals associated with injury play an important function in patient wellness and as such must be acknowledged through adequate assessment and management. For example, pain or any change in pain is a key predictor of wound infection and one of the four cardinal signs of inflammation.1 Unresolved pain is often associated with delayed wound closure.
Assessment. A pain history is essential to wound pain management.32 Assessment must include the nature, onset, duration, and exacerbating and relieving factors. This will help determine the cause of the pain and direct its management. Pain intensity can be reliably measured using validated pain scales. A verbally administered 0- to 10-point numerical rating scale is a good first choice for measuring pain numerical intensity. Most patients can function with a pain level of 3 to 4 out of 10.33
Patients with persistent pain should be reassessed regularly for improvement, deterioration, and adherence to medication regimens. The use of a pain diary with entries regarding pain intensity, medications used, mood, and response to treatment may be a good management strategy. For individuals with communication limitations, the pain scale should incorporate pictures for easy recognition.
Management. The management of wound pain can be integrated into the WBP framework: treat the cause and address local wound factors and patient-centered concerns.3 Treating the cause should determine the correct diagnosis and initiate treatment of the wound pain. Patient-centered concerns must focus on what the patient sees as the primary reasons and resolutions for the pain. Patient anticipatory pain and suffering can be just as disruptive to quality of life as the actual experience of pain.
Multiple pain management strategies exist and are not always pharmaceutical (Table 5). Consider total patient management, including all aspects of WBP, in choosing a management strategy. Remember: pain is what the patient says it is.34
Table 5. Pain management strategies
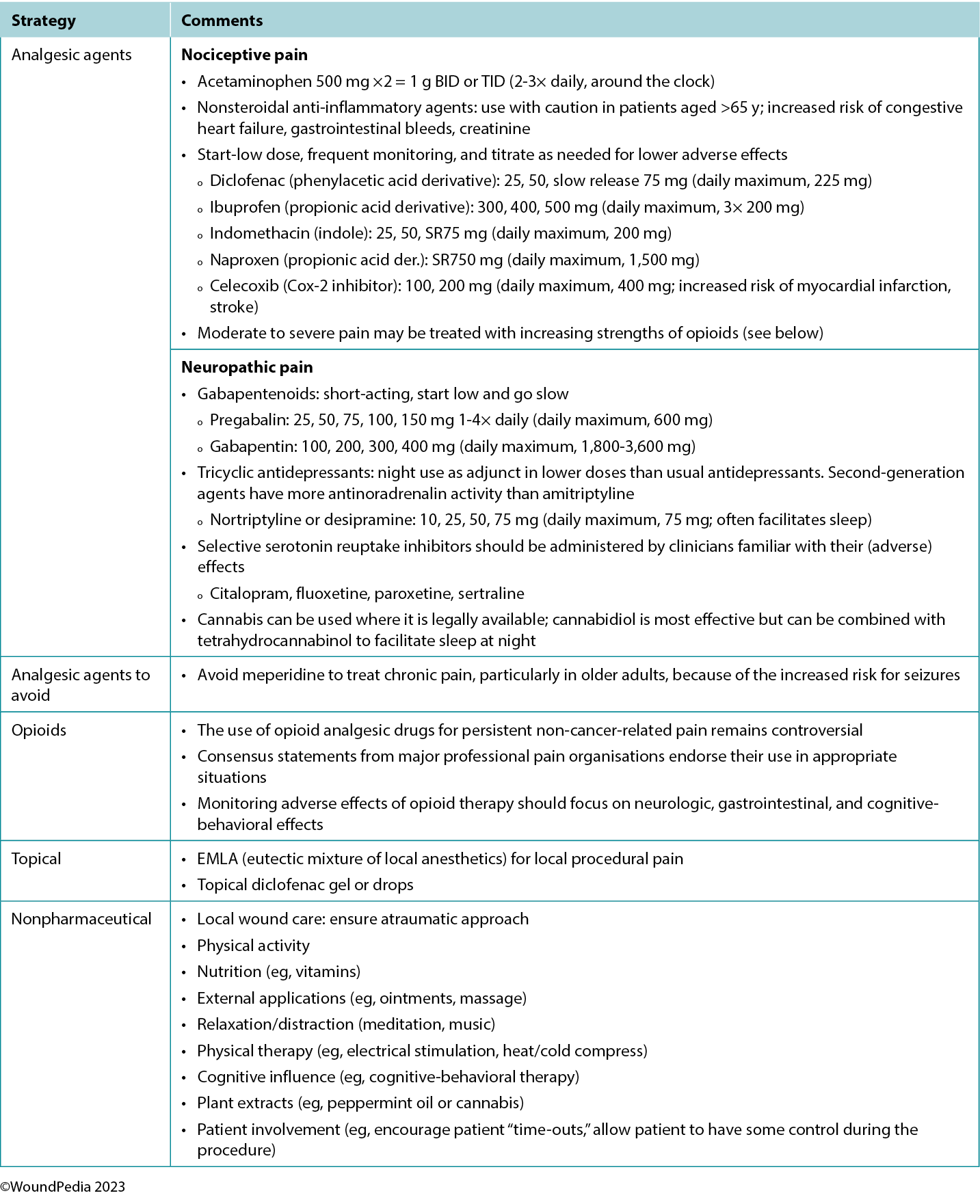
Assessment and management given limited resources. In regions with limited resources, assessment remains possible because it requires no costly tools. Most pain scales are freely available despite some initial cost relative to education and training of practitioners.31 Treatment options for pain in resource-restricted environments may be more practical if driven with nonpharmacologic methods (Table 5). Some of these options may also be more socially acceptable or already practiced culturally (eg, meditation, plant-based treatments) and particularly applicable in nociceptive pain management. Implementing such strategies can then preserve pharmaceutical management for those with pain that cannot be managed by nonpharmacologic means (eg, neuropathic pain).35
2B. Identify activities of daily living that may affect healing outcomes
2C. Assess patients for (harmful) lifestyle habits that may impact wound healing (eg, smoking, alcohol, and other substances)
2D. Empower patients using sustainable educational interventions that include their support system. When possible, use the patient’s primary language and consider their cultural background, religion, accepted behaviors, taboos, and beliefs
In resource-limited environments, patient-centered concerns and barriers to clinical outcomes are crucial for providers to understand and address within the context of cultural, spiritual, and religious beliefs of the respective community.
Wound healing disparities exist among Indigenous populations across the globe. These disparities are often rooted in historical and ongoing socioeconomic, cultural, and healthcare-related factors. Cultural diversity and societal pressure also often dictate formal resource allocation processes to certain health sectors. Some key barriers to wound healing among Indigenous populations include historical trauma, socioeconomic disparities, limited access to healthcare, cultural barriers, chronic health conditions, cultural healing practices, geographic isolation, and healthcare system bias.36 Many cultures have an honor system in managing their sick, older adult, and chronically ill members. These principles are easier upheld if sufficient resources are available to maintain them.
Many studies have identified a major medical illness as one of the core reasons a family can incur large debts.37,38 Even in government-run clinics, additional dressing materials or medicines may be charged to the family. Patients and family members may therefore resort to alternative treatment methods (nonallopathic medicine) from local/Indigenous/traditional healers. Although often less costly, these healers may not have the necessary skills or expertise in managing chronic wounds, leading to deterioration.
Loss of independent mobility because of wound chronicity is another major factor that impacts attendance and regular follow-up. Transport availability varies in resource-restricted environments, and walking may be the only way to access a public transport pick-up point. Secluded rural environments are often affected the most and require traveling significant distances to reach a formal healthcare facility.
The social health of the family environment and willingness to incorporate a person with healthcare needs can drive the quality of care/self-care rendered as well as patient safety within a home environment. Because of the social structure and milieu in various countries, family support and social support may differ by culture. Often, as time passes, the financial burden increases; patient independence and activities of daily living (ADLs) achievement deteriorates; dressing changes become more challenging; and caregivers become stressed, fatigued, and exhausted.39 Late referrals and critical/terminal patient conditions when eventually presenting to formal care are additional aggravating social and behavioral factors that can compound poor wound healing outcomes.
Individuals with wounds treated at home need a designated space to themselves. Wound odor, persistent pain, and a different routine are the main stressors on both the patient and family in settings where space is at a premium. The mere presence of a major skin wound already negatively impacts the patient’s own social interactions, relationships, sexuality, and self-confidence. This leads to progressive anxiety and depression that may bring about pessimism regarding perceived treatment benefits. Subsequently, patients have lowered self-efficacy that is often associated with further wound deterioration including eventual lower-extremity amputations.40
The real challenge occurs when lifestyle modifications are needed. This often requires additional resources or tailor-made education to construct self-care plans.40,41 The need for health education and lifestyle modification interventions to have clear rationales cannot be overemphasised. Lifestyle interventions may become a financial, social, and logistical challenge, first to acquire and then to maintain within any restricted living domain. Further, it is a vital step to ensure that any financial help received is correctly allocated to the family member with a wound.
A biopsychosocial approach is necessary in managing wound care for patients in resource-restricted environments. The wound care team, beyond managing the wound, must address the social stressors/factors affecting the patient. Each patient will need a unique, mutually agreed-upon management plan that fits their constraints (medical, financial, family, social, and emotional support).40
Statement 3: ability to heal
3A. Healable wound: Determine if adequate blood supply is present for wound healing and that appropriate treatment is available to address the underlying cause(s)
3B. Maintenance wound: Adjust practice if adequate blood supply is present for wound healing but the patient cannot adhere to the plan of care and/or the healthcare system does not have the required resources
3C. Nonhealable wound: Determine alternative wound treatment(s) if blood supply is inadequate and/or the underlying cause cannot be corrected
The process of determining the healing classification of a wound begins with a thorough patient history and physical examination. Identifying the underlying cause(s) of the wound is important. Addressing the underlying cause(s) is the first step to developing an achievable management plan.
In some cases, chronic wounds may also become stalled and fail to achieve the wound edge advancement over the set time; these are known as hard-to-heal wounds. They often fall into the maintenance category but, with additional assessment, may be healable with a re-evaluation of the patient, history, causes, and treatment plan.3,42
Patient-centered concerns and expectations need to be identified, compared with, and aligned with institutional/clinician resource availability, skills, and immediate intervention options that are available.3,42 The management plan is based on the assigned healing classification, which may change.
Protect nonhealable wounds against tissue loss, deep and surrounding wound infection, and general deterioration from a wet wound environment. Decreasing moisture is a priority. Maintenance wounds also need protection against further tissue losses with dry wound bed management and local infection controls as the mainstay. Tissue protection may also be a temporary measure until resources become available and additional patient factors are controlled to achieve full optimisation.
Stalled but healable wounds (hard-to-heal) need a second chance to achieve edge advancement with urgency in reassessment and interprofessional team intervention as the highest priorities.3,42
Statement 4: local wound care: examine, measure and monitor
4A. Document wound progress from baseline to establish measurable healing trajectories (paper-based and/or photoimaging, if available).
4B. Cleanse wounds with tepid (preboiled) potable water, saline, or low-toxicity antiseptic agents. Consider soaks, compresses, and irrigation, where appropriate.
4C. Reassess and document wounds regularly at appropriate intervals over time with available resources. Document and maintain confidentiality of the data.
Wound assessment documentation is an integral component of healthcare practice. It is instrumental in ensuring the delivery of high-quality patient care, monitoring wound status, and providing direction for any changes in wound interventions. The comprehensive and accurate recording of wound assessments is essential to ensure improved patient outcomes, effective communication among healthcare professionals, and legal and regulatory compliance.43
Monitoring progress. Wound assessment documentation serves as a historical record of the wound’s progression over time. By regularly documenting wound characteristics, including size, depth, color, exudate, infection, tissue type, and so on, healthcare professionals can track changes, identify potential complications, and adjust treatment plans. If photo documentation is used, obtain patient consent according to organisational policy, ensure appropriate technique with adequate lighting and appropriate distance from the wound, and include a measuring guide in the photo.44 This ongoing evaluation is critical for evaluating the effectiveness of interventions and making informed decisions regarding wound management. When measuring surface area or volume, it is imperative to use a consistent technique regardless of technology.
Communication. Accurate wound assessments facilitate effective communication among healthcare professionals. When all team members have access to consistent and up-to-date wound documentation, they can work together to develop and implement a coordinated care plan, ensuring patients receive the best possible treatment. It is vital to use consistent terminology that is common to all disciplines. The International Classification of Diseases medical classification system is an example of a globally applicable standard.45
Legal and regulatory compliance. Proper wound assessment and documentation are essential to meet legal and regulatory requirements. Inaccurate or incomplete records can lead to legal issues and negatively impact a healthcare professional’s practice, even in resource-limited environments.
Reimbursement. In many healthcare systems, proper wound assessment documentation is tied to reimbursement-based funding models. Accurate and detailed records are often necessary to justify the use of specific wound care products or procedures and ensure organisations receive adequate reimbursement for services rendered.
Research and quality improvement. Wound assessment data are a valuable resource for research and quality improvement initiatives. This continuous learning process helps improve global wound care and patient outcomes.
Patient-centered care. Proper wound assessment and documentation are an essential component of patient-centered care. It ensures that patients’ conditions are thoroughly evaluated and their treatment plans are tailored to their specific needs. When patients observe that their healthcare provider is committed to documenting and monitoring their wounds, it can enhance trust and patient satisfaction.
To promote language consistency and enhance data clarity, an increasing number of enterprises are creating electronic wound assessment software and applications to reduce the time required for thorough documentation.43 These programs and applications (some more affordable than others) can provide the healthcare team with a structured set of parameters to ensure all clinical features are documented, thereby enhancing overall communication.46 Although these tools are an asset to healthcare professionals, they are not without risk, such as incorrect copying and pasting from previous reports/consult notes or patient data security risks. In areas where such programs and applications are not available, updating
the patient and providing written assessment and intervention plans may be warranted.
Statement 5: local wound care: debridement
5A. Healable wounds/cause corrected: Consider active sharp surgical debridement to bleeding tissue with adequate pain control only if it is within your scope of practice. This is undertaken with guidance from advanced wound care expertise only. If not available, consider conservative (sharp) debridement
5B. Maintenance wounds/nonhealable wounds: Consider conservative (sharp) debridement with adequate pain control only if it is within your scope of practice. Only remove loose hanging slough/debris when indicated and without causing any bleeding
5C. Determine if alternative debridement modalities for healable wounds are available (eg, autolytic, mechanical, enzymatic, and maggot biological options)
Debridement is an important process in the WBP paradigm to remove necrotic tissue and other biomaterials, including biofilm, in healable wounds and prevent odor and infection in maintenance wounds. For all wounds located below the knee, communicate the outcomes of any vascular testing (eg, ABPI, waveform) to all members of the interprofessional team, and document accordingly before attempting debridement because many types may be deleterious to the wound bed with reduced vascular supply.
For healable wounds, local wound bed interventions are best determined via the WBP paradigm based on the patient and wound characteristics. Consider surgical debridement (to bleeding tissue) as a first-line intervention. However, in many rural and remote regions, access to a skilled healthcare professional with the necessary education, knowledge, and judgment for this procedure may not exist.
Conservative (sharp) debridement (without causing bleeding) requires advanced knowledge and skills and is more suitable for nonacute care or specialty clinic settings. Only remove loose hanging or unattached debris from the wound without causing trauma to the wound bed.
Clinical sterile maggot debridement therapy is a limited treatment modality in resource-restricted environments, except in cases of accidental exposure. Maggot infestation is often discovered during dressing changes. Good debridement outcomes may result from accidental maggot therapy, particularly if the larvae are from the highly selective Lucilia sericata/cuprina bottlefly source, as they focus on devitalised tissue as their food source.47,48 Detrimental outcomes may present if the infestation is from the ordinary housefly (Musca domestica) or other invader species, as those larvae may indiscriminately destroy healthy tissue.47,48
Healthcare professionals should assess alternative methods of debridement (eg, autolytic, enzymatic, mechanical) for community sectors, including primary care, home care, and long-term care. Within available resources it is vital to consider patient safety, assess environmental factors, and identify barriers to wound healing before initiating debridement.
Appropriate debridement protocols for maintenance and nonhealable wounds differ significantly from those for healable wounds. Although moist wound healing provides an optimal environment for wound healing, it is a form of debridement (autolytic) that may be detrimental to nonhealable and maintenance wounds. Debridement is generally not a suitable intervention for stable maintenance or nonhealable wounds, because the goal is to keep those dry and free of infection.49 Consider debridement only when a maintenance or nonhealable wound becomes unstable to remove infected or necrotic wound debris in the most atraumatic manner possible.
Patient goals typically include enhancing comfort, minimising wound-related odor, reducing pain, and improving ADLs. Keeping the wound dry enables the formation of a protective layer, whereas debridement carries the risk of removing this protective layer and introducing pathogenic organisms.
Statement 6: local wound care: infection and inflammation
6A. Treat local/superficial wound infection (three or more NERDS criteria) with topical antimicrobials
6B. Manage deep and surrounding wound infection (three or more STONEES criteria) with systemic antimicrobials and concurrent topical antiseptics
6C. Consider anti-inflammatory agents in wounds with persistent ongoing inflammation (topical dressings or systemic medication)
The validated NERDS and STONEES criteria can guide the assessment and treatment of infection and inflammation in chronic wounds.50 Base the diagnosis of infection on clinical signs and symptoms rather than superficial wound swabs, which should be used only to guide antimicrobial selection in the event of an infection. If deep and surrounding tissue infection is suspected, identify the bacterial species and their sensitivity to commonly used antibacterial agents to help guide systemic antimicrobial use. This is especially true if a deep and surrounding infection is not responding to the empiric treatment.
The best tissue samples for wound bed culture swabs are obtained after cleaning the wound with potable water or saline and sampling the wound base without debris. A culture from tissue samples using a curette or other biopsy technique is most likely to represent the organisms in the wound tissue. Alternately, a semiquantitative swab technique using the Levine method can correlate to tissue biopsies.51 The swab is placed on granulation tissue and pressed enough to extract wound exudate and then rotated 360° to cover all surfaces of the swab. Placing the swab in the transport media to premoisten it prior to placing the swab on the skin may increase the bacterial yield for patients with low-exudate wounds.52
Pathogenic bacteria may infiltrate to the bone and cause osteomyelitis, which derails healing potential and is challenging to cure. A bone biopsy is the criterion standard to diagnose suspected osteomyelitis, because superficial cultures do not access the deep bone tissue, and imaging is limited by variable specificity.53 However, a bone biopsy may be uncomfortable, is dependent on skilled clinicians, and may extend the tissue damage. For these reasons, it frequently is not a feasible option, even more so if resources are scarce.
When deep wound infection is confirmed, antimicrobial dressings are appropriate to locally support systemic antibiotic therapy and prevent spread to the deep and surrounding compartment from surface bacteria. The five most common choices of antimicrobial dressings are silver, polyhexamethylene biguanide, iodine, methylene blue/crystal violet, and honey. Of these, silver and honey have additional anti-inflammatory properties.54
In some wounds, broad-spectrum antiseptics are applied for short-term rapid bacterial burden reduction to support systemic antibiotics. When the risk of infection outweighs the cytotoxic properties, low-cost povidone-iodine-moistened gauze changed daily over exposed bone can reduce surface bacteria. This is a short-term strategy accompanied by clinical evaluation for serum thyroid function levels especially when wound surfaces are large. However, with the newer low-toxicity antiseptics, other options are now available that are less aggressive but equally effective.
In general, wounds in immunocompetent patients that present for less than 1 month are treated with agents for Gram-positive coverage. Polymicrobial infections (typically seen in PWDs) or wounds longer than 1 month in duration call for broad-spectrum agents with Gram-positive, Gram-negative, and anaerobic coverage because these patients are often also immunocompromised.55
Cytotoxic agents may be appropriate for nonhealable wounds if the need for topical antimicrobial action is greater than the tissue toxicity. Antiseptics are generally preferred over topical antibiotics as part of antibiotic stewardship because of a lower risk of systemic bacterial resistance and adverse effects associated with contact irritant or contact allergic dermatitis.54
6D. Gently cleanse the wound with low-toxicity solutions (water, saline, noncytotoxic antiseptic agents).
The cleansing solution used depends on the characteristics of the wound and availability in practice. There is poor consensus in the literature on wound cleansing recommendations. An updated 2021 Cochrane review on cleansing solutions of venous leg ulcers concluded that there is a lack of randomised controlled trial evidence “to guide decision-making about the effectiveness of wound cleansing compared with no cleansing and the optimal approaches to cleansing of venous leg ulcers.”56 However, general wound care principles involve low-toxicity solutions including potable or preboiled water, saline, and other wound-friendly antiseptic agents.57 This avoids cytotoxic effects and damage to healthy granulation tissue in healable wounds.
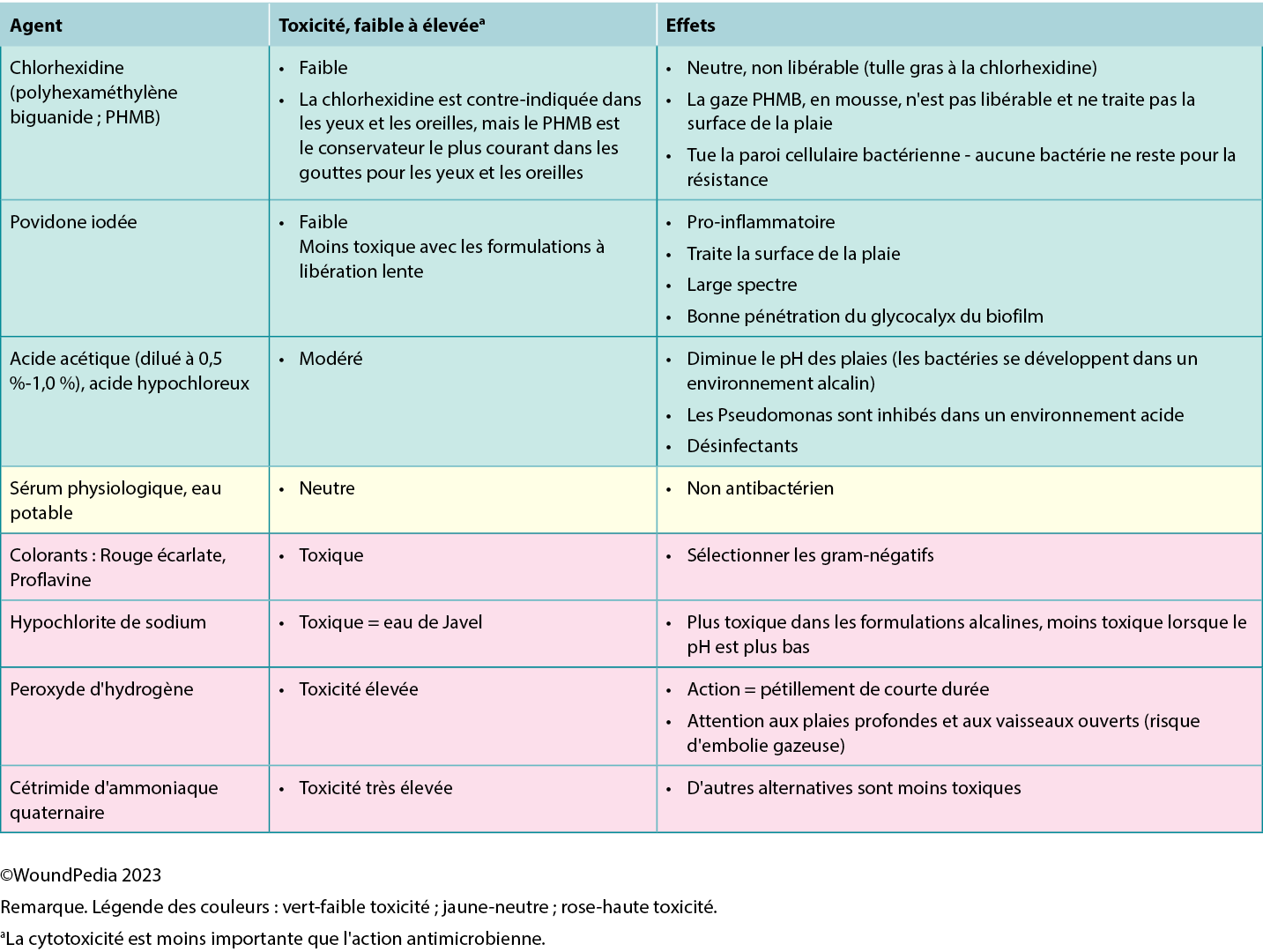
Acetic acid diluted to 0.5% to 1.0% or hypochlorous acid can also be used in some cases in which an acidic environment is preferred (eg, for topical treatment of Pseudomonas aeruginosa).58 Based on the healability classification of the wound, antiseptic agents with some tissue cytotoxicity may be used after a positive risk-benefit assessment. This includes agents such as low-concentration chlorhexidine or its derivative polyhexamethylene biguanide and povidone-iodine. This may be beneficial in cases of maintenance and nonhealable wounds that have a high potential for infection. Further, these agents can be used to manage odor and exudate in addition to controlling bioburden. In resource-limited environments, consider wound hygiene measures and how solutions are prepared, stored, and distributed to patients to prevent cross-contamination.
There is emerging interest in the use of surfactants to remove biofilms that often exist within wound debris and have two surfaces of different viscosity (Supplemental Table 2, http://links.lww.com/NSW/A177). Wound irrigation remains a controversial topic for use in chronic wounds. However, expert opinion is not to irrigate wounds if the base of the wound is not visible to avoid accumulation of the irrigation solution in closed spaces and accidental enlargement of the wound.57 Irrigate wounds with an adequate solution volume (50-100 mL per centimeter of wound length).59
Statement 7: local wound care: moisture management
7A. Maintain moisture balance in healable wounds with hydrogels, films, hydrocolloids, hydrofibers, alginates, and foams
7B. Institute moisture reduction with fluid-lock mechanisms in healable wounds using superabsorbents to wick moisture away from the surface (diaper technology)
7C. Determine if wound packing is needed for healable wounds. It could be wet (donate moisture) or dry (absorb moisture)
7D. Establish a targeted moisture reduction protocol in maintenance and nonhealable wounds to reduce bacterial proliferation
Maintaining moisture balance is complex and depends on the wound type and healing classification. Consider moisture balance, infection control, and patient education in selection of dressing materials.60 Incorporating and tailoring moisture management strategies to the specific wound type and the resources available can optimise patient outcomes and minimise complications (Table 6).3,54 Further research and clinical studies should continue to refine our understanding of wound moisture management to enhance wound care practices in the future.3,54
Table 6. Goals of moisture management based on wound healability3,42,54
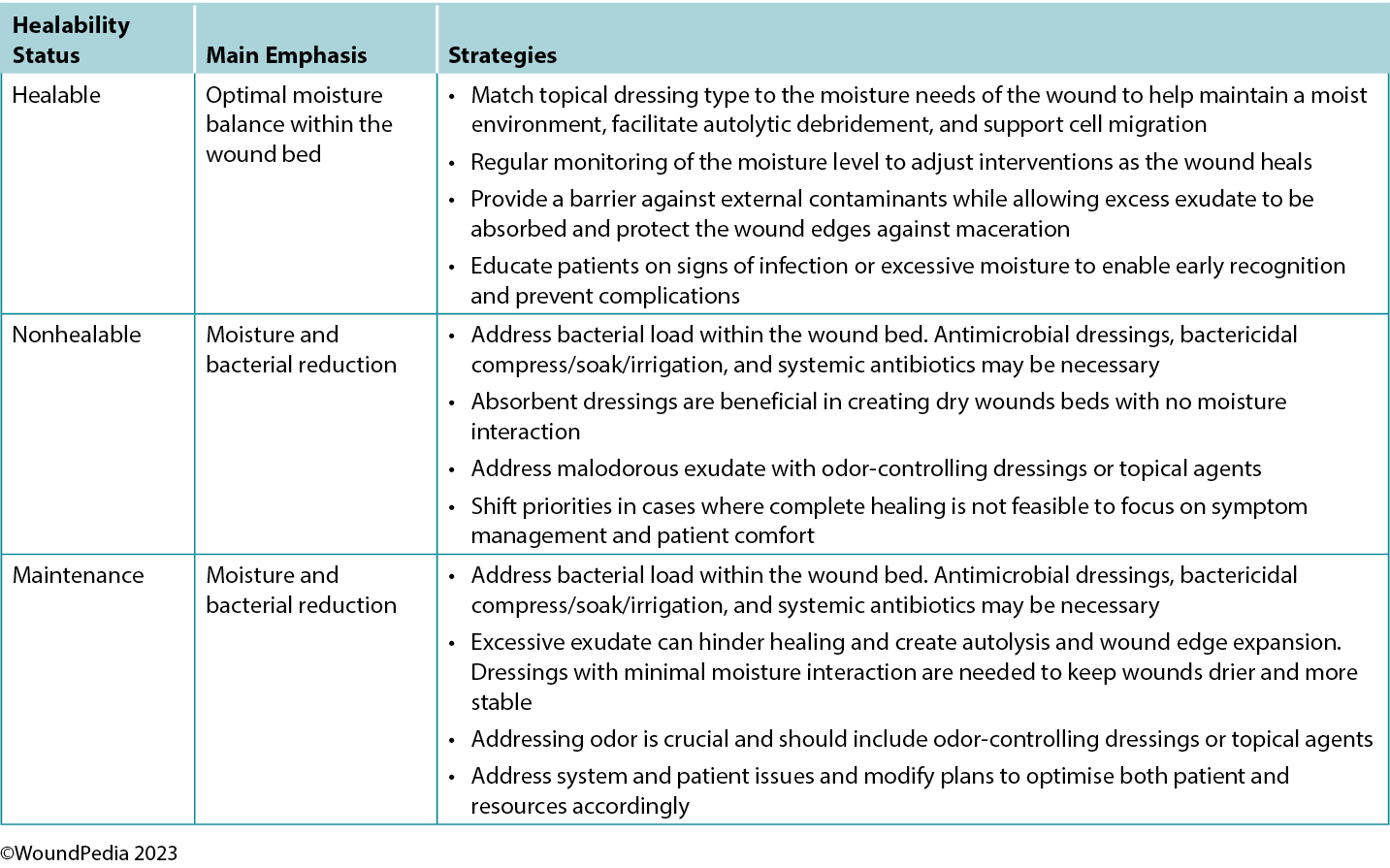
In general, as the level of exudate increases, so should the moisture absorbency or transferring capability of the dressing.3 Moisture-balance dressing options can be combined with antibacterial and anti-inflammatory properties to further meet the wound needs.
The choice of dressing for maintenance and nonhealable wounds should prioritise comfort while avoiding fluid donation to the wound bed and maceration of the wound edges. These wounds require regular reassessment for any progress or deterioration and should be managed to reduce bacterial load. Depending on wound evolution and characteristics over time, dressings may need to be adapted.
Statement 8: Healing trajectory
8A. Consider that healable wounds should be at least 20% to 40% smaller by week 4 to heal by week 12. If factors are present that affect healing time (poor glycemic control, for example), additional healing time may be required
8B. Allocate additional time to healing beyond 12 weeks in healable wounds if there are limited available resources, and continue with consistent care
8C. Prioritise referral to specialist centers (when available) for diagnostic testing and/or a skin biopsy, especially when faced with severe resource restrictions
Wound healing trajectories are useful and necessary for evaluating the needed time to heal, especially using clinical data (measurements) for both acute and chronic wounds. The healing trajectory is based on accurate and consistent wound measurements that determine the wound surface area closure over time. This helps to distinguish wound progression, stalled wounds, and worsening wound status.
Healable acute wounds should be completely closed within 30 days. Expect chronic healable wounds to have a 20% to 40% edge advancement at 30 days (4 weeks) and to close within 12 weeks.3,42,61,62 Nonhealable wounds have no defined time allocated to close, no edge advancement is expected, and all initiated steps are to prevent further deterioration. Maintenance wounds are not expected to heal nor deteriorate, and wound healing may progress slowly without a fixed time expectation unless patient/institution/system optimisation is achieved.
Re-evaluate hard-to-heal wounds periodically for alternate diagnoses. In these cases, consider wound biopsy, further investigation, and/or referral to an interprofessional assessment team. A healing trajectory can be assessed in the first 4 to 8 weeks to predict if a wound is likely to heal by week 12, provided there are no new complicating factors.63 Changes in the wound, the individual, or the environment may necessitate the reclassification of a wound to the maintenance or nonhealable category.
Statement 9: Edge advancement
9A. Consider locally constructed active modalities according to the required mechanism of action and the specific indications for initiating an adjunctive therapy to support wound healing
9B. Decide on adjunctive therapies through an interprofessional team approach and include a prior risk-to-benefit analysis
Select adjunctive therapies according to healability. Initiate these as soon as possible after injury in persons with major trauma to prevent sequelae of long chronicity. Select modalities using an interprofessional team approach based on what is available and the physical mechanism required (while ensuring trauma tissue healability). In hard-to-heal wounds, the wound may need a second chance to heal after reassessment.42 Ensure informed consent is a part of adjunctive therapy decisions.
A risk-to-benefit and cost-effectiveness analysis is helpful and will add in system sustainability. The key to effective adjunctive modality decisions is based on the risk it poses to initiate the therapy (physical discomfort, financial hardship, patient adherence) versus the benefit it will provide (tissue oxygenation, wound contraction, edema reduction, cellular reactivation).42,64 The best risk-benefit decisions are made within an interprofessional team including the patient, ensuring group commitment and treatment completion within optimal use of resources.
Optimising resources, or the slight repurposing thereof, may lead to creative strategies in the hands of interprofessional teams to tailor-make solutions to ensure all patients are optimally treated despite resource restrictions.
Surgery. Even in the most restricted environments, this is the one modality that is mostly available within a medical catchment area, often in tertiary care settings with referrals received from primary care clinics to provide debridement, general surgery with primary/tertiary intention closure, skin grafts, and/or amputations.
Skin grafts may be available in resource-restricted environments as an advanced modality to achieve tissue closure to reduce healing times and prevent recurrent deep wound infections. The procedure can minimise the extensive use of dressing materials over a prolonged period and reduce primary care chronic wound workload. Skin graft decisions are often made to preserve body functionality and promote early wound closure above aesthetic outcomes.65 However, avoid skin grafts for ischemic wounds and most venous stasis ulcers; consider them only in wounds where a favorable outcome could be expected.66,67
Electrical stimulation. Wound healing can be accelerated by enhancing the natural electrical current present in injured skin. In resource-limited environments, this modality should be investigated for wound healing because of its high-level evidence base and availability of devices of this nature (direct current, alternating current, low-intensity direct current, pulsed electromagnetic fields, high-voltage pulsed current, and transcutaneous electrical nerve stimulation devices). The evidence supports increased cellular proliferation and increased microcapillary perfusion, as well as a reduction in bacterial burden and infection on treated wound beds.68
Wall-mounted negative-pressure wound therapy. This can give the healthcare professional control over exudate management and accuracy in fluid replacement for inpatients with high exudate and large tissue defects. Start with the lowest possible pressure (minus 50-80 mm Hg). The patient becomes bedbound for the modality to be maintained, and the base layer (often gauze or petrolatum-impregnated dressings) needs to be replaced at least daily. This, together with starting on the lowest possible negative-pressure setting, will prevent mechanical trauma to the wound bed from tissue adherence and traumatic dressing removal in cases where nonadherent base layers are not available.69 There are now disposable negative-pressure wound therapy devices designed for use in the community as well as do-it-yourself options that can render acceptable clinical outcomes.70,71
Breathing high-flow, highly concentrated oxygen. Oxygen is often overlooked as a legitimate wound healing modality.72 Ironically, it is rarely used, although nearly all formal healthcare settings have copious amounts of oxygen available, even in relatively resource-poor environments. The availability of oxygen concentrators has also increased because of the COVID-19 pandemic, making oxygen administration also a possibility on an outpatient basis in home-based settings.73 Although hyperbaric oxygenation is the most effective means of increasing plasma oxygen concentration and tissue oxygen delivery, this modality is not always readily available. However, providing normobaric (ward) oxygenation still produces a 7.5-fold increase in plasma-borne oxygen (ie, from 0.3 mL/dL to 2.3 mL/dL; Table 7).74 Moreover, intermittent inhalation of 100% oxygen in patients without chronic obstructive pulmonary disorder (eg, 6 hours on/2 hours off by nonrebreather mask) over 3 to 4 days is not harmful to the lungs and may provide significant additional oxygen substrate, while the intermittent increase and decrease in oxygen delivery activate the expression of hypoxia-inducible factor (a strong stimulus for angiogenesis).75 This would suggest that in lieu of hyperbaric oxygen therapy, normobaric oxygen is justified for mitigating conditions on the FDA-approved list of indications for hyperbaric oxygen (Table 7).76 This may include tissue reperfusion injuries (eg, crush injuries, compartment syndromes before and after surgical release); bacterial toxin inhibition (ie, infective myonecrosis or other anaerobic infections); or large-tissue defects (after debridement to maintain the reactivated inflammatory response for up to 48 hours). Normobaric oxygen provides 50% of the Po2 of typical hyperbaric oxygen therapy (at 2 atmospheres); however, many of the pharmacologic effects of oxygen are achieved only under hyperbaric dosages.77,78
Table 7. Normobaric oxygen therapy mechanisms and delivery systems
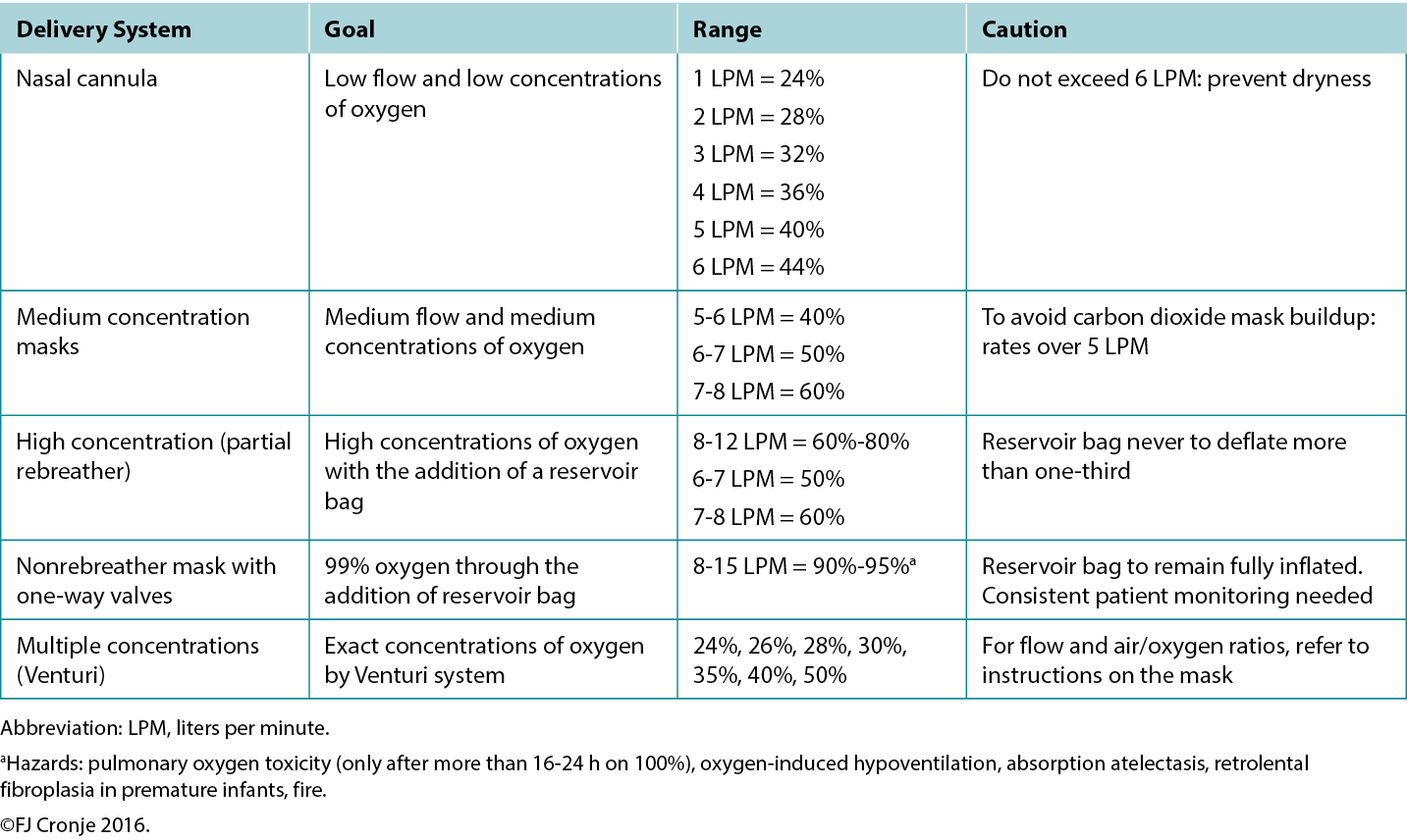
Note that topical oxygen administration directly to a wound does not have the same physiologic effects attributed to systemic oxygen delivery.79 Topical oxygen delivery systems remain subject to ongoing research to determine their beneficial actions beyond improved epithelialisation and possibly a mild antiseptic effect.64 The latter effect has also been attributed to ozone therapy.80 A systematic review completed in 2018 indicated that these therapies could potentially elicit mild oxidative stress or disinfection but that the risk of toxicity due to uncontrolled reactive oxygen species is high.81 Within the limited-resource environment, these devices and use thereof are likely uncontrolled.
Statement 10: Healthcare system change
10A. Facilitate evidence-informed, culturally competent, and equitable care for all patients
10B. Improve provider skills for wound management competency to enhance patient outcomes
10C. Establish timely and effective communication that includes the patient and all interprofessional wound care team members for improved healthcare system wound outcomes
Globally, chronic wound management consumes a significant portion of healthcare resources; preventive care represents the most cost-effective strategy for reducing healthcare system expenditures. There are numerous approaches to integrating preventive care into practice. For instance, DFUs are notorious for leading to high amputation rates and morbidity worldwide, even though many DFUs are preventable. Although diabetes was initially believed to be most prevalent in developed countries, it is noteworthy that 80% of diabetes-related deaths occur in countries with limited resources.82 A validated screening tool, an educated and available interprofessional team, and the implementation of prevention algorithms can be used in countries regardless of the availability of resources.83-85 Other organisational strategies that could be implemented include the following.
Patient navigation. Managing a DFU requires continual support from a circle of care that includes family members and healthcare professionals (including home care and wound care) working as a team. Timely access to both health and social services is often necessary to prevent and heal DFUs. Regionalised, community-based integrated diabetes services linked to interprofessional wound care clinics are proving to be most successful.86
One effective way to ensure optimal and timely care is patient navigation. This concept is adaptable to all healthcare sectors and can improve the timely diagnosis and treatment of wound infections, optimise pain management, and increase access to specialised care, thereby expediting wound closure rates.87 Patient navigation is becoming a vital component of integrated care, facilitating seamless transition between sectors and enhanced clinical outcomes. Further, it is accompanied by a boost in morale for both patient and healthcare professional, decreased nonacute hospital admissions or readmissions, enhanced patient quality of life, and improved adherence to treatment protocols. All these factors combined generate significant cost savings to healthcare systems.87,88
A critical element of successful patient navigation programs is the inclusion of a comprehensive and systematic approach to guide healthcare professionals in assessing and delivering care to each individual patient (eg, the WBP framework). These pathways do not need to be complicated or time consuming, but should ensure specific criteria are met, including regular foot care for those at high risk of amputation, glycemic control to an HbA1c less than 9%, and a BP less than 130/90 mm Hg.23,89
Policy interventions. Organisational policies that detail and provide guidance on best practice interventions and pathways are crucial for the successful and sustainable implementation of wound care protocols. Base these policies on current published guidelines for each specific wound type and translate them into the environment they need to serve. The institution needs to accept them as standards of practice and be approved as such to serve as evidence-based care in environments in which other guidelines may not be successfully adopted because of cultural or language translation challenges. Further, these policies must clearly outline the process for entering and using data, as ongoing quality improvement initiatives are based on data to improve and maintain effective care processes.
Adapted wound care. Although the delivery of care should be adapted to the unique needs of each healthcare sector, certain concepts should be standard, particularly those that enhance effective communication both within and across sectors. The increased adoption of digital technology expedites assessments, enhances access to specialised care, and optimises the allocation of limited resources.90 Where adaptations are implemented as care processes, these practices should be well documented as care standards and be easily accessible to ensure consistency and continuity of care within respective institutions.
Delphi consensus highlights
Some important comments from the panel:
- The ability to heal (healability) is a changeable modality and not to be seen as a static classification as patient condition, circumstances, and choices drive the classification allocation process (3A).
- The adjustment of practice as required in maintenance wounds incorporates the establishment of a conservative wound bed approach, with attention to the allowances the patient is willing to make within their life choices to slowly ensure patient optimisation and subsequently increase host competence (3B).
- When the method of patient documentation is agreed upon within an institution, it should be uniformly used to prevent communication gaps between providers that may inadvertently cause a negative impact on patient care outcomes (4A).
- Antiseptic mouth washes suitable for mucosa are often also friendly for use on a wound bed (4B). This may be considered off-label use.
- The choice for topical bacterial burden control should be on topical (low) toxicity antiseptics (the five most important ones), depending on the ability to heal and bacterial burden priorities to be addressed. Refrain from using topical antibiotic preparations, ointments, and creams on chronic wounds because those preparations are often focused only on Gram-positive organisms and would allow Gram-negative and anaerobic organisms on the wound bed to multiply freely. Further, topical antibiotic preparations need only one mutation to create systemic resistance to the targeted organism. Topical antibiotics are often in a carrier medium that is associated with contact irritant or contact allergic dermatitis (6A and 6B).
- When a healable wound has a significant moisture burden and remains in need of superabsorbent dressings to control the moisture balance of the wound bed, the wound needs thorough reassessment to ensure all underlying causes have been corrected for (7B).
- In establishing an interprofessional team, use any means of communication to build and maintain such a team as that could significantly optimise local capacity despite distances between providers and specialists to increase clinical outcomes despite local limitations (9B).
Conclusions
Optimise chronic wound care in resource-limited environments by initiating small adaptations and creative interventions without compromise to the core principles of care required. Interprofessional wound care teams can serve as a virtual resource to isolated and remote communities to improve clinical outcomes. All of the critical elements for (diabetic) foot management and care can easily be incorporated into diverse environments by increasing local capacity and providing clinician education and culturally appropriate patient empowerment.
Practice pearls
- The holistic care of PWDs includes the optimisation of HbA1c levels, BP, cholesterol levels, and drugs with cardiac- and renal-protective properties.
- The audible handheld 8-MHz Doppler pulse signal is a suitable bedside test for arterial blood supply to the lower limbs. It can be performed as a modification of the traditional ABPI, and the pulse sounds are easy verifiable by remote expert team members using MP3 or MP4 recordings from a cellphone.
- The NERDS and STONEES mnemonics can guide diagnosis and treatment of local/deep and surrounding infection, including an oral antibiotic indication for osteomyelitis.
- Plantar pressure redistribution can be accomplished from innovative, less costly alternatives such as soft felted simple inserts, to the total contact cast and removable cast walker made irremovable if the latter are unavailable or unsuitable for patient preferences or ADLs.
- Integrated coordinated care teams can connect with virtual expertise by equipping healthcare professionals with skills in patient navigation.
- Toolkits containing enablers for practice along with 8-MHz Dopplers and infrared thermometers can facilitate care in resource-limited settings.
Conflict of Interest
The authors declare no conflicts of interest.
Funding
The authors received no funding for this study.
Préparation du lit de la plaie 2024 : Consensus Delphi sur la prise en charge des ulcères du pied dans les environnements à ressources limitées
Hiske Smart, R Gary Sibbald, Laurie Goodman, Elizabeth A Ayello, Reneeka Jaimangal, John H Gregory, Sadanori Akita, Afsaneh Alavi, David G Armstrong, Helen Arputhanathan, Febe Bruwer, Jeremy Caul, Beverley Chan, Frans Cronje, Belen Dofitas, Jassin Hamed, Catherine Harley, Jolene Heil, Mary Hill, Devon Jahnke, Dale Kalina, Chaitanya Kodange, Bharat Kotru, Laura Lee Kozody, Stephan Landis, Kimberly LeBlanc, Mary MacDonald, Tobi Mark, Carlos Martin, Dieter Mayer, Christine Murphy, Harikrishna Nair, Cesar Orellana, Brian Ostrow, Douglas Queen, Patrick Rainville, Erin Rajhathy, Gregory Schultz, Ranjani Somayaji, Michael C Stacey, Gulnaz Tariq, Gregory Weir, Catharine Whiteside, Helen Yifter, Ramesh Zacharias
DOI: 10.33235/wcet.44.1.13-35
Résumé
Contexte La prise en charge des plaies chroniques dans les pays à faibles ressources mérite une attention particulière. Les milieux ruraux ou dépourvus de ressources (c'est-à-dire ceux où les réponses aux besoins de base et les fournitures médicales sont limités et où les membres d’une équipe interprofessionnelle ne sont pas toujours disponibles) peuvent ne pas être en mesure d'appliquer ou de reproduire les meilleures pratiques des milieux urbains ou des milieux disposant de ressources abondantes.
Objectif Les auteurs ont mis en commun leur expertise mondiale pour développer une application dans la pratique et scientifique du modèle de préparation du lit de la plaie pour les communautés ne disposant pas des ressources idéales.
Méthodes Un groupe de 41 experts en plaies de 15 pays est parvenu à un consensus sur la préparation du lit de la plaie dans les environnements à ressources limitées.
Résultats Chaque déclaration de 10 concepts clés (32 sous-énoncés) a atteint un consensus de plus de 88%.
Conclusions Les déclarations de consensus et les justifications peuvent guider la pratique clinique et la recherche pour les praticiens dans les environnements à faibles ressources. Ces concepts devraient inciter à l'innovation permanente afin d'améliorer les résultats pour les patients et l'efficacité du système de santé pour toutes les personnes souffrant d'ulcères du pied, en particulier les personnes diabétiques.
Objectif général
Examiner une application pratique et scientifique du modèle de préparation du lit de la plaie pour les communautés ne disposant pas des ressources idéales.
Public ciblé
Cette activité de formation continue est destinée aux médecins, aux assistants, aux infirmières et infirmiers praticiens et aux infirmières et infirmiers concernés par les soins de la peau et des plaies.
Objectifs/résultats d'apprentissage
Après avoir participé à cette activité éducative, le participant pourra :
1. Résumer les questions liées à l'évaluation des plaies.
2. Identifier une classe de médicaments pour le traitement du diabète de type II dont il a été démontré qu'elle améliore la glycémie, la néphroprotection et les résultats cardiovasculaires.
3. Synthétiser les stratégies de traitement des plaies, y compris les traitements dans les environnements à ressources limitées.
4. Spécifier le délai cible pour l'avancement du bord dans les plaies chroniques cicatrisables.
Introduction
Un cadre pour la préparation du lit de la plaie (PLP) a été introduit en 2000 pour mettre l'accent sur le traitement de la personne dans son ensemble comme fondement d'un traitement local optimal des plaies.1 Au fur et à mesure que ce cadre évoluait vers un cadre international, il est devenu évident que toutes les plaies n'étaient pas cicatrisables. Ces concepts de plaies chroniques et de plaies non cicatrisables ont conduit à des révisions des principes locaux de traitement des plaies et à l'expansion du PLP. L'importance des soins intégrés et coordonnés, avec des infirmières ou infirmiers, des médecins et des professionnels paramédicaux travaillant ensemble pour optimiser les résultats des soins aux patients et l'utilisation du système de santé, a été primordiale dans les développements ultérieurs du PLP.
Cet article se concentre sur l'application du cadre PLP à la prise en charge des plaies liées au pied, en particulier chez les personnes atteintes de diabète (diabétiques), les ulcères du pied neuropathiques liés à la lèpre et d'autres complications telles que la neuropathie et les maladies vasculaires. Plusieurs paramètres sont critiques pour les diabétiques, notamment un mauvais contrôle de la glycémie, des modifications de la tension artérielle, un taux de cholestérol élevé, une redistribution inadéquate de la pression plantaire, des infections et le manque d'exercice. Les effets du tabagisme sont également particulièrement préjudiciables pour sauver les membres et la vie des diabétiques.
Il est essentiel pour cet article de définir les environnements à ressources limitées, notamment la faible disponibilité des ressources, l'absence ou la limitation des financements, les environnements éloignés, isolés ou ruraux, ainsi que les populations autochtones. Ces termes se rapportent tous à des environnements de soins de santé qui peuvent avoir des difficultés à accéder aux fournitures, aux équipements, aux spécialistes et aux compétences et aptitudes avancées en matière de soins des plaies. Les environnements à faibles ressources peuvent être présents partout dans le monde et ne se limitent pas aux pays à faible revenu ou en développement.
Le processus Delphi qui sous-tend ce travail a permis d'élargir et de développer le cadre PLP dans son format actuel. Quarante et un auteurs issus de 15 pays ont participé au processus Delphi, qui s'est déroulé en deux tours, en utilisant une échelle de type Likert en quatre parties (1, tout à fait d'accord ; 2, d'accord ; 3, pas d'accord ; 4, pas du tout d'accord). La première série comprenait 29 déclarations. Bien que toutes les déclarations aient dépassé le niveau de consensus souhaité de 80 %, 299 commentaires ont été pris en compte par le groupe d'auteurs principal. Un rédacteur professionnel a été employé pour améliorer la compréhension et l'exactitude grammaticale des déclarations avant qu'un 2e tour Delphi ne soit déployé avec 32 déclarations construites. Toutes les déclarations ont dépassé le niveau de consensus de 88 %.
Lors du 2e tour, 14 déclarations ont fait l'objet d'un consensus à 100 %. Une déclaration s'est démarquée et a été classée "tout à fait d'accord" par tous les membres du panel Delphi : 10C. Établir une communication efficace et opportune avec le patient et tous les membres de l'équipe interprofessionnelle de traitement des plaies afin d'améliorer les résultats du système de santé en matière de plaies. Parallèlement, chacun des experts internationaux de la blessure a travaillé en groupe pour développer le contenu du manuscrit. Les déclarations de consensus figurent dans le tableau complémentaire 1 (http://links.lww.com/NSW/A176).
Le consensus visait à établir une norme minimale de soins fondée sur des données scientifiques et pouvant être optimisée en fonction des ressources disponibles. Le tableau 1 présente les 10 étapes clés et les 32 sous-énoncés pour les plaies dans les environnements à ressources limitées. Ce processus de consensus a permis d'actualiser le cadre PLP pour qu'il soit applicable indépendamment de la disponibilité des ressources. En outre, il inclut pour la première fois les concepts de trajectoires de cicatrisation et de changement du système de santé (Figure 1).
Le reste de ce rapport met en évidence les 10 déclarations de consensus et discute de la raison d'être de chacune d'entre elles.

Figure 1. Préparation du lit de la plaie 2024. ©WoundPedia 2023
Tableau 1. Préparation du lit de la plaie pour les plaies en dessous du genou dans des environnements où la disponibilité des ressources est limitée
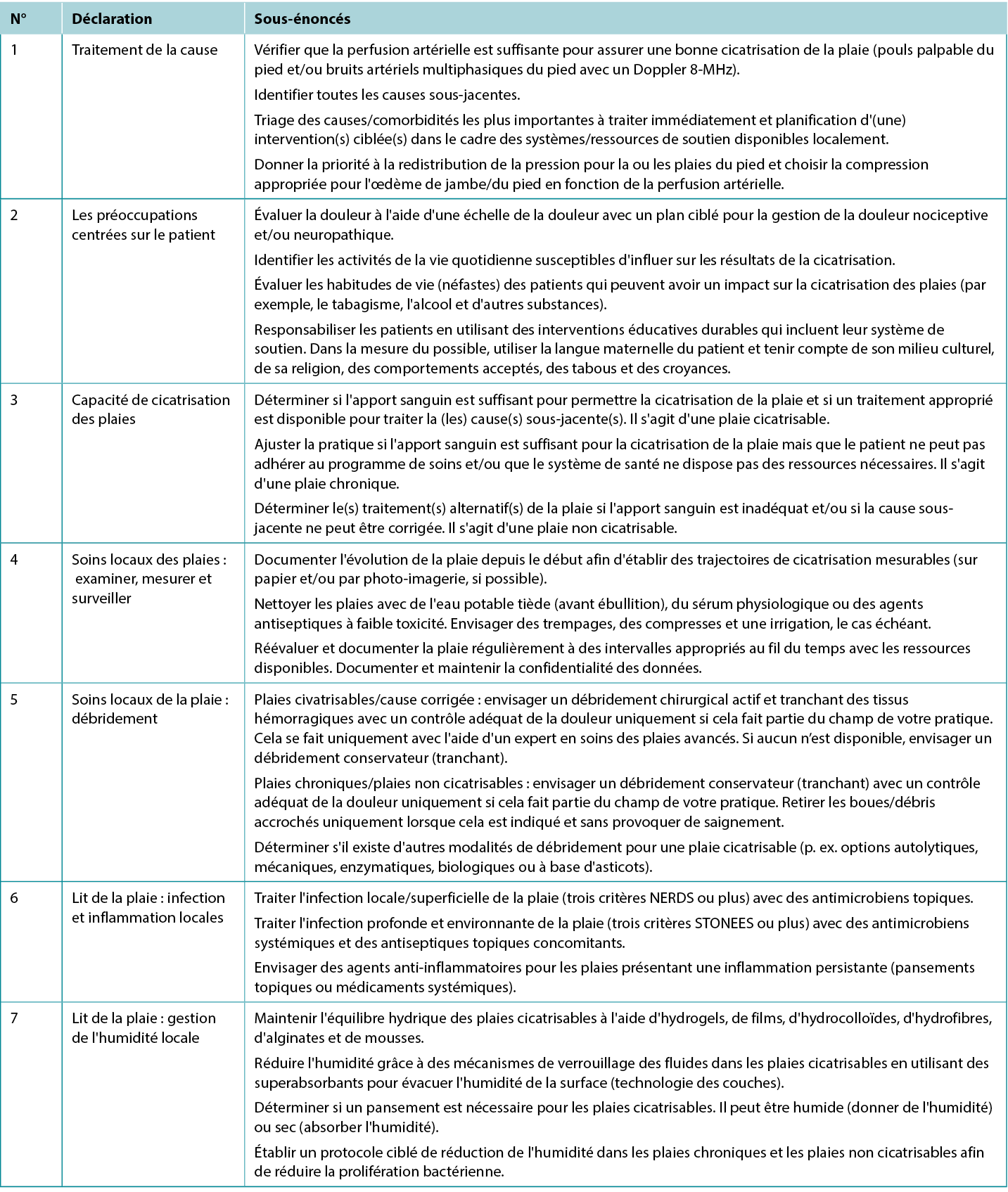

Déclaration 1 : traitement de la cause
1A. Vérifier que la perfusion artérielle est suffisante pour assurer une bonne cicatrisation de la plaie (pouls palpable du pied et/ou bruits artériels multiphasiques du pied avec un Doppler 8-MHz)
Pour déterminer la circulation sanguine dans les membres inférieurs, la première chose à faire est de trouver le(s) pouls(s) palpable(s) du pied. Commencer par les pouls du pédis dorsal et/ou du tibial postérieur. Si un Doppler portable de 8-MHz est disponible, confirmer les schémas de flux multiphasiques (biphasique/triphasique). S’adresser à un spécialiste des maladies vasculaires lorsqu’on observe un son Doppler monophasique ou absent ou que le pouls du pied n’est pas palpable. D'autres signes d'une perfusion artérielle insuffisante sont la douleur des membres inférieurs au repos et les modifications ischémiques des membres (extrémité froide avec rubéfaction dépendante qui blanchit à l'élévation).
Les personnes atteintes de diabète sont sujettes à des problèmes microvasculaires (neuropathie périphérique, altérations du pied de Charcot) et à des complications macrovasculaires, notamment la maladie artérielle périphérique (MAP). Ces conditions contribuent à l'apparition de callosités, d'ulcères du pied et d'une perte de tissus mixtes. Étant donné que jusqu'à 50 % des populations sensibles présentent à la fois un diabète et une MAP,2 il est essentiel d'identifier rapidement la MAP (à l'aide d'un examen physique et de tests vasculaires), car il s'agit d'un facteur de risque majeur de mauvaise cicatrisation des ulcères et d'amputation. Si elle est détectée, une revascularisation immédiate (angioplastie ou pontage vasculaire) est essentielle pour rétablir un flux artériel adéquat dans le pied. Une évaluation supplémentaire peut inclure le temps de remplissage capillaire, un test de blanchiment de Buerger (pâleur à l'élévation, rubéfaction rouge vif à la dépendance) et une claudication à la marche.
Examen vasculaire. En cas d'insuffisance artérielle, l'extrémité est souvent froide au toucher en raison d'un apport insuffisant en nutriments et en oxygène (Tableau 2). Dans les cas sévères, la nécrose tissulaire peut se manifester sous la forme d'ulcères, de tissus des orteils macérés (souvent avec une infection secondaire), de fissures ou de gangrène. D'autres indicateurs de cas sévères comprennent la pâleur lors de l'élévation de la jambe, la claudication induite par l'exercice qui disparaît avec le repos, la cyanose ou la rubéfaction dépendante et l'atrophie musculaire. Notamment, l'œdème des membres inférieurs est plus révélateur de problèmes veineux qu'artériels. Les lésions artérielles sont généralement perforées, avec une base profonde qui contient souvent des tendons, tandis que les ulcères veineux présentent une morphologie de bord irrégulière avec une base de tissu de granulation peu profonde.3
Tableau 2. L'apport vasculaire nécessaire à la cicatrisation des tissus
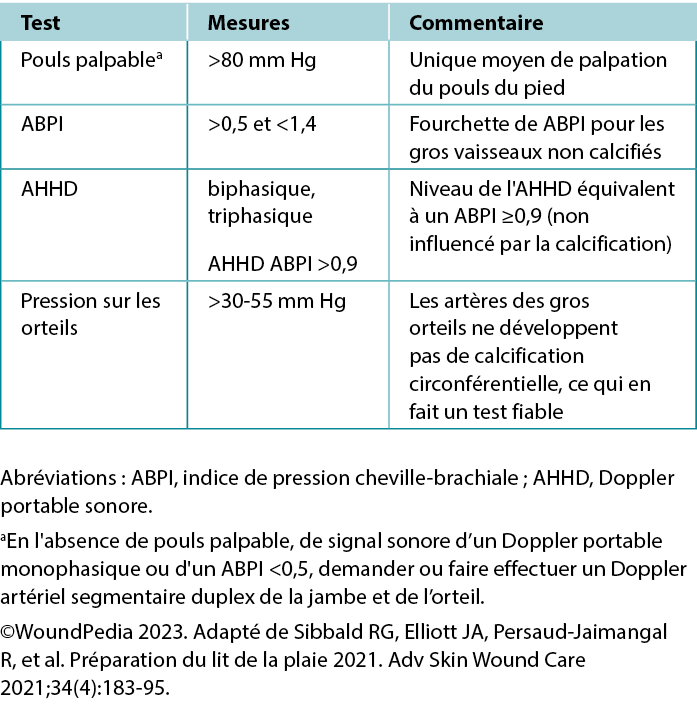
Examen de l'indice de pression cheville-brachiale (ABPI). L'ABPI mesure le rapport entre la tension systolique de la cheville et la tension systolique brachiale à l'aide d'un Doppler 8-MHz. La procédure consiste à utiliser un brassard et à enregistrer la tension systolique lorsque les bruits artériels réapparaissent après le gonflage du brassard. Cependant, des facteurs tels que l'œdème, l'inflammation et la calcification artérielle peuvent affecter sa précision. S'il n'est pas possible de se procurer un Doppler 8 MHz, l'orientation rapide vers un centre d'évaluation tertiaire devient la priorité dans les cas où les pouls du pied sont absents. Dans certains contextes de soins de santé, l'ABPI est toujours requis comme évaluation de la quantification vitale avant d'entamer toute intervention sur les membres inférieurs.
Examen Doppler sonore portable (HAD). Un HAD peut facilement être ajoutée comme paramètre supplémentaire dans certains contextes, si les prestataires choisissent un test plus simple et plus rapide (non influencé par la calcification, sans besoin de presser un mollet douloureux, et sans besoin d'être allongé pendant 20 minutes). L'évaluation de l’HAD peut également fournir des résultats précis en cas d'amputation du gros orteil et être enregistrée sous forme de fichier MP3 ou MP4 et transférée pour une vérification à distance de l'interprétation du signal.
Les professionnels de la santé doivent appliquer le gel sur les sites de pouls du pied appropriés à l'aide d'une sonde Doppler de 8 MHz placée à un angle de 45° par rapport à la peau sur les artères pédieuse dorsale, tibiale postérieure et péronière. Les signaux/formes d'ondes Doppler acquis peuvent ensuite être analysés (soit par un son audible, soit par des tracés visuels) : Un tutoriel complet sur la procédure HAD est disponible en ligne à l'adresse suivante : https://journals.lww.com/aswcjournal/Pages/videogallery.aspx?videoId=20. Optimiser la qualité du signal en repositionnant soigneusement la sonde pour obtenir le signal le plus fort ou le plus multiphasique.
Une forme d'onde monophasique ou absente justifie une évaluation vasculaire complète, y compris un Doppler artériel segmentaire Duplex de la jambe inférieure au laboratoire vasculaire. Une forme d'onde multiphasique indique généralement l'absence de maladie vasculaire périphérique.4 Chez les diabétiques, interpréter le rapport ABPI avec prudence (en raison de l'artériosclérose ou de la calcification artérielle) ; les résultats multiphasiques de l'HAD sont un choix préférable pour confirmer l'apport sanguin adéquat pour la cicatrisation de la plaie. Une forme d'onde multiphasique (biphasique, triphasique) suggère une valeur d'HAD équivalente à un ABPI normal ≥0,9.
Bien que l'HAD soit efficace pour exclure une maladie artérielle, elle peut ne pas identifier les déficits de perfusion segmentaires existants - îlots d'ischémie ou défauts d'angiosomes.5 Par conséquent, l'examen physique du pied et des membres inférieurs est vital pour un diagnostic concluant. Les professionnels de santé peuvent enregistrer les signaux de l’HAD et les transmettre à des spécialistes, facilitant ainsi les évaluations synchrones ou asynchrones à distance. Les évaluations synchrones permettent d'impliquer le patient en temps réel et de prendre des décisions rapides.
Insuffisance veineuse chronique. L'insuffisance veineuse chronique peut coexister chez les diabétiques et celles souffrant d'ulcères du pied. Elle affecte principalement les membres inférieurs et entrave le retour du sang désoxygéné vers le cœur et les poumons. Cette affection résulte souvent d'un dysfonctionnement des valvules veineuses qui peut être déclenché par des facteurs tels que la grossesse ou la prise de poids. Les symptômes les plus courants sont les varices, l'œdème, la décoloration de la peau due à l'hémosidérine, la lipodermatosclérose et les ulcères veineux.6 Ces ulcères peuvent être de toutes tailles (de petits à circonférentiels) et se forment rapidement sur les zones d'accumulation veineuse, généralement sur les faces médiales des membres inférieurs.
La pierre angulaire du traitement des ulcères veineux est le traitement par compression. Cela compense le dysfonctionnement des valvules en améliorant l'action péristaltique de la pompe du muscle du mollet. Les mesures supplémentaires comprennent l'élévation des jambes et la marche. Les procédures ablatives veineuses peuvent être envisagées lorsque les ulcères sont attribués aux veines superficielles. Un œdème veineux non traité peut retarder la cicatrisation d'un ulcère du pied.7
Pour l'optimisation médicale de la MAP, les stratégies clés comprennent un contrôle optimal de la tension artérielle, la mise en place d'un traitement anti-cholestérol et, souvent, l'instauration d'un traitement par statines. Des études récentes recommandent également de traiter les patients souffrant de MAP et d'une maladie coronarienne ou carotidienne concomitante en associant de l'aspirine à faible dose (91-100 mg PO par jour) et du rivaroxaban à faible dose (2,5 mg PO BID).8 Les autres facteurs modifiables sont le sevrage tabagique et les programmes de marche ou d'exercice physique. Pour les patients souffrant d'un ulcère du pied (en particulier chez les diabétiques), une redistribution ou une décharge appropriée de la pression plantaire est essentielle.
1B. Identifier toutes les causes sous-jacentes
Les complications liées aux pieds sont très préoccupantes pour les diabétiques et représentent une charge de morbidité importante pour les systèmes de santé. L'approche holistique est représentée par la formule mnémotechnique ÉIP (évaluation, identification, prise en charge) et se concentre sur le traitement ou l'atténuation des lcauses sous-jacentes des problèmes du pied diabétique, en particulier la neuropathie. L'application d'une approche d'évaluation ciblée en tant que norme des soins de base (VIPS : vasculaire, infection, pression, débridement chirurgical) est cruciale pour prévenir les complications graves, notamment les ulcérations du pied, les amputations des membres inférieurs et une incidence accrue des décès précoces/évitables. Parmi les éléments essentiels liés au pied dans les environnements à ressources limitées, on peut citer les présentations tardives aux soins formels, les diagnostics tardifs,9 la marche pieds nus, les plaies négligées et l'absence de soins préventifs du pied. Une analyse observationnelle en milieu hospitalier réalisée en Éthiopie a identifié plusieurs facteurs contribuant aux complications du pied diabétique10: humidité élevée, déformation du pied, neuropathie, ulcères actifs non identifiés, chaussures inadéquates ou mal adaptées, mauvaise hygiène du pied (par exemple, mycose du pied et des ongles des orteils) et manque de sensibilisation aux soins du pied. Une revue systématique sur les ulcères plantaires chez les patients atteints de lèpre (n = 7 études) a identifié les facteurs de risque suivants pour le développement d'ulcères : incapacité à sentir un monofilament de 10 g lors d'un test sensoriel, déformations graves du pied ou hyperpronation, faible niveau d'éducation et chômage.11 Pour relever ces défis dans un environnement aux ressources limitées, il faut une approche sur plusieurs fronts qui peut inclure la formation des patients et des professionnels de santé, la détection précoce, l'accès aux soins, les programmes de chaussures adaptées et l'engagement de la communauté.
Les évaluations régulières et approfondies du pied comprennent la détection de la neuropathie (perte de sensation protectrice), des problèmes vasculaires (circulation sanguine mauvaise ou absente dans les membres inférieurs), des signes d'infection, des zones de forte pression (formation de callosités) et des frottements (ampoules, souvent avec des composants hémorragiques) afin de faciliter les interventions en temps opportun. L'outil de dépistage simplifié en 60 secondes peut être un précieux moyen d'évaluer rapidement, de segmenter et de suivre les patients en fonction de leur niveau de risque, sans coût important.12 Les patients ayant des antécédents d'ulcération, d'amputation, de chirurgie vasculaire périphérique ou de neuroarthropathie de Charcot présentent le risque le plus élevé de rupture cutanée et doivent faire l'objet d'une attention particulière pour prévenir l'ulcération et d'autres complications.
Pour détecter une infection, les critères NERDS (infection superficielle de la plaie : non-cicatrisation, exsudat, tissu de granulation rouge et friable, débris, odeur) ou STONEES (infection profonde et environnante de la plaie : augmentation de la taille, température supérieure de 3 °F, os [sonde à l'os], nouvelles zones de rupture, érythème >2, exsudat, odeur) ainsi que l'utilisation de la thermométrie infrarouge sans contact peuvent s'avérer utiles.13 Des températures élevées de 3 °F par rapport au membre opposé peuvent signaler une inflammation et un pied présentant un risque plus élevé d'ulcération.13 Un changement comparatif de 1,67 °C est difficile à mesurer cliniquement. Cette même constatation chez une personne souffrant d'un ulcère de la jambe ou du pied est huit fois plus susceptible de signifier une infection profonde et environnante lorsqu'elle est accompagnée d'au moins deux autres critères STONEES.13
Les patients atteints de neuropathie sans ulcère et présentant un pied chaud et gonflé pourraient souffrir d'une neuroarthropathie aiguë de Charcot. La thermométrie infrarouge est un outil d'évaluation précieux dans ce type de cas : un pied de Charcot aigu peut être de 8 à 15 °F plus chaud que l'image miroir du pied opposé. Ces patients ont besoin d'une anamnèse complète, d'un examen clinique et d'images radiographiques pour faciliter la détection précoce. Les autres mesures comprennent la mise en place d'un plâtre de contact total pour la stabilisation et une décharge complète de la pression plantaire à l'aide d'un fauteuil roulant afin de prévenir une détérioration osseuse plus importante et une amputation du membre inférieur (Tableau 3).
Tableau 3. Interventions de décharge pour une plaie plantaire diabétique/neuropathique28
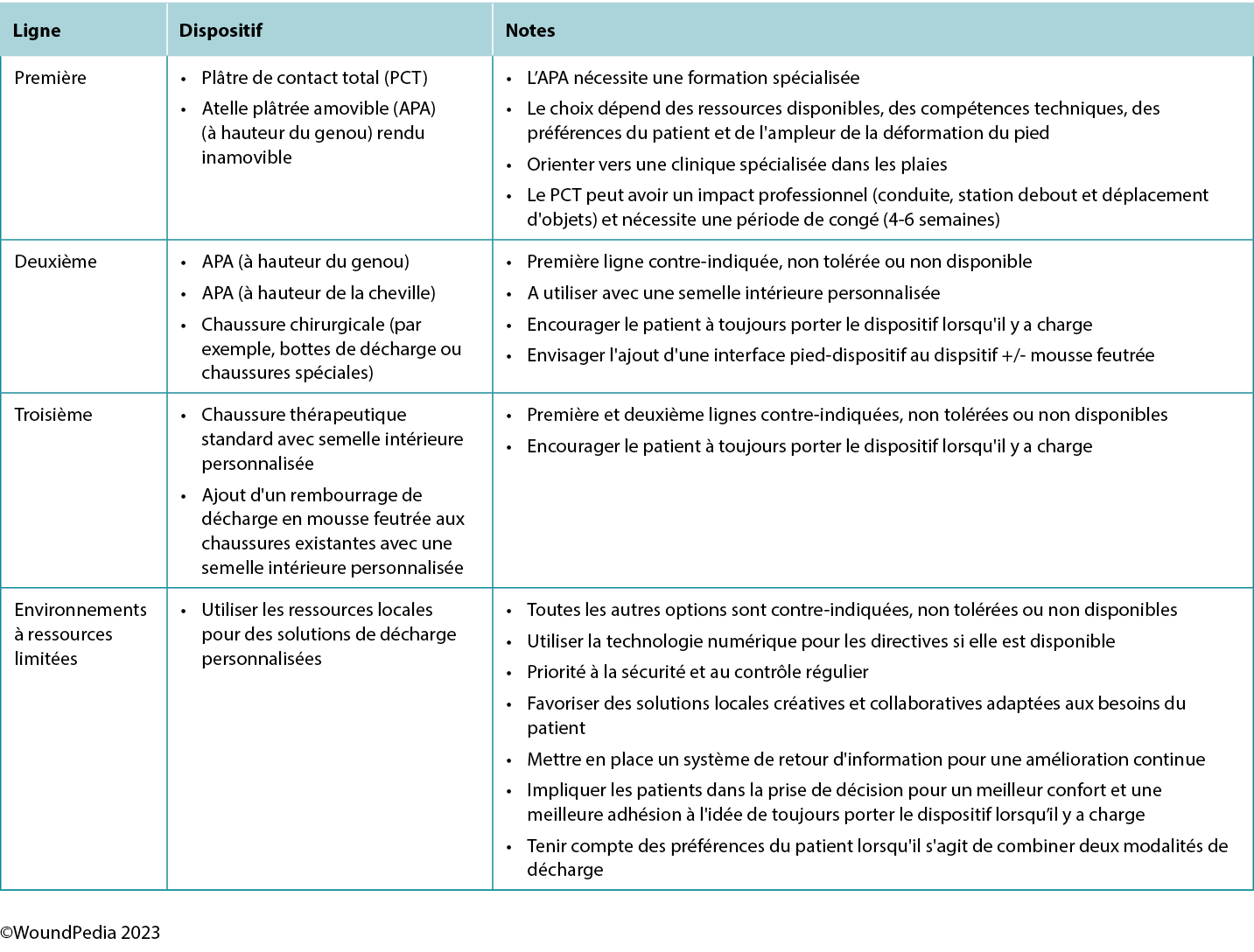
La formation de callosités chez les diabétiques est positivement corrélée à la pression et à la contrainte de cisaillement. Chez les personnes atteintes de neuropathie diabétique, divers facteurs tels que des déformations du pied, une mobilité limitée des articulations, une pression répétée pendant la marche et des chaussures mal adaptées peuvent augmenter le risque de formation de callosités.14 De plus, la présence de callosités peut constituer un risque important car les traumatismes répétés peuvent entraîner une hémorragie sous-cutanée et éventuellement évoluer vers une ulcération. Fournir des dispositifs de redistribution de la pression sur mesure (semelles souples, interventions de cordonniers pour adapter les chaussures et réduction de la marche pieds nus) afin de prévenir la progression ultérieure des callosités en ulcères.
Différentes causes étiologiques peuvent être à l'origine des ulcères du pied chez les diabétiques : neuropathiques en raison d'une neuropathie périphérique, ischémiques et MAP, ou une combinaison des deux- complications neuro-ischémiques du pied. La présence d'une neuropathie diabétique est établie sur la base des antécédents médicaux, de l'examen physique (test du monofilament de 5,07/10 g), d'une altération de la sensation répartie symétriquement dans les deux membres (stocking and glove distribution ) et d'une douleur de brûlure, de picotement, type coup de feu ou de poignard.
1C. Triage des causes/comorbidités les plus importantes à traiter immédiatement et conception d'(une) intervention(s) ciblée(s) dans le cadre des systèmes/ressources en appui disponibles localement
Un ulcère du pied diabétique (UPD) survient chez 25 à 34 % des personnes diabétiques et constitue l'une des complications les plus redoutées, pouvant entraîner l'amputation d'un membre inférieur, un handicap sévère et une réduction de l'espérance de vie.15 D'origine multifactorielle, la neuropathie périphérique liée au diabète et MAP rendent les pieds très vulnérables aux lésions traumatiques. L'accès à un diagnostic et à une intervention rapides sont des facteurs déterminants pour une prise en charge efficace et la préservation des membres.
L'hyperglycémie chronique mesurée par une élévation de l'hémoglobine A1c (HbA1c) est un facteur de risque majeur de neuropathie sensorielle, motrice et autonome. La MAP et la peau sèche augmentent la vulnérabilité du pied aux infections et retardent la cicatrisation, ce qui contribue à des résultats médiocres. Les maladies rénales chroniques augmentent le risque.16 Des études récentes sur la surveillance continue du glucose indiquent qu'une variabilité élevée du glucose (délai réduit pour atteindre les niveaux cibles) peut en outre contribuer aux complications à long terme.17
Jusqu'à 50 % des diabétiques développeront une neuropathie sans qu'aucun remède ne soit connu. La prise en charge comprend l'inspection quotidienne des pieds à la recherche de signes de traumatisme ou d'infection, les soins des pieds et un contrôle efficace de la glycémie.18 Outre la neuropathie, la MAP favorise également l'UPD ; la MAP est largement asymptomatique et peut rester sous-diagnostiquée et non traitée pendant une période prolongée. La prévalence de la MAP est plus de deux fois plus élevée chez les diabétiques que chez les non-diabétiques.19 Une revue systématique des études communautaires portant sur la prévalence globale et les facteurs de risque de la MAP a classé le diabète au premier rang, juste après le tabagisme.20
La Société européenne d'hypertension artérielle recommande aux prestataires de soins et aux patients de viser une tension systolique inférieure à 130 mm Hg et une tension diastolique inférieure à 80 mm Hg. Chez les personnes diabétiques, la tension systolique ne doit pas être inférieure à 120 mm Hg pour éviter une réduction du flux sanguin vers les organes vitaux et les membres inférieurs.21 Bien que les diurétiques, les inhibiteurs calciques, les inhibiteurs de l'enzyme de conversion de l'angiotensine, les antagonistes des récepteurs de l'angiotensine et les β-bloquants puissent tous être utilisés, les inhibiteurs de l'enzyme de conversion de l'angiotensine et les antagonistes des récepteurs de l'angiotensine réduisent les événements cardiovasculaires.22,23 Récemment, les inhibiteurs du SGLT2 ont montré d'excellents résultats dans l'amélioration de la glycémie, de la néphroprotection et des résultats cardiovasculaires.24 En outre, l'incidence de l'UPD est réduite par une détection précoce de la MAP et des modifications du mode de vie.17
La complexité de la prise en charge d'un UPD nécessite une approche d'équipe interprofessionnelle pour identifier les déterminants biologiques, sociaux, géographiques et culturels de la santé. Au Danemark, les personnes diabétiques sont enregistrées par région et ont accès à des cliniques spécialisées dotées d'équipes interprofessionnelles de traitement des plaies. Les taux d'amputation des membres inférieurs ont diminué de manière significative grâce à l'amélioration du traitement du diabète, à l'inspection régulière des pieds, à l'amélioration des soins personnels et au traitement en temps opportun.25 Dans les populations plus dispersées géographiquement (par exemple, en Ontario, au Canada), il existe des disparités significatives dans les taux d'amputation, surtout dans les régions rurales où la prévention en temps opportun, que permettraient une chirurgie de revascularisation et des spécialistes des soins du pied, est insuffisante ou absente.
Au Canada, les personnes les plus vulnérables aux amputations liées au pied diabétique sont les peuples indigènes, les immigrés et les personnes vivant dans les régions rurales et nordiques.26 Le Cercle de santé du diabète indigène (Indigenous Diabetes Health Circle) propose une approche adaptée à la culture des communautés locales des Premières nations de l'Ontario en matière de formation et de connaissances sur le diabète, le bien-être et les soins personnels. Son programme holistique de soins du pied permet un continuum de services qui relie les membres de la communauté aux organismes indigènes partenaires et aux professionnels de santé locaux, et il est prouvé qu'il réduit l'incidence de l'UPD et prévient l’amputation.27
1D. Donner la priorité à la redistribution de la pression pour la ou les plaies du pied et choisir la compression appropriée pour l'œdème de la jambe/du pied en fonction de la perfusion artérielle
La norme de référence pour les dispositifs de redistribution de la pression plantaire est le plâtre à contact total ou l’atelle amovible rendue inamovible.28 Même dans les systèmes de santé où ces modalités de décharge de la pression sont facilement disponibles, moins de 10 % des patients éligibles sont équipés et adhèrent à l'utilisation de ces dispositifs.29
Décharger la pression est essentielle à la guérison des ulcères du pied (Tableau 3). L'objectif est de sélectionner le meilleur dispositif pour le patient en tenant compte des préoccupations du patient, des objectifs de soins et des meilleures données probantes de la pratique. Envisager des solutions créatives pour réutiliser les matériaux locaux tels que les inserts en feutre doux pour décharger la pression dans les environnements à ressources limitées. Il est important d'établir un programme de surveillance précoce entre le patient et le professionnel de santé afin de contrôler et de garantir les résultats souhaités en matière de décharge de la pression. Les professionnels de santé doivent évaluer l'efficacité des dispositifs et apporter continuellement les modifications nécessaires dans le cadre d'un suivi établi. Dans les régions où il n'y a pas de praticiens spécialisés, le fait de donner aux professionnels de santé les compétences de base en matière de déchargement de la pression peut combler cette lacune.
Déclaration 2 : les préoccupations centrées sur le patient
2A. Évaluer la douleur à l'aide d'une échelle de la douleur avec un plan ciblé pour la prise en charge de la douleur nociceptive et/ou neuropathique
La perception de la douleur implique un stimulus qui peut être physique ou chimique. Il existe deux types principaux de douleur: la douleur nociceptive et la douleur neuropathique (Tableau 4). La douleur associée à la plaie est un élément important des préoccupations des patients qui est souvent sous-évalué par les professionnels de santé. À la fin des années 1990, les professionnels de santé se sont intéressés à la douleur associée aux plaies, avec le lancement d'un document de synthèse sur la douleur associée aux plaies.30 Ce document reconnaissait et mettait l'accent sur la détresse liée à la douleur chronique associée aux plaies et sur son influence sur la qualité de vie liée à la santé des patients. La prise en charge de la douleur associée à la plaie a ensuite été intégrée au cadre de la PLP.1,31
Tableau 4. Types de douleur et réponses30
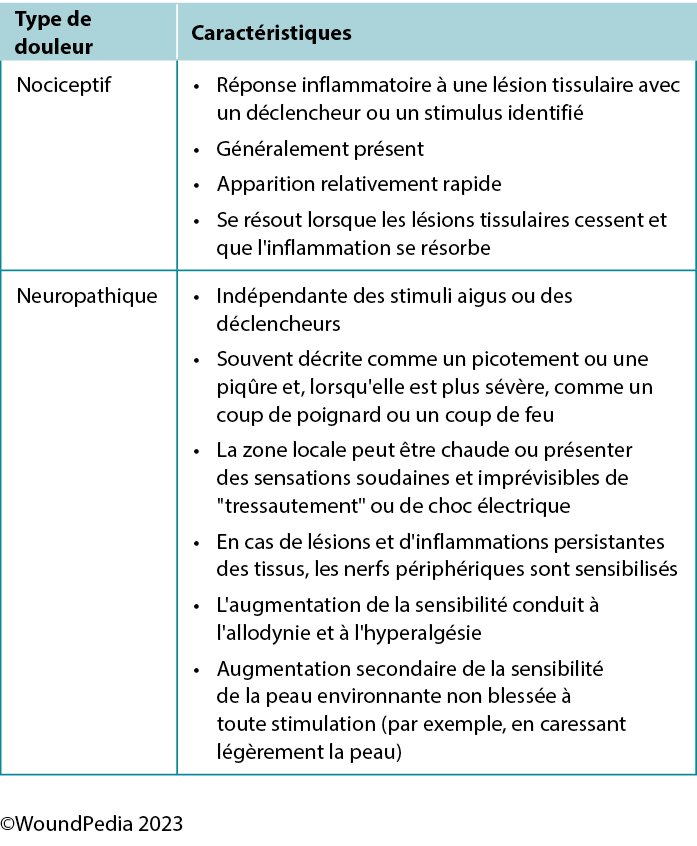
La douleur peut jouer un rôle important dans la prise en charge totale des personnes souffrant de plaies et dans le succès final de la cicatrisation.32 Les signaux de douleur associés aux plaies jouent un rôle important dans le bien-être du patient et, en tant que tels, doivent être reconnus par le biais d'une évaluation et d'une prise en charge adéquates. Par exemple, la douleur ou tout changement dans la douleur est un prédicteur clé de l'infection de la plaie et l'un des quatre signes cardinaux de l'inflammation.1 Une douleur non résolue est souvent associée à une fermeture tardive de la plaie.
Évaluation. L'anamnèse de la douleur est essentielle à la prise en charge de la douleur associée à la plaie.32 L'évaluation doit porter sur la nature, l'apparition, la durée et les facteurs d'exacerbation et de soulagement de la douleur. Cela permettra de déterminer la cause de la douleur et d'orienter sa prise en charge. L'intensité de la douleur peut être mesurée de manière fiable à l'aide d'échelles de douleur validées. Une échelle d'évaluation numérique de 0 à 10 points administrée verbalement est un bon premier choix pour mesurer l'intensité numérique de la douleur.
La plupart des patients peuvent vivre avec un niveau de douleur de 3 à 4 sur 10.33
Les patients souffrant de douleurs persistantes doivent être réévalués régulièrement pour vérifier l'amélioration, la détérioration et leur adhésion aux traitements médicamenteux. L'utilisation d'un journal de la douleur avec des entrées concernant l'intensité de la douleur, les médicaments utilisés, l'humeur et la réponse au traitement peut être une bonne stratégie de prise en charge. Pour les personnes ayant des difficultés de communication, l'échelle de douleur doit comporter des images pour faciliter la reconnaissance.
Prise en charge. La prise en charge de la douleur associée à la plaie peut être intégrée au cadre de la PLP : traiter la cause et prendre en compte les facteurs locaux de la plaie et les préoccupations du patient.3 Le traitement de la cause devrait permettre de déterminer le diagnostic correct et d'initier le traitement de la douleur associée à la plaie. Les préoccupations centrées sur le patient doivent être axées sur ce que le patient considère comme les principales raisons et résolutions de sa douleur. La douleur et la souffrance anticipées par le patient peuvent être tout aussi perturbantes pour la qualité de vie que l'expérience réelle de la douleur.
Il existe de multiples stratégies de prise en charge de la douleur qui ne sont pas toujours pharmaceutiques (Tableau 5). Condidérer la prise en charge totale du patient, y compris tous les aspects de la PLP, dans le choix d'une stratégie de prise en charge. Garder à l’esprit que la douleur est ce que le patient dit qu'elle est.34
Tableau 5. Stratégies de prise en charge de la douleur
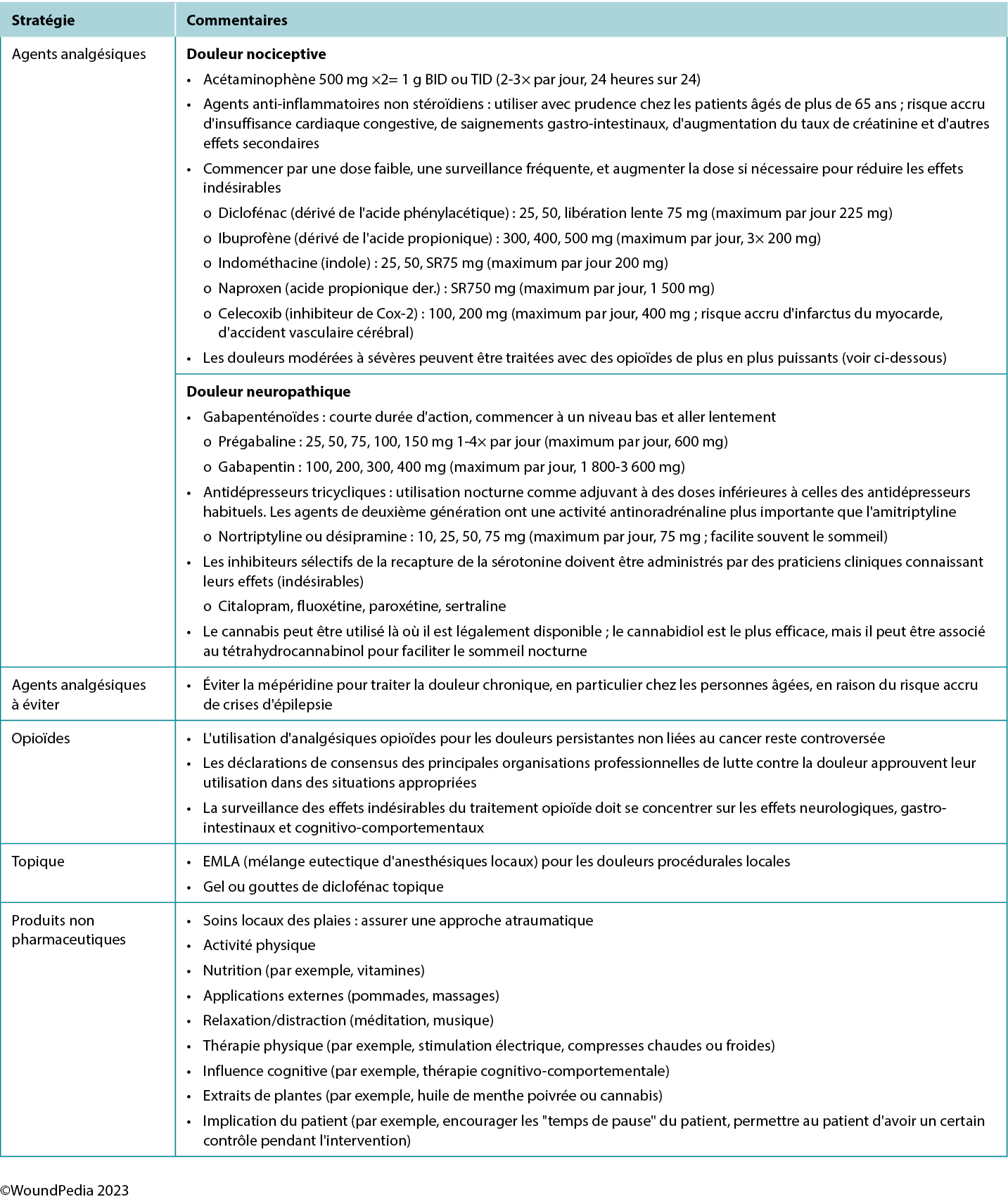
Évaluation et prise en charge compte-tenu des ressources limitées. Dans les régions aux ressources limitées, l'évaluation reste possible car elle ne nécessite pas d'outils coûteux. La plupart des échelles de douleur sont disponibles gratuitement, malgré un certain coût initial lié à la formation des praticiens.31 Les options de traitement de la douleur dans les environnements à ressources limitées peuvent être plus pratiques si elles s'appuient sur des méthodes non pharmacologiques (Tableau 5). Certaines de ces options peuvent également être plus acceptables socialement ou déjà pratiquées culturellement (par exemple, la méditation, les traitements à base de plantes) et particulièrement applicables à la prise en charge de la douleur nociceptive. La mise en œuvre de ces stratégies peut alors préserver la prise en charge pharmaceutique pour les personnes souffrant de douleurs qui ne peuvent pas être gérées par des moyens non pharmacologiques (par exemple, les douleurs neuropathiques).35
2B. Identifier les activités de la vie quotidienne susceptibles d'influer sur les résultats de la cicatrisation
2C. Évaluer les habitudes de vie (néfastes) des patients qui peuvent avoir un impact sur la cicatrisation des plaies (par exemple, le tabagisme, l'alcool et d'autres substances)
2D. Responsabiliser les patients en utilisant des interventions éducatives durables qui incluent leur système de soutien. Dans la mesure du possible, utiliser la langue maternelle du patient et tenir compte de son contexte culturel, de sa religion, des comportements acceptés, des tabous et des croyances
Dans les environnements aux ressources limitées, les préoccupations centrées sur le patient et les obstacles aux résultats cliniques sont essentielles pour que les prestataires les comprennent et les abordent dans le contexte des croyances culturelles, spirituelles et religieuses de la communauté concernée.
Les disparités en matière de cicatrisation des plaies existent parmi les populations indigènes du monde entier. Ces disparités sont souvent dues à des facteurs socio-économiques, culturels et sanitaires aussi bien historiques qu’actuels. La diversité culturelle et la pression sociale dictent également souvent les processus institutionnels d'allocation des ressources à certains secteurs de la santé. Parmi les principaux obstacles à la cicatrisation des plaies chez les populations indigènes figurent les traumatismes historiques, les disparités socio-économiques, l'accès limité aux soins de santé, les barrières culturelles, les maladies chroniques, les pratiques culturelles de cicatrisation, l'isolement géographique et les biais du système de santé.36 De nombreuses cultures ont un système d'honneur dans la prise en charge de leurs membres âgés malades, ou souffrant de maladies chroniques. Ces principes sont plus facilement respectés si des ressources suffisantes sont disponibles pour les maintenir.
De nombreuses études ont identifié une maladie grave comme l'une des principales raisons pour lesquelles une famille peut contracter des dettes importantes.37,38 Même dans les cliniques gérées par le gouvernement, des pansements ou des médicaments supplémentaires peuvent être facturés à la famille. Les patients et les membres de leur famille peuvent donc avoir recours à des méthodes de traitement alternatives (médecine non allopathique) auprès de guérisseurs locaux/indigènes/traditionnels. Bien que souvent moins coûteux, ces guérisseurs n'ont pas toujours les compétences ou l'expertise nécessaires pour gérer les plaies chroniques, ce qui entraîne leur détérioration.
La perte de mobilité autonome due à la chronicité de la plaie est un autre facteur important qui influe sur l'assiduité et la régularité du suivi. La disponibilité des transports varie dans les environnements à ressources limitées, et la marche peut être le seul moyen d'accéder à un point de ramassage des transports publics. Les environnements ruraux isolés sont souvent les plus touchés et nécessitent de parcourir de longues distances pour atteindre un centre de soins institutionnel.
La santé sociale de l'environnement familial et la volonté d'intégrer une personne ayant des besoins en matière de soins de santé peuvent déterminer la qualité des soins et des soins personnels, ainsi que la sécurité des patients dans un environnement domestique. En raison de la structure sociale et du milieu dans les différents pays, le soutien familial et le soutien social peuvent varier d'une culture à l'autre. Souvent, avec le temps, la charge financière augmente ; l'autonomie du patient et l’accomplissement des activités de la vie quotidienne (AVQ) se détériorent ; les changements de pansements deviennent plus difficiles ; et les aidants deviennent stressés, fatigués et épuisés.39 Une orientation tardive vers des soins institutionnels et l'état critique/terminal du patient lorsqu'il se présente finalement sont des facteurs sociaux et comportementaux aggravants supplémentaires qui peuvent participer aux mauvais résultats de la cicatrisation des plaies.
Les personnes dont les plaies sont traitées à domicile ont besoin d'un espace qui leur est réservé. L'odeur de la plaie, la douleur persistante et une routine différente sont les principaux facteurs de stress pour le patient et sa famille dans les environnements où l'espace est limité. La simple présence d'une plaie cutanée importante a déjà un impact négatif sur les interactions sociales, les relations personnelles, la sexualité et la confiance en soi du patient. Il en résulte une anxiété et une dépression progressives qui peuvent entraîner un pessimisme à l'égard des bénfices perçus du traitement. Par la suite, les patients souffrent d'une baisse d'efficacité personnelle qui est souvent associée à une détérioration plus importante de la plaie, voire à une amputation du membre inférieur.40
Le véritable défi se pose lorsque le mode de vie requiert des modifications. Cela nécessite souvent des ressources supplémentaires ou une formation sur mesure pour élaborer un programme de soins personnels.40,41 On ne saurait trop insister sur la nécessité de justifier clairement les interventions en matière d'éducation à la santé et de modification du mode de vie. Les interventions sur le mode de vie peuvent devenir un défi financier, social et logistique, d'abord pour les intégrer et ensuite pour les maintenir dans un domaine de vie limité. En outre, il s'agit d'une étape essentielle pour garantir que toute aide financière reçue est correctement attribuée au membre de la famille souffrant d'une plaie.
Une approche biopsychosociale est nécessaire pour gérer le traitement des plaies chez les patients dans les environnements à ressources limitées. L'équipe de soins de la plaie, au-delà de la prise en charge de la plaie, doit s'occuper des facteurs de stress sociaux qui affectent le patient. Chaque patient aura besoin d'un programme de prise en charge unique, convenu d'un commun accord et adapté à ses contraintes (médicales, financières, familiales, sociales et émotionnelles).40
Déclaration 3 : la capacité de cicatriser
3A. Plaie cicatrisable : Déterminer si l'apport sanguin est suffisant pour permettre la cicatrisation de la plaie et si un traitement approprié est disponible pour traiter la ou les causes sous-jacentes
3B. Plaie chronique : Adapter la pratique si l'apport sanguin est suffisant pour la cicatrisation de la plaie mais que le patient ne peut pas adhérer au plan de soins et/ou que le système de santé ne dispose pas des ressources nécessaires
3C. Plaie non cicatrisable : Déterminer le(s) traitement(s) alternatif(s) de la plaie si l'apport sanguin est insuffisant et/ou si la cause sous-jacente ne peut être corrigée
Le processus de détermination de la classification de la cicatrisation d'une plaie commence par un examen approfondi des antécédents et de l'état physique du patient. Il est important d'identifier la ou les causes sous-jacentes de la plaie. S'attaquer à la (aux) cause(s) sous-jacente(s) est la première étape de l'élaboration d'un programme de prise en charge réalisable.
Dans certains cas, les plaies chroniques peuvent également se bloquer et ne pas atteindre l'avancement des bords de la plaie dans le délai imparti ; il s'agit alors de plaies difficiles à cicatriser. Elles entrent souvent dans la catégorie des plaies chroniques mais, avec une évaluation supplémentaire, elles peuvent s’avérer cicatrisables par une réévaluation du patient, de ses antécédents, des causes et du protocole de soins.3,42
Les préoccupations et les attentes du patient doivent être identifiées, comparées et alignées sur la disponibilité des ressources institutionnelles/cliniques, les compétences et les options d'intervention immédiate disponibles.3,42 Le programme de prise en charge est basé sur la classification de cicatrisation attribuée, qui peut changer.
Protéger les plaies non cicatrisables contre la perte de tissu, l'infection profonde et environnante de la plaie et la détérioration générale due à l'environnement humide de la plaie. La réduction de l'humidité est une priorité. Les plaies chroniques doivent également être protégées contre d'autres pertes de tissus, avec un maintient du lit de la plaie au sec et des contrôles de l'infection locale comme bases. La protection des tissus peut également être une mesure temporaire jusqu'à ce que des ressources soient disponibles et que d'autres facteurs liés au patient soient contrôlés pour parvenir à une optimisation complète.
Les plaies bloquées mais cicatrisables (difficiles à guérir) ont besoin d'une seconde chance pour atteindre l’avancement du bord, l'urgence de la réévaluation et l'intervention de l'équipe interprofessionnelle étant les priorités absolues.3,42
Déclaration 4 : le traitement local des plaies : examiner, mesurer et contrôler
4A. Documenter l'évolution de la plaie depuis le début afin d'établir des trajectoires de cicatrisation mesurables (sur papier et/ou par photo-imagerie, si possible).
4B. Nettoyer les plaies avec de l'eau potable tiède (avant ébullition), du sérum physiologique ou des agents antiseptiques à faible toxicité. Envisager des trempages, des compresses et une irrigation, le cas échéant.
4C. Réévaluer et documenter la plaie régulièrement à des intervalles appropriés au fil du temps avec les ressources disponibles. Documenter et maintenir la confidentialité des données.
La documentation relative à l'évaluation des plaies fait partie intégrante de la pratique des soins de santé. Elle joue un rôle essentiel dans la prestation de soins de haute qualité aux patients, dans le suivi de l'état des plaies et dans l'orientation des changements à apporter aux interventions sur les plaies. L'enregistrement complet et précis de l'évaluation des plaies est essentiel pour garantir l'amélioration des résultats pour les patients, une communication efficace entre les professionnels de santé et le respect des lois et des réglementations.43
Suivi des progrès. La documentation relative à l'évaluation de la plaie sert d'historique de l'évolution de la plaie au fil du temps. En documentant régulièrement les caractéristiques de la plaie (taille, profondeur, couleur, exsudat, infection, type de tissu, etc.), les professionnels de santé peuvent suivre les changements, identifier les complications potentielles et ajuster le protocole de soins Si la documentation photographique est utilisée, il convient d'obtenir le consentement du patient conformément à la politique de l'organisme, de garantir une technique appropriée avec un éclairage adéquat et une distance appropriée par rapport à la plaie, et d'inclure un guide de mesure dans la photo.44 Cette évaluation continue est essentielle pour évaluer l'efficacité des interventions et prendre des décisions éclairées concernant la prise en charge de la plaie. Lors de la mesure de la surface ou du volume, il est impératif d'utiliser une technique cohérente, quelle que soit la technologie utilisée.
Communication. Une évaluation précise de la plaie facilite une communication efficace entre les professionnels de santé. Lorsque tous les membres de l'équipe ont accès à une documentation cohérente et actualisée sur la plaie, ils peuvent travailler ensemble à l'élaboration et à la mise en œuvre d'un protocole de soins coordonné, garantissant ainsi au patient le meilleur traitement possible. Il est essentiel d'utiliser une terminologie cohérente et commune à toutes les disciplines. Le système de classification médicale Classification internationale des maladies est un exemple de norme applicable à l'échelle mondiale.45
Conformité juridique et réglementaire. Une évaluation et une documentation correctes de la plaie sont essentielles pour répondre aux exigences légales et réglementaires. Des dossiers inexacts ou incomplets peuvent entraîner des problèmes juridiques et avoir un impact négatif sur la pratique des professionnels de santé, même dans des environnements aux ressources limitées.
Remboursement. Dans de nombreux systèmes de santé, la documentation de l'évaluation des plaies est liée à des modèles de financement basés sur le remboursement. Des dossiers précis et détaillés sont souvent nécessaires pour justifier l'utilisation de produits ou de procédures spécifiques de traitement des plaies et pour s'assurer que les organismes reçoivent un remboursement adéquat pour les services rendus.
Recherche et amélioration de la qualité. Les données relatives à l'évaluation des plaies constituent une ressource précieuse pour la recherche et les initiatives d'amélioration de la qualité. Ce processus d'apprentissage continu contribue à améliorer les soins des plaies et les résultats pour les patients à l'échelle mondiale.
Soins centrés sur le patient. Une évaluation et une documentation correctes de la plaie sont un élément essentiel des soins centrés sur le patient. Il garantit que l’état des patients est évalué de manière approfondie et que leurs protocoles de soins sont adaptés à leurs besoins spécifiques. Lorsque les patients constatent que leur prestataire de soins de santé s'engage à documenter et à surveiller leur plaie, la confiance et la satisfaction des patients s'en trouvent renforcées.
Pour promouvoir la cohérence de la terminologie et améliorer la clarté des données, un nombre croissant d'entreprises créent des logiciels et des applications électroniques d'évaluation des plaies afin de réduire le temps nécessaire à une documentation complète.43 Ces programmes et applications (certains plus abordables que d'autres) peuvent fournir à l'équipe soignante un ensemble structuré de paramètres permettant de s'assurer que toutes les caractéristiques cliniques sont documentées, améliorant ainsi la communication générale.46 Bien que ces outils soient un atout pour les professionnels de santé, ils ne sont pas sans risques, tels que les copier-coller incorrects à partir de rapports / notes de consultation antérieurs ou les risques liés à la sécurité des données des patients. Dans les régions où ces programmes et applications ne sont pas disponibles, mettre à jour le dossier du patient et fournir des programmes d'évaluation et d'intervention écrits peut être justifié.
Déclaration 5 : le traitement local des plaies : debridement
5A. Plaie cicatrisable/cause corrigée : Envisager un débridement chirurgical actif et tranchant des tissus hémorragiques avec un contrôle adéquat de la douleur uniquement si cela fait partie du champ de votre pratique. Cela se fait uniquement avec l'aide d'un expert en soins des plaies avancés. S'il n'y a pas d’expert disponible, envisager un débridement conservateur (tranchant)
5B. Plaies chroniques/plaies non cicatrisables : Envisager un débridement conservateur (tranchant) avec un contrôle adéquat de la douleur uniquement si cela entre dans le champ de votre pratique. Ne retirer les boues/débris pendants que lorsque cela est indiqué et sans provoquer de saignement
5C. Déterminer s'il existe d'autres modalités de débridement pour les plaies cicatrisables (p. ex. options autolytiques, mécaniques, enzymatiques et biologiques)
Le débridement est un processus important dans le paradigme PLP pour éliminer les tissus nécrotiques et autres biomatériaux, y compris le biofilm, dans les plaies cicatrisables et pour prévenir les odeurs et l'infection dans les plaies chroniques. Pour toutes les plaies situées sous le genou, communiquer les résultats de tout test vasculaire (p. ex. ABPI, forme d'onde) à tous les membres de l'équipe interprofessionnelle et documenter en conséquence avant de tenter un débridement, car de nombreux types peuvent être délétères pour le lit de la plaie avec un apport vasculaire réduit.
Pour les plaies cicatrisables, les interventions locales sur le lit de la plaie sont mieux déterminées par le paradigme PLP en fonction des caractéristiques du patient et de la plaie. Envisager le débridement chirurgical (jusqu'au saignement des tissus) comme intervention de première intention. Cependant, dans de nombreuses régions rurales et isolées, il n'est pas toujours possible d'avoir accès à un professionnel de santé qualifié disposant de la formation, des connaissances et du jugement nécessaires pour cette procédure.
Le débridement conservateur (tranchant) (sans saignement) nécessite des connaissances et des compétences avancées et convient mieux aux soins non aigus ou aux cliniques spécialisées. Ne retirer de la plaie que les débris pendants ou non fixés, sans traumatiser le lit de la plaie.
Le débridement clinique stérile au moyen d’asticots est une modalité de traitement limitée dans les environnements à ressources restreintes, sauf en cas d'exposition accidentelle. L'infestation par les asticots est souvent découverte lors du changement de pansement. Le traitement accidentel par asticots peut donner de bons résultats en matière de débridement, en particulier si les larves proviennent de la source très sélective des mouches Lucilia sericata/cuprina , car elles se concentrent sur les tissus dévitalisés comme source de nourriture.47,48 Des résultats néfastes peuvent survenir si l'infestation provient de la mouche domestique ordinaire (Musca domestica)ou d'autres espèces envahissantes, car ces larves peuvent détruire sans discernement les tissus sains.47,48
Les professionnels de la santé doivent évaluer d'autres méthodes de débridement (par exemple, autolytique, enzymatique, mécanique) dans certaines communautés, y compris les soins primaires, les soins à domicile et les soins de longue durée. Dans la limite des ressources disponibles, il est essentiel de prendre en compte la sécurité du patient, d'évaluer les facteurs environnementaux et d'identifier les obstacles à la cicatrisation des plaies avant d'entamer le débridement.
Les protocoles de débridement appropriés pour les plaies chroniques et les plaies non cicatrisables diffèrent considérablement de ceux des plaies cicatrisables. Bien qu’un environnement humide soit optimal pour la cicatrisation, il s'agit d'une forme de débridement (autolytique) qui peut être préjudiciable aux plaies non cicatrisables et aux plaies chroniques. Le débridement n'est généralement pas une intervention appropriée pour les plaies chroniques stables ou non cicatrisables, car l'objectif est de les garder sèches et exemptes d'infection.49 N'envisager le débridement que lorsqu'une plaie chroniques ou non cicatrisable devient instable, afin d'éliminer les débris infectés ou nécrotiques de la manière la plus atraumatique possible.
Les objectifs du patient sont généralement d'améliorer son confort, de rduire l’ odeur associée à la plaie, de réduire la douleur et d'améliorer les activités quotidiennes. Le maintien de la plaie au sec permet la formation d'une couche protectrice, alors que le débridement comporte le risque d'enlever cette couche protectrice et d'introduire des organismes pathogènes.
Déclaration 6 : le traitement local des plaies : infection et inflammation
6A. Traiter l'infection locale/superficielle de la plaie (trois critères NERDS ou plus) à l'aide d'antimicrobiens topiques
6B. Traiter l'infection profonde et environnante de la plaie (trois critères STONEES ou plus) à l'aide d'antimicrobiens systémiques et d'antiseptiques topiques concomitants
6C. Envisager des agents anti-inflammatoires pour les plaies présentant une inflammation persistante (pansements topiques ou médicaments systémiques)
Les critères validés de NERDS et STONEES peuvent guider l'évaluation et le traitement de l'infection et de l'inflammation dans les plaies chroniques.50 Baser le diagnostic de l'infection sur les signes et symptômes cliniques plutôt que sur les prélèvements superficiels de la plaie, qui ne doivent être utilisés que pour guider la sélection des antimicrobiens en cas d'infection. Si l'on soupçonne une infection des tissus profonds et environnants, il faut identifier les espèces bactériennes et leur sensibilité aux agents antibactériens couramment utilisés afin d'orienter l'utilisation d'antimicrobiens systémiques. Cela est particulièrement vrai si une infection profonde et environnante ne répond pas au traitement empirique.
Les meilleurs échantillons de tissus pour les écouvillons de culture du lit de la plaie sont obtenus après avoir nettoyé la plaie avec de l'eau potable ou du sérum physiologique et prélevé le fond de la plaie sans débris. Une culture à partir d'échantillons de tissus prélevés à l'aide d'une curette ou d'une autre technique de biopsie a toutes les chances de représenter les organismes présents dans les tissus de la plaie. Par ailleurs, une technique d'écouvillonnage semi-quantitative utilisant la méthode de Levine permet d'établir une corrélation avec les biopsies tissulaires.51 L 'écouvillon est placé sur le tissu de granulation et pressé suffisamment pour extraire l'exsudat de la plaie, puis tourné à 360° pour couvrir toutes les surfaces de l'écouvillon. Le fait de placer l'écouvillon dans le milieu de transport pour le pré-humidifier avant de le placer sur la peau peut augmenter le rendement bactérien pour les patients dont les plaies sont peu exsudatives.52
Les bactéries pathogènes peuvent s'infiltrer dans l'os et provoquer une ostéomyélite, qui compromet le potentiel de cicatrisation et est difficile à soigner. Une biopsie osseuse est le critère de référence pour diagnostiquer une suspicion d'ostéomyélite, car les cultures superficielles ne permettent pas d'accéder au tissu osseux profond, et l'imagerie est limitée par une spécificité variable.53 Cependant, une biopsie osseuse peut être inconfortable, elle dépend de praticiens cliniques compétents et peut étendre les lésions tissulaires. Pour ces raisons, cette option n'est souvent pas envisageable, d'autant plus si les ressources sont limitées.
Lorsque l'infection profonde de la plaie est confirmée, les pansements antimicrobiens sont appropriés pour appuyer localement le traitement antibiotique systémique et empêcher la propagation des bactéries de surface dans le compartiment profond et environnant. Les cinq choix les plus courants de pansements antimicrobiens sont l'argent, le polyhexaméthylène biguanide, l'iode, le bleu de méthylène/violet cristallin et le miel. Parmi ceux-ci, l'argent et le miel ont des propriétés anti-inflammatoires supplémentaires.54
Dans certaines plaies, des antiseptiques à large spectre sont appliqués pour une réduction rapide et à court terme de la charge bactérienne afin de compléter les antibiotiques systémiques. Lorsque le risque d'infection l'emporte sur les propriétés cytotoxiques, une gaze bon marché humidifiée à la povidone iodée changée quotidiennement sur l'os exposé peut réduire les bactéries de surface. Il s'agit d'une stratégie à court terme accompagnée d'une évaluation clinique des taux sériques de la fonction thyroïdienne, en particulier lorsque la surface de la plaie est importante. Toutefois, grâce aux nouveaux antiseptiques à faible toxicité, d'autres options moins agressives mais tout aussi efficaces sont désormais disponibles.
En général, les plaies des patients immunocompétents qui durent depuis moins d'un mois sont traitées avec des agents de couverture à Gram positif. Les infections polymicrobiennes (typiquement observées chez les diabétiques) ou les plaies de plus d'un mois requièrent des agents à large spectre avec une couverture Gram positif, Gram négatif et anaérobie, car ces patients sont souvent immunodéprimés.55
Les agents cytotoxiques peuvent être appropriés pour les plaies non cicatrisables si le besoin d'une action antimicrobienne topique est supérieur à la toxicité tissulaire. Les antiseptiques sont généralement préférés aux antibiotiques topiques dans le cadre de la gestion des antibiotiques en raison d'un risque plus faible de résistance bactérienne systémique et d'effets indésirables associés à une dermatite de contact irritante ou allergique.54
6D. Nettoyer délicatement la plaie avec des solutions peu toxiques (eau, sérum physiologique, agents antiseptiques non cytotoxiques).
La solution de nettoyage utilisée dépend des caractéristiques de la plaie et de sa disponibilité dans la pratique. Les recommandations relatives au nettoyage des plaies ne font pas l'objet d'un consensus dans la littérature. Une revue Cochrane mise à jour en 2021 sur les solutions de nettoyage des ulcères de jambe veineux a conclu qu'il y avait un manque de données probantes issues d'essais contrôlés randomisés "pour guider la prise de décision sur l'efficacité du nettoyage des plaies par rapport à l'absence de nettoyage et sur les approches optimales du nettoyage des ulcères de jambe veineux".56 Cependant, les principes généraux de soin des plaies impliquent des solutions à faible toxicité, y compris de l'eau potable ou bouillie, du sérum physiologique et d'autres agents antiseptiques respectueux des plaies.57 Cela évite les effets cytotoxiques et les dommages au tissu de granulation sain dans les plaies cicatrisables.
L'acide acétique dilué de 0,5 % à 1,0 % ou l'acide hypochloreux peuvent également être utilisés dans certains cas où un environnement acide est préférable (par exemple, pour le traitement topique de Pseudomonas aeruginosa).58 En fonction de la classification de la cicatrisation de la plaie, des agents antiseptiques présentant une certaine cytotoxicité tissulaire peuvent être utilisés après une évaluation positive des risques et des bénéfices. Il s'agit d'agents tels que la chlorhexidine à faible concentration ou son dérivé, le polyhexaméthylène biguanide, et la povidone iodée. Cela peut être bénéfique dans les cas de plaies chroniques et de plaies non cicatrisables qui présentent un potentiel élevé d'infection. En outre, ces agents peuvent être utilisés pour gérer les odeurs et les exsudats en plus du contrôle de la charge biologique. Dans les environnements aux ressources limitées, il faut tenir compte des mesures d'hygiène des plaies et de la manière dont les solutions sont préparées, stockées et distribuées aux patients afin d'éviter toute contamination croisée.
L'utilisation d'agents tensioactifs pour éliminer les biofilms qui existent souvent dans les débris de la plaie et qui présentent deux surfaces de viscosité différente suscite un intérêt croissant (Tableau complémentaire 2, http://links.lww.com/NSW/A177). L'irrigation des plaies reste un sujet controversé pour les plaies chroniques. Cependant, l'opinion des experts est de ne pas irriguer les plaies si la base de la plaie n'est pas visible afin d'éviter l'accumulation de la solution d'irrigation dans les espaces fermés et l'élargissement accidentel de la plaie.57 Irriguer les plaies avec un volume de solution adéquat (50-100 mL par centimètre de longueur de la plaie).59
Déclaration 7 : le traitement local des plaies : gestion de l'humidité
7A. Maintenir l'équilibre hydrique des plaies cicatrisables avec des hydrogels, des films, des hydrocolloïdes, des hydrofibres, des alginates et des mousses
7B. Réduction de l'humidité grâce à des mécanismes de verrouillage des fluides dans les plaies cicatrisables utilisant des superabsorbants pour évacuer l'humidité de la surface (technologie des couches)
7C. Déterminer si un pansement est nécessaire pour les plaies cicatrisables. Il peut être humide (donner de l'humidité) ou sec (absorber l'humidité)
7D. Établir un protocole ciblé de réduction de l'humidité dans les plaies chroniques et les plaies non cicatrisables afin de réduire la prolifération bactérienne
Le maintien de l'équilibre hydrique est complexe et dépend du type de plaie et de la classification de la cicatrisation. Tenir compte de l'équilibre de l'humidité, du contrôle de l'infection et de l'éducation du patient lors de la sélection des matériaux de pansement.60 L'intégration et l'adaptation des stratégies de gestion de l'humidité au type de plaie spécifique et aux ressources disponibles peuvent optimiser les résultats pour le patient et minimiser les complications (Tableau 6).3,54 De nouvelles recherches et études cliniques devraient continuer à affiner notre compréhension de la gestion de l'humidité des plaies afin d'améliorer les pratiques de soins des plaies à l'avenir.3,54
Tableau 6. Objectifs de la gestion de l'humidité en fonction de la capacité de cicatrisation de la plaie3,42,54
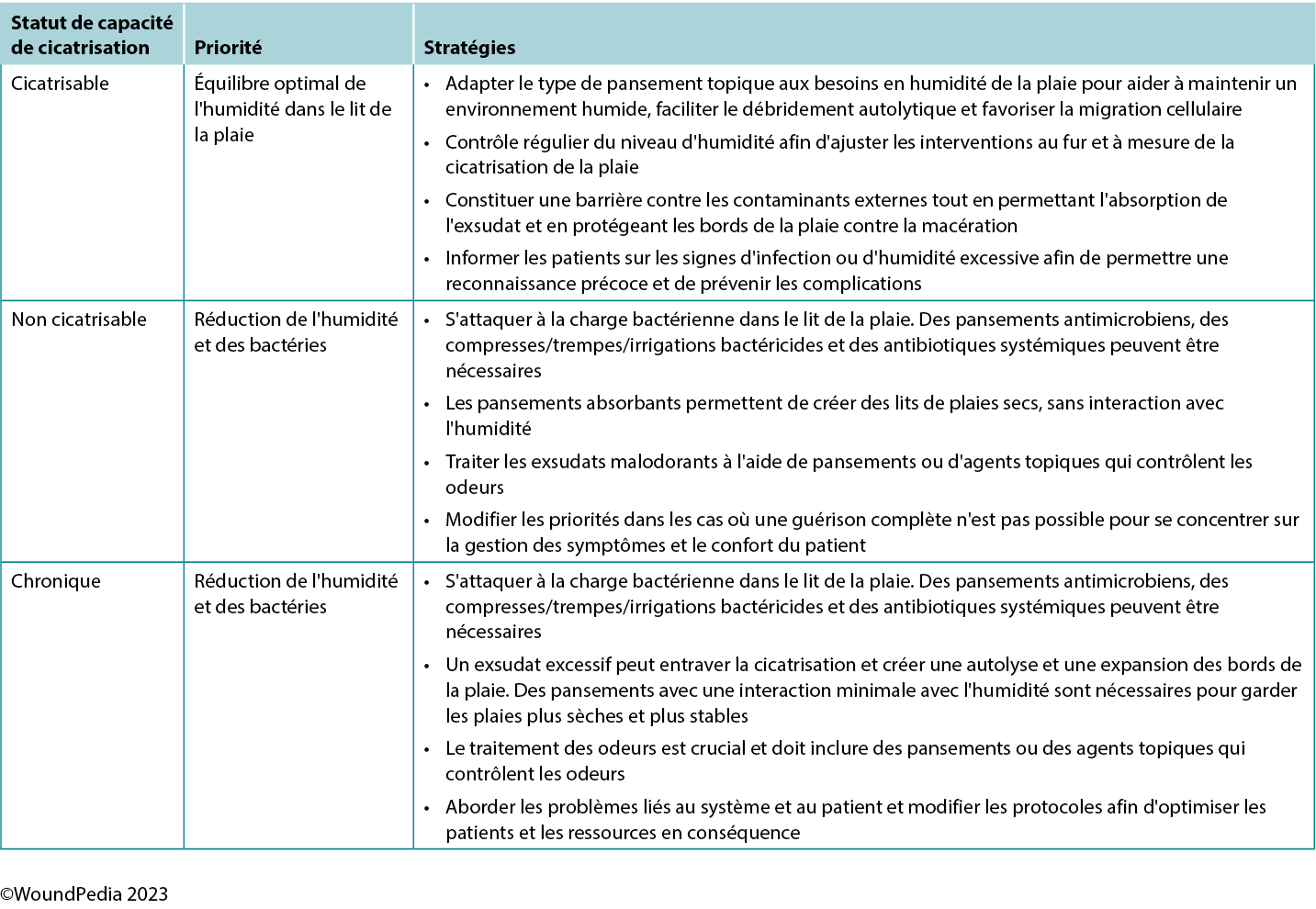
En général, plus le niveau d'exsudat augmente, plus la capacité d'absorption ou de transfert d'humidité du pansement doit être élevée.3 Les options de pansement à équilibre hydrique peuvent être associées à des propriétés antibactériennes et anti-inflammatoires pour mieux répondre aux besoins de la plaie.
Le choix du pansement pour les plaies chroniques et les plaies non cicatrisables doit privilégier le confort tout en évitant l'apport de liquide au lit de la plaie et la macération des bords de la plaie. Ces plaies doivent être réévaluées régulièrement pour détecter toute évolution ou détérioration et doivent être prises en charge pour réduire la charge bactérienne. En fonction de l'évolution et des caractéristiques de la plaie au fil du temps, il peut être nécessaire d'adapter les pansements.
Déclaration 8 : trajectoire de guérison
8A. Il faut considérer que les plaies cicatrisables doivent être réduites d'au moins 20 à 40 % à la semaine 4 pour être cicatrisées à la semaine 12. Si des facteurs affectant le temps de cicatrisation sont présents (mauvais contrôle de la glycémie, par exemple), un temps de cicatrisation supplémentaire peut être nécessaire
8B. Allouer plus de temps à la cicatrisation au-delà de 12 semaines pour les plaies cicatrisables si les ressources disponibles sont limitées, et continuer à prodiguer des soins cohérents
8C. Orienter en priorité les patients vers des centres spécialisés (lorsqu'ils sont disponibles) pour des tests diagnostiques et/ou une biopsie cutanée, en particulier lorsque les ressources sont très limitées
Les trajectoires de cicatrisation sont utiles et nécessaires pour évaluer le temps nécessaire à la cicatrisation, en particulier à l'aide de données cliniques (mesures) pour les plaies aiguës et chroniques. La trajectoire de cicatrisation est basée sur des mesures précises et cohérentes de la plaie qui déterminent la fermeture de la surface de la plaie au fil du temps. Cela permet de distinguer la progression de la plaie, les plaies bloquées et l'aggravation de l'état de la plaie.
Les plaies aiguës cicatrisables doivent être complètement refermées dans les 30 jours. Il faut s'attendre à ce que les plaies chroniques cicatrisables présentent une avancée des bords de 20 à 40 % à 30 jours (4 semaines) et qu'elles se referment dans les 12 semaines.3,42,61,62 Les plaies non cicatrisables n'ont pas de délai défini pour se refermer, aucune avancée des bords n'est attendue et toutes les étapes initiées visent à prévenir une détérioration plus importante. Les plaies chroniques ne sont pas censées cicatriser ni se détériorer, et la cicatrisation peut progresser lentement sans délai fixe, à moins que le patient/l'établissement/le système ne soit optimisé.
Réévaluer périodiquement les plaies difficiles à cicatriser pour rechercher d'autres diagnostics. Pour ces cas, il faut envisager une biopsie de la plaie, un examen plus approfondi et/ou une orientation vers une équipe d'évaluation interprofessionnelle. Une trajectoire de cicatrisation peut être évaluée au cours des 4 à 8 premières semaines pour prédire si une plaie est susceptible de cicatriser à la semaine 12, à condition qu'il n'y ait pas de nouveaux facteurs de complication.63 Des changements dans la plaie, l'individu ou l'environnement peuvent nécessiter le reclassement d'une plaie dans la catégorie chronique ou non cicatrisable.
Déclaration 9 : avancement de la technologie
9A. Envisager des modalités actives construites localement en fonction du mécanisme d'action requis et des indications spécifiques pour l'instauration d'un traitement d'appoint visant à favoriser la cicatrisation des plaies
9B. Décider des traitements d'appoint par une approche d'équipe interprofessionnelle et inclure une analyse préalable des risques et des bénéfices
Sélectionner les traitements d’appoint en tenant compte de la capacité à cicatriser. Chez les personnes souffrant d'un traumatisme majeur, ces mesures doivent être mises en œuvre le plus tôt possible après la blessure afin d'éviter les séquelles à long terme. Sélectionner les modalités en utilisant une approche d'équipe interprofessionnelle basée sur ce qui est disponible et le mécanisme physique requis (tout en s’assurant de la capacité de cicatrisation des tissus traumatiques). Dans le cas de plaies difficiles à cicatriser, la plaie peut avoir besoin d'une seconde chance pour cicatriser après réévaluation.42 Veiller à ce que le consentement éclairéf asse partie des décisions relatives au traitement d'appoint.
Une analyse du rapport risque/bénéfice et du rapport coût/efficacité est utile et contribuera à la durabilité du système. La clé d'une décision efficace concernant les modalités d'appoint est fondée sur le risque que représente la mise en place du traitement (inconfort physique, difficultés financières, adhésion du patient) par rapport au bénéfice qu'elle apportera (oxygénation des tissus, contraction de la plaie, réduction de l'œdème, réactivation cellulaire).42,64 Les meilleures décisions concernant les risques et les bénéfices sont prises au sein d'une équipe interprofessionnelle incluant le patient, garantissant l'engagement du groupe et l'achèvement du traitement dans le cadre d'une utilisation optimale des ressources.
L'optimisation des ressources, ou leur légère réaffectation, peut déboucher sur des stratégies créatives entre les mains d'équipes interprofessionnelles afin d'élaborer des solutions sur mesure pour garantir à tous les patients un traitement optimal malgré les restrictions de ressources.
Chirurgie. Même dans les environnements les plus limités, il s'agit de la modalité la plus disponible dans une zone de captation médicale, souvent dans des environnements de soins tertiaires avec des références reçues des cliniques de soins primaires pour fournir un débridement, une chirurgie générale avec fermeture de l'intention primaire/tertiaire, des greffes de peau, et/ou des amputations.
Les greffes de peau peuvent être disponibles dans les environnements à ressources limitées en tant que modalité avancée pour réaliser la fermeture des tissus afin de réduire les délais de cicatrisation et de prévenir les infections récurrentes des plaies profondes. Cette procédure peut réduire l'utilisation intensive de pansements sur une période prolongée et réduire la charge de travail des soins primaires pour les plaies chroniques. Les décisions relatives aux greffes de peau sont souvent prises pour préserver la fonctionnalité du corps et promouvoir une fermeture rapide de la plaie avant les résultats esthétiques.65 Cependant, il faut éviter les greffes de peau pour les plaies ischémiques et la plupart des ulcères de stase veineuse ; ne les envisager que pour les plaies où l'on peut s'attendre à un résultat favorable.66,67
Stimulation électrique. La cicatrisation des plaies peut être accélérée en augmentant le courant électrique naturel présent dans la peau blessée. Dans les environnements à ressources limitées, cette modalité devrait être étudiée pour la cicatrisation des plaies en raison de son niveau élevé de données probantes et de la disponibilité des dispositifs de cette nature (courant continu, courant alternatif, courant continu de faible intensité, champs électromagnétiques pulsés, courant pulsé de haute tension et dispositifs de stimulation électrique transcutanée des nerfs). Les données disponibles confirment l'augmentation de la prolifération cellulaire et de la perfusion microcapillaire, ainsi que la réduction de la charge bactérienne et de l'infection sur les lits de plaies traités.68
Traitement des plaies par pression négative avec appareil. Celui-ci permet au professionnel de la santé de contrôler la gestion de l'exsudat et la précision du remplacement des fluides pour les patients hospitalisés présentant un exsudat élevé et des défauts tissulaires importants. Commencer par la pression la plus basse possible (moins de 50-80 mm Hg). Le patient doit être alité pour que la modalité soit maintenue, et la couche de base (souvent de la gaze ou des pansements imprégnés de pétrolatum) doit être remplacée au moins une fois par jour. Ceci, ainsi que le fait de commencer par le réglage de pression négative le plus bas possible, évitera les traumatismes mécaniques au lit de la plaie dus à l'adhérence des tissus et au retrait traumatique du pansement dans les cas où des couches de base non adhérentes ne sont pas disponibles.69 Il existe maintenant des dispositifs jetables de traitement des plaies par pression négative conçus pour être utilisés au sein de la population ainsi que des options de bricolage qui peuvent donner des résultats cliniques acceptables.70,71
Respirer de l'oxygène à haut débit et très concentré. L'oxygène est souvent négligé en tant que modalité légitime de cicatrisation des plaies.72 Ironiquement, il est rarement utilisé, bien que presque tous les établissements de soins officiels disposent de grandes quantités d'oxygène, même dans des environnements relativement pauvres en ressources. La disponibilité des concentrateurs d'oxygène a également augmenté en raison de la pandémie de COVID-19, ce qui rend l'administration d'oxygène également possible en ambulatoire dnas les contextes de soins à domicile.73 Bien que l'oxygénation hyperbare soit le moyen le plus efficace d'augmenter la concentration d'oxygène dans le plasma et l'apport d'oxygène dans les tissus, cette modalité n'est pas toujours facilement disponible. Cependant, l'oxygénation normobare (en salle d’hôpital) produit encore une augmentation de 7,5 fois de l'oxygène transporté dans le plasma (c'est-à-dire de 0,3 mL/dL à 2,3 mL/dL ; Tableau 7).74 De plus, l'inhalation intermittente d'oxygène à 100 % chez des patients ne souffrant pas de troubles pulmonaires obstructifs chroniques (p. ex. 6 heures de fonctionnement/2 heures d'arrêt avec un masque non respiratoire) pendant 3 à 4 jours n'est pas nocive pour les poumons et peut fournir un substrat d'oxygène supplémentaire significatif, tandis que l'augmentation et la diminution intermittentes de l'apport d'oxygène activent l'expression du facteur inductible par l'hypoxie (un puissant stimulus pour l'angiogenèse).75 Cela suggère qu'au lieu de l'oxygénothérapie hyperbare, l'oxygène normobare est justifié pour atténuer les conditions figurant sur la liste des indications approuvées par la FDA pour l'oxygène hyperbare (Tableau 7).76 Il peut s'agir de lésions de reperfusion tissulaire (par exemple, lésions par écrasement, syndromes de compartiment avant et après la libération chirurgicale), d'inhibition des toxines bactériennes (par exemple, myonécrose infectieuse ou autres infections anaérobies) ou de défectuosités tissulaires importantes (après débridement pour maintenir la réponse inflammatoire réactivée jusqu'à 48 heures). L'oxygène normobare fournit 50 % de la Po2 de l'oxygénothérapie hyperbare typique (à 2 atmosphères) ; cependant, de nombreux effets pharmacologiques de l'oxygène ne sont obtenus qu'à des doses hyperbares.77,78
Tableau 7. Mécanismes et systèmes d'administration de l'oxygénothérapie normobare
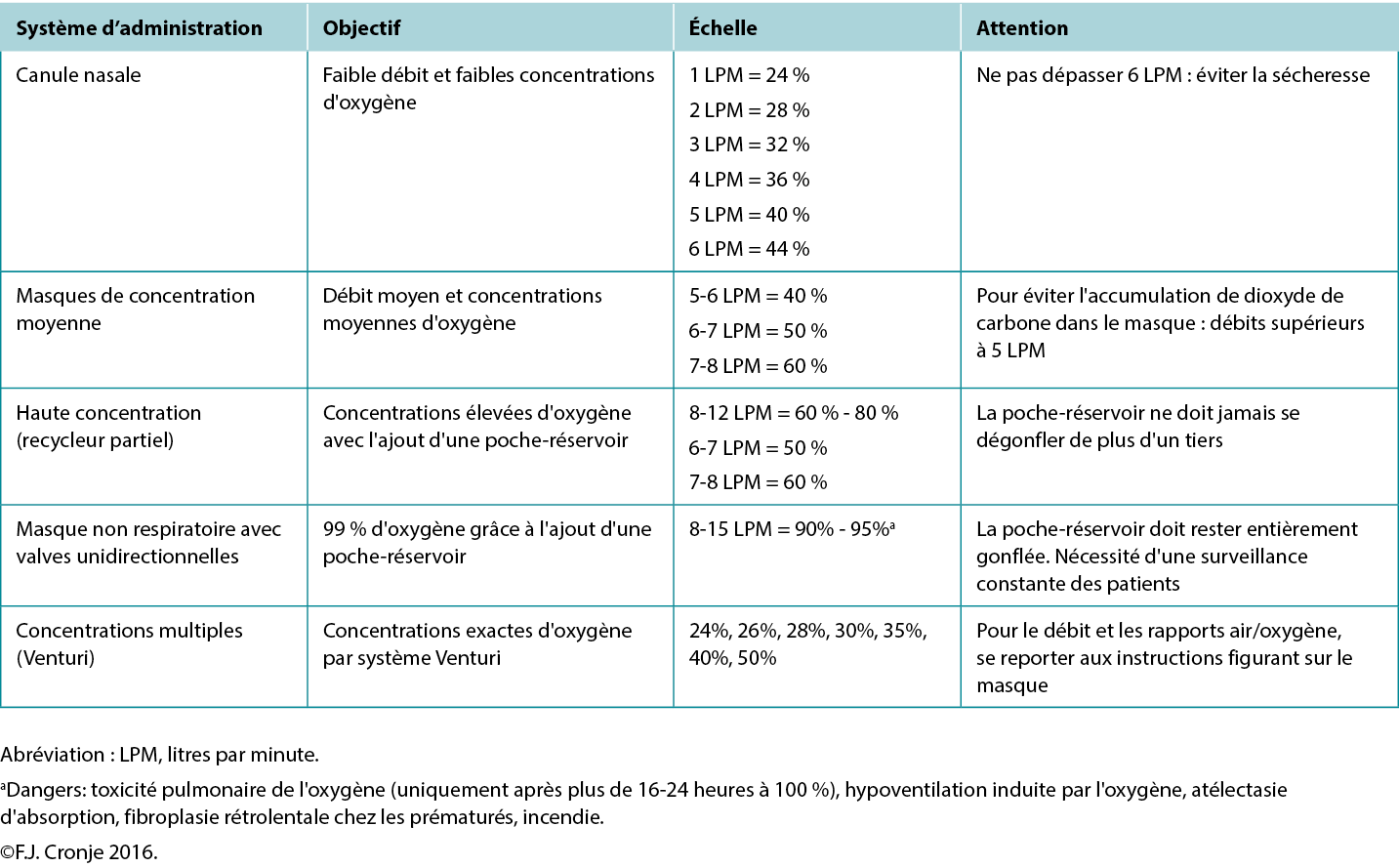
Il convient de noter que l'administration topique d'oxygène directement sur une plaie n'a pas les mêmes effets physiologiques que ceux attribués à l'administration systémique d'oxygène.79 Les systèmes d'administration topique d'oxygène font l'objet de recherches continues afin de déterminer leurs actions bénéfiques au-delà de l'amélioration de l'épithélialisation et éventuellement d'un léger effet antiseptique.64 Ce dernier effet a également été attribué à l'ozonothérapie.80 Une revue systématique achevée en 2018 a indiqué que ces traitements pouvaient potentiellement provoquer un léger stress oxydatif ou une désinfection, mais que le risque de toxicité dû à des espèces réactives de l'oxygène non contrôlées est élevé.81 Dans un environnement aux ressources limitées, ces dispositifs et leur utilisation ne sont probablement pas contrôlés.
Déclaration 10 : changements du système de soins de santé
10A. Faciliter des soins fondés sur des données probantes, culturellement compétents et équitables pour tous les patients
10B. Améliorer les compétences des prestataires en matière de traitement des plaies afin d'améliorer les résultats pour les patients
10C. Établir une communication efficace et opportune avec le patient et tous les membres de l'équipe interprofessionnelle de traitement des plaies afin d'améliorer les résultats du système de santé en matière de plaies
Au niveau mondial, le traitement des plaies chroniques consomme une part importante des ressources de santé ; les soins préventifs représentent la stratégie la plus rentable pour réduire les dépenses du système de santé. Il existe de nombreuses approches pour intégrer les soins préventifs dans la pratique. Par exemple, les UPD sont connus dans le monde entier pour générer des taux élevés d'amputation et de morbidité, alors que de nombreux UPD pourraient faire l’objet d’une prévention. Bien que l'on pensait initialement que le diabète était surtout répandu dans les pays développés, il convient de noter que 80 % des décès liés au diabète surviennent dans des pays disposant de ressources limitées.82 Un outil de dépistage validé, une équipe interprofessionnelle formée et disponible et la mise en œuvre d'algorithmes de prévention peuvent être utilisés dans les pays indépendamment de la disponibilité des ressources.83-85 Les autres stratégies organisationnelles qui pourraient être mises en œuvre sont notamment les suivantes.
Navigation des patients. La prise en charge d'un UPD nécessite un soutien continu de la part d'un cercle de soin comprenant les membres de la famille et les professionnels de la santé (y compris les soins à domicile et le traitement de la plaie) qui travaillent en équipe. Un accès rapide aux services sociaux et de santé est souvent nécessaire pour prévenir et cicatriser les UPD. Les services régionaux intégrés de traitement du diabète, établis au sein la population et rattachés à des cliniques interprofessionnelles de soins des plaies, s'avèrent être les plus efficaces.86
La navigation des patients est un moyen efficace de garantir des soins optimaux et opportuns. Ce concept est adaptable à tous les secteurs des soins de santé et peut améliorer le diagnostic et le traitement des infections des plaies en temps opportun, optimiser la prise en charge de la douleur et accroître l'accès aux soins spécialisés, accélérant ainsi les taux de fermeture des plaies.87 La navigation des patients devient une composante essentielle des soins intégrés, facilitant une transition transparente entre les secteurs et améliorant les résultats cliniques. En outre, elle s'accompagne d'une amélioration du moral des patients et des professionnels de la santé, d'une diminution des admissions ou réadmissions dans les hôpitaux pour des soins non aigus, d'une amélioration de la qualité de vie des patients et d'une meilleure adhésion aux protocoles de traitement. Tous ces facteurs combinés permettent aux systèmes de santé de réaliser d'importantes économies.87,88
Un élément essentiel de la réussite des programmes de navigation des patients est l'inclusion d'une approche complète et systématique pour guider les professionnels de la santé dans l'évaluation et la prestation de soins pour chaque patient (par exemple, le cadre PLP). Ces parcours n'ont pas besoin d'être compliqués ou de prendre beaucoup de temps, mais ils doivent veiller à ce que des critères spécifiques soient respectés, notamment des soins réguliers du pied pour les personnes présentant un risque élevé d'amputation, un contrôle de la glycémie avec un taux d'HbA1c inférieur à 9 % et une tension artérielle inférieure à 130/90 mm Hg.23,89
Interventions politiques. Des politiques organisationnelles qui détaillent et fournissent des directives sur les interventions et les voies d'accès aux meilleures pratiques sont cruciales pour la mise en œuvre réussie et durable des protocoles de soins des plaies. Fonder ces politiques sur les directives actuelles publiées pour chaque type de plaie spécifique et les traduire dans l'environnement qu'elles doivent servir. L'institution doit les accepter comme des normes de pratique et les approuver en tant que telle pour servir de soins fondés sur des données probantes dans des environnements où d'autres directives pourraient ne pas être adoptées avec succès en raison de problèmes de traduction culturelle ou linguistique. En outre, ces politiques doivent décrire clairement le processus de saisie et d'utilisation des données, car les initiatives d'amélioration continue de la qualité reposent sur des données permettant d'améliorer et de maintenir des processus de soins efficaces.
Soins des plaies adaptés. Bien que la prestation de soins doive être adaptée aux besoins uniques de chaque secteur de soins de santé, certains concepts devraient être standardisés, en particulier ceux qui favorisent une communication efficace à la fois au sein des secteurs et entre eux. L'adoption croissante de la technologie numérique accélère les évaluations, améliore l'accès aux soins spécialisés et optimise l'allocation des ressources limitées.90 Lorsque des adaptations sont mises en œuvre en tant que processus de soins, ces pratiques devraient être bien documentées en tant que normes de soins et être facilement accessibles pour garantir la cohérence et la continuité des soins au sein des institutions respectives.
Consensus delphi : points clés
Quelques commentaires importants du panel :
- La capacité de cicatrisation est une modalité changeante et ne doit pas être considérée comme une classification statique, car l'état, les circonstances et les choix du patient déterminent le processus d'attribution de la classification (3A).
- L'adaptation de la pratique requise pour les plaies chroniques comprend l'établissement d'une approche conservatrice du lit de la plaie, en prêtant attention aux concessions que le patient est prêt à faire dans le cadre de ses choix de vie, afin d'assurer lentement l'optimisation du patient et d'augmenter ensuite la compétence de l'organisateur (3B).
- Lorsque la méthode de documentation du patient est convenue au sein d'une institution, elle doit être utilisée de manière uniforme afin d'éviter les lacunes en matière de communication entre les prestataires qui pourraient, par inadvertance, avoir un impact négatif sur les résultats des soins aux patients (4A).
- Les bains de bouche antiseptiques adaptés aux muqueuses sont souvent également adaptés au lit de la plaie (4B). Cela peut être considéré comme une utilisation non conforme à l'étiquetage.
- Le choix pour le contrôle topique de la charge bactérienne doit se porter sur des antiseptiques topiques (à faible toxicité) (les cinq plus importants), en fonction de la capacité de cicatrisation et des priorités de la charge bactérienne à traiter. S'abstenir d'utiliser des préparations antibiotiques topiques, des pommades et des crèmes sur les plaies chroniques car ces préparations sont souvent axées uniquement sur les organismes à Gram positif et permettraient aux organismes à Gram négatif et anaérobies présents sur le lit de la plaie de se multiplier librement. En outre, les préparations antibiotiques topiques n'ont besoin que d'une seule mutation pour créer une résistance systémique à l'organisme ciblé. Les antibiotiques topiques sont souvent contenus dans un support associé à une dermatite de contact irritante ou allergique (6A et 6B).
- Lorsqu'une plaie cicatrisable présente une charge d'humidité importante et continue à nécessiter des pansements superabsorbants pour contrôler l'équilibre hydrique du lit de la plaie, la plaie doit faire l'objet d'une réévaluation approfondie pour s'assurer que toutes les causes sous-jacentes ont été corrigées (7B).
- Lors de la mise en place d'une équipe interprofessionnelle, il convient d'utiliser tous les moyens de communication pour constituer et maintenir une telle équipe, car cela pourrait permettre d'optimiser considérablement les capacités locales malgré les distances entre les prestataires et les spécialistes, afin d'améliorer les résultats cliniques en dépit des limitations locales (9B).
Conclusions
Optimiser le traitement des plaies chroniques dans des environnements aux ressources limitées en procédant à de petites adaptations et à des interventions créatives sans compromettre les principes fondamentaux des soins requis. Les équipes interprofessionnelles de traitement des plaies peuvent servir de ressource virtuelle aux communautés isolées et éloignées afin d'améliorer les résultats cliniques. Tous les éléments essentiels à la gestion et aux soins du pied (diabétique) peuvent facilement être incorporés dans des environnements divers en renforçant les capacités locales, en formant les praticiens cliniques et en responsabilisant les patients en fonction de leur culture.
Joyaux de la pratique
- La prise en charge holistique des personnes diabétiques comprend l'optimisation des taux d'HbA1c , de la tension artérielle et du taux de cholestérol, ainsi que la prise de médicaments ayant des propriétés de protection cardiaque et rénale.
- Le signal d'impulsion sonore d’un Doppler 8-MHz portatif est un test approprié au lit du patient pour déterminer l'apport sanguin artériel aux membres inférieurs. Il peut être réalisé comme une modification de l'ABPI traditionnel, et les bruits du pouls sont facilement vérifiables par les membres de l'équipe d'experts à distance à l'aide d'enregistrements MP3 ou MP4 réalisés à partir d'un téléphone portable.
- Les mnémoniques NERDS et STONEES peuvent guider le diagnostic et le traitement de l'infection locale/profonde et environnante, y compris l'indication d'un antibiotique oral pour l'ostéomyélite.
- La redistribution de la pression plantaire peut être réalisée à l'aide d'alternatives innovantes et moins coûteuses, telles que les semelles simples en feutre mou, le plâtre de contact total et l’atelle amovible rendue inamovible si celui-ci n'est pas disponible ou ne convient pas aux préférences du patient ou à ses activités quotidiennes.
- Les équipes de soins coordonnés intégrées peuvent se connecter à l'expertise virtuelle en dotant les professionnels de santé de compétences en matière de navigation des patients.
- Des trousses à outils contenant des outils pour la pratique ainsi que des Dopplers 8-MHz et des thermomètres infrarouges peuvent faciliter les soins dans des contextes où les ressources sont limitées.
Conflit d'intérêt
Les auteurs ne déclarent aucun conflit d'intérêt.
Financement
Les auteurs n'ont reçu aucun financement pour cette étude.
Author(s)
Hiske Smart*
MA RN PG Dip (UK)
Clinical Nurse Specialist: Wound Specialist Services King Hamad American Mission Hospital, A’Ali, Kingdom of Bahrain
R Gary Sibbald
MD Med FRCPC (Med Derm) FAAD MAPWCA JM
Professor of Medicine and Public Health, Dalla Lana School of Public Health, University of Toronto, Ontario, Canada
Laurie Goodman
MHScN RN Advanced Practice Nurse
WoundPedia, Mississauga, Ontario, Canada
Elizabeth A Ayello
PhD RN CWON ETN MAWPCA FAAN
President, Ayello Harris & Associates, Inc, Copake, New York, USA
Reneeka Jaimangal
MD MDcCH IIWCC
Project Manager, Project ECHO Ontario Skin and Wound Care, WoundPedia, Mississauga, Ontario, Canada
John H Gregory
BEng
President, Opencity Inc, Kitchener, Ontario, Canada
Sadanori Akita
MD PhD
Professor, Fukushima Medical University, Fukuoka, Japan
Afsaneh Alavi
MD FRCPC
Professor of Dermatology, Mayo Clinic, Rochester, Minnesota, USA
David G Armstrong
DPM MD PhD
Professor of Surgery, Keck School of Medicine, University of Southern California, Los Angeles, California, USA
Helen Arputhanathan
MSc RN NSWOC WOCC(C)
Manager, Patient Services & Clinical Wound Care, Home and Community Care Support Services, Hamilton Niagara Haldimand Brant, Waterloo, Ontario, Canada
Febe Bruwer
PhD (UFS) MSocSci MSc
Advanced Nurse Specialist and Unit Manager of the Wound Clinic, Life Roseacres Hospital, Germiston, South Africa
Jeremy Caul
MClSc-WH RN WOCC(c)
Nurse Advisor, Home and Community Care, Ontario Region for Indigenous Services Canada/First Nations and Inuit Health Branch, Ontario, Canada
Beverley Chan
MD MSc,FRCSC
Vascular Surgeon and Division Lead, Halton Healthcare, Oakville, Ontario, Canada
Frans Cronje
MBChB MSc
Aerospace Medicine, PGDOccMed, Fellow EHM (Duke), Aviation and Aerospace Medical Specialist, Head of Department Baromedicine, King Hamad American Mission Hospital, A’ali, Kingdom of Bahrain
Belen Dofitas
MD PhD
Associate Professor, Department of Dermatology, College of Medicine & Philippine General Hospital, University of the Philippines, Manila
Jassin Hamed
MD
Consultant Internal Medicine, COO Global Care Hospital, Abu Dhabi, United Arab Emirates
Catherine Harley
eMBA RN
Chief Executive Officer, Nurses Specialized in Wound, Ostomy and Continence Canada, Ottawa, Ontario, Canada
Jolene Heil
MclSc-WH RN NSWOC
Advanced Practice Nurse and Clinical Nurse Specialist—Wound Care, Providence Care, Kingston, Ontario, Canada
Mary Hill
MN BScN RN NSWOC WOCC(C)
NSWOC Educator/Consultant CAT Team, Integrated Home Care—Calgary Zone, Alberta, Canada
Devon Jahnke
DCh MCISc-WH
Chiropodist, Complex Centre for Diabetes Care, Health Sciences North, Sudbury Outpatient Centre, Ontario, Canada
Dale Kalina
MD MBA FRCPC (ID)
Chief Medical Information Officer, Brant Community Healthcare System, Brantford, Ontario, Canada
Chaitanya Kodange
MBBS DMM DHA MD (Psy) IIWCC-UAE
Consultant Diving, Hyperbaric and Wound Care & Psychiatrist, King Hamad University Hospital, Kingdom of Bahrain
Bharat Kotru
PhD MSc DPM
Podiatrist and Wound Care Specialist, Advance Foot & Wound Care Centre, Amandeep Group of Hospitals, Amritsar, Punjab, India
Laura Lee Kozody
DCh
Chiropodist, Toronto Regional Wound Healing Clinic, Mississauga, Ontario, Canada
Stephan Landis
MD FRCPC
Consultant, Guelph General Hospital Ambulatory Wound Clinic, Guelph, Ontario, Canada
Kimberly LeBlanc
PhD RN NSWOC WOCC(C) FCAN
Academic Chair, Nurses Specializing in Wound, Ostomy and Continence Canada, Ottawa, Ontario, Canada
Mary MacDonald
MD PhD FRCSC
Assistant Professor, School of Medicine, NOSM University, and Vascular Surgeon, Thunder Bay Regional Health Sciences Centre, Thunder Bay, Ontario, Canada
Tobi Mark
BSc DCh
Associate Professor of Chiropody, The Michener Institute of Education at UHN, Toronto, Ontario, Canada
Carlos Martin
DM PG-Dip MBBS
Consultant, Vascular Surgery, Georgetown Public Hospital Corporation, Guyana
Dieter Mayer
MD FAPWCA Consultant, Institute for Advanced Wound Care & Education, Hausen am Albis, Switzerland
Christine Murphy
PhD MClSc-WH RN NSWOC WOCC(C)
Advanced Practice Nurse, The Ottawa Hospital, Ontario, Canada
Harikrishna Nair
MD PhD FRCPI FRCPE FCWCS
Head and Senior Wound Care Physician, Wound Care Unit, Department of Internal Medicine, Kuala Lumpur Hospital, and Professor, Faculty of Medicine, Lincoln University College, Malaysia
Cesar Orellana
MD FRCPC FACP
Infectious Diseases Consultant, Grand River Hospital and St Mary’s General Hospital, Kitchener, Ontario, Canada
Brian Ostrow
MD BSc FRCS(C)
Adjunct Assistant Professor (retired), Department of Surgery, University of Toronto, Ontario, Canada
Douglas Queen
PhD MBA
Chief Executive Officer, Medicalhelplines.com Inc, Toronto, Ontario, Canada
Patrick Rainville
DCh,
Owner, Rainville Foot Health, Timmins, Ontario, Canada
Erin Rajhathy
MclSc-WH RN NSWOC WOCC(C)
Doctoral Student, Swedish Centre for Skin and Wound Research, Nursing Science Unit, School of Health Sciences, Faculty of Medicine and Health, Örebro University, Örebro, Sweden
Gregory Schultz
PhD
Professor Emeritus, University of Florida, Gainesville, Florida, USA
Ranjani Somayaji
MD MPH FRCPC
Associate Professor, University of Calgary, Calgary, Canada
Michael C Stacey
DS MBBS FRACS
Vascular Surgeon and Professor of Surgery, McMaster University, Hamilton, Ontario, Canada
Gulnaz Tariq
MSc (UK) RN PG Dip (PAK)
Director of Wound Care & Education, Global Care Hospital, Abu Dhabi, United Arab Emirates
Gregory Weir
MBChB Mmed (Ch)
Vascular Surgeon, Life Eugene Marais Hospital, Pretoria, South Africa
Catharine Whiteside
MD PhD CM FRCPC
Professor Emerita and Former Dean of Medicine, University of Toronto, Ontario, Canada
Helen Yifter
MD
Associate Professor of Medicine, University of Rwanda, Kigali, Rwanda
Ramesh Zacharias
MD FRCS(C)
Assistant Clinical Professor, Anesthesia, Faculty of Health Sciences, McMaster University, Hamilton, Ontario, Canada
* Corresponding author
References
- Sibbald RG, Williamson D, Orsted HL, et al. Preparing the wound bed—debridement, bacterial balance and moisture balance. Ostomy Wound Manage 2000;46(11):14-35.
- Fitridge R, Chuter V, Mills J, et al. The intersocietal IWGDF, ESVS, SVS guidelines on peripheral artery disease in people with diabetes mellitus and a foot ulcer. J Vasc Surg 2023;78(5):1101-31.
- Sibbald RG, Elliott JA, Persaud-Jaimangal R, et al. Wound Bed Preparation 2021. Adv Skin Wound Care 2021;34(4):183-95.
- Alavi A, Sibbald RG, Nabavizadeh R, Valaei F, Coutts P, Mayer D. Audible handheld Doppler ultrasound determines reliable and inexpensive exclusion of significant peripheral arterial disease. Vascular 2015;23(6):622-9.
- Dworak M, Andraska EA, Gharacholou SM, Myers M, Chapman SC. Fluorescent angiography used as a tool to guide angiosome-directed endovascular therapy for diabetic foot ulcers. J Vasc Surg Cases Innov Tech 2021;7(1):159-63.
- Sassaki VS, Fukaya E. Varicose veins: approach, assessment, and management to the patient with chronic venous disease. Med Clin North Am 2023;107(5):895-909.
- Armstrong DG, Boulton AJM, Sicco AB. Diabetic foot ulcers and their recurrence. N Engl J Med 2017;376(24):2367-75.
- Eikelboom JW, Connolly SJ, Bosch J, et al. Rivaroxaban with or without aspirin in stable cardiovascular disease. N Engl J Med 2017;377(14):1319-30.
- Levin ME. An overview of the diabetic foot: pathogenesis, management and prevention of lesions. Int J Diab Dev Countries 1994;14:39-47.
- Bekele F, Chelkeba L, Fekadu G, Bekele K. Risk factors and outcomes of diabetic foot ulcer among diabetes mellitus patients admitted to Nekemte referral hospital, Western Ethiopia: prospective observational study. Ann Med Surg (Lond) 2020;51:17-23.
- Govindasamy K, Darlong J, Watson SI, Gill P. Prevalence of plantar ulcer and its risk factors in leprosy: a systematic review and meta-analysis. J Foot Ankle Res 2023;16(1):77.
- Sibbald RG, Ayello EA, Alavi A, et al. Screening for the high-risk diabetic foot: a 60-Second Tool. Adv Skin Wound Care 2012;25(10):465-76.
- Sibbald RG, Mufti A, Armstrong DG. Infrared skin thermometry: an underutilized cost-effective tool for routine wound care practice and patient high-risk diabetic foot self-monitoring. Adv Skin Wound Care 2015;28(1):37-44.
- Amemiya A, Noguchi H, Oe M, et al. Factors associated with callus formation in the plantar region through gait measurement in patients with diabetic neuropathy: an observational case-control study. Sensors 2020;20:4863.
- Armstrong DG, Swerdlow MA, Armstrong AA, Conte MS, Padula WV, Bus SA. Five year mortality and direct costs of care for people with diabetic foot complications are comparable to cancer. J Foot Ankle Res 2020;13(1):16.
- Diabetes Canada Clinical Practice Guidelines Expert Committee. Diabetes Canada 2018 clinical practice guidelines for the prevention and management of diabetes in Canada. Can J Diabetes 2018;42(Suppl 1):S1-325.
- Zhang X, Yang X, Sun B, et al. Perspectives of glycemic variability in diabetic neuropathy: a comprehensive review. Commun Biol 2021;4:1366.
- Bril V, Breiner A, Perkins BA, Zochodne D. Diabetes Canada 2018 clinical practice guidelines for the prevention and management of diabetes in Canada. Neuropathy. Can J Diabetes 2018;42:S217-21.
- Soyoye DO, Abiodun OO, Ikem RT, Kolawole BA, Akintomide AO. Diabetes and peripheral artery disease: a review. World J Diabetes 2021;12(6):827-38.
- Song P, Rudan D, Zhu Y, et al. Global, regional, and national prevalence and risk factors for peripheral artery disease in 2015: an updated systematic review and analysis. Lancet Glob Health 2019;7:e1020-30.
- Williams B, Mancia G. Ten commandments of the 2018 ESC/ESH HTN guidelines on hypertension in adults. Eur Heart J 2018;39:3007-8.
- Dagenais GR. Vascular protection: telmisartan in the ONTARGET trial programme. Eur Heart J Suppl 2009;11(suppl_F):F47-53.
- Gerstein HC. Diabetes and the HOPE study: implications for macrovascular and microvascular disease. Int J Clin Pract Suppl 2001;(117):8-12.
- Fonseca-Correa JI, Correa-Rotter R. Sodium-glucose cotransporter 2 inhibitors mechanisms of action: a review. Front Med 2021;8:777861.
- Rasmussen BSB, Yderstraede KB, Carstensen B, et al. Substantial reduction in the number of amputations among patients with diabetes: a cohort study over 16 years. Diabetologia 2016;59:121-9.
- de Mestral C, Hussain MA, Austin PC, et al. Regional health care services and rates of lower extremity amputation related to diabetes and peripheral artery disease: an ecological study. CMAJ Open 2020;8(4):E659-66.
- Baird R, Cosh L, Bruser G, Rowe R, Walker J. Indigenous Diabetes Health Circle: Foot Care Evaluation Program. April 2022. https://idhc.life/wp-content/uploads/2023/02/IDHC_Foot-Care-Research-Report.pdf. Last accessed January 3, 2024.
- Bus SA, Armstrong DG, Crews RT, et al. Guidelines on offloading foot ulcers in persons with diabetes (IWGDF 2023 update). Diabetes Metab Res Rev 2023:e3647.
- Withers RV, Perrin BM, Landorf KB, et al. Offloading effects of a removable cast walker with and without modification for diabetes-related foot ulceration: a plantar pressure study. J Foot Ankle Res 2023;16:27.
- Moffatt CJ, Franks PJ, Hollinworth H. Understanding wound pain and trauma: an international perspective. In: Pain at Wound Dressing Changes: A Position Document. European Wound Management Association; 2002:2-7.
- Queen D, Woo K, Shulz VN, Sibbald RG. Chronic wound pain and palliative cancer care. Ostomy Wound Manage 2003;49(10):16-8.
- Reddy M, Kohr R, Queen D, Keast D, Sibbald RG. Practical treatment of wound pain and trauma: a patient-centered approach. An overview. Ostomy Wound Manage 2003;49(4A):2-15.
- Boonstra AM, Stewart RE, Köke AJ, et al. Cut-off points for mild, moderate, and severe pain on the numeric rating scale for pain in patients with chronic musculoskeletal pain: variability and influence of sex and catastrophizing. Front Psychol 2016;7:1466.
- Byma EA, Wheeler H. The experience of new graduate registered nurses as managers of pain. Pain Manage Nurs 2021;22(3):429-35.
- D’Souza RS, Barman R, Joseph A, Abd-Elsayed A. Evidence-based treatment of painful diabetic neuropathy: a systematic review. Curr Pain Headache Rep 2022;26(8):583-94.
- Sibbald RG, Hastings-Truelove A, DeJong P, Ayello EA. Reconciliation and diversity for educators: the medicine wheel, Bloom’s taxonomy, and CanMEDS competencies. Adv Skin Wound Care 2023;36(2):64-6.
- Murphy A, McGowan C, McKee M, et al. Coping with healthcare costs for chronic illness in low-income and middle-income countries: a systematic literature review. BMJ Global Health 2019;4:e001475.
- Okediji PT, Ojo AO, Ojo AI, Ojo AS, Ojo OE, Abioye-Kuteyi EA. The economic impacts of chronic illness on households of patients in Ile-Ife, South-western Nigeria. Cureus 2017;9(10):e1756.
- Adelman RD, Tmanova LL, Delgado D, Dion S, Lachs MS. Caregiver burden: a clinical review. JAMA 2014;311(10):1052-60.
- Kodange C. Screening for depression in patients with chronic wounds. Adv Skin Wound Care 2021;34(9):502-3.
- Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2022;45(11):2753-86.
- Boersema GC, Smart H, Giaquinto-Cilliers MGC, et al. Management of nonhealable and maintenance wounds: a systematic integrative review and referral pathway. Adv Skin Wound Care 2021;34(1):11-22.
- Ebbers T, Kool RB, Smeele LE, et al. The impact of structured and standardized documentation on documentation quality; a multicenter, retrospective study. J Med Syst 2022;46(7):46.
- Onuh OC, Brydges HT, Nasr H, Savage E, Gorenstein S, Chiu E. Capturing essentials in wound photography past, present, and future: a proposed algorithm for standardization. Adv Skin Wound Care 2022;35:483-92.
- World Health Organization. International Statistical Classification of Diseases and Related Health Problems (ICD). 2023. www.who.int/standards/classifications/classification-of-diseases. Last accessed January 3, 2024.
- Wurster F, Fütterer G, Beckmann M, et al. The analyzation of change in documentation due to the introduction of electronic patient records in hospitals—a systematic review. J Med Syst 2022;46(8):54.
- Nair HK, Ahmad NW, Ismail AA, et al. Maggot debridement therapy to treat hard-to-heal diabetic foot ulcers: a single-centre study. J Wound Care 2021;30(Sup12):S30-6.
- Williams KA, Cronje FJ, Avenant L, Villet MH. Identifying flies used for maggot debridement therapy. S Afr Med J 2008;98(3):196-9.
- Tran DL, Huang RW, Chiu ES, et al. Debridement: technical considerations and treatment options for the interprofessional team. Adv Skin Wound Care 2023;36(4):180-7.
- Woo KY, Sibbald RG. A cross-sectional validation study of using NERDS and STONEES to assess bacterial burden. Ostomy Wound Manage 2009;55(8):40.
- Angel DE, Lloyd P, Carville K, Santamaria N. The clinical efficacy of two semi‐quantitative wound‐swabbing techniques in identifying the causative organism(s) in infected cutaneous wounds. Int Wound J 2011;8(2):176-85.
- Rawlinson S, Ciric L, Cloutman-Green E. How to carry out microbiological sampling of healthcare environment surfaces? A review of current evidence. J Hosp Infect 2019;103(4):363-74.
- Hatzenbuehler J, Pulling TJ. Diagnosis and management of osteomyelitis. Am Fam Physician 2011;84(9):1027-33.
- Sibbald RG, Elliott JA, Ayello EA, Somayaji R. Optimizing the moisture management tightrope with Wound Bed Preparation 2015©. Adv Skin Wound Care 2015;28(10):466-76.
- Joshi N, Caputo GM, Weitekamp MR, Karchmer AW. Infections in patients with diabetes mellitus. N Engl J Med 1999;341(25):1906-12.
- McLain NE, Moore ZE, Avsar P. Wound cleansing for treating venous leg ulcers. Cochrane Database Syst Rev 2021;3(3):CD011675.
- Sibbald RG, Goodman L, Woo KY, et al. Special considerations in Wound Bed Preparation 2011: an update©. Adv Skin Wound Care 2011;24(9): 415-36.
- Block MS, Rowan BG. Hypochlorous acid: a review. J Oral Maxillofacial Surg 2020;78(9):1461-6.
- International Wound Infection Institute. Wound infection in clinical practice: principles of best practice. 3rd ed. Wounds Int 2022:1-60.
- Giaquinto-Cilliers MGC. Classification of dressings: a framework adapted to the Wound Bed Preparation Paradigm. Wound Heal South Afr 2023;16(2):31-3.
- Berezo M, Budman J, Deutscher D, Hess CT, Smith K, Hayes D. Predicting chronic wound healing time using machine learning. Adv Wound Care 2022;11(6):281-96.
- Pavlovčič U, Diaci J, Možina J, et al. Wound perimeter, area, and volume measurement based on laser 3D and color acquisition. Biomed Eng Online 2015;14(39).
- Laporte M, Keller HH, Payette H, et al. Validity and reliability of the new Canadian Nutrition Screening Tool in the ‘real-world’ hospital setting. Eur J Clin Nutr 2015;69(5):558-64.
- Feldmeier JJ, Hopf HW, Warriner R3, Fife CE, Gesell LB, Bennett M. UHMS position statement: topical oxygen for chronic wounds. Undersea Hyperb Med 2005;32(3):157-68.
- Guzman KJ, Gemo N, Martins DB, et al. Current challenges of plastic surgical care in sub-Saharan Africa (Maputo, Mozambique). Plast Reconstr Surg Glob Open 2018;6(8):e1893.
- Jones JE, Nelson EA. Skin grafting for venous leg ulcers. Cochrane Database Syst Rev 2007;(2):CD001737.
- Kirketerp-Møller K, Doerfler P, Schoefmann N, et al. Biomarkers of skin graft healing in venous leg ulcers. Acta Derm Venereol 2022;102:adv00749.
- Thakral G, Lafontaine J, Najafi B, Talal TK, Kim P, Lavery LA. Electrical stimulation to accelerate wound healing. Diabetes Foot Ankle 2013;4.
- Chaput B, Garrido I, Eburdery H, Grolleau JL, Chavoin JP. Low-cost negative-pressure wound therapy using wall vacuum: a 15 dollars by day alternative. Plast Reconstr Surg Glob Open 2015;3(6):e418.
- Estillore KM, Quevedo GL, Bonifacio LR. Improvised suction apparatus for closure of large soft tissue deficit. Malaysian Orthop J 2013;7(2):29.
- Farré R, Rodríguez-Lázaro MA, Gonzalez-Martin J, et al. Device for negative pressure wound therapy in low-resource regions: open-source description and bench test evaluation. J Clin Med 2022;11(18):5417.
- Rose S, Sardar S, Sasi S, Al Mohanadi DH, Al-Mohammed AA, Zahid M. Time for change in practice of in-patient oxygen therapy: a period-limited, multidimensional approach to improve oxygen prescription compliance: quality improvement project at Hamad General Hospital, Qatar. BMJ Open Qual 2021;10(4):e001574.
- McAllister S, Thorn L, Boladuadua S, et al. Cost analysis and critical success factors of the use of oxygen concentrators versus cylinders in sub-divisional hospitals in Fiji. BMC Health Serv Res 2021;21(1):1-7.
- Jain KK. Physical, physiological, and biochemical aspects of hyperbaric oxygenation. In: Jain KK, ed. Textbook of Hyperbaric Medicine. 6th ed. Springer; 2017:11-22.
- Chang AJ, Bargmann CI. Hypoxia and the HIF-1 transcriptional pathway reorganize a neuronal circuit for oxygen-dependent behavior in Caenorhabditis elegans. Proc Natl Acad Sci USA 2008;105(20):7321-6.
- Moon RE. Hyperbaric Oxygen Therapy Indications. North Palm Beach, FL: Best Publishing Company; 2019.
- Chazalviel L, Blatteau JE, Vallée N, Risso JJ, Besnard S, Abraini JH. Effects of normobaric versus hyperbaric oxygen on cell injury induced by oxygen and glucose deprivation in acute brain slices. Med Gas Res 2016;6(3):169-73.
- Velej V, Cankar K, Vidmar J. The effects of normobaric and hyperbaric oxygenation on MRI signal intensities in T1 -weighted, T2 -weighted and FLAIR images in human brain. Radiol Oncol 2023;57(3):317-24.
- UHMS position statement: topical oxygen for chronic wounds. Undersea Hyperb Med 2018;45(3):379-80.
- Rapone B, Ferrara E, Santacroce L, et al. The gaseous ozone therapy as a promising antiseptic adjuvant of periodontal treatment: a randomized controlled clinical trial. Int J Environ Res Public Health 2022;19(2):985.
- Fitzpatrick E, Holland OJ, Vanderlelie JJ. Ozone therapy for the treatment of chronic wounds: a systematic review. Int Wound J 2018;15(4):633-44.
- Woodbury M, Sibbald RG, Ostrow B, Persaud R, Lowe J. Tool for rapid & easy identification of high-risk diabetic foot: validation & clinical pilot of the simplified 60 second diabetic foot screening tool. PLoS One 2015;10(6):1-3.
- Abbas ZG, Lutale JK, Bakker K, Baker N, Archibald LK. The ‘step by step’ diabetic foot project in Tanzania: a model for improving patient outcomes in less-developed countries. Int Wound J 2011;8:169-75.
- Abbas ZG. Reducing diabetic limb amputations in developing countries. Expert Rev Endocrinol Metab 2015;10:425-34.
- Ousey K, Chadwick P, Jawien A, et al. Identifying and treating foot ulcers in patients with diabetes: saving feet, legs and lives. J Wound Care 2018;27(5 Suppl 5b).
- Heerschap C, Nicholas A, Whitehead M. Wound management: investigating the interprofessional decision-making process. Int Wound J 2019;16(1):233-42.
- Arputhanathan H, Hyde J, Atiloa T, Queen D, Elliott J, Sibbald RG. A patient navigation model to improve complex wound care outcomes. Adv Skin Wound Care 2022;35(9):499-508.
- Doucet S, Luke A, Anthonisen G, et al. Hospital-based patient navigation programmes for patients who experience injury-related trauma and their caregivers: a scoping review protocol. BMJ Open 2022;12:e055750.
- Narayan KMV, Zhang P, Kanaya AM, et al. Diabetes: the pandemic and potential solutions. In: Jamison DT, Breman JG, Measham AR, et al, eds. Disease Control Priorities in Developing Countries. 2nd ed. Washington, DC: World Bank; 2006:591-603.
- Kostovich CT, Etinggen B, Wirth M, et al. Outcomes of telehealth for wound care: a scoping review. Adv Skin Wound Care 2022;35(7):394-403.
Supplemental Table 1. Delphi consensus achieved among 41 contributors on 32 wound bed preparation (wbp) 2024 statements
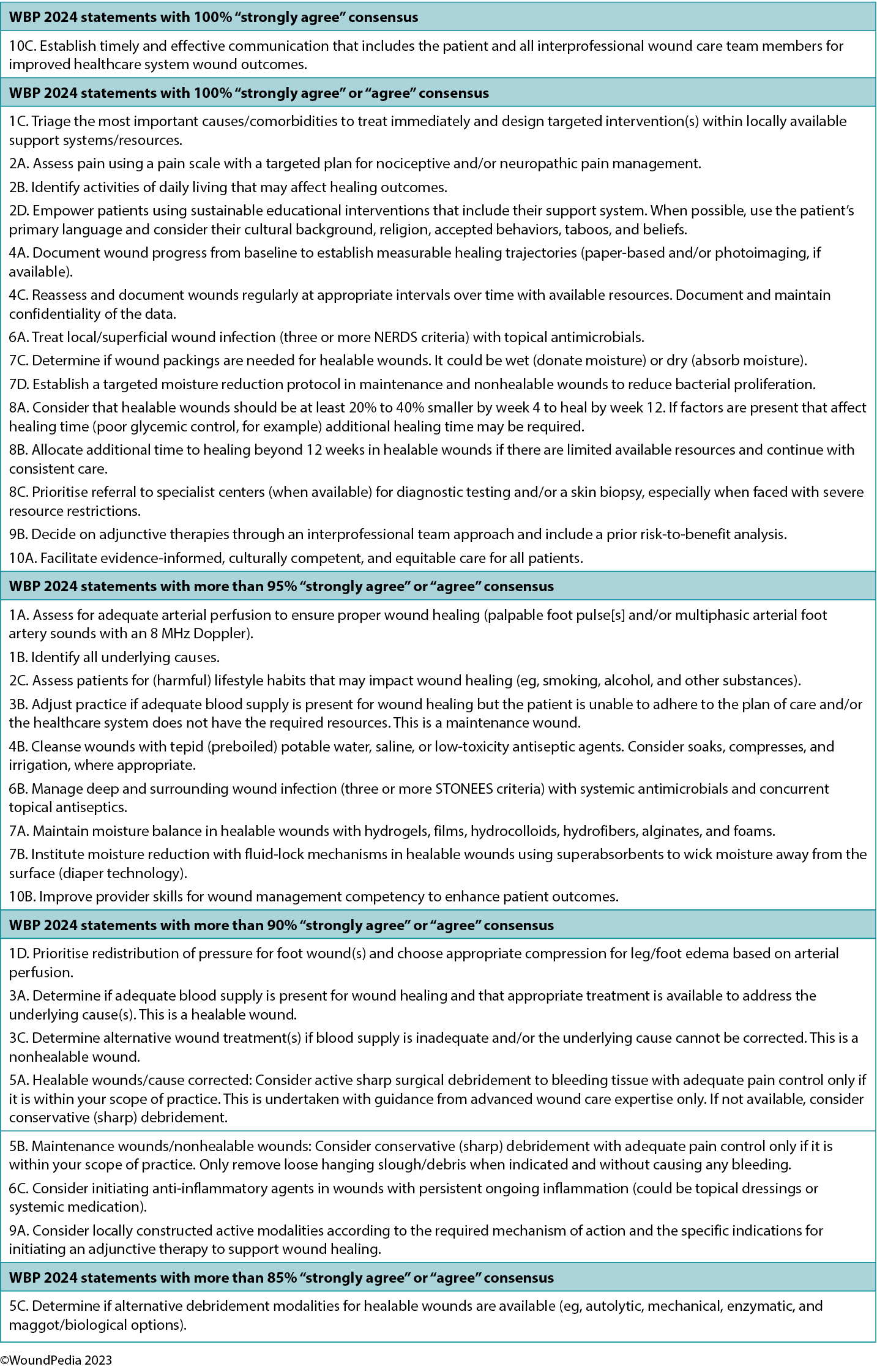
Supplement Table 2. Common antiseptic agents for nonhealable wounds
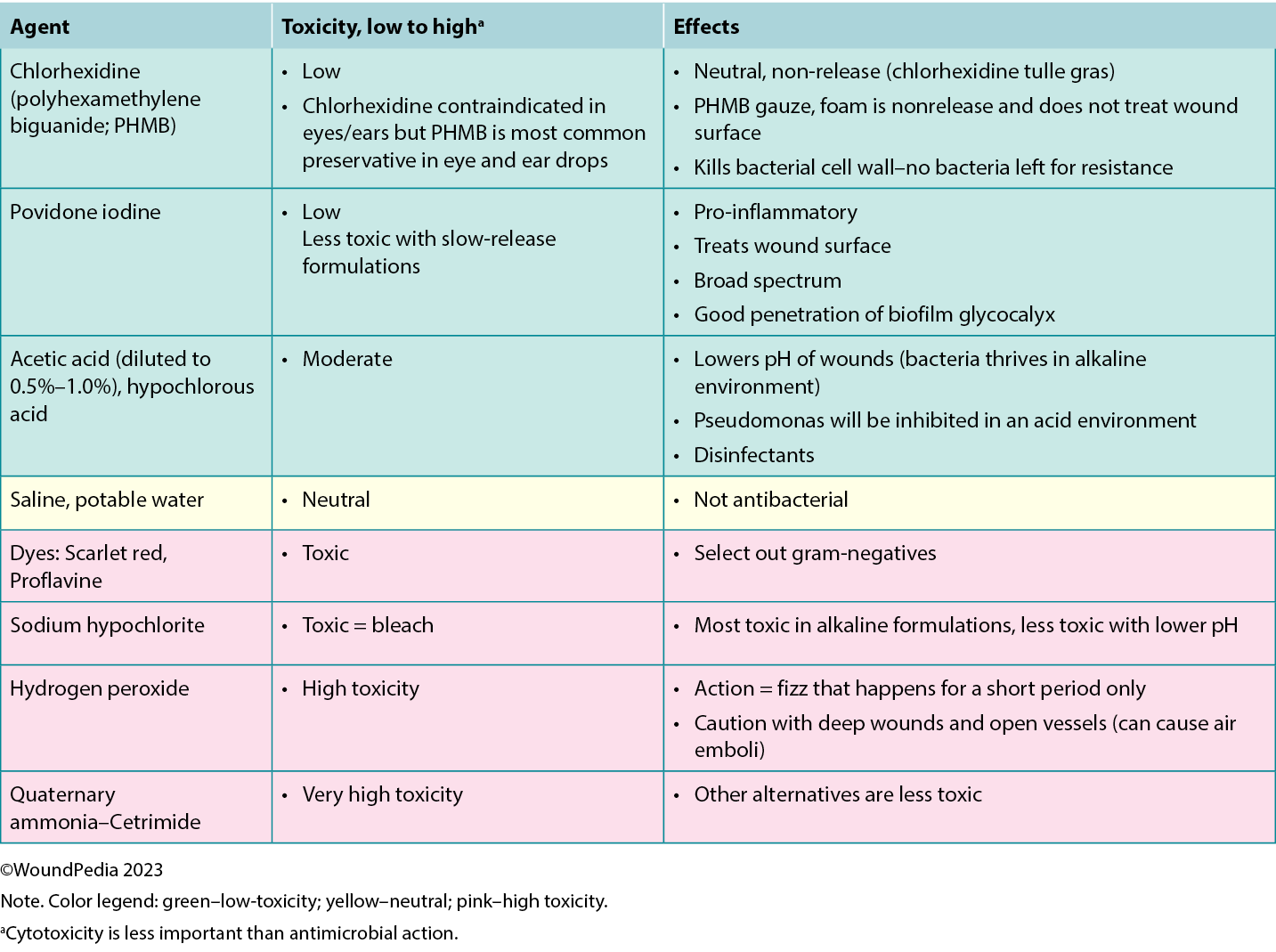
Tableau supplémentaire 1. Un consensus Delphi a été atteint entre 41 contributeurs sur 32 déclarations relatives à la préparation du lit de la plaie (PLP) 2024

Tableau supplémentaire 2. Agents antiseptiques courants pour les plaies non cicatrisables